化学反应的热效应-高考化学考前专项练习试题(含解析)
文档属性
| 名称 | 化学反应的热效应-高考化学考前专项练习试题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 442.8KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-13 10:52:40 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
化学反应的热效应
共18题,满分100分
题号 一 二 三 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请注意保持试卷整洁
一、单选题(共50分)
1.(本题5分)已知稀溶液中,。由此判断下列热化学方程式书写正确的是
A.
B.
C.
D.
2.(本题5分)已知分解1mol H2O2放出热量98kJ,在含少量I-的溶液中,H2O2分解的机理为:
H2O2+I-→H2O+IO- 慢
H2O2+IO-→H2O+O2+I- 快
下列有关该反应的说法正确的是( )
A.反应速率与I-浓度无关
B.IO-也是该反应的催化剂
C.分解2mol H2O2放出热量196kJ
D.v(H2O2)=v(H2O)=v(O2)
3.(本题5分)下列说法正确的是
A.需要加热的反应一定是吸热反应
B.X(s)=Y(s)是放热反应,则X比Y稳定
C.等量的硫蒸气和固态硫分别完全燃烧,后者放出的热量更多
D.在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同
4.(本题5分)已知:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1。对于下列稀溶液或固体之间的反应:
①HCl(aq)+NH3·H2O (aq)===NH4Cl(aq)+H2O(l) ΔH=-a kJ·mol-1
②HCl(aq)+NaOH(s)===NaCl(aq)+H2O(l) ΔH=-b kJ·mol-1
③HNO3 (aq)+NaOH (aq)===NaNO3 (aq)+H2O(l) ΔH=-c kJ·mol-1
下列有关a、b、c三者的大小关系中正确的是
A.a>b>c>57.3 B.a>b=c=57.3
C.b>c=57.4>a D.无法比较
5.(本题5分)下列过程中能量变化与如图一致的是
A.干冰升华 B.工业合成氨 C.H+Cl→H-Cl D.浓硫酸稀释
6.(本题5分)根据碘与氢气反应的热化学方程式:
①I2( )+H2(g)2HI(g) ΔH="-9.48" kJ·mol-1
②I2( )+H2(g)2HI(g) ΔH="+26.48" kJ·mol-1
下列判断中正确的是
A.①中的I2为固态,②中的I2为气态
B.254 g I2(g)完全反应放热9.48 kJ
C.①的产物比②的产物热稳定性更好
D.1 mol固态碘升华时将吸热17 kJ
7.(本题5分)下列说法不正确的是
A.引起化学反应能量变化的主要原因是化学键的断裂和生成
B.化学反应中的能量变化只有热量变化
C.原电池中主要能量变化是化学能转变为电能
D.二次电池充电过程是将电能转变为化学能
8.(本题5分)已知:(1)Zn(s)+O2(g)=ZnO(s),△H=﹣348.3 kJ/mol
(2)2Ag(s)+O2(g)=Ag2O(s),△H=﹣31.0 kJ/mol
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于
A.﹣317.3 kJ/mol B.﹣379.3 kJ/mol
C.﹣332.8 kJ/mol D.+317.3 kJ/mol
9.(本题5分)下列说法错误的是
A.煤、石油、天然气是当今世界最重要的三种化石燃料
B.化学反应必伴随能量的变化
C.化学反应释放的能量一定是热能
D.向鸡蛋白溶液中加入醋酸铅溶液,生成白色沉淀,加水不溶解
10.(本题5分)2022年2月,第24届冬奥会在北京和张家口联合举行。本届冬奥会的办奥理念是“绿色、共享、开放、廉洁”。下列说法错误的是
A.场馆使用的光伏发电系统含有太阳能电池板,其主要材料是硅
B.冬奥会颁奖花束所用的编织材料是以羊毛为原料的绒线,其主要成分为蛋白质
C.速滑馆采用二氧化碳跨临界直接制冰,实现二氧化碳的循环利用和零排放,干冰属于分子晶体
D.冬奥会火炬改良了气源比例,使火焰在日光下也清晰可见,火炬燃烧过程化学能完全转化为热能
二、判断题(共20分)
11.(本题4分)中和热测定实验时,如果没有环形玻璃棒,可用环形铜质搅拌棒代替。(_____)
12.(本题4分)。( )
13.(本题4分)反应条件(点燃或加热)对热效应有影响,所以热化学方程式必须注明反应条件。
14.(本题4分)经过处理的厨余垃圾残渣,在焚烧发电过程中存在化学能、热能、电能间的转化。(_______)
15.(本题4分)根据可知,氢气的燃烧热为。(______)
三、解答题(共30分)
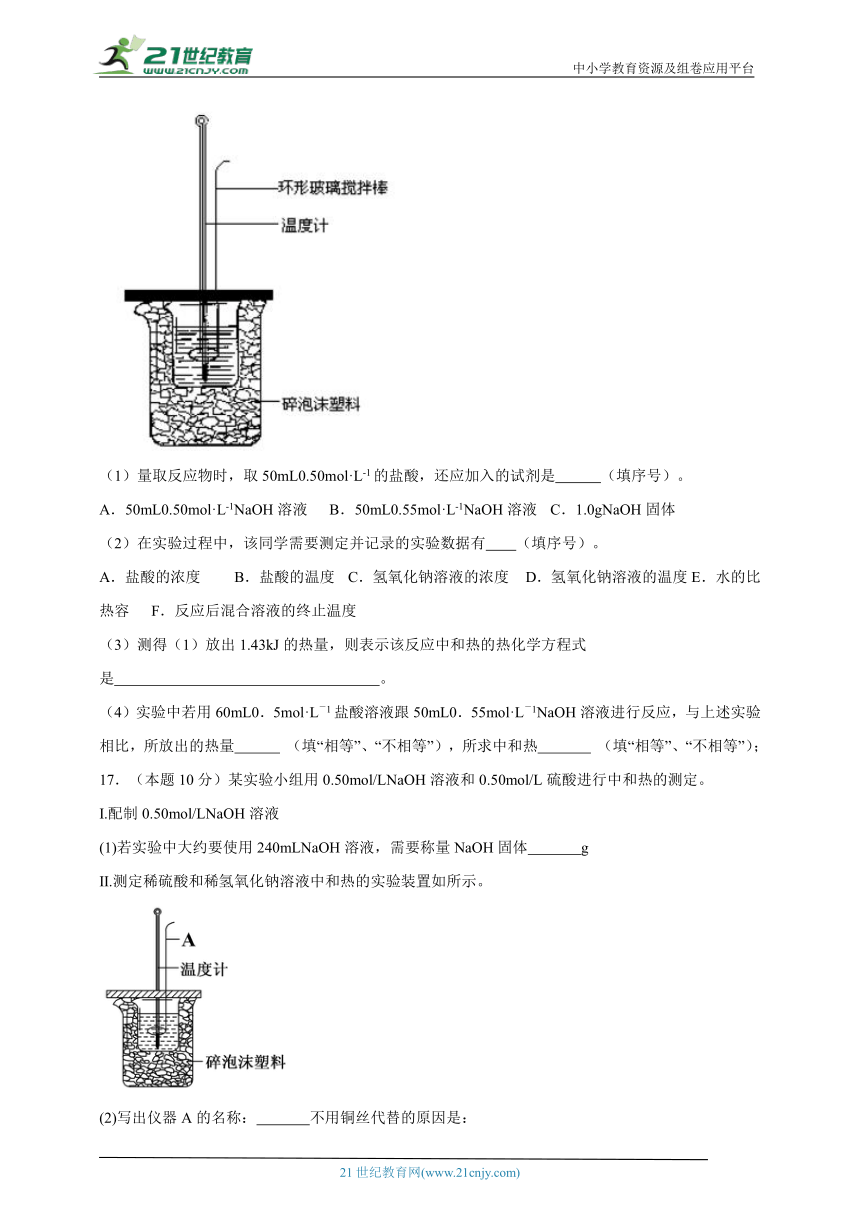
16.(本题10分)中和热的测定实验(如图)。
(1)量取反应物时,取50mL0.50mol·L-1的盐酸,还应加入的试剂是 (填序号)。
A.50mL0.50mol·L-1NaOH溶液 B.50mL0.55mol·L-1NaOH溶液 C.1.0gNaOH固体
(2)在实验过程中,该同学需要测定并记录的实验数据有 (填序号)。
A.盐酸的浓度 B.盐酸的温度 C.氢氧化钠溶液的浓度 D.氢氧化钠溶液的温度E.水的比热容 F.反应后混合溶液的终止温度
(3)测得(1)放出1.43kJ的热量,则表示该反应中和热的热化学方程式是 。
(4)实验中若用60mL0.5mol·L-1盐酸溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”、“不相等”),所求中和热 (填“相等”、“不相等”);
17.(本题10分)某实验小组用0.50mol/LNaOH溶液和0.50mol/L硫酸进行中和热的测定。
Ⅰ.配制0.50mol/LNaOH溶液
(1)若实验中大约要使用240mLNaOH溶液,需要称量NaOH固体 g
Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验装置如所示。
(2)写出仪器A的名称: 不用铜丝代替的原因是:
(3)取50mLNaOH溶液和30mL硫酸进行实验,实验数据如表。
温度 实验次数 起始温度t1/℃ 终止温度t2/℃
H2SO4 NaOH 平均值
1 26.2 26.0 26.1 30.1
2 27.0 27.4 27.2 33.3
3 25.9 25.9 25.9 29.8
4 26.4 26.2 26.3 30.4
已知:Q=cmΔt c=4.18J·g-1·℃-1
根据实验数据,计算中和热反应的ΔH=
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的反应热的数值 (填“偏大”“偏小”或“无影响”)。
18.(本题10分)某实验小组设计用50 mL1.0mol/L盐酸跟50 mL1.1 mol/L氢氧化钠溶液在右图装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)环形玻璃搅拌棒的作用是___________________。
(2)中和反应放出的热量会造成少量盐酸在反应中挥发,则测得的中和热的数值________(填“偏大”、“偏小”或“不变”)。
(3)该实验小组做了三次实验,每次取溶液各50 mL,并将实验数据记录如下:
已知盐酸、NaOH溶液的密度与水相同,中和后生成的溶液的比热容c=4.18×10-3kJ/(g.℃),则该反应的中和热△H=__________。
(4)在中和热测定实验中,测量起始温度时需要两个温度计,如果只用一个温度计测量,则测得的中和热的数值___________(填“偏大”、“偏小”或“不变”)。
参考答案:
1.D
【详解】A.因浓硫酸稀释会放出大量的热,所以浓硫酸与KOH反应生成1mol水时放出的热量大于57.3kJ,A错误;
B.Ba(OH)2和H2SO4反应时生成硫酸钡沉淀,形成沉淀时会放热,所以Ba(OH)2和H2SO4反应生成1mol水时放出的热量大于57.3kJ,B错误;
C.HCN是弱酸,弱酸电离时吸热,则HCN与KOH反应生成1mol水时放出的热量小于57.3kJ,C错误;
D.在稀溶液中,强酸与强碱发生中和反应生成1mol液态水时的反应热是中和热,中和热为ΔH=-57.3KJ/mol,则HCl(aq)+NaOH(aq)=H2O(l)+NaCl(aq)ΔH=-57.3kJ/mol,D正确;
本题选D。
2.C
【分析】有题意可知,反应的总方程式为2H2O22H2O+O2↑。
【详解】A.反应速率与浓度有关,所以I-浓度越大,速率越快,故A选项错误。
B.由题意可知I-为反应的催化剂,故B选项错误。
C.分解1mol H2O2放出热量98kJ,分解2mol H2O2放出热量196kJ,故C选项正确。
D.速率比等于化学计量数比,反应的总方程式为2H2O22H2O+O2↑,水不能用来表示反应的速率,且过氧化氢和氧气速率比为2:1,故D选项错误。
【点睛】本题的易错点为D选项,注意写出反应的总方程式后对各个物质的反应速率进行比较,并且水为纯溶剂,不用来表示反应速率。
3.D
【详解】A.需要加热的反应不一定是吸热反应,如铝热反应;A错误;
B.为放热反应,放热反应中反应物具有的总能量大于生成物具有的总能量,所以X(s)的总能量大于Y(s)的总能量,因此Y比X稳定,B错误;
C.相同条件下,同一物质在气态时具有的能量最高,液体时次之,固态时最低,反应放出的热量等于反应物所具有的总能量减去生成物所具有的总能量,因为生成物是一样的,所以等量的硫蒸气完全燃烧时放出的热量比固态硫放出的要多,C错误;
D.化学反应的本质是旧键断裂,新键形成,旧键断裂吸收的能量不等于新键形成放出的能量,D正确。
故选D。
4.C
【分析】中和反应是放热反应,强酸和强碱的稀溶液反应生成可溶性盐与1mol水,放出的热量为57.3kJ。①氨水是弱碱,电离要消耗能量;②氢氧化钠固体溶于水放出大量的热;③强酸和强碱的稀溶液反应生成可溶性盐与1mol水,放出的热量为57.3kJ,据此解答。
【详解】①盐酸与氨水反应生成1mol水,因为氨水是弱碱,电离要消耗能量,所以放出的热量小于57.3kJ;②稀盐酸与氢氧化钠固体发生生成1mol水,由于氢氧化钠固体溶于水放出大量的热,所以放出的热量大于57.3kJ;③稀的硝酸与稀氢氧化钾溶液反应生成可溶性盐与1mol水,放出的热量为57.3kJ。所以三个反应的放出热量②>③>①,即b>c>a。故选C。
【点睛】考查中和反应反应热的判断,必须是强酸和强碱的稀溶液反应生成可溶性盐与1mol水,反应热才是57.3kJ/mol,如果是浓溶液会大于57.3kJ/mol,因为浓酸和浓碱稀释放热,如果是弱酸和弱碱会小于57.3kJ/mol,因为弱酸和弱碱电离需要吸热。
5.A
【详解】根据图象可知,该过程中物质的起始能量小于终了能量,需要吸收能量。A. 干冰升华是吸热过程,故A正确;B. 工业合成氨是放热过程,故B错误;C. H+Cl→H-Cl是放热过程,故C错误;D. 浓硫酸稀释是放热过程,故D错误;故选A。
6.B
【详解】试题分析:已知:①I2( )+H2(g)2HI(g) ΔH="-9.48" kJ·mol-1;②I2( )+H2(g)2HI(g) ΔH="+26.48" kJ·mol-1,利用盖斯定律将①-②可得I2(?)=I2(?)△H=-9.48kJ/mol-26.48kJ/mol-1=-35.96kJ/mol,则A、根据以上分析可知反应①中碘是气态,②中碘是固态,A错误;B、254 g I2(g)是1mol,完全反应放热9.48 kJ,B正确;C、①②反应产物都是HI,状态相同,稳定性相同,C错误;D、由I2(g)=I2(s)△H=-35.96kJ/mol,可知1mol固态碘与1mol气态碘所含的能量相差35.96kJ,D错误,答案选B。
考点:化学反应与能量
7.B
【详解】A.引起化学反应能量变化的主要原因是化学键的断裂和生成,化学反应的实质就是旧化学键断裂和新化学键的生成,而旧化学键断裂所吸收的能量与新化学键所释放的能量不同导致发生了能量的变化。故A正确;
B.化学反应过程中的能量变化主要是热量变化,也可以以光能、电能等形式变化,故B错误;
C.原电池是一种把化学能转化为电能的装置,原电池工作时,能量转化的主要形式是将化学能转化为电能,故C 正确;
D.二次电池充电过程中,利用了电解池原理,是电能转换成化学能,故D正确;
本题答案B。
8.A
【详解】已知:(1)Zn(s)+O2(g)=ZnO(s),△H=﹣348.3kJ/mol
(2)2Ag(s)+O2(g)=Ag2O(s),△H=﹣31.0kJ/mol
根据盖斯定律,将(1)-(2),整理可得:Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H=﹣317.3 kJ/mol,故合理选项是A。
9.C
【详解】A.煤、石油、天然气是重要的三种化石燃料,A正确;
B.化学反应必伴随能量的变化,不是放热就是吸热,B正确;
C.化学反应释放的能量可能以热能形式也可能是光能或声能形式,C错误;
D.蛋白质溶液中加入醋酸铅,蛋白质发生变性,产生白色沉淀,加水不溶解,D正确;
故选C。
10.D
【详解】A.Si的导电性介于导体和绝缘体之间,是良好的半导体材料,可以做太阳能电池板的原料,故A正确;
B.羊毛的主要成分是蛋白质,故B正确;
C.干冰是固体二氧化碳,干冰是二氧化碳分子间通过范德华力结合而成的,属于分子晶体,故C正确;
D.火炬燃烧过程中化学能部分转化为热能,部分转化为光能,故D错误;
故选D。
11.错误
【详解】由于铜具有导热性;中和热测定实验中若用环形铜质搅拌棒,会有相当一部分热量通过环形铜质搅拌棒与空气进行热交换而损失,增大实验误差;故错误。
12.错误
【详解】硫在氧气中燃烧的反应为放热反应,反应的焓变ΔH小于0,故错误。
13.错误
【详解】热化学方程式主要是强调这个反应的反应热是多少,而不是强调这个反应在什么条件下能发生,根据盖斯定律,只要反应物和生成物一致,不管在什么条件下发生反应热都是一样的,因此不需要注明反应条件,该说法错误。
14.正确
【详解】焚烧发电过程中存在化学能转化为热能再转化为机械能最后电能,正确。
15.错误
【详解】燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,该热化学方程式中H2的化学计量数不是1,故错误。
16. B B D F NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H= 57.2kJ/mol 不相等 相等
【详解】试题分析:本题主要研究酸碱中和热的测定,重点考查中和热测定操作、热化学方程式书写、实验误差分析等基础知识和基本技能,考查考生对“中和热”的理解能力和实验综合分析能力。
解析:(1)中和热是强酸强碱稀溶液完全反应生成1mol液态水时释放的热量,所以不能选用NaOH固体,同时为了确保HCl完全反应,因此需要加入略过量的NaOH稀溶液,所以选择B答案。正确答案:B。(2)实验过程中除了给出的两种稀溶液的浓度和体积外,需要测量和记录的数据包括稀盐酸和烯NaOH溶液的起始温度、实验过程中容器的最高温度。正确答案:BDF。(3)根据实验已知的两种稀溶液浓度和体积可知,反应生成液态水0.025mol,因此反应生成1mol液态水时释放的热量为1.43kJ÷0.025mol=57.2 kJ/mol ,所以表示该反应中和热的热化学方程式是NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H= 57.2kJ/mol 。正确答案 :NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H= 57.2kJ/mol。(4)当“用60mL0.5mol·L-1盐酸溶液跟50mL0.55mol·L-1NaOH溶液进行反应”时,参加反应的反应物更多,因此释放的能量更多,但是由于最终均以生成1mol液态水衡量中和热,所以中和热不变。正确答案:不相等、相等。
点睛:一定温度下,虽然具体实验测量中吸收或是释放的热量会发生改变,但是具体反应的反应热不随实验中反应物而改变,因为反应确定后,热化学方程式所表达的反应物及生成物的量是不变的。
17.(1)5.0g
(2) 玻璃搅拌器 铜丝易导热,损失的热量更多,造成实验误差更大
(3)53.5kJ/mol
(4)偏小
【详解】(1)若实验中大约要使用240mLNaOH溶液,由于需要250mL容量瓶,则需要称量NaOH固体的质量是0.25L×0.5mol/L×40g/mol=5.0g
(2)仪器A的名称是玻璃搅拌器,由于铜丝易导热,损失的热量更多,造成实验误差更大,因此不用铜丝代替;
(3)根据实验数据,四次实验温度差分别是(℃)4.0、6.1、3.9、4.1,其中第二次实验误差大,舍去,另外三次温度差的平均值是4.0℃,反应中生成水的物质的量是0.025mol,则中和热反应的ΔH=≈53.5kJ/mol;
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,由于一水合氨电离吸热,则测得的反应热的数值偏小。
18.(1)使酸和碱充分混合,加快反应速率,并使小烧杯内液体温度上下一致;(2)偏小;(3)-56.8 kJ.mol-1;(4)偏小。
【详解】试题分析:(1)环形玻璃搅拌棒的作用是:使酸和碱充分混合,加快反应速率,并使小烧杯内液体温度上下一致;(2)根据△H=-cm△t/n(H2O)kJ·mol-1,盐酸挥发,造成放出的热量减少,△t偏低,中和热的数值偏低;(3)平均温差是(6.8+6.7+6.9)/3℃=6.8℃,根据(2)中公式,△H=-4.18×10-3 × 100 × 6.8/(50 × 10-3 × 1)kJ·mol-1=-56.8kJ·mol-1;(4)如果只用一个温度计,造成热量的损失,所测中和热的数值偏小。
考点:考查中和热测定等知识。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
化学反应的热效应
共18题,满分100分
题号 一 二 三 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请注意保持试卷整洁
一、单选题(共50分)
1.(本题5分)已知稀溶液中,。由此判断下列热化学方程式书写正确的是
A.
B.
C.
D.
2.(本题5分)已知分解1mol H2O2放出热量98kJ,在含少量I-的溶液中,H2O2分解的机理为:
H2O2+I-→H2O+IO- 慢
H2O2+IO-→H2O+O2+I- 快
下列有关该反应的说法正确的是( )
A.反应速率与I-浓度无关
B.IO-也是该反应的催化剂
C.分解2mol H2O2放出热量196kJ
D.v(H2O2)=v(H2O)=v(O2)
3.(本题5分)下列说法正确的是
A.需要加热的反应一定是吸热反应
B.X(s)=Y(s)是放热反应,则X比Y稳定
C.等量的硫蒸气和固态硫分别完全燃烧,后者放出的热量更多
D.在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同
4.(本题5分)已知:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1。对于下列稀溶液或固体之间的反应:
①HCl(aq)+NH3·H2O (aq)===NH4Cl(aq)+H2O(l) ΔH=-a kJ·mol-1
②HCl(aq)+NaOH(s)===NaCl(aq)+H2O(l) ΔH=-b kJ·mol-1
③HNO3 (aq)+NaOH (aq)===NaNO3 (aq)+H2O(l) ΔH=-c kJ·mol-1
下列有关a、b、c三者的大小关系中正确的是
A.a>b>c>57.3 B.a>b=c=57.3
C.b>c=57.4>a D.无法比较
5.(本题5分)下列过程中能量变化与如图一致的是
A.干冰升华 B.工业合成氨 C.H+Cl→H-Cl D.浓硫酸稀释
6.(本题5分)根据碘与氢气反应的热化学方程式:
①I2( )+H2(g)2HI(g) ΔH="-9.48" kJ·mol-1
②I2( )+H2(g)2HI(g) ΔH="+26.48" kJ·mol-1
下列判断中正确的是
A.①中的I2为固态,②中的I2为气态
B.254 g I2(g)完全反应放热9.48 kJ
C.①的产物比②的产物热稳定性更好
D.1 mol固态碘升华时将吸热17 kJ
7.(本题5分)下列说法不正确的是
A.引起化学反应能量变化的主要原因是化学键的断裂和生成
B.化学反应中的能量变化只有热量变化
C.原电池中主要能量变化是化学能转变为电能
D.二次电池充电过程是将电能转变为化学能
8.(本题5分)已知:(1)Zn(s)+O2(g)=ZnO(s),△H=﹣348.3 kJ/mol
(2)2Ag(s)+O2(g)=Ag2O(s),△H=﹣31.0 kJ/mol
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于
A.﹣317.3 kJ/mol B.﹣379.3 kJ/mol
C.﹣332.8 kJ/mol D.+317.3 kJ/mol
9.(本题5分)下列说法错误的是
A.煤、石油、天然气是当今世界最重要的三种化石燃料
B.化学反应必伴随能量的变化
C.化学反应释放的能量一定是热能
D.向鸡蛋白溶液中加入醋酸铅溶液,生成白色沉淀,加水不溶解
10.(本题5分)2022年2月,第24届冬奥会在北京和张家口联合举行。本届冬奥会的办奥理念是“绿色、共享、开放、廉洁”。下列说法错误的是
A.场馆使用的光伏发电系统含有太阳能电池板,其主要材料是硅
B.冬奥会颁奖花束所用的编织材料是以羊毛为原料的绒线,其主要成分为蛋白质
C.速滑馆采用二氧化碳跨临界直接制冰,实现二氧化碳的循环利用和零排放,干冰属于分子晶体
D.冬奥会火炬改良了气源比例,使火焰在日光下也清晰可见,火炬燃烧过程化学能完全转化为热能
二、判断题(共20分)
11.(本题4分)中和热测定实验时,如果没有环形玻璃棒,可用环形铜质搅拌棒代替。(_____)
12.(本题4分)。( )
13.(本题4分)反应条件(点燃或加热)对热效应有影响,所以热化学方程式必须注明反应条件。
14.(本题4分)经过处理的厨余垃圾残渣,在焚烧发电过程中存在化学能、热能、电能间的转化。(_______)
15.(本题4分)根据可知,氢气的燃烧热为。(______)
三、解答题(共30分)
16.(本题10分)中和热的测定实验(如图)。
(1)量取反应物时,取50mL0.50mol·L-1的盐酸,还应加入的试剂是 (填序号)。
A.50mL0.50mol·L-1NaOH溶液 B.50mL0.55mol·L-1NaOH溶液 C.1.0gNaOH固体
(2)在实验过程中,该同学需要测定并记录的实验数据有 (填序号)。
A.盐酸的浓度 B.盐酸的温度 C.氢氧化钠溶液的浓度 D.氢氧化钠溶液的温度E.水的比热容 F.反应后混合溶液的终止温度
(3)测得(1)放出1.43kJ的热量,则表示该反应中和热的热化学方程式是 。
(4)实验中若用60mL0.5mol·L-1盐酸溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”、“不相等”),所求中和热 (填“相等”、“不相等”);
17.(本题10分)某实验小组用0.50mol/LNaOH溶液和0.50mol/L硫酸进行中和热的测定。
Ⅰ.配制0.50mol/LNaOH溶液
(1)若实验中大约要使用240mLNaOH溶液,需要称量NaOH固体 g
Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验装置如所示。
(2)写出仪器A的名称: 不用铜丝代替的原因是:
(3)取50mLNaOH溶液和30mL硫酸进行实验,实验数据如表。
温度 实验次数 起始温度t1/℃ 终止温度t2/℃
H2SO4 NaOH 平均值
1 26.2 26.0 26.1 30.1
2 27.0 27.4 27.2 33.3
3 25.9 25.9 25.9 29.8
4 26.4 26.2 26.3 30.4
已知:Q=cmΔt c=4.18J·g-1·℃-1
根据实验数据,计算中和热反应的ΔH=
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的反应热的数值 (填“偏大”“偏小”或“无影响”)。
18.(本题10分)某实验小组设计用50 mL1.0mol/L盐酸跟50 mL1.1 mol/L氢氧化钠溶液在右图装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)环形玻璃搅拌棒的作用是___________________。
(2)中和反应放出的热量会造成少量盐酸在反应中挥发,则测得的中和热的数值________(填“偏大”、“偏小”或“不变”)。
(3)该实验小组做了三次实验,每次取溶液各50 mL,并将实验数据记录如下:
已知盐酸、NaOH溶液的密度与水相同,中和后生成的溶液的比热容c=4.18×10-3kJ/(g.℃),则该反应的中和热△H=__________。
(4)在中和热测定实验中,测量起始温度时需要两个温度计,如果只用一个温度计测量,则测得的中和热的数值___________(填“偏大”、“偏小”或“不变”)。
参考答案:
1.D
【详解】A.因浓硫酸稀释会放出大量的热,所以浓硫酸与KOH反应生成1mol水时放出的热量大于57.3kJ,A错误;
B.Ba(OH)2和H2SO4反应时生成硫酸钡沉淀,形成沉淀时会放热,所以Ba(OH)2和H2SO4反应生成1mol水时放出的热量大于57.3kJ,B错误;
C.HCN是弱酸,弱酸电离时吸热,则HCN与KOH反应生成1mol水时放出的热量小于57.3kJ,C错误;
D.在稀溶液中,强酸与强碱发生中和反应生成1mol液态水时的反应热是中和热,中和热为ΔH=-57.3KJ/mol,则HCl(aq)+NaOH(aq)=H2O(l)+NaCl(aq)ΔH=-57.3kJ/mol,D正确;
本题选D。
2.C
【分析】有题意可知,反应的总方程式为2H2O22H2O+O2↑。
【详解】A.反应速率与浓度有关,所以I-浓度越大,速率越快,故A选项错误。
B.由题意可知I-为反应的催化剂,故B选项错误。
C.分解1mol H2O2放出热量98kJ,分解2mol H2O2放出热量196kJ,故C选项正确。
D.速率比等于化学计量数比,反应的总方程式为2H2O22H2O+O2↑,水不能用来表示反应的速率,且过氧化氢和氧气速率比为2:1,故D选项错误。
【点睛】本题的易错点为D选项,注意写出反应的总方程式后对各个物质的反应速率进行比较,并且水为纯溶剂,不用来表示反应速率。
3.D
【详解】A.需要加热的反应不一定是吸热反应,如铝热反应;A错误;
B.为放热反应,放热反应中反应物具有的总能量大于生成物具有的总能量,所以X(s)的总能量大于Y(s)的总能量,因此Y比X稳定,B错误;
C.相同条件下,同一物质在气态时具有的能量最高,液体时次之,固态时最低,反应放出的热量等于反应物所具有的总能量减去生成物所具有的总能量,因为生成物是一样的,所以等量的硫蒸气完全燃烧时放出的热量比固态硫放出的要多,C错误;
D.化学反应的本质是旧键断裂,新键形成,旧键断裂吸收的能量不等于新键形成放出的能量,D正确。
故选D。
4.C
【分析】中和反应是放热反应,强酸和强碱的稀溶液反应生成可溶性盐与1mol水,放出的热量为57.3kJ。①氨水是弱碱,电离要消耗能量;②氢氧化钠固体溶于水放出大量的热;③强酸和强碱的稀溶液反应生成可溶性盐与1mol水,放出的热量为57.3kJ,据此解答。
【详解】①盐酸与氨水反应生成1mol水,因为氨水是弱碱,电离要消耗能量,所以放出的热量小于57.3kJ;②稀盐酸与氢氧化钠固体发生生成1mol水,由于氢氧化钠固体溶于水放出大量的热,所以放出的热量大于57.3kJ;③稀的硝酸与稀氢氧化钾溶液反应生成可溶性盐与1mol水,放出的热量为57.3kJ。所以三个反应的放出热量②>③>①,即b>c>a。故选C。
【点睛】考查中和反应反应热的判断,必须是强酸和强碱的稀溶液反应生成可溶性盐与1mol水,反应热才是57.3kJ/mol,如果是浓溶液会大于57.3kJ/mol,因为浓酸和浓碱稀释放热,如果是弱酸和弱碱会小于57.3kJ/mol,因为弱酸和弱碱电离需要吸热。
5.A
【详解】根据图象可知,该过程中物质的起始能量小于终了能量,需要吸收能量。A. 干冰升华是吸热过程,故A正确;B. 工业合成氨是放热过程,故B错误;C. H+Cl→H-Cl是放热过程,故C错误;D. 浓硫酸稀释是放热过程,故D错误;故选A。
6.B
【详解】试题分析:已知:①I2( )+H2(g)2HI(g) ΔH="-9.48" kJ·mol-1;②I2( )+H2(g)2HI(g) ΔH="+26.48" kJ·mol-1,利用盖斯定律将①-②可得I2(?)=I2(?)△H=-9.48kJ/mol-26.48kJ/mol-1=-35.96kJ/mol,则A、根据以上分析可知反应①中碘是气态,②中碘是固态,A错误;B、254 g I2(g)是1mol,完全反应放热9.48 kJ,B正确;C、①②反应产物都是HI,状态相同,稳定性相同,C错误;D、由I2(g)=I2(s)△H=-35.96kJ/mol,可知1mol固态碘与1mol气态碘所含的能量相差35.96kJ,D错误,答案选B。
考点:化学反应与能量
7.B
【详解】A.引起化学反应能量变化的主要原因是化学键的断裂和生成,化学反应的实质就是旧化学键断裂和新化学键的生成,而旧化学键断裂所吸收的能量与新化学键所释放的能量不同导致发生了能量的变化。故A正确;
B.化学反应过程中的能量变化主要是热量变化,也可以以光能、电能等形式变化,故B错误;
C.原电池是一种把化学能转化为电能的装置,原电池工作时,能量转化的主要形式是将化学能转化为电能,故C 正确;
D.二次电池充电过程中,利用了电解池原理,是电能转换成化学能,故D正确;
本题答案B。
8.A
【详解】已知:(1)Zn(s)+O2(g)=ZnO(s),△H=﹣348.3kJ/mol
(2)2Ag(s)+O2(g)=Ag2O(s),△H=﹣31.0kJ/mol
根据盖斯定律,将(1)-(2),整理可得:Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H=﹣317.3 kJ/mol,故合理选项是A。
9.C
【详解】A.煤、石油、天然气是重要的三种化石燃料,A正确;
B.化学反应必伴随能量的变化,不是放热就是吸热,B正确;
C.化学反应释放的能量可能以热能形式也可能是光能或声能形式,C错误;
D.蛋白质溶液中加入醋酸铅,蛋白质发生变性,产生白色沉淀,加水不溶解,D正确;
故选C。
10.D
【详解】A.Si的导电性介于导体和绝缘体之间,是良好的半导体材料,可以做太阳能电池板的原料,故A正确;
B.羊毛的主要成分是蛋白质,故B正确;
C.干冰是固体二氧化碳,干冰是二氧化碳分子间通过范德华力结合而成的,属于分子晶体,故C正确;
D.火炬燃烧过程中化学能部分转化为热能,部分转化为光能,故D错误;
故选D。
11.错误
【详解】由于铜具有导热性;中和热测定实验中若用环形铜质搅拌棒,会有相当一部分热量通过环形铜质搅拌棒与空气进行热交换而损失,增大实验误差;故错误。
12.错误
【详解】硫在氧气中燃烧的反应为放热反应,反应的焓变ΔH小于0,故错误。
13.错误
【详解】热化学方程式主要是强调这个反应的反应热是多少,而不是强调这个反应在什么条件下能发生,根据盖斯定律,只要反应物和生成物一致,不管在什么条件下发生反应热都是一样的,因此不需要注明反应条件,该说法错误。
14.正确
【详解】焚烧发电过程中存在化学能转化为热能再转化为机械能最后电能,正确。
15.错误
【详解】燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,该热化学方程式中H2的化学计量数不是1,故错误。
16. B B D F NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H= 57.2kJ/mol 不相等 相等
【详解】试题分析:本题主要研究酸碱中和热的测定,重点考查中和热测定操作、热化学方程式书写、实验误差分析等基础知识和基本技能,考查考生对“中和热”的理解能力和实验综合分析能力。
解析:(1)中和热是强酸强碱稀溶液完全反应生成1mol液态水时释放的热量,所以不能选用NaOH固体,同时为了确保HCl完全反应,因此需要加入略过量的NaOH稀溶液,所以选择B答案。正确答案:B。(2)实验过程中除了给出的两种稀溶液的浓度和体积外,需要测量和记录的数据包括稀盐酸和烯NaOH溶液的起始温度、实验过程中容器的最高温度。正确答案:BDF。(3)根据实验已知的两种稀溶液浓度和体积可知,反应生成液态水0.025mol,因此反应生成1mol液态水时释放的热量为1.43kJ÷0.025mol=57.2 kJ/mol ,所以表示该反应中和热的热化学方程式是NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H= 57.2kJ/mol 。正确答案 :NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H= 57.2kJ/mol。(4)当“用60mL0.5mol·L-1盐酸溶液跟50mL0.55mol·L-1NaOH溶液进行反应”时,参加反应的反应物更多,因此释放的能量更多,但是由于最终均以生成1mol液态水衡量中和热,所以中和热不变。正确答案:不相等、相等。
点睛:一定温度下,虽然具体实验测量中吸收或是释放的热量会发生改变,但是具体反应的反应热不随实验中反应物而改变,因为反应确定后,热化学方程式所表达的反应物及生成物的量是不变的。
17.(1)5.0g
(2) 玻璃搅拌器 铜丝易导热,损失的热量更多,造成实验误差更大
(3)53.5kJ/mol
(4)偏小
【详解】(1)若实验中大约要使用240mLNaOH溶液,由于需要250mL容量瓶,则需要称量NaOH固体的质量是0.25L×0.5mol/L×40g/mol=5.0g
(2)仪器A的名称是玻璃搅拌器,由于铜丝易导热,损失的热量更多,造成实验误差更大,因此不用铜丝代替;
(3)根据实验数据,四次实验温度差分别是(℃)4.0、6.1、3.9、4.1,其中第二次实验误差大,舍去,另外三次温度差的平均值是4.0℃,反应中生成水的物质的量是0.025mol,则中和热反应的ΔH=≈53.5kJ/mol;
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,由于一水合氨电离吸热,则测得的反应热的数值偏小。
18.(1)使酸和碱充分混合,加快反应速率,并使小烧杯内液体温度上下一致;(2)偏小;(3)-56.8 kJ.mol-1;(4)偏小。
【详解】试题分析:(1)环形玻璃搅拌棒的作用是:使酸和碱充分混合,加快反应速率,并使小烧杯内液体温度上下一致;(2)根据△H=-cm△t/n(H2O)kJ·mol-1,盐酸挥发,造成放出的热量减少,△t偏低,中和热的数值偏低;(3)平均温差是(6.8+6.7+6.9)/3℃=6.8℃,根据(2)中公式,△H=-4.18×10-3 × 100 × 6.8/(50 × 10-3 × 1)kJ·mol-1=-56.8kJ·mol-1;(4)如果只用一个温度计,造成热量的损失,所测中和热的数值偏小。
考点:考查中和热测定等知识。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
