化学电源-高考化学考前专项练习试题(含解析)
文档属性
| 名称 | 化学电源-高考化学考前专项练习试题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-13 10:53:06 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
化学电源
共18题,满分100分
题号 一 二 三 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请注意保持试卷整洁
一、单选题(共50分)
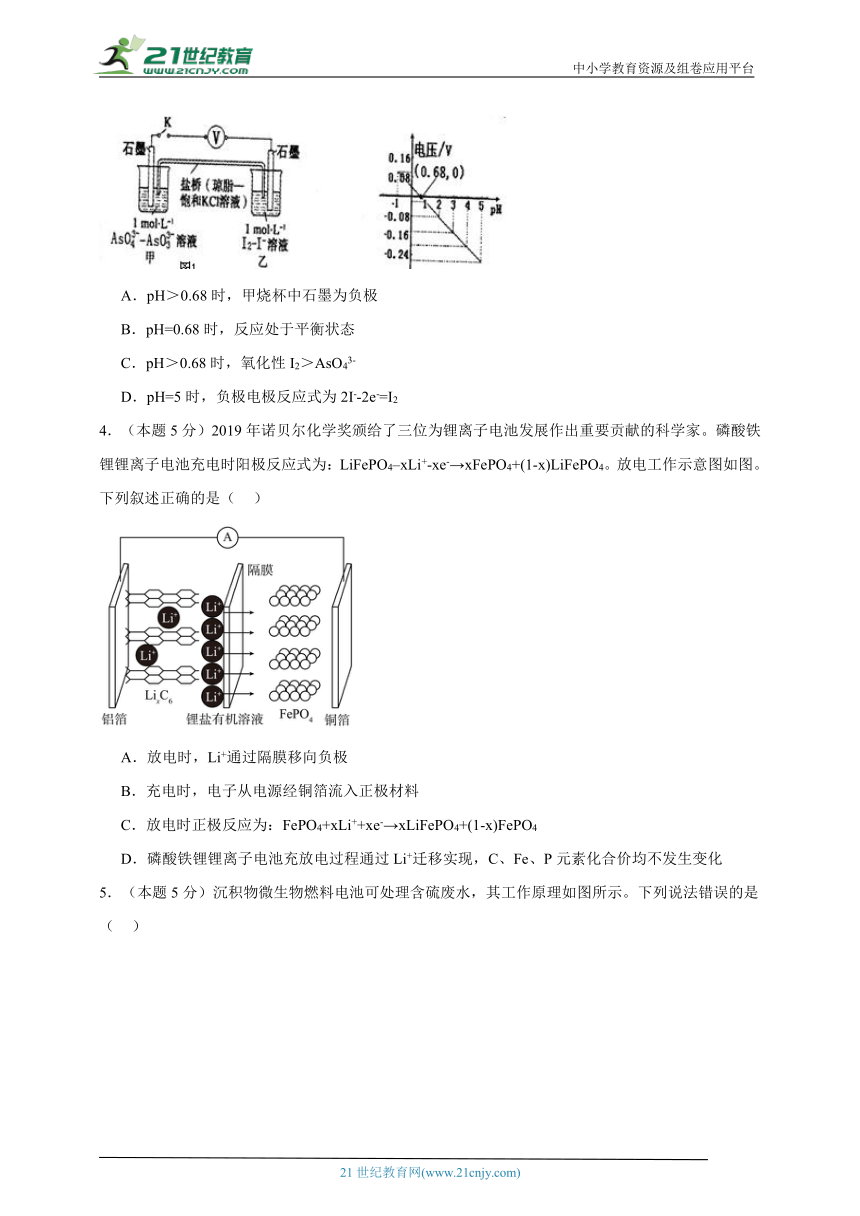
1.(本题5分)以Na3Ti2(PO4)3为负极材料的新型可充电钠离子电池的工作原理如图。下列说法错误的是
A.放电时,正极反应式为Fe[Fe(CN)6]+2Na++2e-=Na2Fe[Fe(CN)6]
B.充电时,a端接电源正极
C.充电时,每生成1molFe[Fe(CN)6]消耗2molNaTi2(PO4)3
D.充电时,Na+通过离子交换膜从左室移向右室
2.(本题5分)—种以Na2SO4为电解质的钠离子电池的总反应如下,下列有关说法正确的是
NaTi2(PO4)3+Zn+Na2SO4Na3Ti2(PO4)3+ZnSO4
A.放电时,NaTi2(PO4)3发生氧化反应 B.放电时,Na+向锌电极移动
C.充电时,阳极反应式为[Ti2(PO4)3]-+2e-[Ti2(PO4)3]3- D.充电时,每转移0.2mol电子,理论上阴极增重6.5g
3.(本题5分)某实验小组依据反应AsO43-+2H++2I- AsO33-+I2+H2O设计左下图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如右下图,下列有关叙述错误的是
A.pH>0.68时,甲烧杯中石墨为负极
B.pH=0.68时,反应处于平衡状态
C.pH>0.68时,氧化性I2>AsO43-
D.pH=5时,负极电极反应式为2I--2e-=I2
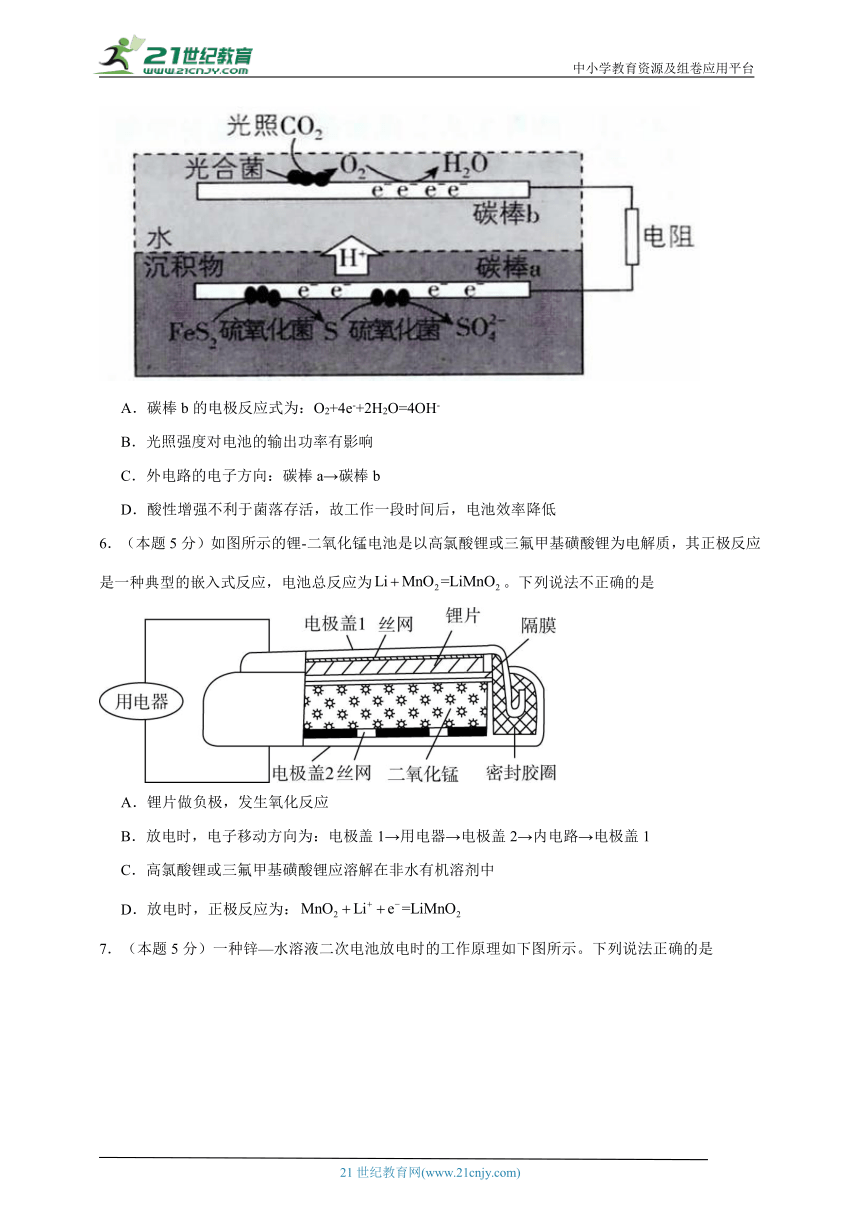
4.(本题5分)2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家。磷酸铁锂锂离子电池充电时阳极反应式为:LiFePO4–xLi+-xe-→xFePO4+(1-x)LiFePO4。放电工作示意图如图。下列叙述正确的是( )
A.放电时,Li+通过隔膜移向负极
B.充电时,电子从电源经铜箔流入正极材料
C.放电时正极反应为:FePO4+xLi++xe-→xLiFePO4+(1-x)FePO4
D.磷酸铁锂锂离子电池充放电过程通过Li+迁移实现,C、Fe、P元素化合价均不发生变化
5.(本题5分)沉积物微生物燃料电池可处理含硫废水,其工作原理如图所示。下列说法错误的是( )
A.碳棒b的电极反应式为:O2+4e-+2H2O=4OH-
B.光照强度对电池的输出功率有影响
C.外电路的电子方向:碳棒a→碳棒b
D.酸性增强不利于菌落存活,故工作一段时间后,电池效率降低
6.(本题5分)如图所示的锂-二氧化锰电池是以高氯酸锂或三氟甲基磺酸锂为电解质,其正极反应是一种典型的嵌入式反应,电池总反应为。下列说法不正确的是
A.锂片做负极,发生氧化反应
B.放电时,电子移动方向为:电极盖1→用电器→电极盖2→内电路→电极盖1
C.高氯酸锂或三氟甲基磺酸锂应溶解在非水有机溶剂中
D.放电时,正极反应为:
7.(本题5分)一种锌—水溶液二次电池放电时的工作原理如下图所示。下列说法正确的是
A.放电时的正极反应为Zn0.5-xMnO2-2xe-+xZn2+=Zn0.5MnO2
B.放电时CF3SO移向电源的正极
C.充电时,Zn电极与外接直流电源的正极相连
D.充电时,电路中每转移1mole-,Zn电极质量增加32.5g
8.(本题5分)如图,某液态金属储能电池放电时产生金属化合物Li3Bi,下列说法正确的是
A.放电时,N电极的质量减小
B.放电时,M电极反应为: Ni-2e-= Ni2+
C.充电时,Li+由N电极向M电极移动
D.充电时,N电极反应为: Li3Bi+3e- =3Li++ Bi
9.(本题5分)微生物电池具有高效、清洁、环保等优点。某微生物电池工作原理如图所示,下列说法错误的是
A.a极为该电池的负极
B.b极的电极反应式为
C.放电过程中a极附近pH降低
D.当外电路通过时,理论上溶液中会有通过质子交换膜移向b极
10.(本题5分)以KOH溶液为离子导体,分别组成CH3OH—O2、N2H4—O2、(CH3)2NNH2—O2清洁燃料电池,下列说法正确的是
A.放电过程中,K+均向负极移动
B.放电过程中,KOH的物质的量均减小
C.消耗1mol O2时,理论上N2H4—O2燃料电池气体产物的体积在标准状况下为11.2L
D.消耗等质量燃料,(CH3)2NNH2—O2燃料电池的理论放电量最大
二、判断题(共20分)
11.(本题4分)铅蓄电池在放电过程中,负极质量减小,正极质量增加。
12.(本题4分)充电电池可以无限制地反复充电、放电。(__)
13.(本题4分)燃料电池的电极不参与反应,有很强的催化活性,起导电作用。(_____)
14.(本题4分)碱性锌锰干电池是一次电池,其中MnO2是催化剂,可使锌锰干电池的比能量高、可储存时间长。(_______)
15.(本题4分)我们可以根据硫酸密度的大小来判断铅酸蓄电池是否需要充电。(______)
三、解答题(共30分)
16.(本题10分)如图所示为CH4燃料电池的装置(A、B为多孔碳棒):
(1) (填A或B)处电极入口通甲烷,其电极反应式为 。
(2)当消耗甲烷的体积为11.2 L(标准状况下)时,消耗KOH的质量为 g。
(3)铅蓄电池是最早使用的充电电池,由Pb、PbO2、硫酸构成。该电池工作时,正极的电极反应式为 。
17.(本题10分)肼( N2H4)和偏二甲肼(C2H8N2 )常用于火箭推进剂和燃料电池,NO2的二聚体N2O4 则是火箭中常用氧化剂。回答下列问题:
(1)肼燃料电池原理如图所示,左边电极上发生的电极反应式为 ;电池工作时OH-向 移动(填“负极”或“正极”),整个溶液的碱性 (填“减小”或“增大”)。
(2)火箭常用 N2O4 作氧化剂,肼作燃料,已知:
①N2(g)+2O2(g)=2NO2(g) △H1=-66.7kJ·mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H2=-530.5kJ·mol-1
③2NO2(g) N2O4(g) △H3=-55.7kJ·mol-1
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式: 。
(3)“长征二号”火箭所用的燃料是偏二甲肼(C2H8N2)(其中N的化合价为-3)和四氧化二氮(N2O4)。在火箭升空过程中燃料发生反应 C2H8N2 +2N2O4=2CO2↑+3N2↑+4H2O↑。下列有关叙述正确的是
A.该反应中N2O4是氧化剂,偏二甲肼是还原剂 B.每消耗1molC2H8N2,转移电子数目为16NA
C. CO2既不是氧化产物也不是还原产物 D.N2既是氧化产物又是还原产物
18.(本题10分)CuSO4溶液是中学化学及工农业生产中常见的一种试剂。某同学利用CuSO4溶液,进行以下实验探究。
(1)图一是根据反应Zn+CuSO4==Cu+ZnSO4设计成的锌铜原电池。Cu极的电极反应式是 ,盐桥中是含有琼胶的KCl饱和溶液,电池工作时K+向 移动(填“甲”或“乙”)。
(2)图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是 (填“CH4”或“O2”),a处电极上发生的电极反应式是 ;当铜电极的质量减轻3.2g,则消耗的CH4在标准状况下的体积为 L。
(3)一段时间后,燃料电池的电解质溶液完全转化为K2CO3,以下关系正确的是 。
A.c(K+)+c(H+)=c(HCO)+c(CO)+c(OH-)
B.c(OH-)=c(H+)+c(HCO)+2c(H2CO3)
C.c(K+)>c(CO)>c(H+)>c(OH-)
D.c(K+)>c(CO)>c(OH-)>c(HCO)
E.c(K+)=2c(CO)+c(HCO)+c(H2CO3)
参考答案:
1.C
【分析】Na3Ti2(PO4)3为负极材料,所以放电时Na3Ti2(PO4)3被氧化为NaTi2(PO4)3,Mo箔为正极,Fe[Fe(CN)6]被还原为Na2Fe[Fe(CN)6]。
【详解】A.放电时,Mo箔为正极,Fe[Fe(CN)6]被还原为Na2Fe[Fe(CN)6],电极反应为Fe[Fe(CN)6]+2Na++2e-=Na2Fe[Fe(CN)6],A正确;
B.放电时Mo箔为正极,则充电时Mo箔为阳极,a端连接电源正极,B正确;
C.充电时右侧为阴极,电极反应为NaTi2(PO4)3+2e-+2Na+= Na3Ti2(PO4)3,阳极反应为Na2Fe[Fe(CN)6]-2e-=Fe[Fe(CN)6]+2Na+,根据电极反应可知每生成1molFe[Fe(CN)6]转移2mol电子,消耗1molNaTi2(PO4)3,C错误;
D.充电时为电解池,电解池中阳离子由阳极流向阴极,即Na+通过离子交换膜从左室移向右室,D正确;
综上所述答案为C。
2.D
【详解】A.根据原电池的工作原理,正极上发生还原反应,化合价降低,负极上发生氧化反应,化合价升高,根据电池总反应,锌的化合价升高,因此锌为负极,发生氧化反应,NaTi2(PO4)3中Ti的化合价由+4价→+3价,化合价降低,因此NaTi2(PO4)3发生还原反应,故A错误;
B.根据原电池工作原理,Na+向正极移动,故B错误;
C.充电时,电池的正极接电源的正极,电池的负极接电源的负极,电池正极反应式为[Ti2(PO4)3]-+2e-=[Ti2(PO4)3]2-,充电时阳极反应式为[Ti2(PO4)3]2--2e-=[Ti2(PO4)3]-,故C错误;
D.充电时阴极反应式为Zn2++2e-=Zn,每转移0.2mol电子,阴极增重6.5g,故D正确;
故选D。
3.D
【详解】A.pH>0.68时,电压小于0,反应向左进行,AsO33-失电子,甲烧杯中石墨为负极,选项A正确;B.pH=0.68时,电压为0,反应处于平衡状态,选项B正确;C.pH>0.68时,电压大于0,反应向左进行,AsO43-为氧化产物,I2为氧化剂,氧化性 AsO43-点睛:本题考查了原电池原理的应用和化学平衡移动,侧重于知识的综合应用的考查,易错点为选项C:pH>0.68时,电压大于0,反应向左进行,AsO43-为氧化产物,I2为氧化剂,氧化性 AsO43-氧化产物。
4.C
【分析】放电时为原电池,原电池中阳离子流向正极,根据锂离子的流向可知铜箔为正极,发生还原反应,铝箔为负极,发生氧化反应,充电时为电解池,铜箔上发生氧化反应为阳极,铝箔发生还原反应为阴极,即充电时铜箔上的反应为LiFePO4–xLi+-xe-→xFePO4+(1-x)LiFePO4,据此分析解答。
【详解】A.放电时为原电池,原电池中阳离子流向正极,故A错误;
B.充电时,正极材料上发生失电子的氧化反应,电子流出,故B错误;
C.放电时的正极反应和充电时的阳极反应相反,为FePO4+xLi++xe-→xLiFePO4+(1-x)FePO4,故C正确;
D.根据阳极的反应式可知充放电的过程中Fe元素的化合价发生变化,故D错误;
综上所述答案为C。
5.A
【分析】由图可知,H+向b极移动,原电池中阳离子向正极移动,因此碳棒a失去电子,作负极,碳棒b得到电子作正极,据此分析解答问题。
【详解】A.碳棒b作正极,电极上O2得电子生成水,电极方程式为:O2+4e-+4H+=2H2O,A选项错误;
B.碳棒b,CO2在光照和光合菌的作用下反应生成氧气,光照强度对电池的输出功率有影响,B选项正确;
C.外电路电子由负极流向正极,即碳棒a→碳棒b,C选项正确;
D.电池工作一段时间后,电解质溶液酸性增强,酸性增强会使菌落失活,故工作一段时间后,电池效率降低,D选项正确;
答案选A。
6.B
【分析】由图可知,Li片作负极,电极反应式为Li-e-═Li+,MnO2作正极,电极反应式为MnO2+Li++e-═LiMnO2,据此分析解题。
【详解】A.由分析可知,Li片作负极,失电子发生氧化反应,A正确;
B.原电池工作时,电子从负极经外电路流向正极,不经过电解质,B错误;
C.Li性质活泼,能与水反应,故高氯酸锂或三氟甲基磺酸锂应溶解在非水有机溶剂中,C正确;
D.MnO2作正极,电极反应式为MnO2+Li++e-═LiMnO2,D正确;
故答案为:B。
7.D
【详解】A.放电时的正极反应为Zn0.5-xMnO2+2xe-+xZn2+=Zn0.5MnO2,故A错误;
B.放电时阴离子向负极移动,故B错误;
C.充电时,Zn电极与外接直流电源的负极相连,故C错误;
D.充电时,Zn电极上发生反应:,电路中每转移1mole-,生成0.5molZn,质量增加32.5g,故D正确;
故选D。
8.C
【分析】由题中信息可知,放电时,作原电池,M极由于Li比Ni更活泼,也比N极上的Sb、Bi、Sn更活泼,故M极作负极,电极反应为Li-e- =Li+ ,N极为正极,电极反应为3Li++3e- + Bi=Li3Bi;据此解答。
【详解】A.由上述分析可知,放电时,作原电池,N极为正极,电极反应为3Li++3e- + Bi=Li3Bi,质量增大,故A错误;
B.由上述分析可知,放电时,作原电池,M为负极,Li比Ni更活泼,则M电极反应为Li-e- =Li+ ,故B错误;
C.充电时,作电解池,M为阴极,得电子发生还原反应,阳离子移动向阴极,则Li+由N电极向M电极移动,故C正确;
D.充电时,作电解池,N为阳极,失电子发生氧化反应,N电极反应为Li3Bi-3e- =3Li++ Bi,故D错误;
答案为C。
9.B
【详解】A.该电池中甲醇做还原剂,所以a极为该电池的负极,A项正确;
B.b极的电极反应式为,B项错误;
C.放电过程中a极的电极反应式为,所以其附近pH降低,C项正确;
D.通过质子交换膜移向b极,D项正确。
故答案为:B
10.D
【详解】A.燃料电池放电过程中阳离子朝得电子的一极即正极移动,A错误;
B.放电过程中,负极燃料消耗的OH-物质的量与正极氧气得电子后与水反应生成的OH-物质的量相等,KOH的物质的量均不变,B错误;
C.N2H4—O2燃料电池消耗1mol O2时转移4mole-,根据负极反应式: ,生成的气体产物1mol,在标准状况下为22.4L,C错误;
D.mgCH3OH理论放电量为 ,mg N2H4理论放电量为,mg(CH3)2NNH2理论放电量为,(CH3)2NNH2—O2燃料电池的理论放电量最大,D正确;
故选D。
11.错误
【详解】铅蓄电池放电过程中,负极反应Pb-2e-+SO=PbSO4↓,正极反应PbO2+2e-+4H++SO=PbSO4↓+2H2O。因此,负极、正极固体质量均增大。原说法错误;
12.错误
【解析】略
13.正确
【详解】燃料电池中,参与电极反应的是燃料和氧气,电极不参与反应,其有很强的催化活性,主要起导电作用,该说法正确。
14.错误
【详解】碱性锌锰干电池是一次电池,锌易失电子作负极,MnO2作正极,正极上MnO2得电子发生还原反应,不是催化剂,错误。
15.正确
【详解】铅蓄电池工作过程中硫酸参与化学反应,且硫酸浓度减小时密度也减小,所以可根据硫酸密度的大小判断铅蓄电池是否需要充电,故答案为:正确。
16. B CH4+10OH 8e ===+7H2O 56 PbO2+2e ++4H+===PbSO4+2H2O
【分析】根据图中电子的流向,可判断B为电池的负极,反应中失电子,可知B处通入的气体为甲烷,电极A为正极,通入氧气;
【详解】(1)根据分析可知,B电极为负极,通入的气体为甲烷,电解质溶液呈碱性,则甲烷失电子与电解质溶液中的氢氧根离子反应生成碳酸根离子和水,反应式为:CH4+10OH 8e =+7H2O;
(2)总方程式为CH4+2O2+2OH =+3H2O,当消耗甲烷的体积为11.2 L(标准状况下)时,根据方程式知,消耗KOH的质量为0.5 mol×2×56 g/mol=56 g。
(3)铅蓄电池是最早使用的充电电池,由Pb、PbO2、硫酸构成。该电池工作时,正极PbO2得电子生成硫酸铅,其电极反应为:PbO2+2e ++4H+===PbSO4+2H2O。
【点睛】原电池负极失电子化合价升高,外电路电子由负极流向正极;内电路中阳离子向正极移动,阴离子向负极移动。
17. N2H4-4e-+4OH-=N2+4H2O 负极 减小 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H=-938.6 kJ· mol-1 ABD
【详解】Ⅰ.(1)根据原电池工作原理,左端为负极,在碱性电解质中失去电子生成氮气和水,电极反应为N2H4-4e-+4OH-=N2+4H2O ;电池工作时OH-向负极移动参加了反应,整个溶液的碱性减小。因此,本题正确答案是: N2H4-4e-+4OH-=N2+4H2O 负极 减小。
(2)由①N2(g)+2O2(g)=2NO2(g) △H1=-66.7kJ·mol-1;②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H2=-530.5kJ·mol-1;③2NO2(g) N2O4(g) △H3=-55.7kJ·mol-1。根据盖斯定律可以知道②2-①-③得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H=(-530.5kJ·mol-1)2-(-66.7kJ·mol-1)-( -55.7kJ·mol-1)=938.6 kJ· mol-1 。即热化学方程式为2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H=-938.6 kJ· mol-;
(3)A.在 C2H8N2 +2N2O4=2CO2↑+3N2↑+4H2O↑反应中,C2H8N2中C元素化合价由-1价升高到+4价,N元素化合价由-3价升高到0价,偏二甲肼是还原剂, N2O4中N元素化合价由+4价升高到0价,化合价降低,所以N2O4做氧化剂,所以A选项是正确的; B. 结合上述分析,每个C原子转移5个电子,每个N原子转移3个电子,所以每消耗1molC2H8N2,转移电子数目为52+32=16NA,,故B正确;C. 根据C2H8N2 +2N2O4=2CO2↑+3N2↑+4H2O↑,C元素化合价由-1价升高到+4,所以CO2是氧化产物,故C错误;D. 根据反应方程式知N2既是C2H8N2中的氮元素被氧化的产物,也是N2O4被还原的产物,所以D正确;答案:ABD。
18. Cu2++2e-=Cu 乙 O2 CH4-8e-+10OH-=CO+7H2O 0.28 BD
【详解】(1)原电池负极失电子,化合价升高,正极得电子,化合价降低,反应中锌元素化合价升高、锌电极为负极,铜元素化合价降低、铜电极为正极,因此铜电极的正极反应式为:Cu2++2e-=Cu;负极失电子、正极得电子,因此阳离子向正极移动、阴离子向负极移动,则电池工作时,钾离子向乙极移动。
(2)电镀时,镀件铁作电解池的阴极,连接甲烷燃料电源的负极,镀层金属铜作阳极,连接甲烷燃料电池的正极,而燃料电池中,燃料失电子作负极,氧气得电子作正极,所以b应通入O2;甲烷失电子生成二氧化碳,二氧化碳又和氢氧根离子结合生成碳酸根离子,因此a处电极上发生的电极反应式是:CH4-8e-+10OH-=CO+7H2O;阳极电极反应式为:Cu-2e-=Cu2+,当铜电极的质量减轻3.2g即0.05mol时,转移电子0.1mol,根据得失电子守恒,燃料电池也转移0.1mol电子,此时消耗甲烷0.1mol=mol,所以标准状况下消耗甲烷的体积为: mol×22.4L/mol=0.28L。
(3)A.碳酸钾溶液中存在电荷守恒:c(K+)+c(H+)=c(HCO)+2c(CO)+c(OH-),A错误;
B.碳酸钾溶液中存在电荷守恒:c(K+)+c(H+)=c(HCO)+2c(CO)+c(OH-),物料守恒:c(K+)=2c(HCO)+2c(CO)+2c(H2CO3),两式相减得:c(OH-)=c(H+)+c(HCO)+2c(H2CO3),B正确;
C.碳酸钾为强碱弱酸盐,水溶液显碱性,则c(OH-)>c(H+),C错误;
D.碳酸钾完全电离生成钾离子和碳酸根离子,碳酸根离子水解生成碳酸氢根离子和氢氧根离子,水电离生成氢离子和氢氧根离子,因此有:c(K+)>c(CO)>c(OH-)>c(HCO),D正确;
E.碳酸钾溶液中存在物料守:c(K+)=2c(HCO)+2c(CO)+2c(H2CO3),E错误;
答案选BD。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
化学电源
共18题,满分100分
题号 一 二 三 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请注意保持试卷整洁
一、单选题(共50分)
1.(本题5分)以Na3Ti2(PO4)3为负极材料的新型可充电钠离子电池的工作原理如图。下列说法错误的是
A.放电时,正极反应式为Fe[Fe(CN)6]+2Na++2e-=Na2Fe[Fe(CN)6]
B.充电时,a端接电源正极
C.充电时,每生成1molFe[Fe(CN)6]消耗2molNaTi2(PO4)3
D.充电时,Na+通过离子交换膜从左室移向右室
2.(本题5分)—种以Na2SO4为电解质的钠离子电池的总反应如下,下列有关说法正确的是
NaTi2(PO4)3+Zn+Na2SO4Na3Ti2(PO4)3+ZnSO4
A.放电时,NaTi2(PO4)3发生氧化反应 B.放电时,Na+向锌电极移动
C.充电时,阳极反应式为[Ti2(PO4)3]-+2e-[Ti2(PO4)3]3- D.充电时,每转移0.2mol电子,理论上阴极增重6.5g
3.(本题5分)某实验小组依据反应AsO43-+2H++2I- AsO33-+I2+H2O设计左下图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如右下图,下列有关叙述错误的是
A.pH>0.68时,甲烧杯中石墨为负极
B.pH=0.68时,反应处于平衡状态
C.pH>0.68时,氧化性I2>AsO43-
D.pH=5时,负极电极反应式为2I--2e-=I2
4.(本题5分)2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家。磷酸铁锂锂离子电池充电时阳极反应式为:LiFePO4–xLi+-xe-→xFePO4+(1-x)LiFePO4。放电工作示意图如图。下列叙述正确的是( )
A.放电时,Li+通过隔膜移向负极
B.充电时,电子从电源经铜箔流入正极材料
C.放电时正极反应为:FePO4+xLi++xe-→xLiFePO4+(1-x)FePO4
D.磷酸铁锂锂离子电池充放电过程通过Li+迁移实现,C、Fe、P元素化合价均不发生变化
5.(本题5分)沉积物微生物燃料电池可处理含硫废水,其工作原理如图所示。下列说法错误的是( )
A.碳棒b的电极反应式为:O2+4e-+2H2O=4OH-
B.光照强度对电池的输出功率有影响
C.外电路的电子方向:碳棒a→碳棒b
D.酸性增强不利于菌落存活,故工作一段时间后,电池效率降低
6.(本题5分)如图所示的锂-二氧化锰电池是以高氯酸锂或三氟甲基磺酸锂为电解质,其正极反应是一种典型的嵌入式反应,电池总反应为。下列说法不正确的是
A.锂片做负极,发生氧化反应
B.放电时,电子移动方向为:电极盖1→用电器→电极盖2→内电路→电极盖1
C.高氯酸锂或三氟甲基磺酸锂应溶解在非水有机溶剂中
D.放电时,正极反应为:
7.(本题5分)一种锌—水溶液二次电池放电时的工作原理如下图所示。下列说法正确的是
A.放电时的正极反应为Zn0.5-xMnO2-2xe-+xZn2+=Zn0.5MnO2
B.放电时CF3SO移向电源的正极
C.充电时,Zn电极与外接直流电源的正极相连
D.充电时,电路中每转移1mole-,Zn电极质量增加32.5g
8.(本题5分)如图,某液态金属储能电池放电时产生金属化合物Li3Bi,下列说法正确的是
A.放电时,N电极的质量减小
B.放电时,M电极反应为: Ni-2e-= Ni2+
C.充电时,Li+由N电极向M电极移动
D.充电时,N电极反应为: Li3Bi+3e- =3Li++ Bi
9.(本题5分)微生物电池具有高效、清洁、环保等优点。某微生物电池工作原理如图所示,下列说法错误的是
A.a极为该电池的负极
B.b极的电极反应式为
C.放电过程中a极附近pH降低
D.当外电路通过时,理论上溶液中会有通过质子交换膜移向b极
10.(本题5分)以KOH溶液为离子导体,分别组成CH3OH—O2、N2H4—O2、(CH3)2NNH2—O2清洁燃料电池,下列说法正确的是
A.放电过程中,K+均向负极移动
B.放电过程中,KOH的物质的量均减小
C.消耗1mol O2时,理论上N2H4—O2燃料电池气体产物的体积在标准状况下为11.2L
D.消耗等质量燃料,(CH3)2NNH2—O2燃料电池的理论放电量最大
二、判断题(共20分)
11.(本题4分)铅蓄电池在放电过程中,负极质量减小,正极质量增加。
12.(本题4分)充电电池可以无限制地反复充电、放电。(__)
13.(本题4分)燃料电池的电极不参与反应,有很强的催化活性,起导电作用。(_____)
14.(本题4分)碱性锌锰干电池是一次电池,其中MnO2是催化剂,可使锌锰干电池的比能量高、可储存时间长。(_______)
15.(本题4分)我们可以根据硫酸密度的大小来判断铅酸蓄电池是否需要充电。(______)
三、解答题(共30分)
16.(本题10分)如图所示为CH4燃料电池的装置(A、B为多孔碳棒):
(1) (填A或B)处电极入口通甲烷,其电极反应式为 。
(2)当消耗甲烷的体积为11.2 L(标准状况下)时,消耗KOH的质量为 g。
(3)铅蓄电池是最早使用的充电电池,由Pb、PbO2、硫酸构成。该电池工作时,正极的电极反应式为 。
17.(本题10分)肼( N2H4)和偏二甲肼(C2H8N2 )常用于火箭推进剂和燃料电池,NO2的二聚体N2O4 则是火箭中常用氧化剂。回答下列问题:
(1)肼燃料电池原理如图所示,左边电极上发生的电极反应式为 ;电池工作时OH-向 移动(填“负极”或“正极”),整个溶液的碱性 (填“减小”或“增大”)。
(2)火箭常用 N2O4 作氧化剂,肼作燃料,已知:
①N2(g)+2O2(g)=2NO2(g) △H1=-66.7kJ·mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H2=-530.5kJ·mol-1
③2NO2(g) N2O4(g) △H3=-55.7kJ·mol-1
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式: 。
(3)“长征二号”火箭所用的燃料是偏二甲肼(C2H8N2)(其中N的化合价为-3)和四氧化二氮(N2O4)。在火箭升空过程中燃料发生反应 C2H8N2 +2N2O4=2CO2↑+3N2↑+4H2O↑。下列有关叙述正确的是
A.该反应中N2O4是氧化剂,偏二甲肼是还原剂 B.每消耗1molC2H8N2,转移电子数目为16NA
C. CO2既不是氧化产物也不是还原产物 D.N2既是氧化产物又是还原产物
18.(本题10分)CuSO4溶液是中学化学及工农业生产中常见的一种试剂。某同学利用CuSO4溶液,进行以下实验探究。
(1)图一是根据反应Zn+CuSO4==Cu+ZnSO4设计成的锌铜原电池。Cu极的电极反应式是 ,盐桥中是含有琼胶的KCl饱和溶液,电池工作时K+向 移动(填“甲”或“乙”)。
(2)图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是 (填“CH4”或“O2”),a处电极上发生的电极反应式是 ;当铜电极的质量减轻3.2g,则消耗的CH4在标准状况下的体积为 L。
(3)一段时间后,燃料电池的电解质溶液完全转化为K2CO3,以下关系正确的是 。
A.c(K+)+c(H+)=c(HCO)+c(CO)+c(OH-)
B.c(OH-)=c(H+)+c(HCO)+2c(H2CO3)
C.c(K+)>c(CO)>c(H+)>c(OH-)
D.c(K+)>c(CO)>c(OH-)>c(HCO)
E.c(K+)=2c(CO)+c(HCO)+c(H2CO3)
参考答案:
1.C
【分析】Na3Ti2(PO4)3为负极材料,所以放电时Na3Ti2(PO4)3被氧化为NaTi2(PO4)3,Mo箔为正极,Fe[Fe(CN)6]被还原为Na2Fe[Fe(CN)6]。
【详解】A.放电时,Mo箔为正极,Fe[Fe(CN)6]被还原为Na2Fe[Fe(CN)6],电极反应为Fe[Fe(CN)6]+2Na++2e-=Na2Fe[Fe(CN)6],A正确;
B.放电时Mo箔为正极,则充电时Mo箔为阳极,a端连接电源正极,B正确;
C.充电时右侧为阴极,电极反应为NaTi2(PO4)3+2e-+2Na+= Na3Ti2(PO4)3,阳极反应为Na2Fe[Fe(CN)6]-2e-=Fe[Fe(CN)6]+2Na+,根据电极反应可知每生成1molFe[Fe(CN)6]转移2mol电子,消耗1molNaTi2(PO4)3,C错误;
D.充电时为电解池,电解池中阳离子由阳极流向阴极,即Na+通过离子交换膜从左室移向右室,D正确;
综上所述答案为C。
2.D
【详解】A.根据原电池的工作原理,正极上发生还原反应,化合价降低,负极上发生氧化反应,化合价升高,根据电池总反应,锌的化合价升高,因此锌为负极,发生氧化反应,NaTi2(PO4)3中Ti的化合价由+4价→+3价,化合价降低,因此NaTi2(PO4)3发生还原反应,故A错误;
B.根据原电池工作原理,Na+向正极移动,故B错误;
C.充电时,电池的正极接电源的正极,电池的负极接电源的负极,电池正极反应式为[Ti2(PO4)3]-+2e-=[Ti2(PO4)3]2-,充电时阳极反应式为[Ti2(PO4)3]2--2e-=[Ti2(PO4)3]-,故C错误;
D.充电时阴极反应式为Zn2++2e-=Zn,每转移0.2mol电子,阴极增重6.5g,故D正确;
故选D。
3.D
【详解】A.pH>0.68时,电压小于0,反应向左进行,AsO33-失电子,甲烧杯中石墨为负极,选项A正确;B.pH=0.68时,电压为0,反应处于平衡状态,选项B正确;C.pH>0.68时,电压大于0,反应向左进行,AsO43-为氧化产物,I2为氧化剂,氧化性 AsO43-
4.C
【分析】放电时为原电池,原电池中阳离子流向正极,根据锂离子的流向可知铜箔为正极,发生还原反应,铝箔为负极,发生氧化反应,充电时为电解池,铜箔上发生氧化反应为阳极,铝箔发生还原反应为阴极,即充电时铜箔上的反应为LiFePO4–xLi+-xe-→xFePO4+(1-x)LiFePO4,据此分析解答。
【详解】A.放电时为原电池,原电池中阳离子流向正极,故A错误;
B.充电时,正极材料上发生失电子的氧化反应,电子流出,故B错误;
C.放电时的正极反应和充电时的阳极反应相反,为FePO4+xLi++xe-→xLiFePO4+(1-x)FePO4,故C正确;
D.根据阳极的反应式可知充放电的过程中Fe元素的化合价发生变化,故D错误;
综上所述答案为C。
5.A
【分析】由图可知,H+向b极移动,原电池中阳离子向正极移动,因此碳棒a失去电子,作负极,碳棒b得到电子作正极,据此分析解答问题。
【详解】A.碳棒b作正极,电极上O2得电子生成水,电极方程式为:O2+4e-+4H+=2H2O,A选项错误;
B.碳棒b,CO2在光照和光合菌的作用下反应生成氧气,光照强度对电池的输出功率有影响,B选项正确;
C.外电路电子由负极流向正极,即碳棒a→碳棒b,C选项正确;
D.电池工作一段时间后,电解质溶液酸性增强,酸性增强会使菌落失活,故工作一段时间后,电池效率降低,D选项正确;
答案选A。
6.B
【分析】由图可知,Li片作负极,电极反应式为Li-e-═Li+,MnO2作正极,电极反应式为MnO2+Li++e-═LiMnO2,据此分析解题。
【详解】A.由分析可知,Li片作负极,失电子发生氧化反应,A正确;
B.原电池工作时,电子从负极经外电路流向正极,不经过电解质,B错误;
C.Li性质活泼,能与水反应,故高氯酸锂或三氟甲基磺酸锂应溶解在非水有机溶剂中,C正确;
D.MnO2作正极,电极反应式为MnO2+Li++e-═LiMnO2,D正确;
故答案为:B。
7.D
【详解】A.放电时的正极反应为Zn0.5-xMnO2+2xe-+xZn2+=Zn0.5MnO2,故A错误;
B.放电时阴离子向负极移动,故B错误;
C.充电时,Zn电极与外接直流电源的负极相连,故C错误;
D.充电时,Zn电极上发生反应:,电路中每转移1mole-,生成0.5molZn,质量增加32.5g,故D正确;
故选D。
8.C
【分析】由题中信息可知,放电时,作原电池,M极由于Li比Ni更活泼,也比N极上的Sb、Bi、Sn更活泼,故M极作负极,电极反应为Li-e- =Li+ ,N极为正极,电极反应为3Li++3e- + Bi=Li3Bi;据此解答。
【详解】A.由上述分析可知,放电时,作原电池,N极为正极,电极反应为3Li++3e- + Bi=Li3Bi,质量增大,故A错误;
B.由上述分析可知,放电时,作原电池,M为负极,Li比Ni更活泼,则M电极反应为Li-e- =Li+ ,故B错误;
C.充电时,作电解池,M为阴极,得电子发生还原反应,阳离子移动向阴极,则Li+由N电极向M电极移动,故C正确;
D.充电时,作电解池,N为阳极,失电子发生氧化反应,N电极反应为Li3Bi-3e- =3Li++ Bi,故D错误;
答案为C。
9.B
【详解】A.该电池中甲醇做还原剂,所以a极为该电池的负极,A项正确;
B.b极的电极反应式为,B项错误;
C.放电过程中a极的电极反应式为,所以其附近pH降低,C项正确;
D.通过质子交换膜移向b极,D项正确。
故答案为:B
10.D
【详解】A.燃料电池放电过程中阳离子朝得电子的一极即正极移动,A错误;
B.放电过程中,负极燃料消耗的OH-物质的量与正极氧气得电子后与水反应生成的OH-物质的量相等,KOH的物质的量均不变,B错误;
C.N2H4—O2燃料电池消耗1mol O2时转移4mole-,根据负极反应式: ,生成的气体产物1mol,在标准状况下为22.4L,C错误;
D.mgCH3OH理论放电量为 ,mg N2H4理论放电量为,mg(CH3)2NNH2理论放电量为,(CH3)2NNH2—O2燃料电池的理论放电量最大,D正确;
故选D。
11.错误
【详解】铅蓄电池放电过程中,负极反应Pb-2e-+SO=PbSO4↓,正极反应PbO2+2e-+4H++SO=PbSO4↓+2H2O。因此,负极、正极固体质量均增大。原说法错误;
12.错误
【解析】略
13.正确
【详解】燃料电池中,参与电极反应的是燃料和氧气,电极不参与反应,其有很强的催化活性,主要起导电作用,该说法正确。
14.错误
【详解】碱性锌锰干电池是一次电池,锌易失电子作负极,MnO2作正极,正极上MnO2得电子发生还原反应,不是催化剂,错误。
15.正确
【详解】铅蓄电池工作过程中硫酸参与化学反应,且硫酸浓度减小时密度也减小,所以可根据硫酸密度的大小判断铅蓄电池是否需要充电,故答案为:正确。
16. B CH4+10OH 8e ===+7H2O 56 PbO2+2e ++4H+===PbSO4+2H2O
【分析】根据图中电子的流向,可判断B为电池的负极,反应中失电子,可知B处通入的气体为甲烷,电极A为正极,通入氧气;
【详解】(1)根据分析可知,B电极为负极,通入的气体为甲烷,电解质溶液呈碱性,则甲烷失电子与电解质溶液中的氢氧根离子反应生成碳酸根离子和水,反应式为:CH4+10OH 8e =+7H2O;
(2)总方程式为CH4+2O2+2OH =+3H2O,当消耗甲烷的体积为11.2 L(标准状况下)时,根据方程式知,消耗KOH的质量为0.5 mol×2×56 g/mol=56 g。
(3)铅蓄电池是最早使用的充电电池,由Pb、PbO2、硫酸构成。该电池工作时,正极PbO2得电子生成硫酸铅,其电极反应为:PbO2+2e ++4H+===PbSO4+2H2O。
【点睛】原电池负极失电子化合价升高,外电路电子由负极流向正极;内电路中阳离子向正极移动,阴离子向负极移动。
17. N2H4-4e-+4OH-=N2+4H2O 负极 减小 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H=-938.6 kJ· mol-1 ABD
【详解】Ⅰ.(1)根据原电池工作原理,左端为负极,在碱性电解质中失去电子生成氮气和水,电极反应为N2H4-4e-+4OH-=N2+4H2O ;电池工作时OH-向负极移动参加了反应,整个溶液的碱性减小。因此,本题正确答案是: N2H4-4e-+4OH-=N2+4H2O 负极 减小。
(2)由①N2(g)+2O2(g)=2NO2(g) △H1=-66.7kJ·mol-1;②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H2=-530.5kJ·mol-1;③2NO2(g) N2O4(g) △H3=-55.7kJ·mol-1。根据盖斯定律可以知道②2-①-③得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H=(-530.5kJ·mol-1)2-(-66.7kJ·mol-1)-( -55.7kJ·mol-1)=938.6 kJ· mol-1 。即热化学方程式为2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H=-938.6 kJ· mol-;
(3)A.在 C2H8N2 +2N2O4=2CO2↑+3N2↑+4H2O↑反应中,C2H8N2中C元素化合价由-1价升高到+4价,N元素化合价由-3价升高到0价,偏二甲肼是还原剂, N2O4中N元素化合价由+4价升高到0价,化合价降低,所以N2O4做氧化剂,所以A选项是正确的; B. 结合上述分析,每个C原子转移5个电子,每个N原子转移3个电子,所以每消耗1molC2H8N2,转移电子数目为52+32=16NA,,故B正确;C. 根据C2H8N2 +2N2O4=2CO2↑+3N2↑+4H2O↑,C元素化合价由-1价升高到+4,所以CO2是氧化产物,故C错误;D. 根据反应方程式知N2既是C2H8N2中的氮元素被氧化的产物,也是N2O4被还原的产物,所以D正确;答案:ABD。
18. Cu2++2e-=Cu 乙 O2 CH4-8e-+10OH-=CO+7H2O 0.28 BD
【详解】(1)原电池负极失电子,化合价升高,正极得电子,化合价降低,反应中锌元素化合价升高、锌电极为负极,铜元素化合价降低、铜电极为正极,因此铜电极的正极反应式为:Cu2++2e-=Cu;负极失电子、正极得电子,因此阳离子向正极移动、阴离子向负极移动,则电池工作时,钾离子向乙极移动。
(2)电镀时,镀件铁作电解池的阴极,连接甲烷燃料电源的负极,镀层金属铜作阳极,连接甲烷燃料电池的正极,而燃料电池中,燃料失电子作负极,氧气得电子作正极,所以b应通入O2;甲烷失电子生成二氧化碳,二氧化碳又和氢氧根离子结合生成碳酸根离子,因此a处电极上发生的电极反应式是:CH4-8e-+10OH-=CO+7H2O;阳极电极反应式为:Cu-2e-=Cu2+,当铜电极的质量减轻3.2g即0.05mol时,转移电子0.1mol,根据得失电子守恒,燃料电池也转移0.1mol电子,此时消耗甲烷0.1mol=mol,所以标准状况下消耗甲烷的体积为: mol×22.4L/mol=0.28L。
(3)A.碳酸钾溶液中存在电荷守恒:c(K+)+c(H+)=c(HCO)+2c(CO)+c(OH-),A错误;
B.碳酸钾溶液中存在电荷守恒:c(K+)+c(H+)=c(HCO)+2c(CO)+c(OH-),物料守恒:c(K+)=2c(HCO)+2c(CO)+2c(H2CO3),两式相减得:c(OH-)=c(H+)+c(HCO)+2c(H2CO3),B正确;
C.碳酸钾为强碱弱酸盐,水溶液显碱性,则c(OH-)>c(H+),C错误;
D.碳酸钾完全电离生成钾离子和碳酸根离子,碳酸根离子水解生成碳酸氢根离子和氢氧根离子,水电离生成氢离子和氢氧根离子,因此有:c(K+)>c(CO)>c(OH-)>c(HCO),D正确;
E.碳酸钾溶液中存在物料守:c(K+)=2c(HCO)+2c(CO)+2c(H2CO3),E错误;
答案选BD。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
