化学反应热的计算-高考化学考前专项练习试题(含解析)
文档属性
| 名称 | 化学反应热的计算-高考化学考前专项练习试题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 833.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-13 12:09:02 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
化学反应热的计算
共18题,满分100分
题号 一 二 三 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请注意保持试卷整洁
一、单选题(共50分)
1.(本题5分)与反应的能量变化如图所示(各粒子均处于基态,单位为),则下列说法不正确的是
A.的第一电离能
B.键能为
C.,
D.
2.(本题5分)下列说法错误的有
①化学反应除了生成新物质外,还伴随着能量的变化
②需要加热才能发生的反应都是吸热反应
③热化学方程式应注明反应时的温度与压强,若没注明则表示常温、常压时的反应
④等量的氢气和氧气分别完全燃烧生成气态水和液态水,前者放出的热量多
⑤H2(g)+I2(g)2HI(g) ΔH=-QkJ·mol-1,表示常温常压下,在恒温密闭容器中当有1molH2和1mol I2(g)反应生成2molHI时放出QkJ的热量
⑥同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照条件下和点燃条件下的ΔH相同
A.1项 B.2项 C.3项 D.5项
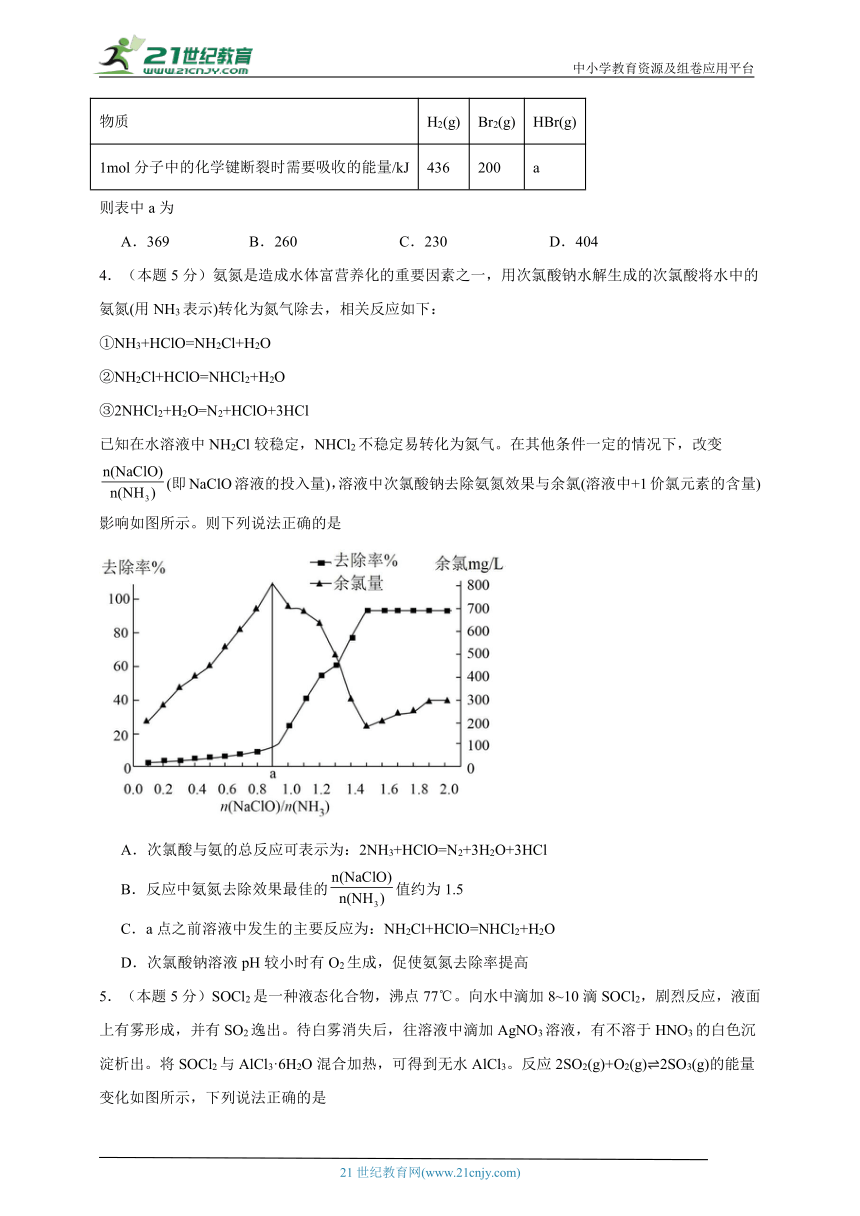
3.(本题5分)已知H2(g)+Br2(g)=2HBr(g) ΔH=-102kJ·mol-1,其他相关数据如下表:
物质 H2(g) Br2(g) HBr(g)
1mol分子中的化学键断裂时需要吸收的能量/kJ 436 200 a
则表中a为
A.369 B.260 C.230 D.404
4.(本题5分)氨氮是造成水体富营养化的重要因素之一,用次氯酸钠水解生成的次氯酸将水中的氨氮(用NH3表示)转化为氮气除去,相关反应如下:
①NH3+HClO=NH2Cl+H2O
②NH2Cl+HClO=NHCl2+H2O
③2NHCl2+H2O=N2+HClO+3HCl
已知在水溶液中NH2Cl较稳定,NHCl2不稳定易转化为氮气。在其他条件一定的情况下,改变(即NaClO溶液的投入量),溶液中次氯酸钠去除氨氮效果与余氯(溶液中+1价氯元素的含量)影响如图所示。则下列说法正确的是
A.次氯酸与氨的总反应可表示为:2NH3+HClO=N2+3H2O+3HCl
B.反应中氨氮去除效果最佳的值约为1.5
C.a点之前溶液中发生的主要反应为:NH2Cl+HClO=NHCl2+H2O
D.次氯酸钠溶液pH较小时有O2生成,促使氨氮去除率提高
5.(本题5分)SOCl2是一种液态化合物,沸点77℃。向水中滴加8~10滴SOCl2,剧烈反应,液面上有雾形成,并有SO2逸出。待白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色沉淀析出。将SOCl2与AlCl3·6H2O混合加热,可得到无水AlCl3。反应2SO2(g)+O2(g) 2SO3(g)的能量变化如图所示,下列说法正确的是
A.SO2的键角小于SO3的键角
B.2SO2(g)+O2(g) 2SO3(l) △H=(x-y) kJ·mol-1
C.反应达到限度时,增大容器容积能增大正反应速率
D.每转移电子4mol,有22.4L的O2被还原
6.(本题5分)甲醇可通过氢化法合成:。恒定温度为时,将和充入密闭容器中,测得按I变化。下列说法不正确的是
A.时,I中反应进行到B点时释放的热量为
B.时,该反应平衡常数为
C.若其他条件不变,增大起始,所得可能按Ⅱ变化
D.若其他条件不变,缩小容器体积,所得可能按Ⅱ无变化
7.(本题5分)下列有关叙述正确的是
A.已知2H2(g)+O2(g) = 2H2O(g) △H = —483.6kJ/mol,则氢气的燃烧热为241.8 kJ/mol
B.已知C(石墨,s) = C(金刚石,s) △H>0,则金刚石比石墨稳定
C.已知2C(s) +2O2(g) = 2CO2(g) △H1; 2C(s) + O2(g) = 2CO(g) △H2;,则△H1>△H2
D.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热方程式为NaOH(aq) + HCl(aq) = NaCl(aq) +H2O(l) △H=一57.4kJ/mol
8.(本题5分)已知NaHCO3溶液与盐酸反应生成CO2吸热,Na2CO3溶液与盐酸反应生成CO2放热。关于下列ΔH的判断正确的是
①CO(aq)+H+(aq) HCO(aq) ΔH1
②HCO(aq)+H+(aq) H2CO3(aq) ΔH2
③H2CO3(aq) H2O(l)+CO2(g) ΔH3
A.ΔH1<0;ΔH2>0 B.ΔH2+ΔH3>0
C.ΔH1+ΔH2+ΔH3>0 D.ΔH1>ΔH3
9.(本题5分)把温度为20℃,浓度为1.0mol/L的硫酸溶液和2.2mol/L的碱液各50mL混合,搅动,测得酸碱混合物的温度变化数据如下(溶液密度为1g/mL,比热容为4.184kJ/(kg·℃))
反应物 起始温度T1/℃ 终止温度T2/℃
H2SO4+NaOH 20 33.6
H2SO4+NH3·H2O 20 32.6
则NH3+H2ONH3·H2O的 H为
A.+4.2kJ B.+2.1kJ C.-2.1kJ D.-4.2kJ
10.(本题5分)下列热化学方程式正确的是
A.甲烷的燃烧热=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) =-890.3kJ/mol
B.500℃、30MPa下,将0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)2NH3(g) =-38.6kJ/mol
C.HCl和NaOH反应的中和热=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(-57.3)kJ/mol
D.已知C(s)+O2(g)=CO2(g) =a,C(s)+O2(g)=CO(g) =b,则a<b
二、判断题(共20分)
11.(本题4分)比较ΔH大小,只需比较数值,不用考虑正负号。
12.(本题4分)反应的可通过下式估算:反应中形成新共价键的键能之和-反应中断裂旧共价键的键能之和。(_______)
13.(本题4分)已知N2(g)+3H2(g)=2NH3(g) ΔH=-92 kJ·mol-1,则NH3(g)=N2(g)+H2(g) ΔH=+46 kJ·mol-1。(________)
14.(本题4分)已知 ,,则。(___________)
15.(本题4分)当反应逆向进行时,其反应热与正反应热的反应热数值相等,符号相反。
三、解答题(共30分)
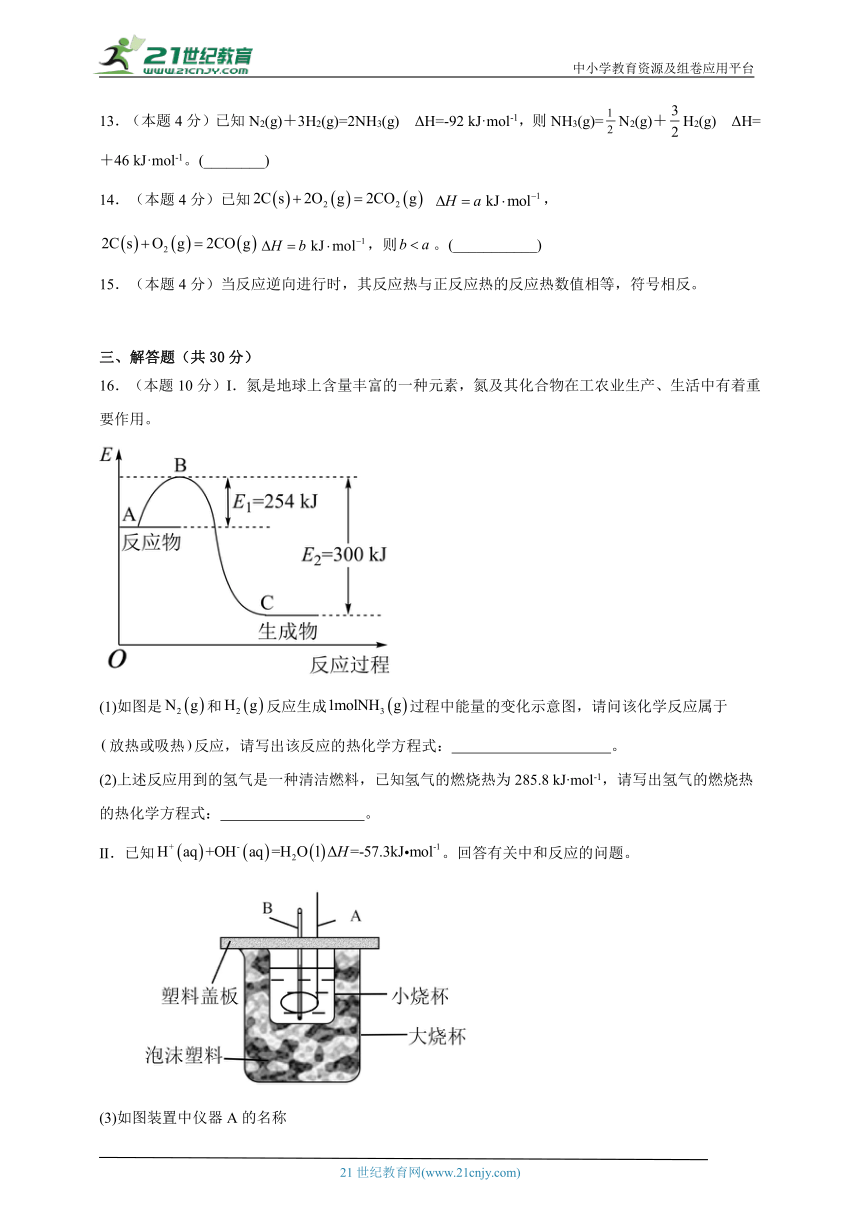
16.(本题10分)I.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)如图是和反应生成过程中能量的变化示意图,请问该化学反应属于 放热或吸热反应,请写出该反应的热化学方程式: 。
(2)上述反应用到的氢气是一种清洁燃料,已知氢气的燃烧热为285.8 kJ mol-1,请写出氢气的燃烧热的热化学方程式: 。
II.已知。回答有关中和反应的问题。
(3)如图装置中仪器A的名称
(4)碎泡沫塑料的作用是
17.(本题10分)中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 ,烧杯间填满碎塑料泡沫的作用是 。
(2)大烧杯上如不盖硬纸板,则求得的中和热数值 (填“偏大”、“偏小”、“无影响”)
(3)实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,
与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热的数值会 (填“相等”或“不相等”),理由是 。
18.(本题10分)测定50mL0.50mol L-1盐酸和50mL0.55mol L-1NaOH溶液反应的反应热的实验装置如图所示。回答下列问题:
(1)图中缺少的一种仪器是 。
(2)实验时玻璃搅拌器的运动方向是 (填标号)。
a.上下 b.左右 c.顺时针 d.逆时针
(3)假设盐酸和氢氧化钠溶液的密度都是1g cm-3,又知中和反应后生成的溶液的比热容c=4.18J/(g ℃)。实验记录数据如表:
实验序号 起始温度t1/℃ 终止温度t1/℃
盐酸 氢氧化钠溶液 混合溶液
1 20.0 20.1 23.2
2 20.2 20.4 23.4
3 20.5 20.6 23.6
则中和反应生成1molH2O(l)的△H= kJ mol-1(保留1位小数)。若计算结果与理论数据(57.3kJ mol-1)相比较,有误差,则可能导致该误差的原因是 (填标号)。
a.实验装置保温、隔热效果差
b.用量筒量取盐酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定盐酸的起始温度后直接去测定NaOH溶液的温度
(4)现将一定量的稀氢氧化钾溶液、稀氢氧化钙溶液、稀氨水分别和1L1mol L-1稀盐酸恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2、△H3的大小关系为 。
(5)下列说法正确的是 (填标号)。
a.向内筒中加入稀碱时,应当缓慢而匀速地加入
b.将用量筒量取好的稀盐酸加入内筒后,应当快速用水冲洗量筒内壁剩余的稀盐酸至内筒中,以免造成测量误差
c.用量筒量取稀酸或碱时,眼睛必须与液体凹面最低处相平
d.内筒洗净后,未及时烘干,直接用该内筒进行实验,对生成1molH2O时所测得的中和反应的反应热(△H)无影响
参考答案:
1.A
【详解】A.由图可知,(g)失去1个电子生成Na+,的第一电离能,故A错误;
B.由图可知,Cl2(g)断键生成Cl(g)吸收的能量为,键能为,故B正确;
C.(g)失去1个电子生成Na+(g)需要吸收能量,,Na+(g)和Cl-(g)形成离子键得到NaCl要放出热量,,故C正确;
D.由盖斯定律可知,结合图中历程,,则,故D正确;
故选A。
2.B
【详解】①化学反应除了生成新物质外,还伴随着能量的变化,正确;
②需要加热才能发生的反应不一定都是吸热反应,例如木炭燃烧等,错误;
③热化学方程式应注明反应时的温度与压强,若没注明则表示常温、常压时的反应,正确;
④等量的氢气和氧气分别完全燃烧生成气态水和液态水,前者放出的热量少,错误;
⑤H2(g)+I2(g) 2HI(g) ΔH=-QkJ·mol-1,表示常温、常压下,在恒温密闭容器中当有1molH2和1mol I2(g)反应,生成2molHI时放出QkJ的热量,正确;
⑥反应热与反应条件没有关系,同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照条件下和点燃条件下的ΔH相同,正确;
答案选B。
3.A
【详解】已知H2(g)+Br2(g)=2HBr(g) ΔH=-102 kJ mol-1,反应热等于反应物的总键能减生成物的总键能,则△H=-102 kJ mol-1 =436 kJ mol-1+200 kJ mol-1 2×a kJ mol-1,得:a =369,答案选A。
4.B
【详解】反应反应反应,依据化学方程式和盖斯定律,得到化学方程式,选项A错误;
B.反应中氨氮去除效果最佳的值,从图象分析可知为去除率较高同时余氯量最少,图象中符合的比值为,选项B正确;
点时,说明少,则次氯酸钠水解生成的次氯酸也是少量的,因此,发生的主要反应为,而不是,选项C错误;
D.次氯酸钠溶液pH较小时有生成,由于次氯酸减少,所以使得氨氮去除率降低,选项D错误。
答案选B。
5.A
【详解】A.SO2中S原子采用sp2杂化,有1个孤电子对;SO3中S原子采用sp2杂化,无个孤电子对,所以SO2的键角小于SO3的键角,故A正确;
B.根据图示,2SO2(g)+O2(g) 2SO3(g) △H=(x-y) kJ·mol-1,故B错误;
C.反应达到限度时,增大容器容积,浓度减小,正逆反应速率均减小,故C错误;
D.每转移电子4mol,有1molO2被还原,非标准状况下的体积不一定是22.4L,故D错误;
选A。
6.C
【详解】A.由图像可知,I中反应进行到B点时,为3mol/L,则为3mol,起始H2为12mol,则转化的H2为9mol,故释放的热量为,A正确;
B.由图像可知,I中反应进行到C点时,反应达平衡,为2mol/L,列三段式为,则,B正确;
C.若其他条件不变,增大起始,则在相同时间时,大于Ⅰ中的,故不能按照Ⅱ变化,C错误;
D.若其他条件不变,缩小容器体积,体系压强增大,则化学反应速率加快,平衡向正反应方向移动,达平衡时减小,故可能按照Ⅱ变化,D正确;
答案选C。
7.D
【详解】A项,H2完全燃烧后生成的稳定氧化物为H2O(l),氢气的燃烧热大于241.8kJ/mol,错误;B项,石墨转化为金刚石为吸热反应,石墨具有的总能量小于金刚石具有的总能量,则石墨比金刚石稳定,错误;C项,两者都是C(s)的燃烧反应,ΔH10、ΔH20,前者为2molC(s)完全燃烧,后者为2molC(s)不完全燃烧,等物质的量的C(s)完全燃烧放出的热量大于不完全燃烧放出的热量,则ΔH1ΔH2,错误;D项,n(H2O)=n(NaOH)==0.5mol,则生成1molH2O放出的热量为=57.4kJ,则中和热的热化学方程式为NaOH(aq)+ HCl(aq)=NaCl(aq)+H2O(l) △H=一57.4kJ/mol,正确;答案选D。
8.B
【详解】A.CO(aq)+H+(aq) HCO(aq)形成化学键放热,ΔH1<0;HCO(aq)+H+(aq) H2CO3(aq)形成化学键放热,ΔH2<0,故A错误;
B.NaHCO3溶液与盐酸反应生成CO2吸热,根据盖斯定律ΔH2+ΔH3>0,故B正确;
C.Na2CO3溶液与盐酸反应生成CO2放热,根据盖斯定律ΔH1+ΔH2+ΔH3<0,故C错误;
D.分解反应吸热,H2CO3(aq) H2O(l)+CO2(g)ΔH3>0;CO(aq)+H+(aq) HCO(aq) 形成化学键放热ΔH1<0,所以ΔH1<ΔH3,故D错误;
选B。
9.D
【详解】根据反应焓变的计算公式可知,H2SO4与NaOH反应①2H+(aq) +20H-(aq)=2H20(l)的焓变为:,
H2SO4与NH3·H2O的反应:②2H+(aq)+2NH3·H2O(aq)=2NH(aq)+2H20(l)的焓变为,可得NH3·H2ONH(aq)+0H-(aq) H=+4.2,则NH(aq)+0H-(aq) NH3+H2ONH3·H2O H=-4.2,故答案为:D
10.D
【详解】A.由甲烷的燃烧热H= 890.3 kJ mol 1,燃烧热表示可燃物完全燃烧生成稳定的氧化物,产物水为液体水,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(l) H= 890.3 kJ mol 1,A项错误;
B.将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,合成氨为可逆反应,0.5 mol N2不能完全反应生成,则1molN2(g)充分反应生成NH3(g)放热大于38.6kJ,放热反应的焓变为负值,则N2(g)+3H2(g) 2NH3(g) △H< 38.6 kJ mol 1,B项错误;
C.中和热是一个定值,指常温下1molH+和1molOH-反应生成1molH2O放出的热量,不同的酸和碱反应会有不同的反应热,其值与中和热未必一致,C项错误;
D.完全燃烧比不完全燃烧放出热量多,燃烧反应的焓变为负值,由2C(s)+2O2(g)=2CO2(g) △H=a, 2C(s)+O2(g)=2CO(g) △H=b,可知a故答案选D。
11.错误
【详解】比较ΔH大小,需要正负号和数值一起比较,错误。
12.错误
【详解】反应的焓变等于反应物断裂旧共价键的键能之和减去生成物形成新共价键的键能之和,故答案为:错误。
13.正确
【详解】反应出放出热量与反应物用量有关;反应反向进行,则放热反应变为吸热反应,故正确;
14.错误
【详解】等物质的量的C完全燃烧生成CO2时放出的热量高于不完全燃烧生成CO时放出的热量,因此a15.正确
【详解】正反应的反应热=反应物的键能总和-生成物的键能总和,逆反应的反应热=生成物的键能总和-反应物的键能总和,因此两者反应热数值相等,符号相反,该说法正确。
16. 放热 N2(g)+H2(g)NH3(g) △H=-46kJ mol-1 H2(g)+O2(g)==H2O(l) △H=-285.8kJ mol-1 环形玻璃搅拌棒 保温、支撑
【分析】从A到B,需要吸收热量254kJ,此能量为正反应的活化能;从B到C,能放出热量300kJ,此能量也为逆反应的活化能的绝对值(逆反应的活化能为300kJ)。
【详解】(1)从图中可以看出,和反应生成过程中,生成物的总能量低于反应物的总能量,所以该化学反应属于放热反应,该反应的生成物NH3为1mol,则反应物N2为mol,H2为mol,热化学方程式为:N2(g)+H2(g)NH3(g) △H=-46kJ mol-1。 答案为:放热;N2(g)+H2(g)NH3(g) △H=-46kJ mol-1;
(2)已知氢气的燃烧热为285.8 kJ mol-1,则氢气的燃烧热的热化学方程式:H2(g)+O2(g)==H2O(l) △H=-285.8kJ mol-1。答案为:H2(g)+O2(g)==H2O(l) △H=-285.8kJ mol-1;
(3)如图装置中,仪器A用于混合液的搅拌,其名称为环形玻璃搅拌棒。答案为:环形玻璃搅拌棒;
(4)碎泡沫塑料的作用,一是使测定的反应后最高温度准确,即保温;二是支撑小烧杯,使小烧杯口尽可能与大烧杯口平齐,实际上也是起保温作用,所以作用是保温、支撑。答案为:保温、支撑。
【点睛】300kJ是由活化分子生成产物NH3(g)所释放的能量,我们易错误地认为是该反应的△H。
17. 环形玻璃搅拌棒或环形玻璃棒 保温、隔热,减少实验过程中的热量损失 偏小 不相等 相等 中和热是指酸跟碱发生中和反应生成lmolH2O所放出的热量,与酸、碱的用量无关
【详解】试题分析::(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是保温、隔热,减少实验过程中的热量损失;(2)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小;(3)反应放出的热量和所用酸以及碱的量的多少有关,若用60mL 0.50mol/L的盐酸跟50mL 0.55mol/L的NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏大,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以改用60mL 0.50mol/L的盐酸跟50mL 0.55mol/L的NaOH溶液进行上述实验,测得中和热数值相等,故答案为不相等;因为酸、碱发生中和反应放出的热量与酸、碱的用量有关;相等;中和热是指酸跟碱发生中和反应生成lmolH2O所放出的热量,它与酸、碱的用量无关.
考点:考查学生有关中和热的测定,注意中和热与酸、碱的物质的量无关
18.(1)温度计
(2)a
(3) -51.8 acd
(4)△H3>△H1=△H2
(5)c
【分析】用实验测定中和热,一方面要保证溶质物质的量的数据准确,也就是量取时不出现偏差,另一方面要保证初始温度和反应后最高温度测定准确。
【详解】(1)测定中和热时,需要测定盐酸和氢氧化钠溶液的初始温度、反应时的最高温度,所以图中缺少的一种仪器是温度计。答案为:温度计;
(2)实验时,环形玻璃搅拌器是套在温度计上的,所以运动方向只能是上下移动,故选a。答案为:a;
(3)三次实验温度升高的平均值为:℃=3.1℃,放出热量为:4.18J·g-1·℃-1×100g×3.1℃=1295.8J=1.2958kJ,则中和反应生成1molH2O(l)的△H=-≈-51.8 kJ mol-1。
实验测出的中和热数据偏低。
a.实验装置保温,隔热效果差,则会发生热量散失,造成中和热测定值偏低,a符合题意;
b.用量筒量取盐酸时仰视读数,量取的盐酸体积偏大,反应放出的热量偏多,中和热测定值偏高,b不符合题意;
c.分多次将NaOH溶液倒入小烧杯中,倒入过程中会发生热量散失,从而造成中和热测定值偏低,c符合题意;
d.用测量盐酸的温度计直接测定NaOH溶液的温度,测出的NaOH溶液的初始温度偏高,温度差偏小,从而造成中和热测定值偏低,d符合题意;
故选acd。答案为:-51.8;acd;
(4)氢氧化钾、氢氧化钙都是强碱,发生完全电离,一水合氨为弱碱,电离时需要吸收热量,所以△H1、△H2、△H3的大小关系为△H3>△H1=△H2。答案为:△H3>△H1=△H2;
(5)a.向内筒中加入稀碱时,缓慢加入会造成热量损失,应快速加入,a不正确;
b.将用量筒量取好的稀盐酸加入内筒后,不能将量筒内壁剩余的稀盐酸水洗后放入内筒,否则会导致盐酸加入量过多、溶液质量增大,从而造成测量误差,b不正确;
c.用量筒量取稀酸或碱时,眼睛应平视,且视线与液体凹面最低处相平,c正确;
d.内筒未烘干,直接用该内筒进行实验,溶液质量偏大,则反应时最高温度值偏低,从而使生成1molH2O时所测得的中和反应的反应热(△H)偏高,d不正确;
故选c。答案为:c。
【点睛】为了减少温度测量误差,测量酸、碱温度时,应使用同一支温度计。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
化学反应热的计算
共18题,满分100分
题号 一 二 三 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请注意保持试卷整洁
一、单选题(共50分)
1.(本题5分)与反应的能量变化如图所示(各粒子均处于基态,单位为),则下列说法不正确的是
A.的第一电离能
B.键能为
C.,
D.
2.(本题5分)下列说法错误的有
①化学反应除了生成新物质外,还伴随着能量的变化
②需要加热才能发生的反应都是吸热反应
③热化学方程式应注明反应时的温度与压强,若没注明则表示常温、常压时的反应
④等量的氢气和氧气分别完全燃烧生成气态水和液态水,前者放出的热量多
⑤H2(g)+I2(g)2HI(g) ΔH=-QkJ·mol-1,表示常温常压下,在恒温密闭容器中当有1molH2和1mol I2(g)反应生成2molHI时放出QkJ的热量
⑥同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照条件下和点燃条件下的ΔH相同
A.1项 B.2项 C.3项 D.5项
3.(本题5分)已知H2(g)+Br2(g)=2HBr(g) ΔH=-102kJ·mol-1,其他相关数据如下表:
物质 H2(g) Br2(g) HBr(g)
1mol分子中的化学键断裂时需要吸收的能量/kJ 436 200 a
则表中a为
A.369 B.260 C.230 D.404
4.(本题5分)氨氮是造成水体富营养化的重要因素之一,用次氯酸钠水解生成的次氯酸将水中的氨氮(用NH3表示)转化为氮气除去,相关反应如下:
①NH3+HClO=NH2Cl+H2O
②NH2Cl+HClO=NHCl2+H2O
③2NHCl2+H2O=N2+HClO+3HCl
已知在水溶液中NH2Cl较稳定,NHCl2不稳定易转化为氮气。在其他条件一定的情况下,改变(即NaClO溶液的投入量),溶液中次氯酸钠去除氨氮效果与余氯(溶液中+1价氯元素的含量)影响如图所示。则下列说法正确的是
A.次氯酸与氨的总反应可表示为:2NH3+HClO=N2+3H2O+3HCl
B.反应中氨氮去除效果最佳的值约为1.5
C.a点之前溶液中发生的主要反应为:NH2Cl+HClO=NHCl2+H2O
D.次氯酸钠溶液pH较小时有O2生成,促使氨氮去除率提高
5.(本题5分)SOCl2是一种液态化合物,沸点77℃。向水中滴加8~10滴SOCl2,剧烈反应,液面上有雾形成,并有SO2逸出。待白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色沉淀析出。将SOCl2与AlCl3·6H2O混合加热,可得到无水AlCl3。反应2SO2(g)+O2(g) 2SO3(g)的能量变化如图所示,下列说法正确的是
A.SO2的键角小于SO3的键角
B.2SO2(g)+O2(g) 2SO3(l) △H=(x-y) kJ·mol-1
C.反应达到限度时,增大容器容积能增大正反应速率
D.每转移电子4mol,有22.4L的O2被还原
6.(本题5分)甲醇可通过氢化法合成:。恒定温度为时,将和充入密闭容器中,测得按I变化。下列说法不正确的是
A.时,I中反应进行到B点时释放的热量为
B.时,该反应平衡常数为
C.若其他条件不变,增大起始,所得可能按Ⅱ变化
D.若其他条件不变,缩小容器体积,所得可能按Ⅱ无变化
7.(本题5分)下列有关叙述正确的是
A.已知2H2(g)+O2(g) = 2H2O(g) △H = —483.6kJ/mol,则氢气的燃烧热为241.8 kJ/mol
B.已知C(石墨,s) = C(金刚石,s) △H>0,则金刚石比石墨稳定
C.已知2C(s) +2O2(g) = 2CO2(g) △H1; 2C(s) + O2(g) = 2CO(g) △H2;,则△H1>△H2
D.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热方程式为NaOH(aq) + HCl(aq) = NaCl(aq) +H2O(l) △H=一57.4kJ/mol
8.(本题5分)已知NaHCO3溶液与盐酸反应生成CO2吸热,Na2CO3溶液与盐酸反应生成CO2放热。关于下列ΔH的判断正确的是
①CO(aq)+H+(aq) HCO(aq) ΔH1
②HCO(aq)+H+(aq) H2CO3(aq) ΔH2
③H2CO3(aq) H2O(l)+CO2(g) ΔH3
A.ΔH1<0;ΔH2>0 B.ΔH2+ΔH3>0
C.ΔH1+ΔH2+ΔH3>0 D.ΔH1>ΔH3
9.(本题5分)把温度为20℃,浓度为1.0mol/L的硫酸溶液和2.2mol/L的碱液各50mL混合,搅动,测得酸碱混合物的温度变化数据如下(溶液密度为1g/mL,比热容为4.184kJ/(kg·℃))
反应物 起始温度T1/℃ 终止温度T2/℃
H2SO4+NaOH 20 33.6
H2SO4+NH3·H2O 20 32.6
则NH3+H2ONH3·H2O的 H为
A.+4.2kJ B.+2.1kJ C.-2.1kJ D.-4.2kJ
10.(本题5分)下列热化学方程式正确的是
A.甲烷的燃烧热=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) =-890.3kJ/mol
B.500℃、30MPa下,将0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)2NH3(g) =-38.6kJ/mol
C.HCl和NaOH反应的中和热=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(-57.3)kJ/mol
D.已知C(s)+O2(g)=CO2(g) =a,C(s)+O2(g)=CO(g) =b,则a<b
二、判断题(共20分)
11.(本题4分)比较ΔH大小,只需比较数值,不用考虑正负号。
12.(本题4分)反应的可通过下式估算:反应中形成新共价键的键能之和-反应中断裂旧共价键的键能之和。(_______)
13.(本题4分)已知N2(g)+3H2(g)=2NH3(g) ΔH=-92 kJ·mol-1,则NH3(g)=N2(g)+H2(g) ΔH=+46 kJ·mol-1。(________)
14.(本题4分)已知 ,,则。(___________)
15.(本题4分)当反应逆向进行时,其反应热与正反应热的反应热数值相等,符号相反。
三、解答题(共30分)
16.(本题10分)I.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)如图是和反应生成过程中能量的变化示意图,请问该化学反应属于 放热或吸热反应,请写出该反应的热化学方程式: 。
(2)上述反应用到的氢气是一种清洁燃料,已知氢气的燃烧热为285.8 kJ mol-1,请写出氢气的燃烧热的热化学方程式: 。
II.已知。回答有关中和反应的问题。
(3)如图装置中仪器A的名称
(4)碎泡沫塑料的作用是
17.(本题10分)中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 ,烧杯间填满碎塑料泡沫的作用是 。
(2)大烧杯上如不盖硬纸板,则求得的中和热数值 (填“偏大”、“偏小”、“无影响”)
(3)实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,
与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热的数值会 (填“相等”或“不相等”),理由是 。
18.(本题10分)测定50mL0.50mol L-1盐酸和50mL0.55mol L-1NaOH溶液反应的反应热的实验装置如图所示。回答下列问题:
(1)图中缺少的一种仪器是 。
(2)实验时玻璃搅拌器的运动方向是 (填标号)。
a.上下 b.左右 c.顺时针 d.逆时针
(3)假设盐酸和氢氧化钠溶液的密度都是1g cm-3,又知中和反应后生成的溶液的比热容c=4.18J/(g ℃)。实验记录数据如表:
实验序号 起始温度t1/℃ 终止温度t1/℃
盐酸 氢氧化钠溶液 混合溶液
1 20.0 20.1 23.2
2 20.2 20.4 23.4
3 20.5 20.6 23.6
则中和反应生成1molH2O(l)的△H= kJ mol-1(保留1位小数)。若计算结果与理论数据(57.3kJ mol-1)相比较,有误差,则可能导致该误差的原因是 (填标号)。
a.实验装置保温、隔热效果差
b.用量筒量取盐酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定盐酸的起始温度后直接去测定NaOH溶液的温度
(4)现将一定量的稀氢氧化钾溶液、稀氢氧化钙溶液、稀氨水分别和1L1mol L-1稀盐酸恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2、△H3的大小关系为 。
(5)下列说法正确的是 (填标号)。
a.向内筒中加入稀碱时,应当缓慢而匀速地加入
b.将用量筒量取好的稀盐酸加入内筒后,应当快速用水冲洗量筒内壁剩余的稀盐酸至内筒中,以免造成测量误差
c.用量筒量取稀酸或碱时,眼睛必须与液体凹面最低处相平
d.内筒洗净后,未及时烘干,直接用该内筒进行实验,对生成1molH2O时所测得的中和反应的反应热(△H)无影响
参考答案:
1.A
【详解】A.由图可知,(g)失去1个电子生成Na+,的第一电离能,故A错误;
B.由图可知,Cl2(g)断键生成Cl(g)吸收的能量为,键能为,故B正确;
C.(g)失去1个电子生成Na+(g)需要吸收能量,,Na+(g)和Cl-(g)形成离子键得到NaCl要放出热量,,故C正确;
D.由盖斯定律可知,结合图中历程,,则,故D正确;
故选A。
2.B
【详解】①化学反应除了生成新物质外,还伴随着能量的变化,正确;
②需要加热才能发生的反应不一定都是吸热反应,例如木炭燃烧等,错误;
③热化学方程式应注明反应时的温度与压强,若没注明则表示常温、常压时的反应,正确;
④等量的氢气和氧气分别完全燃烧生成气态水和液态水,前者放出的热量少,错误;
⑤H2(g)+I2(g) 2HI(g) ΔH=-QkJ·mol-1,表示常温、常压下,在恒温密闭容器中当有1molH2和1mol I2(g)反应,生成2molHI时放出QkJ的热量,正确;
⑥反应热与反应条件没有关系,同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照条件下和点燃条件下的ΔH相同,正确;
答案选B。
3.A
【详解】已知H2(g)+Br2(g)=2HBr(g) ΔH=-102 kJ mol-1,反应热等于反应物的总键能减生成物的总键能,则△H=-102 kJ mol-1 =436 kJ mol-1+200 kJ mol-1 2×a kJ mol-1,得:a =369,答案选A。
4.B
【详解】反应反应反应,依据化学方程式和盖斯定律,得到化学方程式,选项A错误;
B.反应中氨氮去除效果最佳的值,从图象分析可知为去除率较高同时余氯量最少,图象中符合的比值为,选项B正确;
点时,说明少,则次氯酸钠水解生成的次氯酸也是少量的,因此,发生的主要反应为,而不是,选项C错误;
D.次氯酸钠溶液pH较小时有生成,由于次氯酸减少,所以使得氨氮去除率降低,选项D错误。
答案选B。
5.A
【详解】A.SO2中S原子采用sp2杂化,有1个孤电子对;SO3中S原子采用sp2杂化,无个孤电子对,所以SO2的键角小于SO3的键角,故A正确;
B.根据图示,2SO2(g)+O2(g) 2SO3(g) △H=(x-y) kJ·mol-1,故B错误;
C.反应达到限度时,增大容器容积,浓度减小,正逆反应速率均减小,故C错误;
D.每转移电子4mol,有1molO2被还原,非标准状况下的体积不一定是22.4L,故D错误;
选A。
6.C
【详解】A.由图像可知,I中反应进行到B点时,为3mol/L,则为3mol,起始H2为12mol,则转化的H2为9mol,故释放的热量为,A正确;
B.由图像可知,I中反应进行到C点时,反应达平衡,为2mol/L,列三段式为,则,B正确;
C.若其他条件不变,增大起始,则在相同时间时,大于Ⅰ中的,故不能按照Ⅱ变化,C错误;
D.若其他条件不变,缩小容器体积,体系压强增大,则化学反应速率加快,平衡向正反应方向移动,达平衡时减小,故可能按照Ⅱ变化,D正确;
答案选C。
7.D
【详解】A项,H2完全燃烧后生成的稳定氧化物为H2O(l),氢气的燃烧热大于241.8kJ/mol,错误;B项,石墨转化为金刚石为吸热反应,石墨具有的总能量小于金刚石具有的总能量,则石墨比金刚石稳定,错误;C项,两者都是C(s)的燃烧反应,ΔH10、ΔH20,前者为2molC(s)完全燃烧,后者为2molC(s)不完全燃烧,等物质的量的C(s)完全燃烧放出的热量大于不完全燃烧放出的热量,则ΔH1ΔH2,错误;D项,n(H2O)=n(NaOH)==0.5mol,则生成1molH2O放出的热量为=57.4kJ,则中和热的热化学方程式为NaOH(aq)+ HCl(aq)=NaCl(aq)+H2O(l) △H=一57.4kJ/mol,正确;答案选D。
8.B
【详解】A.CO(aq)+H+(aq) HCO(aq)形成化学键放热,ΔH1<0;HCO(aq)+H+(aq) H2CO3(aq)形成化学键放热,ΔH2<0,故A错误;
B.NaHCO3溶液与盐酸反应生成CO2吸热,根据盖斯定律ΔH2+ΔH3>0,故B正确;
C.Na2CO3溶液与盐酸反应生成CO2放热,根据盖斯定律ΔH1+ΔH2+ΔH3<0,故C错误;
D.分解反应吸热,H2CO3(aq) H2O(l)+CO2(g)ΔH3>0;CO(aq)+H+(aq) HCO(aq) 形成化学键放热ΔH1<0,所以ΔH1<ΔH3,故D错误;
选B。
9.D
【详解】根据反应焓变的计算公式可知,H2SO4与NaOH反应①2H+(aq) +20H-(aq)=2H20(l)的焓变为:,
H2SO4与NH3·H2O的反应:②2H+(aq)+2NH3·H2O(aq)=2NH(aq)+2H20(l)的焓变为,可得NH3·H2ONH(aq)+0H-(aq) H=+4.2,则NH(aq)+0H-(aq) NH3+H2ONH3·H2O H=-4.2,故答案为:D
10.D
【详解】A.由甲烷的燃烧热H= 890.3 kJ mol 1,燃烧热表示可燃物完全燃烧生成稳定的氧化物,产物水为液体水,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(l) H= 890.3 kJ mol 1,A项错误;
B.将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,合成氨为可逆反应,0.5 mol N2不能完全反应生成,则1molN2(g)充分反应生成NH3(g)放热大于38.6kJ,放热反应的焓变为负值,则N2(g)+3H2(g) 2NH3(g) △H< 38.6 kJ mol 1,B项错误;
C.中和热是一个定值,指常温下1molH+和1molOH-反应生成1molH2O放出的热量,不同的酸和碱反应会有不同的反应热,其值与中和热未必一致,C项错误;
D.完全燃烧比不完全燃烧放出热量多,燃烧反应的焓变为负值,由2C(s)+2O2(g)=2CO2(g) △H=a, 2C(s)+O2(g)=2CO(g) △H=b,可知a
11.错误
【详解】比较ΔH大小,需要正负号和数值一起比较,错误。
12.错误
【详解】反应的焓变等于反应物断裂旧共价键的键能之和减去生成物形成新共价键的键能之和,故答案为:错误。
13.正确
【详解】反应出放出热量与反应物用量有关;反应反向进行,则放热反应变为吸热反应,故正确;
14.错误
【详解】等物质的量的C完全燃烧生成CO2时放出的热量高于不完全燃烧生成CO时放出的热量,因此a
【详解】正反应的反应热=反应物的键能总和-生成物的键能总和,逆反应的反应热=生成物的键能总和-反应物的键能总和,因此两者反应热数值相等,符号相反,该说法正确。
16. 放热 N2(g)+H2(g)NH3(g) △H=-46kJ mol-1 H2(g)+O2(g)==H2O(l) △H=-285.8kJ mol-1 环形玻璃搅拌棒 保温、支撑
【分析】从A到B,需要吸收热量254kJ,此能量为正反应的活化能;从B到C,能放出热量300kJ,此能量也为逆反应的活化能的绝对值(逆反应的活化能为300kJ)。
【详解】(1)从图中可以看出,和反应生成过程中,生成物的总能量低于反应物的总能量,所以该化学反应属于放热反应,该反应的生成物NH3为1mol,则反应物N2为mol,H2为mol,热化学方程式为:N2(g)+H2(g)NH3(g) △H=-46kJ mol-1。 答案为:放热;N2(g)+H2(g)NH3(g) △H=-46kJ mol-1;
(2)已知氢气的燃烧热为285.8 kJ mol-1,则氢气的燃烧热的热化学方程式:H2(g)+O2(g)==H2O(l) △H=-285.8kJ mol-1。答案为:H2(g)+O2(g)==H2O(l) △H=-285.8kJ mol-1;
(3)如图装置中,仪器A用于混合液的搅拌,其名称为环形玻璃搅拌棒。答案为:环形玻璃搅拌棒;
(4)碎泡沫塑料的作用,一是使测定的反应后最高温度准确,即保温;二是支撑小烧杯,使小烧杯口尽可能与大烧杯口平齐,实际上也是起保温作用,所以作用是保温、支撑。答案为:保温、支撑。
【点睛】300kJ是由活化分子生成产物NH3(g)所释放的能量,我们易错误地认为是该反应的△H。
17. 环形玻璃搅拌棒或环形玻璃棒 保温、隔热,减少实验过程中的热量损失 偏小 不相等 相等 中和热是指酸跟碱发生中和反应生成lmolH2O所放出的热量,与酸、碱的用量无关
【详解】试题分析::(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是保温、隔热,减少实验过程中的热量损失;(2)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小;(3)反应放出的热量和所用酸以及碱的量的多少有关,若用60mL 0.50mol/L的盐酸跟50mL 0.55mol/L的NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏大,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以改用60mL 0.50mol/L的盐酸跟50mL 0.55mol/L的NaOH溶液进行上述实验,测得中和热数值相等,故答案为不相等;因为酸、碱发生中和反应放出的热量与酸、碱的用量有关;相等;中和热是指酸跟碱发生中和反应生成lmolH2O所放出的热量,它与酸、碱的用量无关.
考点:考查学生有关中和热的测定,注意中和热与酸、碱的物质的量无关
18.(1)温度计
(2)a
(3) -51.8 acd
(4)△H3>△H1=△H2
(5)c
【分析】用实验测定中和热,一方面要保证溶质物质的量的数据准确,也就是量取时不出现偏差,另一方面要保证初始温度和反应后最高温度测定准确。
【详解】(1)测定中和热时,需要测定盐酸和氢氧化钠溶液的初始温度、反应时的最高温度,所以图中缺少的一种仪器是温度计。答案为:温度计;
(2)实验时,环形玻璃搅拌器是套在温度计上的,所以运动方向只能是上下移动,故选a。答案为:a;
(3)三次实验温度升高的平均值为:℃=3.1℃,放出热量为:4.18J·g-1·℃-1×100g×3.1℃=1295.8J=1.2958kJ,则中和反应生成1molH2O(l)的△H=-≈-51.8 kJ mol-1。
实验测出的中和热数据偏低。
a.实验装置保温,隔热效果差,则会发生热量散失,造成中和热测定值偏低,a符合题意;
b.用量筒量取盐酸时仰视读数,量取的盐酸体积偏大,反应放出的热量偏多,中和热测定值偏高,b不符合题意;
c.分多次将NaOH溶液倒入小烧杯中,倒入过程中会发生热量散失,从而造成中和热测定值偏低,c符合题意;
d.用测量盐酸的温度计直接测定NaOH溶液的温度,测出的NaOH溶液的初始温度偏高,温度差偏小,从而造成中和热测定值偏低,d符合题意;
故选acd。答案为:-51.8;acd;
(4)氢氧化钾、氢氧化钙都是强碱,发生完全电离,一水合氨为弱碱,电离时需要吸收热量,所以△H1、△H2、△H3的大小关系为△H3>△H1=△H2。答案为:△H3>△H1=△H2;
(5)a.向内筒中加入稀碱时,缓慢加入会造成热量损失,应快速加入,a不正确;
b.将用量筒量取好的稀盐酸加入内筒后,不能将量筒内壁剩余的稀盐酸水洗后放入内筒,否则会导致盐酸加入量过多、溶液质量增大,从而造成测量误差,b不正确;
c.用量筒量取稀酸或碱时,眼睛应平视,且视线与液体凹面最低处相平,c正确;
d.内筒未烘干,直接用该内筒进行实验,溶液质量偏大,则反应时最高温度值偏低,从而使生成1molH2O时所测得的中和反应的反应热(△H)偏高,d不正确;
故选c。答案为:c。
【点睛】为了减少温度测量误差,测量酸、碱温度时,应使用同一支温度计。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
