化学反应原理综合考查-高考化学考前专项练习试题(含解析)
文档属性
| 名称 | 化学反应原理综合考查-高考化学考前专项练习试题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 983.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-13 12:11:05 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
化学反应原理综合考查
共13题,满分100分
题号 一 二 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请注意保持试卷整洁
一、单选题(共50分)
1.(本题5分)硫酸盐(含、)气溶胶是 PM2.5的成分之一。近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下:
下列说法不正确的是( )
A.该过程有 H2O 参与 B.NO2是生成硫酸盐的还原剂
C.硫酸盐气溶胶呈酸性 D.该过程中有硫氧键生成
2.(本题5分)下列说法中不正确的是
A.离子化合物中可能有非金属元素
B.共价化合物中一定不含有离子键,离子化合物中可能存在共价键
C.吸热反应不一定需要加热就能发生
D.一定条件下lmolN2与3molH2在密闭容器中充分反应可生成2molNH3
3.(本题5分)下列说法正确的是
A.在海轮船壳上镶入锌块保护海轮,利用的是牺牲阳极的阴极保护法
B.KNO3溶液和CH3OONH4溶液均显中性.两溶液中水的电离程度相等
C.若1 molNa2O2与足量水反应产生O2,理论上转移的电子数约为2×6.02×1023
D.用pH 均为2 的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
4.(本题5分)偏二甲肼为价与是常用的火箭推进剂,发生的化学反应如下: ,下列说法不正确的是
A.该反应在任何情况下都能自发进行
B.含有共价键
C.反应中,氧化产物为,还原产物为
D.反应中,生成时,转移
5.(本题5分)坦克的制造材料主要是各种金属的合金,铁便是其中十分重要的一种。下列关于铁的说法中正确的是
A.铁单质只具有还原性,其阳离子只具有氧化性
B.常温下,单质铁与浓硫酸不反应
C.铁元素属于过渡元素,其原子序数为26
D.比较与相同浓度的盐酸反应生成氢气的速率,纯铁比生铁的快
6.(本题5分)氮的氧化物对环境造成了极大的危害,研究消除氮的氧化物的污染是科技工作者的重要课题。如图是研究自由基CNS·与NO的会反应历程,4条反应路径中能量变化如图所示。已知: IM11:IM12:( 虚线表示未形成化学键,实线表示单键、双键等化学键)。下列说法错误的是
A.自由基CNS·的电子式是:
B.反应速率的大小顺序:①>②>③>④
C.反应路径④经过了2个中间体和3个过渡态
D.IM12转化为OCS和N2时,需断裂O-N键和C-N键
7.(本题5分)下列叙述中正确的是
A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
B.常温常压下,氢氧燃料电池放电过程中消耗11.2 L H2,转移电子的数目为6.02×1023
C.工业制粗硅2C(s)+SiO2(s)===Si(s)+2CO(g),室温下不能自发进行,则△H>0
D.稀盐酸和稀氢氧化钠反应的中和热为-57.3 kJ mol-1,则稀醋酸和稀氨水反应的中和热也为-57.3kJ·mol-1
8.(本题5分)等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如图所示,下列叙述正确的是
A.M、N两种金属中较活泼的是N B.生成H2的质量MC.相对原子质量较大的是N D.产生H2的快慢程度为N>M
9.(本题5分)下列关于无机物应用的叙述正确的是( )
A.湿法脱除烟气中的NO,是利用的氧化性
B.半导体工业中可用氢氟酸除去硅片表面的层,是因为HF具有强酸性
C.法利用溶液脱除烟气中的,是利用溶液呈酸性
D.用氨水除去铜器表面的转化为,是利用的还原性
10.(本题5分)一定温度下,在Ba(OH)2的悬浊液中,存在Ba(OH)2固体与其电离的离子间的溶解平衡关系:Ba(OH)2(s)Ba2+(aq)+2OH-(aq),向此体系中再加入少量的BaO粉末,如果保持温度不变,则下列说法正确的是
A.c(Ba2+)增大
B.溶液中Ba2+数目减少
C.溶液pH减小
D.溶液质量增大
二、解答题(共50分)
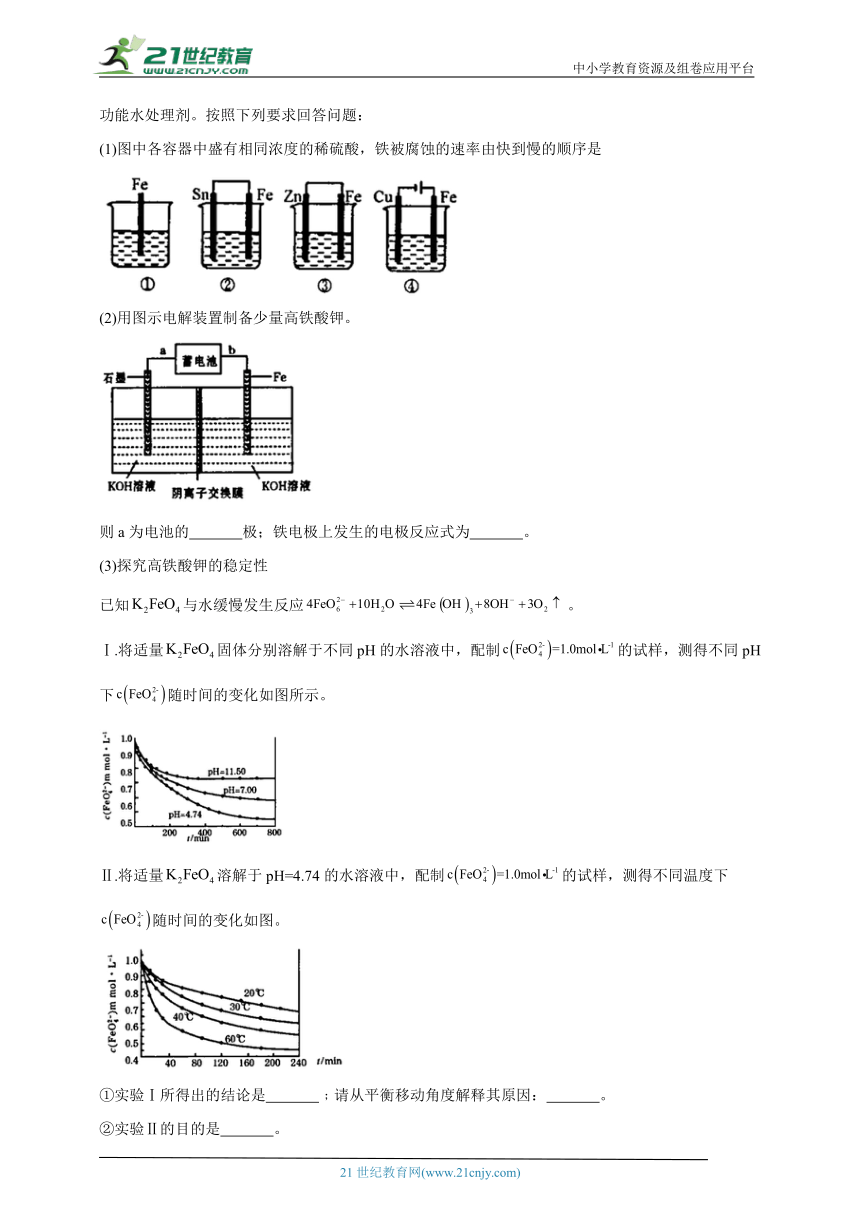
11.(本题15分)铁是人类应用最广泛的金属,含铁化合物高铁酸钾是一种新型高效的多功能水处理剂。按照下列要求回答问题:
(1)图中各容器中盛有相同浓度的稀硫酸,铁被腐蚀的速率由快到慢的顺序是
(2)用图示电解装置制备少量高铁酸钾。
则a为电池的 极;铁电极上发生的电极反应式为 。
(3)探究高铁酸钾的稳定性
已知与水缓慢发生反应。
Ⅰ.将适量固体分别溶解于不同pH的水溶液中,配制的试样,测得不同pH下随时间的变化如图所示。
Ⅱ.将适量溶解于pH=4.74的水溶液中,配制的试样,测得不同温度下随时间的变化如图。
①实验Ⅰ所得出的结论是 ﹔请从平衡移动角度解释其原因: 。
②实验Ⅱ的目的是 。
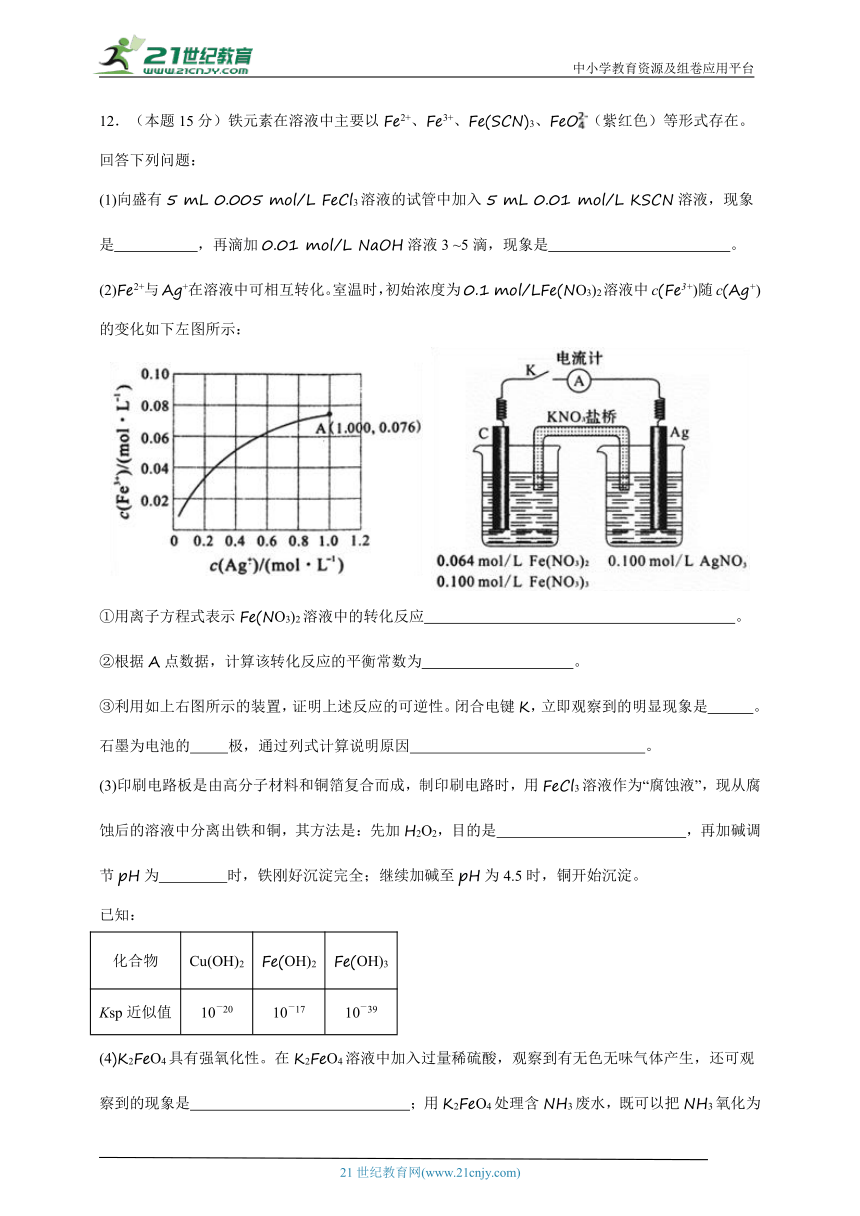
12.(本题15分)铁元素在溶液中主要以Fe2+、Fe3+、Fe(SCN)3、FeO(紫红色)等形式存在。回答下列问题:
(1)向盛有5 mL 0.005 mol/L FeCl3溶液的试管中加入5 mL 0.01 mol/L KSCN溶液,现象是 ,再滴加0.01 mol/L NaOH溶液3 ~5滴,现象是 。
(2)Fe2+与Ag+在溶液中可相互转化。室温时,初始浓度为0.1 mol/LFe(NO3)2溶液中c(Fe3+)随c(Ag+)的变化如下左图所示:
①用离子方程式表示Fe(NO3)2溶液中的转化反应 。
②根据A点数据,计算该转化反应的平衡常数为 。
③利用如上右图所示的装置,证明上述反应的可逆性。闭合电键K,立即观察到的明显现象是 。石墨为电池的 极,通过列式计算说明原因 。
(3)印刷电路板是由高分子材料和铜箔复合而成,制印刷电路时,用FeCl3溶液作为“腐蚀液”,现从腐蚀后的溶液中分离出铁和铜,其方法是:先加H2O2,目的是 ,再加碱调节pH为 时,铁刚好沉淀完全;继续加碱至pH为4.5时,铜开始沉淀。
已知:
化合物 Cu(OH)2 Fe(OH)2 Fe(OH)3
Ksp近似值 10-20 10-17 10-39
(4)K2FeO4具有强氧化性。在K2FeO4溶液中加入过量稀硫酸,观察到有无色无味气体产生,还可观察到的现象是 ;用K2FeO4处理含NH3废水,既可以把NH3氧化为N2防止水体富营养化,又能生成一种净水剂,该反应的离子方程式为 。
13.(本题20分)Na2S2O3用于照相业定影剂、鞣革时重铬酸盐的还原剂等.
(1)Na2S2O3溶液与稀硫酸的反应可探究外界条件对化学反应速率的影响.Na2S2O3溶液与稀硫酸反应的离子方程式为 ;表格中H2O的体积x= ,其中探究温度对化学反应速率的影响的实验是 (填序号).
实验 反应温度/℃ Na2S2O溶液 稀H2SO4 H2O
V/mL c/mol·L-1 V/mL c/mol·L-1 V/mL
Ⅰ 20 10 0.1 10 0.1 0
Ⅱ 20 5 0.2 10 0.2 x
Ⅲ 40 10 0.1 10 0.1 0
(2)工业上可用反应制取Na2S2O3.实验室模拟该工业过程制取Na2S2O3的装置如图所示.
①试管a中的化学方程式为 .
②反应结束后,将试管b中溶液水浴加热浓缩, ,经过滤、乙醇洗涤晶体、干燥,得到。用乙醇而不用水洗涤晶体的原因 .
③测定产品纯度:准确称取mg晶体,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol·L-1碘的标准溶液滴定,反应原理为:。若消耗碘的标准液体积为20.00mL,产品的质量分数为(设相对分子质量为M) (写出计算表达式)
参考答案:
1.B
【详解】A.根据图示中各微粒的构造可知,该过程有H2O参与,选项A正确;
B.根据图示的转化过程,NO2转化为HNO2,N元素的化合价由+4价变为+3价,化合价降低,得电子被还原,做氧化剂,则NO2的是生成硫酸盐的氧化剂,选项B不正确;
C.硫酸盐(含SO、HSO)气溶胶中含有HSO,转化过程有水参与,则HSO在水中可电离生成H+和SO,则硫酸盐气溶胶呈酸性,选项C正确;
D.根据图示转化过程中,由SO转化为HSO,根据图示对照,有硫氧键生成,选项D正确;
答案选B。
2.D
【详解】A、NaOH为离子化合物,其中含有非金属元素O、H,正确;B、共价化合物中一定不含离子键,含有离子键的化合物一定是离子化合物,离子化合物中可能含有共价键,例如NaOH。正确;C、吸热反应不一定需要加热就能发生,例如氯化铵与氢氧化钡反应2NH4Cl(s)+Ba(OH)2·8H2O(s)=BaCl2+2NH3↑+10H2O直接搅拌就可以,该反应吸收大量的热,烧杯杯底沾些水反应后会结冰。正确;D、一定条件下,氮气和氢气生成氨气的反应是可逆反应,可逆反应中存在化学平衡,当正逆反应速率相等时,反应达到平衡状态,导致反应物不能完全转化为生成物。错误;故选D。
点睛:本题重点考查了离子化合物与共价化合物。离子化合物中肯定含有离子键,可能含有共价键。共价化合物中仅含有共价键。
3.A
【详解】A. 在海轮船壳上镶入锌块保护海轮,利用的是原电池原理,属于牺牲阳极的阴极保护法,A正确;B. KNO3溶液和CH3OONH4溶液均显中性.硝酸钾被水解,醋酸铵水解,促进水的电离,B错误;C. 若1 molNa2O2与足量水反应产生O2,理论上转移的电子数约为6.02×1023,C错误;D. 用pH 均为2 的盐酸和醋酸分别中和等物质的量的NaOH,醋酸是弱酸,浓度大于盐酸,消耗醋酸的体积更小,D错误,答案选A。
4.C
【详解】A.该反应是熵增反应,即,又是放热反应,即,则一定小于零,故该反应在任何情况下都能自发进行,故A正确;
B.一个分子中含有11个共价键,则含有11mol共价键,故B正确;
C.反应中,偏二甲肼中N元素化合价由价升高为0价,中N元素化合价由价降低为0价,则既是氧化产物又是还原产物,偏二甲肼中碳元素由价升高为价,为氧化产物,故C错误;
D.中N元素化合价由价降低为0价,生成1mol时消耗,转移8mol,故D正确;
故答案选C。
5.C
【分析】A、最低价态的元素只有还原性,中间价态的元素既有氧化性又有还原性,最高价态的元素只有氧化性;
B、常温下,铁和浓硫酸发生钝化现象;
C、铁是26号元素,属于过渡元素;
D、作原电池负极的金属能加快被腐蚀速率。
【详解】A.亚铁离子的化合价是中间价态,所以亚铁离子有还原性,也有氧化性,选项A错误;
B.常温下,铁和浓硫酸反应生成一层致密的氧化物薄膜而阻止进一步反应,但并不是铁和浓硫酸不反应,选项B错误;
C.铁是26号元素,属于第V III族元素,为过渡元素,选项C正确;
D.纯铁和稀盐酸不能构成原电池,生铁中铁、碳、盐酸构成原电池,铁作负极,作原电池负极的金属能加快被腐蚀速率,所以生铁反应速率比纯铁快,选项D错误;
答案选C。
6.A
【详解】A.自由基中有单电子,则CNS·的电子式是: ,故A项错误;
B.由能量变化曲线可知,活化能大小顺序:④>③>②>①,故反应速率快慢为①>②>③>④, 故B项正确;
C.反应路径④经过的中间体是IM41 、IM42 ,过渡态是TS41、TS42 、TS43 ,故C项正确;
D.对比产物OCS、N2与IM12的结构可知,该转化过程中,需断裂O-N键和C- N键,故D项正确。
故本题选A。
7.C
【详解】A. 若在海轮外壳上附着一些铜块,构成铁铜原电池,铁作负极,加快海轮外壳的腐蚀,故错误;
B. 常温常压下,气体摩尔体积的值发生变化,11.2 L H2的物质的量不是0.5mol,故错误;
C. △G=△H-T△S,气体体积增加, △S>0,室温下不能自发进行,即△G>0,则△H>0,故正确;
D. 醋酸和一水合氨都是弱电解质,其电离都是吸热反应,所以它们反应的中和热不是-57.3kJ·mol-1,D错误;
故合理选项为C。
8.C
【详解】A.根据图像知,M反应的快,M比较活泼,A错误;
B.由图像知,M生成的氢气的质量大,B错误;
C.金属的质量相等,而N生成的氢气的量少,其相对原子质量较大,C正确;
D.由图像知,M反应的快,N反应的慢,D错误;
故选C。
9.A
【分析】本题考查常见无机物的性质及有关反应原理等知识点,意在考查新情景下分析、理解能力和知识整合能力,难度不大。
【详解】A.中氯显价,有较强的氧化性,能将NO氧化为硝酸盐或亚硝酸盐而除去,故A正确;
B.氢氟酸是弱酸,除去是利用与HF发生反应:,故B错误;
C.溶液脱除烟气中的是利用的氧化性,故C错误;
D.该过程未发生氧化还原反应,故D错误;
故选A。
10.B
【详解】向悬浊液中加少量BaO,发生:BaO+H2O=Ba(OH)2 ,消耗水,因为Ba(OH)2 的悬浊液,则溶液中浓度不变,因水减少,则析出Ba(OH)2 ,溶液中Ba2+数目减少,形成该温度下的饱和溶液,A、c(Ba2+)不变,故A错误;B、溶液中Ba2+数目减少,故B正确;C、pH不变,故C错误;D、溶液质量减少;故选B。
点睛:本题考查溶解平衡,为高频考点,侧重于学生的分析能力的考查,题目难度一般,要注意向悬浊液中加少量BaO,发生的反应:BaO+H2O=Ba(OH)2 后溶液中存在溶解平衡,已溶的Ba(OH)2 和末溶的Ba(OH)2 之间形成平衡,从平衡移动的角度分析,就容易理解。
11. ④>②>①>③ 负 Fe-6e-+8OH-=FeO+4H2O 溶液的pH越大,K2FeO4稳定性越强 溶液的碱性越强,c(OH-)越大,促使FeO与水的反应逆向移动 探究温度对K2FeO4稳定性的影响
【详解】(1)图①为化学腐蚀;图②为原电池装置,在酸性条件下Fe比Sn活泼,Fe作负极,被氧化,腐蚀速率加快;图③Zn比Fe活泼,Zn作负极,Fe作正极,被保护,为牺牲阳极的阴极保护法;图④为电解池装置,其中Fe与电源正极相连,作阳极,腐蚀速率加快;金属腐蚀速率大小顺序为:电解池>原电池>化学腐蚀>电化学保护,故填④>②>①>③;
(2)装置为电解池装置,欲制备高铁酸钾,根据比较Fe与中Fe元素的化合价可知,Fe被氧化,作阳极,故Fe与蓄电池正极相连;即a为电源负极,Fe电极的反应式为,故填负、;
(3)①从图中的浓度与pH看出,相同时间下,pH越大,的浓度越高;相同pH下,的浓度随时间的推移而降低,以此得出结论:溶液的pH越大,K2FeO4稳定性越强,其原因是因为增加使可逆反应,平衡向左移动,故填溶液的pH越大,K2FeO4稳定性越强、溶液的碱性越强,c(OH-)越大,促使与水的反应逆向移动;
②从实验Ⅱ的图象中可以看出,其为不同温度下浓度随时间的变化关系,即不同温度下的稳定性与温度的关系,故填探究温度对K2FeO4稳定性的影响;
【点睛】关于图象问题,首先确定横坐标和纵坐标所代表的物理量,坐标系内的曲线表示纵坐标随横坐标的变化而变化的关系,即定一议二,确定一个物理量,讨论其它两个物理量的变化关系。
12. 溶液变红色 溶液红色变浅 Fe2++Ag+Fe3++Ag↓ 3.17 电流计指针发生偏转 正 Q= =>3.17,反应逆向进行,所以石墨电极为正极 将Fe2+氧化为Fe3+ 2.7 溶液由紫红色变为黄色 2FeO+2NH3+2H2O=2Fe(OH)3↓+N2↑+4OH-
【详解】(1)向盛有5 mL 0.005 mol/L FeCl3溶液的试管中加入5 mL 0.01 mol/L KSCN溶液,现象是溶液变红色。再滴加0.01 mol/L NaOH溶液3~5滴,生成氢氧化铁沉淀,铁离子浓度降低,因此现象是溶液红色变浅。(2)①根据图象可知铁离子浓度逐渐增大,说明亚铁离子被银离子氧化,反应的离子方程式为 Fe2++Ag+Fe3++Ag↓。②根据图象可知平衡时铁离子是0.076mol/L,银离子是1mol/L,根据方程式可知消耗亚铁离子是0.076mol/L,所以平衡时亚铁离子浓度是0.1mol/L-0.076mol/L=0.024mol/L,因此该转化反应的平衡常数为。③闭合电键K,构成原电池,立即观察到的明显现象是电流计指针发生偏转。由于Q= =>3.17,反应逆向进行,所以石墨电极为正极,银离子得到电子。(3)印刷电路板是由高分子材料和铜箔复合而成,制印刷电路时,用FeCl3溶液作为“腐蚀液”,现从腐蚀后的溶液中分离出铁和铜,其方法是:
双氧水具有强氧化性,先加H2O2,目的是将Fe2+氧化为Fe3+便于形成氢氧化铁沉淀。根据表中数据可知铁刚好沉淀完全时氢氧根浓度是,因此根据水的离子积常数为10-14可知pH=2.7。(4)K2FeO4具有强氧化性。在K2FeO4溶液中加入过量稀硫酸,观察到有无色无味气体产生,产生的气体是氧气,所以还原产物是铁离子,因此还可观察到的现象是溶液由紫红色变为黄色;用K2FeO4处理含NH3废水,既可以把NH3氧化为N2防止水体富营养化,又能生成一种净水剂,该净水剂是氢氧化铁,反应的离子方程式为 2FeO42-+2NH3+2H2O=2Fe(OH)3↓+N2↑+4OH-。
13. 5 I和Ⅲ 冷却结晶 降低硫代硫酸钠溶解度,防止因洗涤而损失产品;乙醇易挥发带走水分
【详解】(1)Na2S2O3溶液与稀硫酸反应生成硫酸钠、硫单质、二氧化硫和水,其离子方程式为;Ⅰ和Ⅱ探究稀硫酸浓度对反应速率的影响,因此其他量相同即溶液的总体积相同,因此表格中H2O的体积x=5,I和Ⅲ只有温度不相同,其他量相同,因此探究温度对化学反应速率的影响的实验是I和Ⅲ;故答案为:;5;I和Ⅲ。
(2)①试管a中是铜和浓硫酸加热条件下反应生成二氧化硫、硫酸铜和水,其化学方程式为;故答案为:。
②反应结束后,从溶液到晶体,因此要将试管b中溶液水浴加热浓缩,冷却结晶,经过滤、乙醇洗涤晶体、干燥,得到。水会溶解少量硫代硫酸钠,为了减少硫代硫酸钠溶解损失,因此用乙醇而不用水洗涤晶体的原因降低硫代硫酸钠溶解度,防止因洗涤而损失产品;乙醇易挥发带走水分;故答案为:冷却结晶;降低硫代硫酸钠溶解度,防止因洗涤而损失产品;乙醇易挥发带走水分。
③根据题意得到关系式,因此产品中物质的量为0.1000mol·L-1×0.02L×2=0.004mol,其质量分数为;故答案为:。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
化学反应原理综合考查
共13题,满分100分
题号 一 二 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请注意保持试卷整洁
一、单选题(共50分)
1.(本题5分)硫酸盐(含、)气溶胶是 PM2.5的成分之一。近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下:
下列说法不正确的是( )
A.该过程有 H2O 参与 B.NO2是生成硫酸盐的还原剂
C.硫酸盐气溶胶呈酸性 D.该过程中有硫氧键生成
2.(本题5分)下列说法中不正确的是
A.离子化合物中可能有非金属元素
B.共价化合物中一定不含有离子键,离子化合物中可能存在共价键
C.吸热反应不一定需要加热就能发生
D.一定条件下lmolN2与3molH2在密闭容器中充分反应可生成2molNH3
3.(本题5分)下列说法正确的是
A.在海轮船壳上镶入锌块保护海轮,利用的是牺牲阳极的阴极保护法
B.KNO3溶液和CH3OONH4溶液均显中性.两溶液中水的电离程度相等
C.若1 molNa2O2与足量水反应产生O2,理论上转移的电子数约为2×6.02×1023
D.用pH 均为2 的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
4.(本题5分)偏二甲肼为价与是常用的火箭推进剂,发生的化学反应如下: ,下列说法不正确的是
A.该反应在任何情况下都能自发进行
B.含有共价键
C.反应中,氧化产物为,还原产物为
D.反应中,生成时,转移
5.(本题5分)坦克的制造材料主要是各种金属的合金,铁便是其中十分重要的一种。下列关于铁的说法中正确的是
A.铁单质只具有还原性,其阳离子只具有氧化性
B.常温下,单质铁与浓硫酸不反应
C.铁元素属于过渡元素,其原子序数为26
D.比较与相同浓度的盐酸反应生成氢气的速率,纯铁比生铁的快
6.(本题5分)氮的氧化物对环境造成了极大的危害,研究消除氮的氧化物的污染是科技工作者的重要课题。如图是研究自由基CNS·与NO的会反应历程,4条反应路径中能量变化如图所示。已知: IM11:IM12:( 虚线表示未形成化学键,实线表示单键、双键等化学键)。下列说法错误的是
A.自由基CNS·的电子式是:
B.反应速率的大小顺序:①>②>③>④
C.反应路径④经过了2个中间体和3个过渡态
D.IM12转化为OCS和N2时,需断裂O-N键和C-N键
7.(本题5分)下列叙述中正确的是
A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
B.常温常压下,氢氧燃料电池放电过程中消耗11.2 L H2,转移电子的数目为6.02×1023
C.工业制粗硅2C(s)+SiO2(s)===Si(s)+2CO(g),室温下不能自发进行,则△H>0
D.稀盐酸和稀氢氧化钠反应的中和热为-57.3 kJ mol-1,则稀醋酸和稀氨水反应的中和热也为-57.3kJ·mol-1
8.(本题5分)等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如图所示,下列叙述正确的是
A.M、N两种金属中较活泼的是N B.生成H2的质量M
9.(本题5分)下列关于无机物应用的叙述正确的是( )
A.湿法脱除烟气中的NO,是利用的氧化性
B.半导体工业中可用氢氟酸除去硅片表面的层,是因为HF具有强酸性
C.法利用溶液脱除烟气中的,是利用溶液呈酸性
D.用氨水除去铜器表面的转化为,是利用的还原性
10.(本题5分)一定温度下,在Ba(OH)2的悬浊液中,存在Ba(OH)2固体与其电离的离子间的溶解平衡关系:Ba(OH)2(s)Ba2+(aq)+2OH-(aq),向此体系中再加入少量的BaO粉末,如果保持温度不变,则下列说法正确的是
A.c(Ba2+)增大
B.溶液中Ba2+数目减少
C.溶液pH减小
D.溶液质量增大
二、解答题(共50分)
11.(本题15分)铁是人类应用最广泛的金属,含铁化合物高铁酸钾是一种新型高效的多功能水处理剂。按照下列要求回答问题:
(1)图中各容器中盛有相同浓度的稀硫酸,铁被腐蚀的速率由快到慢的顺序是
(2)用图示电解装置制备少量高铁酸钾。
则a为电池的 极;铁电极上发生的电极反应式为 。
(3)探究高铁酸钾的稳定性
已知与水缓慢发生反应。
Ⅰ.将适量固体分别溶解于不同pH的水溶液中,配制的试样,测得不同pH下随时间的变化如图所示。
Ⅱ.将适量溶解于pH=4.74的水溶液中,配制的试样,测得不同温度下随时间的变化如图。
①实验Ⅰ所得出的结论是 ﹔请从平衡移动角度解释其原因: 。
②实验Ⅱ的目的是 。
12.(本题15分)铁元素在溶液中主要以Fe2+、Fe3+、Fe(SCN)3、FeO(紫红色)等形式存在。回答下列问题:
(1)向盛有5 mL 0.005 mol/L FeCl3溶液的试管中加入5 mL 0.01 mol/L KSCN溶液,现象是 ,再滴加0.01 mol/L NaOH溶液3 ~5滴,现象是 。
(2)Fe2+与Ag+在溶液中可相互转化。室温时,初始浓度为0.1 mol/LFe(NO3)2溶液中c(Fe3+)随c(Ag+)的变化如下左图所示:
①用离子方程式表示Fe(NO3)2溶液中的转化反应 。
②根据A点数据,计算该转化反应的平衡常数为 。
③利用如上右图所示的装置,证明上述反应的可逆性。闭合电键K,立即观察到的明显现象是 。石墨为电池的 极,通过列式计算说明原因 。
(3)印刷电路板是由高分子材料和铜箔复合而成,制印刷电路时,用FeCl3溶液作为“腐蚀液”,现从腐蚀后的溶液中分离出铁和铜,其方法是:先加H2O2,目的是 ,再加碱调节pH为 时,铁刚好沉淀完全;继续加碱至pH为4.5时,铜开始沉淀。
已知:
化合物 Cu(OH)2 Fe(OH)2 Fe(OH)3
Ksp近似值 10-20 10-17 10-39
(4)K2FeO4具有强氧化性。在K2FeO4溶液中加入过量稀硫酸,观察到有无色无味气体产生,还可观察到的现象是 ;用K2FeO4处理含NH3废水,既可以把NH3氧化为N2防止水体富营养化,又能生成一种净水剂,该反应的离子方程式为 。
13.(本题20分)Na2S2O3用于照相业定影剂、鞣革时重铬酸盐的还原剂等.
(1)Na2S2O3溶液与稀硫酸的反应可探究外界条件对化学反应速率的影响.Na2S2O3溶液与稀硫酸反应的离子方程式为 ;表格中H2O的体积x= ,其中探究温度对化学反应速率的影响的实验是 (填序号).
实验 反应温度/℃ Na2S2O溶液 稀H2SO4 H2O
V/mL c/mol·L-1 V/mL c/mol·L-1 V/mL
Ⅰ 20 10 0.1 10 0.1 0
Ⅱ 20 5 0.2 10 0.2 x
Ⅲ 40 10 0.1 10 0.1 0
(2)工业上可用反应制取Na2S2O3.实验室模拟该工业过程制取Na2S2O3的装置如图所示.
①试管a中的化学方程式为 .
②反应结束后,将试管b中溶液水浴加热浓缩, ,经过滤、乙醇洗涤晶体、干燥,得到。用乙醇而不用水洗涤晶体的原因 .
③测定产品纯度:准确称取mg晶体,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol·L-1碘的标准溶液滴定,反应原理为:。若消耗碘的标准液体积为20.00mL,产品的质量分数为(设相对分子质量为M) (写出计算表达式)
参考答案:
1.B
【详解】A.根据图示中各微粒的构造可知,该过程有H2O参与,选项A正确;
B.根据图示的转化过程,NO2转化为HNO2,N元素的化合价由+4价变为+3价,化合价降低,得电子被还原,做氧化剂,则NO2的是生成硫酸盐的氧化剂,选项B不正确;
C.硫酸盐(含SO、HSO)气溶胶中含有HSO,转化过程有水参与,则HSO在水中可电离生成H+和SO,则硫酸盐气溶胶呈酸性,选项C正确;
D.根据图示转化过程中,由SO转化为HSO,根据图示对照,有硫氧键生成,选项D正确;
答案选B。
2.D
【详解】A、NaOH为离子化合物,其中含有非金属元素O、H,正确;B、共价化合物中一定不含离子键,含有离子键的化合物一定是离子化合物,离子化合物中可能含有共价键,例如NaOH。正确;C、吸热反应不一定需要加热就能发生,例如氯化铵与氢氧化钡反应2NH4Cl(s)+Ba(OH)2·8H2O(s)=BaCl2+2NH3↑+10H2O直接搅拌就可以,该反应吸收大量的热,烧杯杯底沾些水反应后会结冰。正确;D、一定条件下,氮气和氢气生成氨气的反应是可逆反应,可逆反应中存在化学平衡,当正逆反应速率相等时,反应达到平衡状态,导致反应物不能完全转化为生成物。错误;故选D。
点睛:本题重点考查了离子化合物与共价化合物。离子化合物中肯定含有离子键,可能含有共价键。共价化合物中仅含有共价键。
3.A
【详解】A. 在海轮船壳上镶入锌块保护海轮,利用的是原电池原理,属于牺牲阳极的阴极保护法,A正确;B. KNO3溶液和CH3OONH4溶液均显中性.硝酸钾被水解,醋酸铵水解,促进水的电离,B错误;C. 若1 molNa2O2与足量水反应产生O2,理论上转移的电子数约为6.02×1023,C错误;D. 用pH 均为2 的盐酸和醋酸分别中和等物质的量的NaOH,醋酸是弱酸,浓度大于盐酸,消耗醋酸的体积更小,D错误,答案选A。
4.C
【详解】A.该反应是熵增反应,即,又是放热反应,即,则一定小于零,故该反应在任何情况下都能自发进行,故A正确;
B.一个分子中含有11个共价键,则含有11mol共价键,故B正确;
C.反应中,偏二甲肼中N元素化合价由价升高为0价,中N元素化合价由价降低为0价,则既是氧化产物又是还原产物,偏二甲肼中碳元素由价升高为价,为氧化产物,故C错误;
D.中N元素化合价由价降低为0价,生成1mol时消耗,转移8mol,故D正确;
故答案选C。
5.C
【分析】A、最低价态的元素只有还原性,中间价态的元素既有氧化性又有还原性,最高价态的元素只有氧化性;
B、常温下,铁和浓硫酸发生钝化现象;
C、铁是26号元素,属于过渡元素;
D、作原电池负极的金属能加快被腐蚀速率。
【详解】A.亚铁离子的化合价是中间价态,所以亚铁离子有还原性,也有氧化性,选项A错误;
B.常温下,铁和浓硫酸反应生成一层致密的氧化物薄膜而阻止进一步反应,但并不是铁和浓硫酸不反应,选项B错误;
C.铁是26号元素,属于第V III族元素,为过渡元素,选项C正确;
D.纯铁和稀盐酸不能构成原电池,生铁中铁、碳、盐酸构成原电池,铁作负极,作原电池负极的金属能加快被腐蚀速率,所以生铁反应速率比纯铁快,选项D错误;
答案选C。
6.A
【详解】A.自由基中有单电子,则CNS·的电子式是: ,故A项错误;
B.由能量变化曲线可知,活化能大小顺序:④>③>②>①,故反应速率快慢为①>②>③>④, 故B项正确;
C.反应路径④经过的中间体是IM41 、IM42 ,过渡态是TS41、TS42 、TS43 ,故C项正确;
D.对比产物OCS、N2与IM12的结构可知,该转化过程中,需断裂O-N键和C- N键,故D项正确。
故本题选A。
7.C
【详解】A. 若在海轮外壳上附着一些铜块,构成铁铜原电池,铁作负极,加快海轮外壳的腐蚀,故错误;
B. 常温常压下,气体摩尔体积的值发生变化,11.2 L H2的物质的量不是0.5mol,故错误;
C. △G=△H-T△S,气体体积增加, △S>0,室温下不能自发进行,即△G>0,则△H>0,故正确;
D. 醋酸和一水合氨都是弱电解质,其电离都是吸热反应,所以它们反应的中和热不是-57.3kJ·mol-1,D错误;
故合理选项为C。
8.C
【详解】A.根据图像知,M反应的快,M比较活泼,A错误;
B.由图像知,M生成的氢气的质量大,B错误;
C.金属的质量相等,而N生成的氢气的量少,其相对原子质量较大,C正确;
D.由图像知,M反应的快,N反应的慢,D错误;
故选C。
9.A
【分析】本题考查常见无机物的性质及有关反应原理等知识点,意在考查新情景下分析、理解能力和知识整合能力,难度不大。
【详解】A.中氯显价,有较强的氧化性,能将NO氧化为硝酸盐或亚硝酸盐而除去,故A正确;
B.氢氟酸是弱酸,除去是利用与HF发生反应:,故B错误;
C.溶液脱除烟气中的是利用的氧化性,故C错误;
D.该过程未发生氧化还原反应,故D错误;
故选A。
10.B
【详解】向悬浊液中加少量BaO,发生:BaO+H2O=Ba(OH)2 ,消耗水,因为Ba(OH)2 的悬浊液,则溶液中浓度不变,因水减少,则析出Ba(OH)2 ,溶液中Ba2+数目减少,形成该温度下的饱和溶液,A、c(Ba2+)不变,故A错误;B、溶液中Ba2+数目减少,故B正确;C、pH不变,故C错误;D、溶液质量减少;故选B。
点睛:本题考查溶解平衡,为高频考点,侧重于学生的分析能力的考查,题目难度一般,要注意向悬浊液中加少量BaO,发生的反应:BaO+H2O=Ba(OH)2 后溶液中存在溶解平衡,已溶的Ba(OH)2 和末溶的Ba(OH)2 之间形成平衡,从平衡移动的角度分析,就容易理解。
11. ④>②>①>③ 负 Fe-6e-+8OH-=FeO+4H2O 溶液的pH越大,K2FeO4稳定性越强 溶液的碱性越强,c(OH-)越大,促使FeO与水的反应逆向移动 探究温度对K2FeO4稳定性的影响
【详解】(1)图①为化学腐蚀;图②为原电池装置,在酸性条件下Fe比Sn活泼,Fe作负极,被氧化,腐蚀速率加快;图③Zn比Fe活泼,Zn作负极,Fe作正极,被保护,为牺牲阳极的阴极保护法;图④为电解池装置,其中Fe与电源正极相连,作阳极,腐蚀速率加快;金属腐蚀速率大小顺序为:电解池>原电池>化学腐蚀>电化学保护,故填④>②>①>③;
(2)装置为电解池装置,欲制备高铁酸钾,根据比较Fe与中Fe元素的化合价可知,Fe被氧化,作阳极,故Fe与蓄电池正极相连;即a为电源负极,Fe电极的反应式为,故填负、;
(3)①从图中的浓度与pH看出,相同时间下,pH越大,的浓度越高;相同pH下,的浓度随时间的推移而降低,以此得出结论:溶液的pH越大,K2FeO4稳定性越强,其原因是因为增加使可逆反应,平衡向左移动,故填溶液的pH越大,K2FeO4稳定性越强、溶液的碱性越强,c(OH-)越大,促使与水的反应逆向移动;
②从实验Ⅱ的图象中可以看出,其为不同温度下浓度随时间的变化关系,即不同温度下的稳定性与温度的关系,故填探究温度对K2FeO4稳定性的影响;
【点睛】关于图象问题,首先确定横坐标和纵坐标所代表的物理量,坐标系内的曲线表示纵坐标随横坐标的变化而变化的关系,即定一议二,确定一个物理量,讨论其它两个物理量的变化关系。
12. 溶液变红色 溶液红色变浅 Fe2++Ag+Fe3++Ag↓ 3.17 电流计指针发生偏转 正 Q= =>3.17,反应逆向进行,所以石墨电极为正极 将Fe2+氧化为Fe3+ 2.7 溶液由紫红色变为黄色 2FeO+2NH3+2H2O=2Fe(OH)3↓+N2↑+4OH-
【详解】(1)向盛有5 mL 0.005 mol/L FeCl3溶液的试管中加入5 mL 0.01 mol/L KSCN溶液,现象是溶液变红色。再滴加0.01 mol/L NaOH溶液3~5滴,生成氢氧化铁沉淀,铁离子浓度降低,因此现象是溶液红色变浅。(2)①根据图象可知铁离子浓度逐渐增大,说明亚铁离子被银离子氧化,反应的离子方程式为 Fe2++Ag+Fe3++Ag↓。②根据图象可知平衡时铁离子是0.076mol/L,银离子是1mol/L,根据方程式可知消耗亚铁离子是0.076mol/L,所以平衡时亚铁离子浓度是0.1mol/L-0.076mol/L=0.024mol/L,因此该转化反应的平衡常数为。③闭合电键K,构成原电池,立即观察到的明显现象是电流计指针发生偏转。由于Q= =>3.17,反应逆向进行,所以石墨电极为正极,银离子得到电子。(3)印刷电路板是由高分子材料和铜箔复合而成,制印刷电路时,用FeCl3溶液作为“腐蚀液”,现从腐蚀后的溶液中分离出铁和铜,其方法是:
双氧水具有强氧化性,先加H2O2,目的是将Fe2+氧化为Fe3+便于形成氢氧化铁沉淀。根据表中数据可知铁刚好沉淀完全时氢氧根浓度是,因此根据水的离子积常数为10-14可知pH=2.7。(4)K2FeO4具有强氧化性。在K2FeO4溶液中加入过量稀硫酸,观察到有无色无味气体产生,产生的气体是氧气,所以还原产物是铁离子,因此还可观察到的现象是溶液由紫红色变为黄色;用K2FeO4处理含NH3废水,既可以把NH3氧化为N2防止水体富营养化,又能生成一种净水剂,该净水剂是氢氧化铁,反应的离子方程式为 2FeO42-+2NH3+2H2O=2Fe(OH)3↓+N2↑+4OH-。
13. 5 I和Ⅲ 冷却结晶 降低硫代硫酸钠溶解度,防止因洗涤而损失产品;乙醇易挥发带走水分
【详解】(1)Na2S2O3溶液与稀硫酸反应生成硫酸钠、硫单质、二氧化硫和水,其离子方程式为;Ⅰ和Ⅱ探究稀硫酸浓度对反应速率的影响,因此其他量相同即溶液的总体积相同,因此表格中H2O的体积x=5,I和Ⅲ只有温度不相同,其他量相同,因此探究温度对化学反应速率的影响的实验是I和Ⅲ;故答案为:;5;I和Ⅲ。
(2)①试管a中是铜和浓硫酸加热条件下反应生成二氧化硫、硫酸铜和水,其化学方程式为;故答案为:。
②反应结束后,从溶液到晶体,因此要将试管b中溶液水浴加热浓缩,冷却结晶,经过滤、乙醇洗涤晶体、干燥,得到。水会溶解少量硫代硫酸钠,为了减少硫代硫酸钠溶解损失,因此用乙醇而不用水洗涤晶体的原因降低硫代硫酸钠溶解度,防止因洗涤而损失产品;乙醇易挥发带走水分;故答案为:冷却结晶;降低硫代硫酸钠溶解度,防止因洗涤而损失产品;乙醇易挥发带走水分。
③根据题意得到关系式,因此产品中物质的量为0.1000mol·L-1×0.02L×2=0.004mol,其质量分数为;故答案为:。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
