明矾-高考化学考前专项练习试题(含解析)
文档属性
| 名称 | 明矾-高考化学考前专项练习试题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 726.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-13 12:19:37 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
明矾
共18题,满分100分
题号 一 二 三 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请注意保持试卷整洁
一、单选题(共50分)
1.(本题5分)下列物质的性质与用途具有对应关系的是
A.难溶于水,可用于制取
B.溶于水形成胶体,可用作净水剂
C.具有还原性,可作治疗贫血药剂
D.浓硫酸具有吸水性,可以使蔗糖脱水炭化
2.(本题5分)高铁酸钾是一种重要的绿色净水剂,具有净水和消毒双重功能。某课外学习小组设计如图所示方案制备高铁酸钾。下列说法不正确的是
A.高铁酸钾中铁元素的化合价为+6,具有强氧化性
B.氧化过程中,生成2时,转移6
C.高铁酸钠的溶解度大于高铁酸钾的溶解度
D.明矾、硫酸铁、高铁酸钾都能净水,其净水原理完全相同
3.(本题5分)下列物质用途与盐类水解无关的是
A.溶液蚀刻铜板 B.热的纯碱溶液去油污
C.明矾作净水剂 D.小苏打和硫酸铝制泡沫灭火器
4.(本题5分)化学与生活密切相关。下列说法不正确的是
A.双氧水和75%的酒精溶液都可以作消毒剂
B.水玻璃可用于制备黏合剂和防火剂
C.铁粉放在食品袋中作抗氧化剂
D.明矾和蓝矾都可以作饮用水的净水剂
5.(本题5分)有关物质性质或用途的说法正确的是( )
A.浓硫酸具有强氧化性,故不可用作干燥二氧化硫气体
B.明矾可用作净水剂、晶体硅用来制作光导纤维
C.稀硫酸中加入KNO3可使金属铜溶解
D.氯气通入品红溶液中溶液褪色,说明Cl2具有漂白性
6.(本题5分)下列说法正确的是
A.明矾净水时发生了物理及化学变化,明矾能起到杀菌消毒的作用
B.稀豆浆、淀粉溶液、蛋白质溶液均能产生丁达尔效应
C.红宝石、蓝宝石主要成分是氧化铝,而石英玻璃、分子筛的主要成分是硅酸盐
D.日常生活中碱块(Na2CO3·10H2O)变成碱面(Na2CO3)属于风化,是物理变化
7.(本题5分)如图所示为氯元素的“价-类”二维图。下列说法正确的是
A.分别蘸有①的浓溶液和浓氨水的玻璃棒互相靠近会产生白烟
B.⑥中阴离子的空间构型为平面四边形
C.④的电子式为
D.明矾与③的净水原理相同
8.(本题5分)化学与生活息息相关。下列说法正确的是
A.A12O3作耐火材料是因为氧化铝熔点高
B.医疗上,碳酸氢钠是治疗胃穿孔的一种药剂
C.明矾可用于自来水的杀菌消毒
D.水玻璃是纯净物。
9.(本题5分)化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A.明矾与水反应生成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.江河入海口三角洲的形成通常与胶体的性质有关系
C.水泥厂、冶金厂用高压电作用于气溶胶以除去烟尘,是利用了电泳原理
D.《本草纲目》“烧酒”写道:“自元时始创其法,用浓酒和糟入甑,蒸令气……其清如水,味极浓烈,盖酒露也"。这种方法是分液
10.(本题5分)化学与生产、生活密切相关。下列说法正确的是
A.用烧碱溶液除铁锈 B.可用作钡餐
C.冬天应将面团置于温热处发酵 D.铝盐可用作生活用水消毒剂
二、判断题(共20分)
11.(本题4分)明矾水解时产生具有吸附性的胶体粒子,可作漂白剂。(_______)
12.(本题4分)明矾常用作净水剂。(_______)
13.(本题4分)河水中有许多杂质和有害细菌,加入明矾消毒杀菌后可以直接饮用(______)
14.(本题4分)明矾可作净水剂,起到杀菌消毒的作用。(_______)
15.(本题4分)明矾用作净水剂,可以除去废水中的铜离子。(_______)
三、解答题(共30分)
16.(本题10分)明矾可做中药,性味酸涩、寒、有毒。利用废铝制备明矾,并测定其组成,实验过程如下。
Ⅰ.制备明矾
实验步骤如图:
(1)溶解步骤中主要发生的离子反应方程式为 。
(2)用蒸馏水洗涤晶体的操作过程是 。
(3)生活中明矾可用作净水剂,结合离子方程式说明净水原理: 。
Ⅱ.样品中硫酸根的测定
(一)绘制标准硫酸钡悬浊液吸光光谱图
①分别量取0、1.0、2.0、3.0、4.0mL浓度为500μg/mL的标准硫酸钾溶液移入10mL的比色管中,然后分别加入5mL浓度为1g/mL的溶液,用蒸馏水定容。
②用分光光度计测量标准系列(波长采用420nm),数据如下(忽略混合过程中的体积变化)。
(mL) 1.0 2.0 3.0 4.0
蒸馏水体积(mL) 5 a b c 1
浓度(μg/mL) 0 50 100 150 200
吸光值A 0 0.371 0.553 0.778 1.013
③绘制硫酸钡悬浊液的吸光光谱图,绘制如下。
(4)上述实验数据中b= ,m= (保留1位有效数字)。
(二)测定样品中硫酸根浓度
①称取1.018g样品晶体配制成250mL的样品溶液。
②量取1.0mL样品溶液移入10mL的比色管中,然后加入5mL浓度为1g/mL的溶液,用蒸馏水定容,测得样品的吸光值为0.858。
(5)测得样品中硫酸根的质量分数为 %(保留2位有效数字)。
(6)实验测得硫酸根的含量小于理论值,可能的原因有_______(填标号)。
A.实验Ⅰ制得样品中有杂质 B.实验中所用标准硫酸钾溶液浓度偏大
C.样品溶液配制过程中,定容仰视读数 D.样品溶液配制过程中,容量瓶未润洗
17.(本题10分)某研究性学习小组模拟工业生产过程进行实验。请回答下列问题:
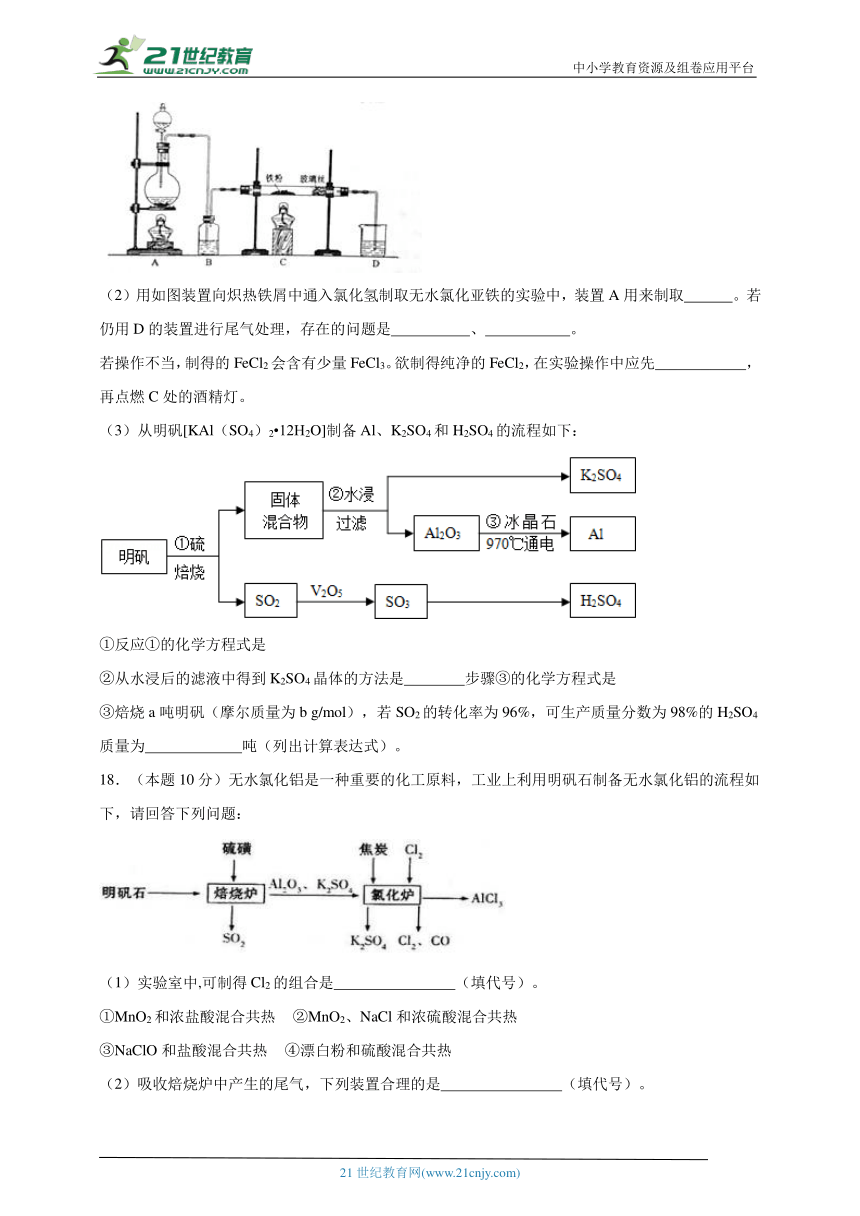
(1)用如图所示的装置向500—600℃的铁屑中通入氯气制取无水氯化铁的实验中,实验开始前应如何检查装置的气密性 。
(2)用如图装置向炽热铁屑中通入氯化氢制取无水氯化亚铁的实验中,装置A用来制取 。若仍用D的装置进行尾气处理,存在的问题是 、 。
若操作不当,制得的FeCl2会含有少量FeCl3。欲制得纯净的FeCl2,在实验操作中应先 ,再点燃C处的酒精灯。
(3)从明矾[KAl(SO4)2 12H2O]制备Al、K2SO4和H2SO4的流程如下:
①反应①的化学方程式是
②从水浸后的滤液中得到K2SO4晶体的方法是 步骤③的化学方程式是
③焙烧a吨明矾(摩尔质量为b g/mol),若SO2的转化率为96%,可生产质量分数为98%的H2SO4质量为 吨(列出计算表达式)。
18.(本题10分)无水氯化铝是一种重要的化工原料,工业上利用明矾石制备无水氯化铝的流程如下,请回答下列问题:
(1)实验室中,可制得Cl2的组合是 (填代号)。
①MnO2和浓盐酸混合共热 ②MnO2、NaCl和浓硫酸混合共热
③NaClO和盐酸混合共热 ④漂白粉和硫酸混合共热
(2)吸收焙烧炉中产生的尾气,下列装置合理的是 (填代号)。
(3)写出氧化炉中反应的化学方程式 。
(4)生产氯化铝的过程中焙烧炉和氯化炉中产生的SO2、Cl2等大气污染物,若将二者按照一定比例通入水中可减少污染。试设计简单实验检验二者是否恰好完全反应,简要描述实验步骤、现象和结论 (仪器自选)。
可供选择试剂如下:
①滴加酚酞的氢氧化钠溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液
(5)某同学设计用如下装置验证二氧化硫的某些化学性质。
① 能说明二氧化硫具有氧化性的实验现象为 。
② 写出a瓶中发生反应的离子方程式 。
③ 充分反应后,取a瓶中的溶液分成三份,分别进行如下实验。
实验I:向第一份溶液中加入足量的NaOH溶液,生成白色沉淀,迅速变为灰绿色,最终变为红褐色。
实验II:向第二份溶液中加入少量KMnO4溶液,紫色褪去。
实验III:向第三份溶液中加入BaCl2溶液,生成白色沉淀。
上述实验中能充分证明二氧化硫具有还原性的是 (填实验代号)。
参考答案:
1.B
【详解】A.BaSO4可以和C在高温条件下反应生成BaS和CO,用于制取BaS,利用的是BaSO4的氧化性,与BaSO4难溶于水无对应关系,选项A不符合题意;
B.明矾[KAl(SO4)2·12H2O ]在水中能形成Al(OH)3胶体,胶体能吸附水中杂质形成沉淀,可用作净水剂,选项B符合题意;
C.FeSO4中的亚铁离子能与血红蛋白结合,从而改善贫血症状,可作治疗贫血药剂,与FeSO4具有还原性无对应关系,选项C不符合题意;
D.浓硫酸具有脱水性,使蔗糖脱水碳化,与吸水性无关,选项D不符合题意;
故答案为:B。
2.D
【分析】氢氧化钠生成次氯酸钠,次氯酸钠和硝酸铁生成高铁酸钠加入氢氧化钾得到高铁酸钾;
【详解】A.K2FeO4中K为+1价、O为-2价,由化合价代数和为0可知Fe元素化合价为+6价,Fe元素为+6价,为最高价,具有强氧化性,A正确;
B.Fe元素的化合价从+3价升高到+6价,生成2 mol FeO42-时,转移6 mol 电子,B正确;
C.加入KOH,反应向溶解度小的方向进行,生成K2FeO4,说明K2FeO4溶解度更小,即高铁酸钠的溶解度大于高铁酸钾的溶解度,C正确;
D.K2FeO4具有强氧化性,可用于消毒杀菌;明矾、硫酸铁能形成胶体吸附净水,净水原理不相同,D错误;
故选D。
3.A
【详解】A.FeCl3蚀刻铜板,发生2Fe3++Cu=2Fe2++Cu2+,与盐类水解无关,故A符合题意;
B.油污能与NaOH反应生成可溶于水的物质,纯碱溶液中存在,加热促进水解,碱性增强,去油污能力增强,该用途与盐类水解有关,故B不符合题意;
C.明矾是KAl(SO4)2·12H2O,Al3+水解成氢氧化铝胶体,氢氧化铝胶体吸附水中悬浮固体小颗粒,胶体沉淀,达到净水的目的,与盐类水解有关,故C不符合题意;
D.小苏打与硫酸铝溶液反应6NaHCO3+Al2(SO4)3=2Al(OH)3↓+6CO2↑+3Na2SO4,发生双水解反应,与盐类水解有关,故D不符合题意;
答案为A。
4.D
【详解】双氧水、75%的酒精溶液都能够使蛋白质变性,可以作消毒剂,A正确;水玻璃主要成分为硅酸钠溶液,它不能燃烧,具有粘性,可以做黏合剂和防火剂,B正确;铁粉能够与氧气反应,放在食品袋中作抗氧化剂,C正确;明矾为十二水合硫酸铝钾晶体,可做净水剂;蓝矾为硫酸铜晶体,为重金属盐,能够使蛋白质变性,有毒不能作为饮用水的净水剂,D错误;正确选项D。
5.C
【详解】A. 二氧化硫中的硫为+4价,浓硫酸中的硫为+6价,二者之间不能反应,故浓硫酸可干燥SO2气体,A项错误;
B. 用来制作光导纤维的是二氧化硅晶体,B项错误;
C. 稀硫酸中加入硝酸钾相当于稀硝酸,故可溶解金属Cu,C项正确;
D. 氯气本身无漂白性,D项错误;
答案选C。
6.B
【详解】A. 明矾水解生成的氢氧化铝胶体能吸附除去水中的悬浮杂质,明矾不能起到杀菌消毒的作用,故A错误;B. 稀豆浆、淀粉溶液、蛋白质溶液都是胶体,均能产生丁达尔效应,故B正确;C. 石英玻璃的主要成分是二氧化硅,故C错误;D.碱块与碱面是不同的物质,风化产生了新物质,是化学变化,故D错误。故选B。
7.A
【详解】A.如图所示,①是,②是,③是,④是,⑤是次氯酸盐,⑥是。蘸有浓盐酸和浓氨水的玻璃棒靠近会产生白烟,A项正确;
B.中氯原子价层电子对数为4+=4、没有孤电子对,故其空间构型是:正四面体,B项错误;
C.的电子式为,C项错误;
D.明矾和均可用作净水剂,明矾水解生成的氢氧化铝胶体可以吸附水中的悬浮物,达到净水的目的,二氧化氯净水是利用其强氧化性杀死水中的细菌和病毒,原理不同,D项错误;
答案选A。
8.A
【分析】氧化铝为离子晶体,熔点高;碳酸氢钠能和胃中的盐酸反应生成CO2气体;明矾没有强氧化性,不能杀菌消毒;水玻璃是硅酸钠的水溶液,属于混合物。
【详解】氧化铝熔点高,常用作耐火材料,A正确;碳酸氢钠能和胃中的盐酸反应生成CO2气体,CO2气体会加速胃穿孔,B错误;明矾溶于水,电离出铝离子,铝离子在溶液中水解生成氢氧化铝胶体,胶体能净水,但明矾没有强氧化性,不能杀菌消毒,C错误;水玻璃是硅酸钠水溶液,属于混合物,D错误。
故选A。
【点睛】本题考查了物质的性质与用途,把握物质的性质、发生的反应、性质与用途的关系为解答的关键。
9.D
【详解】A.明矾净水的原理是Al3+水解生成的Al(OH)3胶体能吸附水中悬浮物,故A正确;
B.江河中的泥沙属于胶体分散系,江河入海口三角洲的形成与胶体的聚沉性质有关,故B正确;
C.烟尘是气溶胶,胶粒在电场中发生定向移动,是利用了电泳原理,故C正确;
D.乙醇蒸发再冷凝,应该蒸馏操作,故D错误;
故答案为D。
10.C
【详解】A.氢氧化钠和氧化铁不反应,不能用烧碱溶液除铁锈,故A错误;
B.能溶于胃酸,不能用作钡餐,BaSO4用作钡餐,故B错误;
C.升高温度加快面团发酵速率,冬天应将面团置于温热处发酵,故C正确;
D.铝盐用作生活用水净水剂,不能用作消毒剂,故D错误;
选C。
11.错误
【详解】明矾[KAl(SO4)2 12H2O]作为净水剂是因为明矾溶于水发生水解反应,反应的离子方程式为:Al3++3H2OAl(OH)3+3H+,生成氢氧化铝胶体,氢氧化铝胶体可以吸附杂质,明矾不具有漂白性,不能作漂白剂,故错误。
12.正确
【详解】明矾是KAl(SO4)2 12H2O,溶于水电离出来的Al3+能发生水解生成氢氧化铝胶体,胶体具有吸附性,可以吸附水中的悬浮杂质从而净水,正确。
13.错误
【分析】根据明矾的作用及细菌的处理方法进行判断。
【详解】明矾可以净水,不能杀菌消毒,故本题叙述错误。
【点睛】细菌成分是蛋白质,利用蛋白质变性进行杀菌。
14.错误
【详解】明矾溶于水,在水中电离产生的Al3+发生水解作用产生Al(OH)3胶体,其表面积大,吸附力强,能够吸附水中悬浮的固体小颗粒,使之形成沉淀而从水中析出,从而具有净水作用,故明矾可用作净水剂。但水解产生的Al(OH)3胶体不具有强氧化性,不能起到杀菌消毒的作用,只能作净水剂,而不能起杀菌消毒作用,故上述说法是错误的。
15.错误
【详解】明矾电离产生的Al3+在水中发生水解作用产生Al(OH)3胶体,其表面积大,吸附力强,能够吸附水中悬浮的固体小颗粒,使之形成沉淀而从水中析出,从而具有净水作用,因此明矾可用作净水剂,但其只能吸附水中悬浮的固体小颗粒,而不能吸附溶于水的Cu2+,因此不能除去废水中的铜离子,故上述说法是错误的。
16.(1)
(2)向过滤器中注入蒸馏水,使其完全浸没晶体,待蒸馏水自然流尽后,重复操作2~3次
(3),形成的胶体具有吸附性,能吸附水中的悬浮物共同沉降
(4) 3 0.005
(5)39
(6)BC
【分析】废铝在KOH溶液中溶解得到偏铝酸钾溶液,过滤除去不溶性杂质,向溶液中加入稀硫酸,偏铝酸钾与稀硫酸反应得到含有SO、K+、Al3+的溶液,浓缩后,冰水浴冷却结晶,经过滤、洗涤、干燥得到产品。
【详解】(1)溶解过程中主要反应为Al和KOH溶液的反应,离子方程式为;
(2)用蒸馏水洗涤晶体的一般操作为:向过滤器中注入蒸馏水,使其完全浸没晶体,待蒸馏水自然流尽后,重复操作2~3次;
(3)铝离子水解,形成的胶体具有吸附性,能吸附水中的悬浮物共同沉降;
(4)各组数据中所用溶液总体积应相等,所以,得;将代入可得,解得,故答案为:3;0.005;
(5)将代入,解得,所以样品中硫酸根的质量分数为,故答案为:39;
(6)A.中硫酸根的质量分数大于明矾,所以若样品中有杂质会导致结果偏高,A不符合题意;
B.实验中所用标准硫酸钾溶液浓度偏大,则导致吸光光谱图整体向左平移,所以同样的吸光值,会使相应的硫酸根浓度偏小,B符合题意;
C.样品溶液配制过程中,定容仰视读数,导致样品溶液被稀释,硫酸根的浓度减小,测定的吸光值偏小,则计算得到的硫酸根的质量分数偏小,C符合题意;
D.样品溶液配制过程中,容量瓶未润洗,对结果无影响,D不符合题意;
综上所述,答案为:BC。
17. 把B、D中导管下端浸入水中,用酒精灯给烧瓶微热,看到B、D中导管下口有气泡冒出,停止加热后,有一段稳定的水柱,说明装置不漏气 HCl 易发生倒吸 缺少防止水蒸气进入C中装置 通入氯化氢(赶尽装置中的空气) 4KAl(SO4)2 12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O 蒸发结晶 2Al2O34Al+3O2↑ 216a/b
【详解】试题分析:(1)检查气密性需要将导管放入水中,并将分液漏斗的活塞关闭,再用酒精灯加热,看到B、D中导管下口有气泡冒出,停止加热后,有一段稳定的水柱,说明装置不漏气;(2)因为是铁和氯化氢反应制取无水氯化亚铁,所以装置A是制取氯化氢的;因为氯化氢极易溶于水,所以易发生倒吸,缺少防止水蒸气进入C中装置。氯化亚铁变氯化铁是因为有氧化剂存在,所以应该先通入氯化氢,赶尽装置中的空气。(3)①通过流程分析,焙烧生成的产物有硫酸钾,氧化铝,二氧化硫和水,所以方程式为:4KAl(SO4)2 12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O。②滤液中得到硫酸钾,得到硫酸钾晶体的方法为蒸发结晶;步骤③为氧化铝电解生成铝和氧气,方程式为:2Al2O34Al+3O2↑ 。③硫酸的质量=。
考点:物质的制备实验,根据化学方程式的计算
18. ①②③④ ad Al2O3+3C+3Cl22AlCl3+3CO 取所得溶液少许置于试管中,滴加品红溶液,若品红溶液不褪色,说明二者恰好完全反应;否则二者未完全反应。 b中出现淡黄色浑浊 2Fe3++SO2+2H2O=SO42-+2Fe2++4H+ Ⅰ和Ⅱ
【详解】(1)MnO2和浓盐酸混合共热生成氯气;NaCl和浓硫酸混合共热生成氯化氢,所以MnO2、NaCl和浓硫酸混合共热可以生成氯气;NaClO和盐酸混合共热发生归中反应,生成氯气;漂白粉和硫酸混合共热,发生归中反应,生成氯气,答案选①②③④;
(2)吸收焙烧炉中产生的尾气是二氧化硫,吸收装置需要防倒吸,b装置的防倒吸装置安全瓶的导管错误,c无防倒吸装置,答案选ad;
(3)根据图示,氧化炉中反应物是氧化铝、碳和氯气,生成物是氯化铝和一氧化碳,反应的化学方程式Al2O3+3C+3Cl22AlCl3+3CO;
(4)SO2、Cl2按照一定比例通入水中生成硫酸和盐酸,可减少污染,SO2、Cl2都能使品红褪色,检验二者是否恰好完全反应,可以取所得溶液少许置于试管中,滴加品红溶液,若品红溶液不褪色,说明二者恰好完全反应;否则二者未完全反应;
(5)① 二氧化硫与硫化钠反应生成硫沉淀,表现二氧化硫的氧化性,能说明二氧化硫具有氧化性的实验现象为b中出现淡黄色浑浊;
② a瓶中发生反应是铁离子氧化二氧化硫,反应的离子方程式2Fe3++SO2+2H2O=SO42-+2Fe2++4H+;
③向第一份溶液中加入足量的NaOH溶液,生成白色沉淀,迅速变为灰绿色,最终变为红褐色,说明第一份溶液中含有亚铁离子,能证明二氧化硫具有还原性;KMnO4溶液褪色,说明有还原性物质;原溶液含有硫酸根离子,加入BaCl2溶液生成白色沉淀,不能证明二氧化硫具有还原性。答案选Ⅰ和Ⅱ。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
明矾
共18题,满分100分
题号 一 二 三 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请注意保持试卷整洁
一、单选题(共50分)
1.(本题5分)下列物质的性质与用途具有对应关系的是
A.难溶于水,可用于制取
B.溶于水形成胶体,可用作净水剂
C.具有还原性,可作治疗贫血药剂
D.浓硫酸具有吸水性,可以使蔗糖脱水炭化
2.(本题5分)高铁酸钾是一种重要的绿色净水剂,具有净水和消毒双重功能。某课外学习小组设计如图所示方案制备高铁酸钾。下列说法不正确的是
A.高铁酸钾中铁元素的化合价为+6,具有强氧化性
B.氧化过程中,生成2时,转移6
C.高铁酸钠的溶解度大于高铁酸钾的溶解度
D.明矾、硫酸铁、高铁酸钾都能净水,其净水原理完全相同
3.(本题5分)下列物质用途与盐类水解无关的是
A.溶液蚀刻铜板 B.热的纯碱溶液去油污
C.明矾作净水剂 D.小苏打和硫酸铝制泡沫灭火器
4.(本题5分)化学与生活密切相关。下列说法不正确的是
A.双氧水和75%的酒精溶液都可以作消毒剂
B.水玻璃可用于制备黏合剂和防火剂
C.铁粉放在食品袋中作抗氧化剂
D.明矾和蓝矾都可以作饮用水的净水剂
5.(本题5分)有关物质性质或用途的说法正确的是( )
A.浓硫酸具有强氧化性,故不可用作干燥二氧化硫气体
B.明矾可用作净水剂、晶体硅用来制作光导纤维
C.稀硫酸中加入KNO3可使金属铜溶解
D.氯气通入品红溶液中溶液褪色,说明Cl2具有漂白性
6.(本题5分)下列说法正确的是
A.明矾净水时发生了物理及化学变化,明矾能起到杀菌消毒的作用
B.稀豆浆、淀粉溶液、蛋白质溶液均能产生丁达尔效应
C.红宝石、蓝宝石主要成分是氧化铝,而石英玻璃、分子筛的主要成分是硅酸盐
D.日常生活中碱块(Na2CO3·10H2O)变成碱面(Na2CO3)属于风化,是物理变化
7.(本题5分)如图所示为氯元素的“价-类”二维图。下列说法正确的是
A.分别蘸有①的浓溶液和浓氨水的玻璃棒互相靠近会产生白烟
B.⑥中阴离子的空间构型为平面四边形
C.④的电子式为
D.明矾与③的净水原理相同
8.(本题5分)化学与生活息息相关。下列说法正确的是
A.A12O3作耐火材料是因为氧化铝熔点高
B.医疗上,碳酸氢钠是治疗胃穿孔的一种药剂
C.明矾可用于自来水的杀菌消毒
D.水玻璃是纯净物。
9.(本题5分)化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A.明矾与水反应生成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.江河入海口三角洲的形成通常与胶体的性质有关系
C.水泥厂、冶金厂用高压电作用于气溶胶以除去烟尘,是利用了电泳原理
D.《本草纲目》“烧酒”写道:“自元时始创其法,用浓酒和糟入甑,蒸令气……其清如水,味极浓烈,盖酒露也"。这种方法是分液
10.(本题5分)化学与生产、生活密切相关。下列说法正确的是
A.用烧碱溶液除铁锈 B.可用作钡餐
C.冬天应将面团置于温热处发酵 D.铝盐可用作生活用水消毒剂
二、判断题(共20分)
11.(本题4分)明矾水解时产生具有吸附性的胶体粒子,可作漂白剂。(_______)
12.(本题4分)明矾常用作净水剂。(_______)
13.(本题4分)河水中有许多杂质和有害细菌,加入明矾消毒杀菌后可以直接饮用(______)
14.(本题4分)明矾可作净水剂,起到杀菌消毒的作用。(_______)
15.(本题4分)明矾用作净水剂,可以除去废水中的铜离子。(_______)
三、解答题(共30分)
16.(本题10分)明矾可做中药,性味酸涩、寒、有毒。利用废铝制备明矾,并测定其组成,实验过程如下。
Ⅰ.制备明矾
实验步骤如图:
(1)溶解步骤中主要发生的离子反应方程式为 。
(2)用蒸馏水洗涤晶体的操作过程是 。
(3)生活中明矾可用作净水剂,结合离子方程式说明净水原理: 。
Ⅱ.样品中硫酸根的测定
(一)绘制标准硫酸钡悬浊液吸光光谱图
①分别量取0、1.0、2.0、3.0、4.0mL浓度为500μg/mL的标准硫酸钾溶液移入10mL的比色管中,然后分别加入5mL浓度为1g/mL的溶液,用蒸馏水定容。
②用分光光度计测量标准系列(波长采用420nm),数据如下(忽略混合过程中的体积变化)。
(mL) 1.0 2.0 3.0 4.0
蒸馏水体积(mL) 5 a b c 1
浓度(μg/mL) 0 50 100 150 200
吸光值A 0 0.371 0.553 0.778 1.013
③绘制硫酸钡悬浊液的吸光光谱图,绘制如下。
(4)上述实验数据中b= ,m= (保留1位有效数字)。
(二)测定样品中硫酸根浓度
①称取1.018g样品晶体配制成250mL的样品溶液。
②量取1.0mL样品溶液移入10mL的比色管中,然后加入5mL浓度为1g/mL的溶液,用蒸馏水定容,测得样品的吸光值为0.858。
(5)测得样品中硫酸根的质量分数为 %(保留2位有效数字)。
(6)实验测得硫酸根的含量小于理论值,可能的原因有_______(填标号)。
A.实验Ⅰ制得样品中有杂质 B.实验中所用标准硫酸钾溶液浓度偏大
C.样品溶液配制过程中,定容仰视读数 D.样品溶液配制过程中,容量瓶未润洗
17.(本题10分)某研究性学习小组模拟工业生产过程进行实验。请回答下列问题:
(1)用如图所示的装置向500—600℃的铁屑中通入氯气制取无水氯化铁的实验中,实验开始前应如何检查装置的气密性 。
(2)用如图装置向炽热铁屑中通入氯化氢制取无水氯化亚铁的实验中,装置A用来制取 。若仍用D的装置进行尾气处理,存在的问题是 、 。
若操作不当,制得的FeCl2会含有少量FeCl3。欲制得纯净的FeCl2,在实验操作中应先 ,再点燃C处的酒精灯。
(3)从明矾[KAl(SO4)2 12H2O]制备Al、K2SO4和H2SO4的流程如下:
①反应①的化学方程式是
②从水浸后的滤液中得到K2SO4晶体的方法是 步骤③的化学方程式是
③焙烧a吨明矾(摩尔质量为b g/mol),若SO2的转化率为96%,可生产质量分数为98%的H2SO4质量为 吨(列出计算表达式)。
18.(本题10分)无水氯化铝是一种重要的化工原料,工业上利用明矾石制备无水氯化铝的流程如下,请回答下列问题:
(1)实验室中,可制得Cl2的组合是 (填代号)。
①MnO2和浓盐酸混合共热 ②MnO2、NaCl和浓硫酸混合共热
③NaClO和盐酸混合共热 ④漂白粉和硫酸混合共热
(2)吸收焙烧炉中产生的尾气,下列装置合理的是 (填代号)。
(3)写出氧化炉中反应的化学方程式 。
(4)生产氯化铝的过程中焙烧炉和氯化炉中产生的SO2、Cl2等大气污染物,若将二者按照一定比例通入水中可减少污染。试设计简单实验检验二者是否恰好完全反应,简要描述实验步骤、现象和结论 (仪器自选)。
可供选择试剂如下:
①滴加酚酞的氢氧化钠溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液
(5)某同学设计用如下装置验证二氧化硫的某些化学性质。
① 能说明二氧化硫具有氧化性的实验现象为 。
② 写出a瓶中发生反应的离子方程式 。
③ 充分反应后,取a瓶中的溶液分成三份,分别进行如下实验。
实验I:向第一份溶液中加入足量的NaOH溶液,生成白色沉淀,迅速变为灰绿色,最终变为红褐色。
实验II:向第二份溶液中加入少量KMnO4溶液,紫色褪去。
实验III:向第三份溶液中加入BaCl2溶液,生成白色沉淀。
上述实验中能充分证明二氧化硫具有还原性的是 (填实验代号)。
参考答案:
1.B
【详解】A.BaSO4可以和C在高温条件下反应生成BaS和CO,用于制取BaS,利用的是BaSO4的氧化性,与BaSO4难溶于水无对应关系,选项A不符合题意;
B.明矾[KAl(SO4)2·12H2O ]在水中能形成Al(OH)3胶体,胶体能吸附水中杂质形成沉淀,可用作净水剂,选项B符合题意;
C.FeSO4中的亚铁离子能与血红蛋白结合,从而改善贫血症状,可作治疗贫血药剂,与FeSO4具有还原性无对应关系,选项C不符合题意;
D.浓硫酸具有脱水性,使蔗糖脱水碳化,与吸水性无关,选项D不符合题意;
故答案为:B。
2.D
【分析】氢氧化钠生成次氯酸钠,次氯酸钠和硝酸铁生成高铁酸钠加入氢氧化钾得到高铁酸钾;
【详解】A.K2FeO4中K为+1价、O为-2价,由化合价代数和为0可知Fe元素化合价为+6价,Fe元素为+6价,为最高价,具有强氧化性,A正确;
B.Fe元素的化合价从+3价升高到+6价,生成2 mol FeO42-时,转移6 mol 电子,B正确;
C.加入KOH,反应向溶解度小的方向进行,生成K2FeO4,说明K2FeO4溶解度更小,即高铁酸钠的溶解度大于高铁酸钾的溶解度,C正确;
D.K2FeO4具有强氧化性,可用于消毒杀菌;明矾、硫酸铁能形成胶体吸附净水,净水原理不相同,D错误;
故选D。
3.A
【详解】A.FeCl3蚀刻铜板,发生2Fe3++Cu=2Fe2++Cu2+,与盐类水解无关,故A符合题意;
B.油污能与NaOH反应生成可溶于水的物质,纯碱溶液中存在,加热促进水解,碱性增强,去油污能力增强,该用途与盐类水解有关,故B不符合题意;
C.明矾是KAl(SO4)2·12H2O,Al3+水解成氢氧化铝胶体,氢氧化铝胶体吸附水中悬浮固体小颗粒,胶体沉淀,达到净水的目的,与盐类水解有关,故C不符合题意;
D.小苏打与硫酸铝溶液反应6NaHCO3+Al2(SO4)3=2Al(OH)3↓+6CO2↑+3Na2SO4,发生双水解反应,与盐类水解有关,故D不符合题意;
答案为A。
4.D
【详解】双氧水、75%的酒精溶液都能够使蛋白质变性,可以作消毒剂,A正确;水玻璃主要成分为硅酸钠溶液,它不能燃烧,具有粘性,可以做黏合剂和防火剂,B正确;铁粉能够与氧气反应,放在食品袋中作抗氧化剂,C正确;明矾为十二水合硫酸铝钾晶体,可做净水剂;蓝矾为硫酸铜晶体,为重金属盐,能够使蛋白质变性,有毒不能作为饮用水的净水剂,D错误;正确选项D。
5.C
【详解】A. 二氧化硫中的硫为+4价,浓硫酸中的硫为+6价,二者之间不能反应,故浓硫酸可干燥SO2气体,A项错误;
B. 用来制作光导纤维的是二氧化硅晶体,B项错误;
C. 稀硫酸中加入硝酸钾相当于稀硝酸,故可溶解金属Cu,C项正确;
D. 氯气本身无漂白性,D项错误;
答案选C。
6.B
【详解】A. 明矾水解生成的氢氧化铝胶体能吸附除去水中的悬浮杂质,明矾不能起到杀菌消毒的作用,故A错误;B. 稀豆浆、淀粉溶液、蛋白质溶液都是胶体,均能产生丁达尔效应,故B正确;C. 石英玻璃的主要成分是二氧化硅,故C错误;D.碱块与碱面是不同的物质,风化产生了新物质,是化学变化,故D错误。故选B。
7.A
【详解】A.如图所示,①是,②是,③是,④是,⑤是次氯酸盐,⑥是。蘸有浓盐酸和浓氨水的玻璃棒靠近会产生白烟,A项正确;
B.中氯原子价层电子对数为4+=4、没有孤电子对,故其空间构型是:正四面体,B项错误;
C.的电子式为,C项错误;
D.明矾和均可用作净水剂,明矾水解生成的氢氧化铝胶体可以吸附水中的悬浮物,达到净水的目的,二氧化氯净水是利用其强氧化性杀死水中的细菌和病毒,原理不同,D项错误;
答案选A。
8.A
【分析】氧化铝为离子晶体,熔点高;碳酸氢钠能和胃中的盐酸反应生成CO2气体;明矾没有强氧化性,不能杀菌消毒;水玻璃是硅酸钠的水溶液,属于混合物。
【详解】氧化铝熔点高,常用作耐火材料,A正确;碳酸氢钠能和胃中的盐酸反应生成CO2气体,CO2气体会加速胃穿孔,B错误;明矾溶于水,电离出铝离子,铝离子在溶液中水解生成氢氧化铝胶体,胶体能净水,但明矾没有强氧化性,不能杀菌消毒,C错误;水玻璃是硅酸钠水溶液,属于混合物,D错误。
故选A。
【点睛】本题考查了物质的性质与用途,把握物质的性质、发生的反应、性质与用途的关系为解答的关键。
9.D
【详解】A.明矾净水的原理是Al3+水解生成的Al(OH)3胶体能吸附水中悬浮物,故A正确;
B.江河中的泥沙属于胶体分散系,江河入海口三角洲的形成与胶体的聚沉性质有关,故B正确;
C.烟尘是气溶胶,胶粒在电场中发生定向移动,是利用了电泳原理,故C正确;
D.乙醇蒸发再冷凝,应该蒸馏操作,故D错误;
故答案为D。
10.C
【详解】A.氢氧化钠和氧化铁不反应,不能用烧碱溶液除铁锈,故A错误;
B.能溶于胃酸,不能用作钡餐,BaSO4用作钡餐,故B错误;
C.升高温度加快面团发酵速率,冬天应将面团置于温热处发酵,故C正确;
D.铝盐用作生活用水净水剂,不能用作消毒剂,故D错误;
选C。
11.错误
【详解】明矾[KAl(SO4)2 12H2O]作为净水剂是因为明矾溶于水发生水解反应,反应的离子方程式为:Al3++3H2OAl(OH)3+3H+,生成氢氧化铝胶体,氢氧化铝胶体可以吸附杂质,明矾不具有漂白性,不能作漂白剂,故错误。
12.正确
【详解】明矾是KAl(SO4)2 12H2O,溶于水电离出来的Al3+能发生水解生成氢氧化铝胶体,胶体具有吸附性,可以吸附水中的悬浮杂质从而净水,正确。
13.错误
【分析】根据明矾的作用及细菌的处理方法进行判断。
【详解】明矾可以净水,不能杀菌消毒,故本题叙述错误。
【点睛】细菌成分是蛋白质,利用蛋白质变性进行杀菌。
14.错误
【详解】明矾溶于水,在水中电离产生的Al3+发生水解作用产生Al(OH)3胶体,其表面积大,吸附力强,能够吸附水中悬浮的固体小颗粒,使之形成沉淀而从水中析出,从而具有净水作用,故明矾可用作净水剂。但水解产生的Al(OH)3胶体不具有强氧化性,不能起到杀菌消毒的作用,只能作净水剂,而不能起杀菌消毒作用,故上述说法是错误的。
15.错误
【详解】明矾电离产生的Al3+在水中发生水解作用产生Al(OH)3胶体,其表面积大,吸附力强,能够吸附水中悬浮的固体小颗粒,使之形成沉淀而从水中析出,从而具有净水作用,因此明矾可用作净水剂,但其只能吸附水中悬浮的固体小颗粒,而不能吸附溶于水的Cu2+,因此不能除去废水中的铜离子,故上述说法是错误的。
16.(1)
(2)向过滤器中注入蒸馏水,使其完全浸没晶体,待蒸馏水自然流尽后,重复操作2~3次
(3),形成的胶体具有吸附性,能吸附水中的悬浮物共同沉降
(4) 3 0.005
(5)39
(6)BC
【分析】废铝在KOH溶液中溶解得到偏铝酸钾溶液,过滤除去不溶性杂质,向溶液中加入稀硫酸,偏铝酸钾与稀硫酸反应得到含有SO、K+、Al3+的溶液,浓缩后,冰水浴冷却结晶,经过滤、洗涤、干燥得到产品。
【详解】(1)溶解过程中主要反应为Al和KOH溶液的反应,离子方程式为;
(2)用蒸馏水洗涤晶体的一般操作为:向过滤器中注入蒸馏水,使其完全浸没晶体,待蒸馏水自然流尽后,重复操作2~3次;
(3)铝离子水解,形成的胶体具有吸附性,能吸附水中的悬浮物共同沉降;
(4)各组数据中所用溶液总体积应相等,所以,得;将代入可得,解得,故答案为:3;0.005;
(5)将代入,解得,所以样品中硫酸根的质量分数为,故答案为:39;
(6)A.中硫酸根的质量分数大于明矾,所以若样品中有杂质会导致结果偏高,A不符合题意;
B.实验中所用标准硫酸钾溶液浓度偏大,则导致吸光光谱图整体向左平移,所以同样的吸光值,会使相应的硫酸根浓度偏小,B符合题意;
C.样品溶液配制过程中,定容仰视读数,导致样品溶液被稀释,硫酸根的浓度减小,测定的吸光值偏小,则计算得到的硫酸根的质量分数偏小,C符合题意;
D.样品溶液配制过程中,容量瓶未润洗,对结果无影响,D不符合题意;
综上所述,答案为:BC。
17. 把B、D中导管下端浸入水中,用酒精灯给烧瓶微热,看到B、D中导管下口有气泡冒出,停止加热后,有一段稳定的水柱,说明装置不漏气 HCl 易发生倒吸 缺少防止水蒸气进入C中装置 通入氯化氢(赶尽装置中的空气) 4KAl(SO4)2 12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O 蒸发结晶 2Al2O34Al+3O2↑ 216a/b
【详解】试题分析:(1)检查气密性需要将导管放入水中,并将分液漏斗的活塞关闭,再用酒精灯加热,看到B、D中导管下口有气泡冒出,停止加热后,有一段稳定的水柱,说明装置不漏气;(2)因为是铁和氯化氢反应制取无水氯化亚铁,所以装置A是制取氯化氢的;因为氯化氢极易溶于水,所以易发生倒吸,缺少防止水蒸气进入C中装置。氯化亚铁变氯化铁是因为有氧化剂存在,所以应该先通入氯化氢,赶尽装置中的空气。(3)①通过流程分析,焙烧生成的产物有硫酸钾,氧化铝,二氧化硫和水,所以方程式为:4KAl(SO4)2 12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O。②滤液中得到硫酸钾,得到硫酸钾晶体的方法为蒸发结晶;步骤③为氧化铝电解生成铝和氧气,方程式为:2Al2O34Al+3O2↑ 。③硫酸的质量=。
考点:物质的制备实验,根据化学方程式的计算
18. ①②③④ ad Al2O3+3C+3Cl22AlCl3+3CO 取所得溶液少许置于试管中,滴加品红溶液,若品红溶液不褪色,说明二者恰好完全反应;否则二者未完全反应。 b中出现淡黄色浑浊 2Fe3++SO2+2H2O=SO42-+2Fe2++4H+ Ⅰ和Ⅱ
【详解】(1)MnO2和浓盐酸混合共热生成氯气;NaCl和浓硫酸混合共热生成氯化氢,所以MnO2、NaCl和浓硫酸混合共热可以生成氯气;NaClO和盐酸混合共热发生归中反应,生成氯气;漂白粉和硫酸混合共热,发生归中反应,生成氯气,答案选①②③④;
(2)吸收焙烧炉中产生的尾气是二氧化硫,吸收装置需要防倒吸,b装置的防倒吸装置安全瓶的导管错误,c无防倒吸装置,答案选ad;
(3)根据图示,氧化炉中反应物是氧化铝、碳和氯气,生成物是氯化铝和一氧化碳,反应的化学方程式Al2O3+3C+3Cl22AlCl3+3CO;
(4)SO2、Cl2按照一定比例通入水中生成硫酸和盐酸,可减少污染,SO2、Cl2都能使品红褪色,检验二者是否恰好完全反应,可以取所得溶液少许置于试管中,滴加品红溶液,若品红溶液不褪色,说明二者恰好完全反应;否则二者未完全反应;
(5)① 二氧化硫与硫化钠反应生成硫沉淀,表现二氧化硫的氧化性,能说明二氧化硫具有氧化性的实验现象为b中出现淡黄色浑浊;
② a瓶中发生反应是铁离子氧化二氧化硫,反应的离子方程式2Fe3++SO2+2H2O=SO42-+2Fe2++4H+;
③向第一份溶液中加入足量的NaOH溶液,生成白色沉淀,迅速变为灰绿色,最终变为红褐色,说明第一份溶液中含有亚铁离子,能证明二氧化硫具有还原性;KMnO4溶液褪色,说明有还原性物质;原溶液含有硫酸根离子,加入BaCl2溶液生成白色沉淀,不能证明二氧化硫具有还原性。答案选Ⅰ和Ⅱ。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
