炔烃-高考化学考前专项练习试题(含解析)
文档属性
| 名称 | 炔烃-高考化学考前专项练习试题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 883.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-13 12:23:46 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
炔烃
共18题,满分100分
题号 一 二 三 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请注意保持试卷整洁
一、单选题(共50分)
1.(本题5分)奥昔布宁具有解痉和抗胆碱作用,其结构简式如图所示。下列关于奥昔布宁的说法正确的是
A.分子中的含氧官能团为羟基和羧基 B.分子中碳原子轨道杂化类型有2种
C.奥昔布宁不能使溴的CCl4溶液褪色 D.奥昔布宁能发生消去反应
2.(本题5分)下列选项可以说明分子式为C4H6的某烃是1-丁炔而不是的是
A.燃烧有浓烟产生 B.能使酸性高锰酸钾溶液褪色
C.能使溴的四氯化碳溶液褪色 D.与足量溴水反应,生成物中只有两个碳原子上有溴原子
3.(本题5分)阿西弗兰(R)是一种降血脂剂,一种合成阿西弗兰的路线如下。下列说法正确的是
A.M中所有的碳原子可能共平面
B.P与乙酸乙酯互为同系物
C.可用酸性高锰酸钾溶液鉴别M和R
D.R与足量H2加成后所得产物分子中含有3个手性碳原子
4.(本题5分)丁烷、丙烯、乙炔分子中碳碳键键能总和大小关系是
A.丁烷>丙烯>乙炔 B.乙炔>丙烯>丁烷
C.丙烯>丁烷>乙炔 D.丁烷=丙烯=乙炔
5.(本题5分)含有一个叁键的炔烃,与氢气加成后的产物如图所示,则该烃的结构简式可能有
A.1种 B.2种 C.3种 D.4种
6.(本题5分)下列叙述错误的是
A.丙烯酸能发生加成反应和取代反应
B.用酸性高锰酸钾溶液可鉴别苯和环己烷
C.1,3 丁二烯与2 丁炔互为同分异构体
D.CO2合成淀粉实现了小分子转化为高分子
7.(本题5分)通式为CnH2n-2的一种气态炔烃完全燃烧后,生成CO2和H2O的物质的量之比为4:3,则这种烃的链状同分异构体有( )
A.5种 B.4种 C.3种 D.2种
8.(本题5分)一定条件下,下列试剂均可与烷烃、烯烃、炔烃反应的是
A. B. C.HCl D.
9.(本题5分)下列化学方程式及对应的反应类型均正确的是
选项 化学方程式 反应类型
A +Br2+HBr 取代反应
B CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O 取代反应
C n 加聚反应
D CH≡CH+H2OCH3CHO 取代反应
A.A B.B C.C D.D
10.(本题5分)有7种物质:①甲烷;②丙烯;③聚乙烯;④聚氯乙烯;⑤丁炔;⑥环己烷;⑦环己烯;既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的有
A.4种 B.3种 C.2种 D.1种
二、判断题(共20分)
11.(本题4分)由乙炔的结构可推测所有的炔烃均为直线形结构。(___)
12.(本题4分)判断正误
(1)烷烃只含有饱和键,烯烃只含有不饱和键
(2)烷烃不能发生加成反应,烯烃不能发生取代反应
(3)烷烃的通式一定是CnH2n+2,而烯烃的通式一定是CnH2n
(4)烷烃与烯烃相比,发生加成反应的一定是烯烃
(5)CH3CH=CHCH3分子中的4个碳原子可能在同一直线上
(6)甲烷性质稳定,不能发生氧化反应
(7)的名称为3-甲基-4-异丙基己烷
(8)符合通式CnH2n+2的烃一定是烷烃
(9)丙烷分子中的碳原子在同一条直线上
(10)乙烯和乙炔可用酸性KMnO4溶液鉴别
(11)聚丙烯可发生加成反应
(12)烷烃同分异构体之间,支链越多,沸点越高
(13)顺-2-丁烯和反-2-丁烯均能使溴水褪色
(14)CH2=CHCH=CH2与Br2发生加成反应可生成Br-CH2CH=CHCH2-Br和种物质
(15)顺-2-丁烯和反-2-丁烯均能使溴水褪色
13.(本题4分)炔烃既易发生加成反应,又易发生取代反应。(___)
14.(本题4分)HC≡C—CH3分子中的所有碳原子不可能处于同一平面。(____)
15.(本题4分)通过在空气中点燃的现象,可以区别CH4、CH2=CH2、CH≡CH。(_____)
三、解答题(共30分)
16.(本题10分)丙烯腈是合成纤维、合成橡胶和合成树脂的重要单体,可以由乙炔与HCN反应制得。原理如下
Ⅰ.制备催化剂
(1)通过查阅资料有两种方案可以制备
方案1:铜屑与在浓盐酸中反应
方案2:铜丝在氯气中燃烧
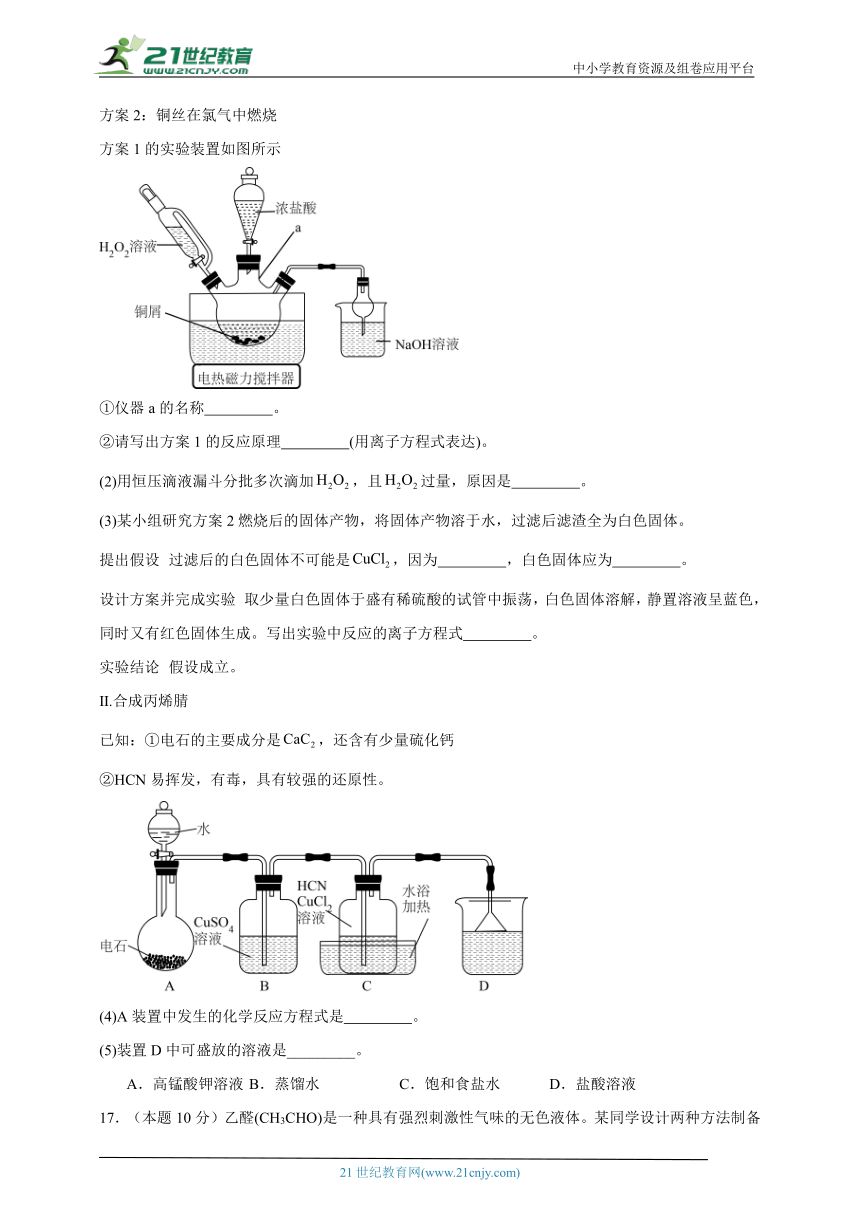
方案1的实验装置如图所示
①仪器a的名称 。
②请写出方案1的反应原理 (用离子方程式表达)。
(2)用恒压滴液漏斗分批多次滴加,且过量,原因是 。
(3)某小组研究方案2燃烧后的固体产物,将固体产物溶于水,过滤后滤渣全为白色固体。
提出假设 过滤后的白色固体不可能是,因为 ,白色固体应为 。
设计方案并完成实验 取少量白色固体于盛有稀硫酸的试管中振荡,白色固体溶解,静置溶液呈蓝色,同时又有红色固体生成。写出实验中反应的离子方程式 。
实验结论 假设成立。
Ⅱ.合成丙烯腈
已知:①电石的主要成分是,还含有少量硫化钙
②HCN易挥发,有毒,具有较强的还原性。
(4)A装置中发生的化学反应方程式是 。
(5)装置D中可盛放的溶液是_________。
A.高锰酸钾溶液 B.蒸馏水 C.饱和食盐水 D.盐酸溶液
17.(本题10分)乙醛(CH3CHO)是一种具有强烈刺激性气味的无色液体。某同学设计两种方法制备乙醛。回答下列问题:
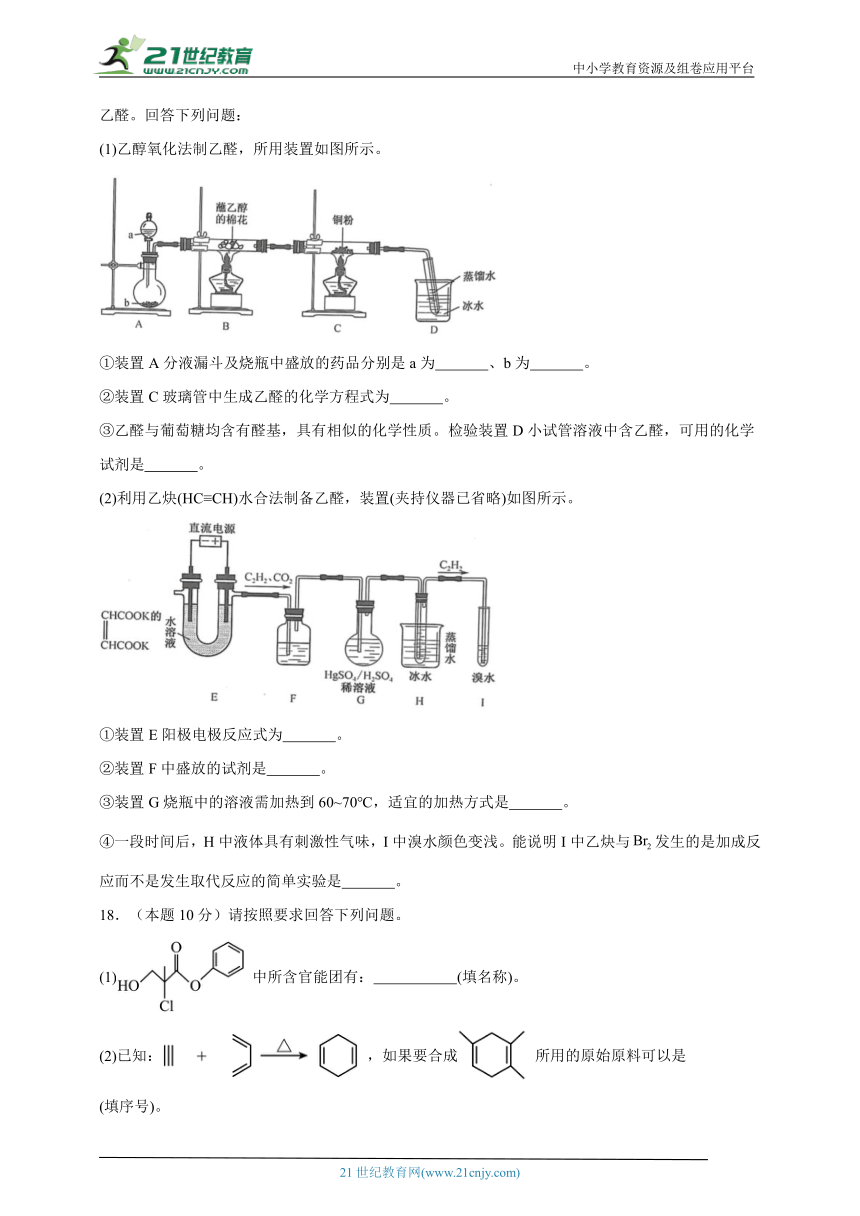
(1)乙醇氧化法制乙醛,所用装置如图所示。
①装置A分液漏斗及烧瓶中盛放的药品分别是a为 、b为 。
②装置C玻璃管中生成乙醛的化学方程式为 。
③乙醛与葡萄糖均含有醛基,具有相似的化学性质。检验装置D小试管溶液中含乙醛,可用的化学试剂是 。
(2)利用乙炔(HC≡CH)水合法制备乙醛,装置(夹持仪器已省略)如图所示。
①装置E阳极电极反应式为 。
②装置F中盛放的试剂是 。
③装置G烧瓶中的溶液需加热到60~70℃,适宜的加热方式是 。
④一段时间后,H中液体具有刺激性气味,I中溴水颜色变浅。能说明I中乙炔与发生的是加成反应而不是发生取代反应的简单实验是 。
18.(本题10分)请按照要求回答下列问题。
(1) 中所含官能团有: (填名称)。
(2)已知: ,如果要合成 所用的原始原料可以是 (填序号)。
①1,3—戊二烯和2—丁炔 ②2—甲基—1,3—丁二烯和2—丁炔
③2,3—二甲基-1,3—戊二烯和乙炔 ④2,3—二甲基—1,3—丁二烯和丙炔
(3)X仅含C、H、O三种元素,取6.00gX与纯氧在加热条件下充分反应,实验如图所示:
①实验结束后,发现B装置增重3.60g,C装置增重15.84g,X的最简式为 。
②现代物理方法分析显示:X的相对分子质量为150;X分子中含酯基;苯环上只有1个取代基,且甲基与酯基相连;有5种化学环境不同的氢,可推知X的结构简式为 。其中测得X的相对分子质量为150的现代物理方法是 (填字母)。
a.质谱法 b.红外光谱 c.紫外光谱 d.核磁共振
③D装置中盛装的药品为 ,若省去装置D,会导致测得的X分子中, 原子质量分数偏高。
参考答案:
1.D
【详解】A.奥昔布宁分子中的含氧官能团为羟基和酯基,不含有羧基,A不正确;
B.奥昔布宁分子中碳原子轨道杂化类型有sp3杂化(环己基、链烃基)、sp2杂质(苯环、酯基)、sp杂质(碳碳叁键),共3种类型,B不正确;
C.奥昔布宁分子中含有的-C≡C-,能使溴的CCl4溶液褪色,C不正确;
D.奥昔布宁分子中的和-OH相连的碳原子与环己基上的邻位碳原子间可通过脱水形成碳碳双键,从而发生消去反应,D正确;
故选D。
2.D
【分析】A、有机物含碳量较高,燃烧会产生浓烟,而二者含碳量相同;
B、二者都是不饱和烃,都能够使高锰酸钾溶液褪色;
C、二者都是不饱和烃,都能够使溴的四氯化碳溶液褪色;
D、根据炔烃和二烯烃中含有不饱和碳原子个数分析。
【详解】1-丁炔和1,3-丁二烯均为不饱和烃,燃烧都有浓烟产生,A项错误;1-丁炔和1,3-丁二烯的官能团分别是碳碳三键、碳碳双键,都能被酸性高锰酸钾溶液氧化,都能与溴发生加成反应而使溶液褪色,B、C项错误:1-丁炔和1,3-丁二烯分别与,足量溴水发生加成反应时,前者生成1,1,2,2—四溴丁烷,后者生成1,2,3,4-四溴丁烷,前者的生成物中只有两个碳原子上有溴原子,后者的生成物中四个碳原子上都有溴原子,D项正确。
【点睛】本题考查了烯烃、炔烃的结构和性质,根据炔烃和二烯烃的结构决定化学性质、反应产物分析是关键。
3.D
【详解】A.M中与羟基所连碳原子杂化类型为sp3,空间构型为四面体形,因此M中所有碳原子不可能共面,故A错误;
B.P的化学式为C6H10O4,乙酸乙酯的化学式为C4H8O2,乙酸乙酯符合通式为CnH2nO2,而P的化学式不符合该通式,因此两者不互为同系物,故B错误;
C.M中含有碳碳三键,R中含有碳碳双键,均能使酸性高锰酸钾溶液褪色,因此酸性高锰酸钾溶液不能鉴别,故C错误;
D.R与足量氢气加成后的产物是 ,故D正确;
答案为D。
4.A
【详解】丁烷分子中含有3个碳碳单键,丙烯分子中含有1个碳碳单键和1个碳碳双键,乙炔分子中含有1个碳碳三键。由于碳碳双键键能小于2个碳碳单键键能之和,而碳碳三键键能小于1个碳碳单键和1个碳碳双键键能之和,因此丁烷、丙烯、乙炔分子中碳碳键键能总和大小关系是丁烷>丙烯>乙炔,答案选A。
5.B
【详解】根据炔烃与氢气加成反应的原理,推知该烷烃分子中相邻的碳原子上均带2个氢原子的碳原子间时对应炔存在的位置,有如图所示的3个位置可以还原,其中1、2两位置相同,故该炔烃共有2种,综上所述B符合题意,故选B。
答案选B。
6.B
【详解】A. 丙烯酸含碳碳双键和羧基、所含碳碳双键能发生加成反应、含羧基能发生酯化反应、属于取代反应,A正确;
B.苯和环己烷均不能与酸性高锰酸钾溶液反应、不能用酸性高锰酸钾溶液鉴别苯和环己烷,B错误;
C. 1,3 丁二烯与2 丁炔分子式均为C4H6,结构不同,互为同分异构体,C正确;
D.淀粉是天然高分子化合物,CO2合成淀粉实现了小分子转化为高分子,D正确;
答案选B。
7.D
【详解】有机物完全燃烧时生成CO2和H2O物质的量之比为4:3,根据C原子、H原子守恒可知,有机物分子满足H原子数与C原子数之比为4:6,某烃室温时为气态,则不饱和烃分子式为C4H6,因为是炔烃,所以结构简式有HC≡CCH2CH3、H3CC≡CCH3两种,答案选D。
8.B
【详解】A.甲烷不与高锰酸钾反应,故A不符合题意;
B.烷烃能与溴发生取代反应;烯烃、炔烃含有不饱和键,能和溴发生加成反应,故B符合题意;
C.甲烷不与HCl反应,故C不符合题意;
D.烷烃为饱和烃,不和氢气反应,故D不符合题意;
故选B。
9.B
【详解】A.在FeBr3的催化作用下,溴原子取代甲苯苯环上的氢原子,A错误;
B.乙醇和乙酸在浓硫酸、加热的条件下发生酯化反应生成乙酸乙酯和水,酯化反应也是取代反应,B正确;
C.苯乙烯加聚后的产物应为,C错误;
D.乙炔和水的反应是加成反应,D错误;
答案选B。
10.B
【分析】既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的物质应含有C=C或C≡C键,发生化学反应;环己烷有机物也能使溴水褪色,但原因是萃取,不是发生的化学反应。
【详解】①甲烷,③聚乙烯,④聚氯乙烯,⑥环己烷等不能使酸性高锰酸钾溶液褪色;②丙烯,⑤丁炔,⑦环己烯都能使酸性高锰酸钾溶液褪色;②丙烯,⑤丁炔,⑦环己烯中都含有不饱和键,与溴水发生加成反应而导致溴水褪色;则既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是②⑤⑦;
故答案选B。
11.错误
【解析】略
12. 错误 错误 错误 正确 错误 错误 错误 正确 错误 错误 错误 错误 正确 错误 正确
【详解】(1)烯烃也可能含有饱和键,错误;
(2)烷烃不能发生加成反应,烯烃也能发生取代反应,错误;
(3)单烯烃的通式一定是CnH2n,错误;
(4)烷烃与烯烃相比,发生加成反应的一定是烯烃,正确;
(5)因碳碳双键的键角为120°,CH3CH=CHCH3分子中的4个碳原子不可能在同一直线上,错误;
(6)甲烷性质稳定,能发生燃烧的氧化反应,错误;
(7)的名称为2,4-二甲基-3-乙基己烷,错误;
(8)符合通式CnH2n+2的烃一定是烷烃,正确;
(9)因饱和碳的键角为109.5°,丙烷分子中的碳原子不在同一条直线上,错误;
(10)乙烯和乙炔都能使酸性KMnO4溶液褪色,不能鉴别,错误;
(11)聚丙烯中无碳碳双键,不可发生加成反应,错误;
(12)烷烃同分异构体之间,支链越多,沸点越低,错误;
(13)顺-2-丁烯和反-2-丁烯均能使溴水褪色,正确;
(14)CH2=CHCH=CH2与Br2按物质的量发生加成反应可生成Br-CH2CH=CHCH2-Br和种物质,错误;
(15)顺-2-丁烯和反-2-丁烯均能使溴水褪色,正确;
13.错误
【详解】炔烃含有碳碳三键,容易发生加成反应,但难以发生取代反应。
14.错误
【详解】HC≡C—CH3可以看作甲基取代乙炔中1个氢原子,所有碳原子在同一平面上,故错误。
15.正确
【详解】甲烷燃烧时火焰为淡绿色火焰,乙烯燃烧时出现明亮火焰,伴有黑烟,而乙炔含碳量较大,燃烧时出现浓烈的黑烟,可以根据CH4、CH2=CH2、CH≡CH燃烧时火焰的明亮程度及冒黑烟的浓烈程度鉴别三者,故答案为:正确。
16.(1) 三颈烧瓶 Cu + H2O2 + 2H+ + 4Cl-= [CuCl4]2-+ 2H2O/Cu + H2O2 + 2H+ = Cu2+ + 2H2O
(2)H2O2不稳定易分解,生成的铜离子对双氧水分解起催化作用,也为了让反应更充分,提高CuCl2的产量
(3) CuCl2溶于水且为有色物质(蓝色) CuCl 2CuCl = Cu2+ + Cu + 2 Cl-
(4)CaC2 + 2H2O → C2H2↑ + Ca(OH)2
(5)A
【分析】丙烯腈(CH2=CHCN)是通过CH≡CH+HCNCH2=CHCN得到,制备催化剂CuCl2常用铜屑与H2O2在浓盐酸中反应得到或铜丝在氯气中燃烧得到;制备乙炔时常用电石与饱和食盐水反应得到,由于含有硫化氢杂质,用硫酸铜溶液处理,将乙炔通入到氯化铜和HCN溶液中水浴加热反应生成丙烯腈,由于HCN有毒,因此尾气用高锰酸钾溶液处理。
【详解】(1)①仪器a的名称为三颈烧瓶;
②方案1的反应原理是铜屑与H2O2在浓盐酸中反应生成氯化铜和水,其离子方程式为:Cu + H2O2 + 2H+ + 4Cl-= [CuCl4]2-+ 2H2O或Cu + H2O2 + 2H+ = Cu2+ + 2H2O;
(2)用恒压滴液漏斗分批多次滴加H2O2,且H2O2过量,原因是H2O2不稳定易分解,生成的铜离子对双氧水分解起催化作用,也为了让反应更充分,提高CuCl2的产量;
(3)过滤后的白色固体不可能是,因为CuCl2溶于水且为有色物质(蓝色),取少量白色固体于盛有稀硫酸的试管中振荡,白色固体溶解,静置溶液呈蓝色,同时又有红色固体生成说明该白色物质在酸性条件下反应生成Cu和铜离子,则根据氧化还原反应原理推测X为CuCl;实验中反应的离子方程式为2CuCl=Cu2++Cu +2Cl-;
(4)A装置中碳化钙和水反应生成乙炔,发生的化学反应方程式是CaC2 + 2H2O → C2H2↑ + Ca(OH)2;
(5)HCN易挥发,D装置主要处理挥发出的HCN气体,HCN有毒,具有较强的还原性,因此利用高锰酸钾的强氧化性将HCN氧化为无毒物质,因此装置D中可盛放的溶液为A。
17.(1) H2O2 MnO2 2CH3CH2OH+O22CH3CHO+2H2O 新制的Cu(OH)2
(2) -2e-=C2H2↑+2CO2↑ NaOH浓溶液 热水浴(或写水浴加热) 测量I试管中通入C2H2前后溴水的pH
【分析】乙醇氧化法制乙醛:装置A中利用二氧化锰催化分解双氧水制取氧气,装置B处得到乙醇蒸气和氧气的混合气体,在装置C处乙醇被催化氧化生成乙醛,装置D冷凝收集乙醛以及未反应的乙醇。
利用乙炔(HC≡CH)水合法制备乙醛:电解KOOCCH=CHCOOK水溶液,阳极得到乙炔和二氧化碳,经NaOH溶液除去CO2后,在装置G中乙炔与水反应得到乙醛,装置H中冷凝收集乙醛,装置I中用溴水吸收未反应的乙炔。
【详解】(1)①装置A应是利用二氧化锰催化分解双氧水制取氧气,所以a为H2O2,b为MnO2;
②在铜的催化作用下,乙醇被氧气氧化为乙醛,化学方程式为2CH3CH2OH+O22CH3CHO+2H2O;
③醛基在碱性环境中与新制Cu(OH)2悬浊液加热反应,得到砖红色沉淀,所以可以用新制的Cu(OH)2检验乙醛;
(2)①阳极上失电子被氧化为C2H2和CO2,根据电子守恒、元素守恒可得电极反应为-2e-=C2H2↑+2CO2↑;
②生成的乙炔中混有CO2,可在装置F中盛放NaOH浓溶液将其除去;
③所需温度低于水的沸点,可以采取水浴加热;
④若乙炔与Br2发生取代反应则会有HBr生成,使溶液酸性增强,而发生加成反应则不会,所以可以通过测量I试管中通入C2H2前后溴水的pH,来说明I中乙炔与Br2发生的是加成反应而不是发生取代反应。
18.(1)羟基、碳氯键、酯基
(2)②④
(3) C9H10O2 a 碱石灰 C
【详解】(1)由结构简式可知,有机物分子中含有的官能团为羟基、碳氯键、酯基,故答案为:羟基、碳氯键、酯基;
(2)由题给信息可知,2—甲基—1,3—丁二烯和2—丁炔发生双烯合成生成 , 2,3—二甲基—1,3—丁二烯和丙炔也能发生双烯合成生成 ,故选②④;
(3)由实验装置图可知,装置A中有机物X与氧气完全燃烧生成二氧化碳和水,装置B中无水氯化钙用于吸收测定反应生成水的量,装置C中盛有的碱石灰用于吸收测定二氧化碳的量,装置D中盛有的碱石灰用于吸收空气中的二氧化碳和水蒸气,防止二氧化碳和水蒸气进入C中导致实验误差;
①由实验结束后,发现B装置增重3.60g,C装置增重15.84g可知,有机物X中含有的碳元素的物质的量为=0.36mol、含有的氢元素的物质的量为×2=0.4mol、含有的氧元素的物质的量为×2=0.08mol,则X分子中碳、氢、氧的原子个数比为0.36mol:0.4mol:0.08mol=9:10:2,最简式为C9H10O2,故答案为:C9H10O2;
②测得X的相对分子质量为150的现代物理方法是质谱法,故选a;由X的相对分子质量为150;X分子中含酯基;苯环上只有1个取代基,且甲基与酯基相连;有5种化学环境不同的氢可知,符合条件的X的结构简式为 ,故答案为: ;a;
③由分析可知,装置D中盛有的碱石灰用于吸收空气中的二氧化碳和水蒸气,防止二氧化碳和水蒸气进入C中导致实验误差,若省去装置D,会使测得的二氧化碳的质量偏大,导致测得的X分子中碳原子的质量分数偏高,故答案为:碱石灰;C。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
炔烃
共18题,满分100分
题号 一 二 三 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请注意保持试卷整洁
一、单选题(共50分)
1.(本题5分)奥昔布宁具有解痉和抗胆碱作用,其结构简式如图所示。下列关于奥昔布宁的说法正确的是
A.分子中的含氧官能团为羟基和羧基 B.分子中碳原子轨道杂化类型有2种
C.奥昔布宁不能使溴的CCl4溶液褪色 D.奥昔布宁能发生消去反应
2.(本题5分)下列选项可以说明分子式为C4H6的某烃是1-丁炔而不是的是
A.燃烧有浓烟产生 B.能使酸性高锰酸钾溶液褪色
C.能使溴的四氯化碳溶液褪色 D.与足量溴水反应,生成物中只有两个碳原子上有溴原子
3.(本题5分)阿西弗兰(R)是一种降血脂剂,一种合成阿西弗兰的路线如下。下列说法正确的是
A.M中所有的碳原子可能共平面
B.P与乙酸乙酯互为同系物
C.可用酸性高锰酸钾溶液鉴别M和R
D.R与足量H2加成后所得产物分子中含有3个手性碳原子
4.(本题5分)丁烷、丙烯、乙炔分子中碳碳键键能总和大小关系是
A.丁烷>丙烯>乙炔 B.乙炔>丙烯>丁烷
C.丙烯>丁烷>乙炔 D.丁烷=丙烯=乙炔
5.(本题5分)含有一个叁键的炔烃,与氢气加成后的产物如图所示,则该烃的结构简式可能有
A.1种 B.2种 C.3种 D.4种
6.(本题5分)下列叙述错误的是
A.丙烯酸能发生加成反应和取代反应
B.用酸性高锰酸钾溶液可鉴别苯和环己烷
C.1,3 丁二烯与2 丁炔互为同分异构体
D.CO2合成淀粉实现了小分子转化为高分子
7.(本题5分)通式为CnH2n-2的一种气态炔烃完全燃烧后,生成CO2和H2O的物质的量之比为4:3,则这种烃的链状同分异构体有( )
A.5种 B.4种 C.3种 D.2种
8.(本题5分)一定条件下,下列试剂均可与烷烃、烯烃、炔烃反应的是
A. B. C.HCl D.
9.(本题5分)下列化学方程式及对应的反应类型均正确的是
选项 化学方程式 反应类型
A +Br2+HBr 取代反应
B CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O 取代反应
C n 加聚反应
D CH≡CH+H2OCH3CHO 取代反应
A.A B.B C.C D.D
10.(本题5分)有7种物质:①甲烷;②丙烯;③聚乙烯;④聚氯乙烯;⑤丁炔;⑥环己烷;⑦环己烯;既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的有
A.4种 B.3种 C.2种 D.1种
二、判断题(共20分)
11.(本题4分)由乙炔的结构可推测所有的炔烃均为直线形结构。(___)
12.(本题4分)判断正误
(1)烷烃只含有饱和键,烯烃只含有不饱和键
(2)烷烃不能发生加成反应,烯烃不能发生取代反应
(3)烷烃的通式一定是CnH2n+2,而烯烃的通式一定是CnH2n
(4)烷烃与烯烃相比,发生加成反应的一定是烯烃
(5)CH3CH=CHCH3分子中的4个碳原子可能在同一直线上
(6)甲烷性质稳定,不能发生氧化反应
(7)的名称为3-甲基-4-异丙基己烷
(8)符合通式CnH2n+2的烃一定是烷烃
(9)丙烷分子中的碳原子在同一条直线上
(10)乙烯和乙炔可用酸性KMnO4溶液鉴别
(11)聚丙烯可发生加成反应
(12)烷烃同分异构体之间,支链越多,沸点越高
(13)顺-2-丁烯和反-2-丁烯均能使溴水褪色
(14)CH2=CHCH=CH2与Br2发生加成反应可生成Br-CH2CH=CHCH2-Br和种物质
(15)顺-2-丁烯和反-2-丁烯均能使溴水褪色
13.(本题4分)炔烃既易发生加成反应,又易发生取代反应。(___)
14.(本题4分)HC≡C—CH3分子中的所有碳原子不可能处于同一平面。(____)
15.(本题4分)通过在空气中点燃的现象,可以区别CH4、CH2=CH2、CH≡CH。(_____)
三、解答题(共30分)
16.(本题10分)丙烯腈是合成纤维、合成橡胶和合成树脂的重要单体,可以由乙炔与HCN反应制得。原理如下
Ⅰ.制备催化剂
(1)通过查阅资料有两种方案可以制备
方案1:铜屑与在浓盐酸中反应
方案2:铜丝在氯气中燃烧
方案1的实验装置如图所示
①仪器a的名称 。
②请写出方案1的反应原理 (用离子方程式表达)。
(2)用恒压滴液漏斗分批多次滴加,且过量,原因是 。
(3)某小组研究方案2燃烧后的固体产物,将固体产物溶于水,过滤后滤渣全为白色固体。
提出假设 过滤后的白色固体不可能是,因为 ,白色固体应为 。
设计方案并完成实验 取少量白色固体于盛有稀硫酸的试管中振荡,白色固体溶解,静置溶液呈蓝色,同时又有红色固体生成。写出实验中反应的离子方程式 。
实验结论 假设成立。
Ⅱ.合成丙烯腈
已知:①电石的主要成分是,还含有少量硫化钙
②HCN易挥发,有毒,具有较强的还原性。
(4)A装置中发生的化学反应方程式是 。
(5)装置D中可盛放的溶液是_________。
A.高锰酸钾溶液 B.蒸馏水 C.饱和食盐水 D.盐酸溶液
17.(本题10分)乙醛(CH3CHO)是一种具有强烈刺激性气味的无色液体。某同学设计两种方法制备乙醛。回答下列问题:
(1)乙醇氧化法制乙醛,所用装置如图所示。
①装置A分液漏斗及烧瓶中盛放的药品分别是a为 、b为 。
②装置C玻璃管中生成乙醛的化学方程式为 。
③乙醛与葡萄糖均含有醛基,具有相似的化学性质。检验装置D小试管溶液中含乙醛,可用的化学试剂是 。
(2)利用乙炔(HC≡CH)水合法制备乙醛,装置(夹持仪器已省略)如图所示。
①装置E阳极电极反应式为 。
②装置F中盛放的试剂是 。
③装置G烧瓶中的溶液需加热到60~70℃,适宜的加热方式是 。
④一段时间后,H中液体具有刺激性气味,I中溴水颜色变浅。能说明I中乙炔与发生的是加成反应而不是发生取代反应的简单实验是 。
18.(本题10分)请按照要求回答下列问题。
(1) 中所含官能团有: (填名称)。
(2)已知: ,如果要合成 所用的原始原料可以是 (填序号)。
①1,3—戊二烯和2—丁炔 ②2—甲基—1,3—丁二烯和2—丁炔
③2,3—二甲基-1,3—戊二烯和乙炔 ④2,3—二甲基—1,3—丁二烯和丙炔
(3)X仅含C、H、O三种元素,取6.00gX与纯氧在加热条件下充分反应,实验如图所示:
①实验结束后,发现B装置增重3.60g,C装置增重15.84g,X的最简式为 。
②现代物理方法分析显示:X的相对分子质量为150;X分子中含酯基;苯环上只有1个取代基,且甲基与酯基相连;有5种化学环境不同的氢,可推知X的结构简式为 。其中测得X的相对分子质量为150的现代物理方法是 (填字母)。
a.质谱法 b.红外光谱 c.紫外光谱 d.核磁共振
③D装置中盛装的药品为 ,若省去装置D,会导致测得的X分子中, 原子质量分数偏高。
参考答案:
1.D
【详解】A.奥昔布宁分子中的含氧官能团为羟基和酯基,不含有羧基,A不正确;
B.奥昔布宁分子中碳原子轨道杂化类型有sp3杂化(环己基、链烃基)、sp2杂质(苯环、酯基)、sp杂质(碳碳叁键),共3种类型,B不正确;
C.奥昔布宁分子中含有的-C≡C-,能使溴的CCl4溶液褪色,C不正确;
D.奥昔布宁分子中的和-OH相连的碳原子与环己基上的邻位碳原子间可通过脱水形成碳碳双键,从而发生消去反应,D正确;
故选D。
2.D
【分析】A、有机物含碳量较高,燃烧会产生浓烟,而二者含碳量相同;
B、二者都是不饱和烃,都能够使高锰酸钾溶液褪色;
C、二者都是不饱和烃,都能够使溴的四氯化碳溶液褪色;
D、根据炔烃和二烯烃中含有不饱和碳原子个数分析。
【详解】1-丁炔和1,3-丁二烯均为不饱和烃,燃烧都有浓烟产生,A项错误;1-丁炔和1,3-丁二烯的官能团分别是碳碳三键、碳碳双键,都能被酸性高锰酸钾溶液氧化,都能与溴发生加成反应而使溶液褪色,B、C项错误:1-丁炔和1,3-丁二烯分别与,足量溴水发生加成反应时,前者生成1,1,2,2—四溴丁烷,后者生成1,2,3,4-四溴丁烷,前者的生成物中只有两个碳原子上有溴原子,后者的生成物中四个碳原子上都有溴原子,D项正确。
【点睛】本题考查了烯烃、炔烃的结构和性质,根据炔烃和二烯烃的结构决定化学性质、反应产物分析是关键。
3.D
【详解】A.M中与羟基所连碳原子杂化类型为sp3,空间构型为四面体形,因此M中所有碳原子不可能共面,故A错误;
B.P的化学式为C6H10O4,乙酸乙酯的化学式为C4H8O2,乙酸乙酯符合通式为CnH2nO2,而P的化学式不符合该通式,因此两者不互为同系物,故B错误;
C.M中含有碳碳三键,R中含有碳碳双键,均能使酸性高锰酸钾溶液褪色,因此酸性高锰酸钾溶液不能鉴别,故C错误;
D.R与足量氢气加成后的产物是 ,故D正确;
答案为D。
4.A
【详解】丁烷分子中含有3个碳碳单键,丙烯分子中含有1个碳碳单键和1个碳碳双键,乙炔分子中含有1个碳碳三键。由于碳碳双键键能小于2个碳碳单键键能之和,而碳碳三键键能小于1个碳碳单键和1个碳碳双键键能之和,因此丁烷、丙烯、乙炔分子中碳碳键键能总和大小关系是丁烷>丙烯>乙炔,答案选A。
5.B
【详解】根据炔烃与氢气加成反应的原理,推知该烷烃分子中相邻的碳原子上均带2个氢原子的碳原子间时对应炔存在的位置,有如图所示的3个位置可以还原,其中1、2两位置相同,故该炔烃共有2种,综上所述B符合题意,故选B。
答案选B。
6.B
【详解】A. 丙烯酸含碳碳双键和羧基、所含碳碳双键能发生加成反应、含羧基能发生酯化反应、属于取代反应,A正确;
B.苯和环己烷均不能与酸性高锰酸钾溶液反应、不能用酸性高锰酸钾溶液鉴别苯和环己烷,B错误;
C. 1,3 丁二烯与2 丁炔分子式均为C4H6,结构不同,互为同分异构体,C正确;
D.淀粉是天然高分子化合物,CO2合成淀粉实现了小分子转化为高分子,D正确;
答案选B。
7.D
【详解】有机物完全燃烧时生成CO2和H2O物质的量之比为4:3,根据C原子、H原子守恒可知,有机物分子满足H原子数与C原子数之比为4:6,某烃室温时为气态,则不饱和烃分子式为C4H6,因为是炔烃,所以结构简式有HC≡CCH2CH3、H3CC≡CCH3两种,答案选D。
8.B
【详解】A.甲烷不与高锰酸钾反应,故A不符合题意;
B.烷烃能与溴发生取代反应;烯烃、炔烃含有不饱和键,能和溴发生加成反应,故B符合题意;
C.甲烷不与HCl反应,故C不符合题意;
D.烷烃为饱和烃,不和氢气反应,故D不符合题意;
故选B。
9.B
【详解】A.在FeBr3的催化作用下,溴原子取代甲苯苯环上的氢原子,A错误;
B.乙醇和乙酸在浓硫酸、加热的条件下发生酯化反应生成乙酸乙酯和水,酯化反应也是取代反应,B正确;
C.苯乙烯加聚后的产物应为,C错误;
D.乙炔和水的反应是加成反应,D错误;
答案选B。
10.B
【分析】既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的物质应含有C=C或C≡C键,发生化学反应;环己烷有机物也能使溴水褪色,但原因是萃取,不是发生的化学反应。
【详解】①甲烷,③聚乙烯,④聚氯乙烯,⑥环己烷等不能使酸性高锰酸钾溶液褪色;②丙烯,⑤丁炔,⑦环己烯都能使酸性高锰酸钾溶液褪色;②丙烯,⑤丁炔,⑦环己烯中都含有不饱和键,与溴水发生加成反应而导致溴水褪色;则既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是②⑤⑦;
故答案选B。
11.错误
【解析】略
12. 错误 错误 错误 正确 错误 错误 错误 正确 错误 错误 错误 错误 正确 错误 正确
【详解】(1)烯烃也可能含有饱和键,错误;
(2)烷烃不能发生加成反应,烯烃也能发生取代反应,错误;
(3)单烯烃的通式一定是CnH2n,错误;
(4)烷烃与烯烃相比,发生加成反应的一定是烯烃,正确;
(5)因碳碳双键的键角为120°,CH3CH=CHCH3分子中的4个碳原子不可能在同一直线上,错误;
(6)甲烷性质稳定,能发生燃烧的氧化反应,错误;
(7)的名称为2,4-二甲基-3-乙基己烷,错误;
(8)符合通式CnH2n+2的烃一定是烷烃,正确;
(9)因饱和碳的键角为109.5°,丙烷分子中的碳原子不在同一条直线上,错误;
(10)乙烯和乙炔都能使酸性KMnO4溶液褪色,不能鉴别,错误;
(11)聚丙烯中无碳碳双键,不可发生加成反应,错误;
(12)烷烃同分异构体之间,支链越多,沸点越低,错误;
(13)顺-2-丁烯和反-2-丁烯均能使溴水褪色,正确;
(14)CH2=CHCH=CH2与Br2按物质的量发生加成反应可生成Br-CH2CH=CHCH2-Br和种物质,错误;
(15)顺-2-丁烯和反-2-丁烯均能使溴水褪色,正确;
13.错误
【详解】炔烃含有碳碳三键,容易发生加成反应,但难以发生取代反应。
14.错误
【详解】HC≡C—CH3可以看作甲基取代乙炔中1个氢原子,所有碳原子在同一平面上,故错误。
15.正确
【详解】甲烷燃烧时火焰为淡绿色火焰,乙烯燃烧时出现明亮火焰,伴有黑烟,而乙炔含碳量较大,燃烧时出现浓烈的黑烟,可以根据CH4、CH2=CH2、CH≡CH燃烧时火焰的明亮程度及冒黑烟的浓烈程度鉴别三者,故答案为:正确。
16.(1) 三颈烧瓶 Cu + H2O2 + 2H+ + 4Cl-= [CuCl4]2-+ 2H2O/Cu + H2O2 + 2H+ = Cu2+ + 2H2O
(2)H2O2不稳定易分解,生成的铜离子对双氧水分解起催化作用,也为了让反应更充分,提高CuCl2的产量
(3) CuCl2溶于水且为有色物质(蓝色) CuCl 2CuCl = Cu2+ + Cu + 2 Cl-
(4)CaC2 + 2H2O → C2H2↑ + Ca(OH)2
(5)A
【分析】丙烯腈(CH2=CHCN)是通过CH≡CH+HCNCH2=CHCN得到,制备催化剂CuCl2常用铜屑与H2O2在浓盐酸中反应得到或铜丝在氯气中燃烧得到;制备乙炔时常用电石与饱和食盐水反应得到,由于含有硫化氢杂质,用硫酸铜溶液处理,将乙炔通入到氯化铜和HCN溶液中水浴加热反应生成丙烯腈,由于HCN有毒,因此尾气用高锰酸钾溶液处理。
【详解】(1)①仪器a的名称为三颈烧瓶;
②方案1的反应原理是铜屑与H2O2在浓盐酸中反应生成氯化铜和水,其离子方程式为:Cu + H2O2 + 2H+ + 4Cl-= [CuCl4]2-+ 2H2O或Cu + H2O2 + 2H+ = Cu2+ + 2H2O;
(2)用恒压滴液漏斗分批多次滴加H2O2,且H2O2过量,原因是H2O2不稳定易分解,生成的铜离子对双氧水分解起催化作用,也为了让反应更充分,提高CuCl2的产量;
(3)过滤后的白色固体不可能是,因为CuCl2溶于水且为有色物质(蓝色),取少量白色固体于盛有稀硫酸的试管中振荡,白色固体溶解,静置溶液呈蓝色,同时又有红色固体生成说明该白色物质在酸性条件下反应生成Cu和铜离子,则根据氧化还原反应原理推测X为CuCl;实验中反应的离子方程式为2CuCl=Cu2++Cu +2Cl-;
(4)A装置中碳化钙和水反应生成乙炔,发生的化学反应方程式是CaC2 + 2H2O → C2H2↑ + Ca(OH)2;
(5)HCN易挥发,D装置主要处理挥发出的HCN气体,HCN有毒,具有较强的还原性,因此利用高锰酸钾的强氧化性将HCN氧化为无毒物质,因此装置D中可盛放的溶液为A。
17.(1) H2O2 MnO2 2CH3CH2OH+O22CH3CHO+2H2O 新制的Cu(OH)2
(2) -2e-=C2H2↑+2CO2↑ NaOH浓溶液 热水浴(或写水浴加热) 测量I试管中通入C2H2前后溴水的pH
【分析】乙醇氧化法制乙醛:装置A中利用二氧化锰催化分解双氧水制取氧气,装置B处得到乙醇蒸气和氧气的混合气体,在装置C处乙醇被催化氧化生成乙醛,装置D冷凝收集乙醛以及未反应的乙醇。
利用乙炔(HC≡CH)水合法制备乙醛:电解KOOCCH=CHCOOK水溶液,阳极得到乙炔和二氧化碳,经NaOH溶液除去CO2后,在装置G中乙炔与水反应得到乙醛,装置H中冷凝收集乙醛,装置I中用溴水吸收未反应的乙炔。
【详解】(1)①装置A应是利用二氧化锰催化分解双氧水制取氧气,所以a为H2O2,b为MnO2;
②在铜的催化作用下,乙醇被氧气氧化为乙醛,化学方程式为2CH3CH2OH+O22CH3CHO+2H2O;
③醛基在碱性环境中与新制Cu(OH)2悬浊液加热反应,得到砖红色沉淀,所以可以用新制的Cu(OH)2检验乙醛;
(2)①阳极上失电子被氧化为C2H2和CO2,根据电子守恒、元素守恒可得电极反应为-2e-=C2H2↑+2CO2↑;
②生成的乙炔中混有CO2,可在装置F中盛放NaOH浓溶液将其除去;
③所需温度低于水的沸点,可以采取水浴加热;
④若乙炔与Br2发生取代反应则会有HBr生成,使溶液酸性增强,而发生加成反应则不会,所以可以通过测量I试管中通入C2H2前后溴水的pH,来说明I中乙炔与Br2发生的是加成反应而不是发生取代反应。
18.(1)羟基、碳氯键、酯基
(2)②④
(3) C9H10O2 a 碱石灰 C
【详解】(1)由结构简式可知,有机物分子中含有的官能团为羟基、碳氯键、酯基,故答案为:羟基、碳氯键、酯基;
(2)由题给信息可知,2—甲基—1,3—丁二烯和2—丁炔发生双烯合成生成 , 2,3—二甲基—1,3—丁二烯和丙炔也能发生双烯合成生成 ,故选②④;
(3)由实验装置图可知,装置A中有机物X与氧气完全燃烧生成二氧化碳和水,装置B中无水氯化钙用于吸收测定反应生成水的量,装置C中盛有的碱石灰用于吸收测定二氧化碳的量,装置D中盛有的碱石灰用于吸收空气中的二氧化碳和水蒸气,防止二氧化碳和水蒸气进入C中导致实验误差;
①由实验结束后,发现B装置增重3.60g,C装置增重15.84g可知,有机物X中含有的碳元素的物质的量为=0.36mol、含有的氢元素的物质的量为×2=0.4mol、含有的氧元素的物质的量为×2=0.08mol,则X分子中碳、氢、氧的原子个数比为0.36mol:0.4mol:0.08mol=9:10:2,最简式为C9H10O2,故答案为:C9H10O2;
②测得X的相对分子质量为150的现代物理方法是质谱法,故选a;由X的相对分子质量为150;X分子中含酯基;苯环上只有1个取代基,且甲基与酯基相连;有5种化学环境不同的氢可知,符合条件的X的结构简式为 ,故答案为: ;a;
③由分析可知,装置D中盛有的碱石灰用于吸收空气中的二氧化碳和水蒸气,防止二氧化碳和水蒸气进入C中导致实验误差,若省去装置D,会使测得的二氧化碳的质量偏大,导致测得的X分子中碳原子的质量分数偏高,故答案为:碱石灰;C。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
