弱电解质的电离-高考化学考前专项练习试题(含解析)
文档属性
| 名称 | 弱电解质的电离-高考化学考前专项练习试题(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 827.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-13 12:24:28 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
弱电解质的电离
共18题,满分100分
题号 一 二 三 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请注意保持试卷整洁
一、单选题(共50分)
1.(本题5分)下列说法正确的是
A.1mol L-1CH3COOH溶液加水稀释或加热均可促进电离,使CH3COO-的物质的量浓度增大
B.等体积等浓度的盐酸、硫酸、醋酸与NaOH溶液生成正盐时,消耗NaOH溶液的体积相同
C.等体积等浓度的盐酸、硫酸、醋酸与足量的锌反应时,盐酸与醋酸产生氢气的体积相同
D.物质的量浓度相同的磷酸钠溶液和磷酸中PO的浓度相同
2.(本题5分)下列实验操作、实验现象和实验结论均正确的是
实验操作 实验现象 实验结论
A 向A、B两支试管中先加入酸性溶液,再分别加入溶液和溶液 B试管中溶液先褪色 反应物浓度越大,化学反应速率越快
B 在溶液中存在如下平衡:,加热 溶液颜色由蓝色变为黄绿色 该反应正向为吸热反应
C 等体积的HA和HB两种酸分别与足量的锌反应,排水法收集气体 HA放出的氢气多且反应速率快 酸性:HA>HB
D 向的平衡体系中加入少量KCl固体 溶液红色变浅 增加生成物浓度,平衡逆向移动
A.A B.B C.C D.D
3.(本题5分)向一定浓度的与的混合液中滴加稀醋酸,溶液导电能力随加入溶液的体积变化如图所示,下列说法错误的是
A.段,溶液导电能力减弱是由于溶液离子数目基本不变,体积增大,离子浓度减小
B.段,发生反应的离子方程式为
C.段,由于是弱酸,离子个数减少,故溶液导电能力下降
D.d点以后,随着溶液的滴加,溶液导电能力不可能增强
4.(本题5分)已知25℃时有关弱酸的电离平衡常数:
弱酸化学式 CH3COOH HCN H2CO3
电离平衡常数(25℃) 1.8×l0–5 4.9×l0–10 K1=4.3×l0–7 K2=5.6×l0–11
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小
C.将a mol·L—1HCN溶液与a mol·L—1NaOH溶液等体积混合,混合液中:c(OH–)>c(H+),c(Na+)>c(CN–)
D.NaHCO3和Na2CO3混合液中,一定有c(Na+)+ c(H+)=c(OH–)+ c(HCO3–) +c(CO32–)
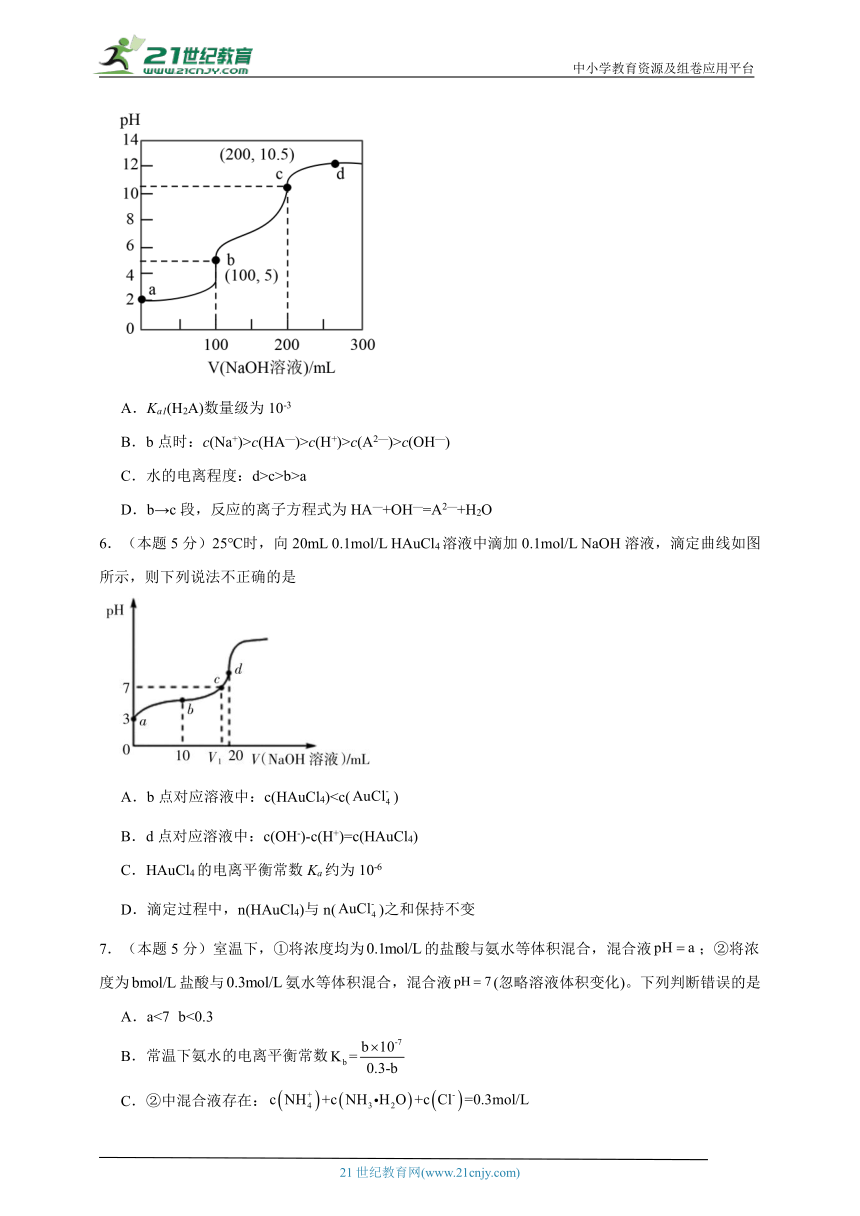
5.(本题5分)室温下,向100mL某浓度的二元弱酸H2A溶液中逐滴加入0.1mol/LNaOH溶液,溶液的pH随NaOH溶液体积的变化曲线如图所示。下列有关说法错误的是
A.Ka1(H2A)数量级为10-3
B.b点时:c(Na+)>c(HA—)>c(H+)>c(A2—)>c(OH—)
C.水的电离程度:d>c>b>a
D.b→c段,反应的离子方程式为HA—+OH—=A2—+H2O
6.(本题5分)25℃时,向20mL 0.1mol/L HAuCl4溶液中滴加0.1mol/L NaOH溶液,滴定曲线如图所示,则下列说法不正确的是
A.b点对应溶液中:c(HAuCl4)B.d点对应溶液中:c(OH-)-c(H+)=c(HAuCl4)
C.HAuCl4的电离平衡常数Ka约为10-6
D.滴定过程中,n(HAuCl4)与n()之和保持不变
7.(本题5分)室温下,①将浓度均为的盐酸与氨水等体积混合,混合液;②将浓度为盐酸与氨水等体积混合,混合液(忽略溶液体积变化)。下列判断错误的是
A.a<7 b<0.3
B.常温下氨水的电离平衡常数
C.②中混合液存在:
D.将①与②混合液混合,则混合后溶液中存在:
8.(本题5分)下列有关电解质溶液的说法正确的是( )
A.向0.1 mol L-1CH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B.用惰性电极电解MgCl2溶液,电解的离子方程式为: 2Cl-+2H2OH2↑+Cl2↑+2OH-
C.向盐酸中加入氨水至中性,溶液中c(NH4+)/c(Cl-)>1
D.将AgCl与AgBr的饱和溶液等体积混合,再加入足量AgNO3溶液,生成的沉淀AgCl多
9.(本题5分)pH=1的HA、HB两溶液各10 mL,分别加水稀释至1000 mL,其pH变化关系如图所示,下
列说法正确的是
A.HA一定是强酸,HB一定是弱酸
B.稀释后,HA溶液的酸性比HB溶液的酸性弱
C.向上述10 mL HA溶液中加入10 mL pH=13的NaOH溶液,溶液中有 c(Na+)>c(A-)>c(OH-)>c(H+)
D.当a=3时,HA、HB两溶液起始浓度相等
10.(本题5分)碳酸钠和碳酸氢钠是两种非常重要的化工产品。下列关于两种物质的水溶液说法错误的是
A.均存在水解平衡和电离平衡
B.均呈碱性,加热后碱性都会增强
C.均存在
D.均存在
二、判断题(共20分)
11.(本题4分)常温下,0.1mol·L-1CH3COONa溶液的pH大于7能证明乙酸是弱酸。( )
12.(本题4分)盐酸与铁粉反应时,向盐酸中加入适量的固体可减小反应速率。(_____)
13.(本题4分)NaHSO4在水溶液及熔融状态下均可电离出Na+、H+、。( )
14.(本题4分)氨气溶于水,当NH3·H2O电离出的c(OH-)=c()时,表明NH3·H2O电离处于平衡状态。( )
15.(本题4分)根据溶液中和的物质的量浓度相等可证明达到电离平衡状态。(_____)
三、解答题(共30分)
16.(本题10分)(三氯化六氨合钴)是合成其他含钴配合物的重要原料,实验中可由金属钴及其他原料制备。
已知:①在时恰好完全沉淀为;
②不同温度下在水中的溶解度如图所示。
(一)的制备
易潮解,的氧化性强于,可用金属钻与氯气反应制备。实验中利用如图装置(连接用橡胶管省略)进行制备。
(1)用图中的装置组合制备,仪器a的名称为 ,仪器连接顺序为 (填标号)。装置B的作用是 。
(2)装置A中发生反应的离子方程式为 。
(二)的制备步骤如下:
Ⅰ.在100mL锥形瓶内加入4.5g研细的,3g和5mL水,加热溶解后加入0.3g活性炭作催化剂。
Ⅱ.冷却后,加入浓氨水混合均匀。控制温度在10℃以下,并缓慢加入10mL溶液。
Ⅲ.在60℃下反应一段时间后,经过______、冷却结晶、过滤、洗涤、干燥等操作,得到晶体。
根据以上步骤,回答下列问题:
(3)在步骤Ⅱ加入浓氨水前,需在步骤Ⅰ中加入,请从平衡移动的角度解释加入的目的 。
(4)步骤Ⅱ中在加入溶液时,控制温度在10℃以下并缓慢加入的目的是 。
(5)步骤Ⅲ中的操作名称为 。
(6)的配位数为 。1L溶液和足量硝酸银反应,生成AgCl的物质的量为 mol。
17.(本题10分)双氧水(H2O2)和水都是极弱电解质,但H2O2溶液显酸性
(1)若把H2O2看成二元弱酸。请写出其在水中的电离方程式: 。
(2)二氧化锰是实验室制取氧气的催化剂。下列是某同学设计实验探究双氧水分解实验方案:
实验 20.0mL双氧水溶液浓度 粉状MnO2 温度 待测数据
Ⅰ 5% 0.2g 20°C
Ⅱ 5% 0.5g 20°C
Ⅲ 10% 0.2g 20°C
①利用实验Ⅰ和Ⅲ,探究 对化学反应速率的影响,实验待测数据是 :若在本组实验中现象不明显,可采取的措施是 。
(3)加0.1 mol MnO2,粉末于50mL过氧化氢溶液(H2O2,ρ=1.1 gmL-1)中,在标准状况下放出气体的体积和时间的关系如图所示。
①前4min内氧气的产生速率为 mLmin-1
②A、B、C、D各点反应速率由快到慢的顺序为 。
③解释反应速率变化的原因 。
④计算H2O2初始状态的浓度 。
18.(本题10分)CH3COOH是常见的弱酸,现有常温下0.1molL-1的CH3COOH溶液。
(1)若温度不变,加水稀释过程中,下列表达式的数据一定变小的是 (填字母序号,下同);若该溶液升高温度,下列表达式的数据增大的是 。
A c(H+)
B c(H+)c(OH-)
C
D
(2)某化学兴趣小组装好了如图所示的实验装置,一支胶头滴管盛有盐酸,另一支胶头滴管盛有同体积、同浓度的醋酸。实验时同时完全捏扁a、b胶头滴管的胶头,观察实验现象
①装置A、B中用红墨水而不用水的目的是 。
②实验刚开始时,发现装置A中的长导管液面上升得比装置B中的要快。则胶头滴管a中盛的是 。 两装置反应结束时(无固体剩余)。静置后两装置中的长导管或面均有所下降,最终液面高度 (填“相等”。“A中的高”或“B中的高”).
(3)实验表明,液态时纯硫酸的电离能力强于纯硝酸,纯硫酸的导电性也是显著强于纯水。又知液态纯酸都能像水那样进行自身电离而建立平衡。且在一定温度下都有各自的离子积常数。据此回答:
①25°C时,液态纯硫酸的离子积常数K(H2SO4) 1×10-14(填“>”“<”或“=”).
②在纯硫酸与纯硝酸的液态混合酸中,存在的阴离子主要是 。
(4)在某温度下的水溶液中,c(H+)=10xmolL-1,c(OH-)=10ymolL-1,x与y的关系如图所示:
①该温度下,水的离子积为 。
②该温度下,0.01 molL-1 NaOH溶液中水电离出c(OH-)为 。
参考答案:
1.C
【详解】A.CH3COOH溶液加水稀释,溶液的体积增大,CH3COO-的物质的量浓度减小,A错误;
B.等体积等浓度的盐酸、硫酸、醋酸与NaOH溶液生成正盐时,硫酸是二元强酸,消耗的氢氧化钠溶液的体积更大,B错误;
C.等体积等浓度的盐酸、硫酸、醋酸与足量的锌反应时,盐酸和醋酸的物质的量相同,产生的氢气的体积相同,C正确;
D.磷酸是弱酸,电离出的磷酸根离子的浓度较少,而磷酸钠溶液中,磷酸能完全电离出磷酸根离子,因此,物质的量浓度相同的磷酸钠溶液和磷酸中,磷酸钠溶液中磷酸根离子浓度更大,D错误;
故选C。
2.B
【详解】A.根据量的计算得到高锰酸钾都没有反应完,因此溶液都没有褪色,因此无法得出反应物浓度越大,化学反应速率越快,故A错误;
B.加热,溶液颜色由蓝色变为黄绿色,说明平衡正向移动,则正向是吸热反应,故B正确;
C.HA放出的氢气多且反应速率快,说明HA溶液的酸的物质的量大,说明HA酸的物质的量浓度大,而pH相等,说明电离程度小,则为更弱的酸,故C错误;
D.反应的实质是,增加KCl的量,对平衡无影响,故D错误。
综上所述,答案为B。
3.C
【分析】ab段是醋酸和NaOH反应,此时离子总物质的量几乎不变,但是溶液体积增大,故溶液导电能力下降,bc段为醋酸和一水合氨反应,生成了强电解质醋酸铵,溶液导电能力增强,cd段及d点以后一水合氨和NaOH均已反应完,加入的醋酸为弱电解质,溶液中离子个数几乎不变,由于溶液体积也增大,离子浓度减小,导电能力下降。
【详解】A.ab段反应为醋酸与氢氧化钠反应生成醋酸钠和水,溶液中离子的总物质的量几乎不变,但溶液体积增大,离子浓度减小,故溶液导电能力减弱,故A正确;
B.bc段为CH3COOH与NH3 H2O反应,所得产物为醋酸铵和水,书写离子方程式为,故B正确;
C.cd段继续滴加CH3COOH溶液,由于NH3 H2O和NaOH已反应完,CH3COOH电离程度很小,溶液中离子个数几乎不变,但溶液体积增大,离子浓度减小,导致溶液导电能力减弱,故C错误;
D.醋酸是弱电解质,随着醋酸的滴加,溶液中离子浓度增大程度小于溶液体积增大程度,溶液导电性下降,故D正确。
答案选B。
4.C
【详解】试题分析:根据电离平衡常数可知,酸性CH3COOH>HCN> HCO3-,越弱越水解,等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa);故A错误;弱电解质越稀电离程度越大,冰醋酸中逐滴加水,醋酸的电离程度增大,故B错误;将a mol·L—1 HCN溶液与a mol·L—1 NaOH溶液等体积混合,恰好完全反应生成NaCN为强碱弱酸盐,CN–水解溶液呈碱性,所以c(OH–)>c(H+),c(Na+)>c(CN–),故C正确;根据电荷守恒,NaHCO3和Na2CO3混合液中,一定有c(Na+)+ c(H+)=c(OH–)+ c(HCO3–) +2c(CO32–),故D错误。
考点:本题考查弱电解质电离。
5.C
【分析】由图可知,a点对应溶液为H2A溶液,酸电离出的氢离子抑制水的电离,H2A溶液与氢氧化钠溶液反应时有b、c两个计量点,b点对应溶液为NaHA溶液、c点对应溶液为Na2A溶液,b点NaHA溶液pH为5说明HA—在溶液中的电离程度大于水解程度,d点为NaOH和Na2A的混合溶液,由b点消耗0.1mol/L氢氧化钠溶液的体积可知,H2A溶液的浓度为=0.1mol/L。
【详解】A.由分析可知,a点对应溶液为0.1mol/L H2A溶液,溶液pH为2,则电离常数Ka1(H2A)= ≈=1×10—3,所以电离常数的数量级为10-3,故A正确;
B.由分析可知,b点对应溶液为NaHA溶液,溶液pH为5说明HA—在溶液中的电离程度大于水解程度,则溶液中离子浓度的大小顺序为c(Na+)>c(HA—)>c(H+)>c(A2—)>c(OH—),故B正确;
C.由分析可知,c点对应溶液为Na2A溶液,A2—在溶液中水解使溶液呈碱性,促进水的电离,d点为NaOH和Na2A的混合溶液,氢氧化钠在溶液中电离出的氢氧根离子抑制A2—在溶液中的水解,水的电离程度小于c点,故C错误;
D.由分析可知,b→c段发生的反应为NaHA溶液与氢氧化钠溶液反应生成Na2A和水,反应的离子方程式为HA—+OH—=A2—+H2O,故D正确;
故选C。
6.C
【分析】a点时,0.1mol/L HAuCl4溶液的pH=3,即c(H+)=10-3mol/L,则HAuCl4为弱酸,故溶液pH=7时,加入NaOH溶液的体积小于20mL。
【详解】A.b点对应溶液中的溶质为等量的HAuCl4、NaAuCl4,溶液显酸性,则HAuCl4电离程度大于NaAuCl4的水解程度,即c(HAuCl4)<c(),A说法正确;
B.d点对应溶液中的溶质为NaAuCl4,根据质子守恒可得c(OH-)=c(HAuCl4)+c(H+),则c(OH-)-c(H+)=c(HAuCl4)成立,B说法正确;
C.HAuCl4的电离平衡常数Ka==10-5,C说法错误;
D.滴定过程中,根据物料守恒,n(HAuCl4)+n()=20mL×0.1mol/L,保持不变,D说法正确;
答案为C。
7.C
【详解】A.①将浓度均为的盐酸与氨水等体积混合,二者恰好完全反应生成氯化铵和水,氯化铵水解显酸性,故混合液<7;②将浓度为盐酸与氨水等体积混合,因该混合液,故必须盐酸少量即b<0.3,A正确;
B.由题意列电荷守恒得:,因室温下混合液,说明溶液显中性,,所以,因等体积混合故=mol/L。常温下氨水中一水合氨的电离方程式为,故其电离平衡常数,B正确;
C.②中混合液存在物料守恒,<,故,C错误;
D.因①溶液显酸性,②溶液显中性,故将①与②混合液混合显酸性,>,由电荷守恒得:,故,D正确;
故选C。
8.D
【分析】A、由电离常数公式可得c(H+)/ c(CH3COOH)=Ka/ c(CH3COO-),稀释时,Ka不变,c(CH3COO-)减小;
B、用惰性电极电解MgCl2溶液时生成氢氧化镁沉淀;
C、中性溶液中c(H+)= c(OH-);
D、当加入足量的浓AgNO3溶液时,AgBr沉淀有所增多,但AgCl沉淀增加更多。
【详解】A项、CH3COOH溶液加水稀释,c(CH3COOH)、c(H+)和c(CH3COO-)都减小,电离常数不变,c(H+)/ c(CH3COOH)=Ka/ c(CH3COO-)增大,故A错误;
B项、用惰性电极电解MgCl2溶液,阴极区生成氢氧化镁沉淀和氢气,阳极区生成氯气,反应的离子方程式为Mg2++2Cl-+2H2OMg(OH)2↓+H2↑+Cl2↑,故B错误;
C项、向盐酸中加入氨水至中性,溶液中c(H+)= c(OH-),由电荷守恒关系c(H+)+ c(NH4+)= c(OH-)+ c(Cl-)可知c(NH4+)=c(Cl-),故C错误;
D项、在AgCl和AgBr两饱和溶液中,前者c(Ag+)大于后者c(Ag+),c(Cl-)>c(Br-),当将AgCl、AgBr两饱和溶液混合时,发生沉淀的转化,生成更多的AgBr沉淀,与此同时,溶液中n(Cl-)比原来AgCl饱和溶液中大,当加入足量的浓AgNO3溶液时,AgBr沉淀有所增多,但AgCl沉淀增加更多,故D正确。
故选D。
【点睛】本题考查水溶液中的离子平衡,涉及了弱电解质的电离、电解原理、溶液酸碱性、沉淀溶解平衡等,注意把握影响弱电解质电离平衡的因素、溶液中电荷守恒关系的应用是解答关键。
9.B
【详解】试题分析:A.当a=3,HA一定是强酸,HB一定为弱酸,若a小于3,两者都为弱酸,故A错误;B.由图象可知,稀释后HA溶液的酸性比HB溶液的酸性弱,故B正确;C.由题意恰好中和时c(Na+)>c(A-)>c(OH-)>c(H+),说明盐溶液呈碱性,则对应的是HA为弱酸,而依据图象不能确定HA一定为弱酸,故C错误;D.由图象可知,两种酸的酸性强弱不同,所以起始pH相等,浓度一定不等,故D错误。故选B。
考点:考查弱电解质的电离平衡;强电解质弱电解质
10.D
【详解】A.碳酸钠和碳酸氢钠溶液均存在水解平衡和水的电离平衡,A正确;
B.碳酸钠和碳酸氢钠溶液均显碱性,加热促进水解,溶液碱性均增强,B正确;
C.根据电荷守恒,两种溶液均有,C正确;
D.根据元素质量守恒,碳酸钠溶液中存在,碳酸氢钠溶液中存在,D错误;
故选D。
11.正确
【详解】常温下0.1mol L-1CH3COONa溶液的pH大于7,则乙酸钠是强碱弱酸盐,则乙酸为弱酸,故正确。
12.正确
【详解】盐酸与铁粉反应时,向盐酸中加入适量的醋酸钠固体,醋酸根离子与氢离子反应生成醋酸,氢离子浓度减小,可减小反应速率,正确。
13.错误
【详解】NaHSO4在水溶液中可电离出Na+、H+、,在熔融状态下只能电离成Na+、,故错误。
14.错误
【详解】无论是否达到电离平衡状态,NH3·H2O电离出的c(OH-)始终等于c(),应为c(OH-)、c()保持不变时,表明NH3·H2O电离处于平衡状态,故错误。
15.错误
【详解】CH3COOH达到电离平衡时溶液中CH3COO-和H+的物质的量浓度相等,反之不一定,如醋酸钠和盐酸的混合溶液中CH3COO-和H+的物质的量浓度相等,并不表明CH3COOH达到电离平衡,故说法错误。
16.(1) 分液漏斗 A→D→C→E→B 防止多余的污染空气,同时防止空气中的水蒸气进入装置E,使潮解
(2)
(3)是利用溶于水电离出,使的电离平衡逆向移动,防止氨水溶液中过大,生成沉淀
(4)防止温度过高使(和)分解
(5)趁热过滤
(6) 6 0.03mol
【分析】
利用浓盐酸与高锰酸钾反应制氯气,通过饱和食盐水除去氯气中的氯化氢,再通过浓硫酸干燥,得到的干燥纯净的氯气通入装置E与钴加热条件下反应生成氯化钴;再利用氯化钴与氨化铵在活性炭催化下反应制;
【详解】(1)根据仪器的构造可知,仪器a的名称为分液漏斗;装置A用于制备Cl2,装置D用于除去Cl2中的HCl,装置C用于干燥Cl2,装置E用于制备CoCl2,装置B的作用是防止多余的氯气污染空气,同时防止空气中的水蒸气进入装置E,使CoCl2潮解,故连接顺序为A→D→C→E→B;答案为分液漏斗;A→D→C→E→B;防止多余的污染空气,同时防止空气中的水蒸气进入装置E,使潮解;
(2)装置A中KMnO4和浓盐酸反应制备Cl2,故方程式为:;
(3)在步骤Ⅱ加入浓氨水前,需在步骤Ⅰ中加入,是利用溶于水电离出,使的电离平衡逆向移动,防止氨水溶液中过大,生成沉淀;
(4)H2O2和NH3·H2O受热易分解,步骤Ⅱ中控制温度在10℃以下并缓慢加入H2O2溶液是为了控制反应速率,防止温度过高使H2O2和NH3·H2O分解;
(5)根据已知信息②可知,在水中的溶解度随着温度的升高而增大,应先趁热过滤除去活性炭等杂质,再经冷却结晶、过滤、洗涤、干燥等操作得到晶体,答案为趁热过滤;
(6)配合物中配体是NH3,配位数为6;1mol能电离出3molCl-,1L溶液和足量硝酸银反应,生成AgCl的物质的量为0.03mol。
17. H2O2 H++HO2-、HO2- H++O22- 浓度 收集等体积氧气所需要的时间(或者相同时间内收集氧气的体积);升高到相同的温度 将三个实验升高到相同的温度; 15mL/min D>C>B>A 刚开始时受温度和浓度两方面的影响,速率较快,随着反应的进行,双氧水的浓度逐渐减小,反应速率也逐渐减小 0.107 mol L 1
【分析】(1)过氧化氢是弱电解质,属于二元弱酸分步电离;
(2)①根据控制单一变量法,比较实验Ⅰ和Ⅲ的数据可知,两个实验中二氧化锰的质量和实验温度都是相同的,只有双氧水溶液的浓度不同,则探究的是浓度对化学反应速率的影响;可以通过测定收集等体积氧气所需要的时间(或者相同时间内收集氧气的体积)来比较反应速率的快慢;若在本组实验中现象不明显,可采取的措施是升高到相同的温度;
(3)①前4min内生成60mL氧气,根据速率单位可知,该速率用单位时间内的体积变化来表示;
②反应物浓度大小决定反应速率大小,随着反应的进行,双氧水的浓度逐渐减小,反应速率也逐渐减小;
③2H2O2 2H2O+O2↑反应为放热反应,刚开始时受温度和浓度两方面的影响,速率较快,但由于随着反应进行,反应物的浓度逐渐减小,速率逐渐减小,综合温度和浓度两方面的影响,浓度变化更大,所以速率逐渐减小;
④2H2O2 2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图像可知,生成氧气的体积为60mL,则可列比例式计算n(H2O2),进而计算其浓度。
【详解】(1)过氧化氢是弱电解质,H2O2溶液显酸性,属于二元弱酸,分步电离,电离的方程式为:H2O2 H++HO2-、HO2- H++O22-;
故答案为:H2O2 H++HO2-、HO2- H++O22-;
(2)①比较实验Ⅰ和Ⅲ的数据可知,两个实验中二氧化锰的质量和实验温度都是相同的,只有双氧水溶液的浓度不同,则探究的是浓度对化学反应速率的影响,可以通过测定收集等体积氧气所需要的时间(或者相同时间内收集氧气的体积)来比较反应速率的快慢;若在本组实验中现象不明显,可采取的措施是将三个实验升高到相同的温度;
故答案为:浓度;收集等体积氧气所需要的时间(或者相同时间内收集氧气的体积);将三个实验升高到相同的温度;
(3)①前4min内生成60mL氧气,则氧气的产生速率为;
故答案为:15mL/min;
②反应物浓度大小决定反应速率大小,随着反应的进行,双氧水的浓度逐渐减小,反应速率也逐渐减小;
故答案为:D>C>B>A;
③2H2O2 2H2O+O2↑反应为放热反应,刚开始时受温度和浓度两方面的影响,速率较快,但由于随着反应进行,反应物的浓度逐渐减小,速率逐渐减小,综合温度和浓度两方面的影响,浓度变化更大(减小的较多),所以速率逐渐减小;,
故答案为:刚开始时受温度和浓度两方面的影响,速率较快,随着反应的进行,双氧水的浓度逐渐减小,反应速率也逐渐减小;
④2H2O2 2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图像可知,生成氧气的体积为60mL,则可列比例式:
2H2O2 2H2O+O2↑
2mol 22.4L
n(H2O2) 0.06L
,解得:n(H2O2)=0.00536mol,所以;
故答案为:0.107 mol L 1。
18. A ABCD 便于观察长导管中液面高度的变化; 盐酸 相同 > HSO4 1.0×10-15 1.0×10-13mol/L
【分析】(1)CH3COOH溶液加水稀释过程中,醋酸的电离程度增大,氢离子浓度、醋酸根离子浓度减小;由于温度不变,则电离平衡常数、水的离子积不变;升高温度后醋酸的电离程度增大,则溶液中氢离子浓度增大、水的离子积增大、电离平衡常数增大;
(2)①装置A、B中用红墨水而不用水,便于观察长导管中液面高度的变化;
②实验刚开始时,盐酸溶液中的c(H+)大,与等质量的锌粒反应时单位时间内放出的热量多,产生的H2多,所以装置中压强大,长导管中液面上升快;两装置反应刚结束时(无固体剩余),发现装置A中的长导管液面比装置B中的高,静置一会后,温度下降压强减小,两装置中的长导管液面均有所下降,但二者产生的氢气的量相等,所以最终液面高度相同;
(3)①由于纯硫酸的导电性显著强于纯水,所以25℃时,液态纯硫酸的离子积常数K(H2SO4)>1×10 14;
②由于纯硫酸的电离能力强于纯硝酸,则在纯硫酸和纯硝酸的液态混合酸中2H2SO4 H3SO4++HSO4 为主要的电离方式;
(4)①该温度下,溶液中水的离子积常数Kw=c(H+)·c(OH-),即Kw=10x×10y=10x+y;
②0.01mol/LNaOH溶液中c(OH-)=0.01mol/L,H+全部由水电离得到,根据水的离子积常数计算氢离子浓度,再依据c水(OH-)=c水(H+)计算溶液中水电离出c(OH-)。
【详解】(1)CH3COOH溶液加水稀释过程中,醋酸的电离程度增大,氢离子浓度、醋酸根离子浓度减小;由于温度不变,则电离平衡常数、水的离子积不变;
A. 0.1 mol L 1的CH3COOH溶液加水稀释过程中,氢离子浓度减小,故A正确;
B. Kw=c(H+) c(OH )只受温度的影响,温度不变,则其值是一个常数,故B错误;
C. 由于,醋酸根离子浓度减小,温度不变,电离平衡常数不变,则增大,故C错误;
D. 为醋酸的电离平衡常数,由于温度不变,则电离平衡常数不变,故D错误;
若该溶液升高温度,醋酸、水的电离程度均增大,则溶液中氢离子、醋酸根离子浓度都增大,醋酸分子的浓度减小,水的离子积增大、电离平衡常数增大;
A. 升高温度,促进醋酸的电离,溶液中氢离子浓度增大,故A正确;
B. Kw=c(H+) c(OH )为水的离子积,升高温度后水的电离程度增大,则水的离子积增大,故B正确;
C. 升高温度,醋酸的电离程度增大,氢离子浓度增大,醋酸分子的浓度减小,则的比值增大,故C正确;
D. 为醋酸的电离平衡常数,升高温度,电离平衡常数增大,故D正确;
故答案为:A;ABCD;
(2)①装置A、B中用红墨水而不用水的原因是便于观察长导管中液面高度的变化;
故答案为:便于观察长导管中液面高度的变化;
②实验刚开始时,盐酸溶液中的c(H+)大,与等质量的锌粒反应时单位时间内放出的热量多,产生的H2多,所以装置中压强大,长导管中液面上升快,所以若发现装置A中的长导管液面上升的比装置B的要高,则胶头滴管a中盛的是盐酸;两装置反应刚结束时(无固体剩余),发现装置A中的长导管液面比装置B中的高,静置一会后,温度下降压强减小,两装置中的长导管液面均有所下降,但二者产生的氢气的量相等,所以最终液面高度相同;
故答案为:盐酸;相同;
(3)①根据实验表明,液态时,纯硫酸的导电性显著强于纯水,已知液态纯酸都能像水那样进行自身电离(H2O+H2O H3O++OH )而建立平衡,且在一定温度下都有各自的离子积常数,这些信息告诉我们纯硫酸存在着电离平衡,且电离程度强于纯水,仿照纯水的电离方式,可以推知纯硫酸的电离方程式为:2H2SO4 H3SO4++HSO4 ,由于纯硫酸的导电性显著强于纯水,所以25℃时,液态纯硫酸的离子积常数K(H2SO4)>1×10 14;
故答案为:>;
②由于纯硫酸的电离能力强于纯硝酸,则在纯硫酸和纯硝酸的液态混合酸中2H2SO4 H3SO4++HSO4 为主要的电离方式,而纯硝酸电离受到纯硫酸电离出的H+的抑制,因此在纯硫酸和纯硝酸的液态混合酸中,存在的阴离子主要是HSO4 ;
故答案为:HSO4 ;
(4)①该温度下,溶液中水的离子积常数Kw=c(H+)·c(OH-),即Kw=10x×10y=10x+y,由图像可知,x+y=-15,故Kw=1.0×10-15;
故答案为:1.0×10-15;
②该温度下,水的离子积常数为10-15,0.01mol/LNaOH溶液中c(OH-)=0.01mol/L,H+全部由水电离得到,根据水的离子积常数得溶液中c水(H+)=c水(OH-)=;
故答案为:1.0×10-13mol/L。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
弱电解质的电离
共18题,满分100分
题号 一 二 三 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请注意保持试卷整洁
一、单选题(共50分)
1.(本题5分)下列说法正确的是
A.1mol L-1CH3COOH溶液加水稀释或加热均可促进电离,使CH3COO-的物质的量浓度增大
B.等体积等浓度的盐酸、硫酸、醋酸与NaOH溶液生成正盐时,消耗NaOH溶液的体积相同
C.等体积等浓度的盐酸、硫酸、醋酸与足量的锌反应时,盐酸与醋酸产生氢气的体积相同
D.物质的量浓度相同的磷酸钠溶液和磷酸中PO的浓度相同
2.(本题5分)下列实验操作、实验现象和实验结论均正确的是
实验操作 实验现象 实验结论
A 向A、B两支试管中先加入酸性溶液,再分别加入溶液和溶液 B试管中溶液先褪色 反应物浓度越大,化学反应速率越快
B 在溶液中存在如下平衡:,加热 溶液颜色由蓝色变为黄绿色 该反应正向为吸热反应
C 等体积的HA和HB两种酸分别与足量的锌反应,排水法收集气体 HA放出的氢气多且反应速率快 酸性:HA>HB
D 向的平衡体系中加入少量KCl固体 溶液红色变浅 增加生成物浓度,平衡逆向移动
A.A B.B C.C D.D
3.(本题5分)向一定浓度的与的混合液中滴加稀醋酸,溶液导电能力随加入溶液的体积变化如图所示,下列说法错误的是
A.段,溶液导电能力减弱是由于溶液离子数目基本不变,体积增大,离子浓度减小
B.段,发生反应的离子方程式为
C.段,由于是弱酸,离子个数减少,故溶液导电能力下降
D.d点以后,随着溶液的滴加,溶液导电能力不可能增强
4.(本题5分)已知25℃时有关弱酸的电离平衡常数:
弱酸化学式 CH3COOH HCN H2CO3
电离平衡常数(25℃) 1.8×l0–5 4.9×l0–10 K1=4.3×l0–7 K2=5.6×l0–11
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小
C.将a mol·L—1HCN溶液与a mol·L—1NaOH溶液等体积混合,混合液中:c(OH–)>c(H+),c(Na+)>c(CN–)
D.NaHCO3和Na2CO3混合液中,一定有c(Na+)+ c(H+)=c(OH–)+ c(HCO3–) +c(CO32–)
5.(本题5分)室温下,向100mL某浓度的二元弱酸H2A溶液中逐滴加入0.1mol/LNaOH溶液,溶液的pH随NaOH溶液体积的变化曲线如图所示。下列有关说法错误的是
A.Ka1(H2A)数量级为10-3
B.b点时:c(Na+)>c(HA—)>c(H+)>c(A2—)>c(OH—)
C.水的电离程度:d>c>b>a
D.b→c段,反应的离子方程式为HA—+OH—=A2—+H2O
6.(本题5分)25℃时,向20mL 0.1mol/L HAuCl4溶液中滴加0.1mol/L NaOH溶液,滴定曲线如图所示,则下列说法不正确的是
A.b点对应溶液中:c(HAuCl4)
C.HAuCl4的电离平衡常数Ka约为10-6
D.滴定过程中,n(HAuCl4)与n()之和保持不变
7.(本题5分)室温下,①将浓度均为的盐酸与氨水等体积混合,混合液;②将浓度为盐酸与氨水等体积混合,混合液(忽略溶液体积变化)。下列判断错误的是
A.a<7 b<0.3
B.常温下氨水的电离平衡常数
C.②中混合液存在:
D.将①与②混合液混合,则混合后溶液中存在:
8.(本题5分)下列有关电解质溶液的说法正确的是( )
A.向0.1 mol L-1CH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B.用惰性电极电解MgCl2溶液,电解的离子方程式为: 2Cl-+2H2OH2↑+Cl2↑+2OH-
C.向盐酸中加入氨水至中性,溶液中c(NH4+)/c(Cl-)>1
D.将AgCl与AgBr的饱和溶液等体积混合,再加入足量AgNO3溶液,生成的沉淀AgCl多
9.(本题5分)pH=1的HA、HB两溶液各10 mL,分别加水稀释至1000 mL,其pH变化关系如图所示,下
列说法正确的是
A.HA一定是强酸,HB一定是弱酸
B.稀释后,HA溶液的酸性比HB溶液的酸性弱
C.向上述10 mL HA溶液中加入10 mL pH=13的NaOH溶液,溶液中有 c(Na+)>c(A-)>c(OH-)>c(H+)
D.当a=3时,HA、HB两溶液起始浓度相等
10.(本题5分)碳酸钠和碳酸氢钠是两种非常重要的化工产品。下列关于两种物质的水溶液说法错误的是
A.均存在水解平衡和电离平衡
B.均呈碱性,加热后碱性都会增强
C.均存在
D.均存在
二、判断题(共20分)
11.(本题4分)常温下,0.1mol·L-1CH3COONa溶液的pH大于7能证明乙酸是弱酸。( )
12.(本题4分)盐酸与铁粉反应时,向盐酸中加入适量的固体可减小反应速率。(_____)
13.(本题4分)NaHSO4在水溶液及熔融状态下均可电离出Na+、H+、。( )
14.(本题4分)氨气溶于水,当NH3·H2O电离出的c(OH-)=c()时,表明NH3·H2O电离处于平衡状态。( )
15.(本题4分)根据溶液中和的物质的量浓度相等可证明达到电离平衡状态。(_____)
三、解答题(共30分)
16.(本题10分)(三氯化六氨合钴)是合成其他含钴配合物的重要原料,实验中可由金属钴及其他原料制备。
已知:①在时恰好完全沉淀为;
②不同温度下在水中的溶解度如图所示。
(一)的制备
易潮解,的氧化性强于,可用金属钻与氯气反应制备。实验中利用如图装置(连接用橡胶管省略)进行制备。
(1)用图中的装置组合制备,仪器a的名称为 ,仪器连接顺序为 (填标号)。装置B的作用是 。
(2)装置A中发生反应的离子方程式为 。
(二)的制备步骤如下:
Ⅰ.在100mL锥形瓶内加入4.5g研细的,3g和5mL水,加热溶解后加入0.3g活性炭作催化剂。
Ⅱ.冷却后,加入浓氨水混合均匀。控制温度在10℃以下,并缓慢加入10mL溶液。
Ⅲ.在60℃下反应一段时间后,经过______、冷却结晶、过滤、洗涤、干燥等操作,得到晶体。
根据以上步骤,回答下列问题:
(3)在步骤Ⅱ加入浓氨水前,需在步骤Ⅰ中加入,请从平衡移动的角度解释加入的目的 。
(4)步骤Ⅱ中在加入溶液时,控制温度在10℃以下并缓慢加入的目的是 。
(5)步骤Ⅲ中的操作名称为 。
(6)的配位数为 。1L溶液和足量硝酸银反应,生成AgCl的物质的量为 mol。
17.(本题10分)双氧水(H2O2)和水都是极弱电解质,但H2O2溶液显酸性
(1)若把H2O2看成二元弱酸。请写出其在水中的电离方程式: 。
(2)二氧化锰是实验室制取氧气的催化剂。下列是某同学设计实验探究双氧水分解实验方案:
实验 20.0mL双氧水溶液浓度 粉状MnO2 温度 待测数据
Ⅰ 5% 0.2g 20°C
Ⅱ 5% 0.5g 20°C
Ⅲ 10% 0.2g 20°C
①利用实验Ⅰ和Ⅲ,探究 对化学反应速率的影响,实验待测数据是 :若在本组实验中现象不明显,可采取的措施是 。
(3)加0.1 mol MnO2,粉末于50mL过氧化氢溶液(H2O2,ρ=1.1 gmL-1)中,在标准状况下放出气体的体积和时间的关系如图所示。
①前4min内氧气的产生速率为 mLmin-1
②A、B、C、D各点反应速率由快到慢的顺序为 。
③解释反应速率变化的原因 。
④计算H2O2初始状态的浓度 。
18.(本题10分)CH3COOH是常见的弱酸,现有常温下0.1molL-1的CH3COOH溶液。
(1)若温度不变,加水稀释过程中,下列表达式的数据一定变小的是 (填字母序号,下同);若该溶液升高温度,下列表达式的数据增大的是 。
A c(H+)
B c(H+)c(OH-)
C
D
(2)某化学兴趣小组装好了如图所示的实验装置,一支胶头滴管盛有盐酸,另一支胶头滴管盛有同体积、同浓度的醋酸。实验时同时完全捏扁a、b胶头滴管的胶头,观察实验现象
①装置A、B中用红墨水而不用水的目的是 。
②实验刚开始时,发现装置A中的长导管液面上升得比装置B中的要快。则胶头滴管a中盛的是 。 两装置反应结束时(无固体剩余)。静置后两装置中的长导管或面均有所下降,最终液面高度 (填“相等”。“A中的高”或“B中的高”).
(3)实验表明,液态时纯硫酸的电离能力强于纯硝酸,纯硫酸的导电性也是显著强于纯水。又知液态纯酸都能像水那样进行自身电离而建立平衡。且在一定温度下都有各自的离子积常数。据此回答:
①25°C时,液态纯硫酸的离子积常数K(H2SO4) 1×10-14(填“>”“<”或“=”).
②在纯硫酸与纯硝酸的液态混合酸中,存在的阴离子主要是 。
(4)在某温度下的水溶液中,c(H+)=10xmolL-1,c(OH-)=10ymolL-1,x与y的关系如图所示:
①该温度下,水的离子积为 。
②该温度下,0.01 molL-1 NaOH溶液中水电离出c(OH-)为 。
参考答案:
1.C
【详解】A.CH3COOH溶液加水稀释,溶液的体积增大,CH3COO-的物质的量浓度减小,A错误;
B.等体积等浓度的盐酸、硫酸、醋酸与NaOH溶液生成正盐时,硫酸是二元强酸,消耗的氢氧化钠溶液的体积更大,B错误;
C.等体积等浓度的盐酸、硫酸、醋酸与足量的锌反应时,盐酸和醋酸的物质的量相同,产生的氢气的体积相同,C正确;
D.磷酸是弱酸,电离出的磷酸根离子的浓度较少,而磷酸钠溶液中,磷酸能完全电离出磷酸根离子,因此,物质的量浓度相同的磷酸钠溶液和磷酸中,磷酸钠溶液中磷酸根离子浓度更大,D错误;
故选C。
2.B
【详解】A.根据量的计算得到高锰酸钾都没有反应完,因此溶液都没有褪色,因此无法得出反应物浓度越大,化学反应速率越快,故A错误;
B.加热,溶液颜色由蓝色变为黄绿色,说明平衡正向移动,则正向是吸热反应,故B正确;
C.HA放出的氢气多且反应速率快,说明HA溶液的酸的物质的量大,说明HA酸的物质的量浓度大,而pH相等,说明电离程度小,则为更弱的酸,故C错误;
D.反应的实质是,增加KCl的量,对平衡无影响,故D错误。
综上所述,答案为B。
3.C
【分析】ab段是醋酸和NaOH反应,此时离子总物质的量几乎不变,但是溶液体积增大,故溶液导电能力下降,bc段为醋酸和一水合氨反应,生成了强电解质醋酸铵,溶液导电能力增强,cd段及d点以后一水合氨和NaOH均已反应完,加入的醋酸为弱电解质,溶液中离子个数几乎不变,由于溶液体积也增大,离子浓度减小,导电能力下降。
【详解】A.ab段反应为醋酸与氢氧化钠反应生成醋酸钠和水,溶液中离子的总物质的量几乎不变,但溶液体积增大,离子浓度减小,故溶液导电能力减弱,故A正确;
B.bc段为CH3COOH与NH3 H2O反应,所得产物为醋酸铵和水,书写离子方程式为,故B正确;
C.cd段继续滴加CH3COOH溶液,由于NH3 H2O和NaOH已反应完,CH3COOH电离程度很小,溶液中离子个数几乎不变,但溶液体积增大,离子浓度减小,导致溶液导电能力减弱,故C错误;
D.醋酸是弱电解质,随着醋酸的滴加,溶液中离子浓度增大程度小于溶液体积增大程度,溶液导电性下降,故D正确。
答案选B。
4.C
【详解】试题分析:根据电离平衡常数可知,酸性CH3COOH>HCN> HCO3-,越弱越水解,等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa);故A错误;弱电解质越稀电离程度越大,冰醋酸中逐滴加水,醋酸的电离程度增大,故B错误;将a mol·L—1 HCN溶液与a mol·L—1 NaOH溶液等体积混合,恰好完全反应生成NaCN为强碱弱酸盐,CN–水解溶液呈碱性,所以c(OH–)>c(H+),c(Na+)>c(CN–),故C正确;根据电荷守恒,NaHCO3和Na2CO3混合液中,一定有c(Na+)+ c(H+)=c(OH–)+ c(HCO3–) +2c(CO32–),故D错误。
考点:本题考查弱电解质电离。
5.C
【分析】由图可知,a点对应溶液为H2A溶液,酸电离出的氢离子抑制水的电离,H2A溶液与氢氧化钠溶液反应时有b、c两个计量点,b点对应溶液为NaHA溶液、c点对应溶液为Na2A溶液,b点NaHA溶液pH为5说明HA—在溶液中的电离程度大于水解程度,d点为NaOH和Na2A的混合溶液,由b点消耗0.1mol/L氢氧化钠溶液的体积可知,H2A溶液的浓度为=0.1mol/L。
【详解】A.由分析可知,a点对应溶液为0.1mol/L H2A溶液,溶液pH为2,则电离常数Ka1(H2A)= ≈=1×10—3,所以电离常数的数量级为10-3,故A正确;
B.由分析可知,b点对应溶液为NaHA溶液,溶液pH为5说明HA—在溶液中的电离程度大于水解程度,则溶液中离子浓度的大小顺序为c(Na+)>c(HA—)>c(H+)>c(A2—)>c(OH—),故B正确;
C.由分析可知,c点对应溶液为Na2A溶液,A2—在溶液中水解使溶液呈碱性,促进水的电离,d点为NaOH和Na2A的混合溶液,氢氧化钠在溶液中电离出的氢氧根离子抑制A2—在溶液中的水解,水的电离程度小于c点,故C错误;
D.由分析可知,b→c段发生的反应为NaHA溶液与氢氧化钠溶液反应生成Na2A和水,反应的离子方程式为HA—+OH—=A2—+H2O,故D正确;
故选C。
6.C
【分析】a点时,0.1mol/L HAuCl4溶液的pH=3,即c(H+)=10-3mol/L,则HAuCl4为弱酸,故溶液pH=7时,加入NaOH溶液的体积小于20mL。
【详解】A.b点对应溶液中的溶质为等量的HAuCl4、NaAuCl4,溶液显酸性,则HAuCl4电离程度大于NaAuCl4的水解程度,即c(HAuCl4)<c(),A说法正确;
B.d点对应溶液中的溶质为NaAuCl4,根据质子守恒可得c(OH-)=c(HAuCl4)+c(H+),则c(OH-)-c(H+)=c(HAuCl4)成立,B说法正确;
C.HAuCl4的电离平衡常数Ka==10-5,C说法错误;
D.滴定过程中,根据物料守恒,n(HAuCl4)+n()=20mL×0.1mol/L,保持不变,D说法正确;
答案为C。
7.C
【详解】A.①将浓度均为的盐酸与氨水等体积混合,二者恰好完全反应生成氯化铵和水,氯化铵水解显酸性,故混合液<7;②将浓度为盐酸与氨水等体积混合,因该混合液,故必须盐酸少量即b<0.3,A正确;
B.由题意列电荷守恒得:,因室温下混合液,说明溶液显中性,,所以,因等体积混合故=mol/L。常温下氨水中一水合氨的电离方程式为,故其电离平衡常数,B正确;
C.②中混合液存在物料守恒,<,故,C错误;
D.因①溶液显酸性,②溶液显中性,故将①与②混合液混合显酸性,>,由电荷守恒得:,故,D正确;
故选C。
8.D
【分析】A、由电离常数公式可得c(H+)/ c(CH3COOH)=Ka/ c(CH3COO-),稀释时,Ka不变,c(CH3COO-)减小;
B、用惰性电极电解MgCl2溶液时生成氢氧化镁沉淀;
C、中性溶液中c(H+)= c(OH-);
D、当加入足量的浓AgNO3溶液时,AgBr沉淀有所增多,但AgCl沉淀增加更多。
【详解】A项、CH3COOH溶液加水稀释,c(CH3COOH)、c(H+)和c(CH3COO-)都减小,电离常数不变,c(H+)/ c(CH3COOH)=Ka/ c(CH3COO-)增大,故A错误;
B项、用惰性电极电解MgCl2溶液,阴极区生成氢氧化镁沉淀和氢气,阳极区生成氯气,反应的离子方程式为Mg2++2Cl-+2H2OMg(OH)2↓+H2↑+Cl2↑,故B错误;
C项、向盐酸中加入氨水至中性,溶液中c(H+)= c(OH-),由电荷守恒关系c(H+)+ c(NH4+)= c(OH-)+ c(Cl-)可知c(NH4+)=c(Cl-),故C错误;
D项、在AgCl和AgBr两饱和溶液中,前者c(Ag+)大于后者c(Ag+),c(Cl-)>c(Br-),当将AgCl、AgBr两饱和溶液混合时,发生沉淀的转化,生成更多的AgBr沉淀,与此同时,溶液中n(Cl-)比原来AgCl饱和溶液中大,当加入足量的浓AgNO3溶液时,AgBr沉淀有所增多,但AgCl沉淀增加更多,故D正确。
故选D。
【点睛】本题考查水溶液中的离子平衡,涉及了弱电解质的电离、电解原理、溶液酸碱性、沉淀溶解平衡等,注意把握影响弱电解质电离平衡的因素、溶液中电荷守恒关系的应用是解答关键。
9.B
【详解】试题分析:A.当a=3,HA一定是强酸,HB一定为弱酸,若a小于3,两者都为弱酸,故A错误;B.由图象可知,稀释后HA溶液的酸性比HB溶液的酸性弱,故B正确;C.由题意恰好中和时c(Na+)>c(A-)>c(OH-)>c(H+),说明盐溶液呈碱性,则对应的是HA为弱酸,而依据图象不能确定HA一定为弱酸,故C错误;D.由图象可知,两种酸的酸性强弱不同,所以起始pH相等,浓度一定不等,故D错误。故选B。
考点:考查弱电解质的电离平衡;强电解质弱电解质
10.D
【详解】A.碳酸钠和碳酸氢钠溶液均存在水解平衡和水的电离平衡,A正确;
B.碳酸钠和碳酸氢钠溶液均显碱性,加热促进水解,溶液碱性均增强,B正确;
C.根据电荷守恒,两种溶液均有,C正确;
D.根据元素质量守恒,碳酸钠溶液中存在,碳酸氢钠溶液中存在,D错误;
故选D。
11.正确
【详解】常温下0.1mol L-1CH3COONa溶液的pH大于7,则乙酸钠是强碱弱酸盐,则乙酸为弱酸,故正确。
12.正确
【详解】盐酸与铁粉反应时,向盐酸中加入适量的醋酸钠固体,醋酸根离子与氢离子反应生成醋酸,氢离子浓度减小,可减小反应速率,正确。
13.错误
【详解】NaHSO4在水溶液中可电离出Na+、H+、,在熔融状态下只能电离成Na+、,故错误。
14.错误
【详解】无论是否达到电离平衡状态,NH3·H2O电离出的c(OH-)始终等于c(),应为c(OH-)、c()保持不变时,表明NH3·H2O电离处于平衡状态,故错误。
15.错误
【详解】CH3COOH达到电离平衡时溶液中CH3COO-和H+的物质的量浓度相等,反之不一定,如醋酸钠和盐酸的混合溶液中CH3COO-和H+的物质的量浓度相等,并不表明CH3COOH达到电离平衡,故说法错误。
16.(1) 分液漏斗 A→D→C→E→B 防止多余的污染空气,同时防止空气中的水蒸气进入装置E,使潮解
(2)
(3)是利用溶于水电离出,使的电离平衡逆向移动,防止氨水溶液中过大,生成沉淀
(4)防止温度过高使(和)分解
(5)趁热过滤
(6) 6 0.03mol
【分析】
利用浓盐酸与高锰酸钾反应制氯气,通过饱和食盐水除去氯气中的氯化氢,再通过浓硫酸干燥,得到的干燥纯净的氯气通入装置E与钴加热条件下反应生成氯化钴;再利用氯化钴与氨化铵在活性炭催化下反应制;
【详解】(1)根据仪器的构造可知,仪器a的名称为分液漏斗;装置A用于制备Cl2,装置D用于除去Cl2中的HCl,装置C用于干燥Cl2,装置E用于制备CoCl2,装置B的作用是防止多余的氯气污染空气,同时防止空气中的水蒸气进入装置E,使CoCl2潮解,故连接顺序为A→D→C→E→B;答案为分液漏斗;A→D→C→E→B;防止多余的污染空气,同时防止空气中的水蒸气进入装置E,使潮解;
(2)装置A中KMnO4和浓盐酸反应制备Cl2,故方程式为:;
(3)在步骤Ⅱ加入浓氨水前,需在步骤Ⅰ中加入,是利用溶于水电离出,使的电离平衡逆向移动,防止氨水溶液中过大,生成沉淀;
(4)H2O2和NH3·H2O受热易分解,步骤Ⅱ中控制温度在10℃以下并缓慢加入H2O2溶液是为了控制反应速率,防止温度过高使H2O2和NH3·H2O分解;
(5)根据已知信息②可知,在水中的溶解度随着温度的升高而增大,应先趁热过滤除去活性炭等杂质,再经冷却结晶、过滤、洗涤、干燥等操作得到晶体,答案为趁热过滤;
(6)配合物中配体是NH3,配位数为6;1mol能电离出3molCl-,1L溶液和足量硝酸银反应,生成AgCl的物质的量为0.03mol。
17. H2O2 H++HO2-、HO2- H++O22- 浓度 收集等体积氧气所需要的时间(或者相同时间内收集氧气的体积);升高到相同的温度 将三个实验升高到相同的温度; 15mL/min D>C>B>A 刚开始时受温度和浓度两方面的影响,速率较快,随着反应的进行,双氧水的浓度逐渐减小,反应速率也逐渐减小 0.107 mol L 1
【分析】(1)过氧化氢是弱电解质,属于二元弱酸分步电离;
(2)①根据控制单一变量法,比较实验Ⅰ和Ⅲ的数据可知,两个实验中二氧化锰的质量和实验温度都是相同的,只有双氧水溶液的浓度不同,则探究的是浓度对化学反应速率的影响;可以通过测定收集等体积氧气所需要的时间(或者相同时间内收集氧气的体积)来比较反应速率的快慢;若在本组实验中现象不明显,可采取的措施是升高到相同的温度;
(3)①前4min内生成60mL氧气,根据速率单位可知,该速率用单位时间内的体积变化来表示;
②反应物浓度大小决定反应速率大小,随着反应的进行,双氧水的浓度逐渐减小,反应速率也逐渐减小;
③2H2O2 2H2O+O2↑反应为放热反应,刚开始时受温度和浓度两方面的影响,速率较快,但由于随着反应进行,反应物的浓度逐渐减小,速率逐渐减小,综合温度和浓度两方面的影响,浓度变化更大,所以速率逐渐减小;
④2H2O2 2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图像可知,生成氧气的体积为60mL,则可列比例式计算n(H2O2),进而计算其浓度。
【详解】(1)过氧化氢是弱电解质,H2O2溶液显酸性,属于二元弱酸,分步电离,电离的方程式为:H2O2 H++HO2-、HO2- H++O22-;
故答案为:H2O2 H++HO2-、HO2- H++O22-;
(2)①比较实验Ⅰ和Ⅲ的数据可知,两个实验中二氧化锰的质量和实验温度都是相同的,只有双氧水溶液的浓度不同,则探究的是浓度对化学反应速率的影响,可以通过测定收集等体积氧气所需要的时间(或者相同时间内收集氧气的体积)来比较反应速率的快慢;若在本组实验中现象不明显,可采取的措施是将三个实验升高到相同的温度;
故答案为:浓度;收集等体积氧气所需要的时间(或者相同时间内收集氧气的体积);将三个实验升高到相同的温度;
(3)①前4min内生成60mL氧气,则氧气的产生速率为;
故答案为:15mL/min;
②反应物浓度大小决定反应速率大小,随着反应的进行,双氧水的浓度逐渐减小,反应速率也逐渐减小;
故答案为:D>C>B>A;
③2H2O2 2H2O+O2↑反应为放热反应,刚开始时受温度和浓度两方面的影响,速率较快,但由于随着反应进行,反应物的浓度逐渐减小,速率逐渐减小,综合温度和浓度两方面的影响,浓度变化更大(减小的较多),所以速率逐渐减小;,
故答案为:刚开始时受温度和浓度两方面的影响,速率较快,随着反应的进行,双氧水的浓度逐渐减小,反应速率也逐渐减小;
④2H2O2 2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图像可知,生成氧气的体积为60mL,则可列比例式:
2H2O2 2H2O+O2↑
2mol 22.4L
n(H2O2) 0.06L
,解得:n(H2O2)=0.00536mol,所以;
故答案为:0.107 mol L 1。
18. A ABCD 便于观察长导管中液面高度的变化; 盐酸 相同 > HSO4 1.0×10-15 1.0×10-13mol/L
【分析】(1)CH3COOH溶液加水稀释过程中,醋酸的电离程度增大,氢离子浓度、醋酸根离子浓度减小;由于温度不变,则电离平衡常数、水的离子积不变;升高温度后醋酸的电离程度增大,则溶液中氢离子浓度增大、水的离子积增大、电离平衡常数增大;
(2)①装置A、B中用红墨水而不用水,便于观察长导管中液面高度的变化;
②实验刚开始时,盐酸溶液中的c(H+)大,与等质量的锌粒反应时单位时间内放出的热量多,产生的H2多,所以装置中压强大,长导管中液面上升快;两装置反应刚结束时(无固体剩余),发现装置A中的长导管液面比装置B中的高,静置一会后,温度下降压强减小,两装置中的长导管液面均有所下降,但二者产生的氢气的量相等,所以最终液面高度相同;
(3)①由于纯硫酸的导电性显著强于纯水,所以25℃时,液态纯硫酸的离子积常数K(H2SO4)>1×10 14;
②由于纯硫酸的电离能力强于纯硝酸,则在纯硫酸和纯硝酸的液态混合酸中2H2SO4 H3SO4++HSO4 为主要的电离方式;
(4)①该温度下,溶液中水的离子积常数Kw=c(H+)·c(OH-),即Kw=10x×10y=10x+y;
②0.01mol/LNaOH溶液中c(OH-)=0.01mol/L,H+全部由水电离得到,根据水的离子积常数计算氢离子浓度,再依据c水(OH-)=c水(H+)计算溶液中水电离出c(OH-)。
【详解】(1)CH3COOH溶液加水稀释过程中,醋酸的电离程度增大,氢离子浓度、醋酸根离子浓度减小;由于温度不变,则电离平衡常数、水的离子积不变;
A. 0.1 mol L 1的CH3COOH溶液加水稀释过程中,氢离子浓度减小,故A正确;
B. Kw=c(H+) c(OH )只受温度的影响,温度不变,则其值是一个常数,故B错误;
C. 由于,醋酸根离子浓度减小,温度不变,电离平衡常数不变,则增大,故C错误;
D. 为醋酸的电离平衡常数,由于温度不变,则电离平衡常数不变,故D错误;
若该溶液升高温度,醋酸、水的电离程度均增大,则溶液中氢离子、醋酸根离子浓度都增大,醋酸分子的浓度减小,水的离子积增大、电离平衡常数增大;
A. 升高温度,促进醋酸的电离,溶液中氢离子浓度增大,故A正确;
B. Kw=c(H+) c(OH )为水的离子积,升高温度后水的电离程度增大,则水的离子积增大,故B正确;
C. 升高温度,醋酸的电离程度增大,氢离子浓度增大,醋酸分子的浓度减小,则的比值增大,故C正确;
D. 为醋酸的电离平衡常数,升高温度,电离平衡常数增大,故D正确;
故答案为:A;ABCD;
(2)①装置A、B中用红墨水而不用水的原因是便于观察长导管中液面高度的变化;
故答案为:便于观察长导管中液面高度的变化;
②实验刚开始时,盐酸溶液中的c(H+)大,与等质量的锌粒反应时单位时间内放出的热量多,产生的H2多,所以装置中压强大,长导管中液面上升快,所以若发现装置A中的长导管液面上升的比装置B的要高,则胶头滴管a中盛的是盐酸;两装置反应刚结束时(无固体剩余),发现装置A中的长导管液面比装置B中的高,静置一会后,温度下降压强减小,两装置中的长导管液面均有所下降,但二者产生的氢气的量相等,所以最终液面高度相同;
故答案为:盐酸;相同;
(3)①根据实验表明,液态时,纯硫酸的导电性显著强于纯水,已知液态纯酸都能像水那样进行自身电离(H2O+H2O H3O++OH )而建立平衡,且在一定温度下都有各自的离子积常数,这些信息告诉我们纯硫酸存在着电离平衡,且电离程度强于纯水,仿照纯水的电离方式,可以推知纯硫酸的电离方程式为:2H2SO4 H3SO4++HSO4 ,由于纯硫酸的导电性显著强于纯水,所以25℃时,液态纯硫酸的离子积常数K(H2SO4)>1×10 14;
故答案为:>;
②由于纯硫酸的电离能力强于纯硝酸,则在纯硫酸和纯硝酸的液态混合酸中2H2SO4 H3SO4++HSO4 为主要的电离方式,而纯硝酸电离受到纯硫酸电离出的H+的抑制,因此在纯硫酸和纯硝酸的液态混合酸中,存在的阴离子主要是HSO4 ;
故答案为:HSO4 ;
(4)①该温度下,溶液中水的离子积常数Kw=c(H+)·c(OH-),即Kw=10x×10y=10x+y,由图像可知,x+y=-15,故Kw=1.0×10-15;
故答案为:1.0×10-15;
②该温度下,水的离子积常数为10-15,0.01mol/LNaOH溶液中c(OH-)=0.01mol/L,H+全部由水电离得到,根据水的离子积常数得溶液中c水(H+)=c水(OH-)=;
故答案为:1.0×10-13mol/L。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
