钛及钛的化合物-高考化学考前专项练习试题(含解析)
文档属性
| 名称 | 钛及钛的化合物-高考化学考前专项练习试题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 981.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-13 12:25:43 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
钛及钛的化合物
共13题,满分100分
题号 一 二 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请注意保持试卷整洁
一、单选题(共50分)
1.(本题5分)二氧化钛()是一种重要的工业原料,某学习小组由酸性含钛废液(含、、、)制备的主要流程如下,已知不溶于水和硫酸。下列说法正确的是
A.加入铁粉时可以加热,温度越高越好
B.“结晶”的操作是:蒸发结晶,趁热过滤
C.“洗涤”时先将沉淀转移至烧杯中再加入洗涤剂
D.该方法中可以循环使用
2.(本题5分)发展改变生活。下列说法不正确的是
A.T-碳()是一种碳的三维结构晶体,其与互为同位素
B.“天问一号”中形状记忆合金的两种金属都属于过渡金属
C.“祝融号”火星探测器上使用的钛合金具有密度小、强度高、耐高温的特性
D.清华大学打造的世界首款异构融合类脑芯片——天机芯的主要材料是硅单质
3.(本题5分)钛铁矿( FeTiO3)制取金属钛的流程如图所示(已知TiCl4为无色液体,极易水解;Ti3+的还原性强于Fe2+)
下列说法正确的是
A.钛铁矿( FeTiO3)中Ti的化合价是+3
B.氯化过程中反应2FeTiO3+6C+7Cl22FeCl3+6CO+ 2TiCl4
C.镁与TiCl4置换时可以用氮气做保护气
D.制取金属钛时可以用Na与TiCl4溶液反应
4.(本题5分)化学与生产生活密切相关,下列说法不正确的是
A.在室外大雪的时候可以用作融雪剂,原因是因为其溶解的时候可以放热
B.铬是硬度最高的金属,常在不锈钢中添加
C.为半导体,可做新型太阳能电池主要材料
D.氧化镁在工业生产中常用作耐火材料
5.(本题5分)化学推动着社会的进步和科技的创新,下列说法错误的是
A.晶体的X射线衍射实验无法获得键长和键角的数值
B.“奋斗者”号潜水器外壳材料为钛合金,钛元素属于第ⅣB族元素
C.抗击新冠疫情时,84消毒液、二氧化氯泡腾片都可作为环境消毒剂
D.“天和核心舱”电推进系统中的腔体采用的氮化硼陶瓷属于新型无机非金属材料
6.(本题5分)二氧化钛()是一种重要的工业原料,某学习小组由酸性含钛废液(含、、、)制备的主要流程如下,已知不溶于水和硫酸。下列说法正确的
A.加入铁粉时可以加热,温度越高越好 B.结晶时可在坩埚中蒸干溶剂获得绿矾
C.“洗涤”时先将沉淀转移至烧杯中再加入洗涤剂 D.该方法中可以循环使用
7.(本题5分)钛酸亚铁()在高温下经氯化得到四氯化钛,再制取金属钛的流程如图所示(已知电负性Ti:1.54,F:3.98,Cl:3.16):
下列说法正确的是
A.氯化过程中,每消耗6 mol碳单质,转移电子14 mol
B.氯化过程中,既是氧化剂也是还原剂
C.相对分子质量:,熔点:
D.制取金属钛时也可以选用隔绝空气
8.(本题5分)钛(熔点为1668℃)广泛应用于生活和科技等各领域,用镁还原制取金属钛是钛生产的重要方法,其简化工艺流程如下,下列说法错误的是
A.工业上,一般选择电解熔融制备金属
B.“高温还原”时,发生反应的化学方程式为
C.“真空蒸馏”的目的是为了降低单质和的沸点,使其气化分离出去
D.“电解”时,阴极上生成单质a,可用作其他联产过程的氧化剂
9.(本题5分)化学与生活密切相关。下列说法错误的是
A.明矾净水时有杀菌消毒的作用
B.硅胶可用作食品的干燥剂
C.钛合金可用于飞机、人造卫星和宇宙飞船等领域
D.漂白粉和洁厕灵不能混合使用
10.(本题5分)金属钛有“未来金属”之称,具有低密度、高硬度等性能,化学性质稳定。钛的化合价主要有+4价和+3价,其中+3价钛极易被氧化。下列有关说法不正确的是
A.钛元素位于周期表第四周期 B.化学性质不稳定
C.(钛酸亚铁)中钛的化合价为+3价 D.钛及其合金可广泛应用于航空领域
二、解答题(共50分)
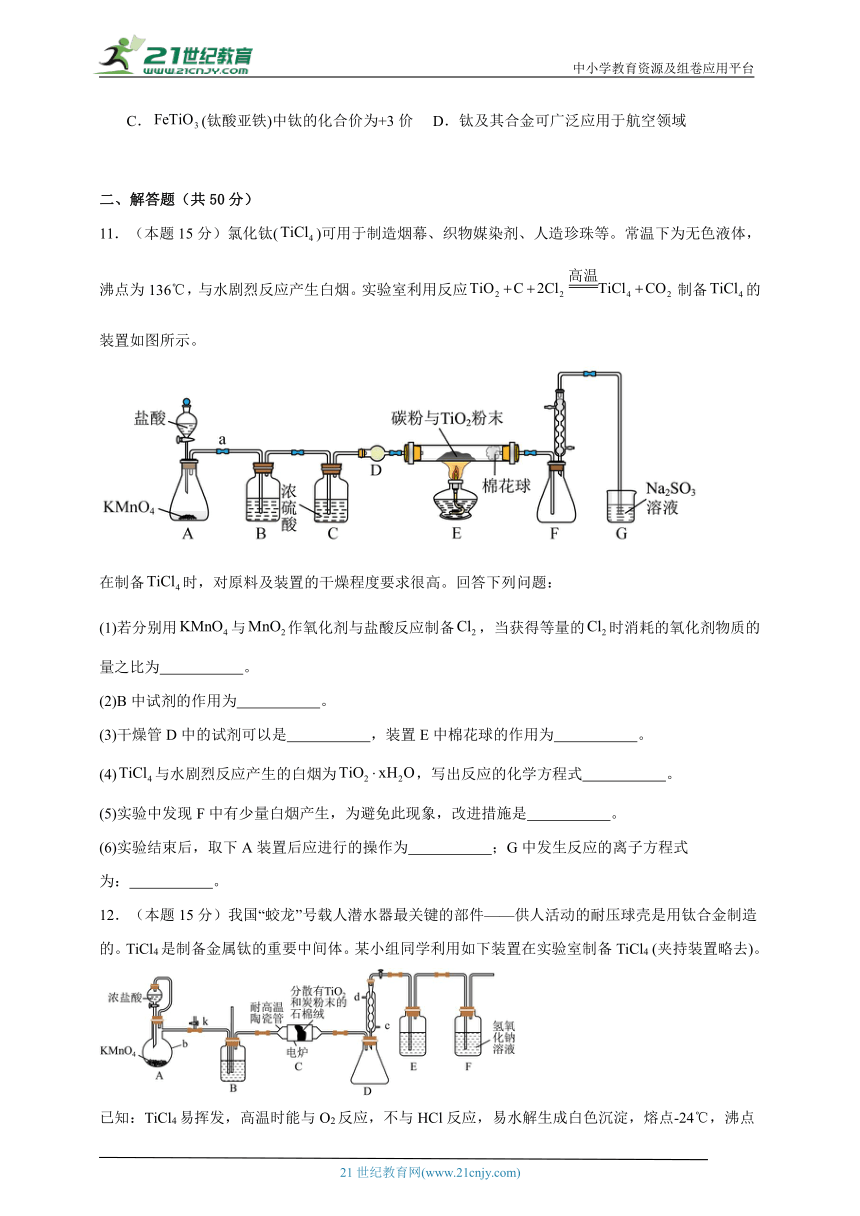
11.(本题15分)氯化钛()可用于制造烟幕、织物媒染剂、人造珍珠等。常温下为无色液体,沸点为136℃,与水剧烈反应产生白烟。实验室利用反应制备的装置如图所示。
在制备时,对原料及装置的干燥程度要求很高。回答下列问题:
(1)若分别用与作氧化剂与盐酸反应制备,当获得等量的时消耗的氧化剂物质的量之比为 。
(2)B中试剂的作用为 。
(3)干燥管D中的试剂可以是 ,装置E中棉花球的作用为 。
(4)与水剧烈反应产生的白烟为,写出反应的化学方程式 。
(5)实验中发现F中有少量白烟产生,为避免此现象,改进措施是 。
(6)实验结束后,取下A装置后应进行的操作为 ;G中发生反应的离子方程式为: 。
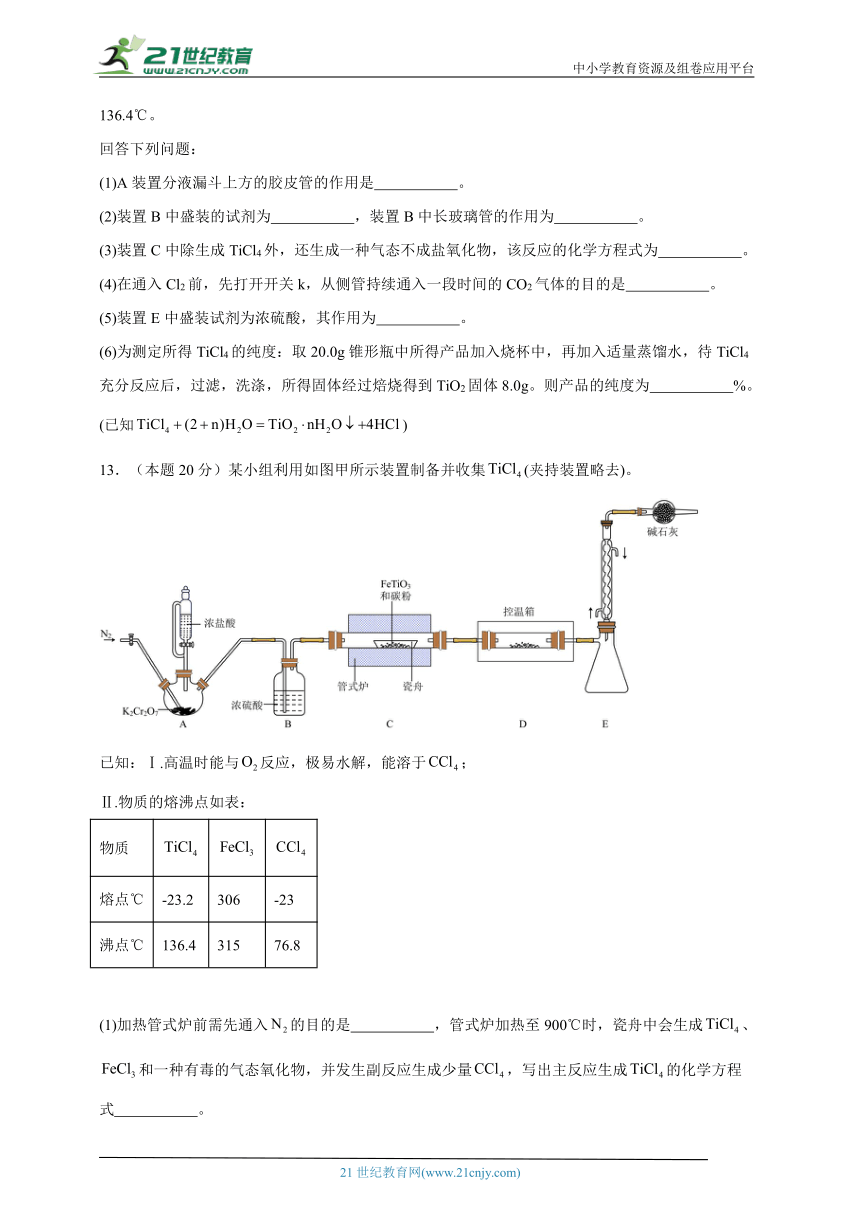
12.(本题15分)我国“蛟龙”号载人潜水器最关键的部件——供人活动的耐压球壳是用钛合金制造的。TiCl4是制备金属钛的重要中间体。某小组同学利用如下装置在实验室制备TiCl4 (夹持装置略去)。
已知:TiCl4易挥发,高温时能与O2反应,不与HCl反应,易水解生成白色沉淀,熔点-24℃,沸点136.4℃。
回答下列问题:
(1)A装置分液漏斗上方的胶皮管的作用是 。
(2)装置B中盛装的试剂为 ,装置B中长玻璃管的作用为 。
(3)装置C中除生成TiCl4外,还生成一种气态不成盐氧化物,该反应的化学方程式为 。
(4)在通入Cl2前,先打开开关k,从侧管持续通入一段时间的CO2气体的目的是 。
(5)装置E中盛装试剂为浓硫酸,其作用为 。
(6)为测定所得TiCl4的纯度:取20.0g锥形瓶中所得产品加入烧杯中,再加入适量蒸馏水,待TiCl4充分反应后,过滤,洗涤,所得固体经过焙烧得到TiO2固体8.0g。则产品的纯度为 %。(已知)
13.(本题20分)某小组利用如图甲所示装置制备并收集(夹持装置略去)。
已知:Ⅰ.高温时能与反应,极易水解,能溶于;
Ⅱ.物质的熔沸点如表:
物质
熔点℃ -23.2 306 -23
沸点℃ 136.4 315 76.8
(1)加热管式炉前需先通入的目的是 ,管式炉加热至900℃时,瓷舟中会生成、和一种有毒的气态氧化物,并发生副反应生成少量,写出主反应生成的化学方程式 。
(2)为除去中的应调节控温箱的温度范围为 ℃。
(3)碱石灰的作用是 ,该装置的缺陷是 。
(4)已知在碳化物中硬度最大,工业上一般在真空和高温(>1800℃)条件下用C还原制取:。
①基态Ti原子的电子排布式为 。
②反应中涉及的元素第一电离能最大的是 ,中化学键类型为 。
③是一种优良的颜料,其晶胞结构如图。
则黑球代表 (填“Ti”或“O”)。该晶体的密度为 (用含a、b、的代数式表示,为阿伏加德罗常数的值)。
参考答案:
1.D
【分析】酸性含钛废液加入铁粉,三价铁转化为二价铁,结晶得到FeSO4 7H2O晶体,过滤母液水解得到,洗涤煅烧得到二氧化钛;
【详解】A.温度升高导致水解造成钛元素损失,A错误;
B.“结晶”的操作中为防止温度过高导致水解造成钛元素损失,应该在较低温度结晶,B错误;
C.“洗涤”时直接在漏斗内洗涤即可,C错误;
D.该方法中可以循环使用,以节约原料控制生产成本,D正确;
故选D。
2.A
【详解】A.T-碳与为同种元素组成的不同单质,所以两者互为同素异形体,A错误;
B.Ti位于第四周期IVB族,Ni位于第四周期VIII族,两者均属于过渡金属元素,B正确;
C.钛合金密度小、强度高、耐高温,C正确;
D.硅单质是计算机芯片的主要成分,D正确;
答案选A。
3.B
【分析】FeTiO3中加入焦炭,再通入Cl2,焦炭被氧化为CO,FeTiO3转化为FeCl3、TiCl4;再加入Mg粉,在Ar存在的环境中加热至800℃,可制得Ti。
【详解】A.Ti3+的还原性强于Fe2+,则Fe3+能将Ti3+氧化为Ti4+,所以钛铁矿( FeTiO3)中Ti的化合价是+4价,A不正确;
B.氯化过程中,Cl2将C氧化为CO,Fe2+氧化为Fe3+,则发生反应2FeTiO3+6C+7Cl22FeCl3+6CO+ 2TiCl4,B正确;
C.镁是活泼的金属元素,能与氮气反应生成氮化镁,则镁与TiCl4置换时不能用氮气做保护气,C不正确;
D.Na能与水反应,则制取金属钛时可以用Na与TiCl4的熔融液反应,不能使用TiCl4的水溶液,D不正确;
故选B。
4.A
【详解】A.氯化镁可以用作融雪剂,原因是雪-氯化镁混合物的熔点低于雪的熔点,使雪能够在比正常情况更低的温度下就能融化,故A错误;
B.铬是硬度最高的金属,常在不锈钢中添加,增强不锈钢的耐腐蚀性,故B正确;
C.为半导体,作为光电极很稳定,制作简单,可做新型太阳能电池主要材料,故C正确;
D.氧化镁的熔点高,常在工业生产中常用作耐火材料,故D正确;
综上所述,答案为A。
5.A
【详解】A.通过晶体的X射线衍射实验,可以确定晶体中哪些原子间存在化学键、并能确定键长和键角,从而得出物质的空间结构,A错误;
B.“奋斗者”号潜水器外壳材料为钛合金,Ti是22号元素,位于第四周期第ⅣB族,B正确;
C.84消毒液的有效成分是NaClO,NaClO、ClO2都具有强氧化性,故84消毒液、二氧化氯泡腾片都可作为环境消毒剂,C正确;
D.“天和核心舱”电推进系统中的腔体采用的氮化硼陶瓷属于新型无机非金属材料,D正确;
故选A。
6.D
【详解】A.升高温度能加快化学反应速率,但升高温度促进Fe2+和Fe3+水解生成氢氧化物沉淀,所以不是温度越高越好,故A错误;
B.结晶应在蒸发皿中进行,为获得绿矾晶体,不能将溶剂蒸干,故B错误;
C.洗涤时直接在过滤器中加水淋洗,并用玻璃棒不断搅拌,重复此操作2~3遍,故C错误;
D.水解所得滤液中的溶质有、,洗涤时需要稀硫酸,所以该方法中硫酸可以循环使用,故D正确;
故答案选D。
7.A
【分析】FeTiO3在高温下经氯化得到TiCl4,该反应的化学方程式为;TiCl4和Mg在Ar气氛中、800℃反应生成Ti,该反应的化学方程式为TiCl4+2MgTi+2MgCl2。
【详解】A.氯化过程中发生反应的化学方程式为,该反应中FeTiO3和C作还原剂,Cl2作氧化剂,每消耗6mol碳单质,就有7mol Cl2参加反应,转移电子14mol,A正确;
B.中Fe的化合价为+2,反应后被氧化为+3,因此作还原剂,B错误;
C.已知电负性Ti:1.54,F:3.98,Cl:3.16,则属于离子晶体,属于分子晶体,离子晶体的熔点高于分子晶体,C错误;
D.制取金属钛时,不可以选用CO2隔绝空气,因为Mg与发生反应,D错误;
故选A。
8.D
【分析】工业生产一般采用电解熔融的方法制镁,则a为氯气,所得Mg通过“高温还原” 、发生反应制取金属钛,再经过真空蒸馏提纯钛等步骤得到钛产品。
【详解】A.由于的熔点高,电解制备金属能耗大,工业生产一般采用电解熔融的方法,A项正确;
B.还原时,发生反应的化学方程式为,B项正确;
C.真空蒸馏时,需要将金属、分离除去,由于金属钛的熔点很高,因此真空蒸馏的目的是为了降低单质和的沸点,C项正确;
D.工业生产中,阳极上发生反应为:,可用作其他联产过程的氧化剂,D项错误;
答案选D。
9.A
【详解】A.明矾净水的原理是生成氢氧化铝胶体,吸附水中的杂质,并没有杀菌消毒的作用,A错误;
B.硅胶多孔,吸附水分子的能力强,可以作为食品的干燥剂,B正确;
C.钛合金硬度大,熔点高,化学性质稳定,耐腐蚀,所以可以用于飞机或人造卫星或宇宙飞船等,C正确;
D.漂白粉的主要成分为次氯酸钙,洁厕灵的主要成分为盐酸,二者反应生成氯气,有毒,故不能混合使用,D正确;
故选A。
10.C
【详解】A.钛元素是22号元素,位于周期表第四周期,A正确;
B.价钛极易被氧化,所以化学性质不稳定,B正确;
C.根据化合价代数和为零,钛酸亚铁中铁为价,所以钛的化合价为价,C错误;
D.钛及其合金具有密度小、强度高、耐酸、碱腐蚀等优良性能,被广泛用于航天,D正确;
故答案为:C。
11.(1)2:5
(2)除去Cl2中的HCl
(3) 白色CuSO4粉末 防止碳粉与TiO2粉末堵塞玻璃管管口
(4)
(5)在F、G之间接一个盛有浓硫酸的洗气瓶、或者将G装置换成盛碱石灰的干燥管
(6) 关上a处和F装置后干燥装置后导管处的止水夹冷却到室温后、停止通冷凝水;并把A装置的导气管插入G中,以防止A装置产生残余氯气
【分析】A中制备氯气,B中盛放饱和食盐水,用于除去Cl2中的HCl,C中盛放浓硫酸,用于干燥氯气,D中放白色CuSO4粉末、用于检验Cl2中的水蒸气是否已除去,E中发生反应,F中通过冷凝收集,为防止水分进入F中引起水解,F后应该接一个干燥装置,G中亚硫酸钠和氯气发生氧化还原反应、为尾气处理装置。
【详解】(1)若分别用与作氧化剂与盐酸反应制备,根据、MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,当获得等量的时消耗高锰酸钾和二氧化锰的物质的量之比为2:5,即消耗的氧化剂物质的量之比为2:5。
(2)据分析,B中试剂的作用为除去Cl2中的HCl。
(3)在制备时,对原料及装置的干燥程度要求很高,则进入E的氯气需干燥而纯净,D用于检验Cl2中的水蒸气是否已除去,则干燥管D中的试剂可以是白色CuSO4粉末,若白色粉末不变蓝说明Cl2中的水蒸气已除去,装置E中棉花球的作用为:防止碳粉与TiO2粉末堵塞玻璃管管口。
(4)与水剧烈反应产生的白烟为,反应的化学方程式为: 。
(5)实验中发现F中有少量白烟产生,为与水剧烈反应产生的,为避免此现象,需防止G中水分进入F中,则收集四氯化钛后还要干燥装置(例如通入盛有浓硫酸的洗气瓶)后再进行多余氯气的处理,故改进措施是:在F、G之间接一个盛有浓硫酸的洗气瓶、或者将G装置换成盛碱石灰的干燥管(防止水蒸气进入装置F同时吸收氯气)。
(6)当观察到球形冷凝管没有液体滴下时说明反应结束,反应结束后应继续通入一段时间Cl2,主要目的是排出残留在装置中的TiCl4,同时防止冷却使液体倒吸入F中,停止通氯气后还需要在干燥环境中继续冷却F装置到室温,则在取下A装置后应进行的操作为:关上a处和F装置后干燥装置后导管处的止水夹冷却到室温后、停止通冷凝水、并把A装置的导气管插入G中,以防止A装置产生残余氯气;G中亚硫酸钠和氯气发生氧化还原反应,发生反应的离子方程式为:。
12.(1)平衡气压,有利于浓盐酸(或液体)顺利滴下
(2) 浓硫酸 平衡气压(或答“做安全管”、“缓冲压强”、“防堵塞的安全装置”等合理即可)
(3)
(4)排除装置中的空气,防止TiCl4和O2反应
(5)防止F装置中的水蒸气进入D中,使TiCl4水解
(6)95.0或95
【分析】制取TiCl4时,用TiO2与Cl2、C在高温下反应,由于TiCl4易挥发,高温时能与O2反应,不与HCl反应,易水解生成白色沉淀,所以反应装置中应不含有空气、水蒸气,反应过程中应排尽装置内的空气、水蒸气,反应过程中还应防止水蒸气的进入。A装置用于制取Cl2,B装置为安全瓶,C装置为制取TiCl4的装置,D装置用于收集TiCl4液体,E装置用于防止F中产生水蒸气的进入,F装置是尾气处理装置。
【详解】(1)A装置分液漏斗上方的胶皮管,可保持分液漏斗内外压强相等,则其作用是:平衡气压,有利于浓盐酸(或液体)顺利滴下。
(2)装置B用于干燥氯气,则盛装的试剂为浓硫酸;由分析可知,装置B中长玻璃管的作用为:平衡气压(或答“做安全管”、“缓冲压强”、“防堵塞的安全装置”等合理即可)。
(3)装置C中除生成TiCl4外,还生成一种气态不成盐氧化物,此气体应为CO,该反应的化学方程式为。
(4)在通入Cl2前,需排尽装置内的空气,先打开开关k,从侧管持续通入一段时间的CO2气体的目的是:排除装置中的空气,防止TiCl4和O2反应。
(5)因为TiCl4易水解生成白色沉淀,所以装置E中盛装试剂为浓硫酸,其作用为:防止F装置中的水蒸气进入D中,使TiCl4水解。
(6)TiO2固体8.0g,物质的量为=0.1mol,TiCl4的物质的量也为0.1mol,质量为0.1mol×190g/mol=19g,则产品的纯度为=95.0或95%。
【点睛】若C装置内导管发生堵塞,B装置中液体可进入长导管内,以平衡内外压强。
13.(1) 排出装置中的空气,防止与空气中的反应
(2)136.4~306
(3) 极易水解,防止空气中的水蒸气进入E装置 缺少处理尾气的装置
(4) (或) O 共价键 Ti
【分析】A为氯气的发生装置,B除去氯气中的水蒸气,C为氯化钛的发生装置,D除去氯化钛中的氯化钛,E为氯化钛收集装置,碱石灰除去空气中的水蒸气,防止氯化钛水解,据此回答。
【详解】(1)①由信息Ⅰ可知,高温时能与反应,故加热管式炉前通入的目的是排出装置中的空气,防止与空气中的反应;
②瓷舟中会生成 TiCl 4、FeCl3 和一种有毒的气态氧化物,并发生副反应生成少量CCl4,化学方程式:;
(2)根据信息Ⅱ可知,除去中的应调节控温箱温度高于的沸点,低于的熔点;
(3)①极易水解,需在收集的装置后增加防水装置,故碱石灰的作用是防止空气中的水蒸气进入E装置;
②管式炉中发生的主反应的生成物中含有气体,故该装置的缺陷是缺少处理尾气的装置;
(4)①钛的原子序数为22,基态钛原子的电子排布式是;
②金属元素第一电离能一般小于非金属元素,钛属于金属元素,第一电离能最小,C、O元素为同周期主族元素,一般情况下,第一电离能从左至右依次增大,第一电离能:O>C;
③TiC中化学键类型为共价键;
④据图知,1个晶胞中黑球个数为,白球个数为,因此黑球代表Ti,白球代表O;
⑤1个晶胞的质量为,1个晶胞的体积为,则晶体密度为。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
钛及钛的化合物
共13题,满分100分
题号 一 二 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请注意保持试卷整洁
一、单选题(共50分)
1.(本题5分)二氧化钛()是一种重要的工业原料,某学习小组由酸性含钛废液(含、、、)制备的主要流程如下,已知不溶于水和硫酸。下列说法正确的是
A.加入铁粉时可以加热,温度越高越好
B.“结晶”的操作是:蒸发结晶,趁热过滤
C.“洗涤”时先将沉淀转移至烧杯中再加入洗涤剂
D.该方法中可以循环使用
2.(本题5分)发展改变生活。下列说法不正确的是
A.T-碳()是一种碳的三维结构晶体,其与互为同位素
B.“天问一号”中形状记忆合金的两种金属都属于过渡金属
C.“祝融号”火星探测器上使用的钛合金具有密度小、强度高、耐高温的特性
D.清华大学打造的世界首款异构融合类脑芯片——天机芯的主要材料是硅单质
3.(本题5分)钛铁矿( FeTiO3)制取金属钛的流程如图所示(已知TiCl4为无色液体,极易水解;Ti3+的还原性强于Fe2+)
下列说法正确的是
A.钛铁矿( FeTiO3)中Ti的化合价是+3
B.氯化过程中反应2FeTiO3+6C+7Cl22FeCl3+6CO+ 2TiCl4
C.镁与TiCl4置换时可以用氮气做保护气
D.制取金属钛时可以用Na与TiCl4溶液反应
4.(本题5分)化学与生产生活密切相关,下列说法不正确的是
A.在室外大雪的时候可以用作融雪剂,原因是因为其溶解的时候可以放热
B.铬是硬度最高的金属,常在不锈钢中添加
C.为半导体,可做新型太阳能电池主要材料
D.氧化镁在工业生产中常用作耐火材料
5.(本题5分)化学推动着社会的进步和科技的创新,下列说法错误的是
A.晶体的X射线衍射实验无法获得键长和键角的数值
B.“奋斗者”号潜水器外壳材料为钛合金,钛元素属于第ⅣB族元素
C.抗击新冠疫情时,84消毒液、二氧化氯泡腾片都可作为环境消毒剂
D.“天和核心舱”电推进系统中的腔体采用的氮化硼陶瓷属于新型无机非金属材料
6.(本题5分)二氧化钛()是一种重要的工业原料,某学习小组由酸性含钛废液(含、、、)制备的主要流程如下,已知不溶于水和硫酸。下列说法正确的
A.加入铁粉时可以加热,温度越高越好 B.结晶时可在坩埚中蒸干溶剂获得绿矾
C.“洗涤”时先将沉淀转移至烧杯中再加入洗涤剂 D.该方法中可以循环使用
7.(本题5分)钛酸亚铁()在高温下经氯化得到四氯化钛,再制取金属钛的流程如图所示(已知电负性Ti:1.54,F:3.98,Cl:3.16):
下列说法正确的是
A.氯化过程中,每消耗6 mol碳单质,转移电子14 mol
B.氯化过程中,既是氧化剂也是还原剂
C.相对分子质量:,熔点:
D.制取金属钛时也可以选用隔绝空气
8.(本题5分)钛(熔点为1668℃)广泛应用于生活和科技等各领域,用镁还原制取金属钛是钛生产的重要方法,其简化工艺流程如下,下列说法错误的是
A.工业上,一般选择电解熔融制备金属
B.“高温还原”时,发生反应的化学方程式为
C.“真空蒸馏”的目的是为了降低单质和的沸点,使其气化分离出去
D.“电解”时,阴极上生成单质a,可用作其他联产过程的氧化剂
9.(本题5分)化学与生活密切相关。下列说法错误的是
A.明矾净水时有杀菌消毒的作用
B.硅胶可用作食品的干燥剂
C.钛合金可用于飞机、人造卫星和宇宙飞船等领域
D.漂白粉和洁厕灵不能混合使用
10.(本题5分)金属钛有“未来金属”之称,具有低密度、高硬度等性能,化学性质稳定。钛的化合价主要有+4价和+3价,其中+3价钛极易被氧化。下列有关说法不正确的是
A.钛元素位于周期表第四周期 B.化学性质不稳定
C.(钛酸亚铁)中钛的化合价为+3价 D.钛及其合金可广泛应用于航空领域
二、解答题(共50分)
11.(本题15分)氯化钛()可用于制造烟幕、织物媒染剂、人造珍珠等。常温下为无色液体,沸点为136℃,与水剧烈反应产生白烟。实验室利用反应制备的装置如图所示。
在制备时,对原料及装置的干燥程度要求很高。回答下列问题:
(1)若分别用与作氧化剂与盐酸反应制备,当获得等量的时消耗的氧化剂物质的量之比为 。
(2)B中试剂的作用为 。
(3)干燥管D中的试剂可以是 ,装置E中棉花球的作用为 。
(4)与水剧烈反应产生的白烟为,写出反应的化学方程式 。
(5)实验中发现F中有少量白烟产生,为避免此现象,改进措施是 。
(6)实验结束后,取下A装置后应进行的操作为 ;G中发生反应的离子方程式为: 。
12.(本题15分)我国“蛟龙”号载人潜水器最关键的部件——供人活动的耐压球壳是用钛合金制造的。TiCl4是制备金属钛的重要中间体。某小组同学利用如下装置在实验室制备TiCl4 (夹持装置略去)。
已知:TiCl4易挥发,高温时能与O2反应,不与HCl反应,易水解生成白色沉淀,熔点-24℃,沸点136.4℃。
回答下列问题:
(1)A装置分液漏斗上方的胶皮管的作用是 。
(2)装置B中盛装的试剂为 ,装置B中长玻璃管的作用为 。
(3)装置C中除生成TiCl4外,还生成一种气态不成盐氧化物,该反应的化学方程式为 。
(4)在通入Cl2前,先打开开关k,从侧管持续通入一段时间的CO2气体的目的是 。
(5)装置E中盛装试剂为浓硫酸,其作用为 。
(6)为测定所得TiCl4的纯度:取20.0g锥形瓶中所得产品加入烧杯中,再加入适量蒸馏水,待TiCl4充分反应后,过滤,洗涤,所得固体经过焙烧得到TiO2固体8.0g。则产品的纯度为 %。(已知)
13.(本题20分)某小组利用如图甲所示装置制备并收集(夹持装置略去)。
已知:Ⅰ.高温时能与反应,极易水解,能溶于;
Ⅱ.物质的熔沸点如表:
物质
熔点℃ -23.2 306 -23
沸点℃ 136.4 315 76.8
(1)加热管式炉前需先通入的目的是 ,管式炉加热至900℃时,瓷舟中会生成、和一种有毒的气态氧化物,并发生副反应生成少量,写出主反应生成的化学方程式 。
(2)为除去中的应调节控温箱的温度范围为 ℃。
(3)碱石灰的作用是 ,该装置的缺陷是 。
(4)已知在碳化物中硬度最大,工业上一般在真空和高温(>1800℃)条件下用C还原制取:。
①基态Ti原子的电子排布式为 。
②反应中涉及的元素第一电离能最大的是 ,中化学键类型为 。
③是一种优良的颜料,其晶胞结构如图。
则黑球代表 (填“Ti”或“O”)。该晶体的密度为 (用含a、b、的代数式表示,为阿伏加德罗常数的值)。
参考答案:
1.D
【分析】酸性含钛废液加入铁粉,三价铁转化为二价铁,结晶得到FeSO4 7H2O晶体,过滤母液水解得到,洗涤煅烧得到二氧化钛;
【详解】A.温度升高导致水解造成钛元素损失,A错误;
B.“结晶”的操作中为防止温度过高导致水解造成钛元素损失,应该在较低温度结晶,B错误;
C.“洗涤”时直接在漏斗内洗涤即可,C错误;
D.该方法中可以循环使用,以节约原料控制生产成本,D正确;
故选D。
2.A
【详解】A.T-碳与为同种元素组成的不同单质,所以两者互为同素异形体,A错误;
B.Ti位于第四周期IVB族,Ni位于第四周期VIII族,两者均属于过渡金属元素,B正确;
C.钛合金密度小、强度高、耐高温,C正确;
D.硅单质是计算机芯片的主要成分,D正确;
答案选A。
3.B
【分析】FeTiO3中加入焦炭,再通入Cl2,焦炭被氧化为CO,FeTiO3转化为FeCl3、TiCl4;再加入Mg粉,在Ar存在的环境中加热至800℃,可制得Ti。
【详解】A.Ti3+的还原性强于Fe2+,则Fe3+能将Ti3+氧化为Ti4+,所以钛铁矿( FeTiO3)中Ti的化合价是+4价,A不正确;
B.氯化过程中,Cl2将C氧化为CO,Fe2+氧化为Fe3+,则发生反应2FeTiO3+6C+7Cl22FeCl3+6CO+ 2TiCl4,B正确;
C.镁是活泼的金属元素,能与氮气反应生成氮化镁,则镁与TiCl4置换时不能用氮气做保护气,C不正确;
D.Na能与水反应,则制取金属钛时可以用Na与TiCl4的熔融液反应,不能使用TiCl4的水溶液,D不正确;
故选B。
4.A
【详解】A.氯化镁可以用作融雪剂,原因是雪-氯化镁混合物的熔点低于雪的熔点,使雪能够在比正常情况更低的温度下就能融化,故A错误;
B.铬是硬度最高的金属,常在不锈钢中添加,增强不锈钢的耐腐蚀性,故B正确;
C.为半导体,作为光电极很稳定,制作简单,可做新型太阳能电池主要材料,故C正确;
D.氧化镁的熔点高,常在工业生产中常用作耐火材料,故D正确;
综上所述,答案为A。
5.A
【详解】A.通过晶体的X射线衍射实验,可以确定晶体中哪些原子间存在化学键、并能确定键长和键角,从而得出物质的空间结构,A错误;
B.“奋斗者”号潜水器外壳材料为钛合金,Ti是22号元素,位于第四周期第ⅣB族,B正确;
C.84消毒液的有效成分是NaClO,NaClO、ClO2都具有强氧化性,故84消毒液、二氧化氯泡腾片都可作为环境消毒剂,C正确;
D.“天和核心舱”电推进系统中的腔体采用的氮化硼陶瓷属于新型无机非金属材料,D正确;
故选A。
6.D
【详解】A.升高温度能加快化学反应速率,但升高温度促进Fe2+和Fe3+水解生成氢氧化物沉淀,所以不是温度越高越好,故A错误;
B.结晶应在蒸发皿中进行,为获得绿矾晶体,不能将溶剂蒸干,故B错误;
C.洗涤时直接在过滤器中加水淋洗,并用玻璃棒不断搅拌,重复此操作2~3遍,故C错误;
D.水解所得滤液中的溶质有、,洗涤时需要稀硫酸,所以该方法中硫酸可以循环使用,故D正确;
故答案选D。
7.A
【分析】FeTiO3在高温下经氯化得到TiCl4,该反应的化学方程式为;TiCl4和Mg在Ar气氛中、800℃反应生成Ti,该反应的化学方程式为TiCl4+2MgTi+2MgCl2。
【详解】A.氯化过程中发生反应的化学方程式为,该反应中FeTiO3和C作还原剂,Cl2作氧化剂,每消耗6mol碳单质,就有7mol Cl2参加反应,转移电子14mol,A正确;
B.中Fe的化合价为+2,反应后被氧化为+3,因此作还原剂,B错误;
C.已知电负性Ti:1.54,F:3.98,Cl:3.16,则属于离子晶体,属于分子晶体,离子晶体的熔点高于分子晶体,C错误;
D.制取金属钛时,不可以选用CO2隔绝空气,因为Mg与发生反应,D错误;
故选A。
8.D
【分析】工业生产一般采用电解熔融的方法制镁,则a为氯气,所得Mg通过“高温还原” 、发生反应制取金属钛,再经过真空蒸馏提纯钛等步骤得到钛产品。
【详解】A.由于的熔点高,电解制备金属能耗大,工业生产一般采用电解熔融的方法,A项正确;
B.还原时,发生反应的化学方程式为,B项正确;
C.真空蒸馏时,需要将金属、分离除去,由于金属钛的熔点很高,因此真空蒸馏的目的是为了降低单质和的沸点,C项正确;
D.工业生产中,阳极上发生反应为:,可用作其他联产过程的氧化剂,D项错误;
答案选D。
9.A
【详解】A.明矾净水的原理是生成氢氧化铝胶体,吸附水中的杂质,并没有杀菌消毒的作用,A错误;
B.硅胶多孔,吸附水分子的能力强,可以作为食品的干燥剂,B正确;
C.钛合金硬度大,熔点高,化学性质稳定,耐腐蚀,所以可以用于飞机或人造卫星或宇宙飞船等,C正确;
D.漂白粉的主要成分为次氯酸钙,洁厕灵的主要成分为盐酸,二者反应生成氯气,有毒,故不能混合使用,D正确;
故选A。
10.C
【详解】A.钛元素是22号元素,位于周期表第四周期,A正确;
B.价钛极易被氧化,所以化学性质不稳定,B正确;
C.根据化合价代数和为零,钛酸亚铁中铁为价,所以钛的化合价为价,C错误;
D.钛及其合金具有密度小、强度高、耐酸、碱腐蚀等优良性能,被广泛用于航天,D正确;
故答案为:C。
11.(1)2:5
(2)除去Cl2中的HCl
(3) 白色CuSO4粉末 防止碳粉与TiO2粉末堵塞玻璃管管口
(4)
(5)在F、G之间接一个盛有浓硫酸的洗气瓶、或者将G装置换成盛碱石灰的干燥管
(6) 关上a处和F装置后干燥装置后导管处的止水夹冷却到室温后、停止通冷凝水;并把A装置的导气管插入G中,以防止A装置产生残余氯气
【分析】A中制备氯气,B中盛放饱和食盐水,用于除去Cl2中的HCl,C中盛放浓硫酸,用于干燥氯气,D中放白色CuSO4粉末、用于检验Cl2中的水蒸气是否已除去,E中发生反应,F中通过冷凝收集,为防止水分进入F中引起水解,F后应该接一个干燥装置,G中亚硫酸钠和氯气发生氧化还原反应、为尾气处理装置。
【详解】(1)若分别用与作氧化剂与盐酸反应制备,根据、MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,当获得等量的时消耗高锰酸钾和二氧化锰的物质的量之比为2:5,即消耗的氧化剂物质的量之比为2:5。
(2)据分析,B中试剂的作用为除去Cl2中的HCl。
(3)在制备时,对原料及装置的干燥程度要求很高,则进入E的氯气需干燥而纯净,D用于检验Cl2中的水蒸气是否已除去,则干燥管D中的试剂可以是白色CuSO4粉末,若白色粉末不变蓝说明Cl2中的水蒸气已除去,装置E中棉花球的作用为:防止碳粉与TiO2粉末堵塞玻璃管管口。
(4)与水剧烈反应产生的白烟为,反应的化学方程式为: 。
(5)实验中发现F中有少量白烟产生,为与水剧烈反应产生的,为避免此现象,需防止G中水分进入F中,则收集四氯化钛后还要干燥装置(例如通入盛有浓硫酸的洗气瓶)后再进行多余氯气的处理,故改进措施是:在F、G之间接一个盛有浓硫酸的洗气瓶、或者将G装置换成盛碱石灰的干燥管(防止水蒸气进入装置F同时吸收氯气)。
(6)当观察到球形冷凝管没有液体滴下时说明反应结束,反应结束后应继续通入一段时间Cl2,主要目的是排出残留在装置中的TiCl4,同时防止冷却使液体倒吸入F中,停止通氯气后还需要在干燥环境中继续冷却F装置到室温,则在取下A装置后应进行的操作为:关上a处和F装置后干燥装置后导管处的止水夹冷却到室温后、停止通冷凝水、并把A装置的导气管插入G中,以防止A装置产生残余氯气;G中亚硫酸钠和氯气发生氧化还原反应,发生反应的离子方程式为:。
12.(1)平衡气压,有利于浓盐酸(或液体)顺利滴下
(2) 浓硫酸 平衡气压(或答“做安全管”、“缓冲压强”、“防堵塞的安全装置”等合理即可)
(3)
(4)排除装置中的空气,防止TiCl4和O2反应
(5)防止F装置中的水蒸气进入D中,使TiCl4水解
(6)95.0或95
【分析】制取TiCl4时,用TiO2与Cl2、C在高温下反应,由于TiCl4易挥发,高温时能与O2反应,不与HCl反应,易水解生成白色沉淀,所以反应装置中应不含有空气、水蒸气,反应过程中应排尽装置内的空气、水蒸气,反应过程中还应防止水蒸气的进入。A装置用于制取Cl2,B装置为安全瓶,C装置为制取TiCl4的装置,D装置用于收集TiCl4液体,E装置用于防止F中产生水蒸气的进入,F装置是尾气处理装置。
【详解】(1)A装置分液漏斗上方的胶皮管,可保持分液漏斗内外压强相等,则其作用是:平衡气压,有利于浓盐酸(或液体)顺利滴下。
(2)装置B用于干燥氯气,则盛装的试剂为浓硫酸;由分析可知,装置B中长玻璃管的作用为:平衡气压(或答“做安全管”、“缓冲压强”、“防堵塞的安全装置”等合理即可)。
(3)装置C中除生成TiCl4外,还生成一种气态不成盐氧化物,此气体应为CO,该反应的化学方程式为。
(4)在通入Cl2前,需排尽装置内的空气,先打开开关k,从侧管持续通入一段时间的CO2气体的目的是:排除装置中的空气,防止TiCl4和O2反应。
(5)因为TiCl4易水解生成白色沉淀,所以装置E中盛装试剂为浓硫酸,其作用为:防止F装置中的水蒸气进入D中,使TiCl4水解。
(6)TiO2固体8.0g,物质的量为=0.1mol,TiCl4的物质的量也为0.1mol,质量为0.1mol×190g/mol=19g,则产品的纯度为=95.0或95%。
【点睛】若C装置内导管发生堵塞,B装置中液体可进入长导管内,以平衡内外压强。
13.(1) 排出装置中的空气,防止与空气中的反应
(2)136.4~306
(3) 极易水解,防止空气中的水蒸气进入E装置 缺少处理尾气的装置
(4) (或) O 共价键 Ti
【分析】A为氯气的发生装置,B除去氯气中的水蒸气,C为氯化钛的发生装置,D除去氯化钛中的氯化钛,E为氯化钛收集装置,碱石灰除去空气中的水蒸气,防止氯化钛水解,据此回答。
【详解】(1)①由信息Ⅰ可知,高温时能与反应,故加热管式炉前通入的目的是排出装置中的空气,防止与空气中的反应;
②瓷舟中会生成 TiCl 4、FeCl3 和一种有毒的气态氧化物,并发生副反应生成少量CCl4,化学方程式:;
(2)根据信息Ⅱ可知,除去中的应调节控温箱温度高于的沸点,低于的熔点;
(3)①极易水解,需在收集的装置后增加防水装置,故碱石灰的作用是防止空气中的水蒸气进入E装置;
②管式炉中发生的主反应的生成物中含有气体,故该装置的缺陷是缺少处理尾气的装置;
(4)①钛的原子序数为22,基态钛原子的电子排布式是;
②金属元素第一电离能一般小于非金属元素,钛属于金属元素,第一电离能最小,C、O元素为同周期主族元素,一般情况下,第一电离能从左至右依次增大,第一电离能:O>C;
③TiC中化学键类型为共价键;
④据图知,1个晶胞中黑球个数为,白球个数为,因此黑球代表Ti,白球代表O;
⑤1个晶胞的质量为,1个晶胞的体积为,则晶体密度为。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
