铁-高考化学考前专项练习试题(含解析)
文档属性
| 名称 | 铁-高考化学考前专项练习试题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 783.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-13 12:34:54 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
铁
共18题,满分100分
题号 一 二 三 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请注意保持试卷整洁
一、单选题(共50分)
1.(本题5分)合金是一类用途广泛的金属材料。下列物质属于合金的是( )。
A.铜 B.钢 C.金刚石 D.四氧化三铁
2.(本题5分)下列叙述正确的是:
①铁能被磁铁吸引
②可以通过化合反应得到FeCl2 和Fe3O4
③Fe在纯氧中燃烧可得Fe2O3
④Fe2O3不可与水反应得Fe(OH)3,所以不能通过化合反应制Fe(OH)3
⑤Fe(OH)2在空气中加热,可得FeO
A.①② B.②④ C.②③④⑤ D.①②⑤
3.(本题5分)如图是某化学兴趣小组设计的观察铁制品锈蚀的实验装置。下列相关叙述中正确的是( )
①一段时间后,铁丝会由下向上出现锈蚀现象
②一段时间后,水面处铁丝锈蚀严重
③一段时间后,塑料瓶会变膨胀,因为铁生锈要放热
④一段时间后,塑料瓶会变瘪,因为铁生锈与空气有关
A.①② B.②④ C.②③ D.③④
4.(本题5分)下列物质能通过化合反应得到的是①NaAlO2;②NaHCO3;③Fe(OH)3④FeCl3
A.只有①②④ B.只有②③④ C.只有①③④ D.全部
5.(本题5分)在给定条件下、下列选项中所示的物质间转化均能一步实现的是
A.
B.
C.
D.
6.(本题5分)下列反应的化学方程式或离子方程式书写正确的是
A.常温下,新切开的钠表面很快变暗:2Na+O2=Na2O2
B.氧化铝与氢氧化钠溶液反应:Al2O3+2OH-=2AlO+H2O
C.向硅酸钠溶液中通入过量CO2:CO2+Na2SiO3+H2O=2Na++CO+H2SiO3↓
D.炽热的铁水不能注入未经干燥的模具,是为防止:2Fe+3H2O(g)Fe2O3+3H2
7.(本题5分)设NA是阿伏加德罗常数的值,下列说法正确的是
A.高温下11.2 g Fe与水蒸气充分反应转移的电子数目为0.6NA
B.常温下pH=12的Na2HPO4溶液中,数目比多0.01NA
C.3.4 g H2O2中O-O键数目与1.2 g金刚石中C-C键数目相同
D.常温下2 L0.5 mol·L-1CH3COONa溶液和1 L1.0 mol·L-1CH3COONa溶液离子数目不相同
8.(本题5分)稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多溶解铜粉19.2g(同时生成NO气体,下同)。向另一份中逐渐加入铁粉,产生气体的量与铁粉的质量变化如图所示,下列说法错误的是
A.原混合酸中c(HNO3)=2 mol/L B.c点时,溶液中的溶质为Fe2(SO4)3
C.ab段发生反应为:Fe+2Fe3+=3Fe2+ D.原混合酸中c (H2SO4) =4 mol/L
9.(本题5分)下列有关说法正确的是
A.NH3在催化作用下与O2反应生成N2O5
B.HClO不稳定,容易分解放出Cl2
C.过量的Fe与Cl2充分反应生成FeCl2
D.Al与浓H2SO4、NaOH溶液都能反应
10.(本题5分)下列反应中,不能产生氢气的是
A.红热的铁与水蒸气 B.钠与水 C.铝和NaOH溶液反应 D.铁与浓硫酸反应
二、判断题(共20分)
11.(本题4分)用铁制容器可以运输浓硝酸和浓H2SO4。
12.(本题4分)铁是较活泼的金属,它与卤素单质(X2)反应生成物为FeX2(_______)
13.(本题4分)铁在高温下与水蒸气反应生成和。(_____)
14.(本题4分)浓硫酸和稀硫酸在常温下都能用铁制容器储存。
15.(本题4分)Fe粉具有还原性,可用作抗氧化剂。(_______)
三、解答题(共30分)
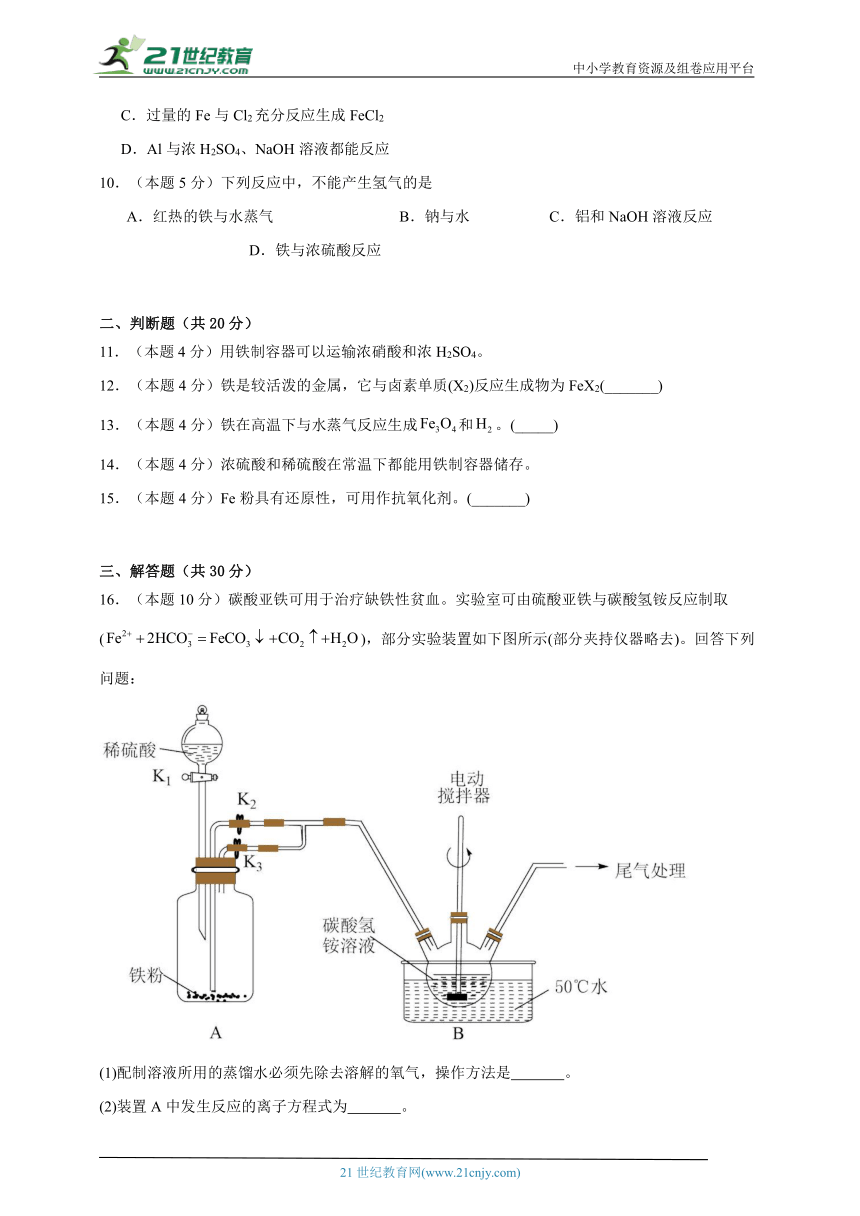
16.(本题10分)碳酸亚铁可用于治疗缺铁性贫血。实验室可由硫酸亚铁与碳酸氢铵反应制取(),部分实验装置如下图所示(部分夹持仪器略去)。回答下列问题:
(1)配制溶液所用的蒸馏水必须先除去溶解的氧气,操作方法是 。
(2)装置A中发生反应的离子方程式为 。
(3)实验开始时,先打开和一段时间,目的是 。将生成的溶液与溶液混合的操作是 。
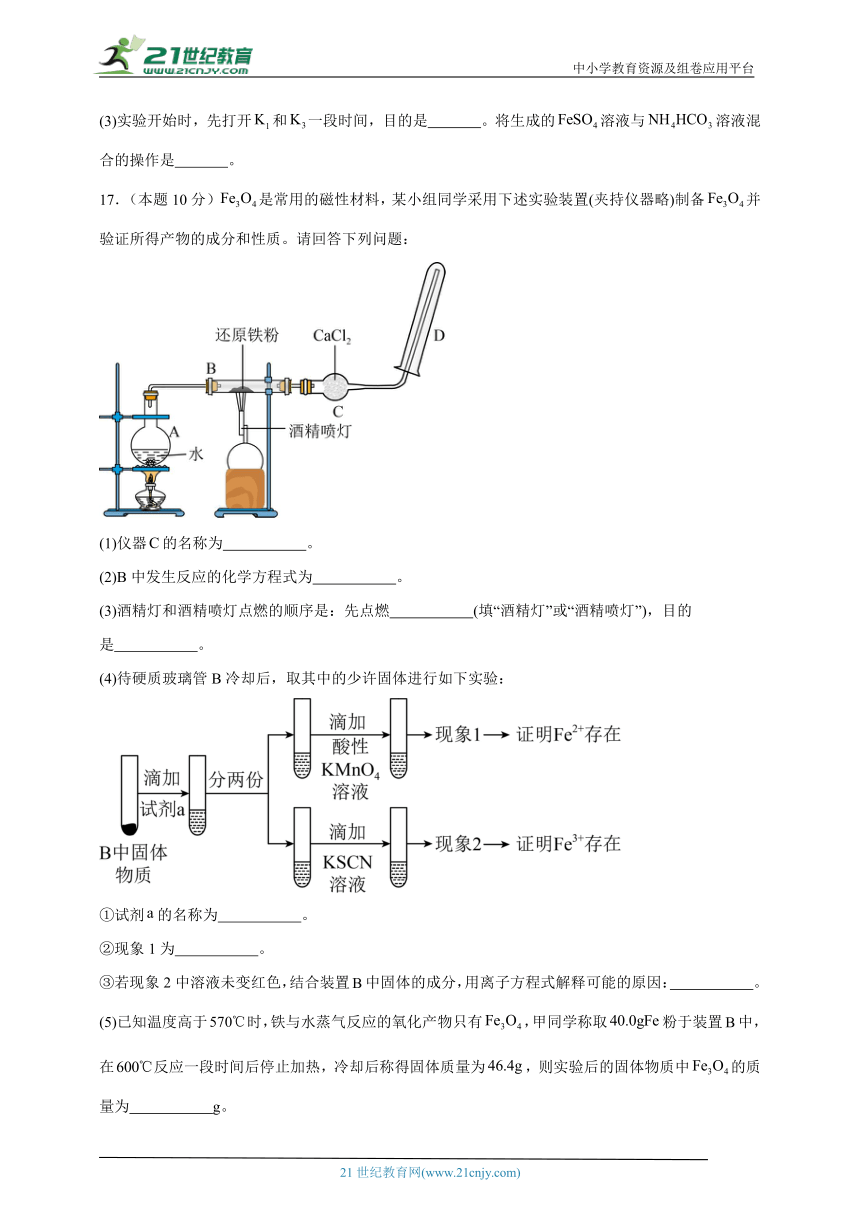
17.(本题10分)是常用的磁性材料,某小组同学采用下述实验装置(夹持仪器略)制备并验证所得产物的成分和性质。请回答下列问题:
(1)仪器的名称为 。
(2)B中发生反应的化学方程式为 。
(3)酒精灯和酒精喷灯点燃的顺序是:先点燃 (填“酒精灯”或“酒精喷灯”),目的是 。
(4)待硬质玻璃管B冷却后,取其中的少许固体进行如下实验:
①试剂的名称为 。
②现象1为 。
③若现象2中溶液未变红色,结合装置中固体的成分,用离子方程式解释可能的原因: 。
(5)已知温度高于时,铁与水蒸气反应的氧化产物只有,甲同学称取粉于装置中,在反应一段时间后停止加热,冷却后称得固体质量为,则实验后的固体物质中的质量为 g。
18.(本题10分)某同学设计如图所示装置(气密性已检查)制备Fe(OH)2白色沉淀。
请回答:
(1)装置5的作用 。
(2)实验开始时,关闭K2,打开K1,反应一段时间后,再打开K2,关闭K1,发现3中溶液不能进入4中。请为装置作一处改进,使溶液能进入4中 。
(3)装置改进后,将3中反应后溶液压入4中,在4中析出了灰绿色沉淀。从实验操作过程分析没有产生白色沉淀的原因 。
参考答案:
1.B
【详解】A,Cu属于金属单质;B,钢是含碳量为0.03%~2%之间的铁碳合金;C,金刚石是碳的一种同素异形体,属于单质;D,四氧化三铁属于金属氧化物;属于合金的是钢,答案选B。
2.A
【解析】略
3.B
【详解】在水面处的铁丝与水和氧气充分接触,即铁丝上面最先生锈,由于铁生锈需要消耗氧气,导致瓶内的气压减小,故一段时间后塑料瓶会变瘪,所以②④正确;
答案选B。
4.B
【详解】试题分析:偏铝酸钠不能通过化合反应制备;碳酸钠和水、CO2反应生成碳酸氢钠,属于化合物;氢氧化亚铁和氧气以及水化合生成氢氧化铁;氯化亚铁和氯气化合生成氯化铁,答案选B。
考点:考查物质制备
5.C
【详解】A.Fe与Cl2反应,一定生成FeCl3,A错误;
B.S与O2反应,生成SO2,三氧化硫溶于水生成硫酸,B错误;
C.N2与O2反应生成NO,NO与O2反应生成NO2,C正确;
D.CaCl2与CO2不会反应生成碳酸钙,复分解反应中弱酸不可制备强酸,D错误;
故选C。
6.B
【详解】A.常温下,新切开的钠表面很快变暗是因为生成氧化钠,反应方程式是4Na+O2=2Na2O,故A错误;
B.氧化铝与氢氧化钠溶液反应生成偏铝酸钠,反应的离子方程式是Al2O3+2OH-=2AlO+H2O,故B正确;
C.向硅酸钠溶液中通入过量CO2生成硅酸沉淀和碳酸氢钠,反应的离子方程式是2CO2+SiO+2H2O=2HCO+H2SiO3↓,故C错误;
D.炽热的铁水不能注入未经干燥的模具,是因为铁和水蒸气反应生成四氧化三铁和氢气,反应方程式是3Fe+4H2O(g)Fe3O4+4H2,故D错误;
选B。
7.D
【详解】A.11.2 g Fe的物质的量是0.2 mol,Fe与H2O蒸气在高温下反应产生Fe3O4、H2,反应方程式为3Fe+4H2O(g)Fe3O4+4H2,每3 mol Fe反应转移8 mol电子,则2 mol Fe参加反应,转移电子的物质的量是n(e-)=,则反应过程中转移的电子数目为0.53NA,A错误;
B.常温下Na2HPO4溶液pH=12,说明水解程度大于电离程度,即c()>c(),溶液体积未知,因此不能确定微粒数目的多少,B错误;
C.3.4 g H2O2的物质的量是0.1 mol,含有O-O键数目是0.1NA;在金刚石中C原子与相邻4个C原子形成共价键,每个共价键为相邻的2个C原子形成,因此1个C原子形成C-C共价键数目为4×=2个。1.2 g金刚石中含有C原子0.1 mol,则其中含有的C-C数目是0.2NA,因此3.4 g H2O2中O-O键数目与1.2 g金刚石中C-C键数目不相等,C错误;
D.2 L0.5 mol·L-1CH3COONa和1 L1.0 mol·L-1CH3COONa溶液中含有溶质CH3COONa的物质的量都是1 mol,但CH3COONa是强碱弱酸盐,CH3COO-会发生水解反应而消耗,且浓度越小,离子水解程度越大,未水解的该离子浓度就越小,因此两种溶液中含有的离子数目不相等,D正确;
故合理选项是D。
8.B
【分析】由图象可知,铁粉质量逐渐增加,oa段发生反应为Fe++4H+=Fe3++NO↑+2H2O,ab段气体的量不变,且Fe3+的氧化性大于H+,则发生反应为Fe+2Fe3+=3Fe2+,bc段又产生气体,则发生反应为Fe+2H+=Fe2++H2↑;据此分析解答。
【详解】A.由上述分析可知,oa段发生反应为Fe++4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,每份混合液中n(HNO3)=n()=n(Fe)==0.2mol,则原混合酸中稀硝酸的物质的量浓度为c(HNO3)==2mol/L,故A正确;
B.由上述分析可知,硝酸全部起氧化剂作用,没有显酸性的硝酸,c点时,铁单质全部转化为亚铁离子,所以c点溶质为FeSO4,故B错误;
C.由上述分析可知,氧化性Fe3+>H+,ab段加入铁粉,先与Fe3+反应,所以ab段气体量不变,即发生反应为Fe+2Fe3+=3Fe2+,故C正确;
D.由上述分析可知,c溶质为FeSO4,由元素守恒,则每份中n(H2SO4)=n(FeSO4)=n(Fe)= =0.4mol,则原混合酸中稀硫酸的物质的量浓度为c(H2SO4)==4mol/L,故D正确;
答案为B。
9.D
【详解】A.氨气在催化作用下与O2反应生成NO,A错误;
B.HClO易分解生成HCl和O2,B错误;
C.无论Fe是否过量,与氯气反应时只能生成氯化铁,C错误;
D.Al在浓硫酸中钝化,钝化的过程Al被氧化为氧化铝、发生了反应,Al与NaOH溶液可以反应生成偏铝酸钠和氢气,D正确;
综上所述答案为D。
10.D
【详解】A、红热的铁与水蒸气反应:3Fe+4H2O(g)Fe3O4+4H2↑,有氢气产生,故A不符合题意;
B、Na与水反应:2Na+2H2O=2NaOH+H2↑,有氢气产生,故B不符合题意;
C、铝与氢氧化钠溶液的反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,有氢气产生,故C不符合题意;
D、铁常温下与浓硫酸发生钝化反应,不产生氢气,故D符合题意。
11.正确
【详解】常温下铁与浓硝酸、浓硝酸发生钝化,因此可以用铁制容器可以运输浓硝酸和浓H2SO4,故正确;
12.错误
【详解】由于F2、Cl2、Br2、I2的氧化性依次减弱,铁是较活泼的金属,它与卤素单质(X2)反应分别为:2Fe+3F22FeF3、2Fe+3Cl22FeCl3、2Fe+3Br22FeBr3、Fe+I2FeI2,即除I2的生成物为FeX2,其余均为FeX3,故答案为:错误。
13.正确
【详解】铁在高温下与水蒸气反应生成和,故正确。
14.错误
【详解】稀硫酸在常温下能与铁反应生成硫酸亚铁和氢气,不能用铁制容器储存
15.正确
【详解】Fe粉能够与空气中的氧气发生反应,失去电子,表现还原性,因此可用作抗氧化剂,除去其中氧气,防止物质氧化变质,故上述说法是正确的。
16.(1)将蒸馏水煮沸后密封冷却
(2)
(3) 使铁与稀硫酸反应制备硫酸亚铁、产生氢气排尽装置内的空气 关闭、打开
【分析】打开活塞K1、K3,A中稀硫酸和铁粉发生反应生成硫酸亚铁和氢气,关闭K1、K3,打开K2,通过气体压强使硫酸亚铁溶液进入B装置,B装置中发生反应。
【详解】(1)氧气在蒸馏水中的溶解度随温度的升高而降低,所以配制溶液所用的蒸馏水必须先除去水中溶解的氧气,具体方法是将蒸馏水煮沸后密封冷却;
(2)装置A中是铁与稀硫酸反应生成硫酸亚铁和氢气,其离子方程式为:Fe+2H+=Fe2++H2↑;
(3)实验开始时,先打开活塞K1、K3一段时间的目的是:使铁与稀硫酸反应制备硫酸亚铁、产生氢气排尽装置内的空气,并产生气体方便利用压强使产生的硫酸亚铁溶液进入装置B中。将生成的溶液与溶液混合的操作是:关闭K1、K3,打开K2,利用气体压强使A中的硫酸亚铁溶液进入B装置中。
17.(1)球形干燥管
(2)
(3) 酒精灯 排净装置中空气
(4) 稀硫酸 酸性KMnO4溶液褪色(或溶液红色褪去)
(5)23.2
【分析】A中制取水蒸气,B中Fe和水蒸气反应生成四氧化三铁和氢气,C用于干燥氢气,D收集检验氢气;
探究B中铁和水反应的黑色固体产物的成分,黑色固体是四氧化三铁或是氧化亚铁,待硬质玻璃管B冷却后,取少许其中的固体物质于试管中,加入足量1mol·L-1稀硫酸溶解;各取少量上述溶液,分别滴加2~3滴酸性KMnO4溶液和硫氰化钾溶液,检验亚铁离子和铁离子,确定氧化物的成分;
【详解】(1)仪器的名称为球形干燥管;
(2)Fe和水蒸气反应生成四氧化三铁和氢气,;
(3)铁会和空气中氧气反应,故实验中先点燃A处酒精灯,生成水蒸气排净装置中空气,再点燃B出酒精喷灯,使得水和铁反应;
(4)①已知酸性KMnO4溶液能与盐酸发生反应干扰实验,应用稀硫酸溶解固体,则试剂a物质名称是稀硫酸;
②亚铁离子具有还原性,能被酸性高锰酸钾溶液氧化而使其褪色,所以现象1为酸性KMnO4溶液褪色(或溶液红色褪去);
③若现象2中溶液未变红色,说明为:;
(5)在600℃,反应为,甲同学称取40.0 g Fe粉于装置B中,一段时间后停止加热,冷却后称得固体质量为46.4g,固体增加质量为生成四氧化三铁中氧元素的质量,则实验后的固体物质中Fe3O4的质量。
18. 液封,防止空气进入装置4中 在装置2、3之间添加止水夹 装置4中的空气没有排尽
【分析】在三颈烧瓶中稀硫酸与Fe反应产生FeSO4、H2,H2可以将装置中的空气排出,防止Fe2+被氧化,生成的H2可以从2的导管中逸出,导致3中溶液不能进入4中,需要在2、3之间添加控制开关;当装置中空气完全排出后,关闭K1及左侧烧杯与三颈烧瓶中,产生的氢气将溶液压入锥形瓶中,与NaOH发生反应:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,若装置4中有空气,反应产生的Fe(OH)2会进一步发生反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3,沉淀会迅速变为灰绿色,最后变为红褐色。
【详解】(1)装置5是通过蒸馏水的液封,起到防止空气进入装置4中的作用,即可防止Fe(OH)2被氧化为Fe(OH)3;
(2)Fe与稀H2SO4反应产生的H2可以从装置2的导管中逸出,使装置3中的压强达不到将液体压入装置4中的程度,因此装置3中溶液不能进入4中,改进措施是在装置2、3之间加一个止水夹;
(3)当装置3中生成的FeSO4溶液被压入装置4中,与NaOH溶液发生反应生成Fe(OH)2沉淀,颜色为灰绿色而非白色,是因为装置4中的空气未排尽,发生了反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
【点睛】本题考查氢氧化亚铁制备的设备的评价与操作。把握物质的性质、制备原理为解答的关键。注意Fe2+具有强还原性,容易被空气中的氧气氧化为Fe3+而导致不能产生白色Fe(OH)2沉淀。应该利用反应产生的H2排出整个装置中的空气,然后关闭左边2、3之间的止水夹,利用反应产生的H2产生的气压将FeSO4溶液压入锥形瓶,与NaOH发生复分解反应产生Fe(OH)2。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
铁
共18题,满分100分
题号 一 二 三 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请注意保持试卷整洁
一、单选题(共50分)
1.(本题5分)合金是一类用途广泛的金属材料。下列物质属于合金的是( )。
A.铜 B.钢 C.金刚石 D.四氧化三铁
2.(本题5分)下列叙述正确的是:
①铁能被磁铁吸引
②可以通过化合反应得到FeCl2 和Fe3O4
③Fe在纯氧中燃烧可得Fe2O3
④Fe2O3不可与水反应得Fe(OH)3,所以不能通过化合反应制Fe(OH)3
⑤Fe(OH)2在空气中加热,可得FeO
A.①② B.②④ C.②③④⑤ D.①②⑤
3.(本题5分)如图是某化学兴趣小组设计的观察铁制品锈蚀的实验装置。下列相关叙述中正确的是( )
①一段时间后,铁丝会由下向上出现锈蚀现象
②一段时间后,水面处铁丝锈蚀严重
③一段时间后,塑料瓶会变膨胀,因为铁生锈要放热
④一段时间后,塑料瓶会变瘪,因为铁生锈与空气有关
A.①② B.②④ C.②③ D.③④
4.(本题5分)下列物质能通过化合反应得到的是①NaAlO2;②NaHCO3;③Fe(OH)3④FeCl3
A.只有①②④ B.只有②③④ C.只有①③④ D.全部
5.(本题5分)在给定条件下、下列选项中所示的物质间转化均能一步实现的是
A.
B.
C.
D.
6.(本题5分)下列反应的化学方程式或离子方程式书写正确的是
A.常温下,新切开的钠表面很快变暗:2Na+O2=Na2O2
B.氧化铝与氢氧化钠溶液反应:Al2O3+2OH-=2AlO+H2O
C.向硅酸钠溶液中通入过量CO2:CO2+Na2SiO3+H2O=2Na++CO+H2SiO3↓
D.炽热的铁水不能注入未经干燥的模具,是为防止:2Fe+3H2O(g)Fe2O3+3H2
7.(本题5分)设NA是阿伏加德罗常数的值,下列说法正确的是
A.高温下11.2 g Fe与水蒸气充分反应转移的电子数目为0.6NA
B.常温下pH=12的Na2HPO4溶液中,数目比多0.01NA
C.3.4 g H2O2中O-O键数目与1.2 g金刚石中C-C键数目相同
D.常温下2 L0.5 mol·L-1CH3COONa溶液和1 L1.0 mol·L-1CH3COONa溶液离子数目不相同
8.(本题5分)稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多溶解铜粉19.2g(同时生成NO气体,下同)。向另一份中逐渐加入铁粉,产生气体的量与铁粉的质量变化如图所示,下列说法错误的是
A.原混合酸中c(HNO3)=2 mol/L B.c点时,溶液中的溶质为Fe2(SO4)3
C.ab段发生反应为:Fe+2Fe3+=3Fe2+ D.原混合酸中c (H2SO4) =4 mol/L
9.(本题5分)下列有关说法正确的是
A.NH3在催化作用下与O2反应生成N2O5
B.HClO不稳定,容易分解放出Cl2
C.过量的Fe与Cl2充分反应生成FeCl2
D.Al与浓H2SO4、NaOH溶液都能反应
10.(本题5分)下列反应中,不能产生氢气的是
A.红热的铁与水蒸气 B.钠与水 C.铝和NaOH溶液反应 D.铁与浓硫酸反应
二、判断题(共20分)
11.(本题4分)用铁制容器可以运输浓硝酸和浓H2SO4。
12.(本题4分)铁是较活泼的金属,它与卤素单质(X2)反应生成物为FeX2(_______)
13.(本题4分)铁在高温下与水蒸气反应生成和。(_____)
14.(本题4分)浓硫酸和稀硫酸在常温下都能用铁制容器储存。
15.(本题4分)Fe粉具有还原性,可用作抗氧化剂。(_______)
三、解答题(共30分)
16.(本题10分)碳酸亚铁可用于治疗缺铁性贫血。实验室可由硫酸亚铁与碳酸氢铵反应制取(),部分实验装置如下图所示(部分夹持仪器略去)。回答下列问题:
(1)配制溶液所用的蒸馏水必须先除去溶解的氧气,操作方法是 。
(2)装置A中发生反应的离子方程式为 。
(3)实验开始时,先打开和一段时间,目的是 。将生成的溶液与溶液混合的操作是 。
17.(本题10分)是常用的磁性材料,某小组同学采用下述实验装置(夹持仪器略)制备并验证所得产物的成分和性质。请回答下列问题:
(1)仪器的名称为 。
(2)B中发生反应的化学方程式为 。
(3)酒精灯和酒精喷灯点燃的顺序是:先点燃 (填“酒精灯”或“酒精喷灯”),目的是 。
(4)待硬质玻璃管B冷却后,取其中的少许固体进行如下实验:
①试剂的名称为 。
②现象1为 。
③若现象2中溶液未变红色,结合装置中固体的成分,用离子方程式解释可能的原因: 。
(5)已知温度高于时,铁与水蒸气反应的氧化产物只有,甲同学称取粉于装置中,在反应一段时间后停止加热,冷却后称得固体质量为,则实验后的固体物质中的质量为 g。
18.(本题10分)某同学设计如图所示装置(气密性已检查)制备Fe(OH)2白色沉淀。
请回答:
(1)装置5的作用 。
(2)实验开始时,关闭K2,打开K1,反应一段时间后,再打开K2,关闭K1,发现3中溶液不能进入4中。请为装置作一处改进,使溶液能进入4中 。
(3)装置改进后,将3中反应后溶液压入4中,在4中析出了灰绿色沉淀。从实验操作过程分析没有产生白色沉淀的原因 。
参考答案:
1.B
【详解】A,Cu属于金属单质;B,钢是含碳量为0.03%~2%之间的铁碳合金;C,金刚石是碳的一种同素异形体,属于单质;D,四氧化三铁属于金属氧化物;属于合金的是钢,答案选B。
2.A
【解析】略
3.B
【详解】在水面处的铁丝与水和氧气充分接触,即铁丝上面最先生锈,由于铁生锈需要消耗氧气,导致瓶内的气压减小,故一段时间后塑料瓶会变瘪,所以②④正确;
答案选B。
4.B
【详解】试题分析:偏铝酸钠不能通过化合反应制备;碳酸钠和水、CO2反应生成碳酸氢钠,属于化合物;氢氧化亚铁和氧气以及水化合生成氢氧化铁;氯化亚铁和氯气化合生成氯化铁,答案选B。
考点:考查物质制备
5.C
【详解】A.Fe与Cl2反应,一定生成FeCl3,A错误;
B.S与O2反应,生成SO2,三氧化硫溶于水生成硫酸,B错误;
C.N2与O2反应生成NO,NO与O2反应生成NO2,C正确;
D.CaCl2与CO2不会反应生成碳酸钙,复分解反应中弱酸不可制备强酸,D错误;
故选C。
6.B
【详解】A.常温下,新切开的钠表面很快变暗是因为生成氧化钠,反应方程式是4Na+O2=2Na2O,故A错误;
B.氧化铝与氢氧化钠溶液反应生成偏铝酸钠,反应的离子方程式是Al2O3+2OH-=2AlO+H2O,故B正确;
C.向硅酸钠溶液中通入过量CO2生成硅酸沉淀和碳酸氢钠,反应的离子方程式是2CO2+SiO+2H2O=2HCO+H2SiO3↓,故C错误;
D.炽热的铁水不能注入未经干燥的模具,是因为铁和水蒸气反应生成四氧化三铁和氢气,反应方程式是3Fe+4H2O(g)Fe3O4+4H2,故D错误;
选B。
7.D
【详解】A.11.2 g Fe的物质的量是0.2 mol,Fe与H2O蒸气在高温下反应产生Fe3O4、H2,反应方程式为3Fe+4H2O(g)Fe3O4+4H2,每3 mol Fe反应转移8 mol电子,则2 mol Fe参加反应,转移电子的物质的量是n(e-)=,则反应过程中转移的电子数目为0.53NA,A错误;
B.常温下Na2HPO4溶液pH=12,说明水解程度大于电离程度,即c()>c(),溶液体积未知,因此不能确定微粒数目的多少,B错误;
C.3.4 g H2O2的物质的量是0.1 mol,含有O-O键数目是0.1NA;在金刚石中C原子与相邻4个C原子形成共价键,每个共价键为相邻的2个C原子形成,因此1个C原子形成C-C共价键数目为4×=2个。1.2 g金刚石中含有C原子0.1 mol,则其中含有的C-C数目是0.2NA,因此3.4 g H2O2中O-O键数目与1.2 g金刚石中C-C键数目不相等,C错误;
D.2 L0.5 mol·L-1CH3COONa和1 L1.0 mol·L-1CH3COONa溶液中含有溶质CH3COONa的物质的量都是1 mol,但CH3COONa是强碱弱酸盐,CH3COO-会发生水解反应而消耗,且浓度越小,离子水解程度越大,未水解的该离子浓度就越小,因此两种溶液中含有的离子数目不相等,D正确;
故合理选项是D。
8.B
【分析】由图象可知,铁粉质量逐渐增加,oa段发生反应为Fe++4H+=Fe3++NO↑+2H2O,ab段气体的量不变,且Fe3+的氧化性大于H+,则发生反应为Fe+2Fe3+=3Fe2+,bc段又产生气体,则发生反应为Fe+2H+=Fe2++H2↑;据此分析解答。
【详解】A.由上述分析可知,oa段发生反应为Fe++4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,每份混合液中n(HNO3)=n()=n(Fe)==0.2mol,则原混合酸中稀硝酸的物质的量浓度为c(HNO3)==2mol/L,故A正确;
B.由上述分析可知,硝酸全部起氧化剂作用,没有显酸性的硝酸,c点时,铁单质全部转化为亚铁离子,所以c点溶质为FeSO4,故B错误;
C.由上述分析可知,氧化性Fe3+>H+,ab段加入铁粉,先与Fe3+反应,所以ab段气体量不变,即发生反应为Fe+2Fe3+=3Fe2+,故C正确;
D.由上述分析可知,c溶质为FeSO4,由元素守恒,则每份中n(H2SO4)=n(FeSO4)=n(Fe)= =0.4mol,则原混合酸中稀硫酸的物质的量浓度为c(H2SO4)==4mol/L,故D正确;
答案为B。
9.D
【详解】A.氨气在催化作用下与O2反应生成NO,A错误;
B.HClO易分解生成HCl和O2,B错误;
C.无论Fe是否过量,与氯气反应时只能生成氯化铁,C错误;
D.Al在浓硫酸中钝化,钝化的过程Al被氧化为氧化铝、发生了反应,Al与NaOH溶液可以反应生成偏铝酸钠和氢气,D正确;
综上所述答案为D。
10.D
【详解】A、红热的铁与水蒸气反应:3Fe+4H2O(g)Fe3O4+4H2↑,有氢气产生,故A不符合题意;
B、Na与水反应:2Na+2H2O=2NaOH+H2↑,有氢气产生,故B不符合题意;
C、铝与氢氧化钠溶液的反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,有氢气产生,故C不符合题意;
D、铁常温下与浓硫酸发生钝化反应,不产生氢气,故D符合题意。
11.正确
【详解】常温下铁与浓硝酸、浓硝酸发生钝化,因此可以用铁制容器可以运输浓硝酸和浓H2SO4,故正确;
12.错误
【详解】由于F2、Cl2、Br2、I2的氧化性依次减弱,铁是较活泼的金属,它与卤素单质(X2)反应分别为:2Fe+3F22FeF3、2Fe+3Cl22FeCl3、2Fe+3Br22FeBr3、Fe+I2FeI2,即除I2的生成物为FeX2,其余均为FeX3,故答案为:错误。
13.正确
【详解】铁在高温下与水蒸气反应生成和,故正确。
14.错误
【详解】稀硫酸在常温下能与铁反应生成硫酸亚铁和氢气,不能用铁制容器储存
15.正确
【详解】Fe粉能够与空气中的氧气发生反应,失去电子,表现还原性,因此可用作抗氧化剂,除去其中氧气,防止物质氧化变质,故上述说法是正确的。
16.(1)将蒸馏水煮沸后密封冷却
(2)
(3) 使铁与稀硫酸反应制备硫酸亚铁、产生氢气排尽装置内的空气 关闭、打开
【分析】打开活塞K1、K3,A中稀硫酸和铁粉发生反应生成硫酸亚铁和氢气,关闭K1、K3,打开K2,通过气体压强使硫酸亚铁溶液进入B装置,B装置中发生反应。
【详解】(1)氧气在蒸馏水中的溶解度随温度的升高而降低,所以配制溶液所用的蒸馏水必须先除去水中溶解的氧气,具体方法是将蒸馏水煮沸后密封冷却;
(2)装置A中是铁与稀硫酸反应生成硫酸亚铁和氢气,其离子方程式为:Fe+2H+=Fe2++H2↑;
(3)实验开始时,先打开活塞K1、K3一段时间的目的是:使铁与稀硫酸反应制备硫酸亚铁、产生氢气排尽装置内的空气,并产生气体方便利用压强使产生的硫酸亚铁溶液进入装置B中。将生成的溶液与溶液混合的操作是:关闭K1、K3,打开K2,利用气体压强使A中的硫酸亚铁溶液进入B装置中。
17.(1)球形干燥管
(2)
(3) 酒精灯 排净装置中空气
(4) 稀硫酸 酸性KMnO4溶液褪色(或溶液红色褪去)
(5)23.2
【分析】A中制取水蒸气,B中Fe和水蒸气反应生成四氧化三铁和氢气,C用于干燥氢气,D收集检验氢气;
探究B中铁和水反应的黑色固体产物的成分,黑色固体是四氧化三铁或是氧化亚铁,待硬质玻璃管B冷却后,取少许其中的固体物质于试管中,加入足量1mol·L-1稀硫酸溶解;各取少量上述溶液,分别滴加2~3滴酸性KMnO4溶液和硫氰化钾溶液,检验亚铁离子和铁离子,确定氧化物的成分;
【详解】(1)仪器的名称为球形干燥管;
(2)Fe和水蒸气反应生成四氧化三铁和氢气,;
(3)铁会和空气中氧气反应,故实验中先点燃A处酒精灯,生成水蒸气排净装置中空气,再点燃B出酒精喷灯,使得水和铁反应;
(4)①已知酸性KMnO4溶液能与盐酸发生反应干扰实验,应用稀硫酸溶解固体,则试剂a物质名称是稀硫酸;
②亚铁离子具有还原性,能被酸性高锰酸钾溶液氧化而使其褪色,所以现象1为酸性KMnO4溶液褪色(或溶液红色褪去);
③若现象2中溶液未变红色,说明为:;
(5)在600℃,反应为,甲同学称取40.0 g Fe粉于装置B中,一段时间后停止加热,冷却后称得固体质量为46.4g,固体增加质量为生成四氧化三铁中氧元素的质量,则实验后的固体物质中Fe3O4的质量。
18. 液封,防止空气进入装置4中 在装置2、3之间添加止水夹 装置4中的空气没有排尽
【分析】在三颈烧瓶中稀硫酸与Fe反应产生FeSO4、H2,H2可以将装置中的空气排出,防止Fe2+被氧化,生成的H2可以从2的导管中逸出,导致3中溶液不能进入4中,需要在2、3之间添加控制开关;当装置中空气完全排出后,关闭K1及左侧烧杯与三颈烧瓶中,产生的氢气将溶液压入锥形瓶中,与NaOH发生反应:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,若装置4中有空气,反应产生的Fe(OH)2会进一步发生反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3,沉淀会迅速变为灰绿色,最后变为红褐色。
【详解】(1)装置5是通过蒸馏水的液封,起到防止空气进入装置4中的作用,即可防止Fe(OH)2被氧化为Fe(OH)3;
(2)Fe与稀H2SO4反应产生的H2可以从装置2的导管中逸出,使装置3中的压强达不到将液体压入装置4中的程度,因此装置3中溶液不能进入4中,改进措施是在装置2、3之间加一个止水夹;
(3)当装置3中生成的FeSO4溶液被压入装置4中,与NaOH溶液发生反应生成Fe(OH)2沉淀,颜色为灰绿色而非白色,是因为装置4中的空气未排尽,发生了反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
【点睛】本题考查氢氧化亚铁制备的设备的评价与操作。把握物质的性质、制备原理为解答的关键。注意Fe2+具有强还原性,容易被空气中的氧气氧化为Fe3+而导致不能产生白色Fe(OH)2沉淀。应该利用反应产生的H2排出整个装置中的空气,然后关闭左边2、3之间的止水夹,利用反应产生的H2产生的气压将FeSO4溶液压入锥形瓶,与NaOH发生复分解反应产生Fe(OH)2。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
