铁矿石与高炉炼铁-高考化学考前专项练习试题(含解析)
文档属性
| 名称 | 铁矿石与高炉炼铁-高考化学考前专项练习试题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 617.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-13 12:37:04 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
铁矿石与高炉炼铁
共13题,满分100分
题号 一 二 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请注意保持试卷整洁
一、单选题(共50分)
1.(本题5分)化学与生产、生活密切相关。下列叙述正确的是
A.溶液不能产生丁达尔效应,不属于胶体
B.可用于文物的年代鉴定,与互称为核素
C.在医学上用作“钡餐”,对人体无毒
D.主要成分为的磁铁矿,是工业炼铁的原料
2.(本题5分)炼钢时常用的氧化剂是空气(或纯氧).炼钢过程中既被氧化又被还原的元素是( )
A.铁 B.硫 C.氧 D.碳
3.(本题5分)在下列自然资源的开发利用中,不涉及化学变化的是
A.用蒸馏法淡化海水 B.用铁矿石冶炼铁
C.用石油裂解生产乙烯 D.用煤生产水煤气
4.(本题5分)下列说法不正确的是( )
A.氢氧化铝胶体能吸附水中悬浮物,可用于净水
B.氧化镁的熔点很高,可用于制作耐高温材料
C.晶体硅是一种半导体材料,常用于制造光导纤维
D.工业炼铁中石灰石的作用是除去铁矿石中的脉石
5.(本题5分)成语、古诗词、谚语等都是我国传统文化的瑰宝。下列有关解读错误的是
选项 传统文化 化学角度解读
A 兰陵美酒郁金香,玉碗盛来琥珀光 “香”主要因为美酒含有酯类物质
B 百炼成钢、钢筋铁骨 生铁在高温下挥发除去碳等杂质转化成钢
C 三月打雷麦谷堆 在雷电作用下N2转化成能被作物吸收的氮元素
D 《本草经集注》记载“如握盐雪不冰,强烧之,紫青烟起…云是真硝石也” 利用物理方法(焰色反应)可以检验钠盐和钾盐
A.A B.B C.C D.D
6.(本题5分)下列说法正确的是
A.某些植物具有富集溴的能力,从海产品中提取溴是工业上获取溴的重要途径
B.工业炼铁需要用到的原料有铁矿石、焦炭、空气和熟石灰
C.冶炼镁时,将六水合氯化镁晶体直接加热分解可得纯净无水氯化镁
D.我国古代就已知晓采用加热胆矾或绿矾的方法制取硫酸
7.(本题5分)北宋沈括对生铁炼钢有这么一段评价:“世间锻铁所谓钢铁者,用柔铁屈盘之,乃以生铁陷其间,泥封炼之,锻令相入,谓之“团钢”,亦谓之“灌钢”。此乃伪钢耳……”,下列说法正确的是
A.生铁和钢都是关于铁的含碳合金,钢中碳的含量较高
B.通过炼制和锻打,可以调节生铁中元素的组成、元素的含量等来改变生铁的性能
C.高碳钢的韧性较好,低碳钢的硬度较大
D.不锈钢是一种常见的合金钢,它的合金元素主要是钨(W)和硅(Si)
8.(本题5分)化学与生产、生活密切相关。下列说法错误的是
A.日前用量最大的合金是钢
B.太阳能电池的半导体材料主要是Si
C.“神舟十二号”飞船的操纵杆的主要成分为碳纤维,属于有机高分子材料
D.科学家将CO2用于合成CH3OH,可实现二氧化碳的绿色利用
9.(本题5分)下列说法不正确的是
A.工业炼铁时,铁矿石和焦炭从炼铁高炉的上口加入
B.工业上制备HCl的方法是将H2和Cl2充分混合后点燃
C.湿法治金是金属冶炼常用的方法之一,如电解ZnSO4溶液制备Zn
D.硝酸工业尾气可用NaOH溶液来吸收
10.(本题5分)下列说法不正确的是
A.炼铁时加入少量石灰石的目的是除去铁矿石中的脉石(主要成分为SiO2)
B.铜的金属活泼性比铁弱,所以在海轮外壳装上铜块可减慢海轮外壳腐蚀
C.在汽车排气管中加装“催化转化器”是为了减少有害气体的排放
D.氧化镁可用于制作高温耐火材料
二、解答题(共50分)
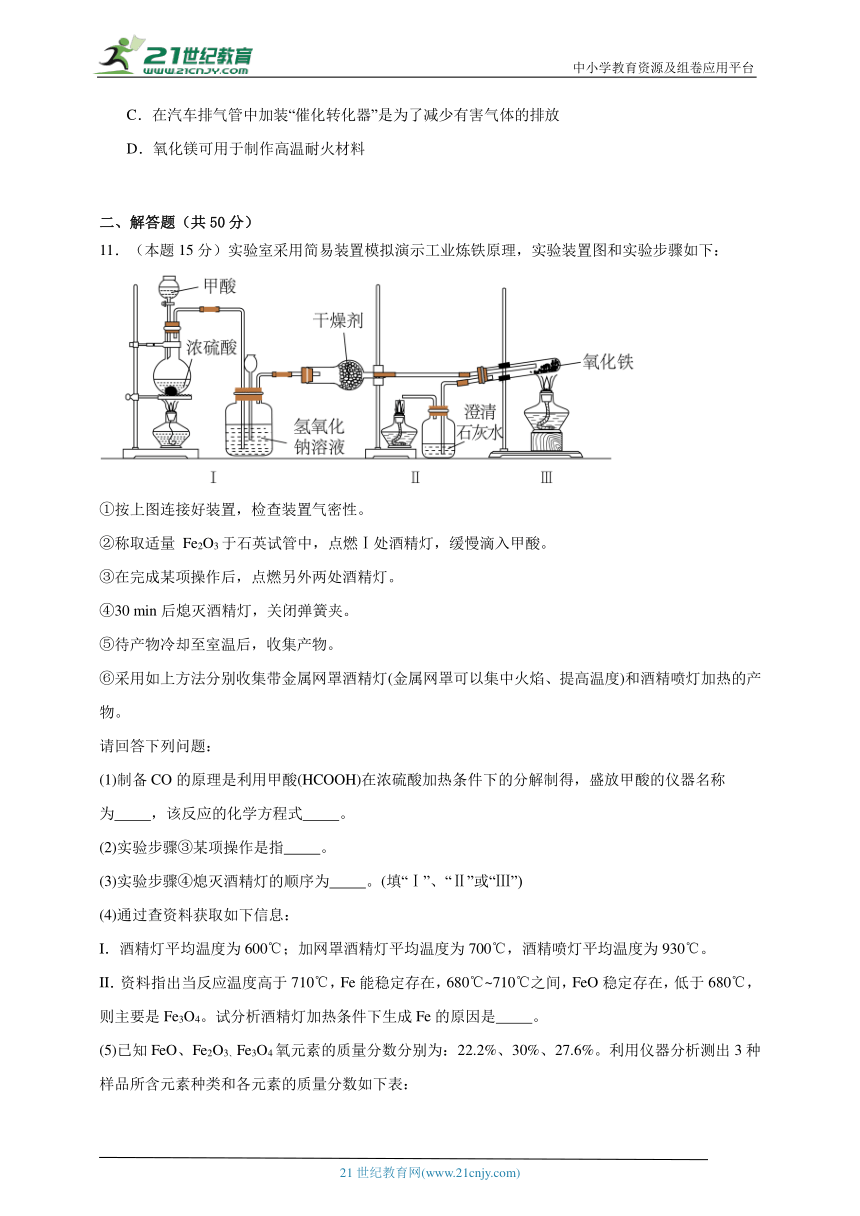
11.(本题15分)实验室采用简易装置模拟演示工业炼铁原理,实验装置图和实验步骤如下:
①按上图连接好装置,检查装置气密性。
②称取适量 Fe2O3于石英试管中,点燃Ⅰ处酒精灯,缓慢滴入甲酸。
③在完成某项操作后,点燃另外两处酒精灯。
④30 min后熄灭酒精灯,关闭弹簧夹。
⑤待产物冷却至室温后,收集产物。
⑥采用如上方法分别收集带金属网罩酒精灯(金属网罩可以集中火焰、提高温度)和酒精喷灯加热的产物。
请回答下列问题:
(1)制备CO的原理是利用甲酸(HCOOH)在浓硫酸加热条件下的分解制得,盛放甲酸的仪器名称为 ,该反应的化学方程式 。
(2)实验步骤③某项操作是指 。
(3)实验步骤④熄灭酒精灯的顺序为 。(填“Ⅰ”、“Ⅱ”或“Ⅲ”)
(4)通过查资料获取如下信息:
I.酒精灯平均温度为600℃;加网罩酒精灯平均温度为700℃,酒精喷灯平均温度为930℃。
II.资料指出当反应温度高于710℃,Fe能稳定存在,680℃~710℃之间,FeO稳定存在,低于680℃,则主要是Fe3O4。试分析酒精灯加热条件下生成Fe的原因是 。
(5)已知FeO、Fe2O3、Fe3O4氧元素的质量分数分别为:22.2%、30%、27.6%。利用仪器分析测出3种样品所含元素种类和各元素的质量分数如下表:
加热方式 产物元素组成 各元素的质量分数%
Fe O
酒精灯 Fe和O 74.50 25.50
带网罩酒精灯 Fe和O 76.48 23.52
酒精喷灯 Fe 100.00 0.00
分析各元素的质量分数可知前二种加热方式得到的产物为混合物,其中酒精灯加热所得产物的组成最多有 种可能。
(6)通过进一步的仪器分析测出前二种加热方式得到的固体粉末成分均为Fe3O4和Fe,用酒精喷灯加热得到的固体粉末成分为Fe。请计算利用酒精灯加热方式混合物中Fe3O4和Fe的质量比为 。(要求保留整数)
12.(本题15分)实验室中,用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高纯氧化铁(—
Fe2O3)的步骤如下:
回答下列问题:
(1)上述实验中,加入铁粉的作用是 。(用离子方程式表示)实验中检验溶液x中的离子是否与铁粉完全反应的试剂是 溶液
(2)实验室欲用18.4 mol·L-1。的浓硫酸配制100 mL5.0mol·L-1的硫酸溶液,所用仪器除胶头滴管、量筒、烧杯、玻璃棒外,还有 (填写仪器名称);
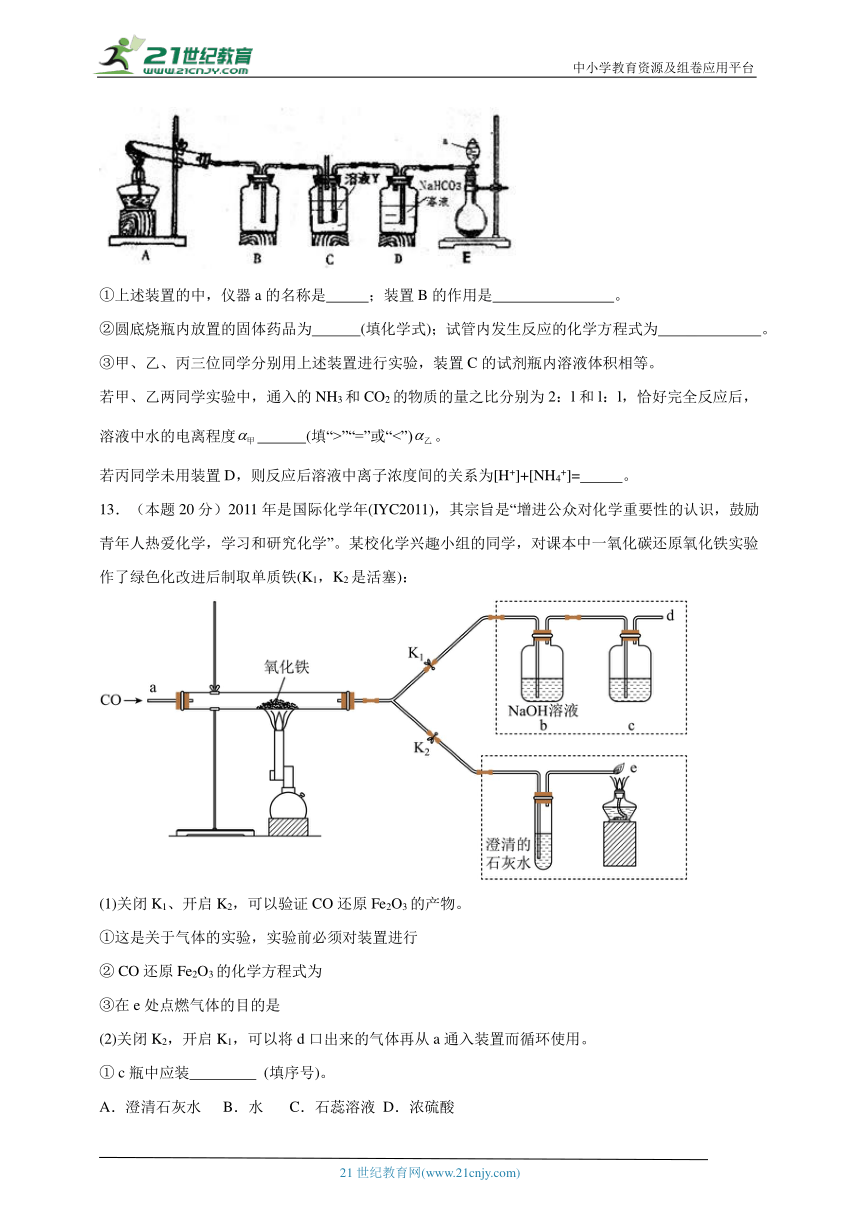
(3)某同学用下图所示装置实现向溶液Y中通入NH3和CO2
①上述装置的中,仪器a的名称是 ;装置B的作用是 。
②圆底烧瓶内放置的固体药品为 (填化学式);试管内发生反应的化学方程式为 。
③甲、乙、丙三位同学分别用上述装置进行实验,装置C的试剂瓶内溶液体积相等。
若甲、乙两同学实验中,通入的NH3和CO2的物质的量之比分别为2:l和l:l,恰好完全反应后,溶液中水的电离程度 (填“>”“=”或“<”)。
若丙同学未用装置D,则反应后溶液中离子浓度间的关系为[H+]+[NH4+]= 。
13.(本题20分)2011年是国际化学年(IYC2011),其宗旨是“增进公众对化学重要性的认识,鼓励青年人热爱化学,学习和研究化学”。某校化学兴趣小组的同学,对课本中一氧化碳还原氧化铁实验作了绿色化改进后制取单质铁(K1,K2是活塞):
(1)关闭K1、开启K2,可以验证CO还原Fe2O3的产物。
①这是关于气体的实验,实验前必须对装置进行
② CO还原Fe2O3的化学方程式为
③在e处点燃气体的目的是
(2)关闭K2,开启K1,可以将d口出来的气体再从a通入装置而循环使用。
① c瓶中应装 (填序号)。
A.澄清石灰水 B.水 C.石蕊溶液 D.浓硫酸
②写出b中的化学反应方程式
③反应完后(假设b瓶中NaOH全部转化为纯碱),要从b瓶中溶液得到纯碱固体,必要的实验操作为转移、 结晶。
④该实验这样改进的主要优点是
参考答案:
1.A
【详解】A.胶体能产生丁达尔效应,溶液不能产生丁达尔效应,MgCl2溶液不属于胶体,故A正确;
B.与质子数相同,中子数不同,互为同位素,故B错误;
C.钡离子是一种重金属离子,对人体有害,可以使人体中毒,硫酸钡在医学上用作钡餐是因为硫酸钡既不溶于水也不溶于酸,不会产生可溶性钡离子,所以它对人体无害,故C错误;
D.磁铁矿的主要成分为,故D错误;
故答案选A。
2.A
【详解】炼钢过程中反应原理:2Fe+O22FeO、FeO+CFe+CO 、2FeO+Si2Fe+SiO2。反应中C元素化合价升高,Fe元素发生Fe~FeO~Fe的一系列反应中,则Fe元素既失去电子也得到电子,所以既被氧化又被还原,答案选A。
【点睛】从化合价的角度分析被氧化还是被还原,要正确的写出炼钢过程的化学方程式。
3.A
【详解】A.蒸馏海水,利用沸点的差异分离易挥发和难挥发的物质,没有涉及到化学变化,A项符合题意;
B.铁矿石炼铁,从铁的化合物得到铁单质,涉及到化学变化,B项不符合题意;
C.石油裂解,使得较长碳链的烷烃断裂得到较短碳链的烃类化工原料,涉及到化学变化,C项不符合题意;
D.煤生成水煤气,C与水蒸气高温条件下得到CO和H2,涉及到化学变化,D项不符合题意;
本题答案选A。
4.C
【详解】A.Al(OH)3胶体具有疏松多孔的结构,具有吸附性,能吸附水中悬浮物,可用于水的净化,所以氢氧化铝胶体可用于净水,故A正确;
B.熔点高的物质可作耐火材料,氧化镁为离子化合物,熔点高,可用于制作耐高温材料,故B正确;
C.晶体硅是良好的半导体材料,常用于制造芯片,常用于制造光导纤维的是二氧化硅,而不是硅,故C错误;
D.炼铁时,石灰石中的碳酸钙在高温条件下分解能生成氧化钙和二氧化碳,氧化钙能和二氧化硅反应生成硅酸钙,从而除去铁矿石中的二氧化硅,故D正确;
答案为C。
5.B
【详解】A.酒放置时间长,部分乙醇转化成乙酸乙酯等酯类物质,具有果香味,A项正确;
B.工业上把生铁炼成钢是用氧气或铁的氧化物作氧化剂在高温条件下把生铁中的过量的碳和其它杂质氧化成气体或炉渣除去,B项错误;
C.在雷电作用下空气中N2和O2反应生成NO,经过一系列化学反应最终形成可溶性硝酸盐,增加土壤中氮肥含量,有利于作物生长,C项正确;
D.钠盐和钾盐焰色反应的颜色不同,焰色反应是物理变化,D项正确;
答案选B。
6.D
【详解】A.溴主要存在于海水中,碘主要富集在海水植物中,海水提溴是工业上获取溴的重要途径,故A错误;
B.工业炼铁需要用到的原料有铁矿石、焦炭、空气和石灰石,焦炭可以提供热量,生成一氧化碳;一氧化碳再跟铁矿石中的氧化物反应,生成铁;石灰石在高温条件下分解能生成氧化钙和二氧化碳,氧化钙能和铁矿石中的杂质二氧化硅反应生成硅酸钙,从而除去二氧化硅,原料中没有熟石灰,故B错误;
C.海水中含有大量镁元素,可以通过多步转化得到六水合氯化镁晶体,氯化镁易水解生成氢氧化镁和氯化氢,且氯化氢易挥发,导致直接加热带结晶水的晶体时得不到氯化镁,为防止氯化镁水解,需要将带结晶水的氯化镁在氯化氢氛围中加热,得到无水氯化镁,采用电解熔融氯化镁的方法冶炼镁,故C错误;
D.加热胆矾或绿矾会分解生成三氧化硫,与水反应生成硫酸,早在1000多年前,我国就已采用加热绿矾的方法制取硫酸,故D正确;
答案选D。
【点睛】熟悉工业冶炼金属原理是解题关键。本题的易错点为B,工业炼铁原料中应有石灰石不是熟石灰,石灰石作用是除去二氧化硅形成硅酸钙炉渣。
7.B
【详解】A.生铁和钢都是铁的含碳合金,钢中碳的含量在0.03%~2.0%之间,生铁中碳的含量在2.0%~4.3%之间,所以生铁的碳含量高于钢的碳含量,故A错误;
B.通过炼制和锻打,可以降低生铁中含碳量,除去生铁中有害元素P、S,调整生铁中Si、Mn的含量,这样的铁有韧性、可锻轧、可延压,故B正确;
C.根据含碳量的不同,碳素钢可分为高碳钢、中碳钢、低碳钢,其中高碳钢硬度较大,韧性较差,低碳钢,硬度较小,韧性较强,故C错误;
D.不锈钢是一种常见的合金钢,它的合金元素主要是铬(Cr)、镍(Ni),常用来制造医疗器械、餐具等,故D错误;
答案为B。
8.C
【详解】A.钢是用量最大、用途最广的合金,A项正确;
B.Si是半导体材料,太阳能电池的半导体材料主要是Si,B项正确;
C.碳纤维属于无机材料,C项错误;
D.CO2在一定条件下可与H2反应合成CH3OH,从而减少二氧化碳的排放,实现二氧化碳的绿色利用,D项正确。
答案选C。
9.B
【详解】
A.工业上高炉炼铁时从炉顶装入铁矿石、焦炭、造渣用熔剂(石灰石),从位于炉子下部沿炉周的风口吹入经预热的空气,在高温下焦炭中的碳同鼓入空气中的氧燃烧生成的一氧化碳,在炉内上升过程中除去铁炉石中的氧,从而还原得到铁,故A项正确;
B. H2和Cl2充分混合后点燃会发生爆炸,不可用于工业制备HCl,故B错误;
C.湿法治金是金属冾炼的常用方法之一,如电解ZnSO4溶液,根据电解池阴阳极放电顺序,阳极水电离出的氢氧根放电,阴极为Zn2+放电得电子生成锌单质,可以制备Zn,故C项正确;
D.硝酸工业会产生氮的氧化物,尾气可用NaOH溶液来吸收,故D正确;
故选B。
10.B
【详解】A.炼铁时加入少量石灰石(主要成分为碳酸钙)的目的是将铁矿石中的脉石(主要成分为SiO2)转变为炉渣(硅酸钙)而除去,故A正确;
B.因为铜的金属活泼性比铁弱,所以在海轮外壳上装上铜块,海轮外壳、铜块和海水形成的原电池中,海轮外壳作负极,从而加快海轮外壳腐蚀,故B错误;
C.在汽车排气管中加装“催化转化器”是为了使汽车尾气中的CO和氮的氧化物转化为CO2和N2,减少有害气体的排放,故C正确;
D.氧化镁具有较高的熔点,可用于制作高温耐火材料,故D正确;
答案选B。
11.(1) 分液漏斗 HCOOH CO↑ + H2O
(2)检验CO纯度
(3)Ⅲ、Ⅰ、Ⅱ
(4)长时间集中加热使局部温度达到生成还原铁所需要的温度
(5)9种
(6)12:1
【详解】(1)根据图中信息盛放甲酸的装置为分液漏斗,在浓硫酸加热条件下,HCOOH分解可得CO,根据质量守恒可知另一个产物为水,反应的化学方程式为:HCOOH CO↑+H2O;故答案为:分液漏斗;HCOOH CO↑+H2O。
(2)CO是可燃性气体,因此应先检验CO纯度后点燃另外两处酒精灯,先检验CO纯度目的看试管内的空气是否排净,防止爆炸;故答案为:检验CO纯度。
(3)实验结束后要等试管冷却后才停止通一氧化碳,故先熄灭Ⅲ处酒精灯,是为了防止生成的铁被空气中的氧气氧化;应最后熄灭Ⅰ处酒精灯,目的是防止多余的一氧化碳进入空气中污染环境,所以实验步骤④熄灭酒精灯的顺序为 Ⅲ、Ⅰ、Ⅱ;故答案为:Ⅲ、Ⅰ、Ⅱ。
(4)加网罩酒精灯平均温度为700℃,当反应温度高于710℃,Fe能稳定存在原因是加网罩酒精灯平均温度为700℃,与710℃温度差比较小,且长时间集中加热可使局部温度达到生成还原铁所需要的温度;故答案为:长时间集中加热使局部温度达到生成还原铁所需要的温度。
(5)由数据可知,Fe、FeO、Fe2O3、Fe3O4中Fe元素的百分含量分别为100%、77.8%、70%、72.4%,酒精灯加热所得产物中Fe元素的百分含量为74.50%,混合物中至少有一个Fe元素含量大于74.50%,至少有一个Fe元素含量小于74.50%,故混合物中一定有Fe和FeO中的至少一种,也一定有Fe2O3和Fe3O4中的一种,这样就会出现,两种混合的有4种:Fe、Fe2O3,Fe、Fe3O4,FeO、Fe2O3,FeO、Fe3O4,三种混合的有4种:Fe、Fe2O3和Fe3O4,FeO、Fe2O3和Fe3O4,Fe2O3、Fe和FeO,Fe3O4、Fe和FeO ,四种混合的有1种:Fe、FeO、Fe2O3和Fe3O4,因此共9种;故答案为:9。
(6)根据酒精灯加热得到的产物为Fe3O4和Fe,且铁元素的百分含量为74.50%,设Fe3O4的质量为x,Fe的质量为y,则,解得:;故答案为:12:1。
12. Fe+2Fe3+=3Fe2+ KSCN 100mL容量瓶 分液漏斗 防倒吸 CaCO3 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O > [H+]+[NH4+]=[ OH-]+2[SO42-]+[Cl-]
【详解】试题分析:(1)硫铁矿烧渣与硫酸反应,二氧化硅不溶于硫酸,所以溶液为硫酸铁和硫酸亚铁溶液,加入铁粉的目的是将铁离子还原为亚铁离子,离子方程式为Fe+2Fe3+=3Fe2+;检验铁离子是否全部被还原,用KSCN溶液,若使KSCN溶液变红色,说明未完全还原;
(2)配制100 mL5.0mol·L-1的硫酸溶液,所用仪器除胶头滴管、量筒、烧杯、玻璃棒外,还有100mL容量瓶盛放溶液;
(3)①仪器a的名称是分液漏斗;A装置产生氨气,因为制取氨气需要加热,所以B装置的作用是防止发生倒吸现象,使装置A的试管炸裂;
②装置E是产生二氧化碳的装置,所以圆底烧瓶内放置的固体药品为碳酸钙,化学式为CaCO3;试管内发生的是氢氧化钙与氯化铵的反应,加热产生氨气,化学方程式为2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O;
③Y为硫酸亚铁溶液,通入的NH3和CO2的物质的量之比分别为2:l和l:l时得到的溶液中的溶质分别为硫酸铵和硫酸氢铵,硫酸铵溶液中铵根离子水解,促进水的电离,而硫酸氢铵溶液中硫酸氢铵电离产生的氢离子,对水的电离起抑制作用,则硫酸铵水解程度大于硫酸氢铵水解程度,所以甲中的水电离程度大于乙的水电离程度;装置D的作用是除去二氧化碳中的氯化氢,若丙同学未用装置D,则二氧化碳中混有氯化氢气体,二氧化碳、氨气、硫酸亚铁反应生成碳酸亚铁沉淀和硫酸铵、氯化铵,则反应后溶液中存在氯离子,离子浓度间的关系符合电荷守恒,所以[H+]+[NH4+]=[ OH-]+2[SO42-]+[Cl-]。
考点:考查离子的检验、溶液的配制、气体的制备、水电离程度的判断
13.(1) 气密性检查 尾气处理、除去没有反应的CO。
(2) D 蒸发浓缩、冷却 能循环利用CO、提高了原料利用率、减少了二氧化碳的排放
【分析】在高温下,一氧化碳能还原氧化铁得到铁和二氧化碳。一氧化碳有毒,因此必须进行尾气处理。反应混合气体先通过碱液吸收,再点燃处理CO,据此回答。
【详解】(1)①为了防止漏气、关于气体的实验,实验前必须对装置进行气密性检查。
②高温下,CO还原Fe2O3得到CO2和Fe,化学方程式为。
③CO有剧毒,不能直接排放到空气中,在e处点燃气体的目的是:尾气处理、除去没有反应的CO。
(2)关闭K2,开启K1,可以将d口出来的气体再从a通入装置而循环使用。则:① d口出来的气体必须是纯净而干燥的CO气体,b装置能充分吸收二氧化碳、c装置用于干燥,则c瓶中应装浓硫酸,选D。
②b中氢氧化钠溶液吸收二氧化碳、化学反应方程式:。
③反应完后(假设b瓶中NaOH全部转化为纯碱),要从b瓶中溶液得到纯碱固体,从溶液中提取的碳酸钠固体是。适合用冷却结晶法。必要的实验操作为转移、蒸发浓缩、冷却、结晶。
④过量的CO从d排出进入a,故该实验这样改进的主要优点是能循环利用CO、提高了原料利用率、减少了二氧化碳的排放。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
铁矿石与高炉炼铁
共13题,满分100分
题号 一 二 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请注意保持试卷整洁
一、单选题(共50分)
1.(本题5分)化学与生产、生活密切相关。下列叙述正确的是
A.溶液不能产生丁达尔效应,不属于胶体
B.可用于文物的年代鉴定,与互称为核素
C.在医学上用作“钡餐”,对人体无毒
D.主要成分为的磁铁矿,是工业炼铁的原料
2.(本题5分)炼钢时常用的氧化剂是空气(或纯氧).炼钢过程中既被氧化又被还原的元素是( )
A.铁 B.硫 C.氧 D.碳
3.(本题5分)在下列自然资源的开发利用中,不涉及化学变化的是
A.用蒸馏法淡化海水 B.用铁矿石冶炼铁
C.用石油裂解生产乙烯 D.用煤生产水煤气
4.(本题5分)下列说法不正确的是( )
A.氢氧化铝胶体能吸附水中悬浮物,可用于净水
B.氧化镁的熔点很高,可用于制作耐高温材料
C.晶体硅是一种半导体材料,常用于制造光导纤维
D.工业炼铁中石灰石的作用是除去铁矿石中的脉石
5.(本题5分)成语、古诗词、谚语等都是我国传统文化的瑰宝。下列有关解读错误的是
选项 传统文化 化学角度解读
A 兰陵美酒郁金香,玉碗盛来琥珀光 “香”主要因为美酒含有酯类物质
B 百炼成钢、钢筋铁骨 生铁在高温下挥发除去碳等杂质转化成钢
C 三月打雷麦谷堆 在雷电作用下N2转化成能被作物吸收的氮元素
D 《本草经集注》记载“如握盐雪不冰,强烧之,紫青烟起…云是真硝石也” 利用物理方法(焰色反应)可以检验钠盐和钾盐
A.A B.B C.C D.D
6.(本题5分)下列说法正确的是
A.某些植物具有富集溴的能力,从海产品中提取溴是工业上获取溴的重要途径
B.工业炼铁需要用到的原料有铁矿石、焦炭、空气和熟石灰
C.冶炼镁时,将六水合氯化镁晶体直接加热分解可得纯净无水氯化镁
D.我国古代就已知晓采用加热胆矾或绿矾的方法制取硫酸
7.(本题5分)北宋沈括对生铁炼钢有这么一段评价:“世间锻铁所谓钢铁者,用柔铁屈盘之,乃以生铁陷其间,泥封炼之,锻令相入,谓之“团钢”,亦谓之“灌钢”。此乃伪钢耳……”,下列说法正确的是
A.生铁和钢都是关于铁的含碳合金,钢中碳的含量较高
B.通过炼制和锻打,可以调节生铁中元素的组成、元素的含量等来改变生铁的性能
C.高碳钢的韧性较好,低碳钢的硬度较大
D.不锈钢是一种常见的合金钢,它的合金元素主要是钨(W)和硅(Si)
8.(本题5分)化学与生产、生活密切相关。下列说法错误的是
A.日前用量最大的合金是钢
B.太阳能电池的半导体材料主要是Si
C.“神舟十二号”飞船的操纵杆的主要成分为碳纤维,属于有机高分子材料
D.科学家将CO2用于合成CH3OH,可实现二氧化碳的绿色利用
9.(本题5分)下列说法不正确的是
A.工业炼铁时,铁矿石和焦炭从炼铁高炉的上口加入
B.工业上制备HCl的方法是将H2和Cl2充分混合后点燃
C.湿法治金是金属冶炼常用的方法之一,如电解ZnSO4溶液制备Zn
D.硝酸工业尾气可用NaOH溶液来吸收
10.(本题5分)下列说法不正确的是
A.炼铁时加入少量石灰石的目的是除去铁矿石中的脉石(主要成分为SiO2)
B.铜的金属活泼性比铁弱,所以在海轮外壳装上铜块可减慢海轮外壳腐蚀
C.在汽车排气管中加装“催化转化器”是为了减少有害气体的排放
D.氧化镁可用于制作高温耐火材料
二、解答题(共50分)
11.(本题15分)实验室采用简易装置模拟演示工业炼铁原理,实验装置图和实验步骤如下:
①按上图连接好装置,检查装置气密性。
②称取适量 Fe2O3于石英试管中,点燃Ⅰ处酒精灯,缓慢滴入甲酸。
③在完成某项操作后,点燃另外两处酒精灯。
④30 min后熄灭酒精灯,关闭弹簧夹。
⑤待产物冷却至室温后,收集产物。
⑥采用如上方法分别收集带金属网罩酒精灯(金属网罩可以集中火焰、提高温度)和酒精喷灯加热的产物。
请回答下列问题:
(1)制备CO的原理是利用甲酸(HCOOH)在浓硫酸加热条件下的分解制得,盛放甲酸的仪器名称为 ,该反应的化学方程式 。
(2)实验步骤③某项操作是指 。
(3)实验步骤④熄灭酒精灯的顺序为 。(填“Ⅰ”、“Ⅱ”或“Ⅲ”)
(4)通过查资料获取如下信息:
I.酒精灯平均温度为600℃;加网罩酒精灯平均温度为700℃,酒精喷灯平均温度为930℃。
II.资料指出当反应温度高于710℃,Fe能稳定存在,680℃~710℃之间,FeO稳定存在,低于680℃,则主要是Fe3O4。试分析酒精灯加热条件下生成Fe的原因是 。
(5)已知FeO、Fe2O3、Fe3O4氧元素的质量分数分别为:22.2%、30%、27.6%。利用仪器分析测出3种样品所含元素种类和各元素的质量分数如下表:
加热方式 产物元素组成 各元素的质量分数%
Fe O
酒精灯 Fe和O 74.50 25.50
带网罩酒精灯 Fe和O 76.48 23.52
酒精喷灯 Fe 100.00 0.00
分析各元素的质量分数可知前二种加热方式得到的产物为混合物,其中酒精灯加热所得产物的组成最多有 种可能。
(6)通过进一步的仪器分析测出前二种加热方式得到的固体粉末成分均为Fe3O4和Fe,用酒精喷灯加热得到的固体粉末成分为Fe。请计算利用酒精灯加热方式混合物中Fe3O4和Fe的质量比为 。(要求保留整数)
12.(本题15分)实验室中,用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高纯氧化铁(—
Fe2O3)的步骤如下:
回答下列问题:
(1)上述实验中,加入铁粉的作用是 。(用离子方程式表示)实验中检验溶液x中的离子是否与铁粉完全反应的试剂是 溶液
(2)实验室欲用18.4 mol·L-1。的浓硫酸配制100 mL5.0mol·L-1的硫酸溶液,所用仪器除胶头滴管、量筒、烧杯、玻璃棒外,还有 (填写仪器名称);
(3)某同学用下图所示装置实现向溶液Y中通入NH3和CO2
①上述装置的中,仪器a的名称是 ;装置B的作用是 。
②圆底烧瓶内放置的固体药品为 (填化学式);试管内发生反应的化学方程式为 。
③甲、乙、丙三位同学分别用上述装置进行实验,装置C的试剂瓶内溶液体积相等。
若甲、乙两同学实验中,通入的NH3和CO2的物质的量之比分别为2:l和l:l,恰好完全反应后,溶液中水的电离程度 (填“>”“=”或“<”)。
若丙同学未用装置D,则反应后溶液中离子浓度间的关系为[H+]+[NH4+]= 。
13.(本题20分)2011年是国际化学年(IYC2011),其宗旨是“增进公众对化学重要性的认识,鼓励青年人热爱化学,学习和研究化学”。某校化学兴趣小组的同学,对课本中一氧化碳还原氧化铁实验作了绿色化改进后制取单质铁(K1,K2是活塞):
(1)关闭K1、开启K2,可以验证CO还原Fe2O3的产物。
①这是关于气体的实验,实验前必须对装置进行
② CO还原Fe2O3的化学方程式为
③在e处点燃气体的目的是
(2)关闭K2,开启K1,可以将d口出来的气体再从a通入装置而循环使用。
① c瓶中应装 (填序号)。
A.澄清石灰水 B.水 C.石蕊溶液 D.浓硫酸
②写出b中的化学反应方程式
③反应完后(假设b瓶中NaOH全部转化为纯碱),要从b瓶中溶液得到纯碱固体,必要的实验操作为转移、 结晶。
④该实验这样改进的主要优点是
参考答案:
1.A
【详解】A.胶体能产生丁达尔效应,溶液不能产生丁达尔效应,MgCl2溶液不属于胶体,故A正确;
B.与质子数相同,中子数不同,互为同位素,故B错误;
C.钡离子是一种重金属离子,对人体有害,可以使人体中毒,硫酸钡在医学上用作钡餐是因为硫酸钡既不溶于水也不溶于酸,不会产生可溶性钡离子,所以它对人体无害,故C错误;
D.磁铁矿的主要成分为,故D错误;
故答案选A。
2.A
【详解】炼钢过程中反应原理:2Fe+O22FeO、FeO+CFe+CO 、2FeO+Si2Fe+SiO2。反应中C元素化合价升高,Fe元素发生Fe~FeO~Fe的一系列反应中,则Fe元素既失去电子也得到电子,所以既被氧化又被还原,答案选A。
【点睛】从化合价的角度分析被氧化还是被还原,要正确的写出炼钢过程的化学方程式。
3.A
【详解】A.蒸馏海水,利用沸点的差异分离易挥发和难挥发的物质,没有涉及到化学变化,A项符合题意;
B.铁矿石炼铁,从铁的化合物得到铁单质,涉及到化学变化,B项不符合题意;
C.石油裂解,使得较长碳链的烷烃断裂得到较短碳链的烃类化工原料,涉及到化学变化,C项不符合题意;
D.煤生成水煤气,C与水蒸气高温条件下得到CO和H2,涉及到化学变化,D项不符合题意;
本题答案选A。
4.C
【详解】A.Al(OH)3胶体具有疏松多孔的结构,具有吸附性,能吸附水中悬浮物,可用于水的净化,所以氢氧化铝胶体可用于净水,故A正确;
B.熔点高的物质可作耐火材料,氧化镁为离子化合物,熔点高,可用于制作耐高温材料,故B正确;
C.晶体硅是良好的半导体材料,常用于制造芯片,常用于制造光导纤维的是二氧化硅,而不是硅,故C错误;
D.炼铁时,石灰石中的碳酸钙在高温条件下分解能生成氧化钙和二氧化碳,氧化钙能和二氧化硅反应生成硅酸钙,从而除去铁矿石中的二氧化硅,故D正确;
答案为C。
5.B
【详解】A.酒放置时间长,部分乙醇转化成乙酸乙酯等酯类物质,具有果香味,A项正确;
B.工业上把生铁炼成钢是用氧气或铁的氧化物作氧化剂在高温条件下把生铁中的过量的碳和其它杂质氧化成气体或炉渣除去,B项错误;
C.在雷电作用下空气中N2和O2反应生成NO,经过一系列化学反应最终形成可溶性硝酸盐,增加土壤中氮肥含量,有利于作物生长,C项正确;
D.钠盐和钾盐焰色反应的颜色不同,焰色反应是物理变化,D项正确;
答案选B。
6.D
【详解】A.溴主要存在于海水中,碘主要富集在海水植物中,海水提溴是工业上获取溴的重要途径,故A错误;
B.工业炼铁需要用到的原料有铁矿石、焦炭、空气和石灰石,焦炭可以提供热量,生成一氧化碳;一氧化碳再跟铁矿石中的氧化物反应,生成铁;石灰石在高温条件下分解能生成氧化钙和二氧化碳,氧化钙能和铁矿石中的杂质二氧化硅反应生成硅酸钙,从而除去二氧化硅,原料中没有熟石灰,故B错误;
C.海水中含有大量镁元素,可以通过多步转化得到六水合氯化镁晶体,氯化镁易水解生成氢氧化镁和氯化氢,且氯化氢易挥发,导致直接加热带结晶水的晶体时得不到氯化镁,为防止氯化镁水解,需要将带结晶水的氯化镁在氯化氢氛围中加热,得到无水氯化镁,采用电解熔融氯化镁的方法冶炼镁,故C错误;
D.加热胆矾或绿矾会分解生成三氧化硫,与水反应生成硫酸,早在1000多年前,我国就已采用加热绿矾的方法制取硫酸,故D正确;
答案选D。
【点睛】熟悉工业冶炼金属原理是解题关键。本题的易错点为B,工业炼铁原料中应有石灰石不是熟石灰,石灰石作用是除去二氧化硅形成硅酸钙炉渣。
7.B
【详解】A.生铁和钢都是铁的含碳合金,钢中碳的含量在0.03%~2.0%之间,生铁中碳的含量在2.0%~4.3%之间,所以生铁的碳含量高于钢的碳含量,故A错误;
B.通过炼制和锻打,可以降低生铁中含碳量,除去生铁中有害元素P、S,调整生铁中Si、Mn的含量,这样的铁有韧性、可锻轧、可延压,故B正确;
C.根据含碳量的不同,碳素钢可分为高碳钢、中碳钢、低碳钢,其中高碳钢硬度较大,韧性较差,低碳钢,硬度较小,韧性较强,故C错误;
D.不锈钢是一种常见的合金钢,它的合金元素主要是铬(Cr)、镍(Ni),常用来制造医疗器械、餐具等,故D错误;
答案为B。
8.C
【详解】A.钢是用量最大、用途最广的合金,A项正确;
B.Si是半导体材料,太阳能电池的半导体材料主要是Si,B项正确;
C.碳纤维属于无机材料,C项错误;
D.CO2在一定条件下可与H2反应合成CH3OH,从而减少二氧化碳的排放,实现二氧化碳的绿色利用,D项正确。
答案选C。
9.B
【详解】
A.工业上高炉炼铁时从炉顶装入铁矿石、焦炭、造渣用熔剂(石灰石),从位于炉子下部沿炉周的风口吹入经预热的空气,在高温下焦炭中的碳同鼓入空气中的氧燃烧生成的一氧化碳,在炉内上升过程中除去铁炉石中的氧,从而还原得到铁,故A项正确;
B. H2和Cl2充分混合后点燃会发生爆炸,不可用于工业制备HCl,故B错误;
C.湿法治金是金属冾炼的常用方法之一,如电解ZnSO4溶液,根据电解池阴阳极放电顺序,阳极水电离出的氢氧根放电,阴极为Zn2+放电得电子生成锌单质,可以制备Zn,故C项正确;
D.硝酸工业会产生氮的氧化物,尾气可用NaOH溶液来吸收,故D正确;
故选B。
10.B
【详解】A.炼铁时加入少量石灰石(主要成分为碳酸钙)的目的是将铁矿石中的脉石(主要成分为SiO2)转变为炉渣(硅酸钙)而除去,故A正确;
B.因为铜的金属活泼性比铁弱,所以在海轮外壳上装上铜块,海轮外壳、铜块和海水形成的原电池中,海轮外壳作负极,从而加快海轮外壳腐蚀,故B错误;
C.在汽车排气管中加装“催化转化器”是为了使汽车尾气中的CO和氮的氧化物转化为CO2和N2,减少有害气体的排放,故C正确;
D.氧化镁具有较高的熔点,可用于制作高温耐火材料,故D正确;
答案选B。
11.(1) 分液漏斗 HCOOH CO↑ + H2O
(2)检验CO纯度
(3)Ⅲ、Ⅰ、Ⅱ
(4)长时间集中加热使局部温度达到生成还原铁所需要的温度
(5)9种
(6)12:1
【详解】(1)根据图中信息盛放甲酸的装置为分液漏斗,在浓硫酸加热条件下,HCOOH分解可得CO,根据质量守恒可知另一个产物为水,反应的化学方程式为:HCOOH CO↑+H2O;故答案为:分液漏斗;HCOOH CO↑+H2O。
(2)CO是可燃性气体,因此应先检验CO纯度后点燃另外两处酒精灯,先检验CO纯度目的看试管内的空气是否排净,防止爆炸;故答案为:检验CO纯度。
(3)实验结束后要等试管冷却后才停止通一氧化碳,故先熄灭Ⅲ处酒精灯,是为了防止生成的铁被空气中的氧气氧化;应最后熄灭Ⅰ处酒精灯,目的是防止多余的一氧化碳进入空气中污染环境,所以实验步骤④熄灭酒精灯的顺序为 Ⅲ、Ⅰ、Ⅱ;故答案为:Ⅲ、Ⅰ、Ⅱ。
(4)加网罩酒精灯平均温度为700℃,当反应温度高于710℃,Fe能稳定存在原因是加网罩酒精灯平均温度为700℃,与710℃温度差比较小,且长时间集中加热可使局部温度达到生成还原铁所需要的温度;故答案为:长时间集中加热使局部温度达到生成还原铁所需要的温度。
(5)由数据可知,Fe、FeO、Fe2O3、Fe3O4中Fe元素的百分含量分别为100%、77.8%、70%、72.4%,酒精灯加热所得产物中Fe元素的百分含量为74.50%,混合物中至少有一个Fe元素含量大于74.50%,至少有一个Fe元素含量小于74.50%,故混合物中一定有Fe和FeO中的至少一种,也一定有Fe2O3和Fe3O4中的一种,这样就会出现,两种混合的有4种:Fe、Fe2O3,Fe、Fe3O4,FeO、Fe2O3,FeO、Fe3O4,三种混合的有4种:Fe、Fe2O3和Fe3O4,FeO、Fe2O3和Fe3O4,Fe2O3、Fe和FeO,Fe3O4、Fe和FeO ,四种混合的有1种:Fe、FeO、Fe2O3和Fe3O4,因此共9种;故答案为:9。
(6)根据酒精灯加热得到的产物为Fe3O4和Fe,且铁元素的百分含量为74.50%,设Fe3O4的质量为x,Fe的质量为y,则,解得:;故答案为:12:1。
12. Fe+2Fe3+=3Fe2+ KSCN 100mL容量瓶 分液漏斗 防倒吸 CaCO3 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O > [H+]+[NH4+]=[ OH-]+2[SO42-]+[Cl-]
【详解】试题分析:(1)硫铁矿烧渣与硫酸反应,二氧化硅不溶于硫酸,所以溶液为硫酸铁和硫酸亚铁溶液,加入铁粉的目的是将铁离子还原为亚铁离子,离子方程式为Fe+2Fe3+=3Fe2+;检验铁离子是否全部被还原,用KSCN溶液,若使KSCN溶液变红色,说明未完全还原;
(2)配制100 mL5.0mol·L-1的硫酸溶液,所用仪器除胶头滴管、量筒、烧杯、玻璃棒外,还有100mL容量瓶盛放溶液;
(3)①仪器a的名称是分液漏斗;A装置产生氨气,因为制取氨气需要加热,所以B装置的作用是防止发生倒吸现象,使装置A的试管炸裂;
②装置E是产生二氧化碳的装置,所以圆底烧瓶内放置的固体药品为碳酸钙,化学式为CaCO3;试管内发生的是氢氧化钙与氯化铵的反应,加热产生氨气,化学方程式为2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O;
③Y为硫酸亚铁溶液,通入的NH3和CO2的物质的量之比分别为2:l和l:l时得到的溶液中的溶质分别为硫酸铵和硫酸氢铵,硫酸铵溶液中铵根离子水解,促进水的电离,而硫酸氢铵溶液中硫酸氢铵电离产生的氢离子,对水的电离起抑制作用,则硫酸铵水解程度大于硫酸氢铵水解程度,所以甲中的水电离程度大于乙的水电离程度;装置D的作用是除去二氧化碳中的氯化氢,若丙同学未用装置D,则二氧化碳中混有氯化氢气体,二氧化碳、氨气、硫酸亚铁反应生成碳酸亚铁沉淀和硫酸铵、氯化铵,则反应后溶液中存在氯离子,离子浓度间的关系符合电荷守恒,所以[H+]+[NH4+]=[ OH-]+2[SO42-]+[Cl-]。
考点:考查离子的检验、溶液的配制、气体的制备、水电离程度的判断
13.(1) 气密性检查 尾气处理、除去没有反应的CO。
(2) D 蒸发浓缩、冷却 能循环利用CO、提高了原料利用率、减少了二氧化碳的排放
【分析】在高温下,一氧化碳能还原氧化铁得到铁和二氧化碳。一氧化碳有毒,因此必须进行尾气处理。反应混合气体先通过碱液吸收,再点燃处理CO,据此回答。
【详解】(1)①为了防止漏气、关于气体的实验,实验前必须对装置进行气密性检查。
②高温下,CO还原Fe2O3得到CO2和Fe,化学方程式为。
③CO有剧毒,不能直接排放到空气中,在e处点燃气体的目的是:尾气处理、除去没有反应的CO。
(2)关闭K2,开启K1,可以将d口出来的气体再从a通入装置而循环使用。则:① d口出来的气体必须是纯净而干燥的CO气体,b装置能充分吸收二氧化碳、c装置用于干燥,则c瓶中应装浓硫酸,选D。
②b中氢氧化钠溶液吸收二氧化碳、化学反应方程式:。
③反应完后(假设b瓶中NaOH全部转化为纯碱),要从b瓶中溶液得到纯碱固体,从溶液中提取的碳酸钠固体是。适合用冷却结晶法。必要的实验操作为转移、蒸发浓缩、冷却、结晶。
④过量的CO从d排出进入a,故该实验这样改进的主要优点是能循环利用CO、提高了原料利用率、减少了二氧化碳的排放。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
