研究有机化合物的一般方法和步骤-高考化学考前专项练习试题(含解析)
文档属性
| 名称 | 研究有机化合物的一般方法和步骤-高考化学考前专项练习试题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 833.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-13 12:39:59 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
研究有机化合物的一般方法和步骤
共18题,满分100分
题号 一 二 三 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请注意保持试卷整洁
一、单选题(共50分)
1.(本题5分)将0.2 mol某烷烃完全燃烧后,生成的气体缓缓通入盛有0.5L 2 mol/L的NaOH溶液中,生成的碳酸钠和碳酸氢钠的物质的量之比1:3,则某烷烃为
A.丁烷 B.乙烷 C.甲烷 D.丙烷
2.(本题5分)美国莱斯大学的Chanteau博士,研究并合成了很多颇具艺术性的纳米分子。某纳米分子有机合成过程中的一步关键反应如下所示:
+
下列说法中正确的是
A.化合物X的官能团有4种
B.化合物Y的核磁共振氢谱中有8组峰
C.化合物Z能使酸性溶液褪色
D.该反应符合绿色化学的理念,原子利用率为100%
3.(本题5分)下列化合物分子中,在核磁共振氢谱图中能给出三种信号峰的是
A.CH3CH2CH3 B.CH3COCH2CH3 C.CH3CH2CH2OH D.CH3OCH3
4.(本题5分)苯甲酸的熔点为122.13℃,微溶于水,易溶于酒精,实验室制备少量苯甲酸的流程如图:
苯甲酸钾溶液苯甲酸固体
下列叙述不正确的是
A.得到的苯甲酸固体用酒精洗涤比用水洗涤好
B.加入KMnO4后紫色变浅或消失,有浑浊生成
C.操作1为过滤,操作2为酸化,操作3为过滤
D.冷凝回流的目的是提高甲苯的转化率
5.(本题5分)某有机物的核磁共振氢谱图如图所示,该有机物可能是
A. B. C.戊烯 D.丙酸
6.(本题5分)扭曲烷( Twistane)是一种具有挥发性的环烷烃,其结构如图所示。下列关于扭曲烷说法正确的是
A.分子式为C10H18
B.与二乙苯互为同分异构体
C.一氯代物有2种(不含立体异构)
D.二氯代物多于6种(不含立体异构)
7.(本题5分)0.1mol某有机物的蒸气跟过量O2混合后点燃,生成13.2g CO2和5.4g H2O,该有机物跟金属反应放出H2,又能跟新制Cu(OH)2悬浊液加热时生成红色沉淀,此有机物还能跟乙酸反应生成酯类化合物.该酯类化合物的结构简式可能是( )
A.CH3CH(OCH3) CHO B.OHCCH2CH2COOCH3
C.CH3CH(OOCCH3)CHO D.OHCCH(OH) COOH
8.(本题5分)有机物X和Y在一定条件下可制得环氧树脂粘合剂Z,其结构:X为,Y为,Z为,下列说法正确的是
A.X核磁共振氢谱有3个吸收峰
B.生成的同时生成
C.X、Y反应生成Z的过程既有取代反应,也有聚合反应
D.相同条件下,苯酚和Y反应生成结构与Z相似的高分子
9.(本题5分)在实验室中,下列除去杂质的方法不正确的是( )
A.溴苯中混有溴,将其加入NaOH稀溶液中反复洗涤、分液
B.乙烷中混有乙烯,在一定条件下通入氢气,使乙烯转化为乙烷
C.硝基苯中混有浓硝酸和浓硫酸,将其加入NaOH溶液中,静置、分液
D.乙醇中混有乙酸,加入氢氧化钠溶液,蒸馏
10.(本题5分)某有机物常用于生产聚酯纤维和树脂,是一种重要化工合成原料,使用现代仪器对该有机物的结构进行测定,相关谱图如下。下列有关说法错误的是
A.由质谱图可知该有机物相对分子质量为91
B.由核磁共振氢谱可知该有机物中有2种不同化学环境的氢原子
C.由红外光谱可获得该有机物化学键或官能团信息
D.综合以上信息可知该有机物为对二甲苯
二、判断题(共20分)
11.(本题4分)乙酸乙酯中混有乙酸,加入氢氧化钠溶液,再加热蒸馏。(______)
12.(本题4分)根据红外光谱可以确定有机物中化学键种类。(_____)
13.(本题4分)向混合液中加入生石灰后蒸馏,以除去乙酸中混有的乙醇。(_____)
14.(本题4分)用96%的工业酒精制取无水乙醇,可采用的方法是加生石灰,再蒸馏。(______)
15.(本题4分)有机物的1H-核磁共振谱图中有4组特征峰。(___________)
三、解答题(共30分)
16.(本题10分)依据有关信息解答下列化学实验问题:
(Ⅰ)醛类是重要的工业原料,可以跟亚硫酸氢钠饱和溶液反应,生成物是α﹣羟基磺酸钠(易溶于水,不溶于饱和亚硫酸氢钠溶液)R-CHO+NaHSO3R-CH(OH)-SO3Na
(1)上述反应类型为 反应。若使CH3 CH(OH)-SO3Na全部变成乙醛,可采用的试剂是 或 ;分离乙醛的操作方法 。
(Ⅱ)实验室利用苯甲醛(安息香醛)制备苯甲醇和苯甲酸的化学原理:
(此原理适用于无α-氢的醛)
已知部分物质的性质:
苯甲醇:熔点(℃):-15.3℃,稍溶于水,易溶于有机溶剂;
苯甲醛:熔点(℃):-26℃,微溶于水,易溶于有机溶剂;
苯甲酸:溶解度为0.344g(25℃),易溶于有机溶剂.主要过程如图所示:
回答下列问题:
(2)操作Ⅰ的名称是 ,乙醚溶液中所溶解的主要成分是 ;
(3)操作Ⅲ的名称是 ,产品乙是 .
(4)按上述操作所得的产品甲中常含有一定量的有机杂质 (填写杂质的名称);限用下列试剂:酸性KMnO4、稀NaOH溶液、稀H2SO4、饱和NaHSO3溶液.写出检验产品甲中含有该杂质的过程: .
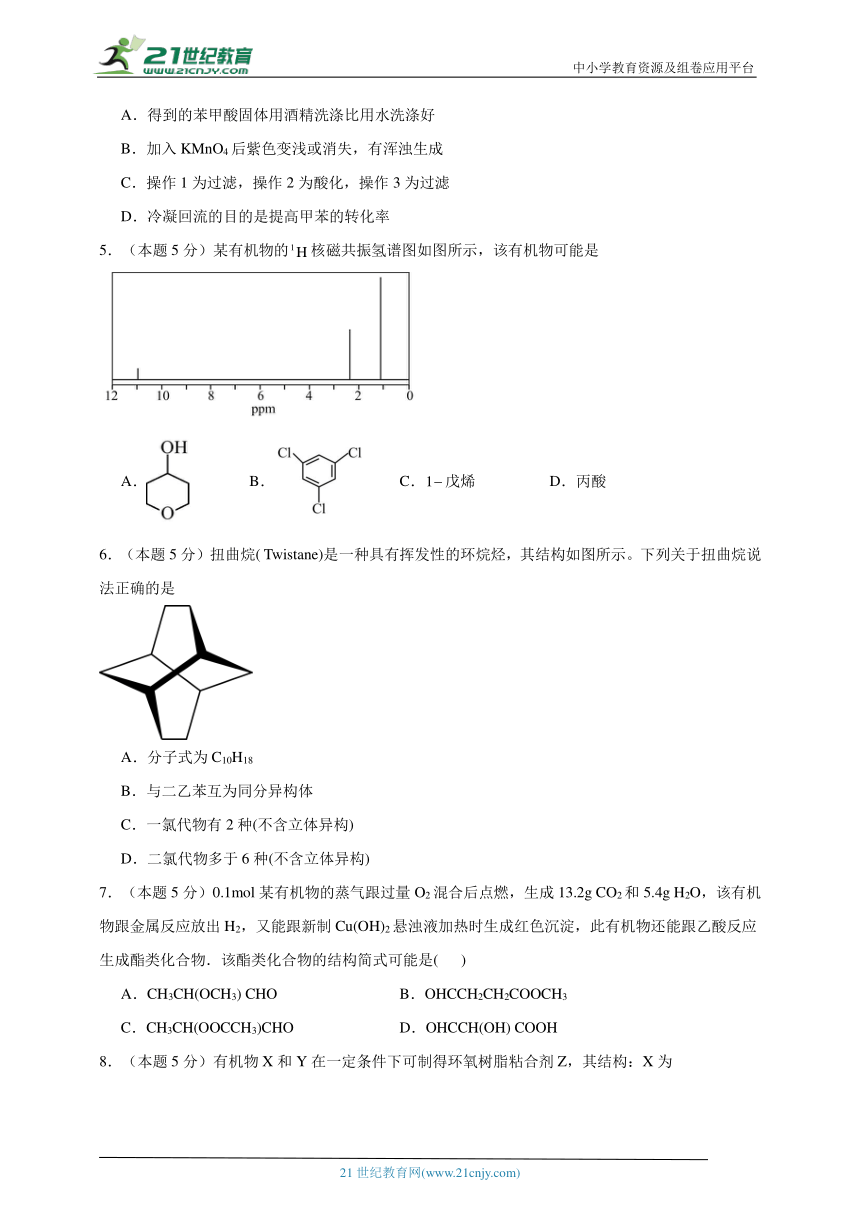
17.(本题10分)通常将一定量的有机物充分燃烧转化为简单的无机物,然后根据产物的质量确定有机物的组成。如图所示是用燃烧法确定有机物分子式的常用装置。若准确称取0.69 g样品(只含C、H、O三种元素中的两种或三种),充分燃烧后,A管质量增加1.32 g,B管质量增加0.81 g。
请回答下列问题:
(1)使产生的O2按从左到右的方向流动,则所选装置中各导管的正确连接顺序是 (填字母)。
(2)装置C中浓硫酸的作用是 。
(3)燃烧管中CuO的作用是 。
(4)根据题中所给数据,推断该有机物的实验式为 。
(5)经测定其蒸气密度为2.054 g/L(已换算为标准状况),则其分子式为 。
(6)该物质的核磁共振氢谱如图所示,三种峰面积之比为1:2:3,则其结构简式为 。
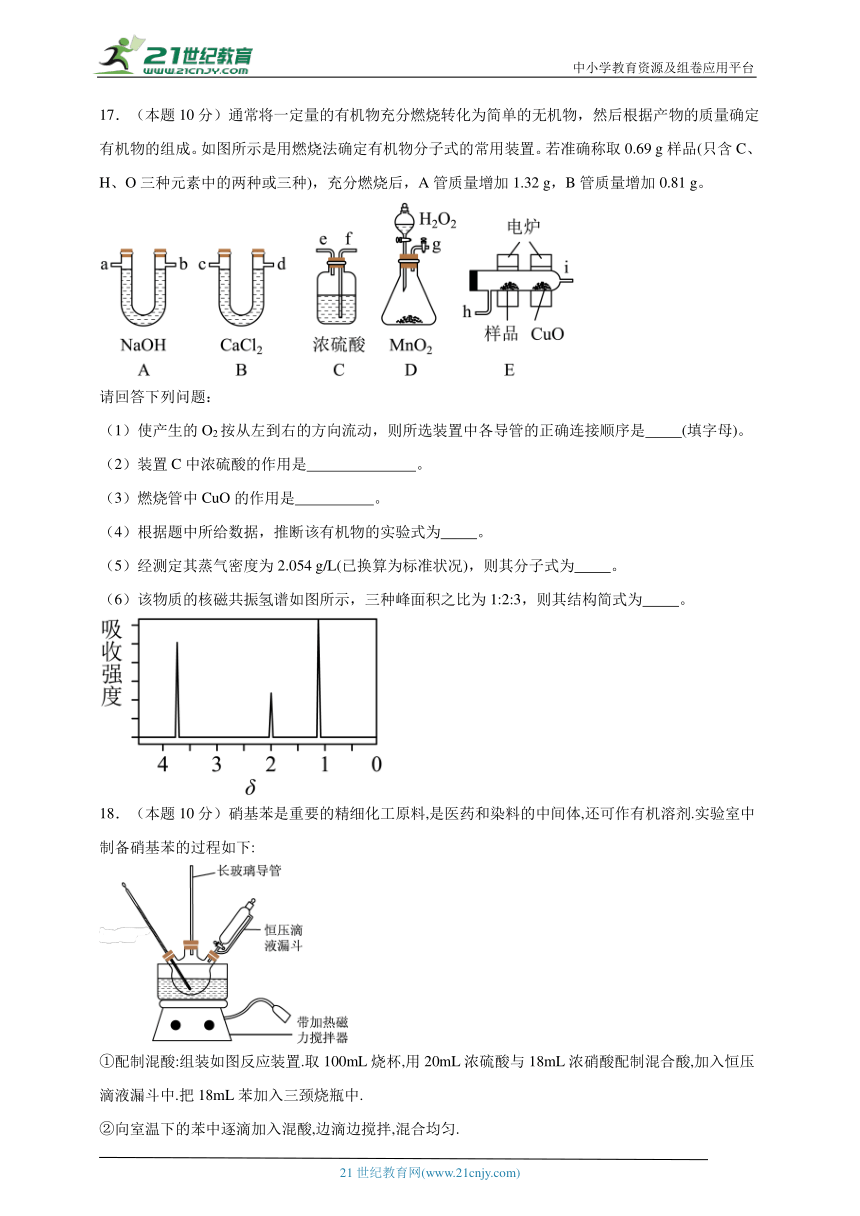
18.(本题10分)硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂.实验室中制备硝基苯的过程如下:
①配制混酸:组装如图反应装置.取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混合酸,加入恒压滴液漏斗中.把18mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀.
③加热在50~60℃下发生反应,直至反说结束.
④除去混合酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后用蒸馏水洗涤得到粗产品.
⑤为了得到更纯净的硝基苯.还需先向液棒中加入试剂A,静置一段时间后弃去试剂A,然后蒸馏,最终得到17.5g硝基苯
已知:
+HNO3(浓)+H2O
+HNO3(浓) (6%)+ (93%)+ (1%)+H2O
可能用到的有关数据列表如下:
物质 熔点/℃ 沸点/℃ 密度(20℃)/(g cm-3) 溶解性
苯 5.5 80 0.88 微溶于水
硝基苯 5.7 210.9 1.205 难溶于水
1,3-二硝基苯 89 301 1.57 微溶于水
浓硝酸 83 1.4 易溶于水
浓硫酸 338 1.84 易溶于水
请回答下列问题:
(1)配制混酸应先在烧杯中加入 .
(2)恒压滴液漏斗的优点是 ,实验装置中长玻璃导管可用 代替(填仪器名称)
(3)要控制反应温度50~60℃,可用水浴加热,其优点为
(4)反应结束后产品在液体的 层(填"上"或"下"),分离混酸和产品的操作方法为
(5)用10% Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净
(6)试剂A是 ,蒸馏过程中需在蒸馏烧瓶中加入沸石,其作用为 若加热后,发现未加沸石,应采取的正确方法
(7)硝基苯的产率为 .
参考答案:
1.A
【详解】方法一:从化学方程式2NaOH+CO2===Na2CO3+H2O 和 NaOH+CO2===NaHCO3,生成 Na2CO3 和 NaHCO3的物质的量之比为1∶3可知,消耗NaOH的物质的量之比为2∶3,进一步可求得对应的NaOH分别为和,与NaOH反应的 CO2 分别为0.2mol和0.6mol,则1mol该烷烃中含碳原子为,根据 CnH2n+2 得H为10mol,则分子式为C4H10,该烷烃为丁烷,选A。
方法二:原子守恒法。设 Na2CO3 与NaHCO3物质的量分别为x、y,则有
2x+y=0.5L×2mol/L ①
x:y=1:3 ②
解得x=0.2mol,y=0.6mol。
n(C)=x+y=0.2mol+0.6mol=0.8mol(碳原子守恒)
烷烃分子中含碳原子为,分子式为C4H10,该烷烃为丁烷,选A。
2.C
【详解】A.化合物X含有的官能团为:碳溴键、醚键和碳碳三键,共3种,A错误;
B.如图所示:,化合物Y含有6种处于不同化学环境的氢原子,所以化合物Y的核磁共振氢谱中有6组峰,B错误;
C.Z中含有碳碳三键可以使酸性溶液褪色,C正确;
D.X中含有溴原子,Z中没有溴原子,可知除了Z还有其他物质生成,原子利用率小于100%,D错误;
答案为:C。
3.B
【详解】试题分析:在核磁共振氢谱图中CH3CH2CH3、CH3CH2CH2OH 、CH3OCH3均只有二种峰,CH3COCH2CH3有三种峰,选项B正确。
考点:核磁共振氢谱图 涉及考点是等效氢
4.A
【分析】由流程可知,甲苯被高锰酸钾氧化生成苯甲酸钾、二氧化锰,操作1为过滤,分离出苯甲酸钾溶液,且苯甲酸的溶解度不大,则操作2中加强酸生成苯甲酸,操作3为过滤,分离出苯甲酸固体,以此来解答。
【详解】A.苯甲酸微溶于水,易溶于酒精,为避免因重新溶解而损失,应用水洗涤好,故A错误;
B.由反应物、生成物可知,加入KMnO4反应后,Mn元素的化合价降低,生成二氧化锰,则紫色变浅或消失,有浑浊生成,故B正确;
C.由上述分析可知,操作1为过滤,操作2为酸化,操作3为过滤,故C正确;
D.冷凝回流可使反应物充分反应,目的是提高甲苯的转化率,故D正确;
故选:A。
5.D
【分析】图中信息显示,有机物分子中含有3种氢原子,且原子个数不等。
【详解】A. 分子中含有4种氢原子,1H核磁共振氢谱有4种吸收峰,A不符合题意;
B. 分子中含有2种氢原子,1H核磁共振氢谱有2种吸收峰,B不符合题意;
C.戊烯的结构简式为CH2=CHCH2CH2CH3,分子中含有5种氢原子,1H核磁共振氢谱有5种吸收峰,C不符合题意;
D.丙酸的结构简式为CH3CH2COOH,分子中含有3种氢原子,氢原子个数比为3:2:1,与图中信息相符,D符合题意;
故选D。
6.D
【详解】A. 结合结构式和球棍模型可以数出一共有10个碳原子(黑球),16个氢原子(白球),因此分子式为C10H16,A项错误;
B. 二乙苯(如邻二乙苯:)的分子式为C10H14,因此与扭曲烷不互为同分异构体,B项错误;
C.扭曲烷有三种氢原子,其一氯代物有3种,C项错误;
D. 由C项分析知,扭曲烷有3种氢原子,当氯原子取代挂星号的氢原子时,另一个氯原子的位置可以有6种氢原子,,当氯原子取代另外两种氢原子时,还可以得到二氯代物,故二氯代物多于6种。D项正确;
答案选D。
7.C
【分析】0.1mol某有机物的蒸气跟足量O2混合点燃,反应后生成13.2g即0.3molCO2和5.4g即0.3molH2O,根据质量守恒可知1个有机物分子中含有3个碳原子和6个氢原子,可能含有氧原子,根据该有机物能跟Na反应放出H2,又能跟新制Cu(OH)2反应生成红色沉淀,此有机物还能跟乙酸反应生成酯类化合物,说明有机物中一定含有羟基、醛基,可能含有羧基,生成的酯类化合物中一定含有酯基来解答。
【详解】A.CH3-CH(OCH3)-CHO中没有酯基,不符合题意,故A错误;
B.OHCCH2COOCH2CH3中含有酯基,但原有机物中没有羟基,不符合题意,故B错误;
C.中含有酯基,原有机物中1个分子中含有3个碳原子和6个氢原子,有机物中含有羟基、醛基,符合题意,故C正确;
D.CH3COOCH2CH2COCH3中没有醛基,不符合题意,故D错误;
故答案为C。
8.C
【详解】A.由结构简式可知,X分子中含有4类氢原子,核磁共振氢谱有4个吸收峰,故A错误;
B.由原子个数守恒可知,X与Y反应生成1molZ的同时生成(n+2)mol氯化氢,故B错误;
C.由结构简式可知,X与Y反应生成Z的过程为X与Y发生缩聚反应生成,与Y发生取代反应生成Z,则生成Z的过程中既有取代反应,也有聚合反应,故C正确;
D.苯酚分子中只含有1个羟基,和Y只能发生取代反应或环加成反应,不能发生缩聚反应,所以不能生成结构与Z相似的高分子,故D错误;
故选C。
9.B
【详解】A.溴与NaOH反应后,与溴苯分层,则在NaOH稀溶液中反复洗涤、分液可除杂,故A正确;
B.乙烯与氢气发生加成反应,但易引入新杂质氢气,不能除杂,应选溴水、洗气除杂,故B错误;
C.浓硝酸和浓硫酸与NaOH反应后,与硝基苯分层,则在NaOH溶液中,静置、分液可除杂,故C正确;
D.乙酸与NaOH能发生中和反应,乙醇易挥发,则乙醇中混有乙酸加入氢氧化钠溶液,蒸馏即可得到乙醇,故D正确;
故答案为B。
10.A
【详解】A.由质谱图可知该有机物相对分子质量为106,故A错误;
B.由核磁共振氢谱图,图中有2种不同化学环境的氢原子,则该有机物中有2种不同化学环境的氢原子,故B正确;
C.由红外光谱可获得该有机物化学键或官能团信息,该有机物中含有碳氢键、苯环、苯环连碳,故C正确;
D.根据红外光谱、核磁共振氢谱图,质谱图分析得到该有机物为对二甲苯,故D正确。
综上所述,答案为A。
11.错误
【详解】乙酸乙酯中混有乙酸,不能用氢氧化钠溶液除乙酸,因为乙酸乙酯也会与氢氧化钠溶液反应,应用饱和碳酸钠溶液,再分液即可,故错误。
12.错误
【详解】不同的化学键或官能团吸收频率不同,在红外光谱图上处于不同的位置,所以红外光谱图能确定有机物分子中的化学键或官能团,不能确定化学键的种类,故错误。
13.错误
【详解】乙酸会与氧化钙反应生成成乙酸钙,故错误。
14.正确
【详解】CaO与水反应后,增大与乙醇的沸点差异,然后蒸馏可分离,故正确;
15.正确
【详解】有机物的1H-核磁共振谱图中有4种H,正确。
16. 加成 NaOH HCl 蒸馏 萃取分液 苯甲醇 过滤 苯甲酸 苯甲醛 取少量产品甲于试管中,向试管中滴加适量的饱和NaHSO3溶液,如果有晶体析出,说明含有苯甲醛
【分析】Ⅱ、由流程可知,苯甲醛与KOH反应生成苯甲醇、苯甲酸钾,然后加水、乙醚萃取苯甲醇,操作Ⅰ分层,得到乙醚与水溶液,则为萃取分液,则乙醚溶液中含苯甲醇,操作II为蒸馏,得到产品甲为苯甲醇;水溶液中含苯甲酸钾,加盐酸发生强酸制取弱酸的反应,生成苯甲酸,苯甲酸的溶解度小,则操作Ⅲ为过滤,则产品乙为苯甲酸,以此来解答。
【详解】Ⅰ、(1)R-CHO+NaHSO3 R-CH(OH)-SO3Na反应类型为加成反应;因为可逆反应R﹣CHO+NaHSO3 R﹣CH(OH)﹣SO3Na,要想使CH3CH(OH)﹣SO3Na全部变成乙醛即使平衡向逆反应方向移动,可以采取加入氢氧化钠或者盐酸消耗亚硫酸氢钠使平衡逆向移动,所以可以加入的为NaOH或者HCl;分离互溶的有机物利用沸点不同,采用蒸馏的方法,所以分离乙醛的操作方法为蒸馏;
故答案为:加成;NaOH或HCl;蒸馏;
Ⅱ、(2)根据以上分析,操作Ⅰ分层乙醚与水溶液,则为萃取分液,故答案为萃取分液;苯甲醇;
(3)根据以上分析,操作Ⅲ为过滤,产品乙是苯甲酸,故答案为过滤;苯甲酸;
(4)根据苯甲醛与KOH反应生成苯甲醇、苯甲酸钾,所得混合物中可能还有未反应的苯甲醛,然后加水、乙醚萃取苯甲醇和未反应的苯甲醛,则乙醚溶液中含苯甲醇和未反应的苯甲醛,所以操作II为蒸馏,得到产品甲为苯甲醇和未反应的苯甲醛,根据醛类是重要的工业原料,可以跟亚硫酸氢钠饱和溶液发生加成反应,生成是α﹣羟基磺酸钠(易溶于水,不溶于饱和亚硫酸氢钠溶液),所以可以通过取少量产品甲于试管中,向试管中滴加适量的饱和NaHSO3溶液,如果有晶体析出,说明含有苯甲醛;
故答案为苯甲醛;取少量产品甲于试管中,向试管中滴加适量的饱和NaHSO3溶液,如果有晶体析出,说明含有苯甲醛。
17. g→f→e→h→i→c(或d)→d(或c)→a(或b)→b(或a) 干燥O2 确保有机物中的碳元素全部转化为CO2 C2H6O C2H6O CH3CH2OH
【分析】通过计算确定有机物的分子式,由有机物的结构特点和题给信息确定有机物的结构简式。根据反应原理可知,该实验要成功必须满足:1、快速制备氧气供燃烧使用;2、氧气要纯净;3、保证碳元素完全转化为CO2,氢元素完全转化为H2O,且CO2和H2O在后面装置中被完全吸收。
【详解】(1)使产生的O2按从左到右的方向流动,需先制备氧气,然后将气体通过浓硫酸干燥氧气,获得纯净的氧气,其导管连接为g→f→e(注意对于C,连接导管需长进短出),接着纯净的氧气与有机物反应,因而e→h→i,氧气与有机物反应生成CO2和H2O,先利用B中CaCl2吸收水蒸气,然后利用A中NaOH吸收CO2,若A和B颠倒,NaOH会同时吸收H2O和CO2,这样无法测定CO2和H2O各自的质量,因而正确的连接顺序为g→f→e→h→i→c(或d)→d(或c)→a(或b)→b(或a);
(2)C中浓硫酸的作用是吸收来自D产生的氧气中的水蒸气,以便获得纯净的氧气,便于后续定量实验;
(3)有机物若不完全燃烧会生成CO,CO和CuO反应会得到CO2,这样可以保证有机物中的碳元素全部转化为CO2;
(4)A管质量增加1.32 g,说明CO2的质量为1.32g,可算出C的质量为0.36g,B管质量增加0.81 g,说明H2O的质量为0.81g,可算出H的质量为0.09g,根据准确称取的0.69 g样品,可计算O的质量为0.69g-0.36g-0.09g=0.24g,则C、H、O原子个数比为=2:6:1,因而该有机物的实验式为C2H6O;
(5)M=Vm×ρ=22.4L·mol-1×2.054g·L-1≈46g·mol-1,则该有机物的相对分子质量与实验式C2H6O的式量相等,故样品的分子式为C2H6O;
(6)由核磁共振氢谱图可知该有机物分子中有三种类型的氢原子,故该有机物的结构简式不是CH3-O-CH3,而是CH3CH2OH。
【点睛】确定有机物分子式的一般方法:(1)直接法(适用已知分子量或者相关条件情况)一般做法:密度(相对密度)→摩尔质量→1摩尔分子中各元素原子的物质的量→分子式;(2)最简式法①确定最简式(实验式):根据有机物各元素的质量分数求出分子组成中各元素的原子个数比,②求出有机物的摩尔质量(相对分子质量)→分子式=(最简式)×n ,其相对分子质量为Mr,解出n得出分子式。
18. 浓硝酸 可以保持漏斗内压强与发生器内压强相等,使漏斗内液体顺利流下冷凝管 球形冷凝管或直形冷凝管均可 受热均匀,温度容易控制 上 分液 取最后一次洗涤液,加入氯化钙溶液,无沉淀生成,说明已洗净 氯化钙 防止暴沸 停止加热,冷却后补加 70%
【详解】(1)由于浓硫酸的密度比浓硝酸的大,当浓硫酸遇水时放出大量的热,所以配置混酸应将浓硫酸加入到浓硝酸中,也就是先在烧杯中先加入浓硝酸,故答案为浓硝酸。
(2)由于在反应的过程中不断加热,会产生大量的气体,这对于液体的加入很不利。若采用恒压滴液漏斗滴加,可以保持漏斗内压强与发生器内压强相等,使漏斗内液体能顺利流下;在实验的过程中苯、硝酸会因为加热而气化,导致物质的浪费与环境污染,所以在装置中长玻璃管可以起到冷凝、降温使物质回流的作用。因此可用冷凝管等冷凝装置代替;故答案为可以保持漏斗内压强与发生器内压强相等,使漏斗内液体顺利流下冷凝管;球形冷凝管或直形冷凝管均可。
(3)水浴加热可使反应受热均匀,温度容易控制,故答案为受热均匀,温度容易控制。
(4)反应结束后产生的硝基苯、1,3-二硝基苯都不溶解于水的液体,密度比酸的混合溶液小,所以反应结束后产品在液体的上层,分离互不相溶的两层液体的方法是分液,故答案为上,分液。
(5)对于得到的粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤。如果洗涤干净,则洗涤液中不含有CO32-。所以检验液体已洗净的方法是取最后一次洗涤液,向溶液中加入氯化钙,若无沉淀生成,说明已洗净;故答案为取最后一次洗涤液,加入氯化钙溶液,无沉淀生成,说明已洗净。
(6)为了得到更纯净的硝基苯,使之不含有水,可以先向液体中加入有吸水干燥作用的无水CaCl2,除去水,然后蒸馏就得到了产品;蒸馏实验中,沸石起到防止暴沸的作用,若实验开始后发现未加入沸石,需停止加热,冷却后补加,故答案为停止加热,冷却后补加。
(7)因为苯的密度为0.88g/cm3,18mL苯的质量为18mL×0.88g/cm3=15.84g,根据反应+HNO3(浓) +H2O ,可以知道硝基苯的质量为g≈25g,故硝基苯的产率为×100%=70%,故答案为70%。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
研究有机化合物的一般方法和步骤
共18题,满分100分
题号 一 二 三 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请注意保持试卷整洁
一、单选题(共50分)
1.(本题5分)将0.2 mol某烷烃完全燃烧后,生成的气体缓缓通入盛有0.5L 2 mol/L的NaOH溶液中,生成的碳酸钠和碳酸氢钠的物质的量之比1:3,则某烷烃为
A.丁烷 B.乙烷 C.甲烷 D.丙烷
2.(本题5分)美国莱斯大学的Chanteau博士,研究并合成了很多颇具艺术性的纳米分子。某纳米分子有机合成过程中的一步关键反应如下所示:
+
下列说法中正确的是
A.化合物X的官能团有4种
B.化合物Y的核磁共振氢谱中有8组峰
C.化合物Z能使酸性溶液褪色
D.该反应符合绿色化学的理念,原子利用率为100%
3.(本题5分)下列化合物分子中,在核磁共振氢谱图中能给出三种信号峰的是
A.CH3CH2CH3 B.CH3COCH2CH3 C.CH3CH2CH2OH D.CH3OCH3
4.(本题5分)苯甲酸的熔点为122.13℃,微溶于水,易溶于酒精,实验室制备少量苯甲酸的流程如图:
苯甲酸钾溶液苯甲酸固体
下列叙述不正确的是
A.得到的苯甲酸固体用酒精洗涤比用水洗涤好
B.加入KMnO4后紫色变浅或消失,有浑浊生成
C.操作1为过滤,操作2为酸化,操作3为过滤
D.冷凝回流的目的是提高甲苯的转化率
5.(本题5分)某有机物的核磁共振氢谱图如图所示,该有机物可能是
A. B. C.戊烯 D.丙酸
6.(本题5分)扭曲烷( Twistane)是一种具有挥发性的环烷烃,其结构如图所示。下列关于扭曲烷说法正确的是
A.分子式为C10H18
B.与二乙苯互为同分异构体
C.一氯代物有2种(不含立体异构)
D.二氯代物多于6种(不含立体异构)
7.(本题5分)0.1mol某有机物的蒸气跟过量O2混合后点燃,生成13.2g CO2和5.4g H2O,该有机物跟金属反应放出H2,又能跟新制Cu(OH)2悬浊液加热时生成红色沉淀,此有机物还能跟乙酸反应生成酯类化合物.该酯类化合物的结构简式可能是( )
A.CH3CH(OCH3) CHO B.OHCCH2CH2COOCH3
C.CH3CH(OOCCH3)CHO D.OHCCH(OH) COOH
8.(本题5分)有机物X和Y在一定条件下可制得环氧树脂粘合剂Z,其结构:X为,Y为,Z为,下列说法正确的是
A.X核磁共振氢谱有3个吸收峰
B.生成的同时生成
C.X、Y反应生成Z的过程既有取代反应,也有聚合反应
D.相同条件下,苯酚和Y反应生成结构与Z相似的高分子
9.(本题5分)在实验室中,下列除去杂质的方法不正确的是( )
A.溴苯中混有溴,将其加入NaOH稀溶液中反复洗涤、分液
B.乙烷中混有乙烯,在一定条件下通入氢气,使乙烯转化为乙烷
C.硝基苯中混有浓硝酸和浓硫酸,将其加入NaOH溶液中,静置、分液
D.乙醇中混有乙酸,加入氢氧化钠溶液,蒸馏
10.(本题5分)某有机物常用于生产聚酯纤维和树脂,是一种重要化工合成原料,使用现代仪器对该有机物的结构进行测定,相关谱图如下。下列有关说法错误的是
A.由质谱图可知该有机物相对分子质量为91
B.由核磁共振氢谱可知该有机物中有2种不同化学环境的氢原子
C.由红外光谱可获得该有机物化学键或官能团信息
D.综合以上信息可知该有机物为对二甲苯
二、判断题(共20分)
11.(本题4分)乙酸乙酯中混有乙酸,加入氢氧化钠溶液,再加热蒸馏。(______)
12.(本题4分)根据红外光谱可以确定有机物中化学键种类。(_____)
13.(本题4分)向混合液中加入生石灰后蒸馏,以除去乙酸中混有的乙醇。(_____)
14.(本题4分)用96%的工业酒精制取无水乙醇,可采用的方法是加生石灰,再蒸馏。(______)
15.(本题4分)有机物的1H-核磁共振谱图中有4组特征峰。(___________)
三、解答题(共30分)
16.(本题10分)依据有关信息解答下列化学实验问题:
(Ⅰ)醛类是重要的工业原料,可以跟亚硫酸氢钠饱和溶液反应,生成物是α﹣羟基磺酸钠(易溶于水,不溶于饱和亚硫酸氢钠溶液)R-CHO+NaHSO3R-CH(OH)-SO3Na
(1)上述反应类型为 反应。若使CH3 CH(OH)-SO3Na全部变成乙醛,可采用的试剂是 或 ;分离乙醛的操作方法 。
(Ⅱ)实验室利用苯甲醛(安息香醛)制备苯甲醇和苯甲酸的化学原理:
(此原理适用于无α-氢的醛)
已知部分物质的性质:
苯甲醇:熔点(℃):-15.3℃,稍溶于水,易溶于有机溶剂;
苯甲醛:熔点(℃):-26℃,微溶于水,易溶于有机溶剂;
苯甲酸:溶解度为0.344g(25℃),易溶于有机溶剂.主要过程如图所示:
回答下列问题:
(2)操作Ⅰ的名称是 ,乙醚溶液中所溶解的主要成分是 ;
(3)操作Ⅲ的名称是 ,产品乙是 .
(4)按上述操作所得的产品甲中常含有一定量的有机杂质 (填写杂质的名称);限用下列试剂:酸性KMnO4、稀NaOH溶液、稀H2SO4、饱和NaHSO3溶液.写出检验产品甲中含有该杂质的过程: .
17.(本题10分)通常将一定量的有机物充分燃烧转化为简单的无机物,然后根据产物的质量确定有机物的组成。如图所示是用燃烧法确定有机物分子式的常用装置。若准确称取0.69 g样品(只含C、H、O三种元素中的两种或三种),充分燃烧后,A管质量增加1.32 g,B管质量增加0.81 g。
请回答下列问题:
(1)使产生的O2按从左到右的方向流动,则所选装置中各导管的正确连接顺序是 (填字母)。
(2)装置C中浓硫酸的作用是 。
(3)燃烧管中CuO的作用是 。
(4)根据题中所给数据,推断该有机物的实验式为 。
(5)经测定其蒸气密度为2.054 g/L(已换算为标准状况),则其分子式为 。
(6)该物质的核磁共振氢谱如图所示,三种峰面积之比为1:2:3,则其结构简式为 。
18.(本题10分)硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂.实验室中制备硝基苯的过程如下:
①配制混酸:组装如图反应装置.取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混合酸,加入恒压滴液漏斗中.把18mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀.
③加热在50~60℃下发生反应,直至反说结束.
④除去混合酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后用蒸馏水洗涤得到粗产品.
⑤为了得到更纯净的硝基苯.还需先向液棒中加入试剂A,静置一段时间后弃去试剂A,然后蒸馏,最终得到17.5g硝基苯
已知:
+HNO3(浓)+H2O
+HNO3(浓) (6%)+ (93%)+ (1%)+H2O
可能用到的有关数据列表如下:
物质 熔点/℃ 沸点/℃ 密度(20℃)/(g cm-3) 溶解性
苯 5.5 80 0.88 微溶于水
硝基苯 5.7 210.9 1.205 难溶于水
1,3-二硝基苯 89 301 1.57 微溶于水
浓硝酸 83 1.4 易溶于水
浓硫酸 338 1.84 易溶于水
请回答下列问题:
(1)配制混酸应先在烧杯中加入 .
(2)恒压滴液漏斗的优点是 ,实验装置中长玻璃导管可用 代替(填仪器名称)
(3)要控制反应温度50~60℃,可用水浴加热,其优点为
(4)反应结束后产品在液体的 层(填"上"或"下"),分离混酸和产品的操作方法为
(5)用10% Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净
(6)试剂A是 ,蒸馏过程中需在蒸馏烧瓶中加入沸石,其作用为 若加热后,发现未加沸石,应采取的正确方法
(7)硝基苯的产率为 .
参考答案:
1.A
【详解】方法一:从化学方程式2NaOH+CO2===Na2CO3+H2O 和 NaOH+CO2===NaHCO3,生成 Na2CO3 和 NaHCO3的物质的量之比为1∶3可知,消耗NaOH的物质的量之比为2∶3,进一步可求得对应的NaOH分别为和,与NaOH反应的 CO2 分别为0.2mol和0.6mol,则1mol该烷烃中含碳原子为,根据 CnH2n+2 得H为10mol,则分子式为C4H10,该烷烃为丁烷,选A。
方法二:原子守恒法。设 Na2CO3 与NaHCO3物质的量分别为x、y,则有
2x+y=0.5L×2mol/L ①
x:y=1:3 ②
解得x=0.2mol,y=0.6mol。
n(C)=x+y=0.2mol+0.6mol=0.8mol(碳原子守恒)
烷烃分子中含碳原子为,分子式为C4H10,该烷烃为丁烷,选A。
2.C
【详解】A.化合物X含有的官能团为:碳溴键、醚键和碳碳三键,共3种,A错误;
B.如图所示:,化合物Y含有6种处于不同化学环境的氢原子,所以化合物Y的核磁共振氢谱中有6组峰,B错误;
C.Z中含有碳碳三键可以使酸性溶液褪色,C正确;
D.X中含有溴原子,Z中没有溴原子,可知除了Z还有其他物质生成,原子利用率小于100%,D错误;
答案为:C。
3.B
【详解】试题分析:在核磁共振氢谱图中CH3CH2CH3、CH3CH2CH2OH 、CH3OCH3均只有二种峰,CH3COCH2CH3有三种峰,选项B正确。
考点:核磁共振氢谱图 涉及考点是等效氢
4.A
【分析】由流程可知,甲苯被高锰酸钾氧化生成苯甲酸钾、二氧化锰,操作1为过滤,分离出苯甲酸钾溶液,且苯甲酸的溶解度不大,则操作2中加强酸生成苯甲酸,操作3为过滤,分离出苯甲酸固体,以此来解答。
【详解】A.苯甲酸微溶于水,易溶于酒精,为避免因重新溶解而损失,应用水洗涤好,故A错误;
B.由反应物、生成物可知,加入KMnO4反应后,Mn元素的化合价降低,生成二氧化锰,则紫色变浅或消失,有浑浊生成,故B正确;
C.由上述分析可知,操作1为过滤,操作2为酸化,操作3为过滤,故C正确;
D.冷凝回流可使反应物充分反应,目的是提高甲苯的转化率,故D正确;
故选:A。
5.D
【分析】图中信息显示,有机物分子中含有3种氢原子,且原子个数不等。
【详解】A. 分子中含有4种氢原子,1H核磁共振氢谱有4种吸收峰,A不符合题意;
B. 分子中含有2种氢原子,1H核磁共振氢谱有2种吸收峰,B不符合题意;
C.戊烯的结构简式为CH2=CHCH2CH2CH3,分子中含有5种氢原子,1H核磁共振氢谱有5种吸收峰,C不符合题意;
D.丙酸的结构简式为CH3CH2COOH,分子中含有3种氢原子,氢原子个数比为3:2:1,与图中信息相符,D符合题意;
故选D。
6.D
【详解】A. 结合结构式和球棍模型可以数出一共有10个碳原子(黑球),16个氢原子(白球),因此分子式为C10H16,A项错误;
B. 二乙苯(如邻二乙苯:)的分子式为C10H14,因此与扭曲烷不互为同分异构体,B项错误;
C.扭曲烷有三种氢原子,其一氯代物有3种,C项错误;
D. 由C项分析知,扭曲烷有3种氢原子,当氯原子取代挂星号的氢原子时,另一个氯原子的位置可以有6种氢原子,,当氯原子取代另外两种氢原子时,还可以得到二氯代物,故二氯代物多于6种。D项正确;
答案选D。
7.C
【分析】0.1mol某有机物的蒸气跟足量O2混合点燃,反应后生成13.2g即0.3molCO2和5.4g即0.3molH2O,根据质量守恒可知1个有机物分子中含有3个碳原子和6个氢原子,可能含有氧原子,根据该有机物能跟Na反应放出H2,又能跟新制Cu(OH)2反应生成红色沉淀,此有机物还能跟乙酸反应生成酯类化合物,说明有机物中一定含有羟基、醛基,可能含有羧基,生成的酯类化合物中一定含有酯基来解答。
【详解】A.CH3-CH(OCH3)-CHO中没有酯基,不符合题意,故A错误;
B.OHCCH2COOCH2CH3中含有酯基,但原有机物中没有羟基,不符合题意,故B错误;
C.中含有酯基,原有机物中1个分子中含有3个碳原子和6个氢原子,有机物中含有羟基、醛基,符合题意,故C正确;
D.CH3COOCH2CH2COCH3中没有醛基,不符合题意,故D错误;
故答案为C。
8.C
【详解】A.由结构简式可知,X分子中含有4类氢原子,核磁共振氢谱有4个吸收峰,故A错误;
B.由原子个数守恒可知,X与Y反应生成1molZ的同时生成(n+2)mol氯化氢,故B错误;
C.由结构简式可知,X与Y反应生成Z的过程为X与Y发生缩聚反应生成,与Y发生取代反应生成Z,则生成Z的过程中既有取代反应,也有聚合反应,故C正确;
D.苯酚分子中只含有1个羟基,和Y只能发生取代反应或环加成反应,不能发生缩聚反应,所以不能生成结构与Z相似的高分子,故D错误;
故选C。
9.B
【详解】A.溴与NaOH反应后,与溴苯分层,则在NaOH稀溶液中反复洗涤、分液可除杂,故A正确;
B.乙烯与氢气发生加成反应,但易引入新杂质氢气,不能除杂,应选溴水、洗气除杂,故B错误;
C.浓硝酸和浓硫酸与NaOH反应后,与硝基苯分层,则在NaOH溶液中,静置、分液可除杂,故C正确;
D.乙酸与NaOH能发生中和反应,乙醇易挥发,则乙醇中混有乙酸加入氢氧化钠溶液,蒸馏即可得到乙醇,故D正确;
故答案为B。
10.A
【详解】A.由质谱图可知该有机物相对分子质量为106,故A错误;
B.由核磁共振氢谱图,图中有2种不同化学环境的氢原子,则该有机物中有2种不同化学环境的氢原子,故B正确;
C.由红外光谱可获得该有机物化学键或官能团信息,该有机物中含有碳氢键、苯环、苯环连碳,故C正确;
D.根据红外光谱、核磁共振氢谱图,质谱图分析得到该有机物为对二甲苯,故D正确。
综上所述,答案为A。
11.错误
【详解】乙酸乙酯中混有乙酸,不能用氢氧化钠溶液除乙酸,因为乙酸乙酯也会与氢氧化钠溶液反应,应用饱和碳酸钠溶液,再分液即可,故错误。
12.错误
【详解】不同的化学键或官能团吸收频率不同,在红外光谱图上处于不同的位置,所以红外光谱图能确定有机物分子中的化学键或官能团,不能确定化学键的种类,故错误。
13.错误
【详解】乙酸会与氧化钙反应生成成乙酸钙,故错误。
14.正确
【详解】CaO与水反应后,增大与乙醇的沸点差异,然后蒸馏可分离,故正确;
15.正确
【详解】有机物的1H-核磁共振谱图中有4种H,正确。
16. 加成 NaOH HCl 蒸馏 萃取分液 苯甲醇 过滤 苯甲酸 苯甲醛 取少量产品甲于试管中,向试管中滴加适量的饱和NaHSO3溶液,如果有晶体析出,说明含有苯甲醛
【分析】Ⅱ、由流程可知,苯甲醛与KOH反应生成苯甲醇、苯甲酸钾,然后加水、乙醚萃取苯甲醇,操作Ⅰ分层,得到乙醚与水溶液,则为萃取分液,则乙醚溶液中含苯甲醇,操作II为蒸馏,得到产品甲为苯甲醇;水溶液中含苯甲酸钾,加盐酸发生强酸制取弱酸的反应,生成苯甲酸,苯甲酸的溶解度小,则操作Ⅲ为过滤,则产品乙为苯甲酸,以此来解答。
【详解】Ⅰ、(1)R-CHO+NaHSO3 R-CH(OH)-SO3Na反应类型为加成反应;因为可逆反应R﹣CHO+NaHSO3 R﹣CH(OH)﹣SO3Na,要想使CH3CH(OH)﹣SO3Na全部变成乙醛即使平衡向逆反应方向移动,可以采取加入氢氧化钠或者盐酸消耗亚硫酸氢钠使平衡逆向移动,所以可以加入的为NaOH或者HCl;分离互溶的有机物利用沸点不同,采用蒸馏的方法,所以分离乙醛的操作方法为蒸馏;
故答案为:加成;NaOH或HCl;蒸馏;
Ⅱ、(2)根据以上分析,操作Ⅰ分层乙醚与水溶液,则为萃取分液,故答案为萃取分液;苯甲醇;
(3)根据以上分析,操作Ⅲ为过滤,产品乙是苯甲酸,故答案为过滤;苯甲酸;
(4)根据苯甲醛与KOH反应生成苯甲醇、苯甲酸钾,所得混合物中可能还有未反应的苯甲醛,然后加水、乙醚萃取苯甲醇和未反应的苯甲醛,则乙醚溶液中含苯甲醇和未反应的苯甲醛,所以操作II为蒸馏,得到产品甲为苯甲醇和未反应的苯甲醛,根据醛类是重要的工业原料,可以跟亚硫酸氢钠饱和溶液发生加成反应,生成是α﹣羟基磺酸钠(易溶于水,不溶于饱和亚硫酸氢钠溶液),所以可以通过取少量产品甲于试管中,向试管中滴加适量的饱和NaHSO3溶液,如果有晶体析出,说明含有苯甲醛;
故答案为苯甲醛;取少量产品甲于试管中,向试管中滴加适量的饱和NaHSO3溶液,如果有晶体析出,说明含有苯甲醛。
17. g→f→e→h→i→c(或d)→d(或c)→a(或b)→b(或a) 干燥O2 确保有机物中的碳元素全部转化为CO2 C2H6O C2H6O CH3CH2OH
【分析】通过计算确定有机物的分子式,由有机物的结构特点和题给信息确定有机物的结构简式。根据反应原理可知,该实验要成功必须满足:1、快速制备氧气供燃烧使用;2、氧气要纯净;3、保证碳元素完全转化为CO2,氢元素完全转化为H2O,且CO2和H2O在后面装置中被完全吸收。
【详解】(1)使产生的O2按从左到右的方向流动,需先制备氧气,然后将气体通过浓硫酸干燥氧气,获得纯净的氧气,其导管连接为g→f→e(注意对于C,连接导管需长进短出),接着纯净的氧气与有机物反应,因而e→h→i,氧气与有机物反应生成CO2和H2O,先利用B中CaCl2吸收水蒸气,然后利用A中NaOH吸收CO2,若A和B颠倒,NaOH会同时吸收H2O和CO2,这样无法测定CO2和H2O各自的质量,因而正确的连接顺序为g→f→e→h→i→c(或d)→d(或c)→a(或b)→b(或a);
(2)C中浓硫酸的作用是吸收来自D产生的氧气中的水蒸气,以便获得纯净的氧气,便于后续定量实验;
(3)有机物若不完全燃烧会生成CO,CO和CuO反应会得到CO2,这样可以保证有机物中的碳元素全部转化为CO2;
(4)A管质量增加1.32 g,说明CO2的质量为1.32g,可算出C的质量为0.36g,B管质量增加0.81 g,说明H2O的质量为0.81g,可算出H的质量为0.09g,根据准确称取的0.69 g样品,可计算O的质量为0.69g-0.36g-0.09g=0.24g,则C、H、O原子个数比为=2:6:1,因而该有机物的实验式为C2H6O;
(5)M=Vm×ρ=22.4L·mol-1×2.054g·L-1≈46g·mol-1,则该有机物的相对分子质量与实验式C2H6O的式量相等,故样品的分子式为C2H6O;
(6)由核磁共振氢谱图可知该有机物分子中有三种类型的氢原子,故该有机物的结构简式不是CH3-O-CH3,而是CH3CH2OH。
【点睛】确定有机物分子式的一般方法:(1)直接法(适用已知分子量或者相关条件情况)一般做法:密度(相对密度)→摩尔质量→1摩尔分子中各元素原子的物质的量→分子式;(2)最简式法①确定最简式(实验式):根据有机物各元素的质量分数求出分子组成中各元素的原子个数比,②求出有机物的摩尔质量(相对分子质量)→分子式=(最简式)×n ,其相对分子质量为Mr,解出n得出分子式。
18. 浓硝酸 可以保持漏斗内压强与发生器内压强相等,使漏斗内液体顺利流下冷凝管 球形冷凝管或直形冷凝管均可 受热均匀,温度容易控制 上 分液 取最后一次洗涤液,加入氯化钙溶液,无沉淀生成,说明已洗净 氯化钙 防止暴沸 停止加热,冷却后补加 70%
【详解】(1)由于浓硫酸的密度比浓硝酸的大,当浓硫酸遇水时放出大量的热,所以配置混酸应将浓硫酸加入到浓硝酸中,也就是先在烧杯中先加入浓硝酸,故答案为浓硝酸。
(2)由于在反应的过程中不断加热,会产生大量的气体,这对于液体的加入很不利。若采用恒压滴液漏斗滴加,可以保持漏斗内压强与发生器内压强相等,使漏斗内液体能顺利流下;在实验的过程中苯、硝酸会因为加热而气化,导致物质的浪费与环境污染,所以在装置中长玻璃管可以起到冷凝、降温使物质回流的作用。因此可用冷凝管等冷凝装置代替;故答案为可以保持漏斗内压强与发生器内压强相等,使漏斗内液体顺利流下冷凝管;球形冷凝管或直形冷凝管均可。
(3)水浴加热可使反应受热均匀,温度容易控制,故答案为受热均匀,温度容易控制。
(4)反应结束后产生的硝基苯、1,3-二硝基苯都不溶解于水的液体,密度比酸的混合溶液小,所以反应结束后产品在液体的上层,分离互不相溶的两层液体的方法是分液,故答案为上,分液。
(5)对于得到的粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤。如果洗涤干净,则洗涤液中不含有CO32-。所以检验液体已洗净的方法是取最后一次洗涤液,向溶液中加入氯化钙,若无沉淀生成,说明已洗净;故答案为取最后一次洗涤液,加入氯化钙溶液,无沉淀生成,说明已洗净。
(6)为了得到更纯净的硝基苯,使之不含有水,可以先向液体中加入有吸水干燥作用的无水CaCl2,除去水,然后蒸馏就得到了产品;蒸馏实验中,沸石起到防止暴沸的作用,若实验开始后发现未加入沸石,需停止加热,冷却后补加,故答案为停止加热,冷却后补加。
(7)因为苯的密度为0.88g/cm3,18mL苯的质量为18mL×0.88g/cm3=15.84g,根据反应+HNO3(浓) +H2O ,可以知道硝基苯的质量为g≈25g,故硝基苯的产率为×100%=70%,故答案为70%。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
