2024年中考化学二轮复习 专题五 工艺流程题课件(共44张PPT)
文档属性
| 名称 | 2024年中考化学二轮复习 专题五 工艺流程题课件(共44张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-13 22:15:40 | ||
图片预览









文档简介
(共44张PPT)
专题五 工艺流程题
一、题目特点
工艺流程题往往与化工生产、生活实际相联系,考查内容为化学反应原理,元素及化合物,物质的分离与提纯,实验操作及名称、目的,流程中的物质转化与循环,工艺的实用价值评价等知识相联系。
此类试题的题干一般分成三部分:题头简单介绍该工艺生产的原料和生产目的;图示是以工艺流程图的形式将原料到产品或工艺过程展示出
来;主要根据流程中涉及的化学知识设置系列问题要求解析。
此类试题呈现高起点、低落点的特点,难度不是很大,但由于学生的表述能力、特别是化学用语的表述存在很大偏差,导致得分率较低。
二、解题方法
Ⅰ.工艺流程路线示意图分析
1.关注“箭头”:箭头入是投料(即反应物);箭头出是生成物(含主产物和副产物);箭头回为循环利用物质。
2.关注方框内所指:包括反应设备;提纯、除杂、分离操作方法;中间产物;产品(包括副产品)等。
3.关注操作:一般为蒸发、过滤、冷却结晶、洗涤、干燥等。
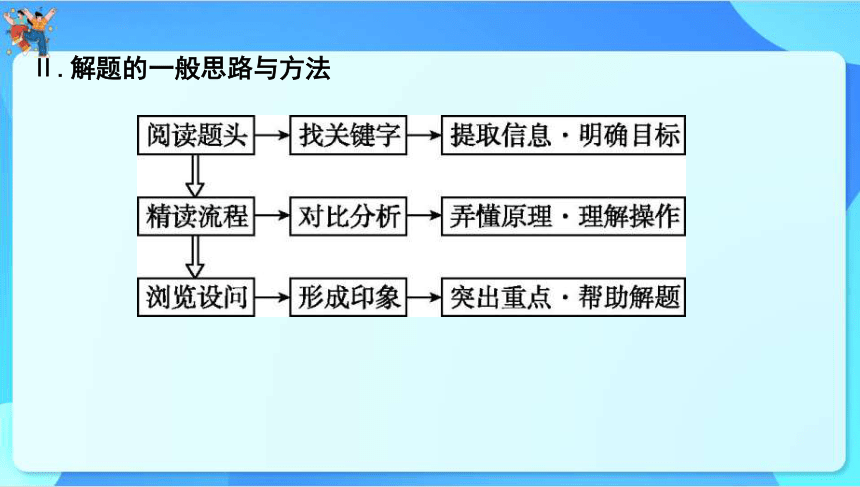
Ⅱ.解题的一般思路与方法
Ⅲ.涉及的考查点及解析模板
1.对原料预处理
(1)粉碎(研磨、喷淋):增大反应物的接触面积,加快反应速率或使反应更充分。
(2)打磨:除去氧化膜(或污物)。
(3)溶解(水溶、酸溶):通过溶于水或酸,使其与不溶性物质经过过滤
分离。
(4)灼烧(煅烧):除去可燃性杂质或使物质高温氧化。
灼烧完全的判断依据:质量不再变化。
(5)加洗涤剂:除油污。
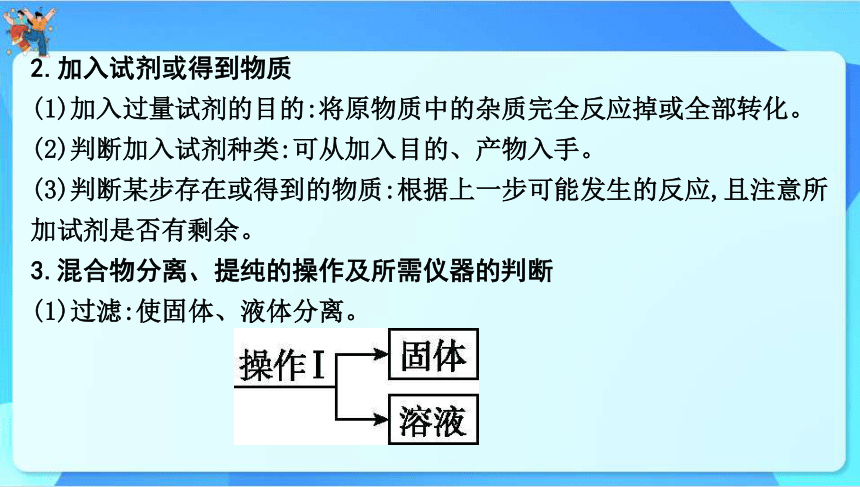
2.加入试剂或得到物质
(1)加入过量试剂的目的:将原物质中的杂质完全反应掉或全部转化。
(2)判断加入试剂种类:可从加入目的、产物入手。
(3)判断某步存在或得到的物质:根据上一步可能发生的反应,且注意所加试剂是否有剩余。
3.混合物分离、提纯的操作及所需仪器的判断
(1)过滤:使固体、液体分离。
①操作的判断:如图中操作Ⅰ。
②过滤操作中使用的玻璃仪器有烧杯、玻璃棒、漏斗 ,其中玻璃棒的作用是引流。
(2)蒸发结晶:提纯溶解度受温度影响变化不大的物质,如NaCl等。
①操作的判断:如图中操作Ⅱ。
②蒸发结晶操作中使用的仪器有酒精灯、玻璃棒、蒸发皿、铁架台(铁圈),其中玻璃棒的作用是搅拌,使液体均匀受热,防止因局部温度过高造成液滴飞溅 。
(3)冷却结晶:提纯溶解度随温度升高明显增大的物质。
操作过程:蒸发浓缩→冷却结晶→过滤→洗涤→干燥。
(4)洗涤:滤渣用水洗;晶体产品用饱和溶液洗涤等。
判断滤渣是否洗涤干净的方法:取少量最后一次洗涤液,检验洗涤液中是否含有溶液中的溶质。
4.控制反应条件
(1)搅拌或加热:加快反应(或溶解)速率。
(2)溶液趁热过滤(控温处理):防止目标物质损失。
(3)调节溶液pH的目的:使目标阳离子沉淀。
(4)通入保护气(如氩气)的作用: 防止物质被氧化。
5.对流程评价改进
可从科学性、安全性、节约性、简便性、对环境的影响等方面分析。
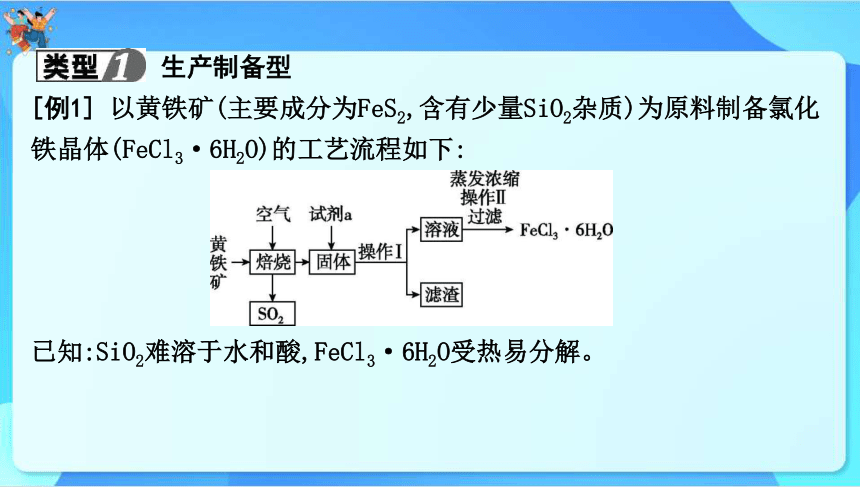
生产制备型
[例1] 以黄铁矿(主要成分为FeS2,含有少量SiO2杂质)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
已知:SiO2难溶于水和酸,FeCl3·6H2O受热易分解。
4
11
2
8
(2)试剂a的名称是 。
(3)操作Ⅱ为 (填“蒸发结晶”或“冷却结晶”)。
稀盐酸
冷却结晶
(4)焙烧产生的SO2可用于工业制备硫酸,制备过程中产生的废气中含有SO2,废水中含有硫酸。以下想法不妥的是 (填字母)。
A.废气可以回收再利用
B.废气可以点燃后排放
C.废水用熟石灰中和后排放
D.改进工艺,减少废气、废水的排放
B
回收利用型
[例2](2023黄冈)兴趣小组的同学利用某废镍材料(含有金属Ni及少量Fe、Cu)回收镍,设计流程如图所示(部分产物略去)。
请根据上述流程回答下列问题:
(1)过滤时,玻璃棒的作用是 。
引流
(2)写出“酸浸”时发生反应的化学方程式 .
(任写一个)。
(3)过氧化氢具有氧化性,“氧化”时发生反应的化学方程式为2FeSO4+
H2SO4+H2O2 Fe2(SO4)3+2X,则X的化学式是 。
(4)Ni、Fe、Cu的金属活动性由强到弱的顺序为 。
H2O
Fe>Ni>Cu
(5)已知Fe3+和Ni2+开始沉淀和完全沉淀时的pH如表。“除铁”过程中加入NaOH溶液的目的是通过调节溶液的pH使Fe3+完全沉淀而Ni2+不沉
淀,则pH的范围是 (填字母)。
A.2.7≤pH<3.2 B.3.2≤pH<7.2
C.7.2B
离子 开始沉淀时的pH 完全沉淀时的pH
Fe3+ 2.7 3.2
Ni2+ 7.2 8.7
分离提纯型
[例3](2023广州)制盐在我国有着悠久的历史。某盐湖水样品含有NaCl、Na2SO4及少量MgSO4和CaSO4,某小组从中获取NaCl和Na2SO4的主
要过程如下:
(1)“除杂1”应依次加入的两种试剂是 ,“除杂2”应加入的试剂是 。[除杂限选试剂:HCl、HNO3、Na2CO3、Ca(OH)2]
(2)将“溶液A”在80 ℃蒸发浓缩,至有少量固体析出。
①该小组分析溶解度曲线,推测析出的少量固体是NaCl,但检验后却发现是Na2SO4。请作出合理解释: .
。
Ca(OH)2、Na2CO3
HCl
溶液中Na2SO4含量比NaCl高,蒸发浓缩时Na2SO4先达到饱和状态而析出
②该小组停止蒸发浓缩,经 、过滤得到大量Na2SO4固体及母液;将母液中的NaCl分离出来,操作是 .
。
(3)设计由硫黄(单质硫)生产Na2SO4的转化路径,依次写出反应的化学方程式: .
。(提示:常见+4价硫的化合物可与O2化合为+6价硫的化合物)
冷却结晶
加热蒸发溶剂至有较多晶体析出,趁热过滤,洗涤、干燥
其他类型
[例4] (2023乐山)保护环境,实现“绿水青山”目标,要对工厂尾气进行无害化处理。某氮肥厂和炼铁厂联合处理尾气的工艺流程如图所示。
回答下列问题:
(1)饱和食盐水是 (填“纯净物”或“混合物”)。
(2)流程中“操作Ⅰ”的名称为 。
(3)根据信息写出加热NaHCO3固体发生反应的化学方程式:
。
(4)流程中,可循环使用的物质是水、 。
混合物
过滤
二氧化碳
1.(2022呼和浩特)2022年4月16日,3名航天员在中国人自己的空间站圆满完成各项任务后返回地球。为了保障航天员在空间站的生命和健康,科学家们精心研制出最新的环境控制和生命保障系统,部分循环过程如图。下列说法不正确的是( )
D
2.二氧化氯(ClO2)是一种高效、广谱、安全的杀菌消毒剂。以粗盐水
(含可溶性杂质MgSO4、CaCl2)为原料,制取ClO2的工艺流程如图:
(1)试剂A为 。
(2)加入过量Na2CO3溶液的作用是 。
(3)步骤④中发生反应的化学方程式为 。(4)步骤⑤涉及的物质中含氯元素化合价最高的物
质是 。
(5)如图流程中可循环利用的物质有 。
Ba(OH)2溶液
除去CaCl2和过量的Ba(OH)2
NaClO3
Cl2和NaCl
3.(2023通辽霍林郭勒模拟)某金属冶炼厂的管道烟泥中含有少量铜、锌、硫等单质。现欲回收铜和锌,并对硫进行环保处理,主要步骤如图所示:
已知:加热的条件下,Zn、Cu都可以与氧气反应生成相应的金属氧化物。
(1)步骤①产生的废气B中,一定含有有害气体,环保处理该气体最好采用的试剂是 (填字母)。
A.浓硫酸 B.食盐水 C.石灰乳
C
(2)写出步骤④中得到铜的化学方程式: 。
(3)步骤③和④中主要操作的名称是 。
(4)取少量的溶液C,往其中加入一定质量的镁粉,充分反应后过滤,得到滤渣和滤液。往滤渣中加入稀盐酸有气泡产生,则滤液中一定没有
(填字母)。
A.硫酸镁 B.硫酸锌
C.硫酸铜 D.硫酸镁和硫酸锌
过滤
C
4.(2023济宁)某一工厂的金属废料中含有铜、铁、金等金属单质,为回收铜和金并得到氧化铁。工作人员设计了如图所示的工艺流程。
请回答:
(1)滤液A的溶质为 (写化学式)。
(2)固体A与空气加热发生化学反应,写出反应后的生成物与适量稀硫酸反应的化学方程式 。
(3)操作1和操作2为同一操作,两操作中用到的玻璃仪器有玻璃棒、烧杯和 。
(4)往滤液B中加入的物质X是 。
FeSO4
漏斗
铁(或Fe)
5.(2023广西)我国科学家利用太阳光在某种新型催化剂表面高效分解水后,再利用某种高效催化剂将二氧化碳转化成有机物X。反应过程如图所示,回答下列问题:
(1)反应①、②使用的催化剂在反应前后的 和化学性质都没有发生变化。
(2)反应①的能量转化形式中存在光能转化为 能 ,产生的H2、O2的体积比约为 。
质量
化学
2∶1
C2H4
澄清石灰水
(4)反应②生成的水全部循环利用,为使该过程持续发生,反应①需要不断补充水,其原因是 。
反应①消耗的水比反应②生成的水多
6.(2023通辽)下图是用粗硅原料(含氧化镁杂质,不考虑其他杂质与酸反应)制备高纯硅和金属镁的流程。
已知:硅不与稀盐酸反应。
请回答下列问题。
(1)操作1的名称是 。
(2)上述流程中,可循环利用的物质是 。
(3)滤液中含有的阳离子为 。
(4)MgCl2制备Mg的化学方程式为 。
过滤
HCl、Cl2
Mg2+、H+
7.(2022枣庄)回收含铜废料(主要成分为Cu)中的铜,部分实验流程
如下:
注:灼烧后得到黑色固体和残留物,残留物不溶于水和稀硫酸。
回答下列问题:
(1)“灼烧”的主要目的是 。
(2)“酸溶”发生反应的化学方程式为 ,反应类型为 。
(3)“转化”生成气体X的成分为 。
将Cu转化为CuO
复分解反应
氢气(或H2)
8.(2022济宁)某工业废液中主要含有CuCl2、NaCl,为防止废液直接排放对环境造成危害,课外探究小组经采样分析,尝试利用这种工业废液回收金属铜。实验设计流程见如图:
(1)步骤①选用的试剂是 ,采用的操作为 。
(2)步骤②发生反应的化学方程式为 。
(3)步骤③发生的反应属于 (填基本反应类型)。
NaOH溶液
过滤
置换反应
9.(2023呼和浩特)为了实现碳减排目标,许多国家都在研究二氧化碳的减排措施,其中“碳捕捉和封存”技术是实现这一目标的重要途径之一。工业流程如图所示:
请回答以下有关问题:
(1)“捕捉室”中氢氧化钠溶液常喷成雾状,主要目的是 .
。
(2)“反应分离器”中涉及的化合反应的化学方程式为 .
。
增大与CO2气体的接触面积,使反应更充分
(3)“封存室”内二氧化碳由气态变为液态,从微观角度解释变化的原因是 。
(4)整个过程中,可以循环利用的物质除水外,还有 .
(填化学式)。
二氧化碳分子间的间隔变小
NaOH、CaCO3、CaO
10.(2023 随州)CO2捕获和转化可减少CO2排放并实现资源利用。一种捕集烟气中CO2并转化利用的流程如图:
(1)CaO俗称 。
(2)催化转化器中发生反应的化学方程式是 。
(3)甲醇(CH3OH)属于 (填“无机物”或“有机物”)。
生石灰
有机物
(4)我国力争在2060年前实现“碳中和”。下列措施不利于大气中CO2减少的是 (只有一个选项符合题意)。
A.用氨水捕集废气中的CO2,将其转化为氮肥
B.大力推广使用干冰实现人工增雨,缓解旱情
C.利用和开发风能、太阳能、氢能等清洁能源
D.通过植树造林,利用光合作用吸收大气中的CO2
B
11.(2023深圳)某同学以金泥(含有Au、CuS、ZnS等)为原料制备(Au)和Cu的流程如图所示:
琴琴同学查阅资料已知:
①预处理的主要目的是将含硫化合物转化为氧化物。
②热空气流充分加热的目的是将Cu、Zn转化为氧化物,并完全分离出ZnO烟尘。
(1)“预处理”中会产生SO2,若SO2直接排放会导致 。
(2)“过程Ⅱ”产生的固体a中,除CuO外一定还有的物质是 。
(3)“过程Ⅲ”分离Au的操作是 ,加入过量稀硫酸的目的是 。
(4)“系列过程”中有一步是向滤液中加入过量铁粉,这一步生成气体的化学方程式为 ,该反应属于 反应(填基本反应类型)。
(5)ZnO烟尘可用NaOH溶液吸收,该反应生成偏锌酸钠(Na2ZnO2)和H2O的化学方程式为 。
酸雨
金(或Au)
过滤
将氧化铜完全转化为硫酸铜,提高铜的产率
置换
12.(2022通辽)我国化学家侯德榜所创立的侯氏联合制碱法,既提高了原料利用率,又“变废为宝”,降低了生产成本,促进了世界制碱技术的发展。侯氏联合制碱法的部分工艺流程如下:
(1)粗盐水中主要含有Na2SO4、MgCl2、CaCl2三种可溶性杂质,工业上常用加入稍过量的 溶液、NaOH溶液、Na2CO3溶液及适量的盐酸等除杂、精制。
(2)Ⅱ中发生反应的化学方程式为 。(3)氯化铵属于化肥中的 ,不采用蒸发结晶的方法得到氯化铵晶体的原因是 。
(4)该流程中可循环利用的物质是水、 。
BaCl2
氮肥
氯化铵受热易分解
CO2
13.(2022大庆)中国航天工业飞速发展,金属钛常被用于航空航天工业。下图是以钛铁矿为主要原料冶炼金属钛的生产工艺流程:
已知:钛铁矿主要成分为钛酸亚铁(FeTiO3),请回答下列问题。
(1)FeTiO3中钛元素的化合价为 。
+4
增大钛铁矿与浓硫酸的接触面积,加快溶浸速率
(3)溶液Ⅱ的主要溶质为TiOSO4,加热时和水发生反应。经过滤得到
H2TiO3。写出化学方程式: 。
CO
作保护气,防止镁、钛在高温下被空气中的氧气氧化
Na的金属活动性比镁强
14.(2022武汉)某化工厂以废金属(主要成分为Fe和Cu,表面有少量油污)为原料回收海绵铜,并制备氯化铁的工艺流程如图所示。
回答问题:
(1)废金属属于 (填“纯净物”或“混合物”)。
(2)“洗涤”的目的是去除废金属表面的油污,试剂X最好选用 (填字母)。
A.水 B.氢氧化钠溶液
C.稀硫酸 D.氯化钠溶液
(3)“酸浸”中发生反应的化学方程式为 。
(4)“滤液甲”中一定含有的溶质是 。
(5)向“滤渣乙”中加入适量盐酸,可以观察到的现象是 .
。
混合物
B
NaNO2、NaCl
红褐色固体逐渐溶解,得到黄色溶液
谢谢观赏!
专题五 工艺流程题
一、题目特点
工艺流程题往往与化工生产、生活实际相联系,考查内容为化学反应原理,元素及化合物,物质的分离与提纯,实验操作及名称、目的,流程中的物质转化与循环,工艺的实用价值评价等知识相联系。
此类试题的题干一般分成三部分:题头简单介绍该工艺生产的原料和生产目的;图示是以工艺流程图的形式将原料到产品或工艺过程展示出
来;主要根据流程中涉及的化学知识设置系列问题要求解析。
此类试题呈现高起点、低落点的特点,难度不是很大,但由于学生的表述能力、特别是化学用语的表述存在很大偏差,导致得分率较低。
二、解题方法
Ⅰ.工艺流程路线示意图分析
1.关注“箭头”:箭头入是投料(即反应物);箭头出是生成物(含主产物和副产物);箭头回为循环利用物质。
2.关注方框内所指:包括反应设备;提纯、除杂、分离操作方法;中间产物;产品(包括副产品)等。
3.关注操作:一般为蒸发、过滤、冷却结晶、洗涤、干燥等。
Ⅱ.解题的一般思路与方法
Ⅲ.涉及的考查点及解析模板
1.对原料预处理
(1)粉碎(研磨、喷淋):增大反应物的接触面积,加快反应速率或使反应更充分。
(2)打磨:除去氧化膜(或污物)。
(3)溶解(水溶、酸溶):通过溶于水或酸,使其与不溶性物质经过过滤
分离。
(4)灼烧(煅烧):除去可燃性杂质或使物质高温氧化。
灼烧完全的判断依据:质量不再变化。
(5)加洗涤剂:除油污。
2.加入试剂或得到物质
(1)加入过量试剂的目的:将原物质中的杂质完全反应掉或全部转化。
(2)判断加入试剂种类:可从加入目的、产物入手。
(3)判断某步存在或得到的物质:根据上一步可能发生的反应,且注意所加试剂是否有剩余。
3.混合物分离、提纯的操作及所需仪器的判断
(1)过滤:使固体、液体分离。
①操作的判断:如图中操作Ⅰ。
②过滤操作中使用的玻璃仪器有烧杯、玻璃棒、漏斗 ,其中玻璃棒的作用是引流。
(2)蒸发结晶:提纯溶解度受温度影响变化不大的物质,如NaCl等。
①操作的判断:如图中操作Ⅱ。
②蒸发结晶操作中使用的仪器有酒精灯、玻璃棒、蒸发皿、铁架台(铁圈),其中玻璃棒的作用是搅拌,使液体均匀受热,防止因局部温度过高造成液滴飞溅 。
(3)冷却结晶:提纯溶解度随温度升高明显增大的物质。
操作过程:蒸发浓缩→冷却结晶→过滤→洗涤→干燥。
(4)洗涤:滤渣用水洗;晶体产品用饱和溶液洗涤等。
判断滤渣是否洗涤干净的方法:取少量最后一次洗涤液,检验洗涤液中是否含有溶液中的溶质。
4.控制反应条件
(1)搅拌或加热:加快反应(或溶解)速率。
(2)溶液趁热过滤(控温处理):防止目标物质损失。
(3)调节溶液pH的目的:使目标阳离子沉淀。
(4)通入保护气(如氩气)的作用: 防止物质被氧化。
5.对流程评价改进
可从科学性、安全性、节约性、简便性、对环境的影响等方面分析。
生产制备型
[例1] 以黄铁矿(主要成分为FeS2,含有少量SiO2杂质)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
已知:SiO2难溶于水和酸,FeCl3·6H2O受热易分解。
4
11
2
8
(2)试剂a的名称是 。
(3)操作Ⅱ为 (填“蒸发结晶”或“冷却结晶”)。
稀盐酸
冷却结晶
(4)焙烧产生的SO2可用于工业制备硫酸,制备过程中产生的废气中含有SO2,废水中含有硫酸。以下想法不妥的是 (填字母)。
A.废气可以回收再利用
B.废气可以点燃后排放
C.废水用熟石灰中和后排放
D.改进工艺,减少废气、废水的排放
B
回收利用型
[例2](2023黄冈)兴趣小组的同学利用某废镍材料(含有金属Ni及少量Fe、Cu)回收镍,设计流程如图所示(部分产物略去)。
请根据上述流程回答下列问题:
(1)过滤时,玻璃棒的作用是 。
引流
(2)写出“酸浸”时发生反应的化学方程式 .
(任写一个)。
(3)过氧化氢具有氧化性,“氧化”时发生反应的化学方程式为2FeSO4+
H2SO4+H2O2 Fe2(SO4)3+2X,则X的化学式是 。
(4)Ni、Fe、Cu的金属活动性由强到弱的顺序为 。
H2O
Fe>Ni>Cu
(5)已知Fe3+和Ni2+开始沉淀和完全沉淀时的pH如表。“除铁”过程中加入NaOH溶液的目的是通过调节溶液的pH使Fe3+完全沉淀而Ni2+不沉
淀,则pH的范围是 (填字母)。
A.2.7≤pH<3.2 B.3.2≤pH<7.2
C.7.2
离子 开始沉淀时的pH 完全沉淀时的pH
Fe3+ 2.7 3.2
Ni2+ 7.2 8.7
分离提纯型
[例3](2023广州)制盐在我国有着悠久的历史。某盐湖水样品含有NaCl、Na2SO4及少量MgSO4和CaSO4,某小组从中获取NaCl和Na2SO4的主
要过程如下:
(1)“除杂1”应依次加入的两种试剂是 ,“除杂2”应加入的试剂是 。[除杂限选试剂:HCl、HNO3、Na2CO3、Ca(OH)2]
(2)将“溶液A”在80 ℃蒸发浓缩,至有少量固体析出。
①该小组分析溶解度曲线,推测析出的少量固体是NaCl,但检验后却发现是Na2SO4。请作出合理解释: .
。
Ca(OH)2、Na2CO3
HCl
溶液中Na2SO4含量比NaCl高,蒸发浓缩时Na2SO4先达到饱和状态而析出
②该小组停止蒸发浓缩,经 、过滤得到大量Na2SO4固体及母液;将母液中的NaCl分离出来,操作是 .
。
(3)设计由硫黄(单质硫)生产Na2SO4的转化路径,依次写出反应的化学方程式: .
。(提示:常见+4价硫的化合物可与O2化合为+6价硫的化合物)
冷却结晶
加热蒸发溶剂至有较多晶体析出,趁热过滤,洗涤、干燥
其他类型
[例4] (2023乐山)保护环境,实现“绿水青山”目标,要对工厂尾气进行无害化处理。某氮肥厂和炼铁厂联合处理尾气的工艺流程如图所示。
回答下列问题:
(1)饱和食盐水是 (填“纯净物”或“混合物”)。
(2)流程中“操作Ⅰ”的名称为 。
(3)根据信息写出加热NaHCO3固体发生反应的化学方程式:
。
(4)流程中,可循环使用的物质是水、 。
混合物
过滤
二氧化碳
1.(2022呼和浩特)2022年4月16日,3名航天员在中国人自己的空间站圆满完成各项任务后返回地球。为了保障航天员在空间站的生命和健康,科学家们精心研制出最新的环境控制和生命保障系统,部分循环过程如图。下列说法不正确的是( )
D
2.二氧化氯(ClO2)是一种高效、广谱、安全的杀菌消毒剂。以粗盐水
(含可溶性杂质MgSO4、CaCl2)为原料,制取ClO2的工艺流程如图:
(1)试剂A为 。
(2)加入过量Na2CO3溶液的作用是 。
(3)步骤④中发生反应的化学方程式为 。(4)步骤⑤涉及的物质中含氯元素化合价最高的物
质是 。
(5)如图流程中可循环利用的物质有 。
Ba(OH)2溶液
除去CaCl2和过量的Ba(OH)2
NaClO3
Cl2和NaCl
3.(2023通辽霍林郭勒模拟)某金属冶炼厂的管道烟泥中含有少量铜、锌、硫等单质。现欲回收铜和锌,并对硫进行环保处理,主要步骤如图所示:
已知:加热的条件下,Zn、Cu都可以与氧气反应生成相应的金属氧化物。
(1)步骤①产生的废气B中,一定含有有害气体,环保处理该气体最好采用的试剂是 (填字母)。
A.浓硫酸 B.食盐水 C.石灰乳
C
(2)写出步骤④中得到铜的化学方程式: 。
(3)步骤③和④中主要操作的名称是 。
(4)取少量的溶液C,往其中加入一定质量的镁粉,充分反应后过滤,得到滤渣和滤液。往滤渣中加入稀盐酸有气泡产生,则滤液中一定没有
(填字母)。
A.硫酸镁 B.硫酸锌
C.硫酸铜 D.硫酸镁和硫酸锌
过滤
C
4.(2023济宁)某一工厂的金属废料中含有铜、铁、金等金属单质,为回收铜和金并得到氧化铁。工作人员设计了如图所示的工艺流程。
请回答:
(1)滤液A的溶质为 (写化学式)。
(2)固体A与空气加热发生化学反应,写出反应后的生成物与适量稀硫酸反应的化学方程式 。
(3)操作1和操作2为同一操作,两操作中用到的玻璃仪器有玻璃棒、烧杯和 。
(4)往滤液B中加入的物质X是 。
FeSO4
漏斗
铁(或Fe)
5.(2023广西)我国科学家利用太阳光在某种新型催化剂表面高效分解水后,再利用某种高效催化剂将二氧化碳转化成有机物X。反应过程如图所示,回答下列问题:
(1)反应①、②使用的催化剂在反应前后的 和化学性质都没有发生变化。
(2)反应①的能量转化形式中存在光能转化为 能 ,产生的H2、O2的体积比约为 。
质量
化学
2∶1
C2H4
澄清石灰水
(4)反应②生成的水全部循环利用,为使该过程持续发生,反应①需要不断补充水,其原因是 。
反应①消耗的水比反应②生成的水多
6.(2023通辽)下图是用粗硅原料(含氧化镁杂质,不考虑其他杂质与酸反应)制备高纯硅和金属镁的流程。
已知:硅不与稀盐酸反应。
请回答下列问题。
(1)操作1的名称是 。
(2)上述流程中,可循环利用的物质是 。
(3)滤液中含有的阳离子为 。
(4)MgCl2制备Mg的化学方程式为 。
过滤
HCl、Cl2
Mg2+、H+
7.(2022枣庄)回收含铜废料(主要成分为Cu)中的铜,部分实验流程
如下:
注:灼烧后得到黑色固体和残留物,残留物不溶于水和稀硫酸。
回答下列问题:
(1)“灼烧”的主要目的是 。
(2)“酸溶”发生反应的化学方程式为 ,反应类型为 。
(3)“转化”生成气体X的成分为 。
将Cu转化为CuO
复分解反应
氢气(或H2)
8.(2022济宁)某工业废液中主要含有CuCl2、NaCl,为防止废液直接排放对环境造成危害,课外探究小组经采样分析,尝试利用这种工业废液回收金属铜。实验设计流程见如图:
(1)步骤①选用的试剂是 ,采用的操作为 。
(2)步骤②发生反应的化学方程式为 。
(3)步骤③发生的反应属于 (填基本反应类型)。
NaOH溶液
过滤
置换反应
9.(2023呼和浩特)为了实现碳减排目标,许多国家都在研究二氧化碳的减排措施,其中“碳捕捉和封存”技术是实现这一目标的重要途径之一。工业流程如图所示:
请回答以下有关问题:
(1)“捕捉室”中氢氧化钠溶液常喷成雾状,主要目的是 .
。
(2)“反应分离器”中涉及的化合反应的化学方程式为 .
。
增大与CO2气体的接触面积,使反应更充分
(3)“封存室”内二氧化碳由气态变为液态,从微观角度解释变化的原因是 。
(4)整个过程中,可以循环利用的物质除水外,还有 .
(填化学式)。
二氧化碳分子间的间隔变小
NaOH、CaCO3、CaO
10.(2023 随州)CO2捕获和转化可减少CO2排放并实现资源利用。一种捕集烟气中CO2并转化利用的流程如图:
(1)CaO俗称 。
(2)催化转化器中发生反应的化学方程式是 。
(3)甲醇(CH3OH)属于 (填“无机物”或“有机物”)。
生石灰
有机物
(4)我国力争在2060年前实现“碳中和”。下列措施不利于大气中CO2减少的是 (只有一个选项符合题意)。
A.用氨水捕集废气中的CO2,将其转化为氮肥
B.大力推广使用干冰实现人工增雨,缓解旱情
C.利用和开发风能、太阳能、氢能等清洁能源
D.通过植树造林,利用光合作用吸收大气中的CO2
B
11.(2023深圳)某同学以金泥(含有Au、CuS、ZnS等)为原料制备(Au)和Cu的流程如图所示:
琴琴同学查阅资料已知:
①预处理的主要目的是将含硫化合物转化为氧化物。
②热空气流充分加热的目的是将Cu、Zn转化为氧化物,并完全分离出ZnO烟尘。
(1)“预处理”中会产生SO2,若SO2直接排放会导致 。
(2)“过程Ⅱ”产生的固体a中,除CuO外一定还有的物质是 。
(3)“过程Ⅲ”分离Au的操作是 ,加入过量稀硫酸的目的是 。
(4)“系列过程”中有一步是向滤液中加入过量铁粉,这一步生成气体的化学方程式为 ,该反应属于 反应(填基本反应类型)。
(5)ZnO烟尘可用NaOH溶液吸收,该反应生成偏锌酸钠(Na2ZnO2)和H2O的化学方程式为 。
酸雨
金(或Au)
过滤
将氧化铜完全转化为硫酸铜,提高铜的产率
置换
12.(2022通辽)我国化学家侯德榜所创立的侯氏联合制碱法,既提高了原料利用率,又“变废为宝”,降低了生产成本,促进了世界制碱技术的发展。侯氏联合制碱法的部分工艺流程如下:
(1)粗盐水中主要含有Na2SO4、MgCl2、CaCl2三种可溶性杂质,工业上常用加入稍过量的 溶液、NaOH溶液、Na2CO3溶液及适量的盐酸等除杂、精制。
(2)Ⅱ中发生反应的化学方程式为 。(3)氯化铵属于化肥中的 ,不采用蒸发结晶的方法得到氯化铵晶体的原因是 。
(4)该流程中可循环利用的物质是水、 。
BaCl2
氮肥
氯化铵受热易分解
CO2
13.(2022大庆)中国航天工业飞速发展,金属钛常被用于航空航天工业。下图是以钛铁矿为主要原料冶炼金属钛的生产工艺流程:
已知:钛铁矿主要成分为钛酸亚铁(FeTiO3),请回答下列问题。
(1)FeTiO3中钛元素的化合价为 。
+4
增大钛铁矿与浓硫酸的接触面积,加快溶浸速率
(3)溶液Ⅱ的主要溶质为TiOSO4,加热时和水发生反应。经过滤得到
H2TiO3。写出化学方程式: 。
CO
作保护气,防止镁、钛在高温下被空气中的氧气氧化
Na的金属活动性比镁强
14.(2022武汉)某化工厂以废金属(主要成分为Fe和Cu,表面有少量油污)为原料回收海绵铜,并制备氯化铁的工艺流程如图所示。
回答问题:
(1)废金属属于 (填“纯净物”或“混合物”)。
(2)“洗涤”的目的是去除废金属表面的油污,试剂X最好选用 (填字母)。
A.水 B.氢氧化钠溶液
C.稀硫酸 D.氯化钠溶液
(3)“酸浸”中发生反应的化学方程式为 。
(4)“滤液甲”中一定含有的溶质是 。
(5)向“滤渣乙”中加入适量盐酸,可以观察到的现象是 .
。
混合物
B
NaNO2、NaCl
红褐色固体逐渐溶解,得到黄色溶液
谢谢观赏!
同课章节目录
