2024年中考化学二轮复习 专题二 物质的检验与鉴别、分离与除杂课件(共40张PPT)
文档属性
| 名称 | 2024年中考化学二轮复习 专题二 物质的检验与鉴别、分离与除杂课件(共40张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 721.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-13 22:50:00 | ||
图片预览








文档简介
(共40张PPT)
专题二 物质的检验与鉴别、分离与除杂
物质的检验与鉴别
一、题目特点
以物质独有的某些性质,选择适当的试剂和方法,准确观察反应中出现的特征现象,以颜色变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等为依据,经适当推理、判断后确定某物质的存在(检验)或将其与其他物质区别开来(鉴别)。
常对某些气体、溶液成分、固体中某种成分进行检验,特别是对溶液中的离子进行检验居多。常见题型有选择题、填空题和实验方案设计题等。
鉴别分不加试剂鉴别、一剂鉴别和任意鉴别等题型。以最简单的方法,用最少的试剂,得到最明显的现象为基本原则。
二、解题方法
解析检验或鉴别类试题的方法基本一样,具体步骤为分别取出少量待测物质(取样),加入少量试剂充分反应(加剂),观察反应现象(观察),根据现象分析、判断、得出结论(结论)。在设计方案时要注意试剂的选择及添加
试剂的顺序,避免因干扰而造成误判。
一般情况下,鉴别物质时首先要选择物理法鉴别,即根据物质的颜色、挥发性(气味)、溶解性、溶解时的吸放热等鉴别;若应用物理法鉴别无法达到目的,可选择化学法鉴别。若物质间有明显的溶解性差异、溶解时的热效应差异及水溶液的颜色差异时,可用“水”来鉴别;若物质间有明显的酸碱性差异,可用酸碱指示剂或pH试纸鉴别。若用常规方法无法鉴别,则可采用互滴法鉴别,即根据各物质的性质不同,互相滴加时产生的现象各
不相同而鉴别出来。
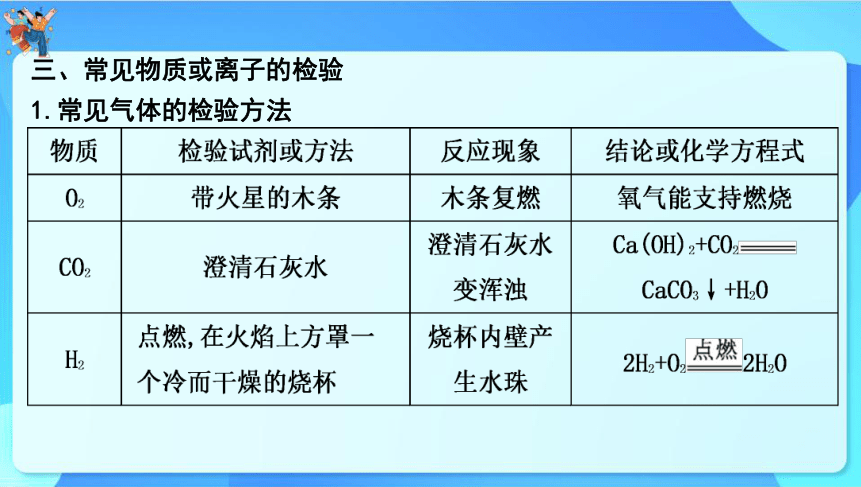
三、常见物质或离子的检验
1.常见气体的检验方法
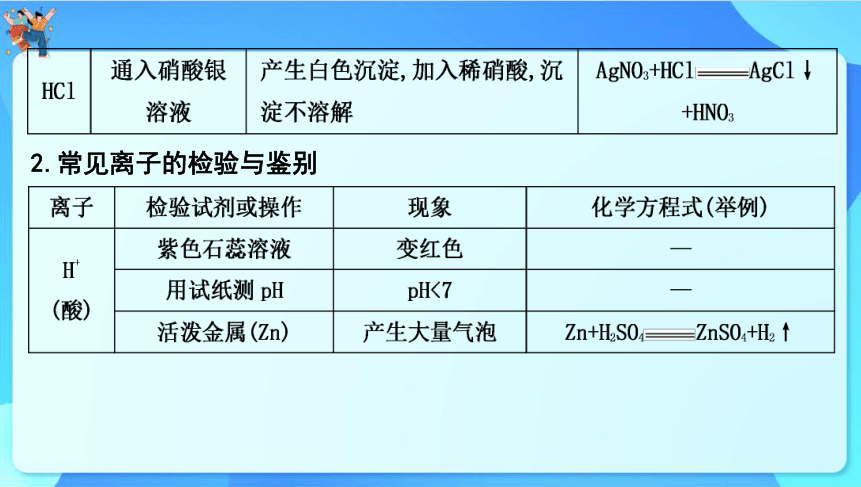
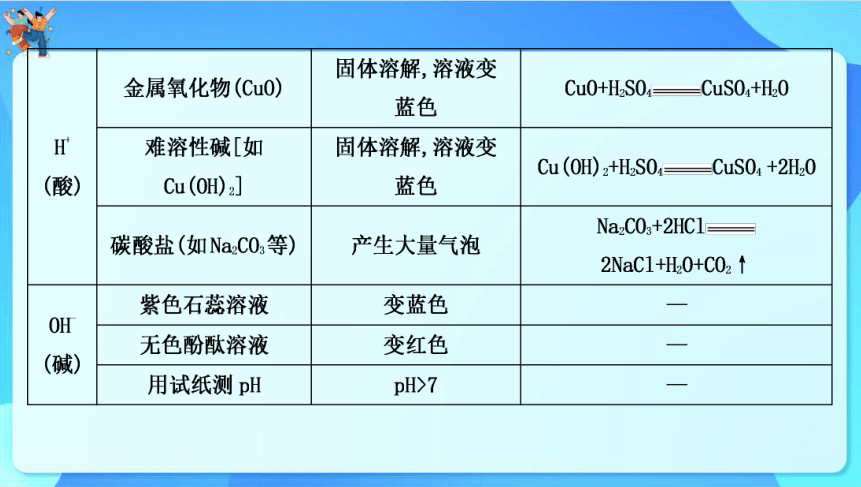
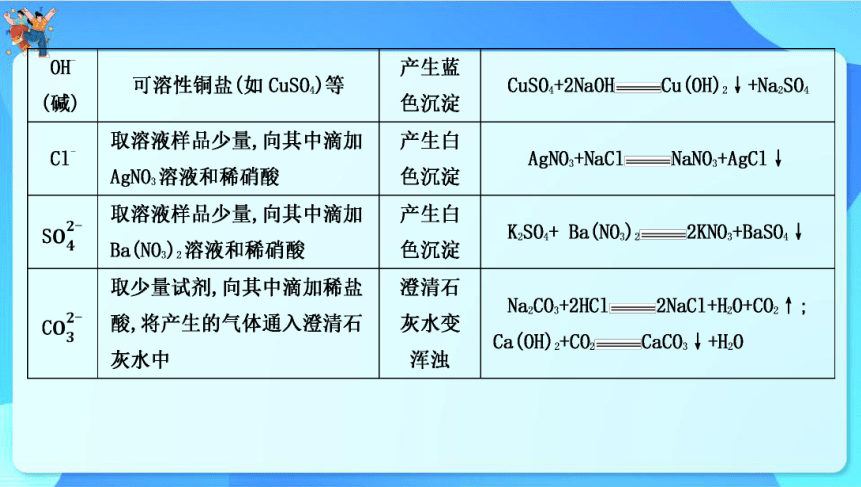
2.常见离子的检验与鉴别
3.日常生活中一些物质的检验、鉴别方法
(1)棉(麻)织品、毛(丝)织品、合成纤维的鉴别——灼烧闻气味法
物质 现象
棉(麻) 直接燃烧,有烧纸的气味,产生灰色、细而软的灰烬
毛(丝) 起泡成球,不延续燃烧,有烧毛发的气味,产生易碎的黑褐色小球
合成 纤维 先熔化后燃烧或边熔化边燃烧,有特殊气味,产生黑色或褪色硬块
(2)硬水和软水的鉴别
硬水能降低肥皂水的起泡能力,生活中常用肥皂水鉴别硬水和软水:在水样中滴加肥皂水,若产生的泡沫较少、浮渣较多的水是硬水;产生泡沫较多的水是软水。
(3)常见化肥的鉴别
①看外观:常见的氮肥、钾肥都是白色晶体,磷肥是灰白色粉末。
②加水溶解:氮肥、钾肥都易溶于水;磷肥大多数不溶于水或部分溶于水。
③加熟石灰混合研磨:铵态氮肥(铵盐)能放出有刺激性氨味的气体,该气体能使湿润的红色石蕊试纸变蓝色。
(4)淀粉的检验:向样品溶液中加入碘水,若淀粉变蓝则可证明。此法可用于碘和淀粉的相互检验。
(5)加碘食盐的检验:向装有碘化钾和淀粉混合溶液的试管中,滴入稀盐酸(或稀硫酸、食醋等)将溶液酸化,再加入食盐,若溶液变蓝色则可
证明。
[例2](2023通辽) 下列操作或方法不能达到实验目的的是( )
C
选项 操作或方法 实验目的
A 闻气味 鉴别氯化钠溶液和白醋
B 将带火星的木条伸入集气瓶内观察 检验集气瓶内气体是否为氧气
C 加入足量铝粉 除去硝酸铜溶液中的硝酸银
D 将浓硫酸沿着烧杯壁,缓慢地注入水中,并用玻璃棒不停搅拌 稀释浓硫酸
物质的分离与除杂
一、题目特点
混合物的分离是将几种物质通过物理或化学方法分开并恢复原状;除杂则要求把不纯物质中的杂质除去,被提纯物要恢复原状但不要求杂质恢复原状。
判断分离或除杂方案是否正确、选择合适的除杂试剂与方法、设计分离或除杂方案等是常见的考查模式,试题多以选择题或实验题的形式
呈现。
二、解题方法
分离是根据混合物中不同成分的溶解性、溶解度受温度变化的影响不同、沸点差异等,多采用过滤、结晶、蒸发、蒸馏等物理方法将各成分分离。除杂最常用的方法是将杂质转化为被提纯物或将杂质转变成与被提纯物状态不同的物质,然后使其自行逸出或采用过滤、结晶等方法将其除去。
在选择除杂试剂时,要遵循不增、不减、易分、最佳等原则。不增即不能引入新的杂质;不减即不能减少被提纯物的量,要求除杂试剂只能与杂质反应而不与被提纯物反应;易分是指杂质转化后要与被提纯物易于分离;最佳是指若能将杂质转化为被提纯物则为最佳方案。对于除杂试剂的用量,一般是当除杂试剂的状态与被提纯物状态相同时,要用适量;除杂试剂
的状态与被提纯物状态不同时,可加过量。
1.混合物分离与提纯常用的方法
(1)物理方法
方法 适用范围 理论依据 举例
过滤 固、液混合物 物质的溶解性不同 粗盐中难溶性杂质的去除
结晶 可溶性固体混合物 物质的溶解度受温度变化的影响不同 硝酸钾和氯化钠
蒸馏 液体混合物 混合物中各成分的沸点不同 石油分馏、分离液态空气制氧气
(2)化学方法
方法 适用范围或原理 举例(括号内为杂质)
沉淀法 将杂质变为沉淀,然后过滤将沉淀除去 HNO3(H2SO4):加入适量的Ba(NO3)2溶液,过滤
化气法 加热或加入一种试剂将杂质变为气体逸出而除去 NaCl溶液(Na2CO3):加入适量的稀盐酸
转化法 将杂质转化为被提纯物质 CO2(CO):将混合气体通过盛有足量灼热的CuO
置换法 应用金属活动性顺序通过置换反应除去杂质 ZnSO4(CuSO4):加入过量的锌后,过滤
吸收法 利用混合物中各组分化学性质的差异,用试剂吸收其中的杂质 CO(CO2):将混合气体通入足量的NaOH溶液中
加热法 杂质受热易分解或加热时能与除杂试剂反应 CaO(CaCO3):高温
CuO(C):把混合物放在氧气流中加热
溶解法 用试剂与杂质反应、溶解过滤除去 Cu(CuO):加足量稀硫酸溶解、过滤
2.常见物质的分离提纯(或除杂)
(1)气态物质的分离提纯(括号内为杂质)
混合物 除杂方案
CO2(H2O) 通过浓硫酸
CO(CO2) 通过足量的氢氧化钠溶液,再通过浓硫酸
CO2(CO) 通过灼热的氧化铜
CO2(HCl) 通过饱和的NaHCO3溶液,再通过浓硫酸
H2(H2O) 通过浓硫酸或碱石灰(生石灰和烧碱的混合物)
H2或O2 (HCl、H2O) 通过盛有足量碱石灰的干燥管;或先通过足量的氢氧化钠溶液,再通过浓硫酸
N2(O2、H2O) 先通过灼热的铜网,再通过浓硫酸或碱石灰等
(2)液态物质的分离提纯(括号内为杂质)
混合物 除杂方案
NaOH溶液(Na2CO3) 加入适量的澄清石灰水,过滤
KCl溶液(K2CO3) 加入适量盐酸;或加入适量CaCl2溶液,过滤
NaCl溶液(Na2CO3) 加入适量的盐酸
NaCl溶液(NaOH) 加入足量的盐酸,蒸发
NaCl溶液(Na2SO4) 加入适量的BaCl2溶液,过滤
NaCl溶液(CuSO4) 加入适量的Ba(OH)2溶液,过滤
NaCl溶液(KNO3) 蒸发结晶,过滤后将滤渣溶解
CaCl2溶液(HCl) 加入过量碳酸钙,过滤
FeSO4溶液(CuSO4) 加足量铁粉,过滤
(3)固态物质的分离提纯(括号内为杂质)
混合物 除杂方案
CaO(CaCO3) 高温煅烧
CaCO3(CaO) 加入大量水、过滤
CuO(Cu) 在空气(或氧气流)中灼烧
Cu(CuO) 加入足量的稀硫酸,过滤;或在H2(或CO)流中加热
KCl(KClO3) 充分加热
MnO2(KCl) 溶解、过滤、洗涤、干燥
KCl(MnO2) 溶解、过滤、蒸发结晶
Cu(Fe) 加入足量的稀硫酸,过滤;或用磁铁吸引
Fe (Cu) 用磁铁吸引
[例3](2023包头)除去下列物质中含有的杂质,所用试剂和方法正确的
是( )
B
选项 物质(括号内为杂质) 除杂试剂和方法
A 稀盐酸(H2SO4) 加入足量Ba(NO3)2,过滤
B O2(水蒸气) 将气体通过足量的浓硫酸,干燥
C CaCO3(CaO) 高温煅烧
D NaOH溶液[Ca(OH)2] 加入过量Na2CO3溶液,过滤
1.(2022北京)下列方法能区分氮气和二氧化碳两瓶气体的是( )
A.闻气味
B.观察颜色
C.倒入适量澄清的石灰水
D.将燃着的木条伸入集气瓶中
C
2.(2023宜昌) 鉴别下列各组物质,所选试剂不正确的是( )
A.硬水和软水——肥皂水
B.黄铜和黄金——硝酸银溶液
C.纯碱和烧碱——酚酞溶液
D.氯化铵和氯化钾——熟石灰
3.(2022烟台)下列各组固体物质,只用加水溶解的方法不能鉴别的是
( )
A.NaCl、KCl
B.CaCO3、CaCl2
C.CuSO4、Na2CO3
D.NH4NO3、NaOH
C
A
4.(2023重庆B)鉴别是重要的实验技能。分别鉴别两组物质:①C、
CuO;②稀H2SO4、Na2CO3溶液。都能选用的试剂是( )
A.O2 B.NaOH溶液
C.铁片 D.稀H2SO4
5.由NaCl、CuCl2、Mg(OH)2组成的固体混合物,将其逐一进行分离,可选用的试剂是( )
A.水、氢氧化钠溶液
B.水、氢氧化钾溶液、稀盐酸
C.水、氢氧化钾溶液
D.水、氢氧化钠溶液、稀盐酸
D
D
6.(2023郴州)下列做法不正确的是( )
A.除去KNO3固体中少量NaCl:加水溶解、蒸发浓缩、冷却结晶、过滤
B.分离水和酒精:蒸馏
C.鉴别Na2CO3和Na2SO4:分别加入盐酸
D.除去CO2中的CO:通入O2点燃
D
7.(2023兰州)物质的鉴别和除杂是重要的实验技能。下列实验目的和实验操作不相符的是( )
D
选项 实验目的 实验操作
A 鉴别硬水和软水 加肥皂水、观察
B 除去氮气中混有的氧气 通过灼热的铜网,观察
C 鉴别硝酸铵和氢氧化钠固体 加适量水,搅拌,测量温度
D 除去氧化铜粉末中混有的炭粉 加入过量稀硫酸,过滤
8.(2022娄底)下列各组物质的溶液,不用其他试剂,用观察或组内物质相互混合的方法,不能将它们一一鉴别出来的是( )
A.CuSO4、NaOH、NaCl
B.Na2CO3、Ca(OH)2、HCl
C.FeCl3、FeSO4、NaNO3
D.Ba(NO3)2、NaCl、H2SO4
D
D
10.(2023赤峰)化学离不开实验,我们通过实验研究物质的性质和变化规律,探寻物质组成的奥秘。科学的方案设计是达到实验目的的前提。下列实验操作,不能达到实验目的的是( )
B
选项 实验目的 实验操作
A 鉴别氯化铵和氯化钾 加入熟石灰固体研磨,闻气味
B 检验NaOH溶液是否变质 滴加无色酚酞溶液,观察颜色
C 分离氯化钠中混有的少量泥沙 溶解、过滤、蒸发、结晶
D 除去氮气中混有的少量氧气 通过灼热的铜丝网
11.用如图装置来分离CO2和CO混合气体并干燥,现装置内空气已排尽。实验步骤为①关闭活塞b和止水夹d,打开止水夹a、c;②关闭止水夹a、c,打开活塞b和止水夹d。甲、乙、丙中分别盛放的试剂为( )
A
选项 甲 乙 丙
A NaOH溶液 稀H2SO4 浓H2SO4
B NaOH溶液 稀H2SO4 NaOH溶液
C 饱和NaHCO3溶液 浓盐酸 浓H2SO4
D 浓H2SO4 NaOH溶液 浓H2SO4
12.将下列括号内的杂质除去,选择合适的试剂并将其化学式填在横
线上。
(1)HNO3(HCl) 。
(2)NaOH[Ca(OH)2] 。
(3)Na2SO4(Na2CO3) 。
(4)Cu(CuO) 。
(5)KNO3(CuSO4) 。
(6)NaCl(CaCO3) 。
AgNO3
Na2CO3
H2SO4
CO(或H2、HCl或H2SO4等)
Ba(OH)2
H2O
13.现有A、B、C、D、E五种溶液,它们分别是氢氧化钠溶液、硫酸铜溶液、碳酸钠溶液、氯化钠溶液和稀硫酸中的一种。鉴别它们可按下图所示的步骤进行。
回答下列问题:
(1)B中的溶质是 (填化学式)。
(2)用X鉴别D、E时,X可以选用不同的物质。
①若X为稀盐酸,写出有气体生成的化学方程式: .
;
②若X为澄清石灰水,写出有沉淀生成的化学方程式: .
。
CuSO4
14.(2022常德)亚硝酸钠是一种工业用盐,它是有毒、有咸味的白色晶体,亚硝酸钠的水溶液无色、呈碱性。人误食会引起中毒,危害人体健康,甚至死亡。硝酸钠是常见的钠盐,其外形与亚硝酸钠相似,硝酸钠水溶液无色、呈中性。实验室有一瓶亚硝酸钠溶液和一瓶硝酸钠溶液,请设计实验鉴别(写出实验操作、实验现象、实验结论)。
实验操作 实验现象 实验结论
. . . . . . .
.
.
取两瓶中的其中一瓶试剂于试管中,向其中滴加无色酚酞溶液(或紫色石蕊溶液或用pH试纸测定溶液pH等,答案不唯一,合理即可,但所加试剂、现象、结论要保持一致)
溶液变红色(或无明显现象)
所取试剂为亚硝酸钠溶液(或所取试剂为硝酸钠溶液)
谢谢观赏!
专题二 物质的检验与鉴别、分离与除杂
物质的检验与鉴别
一、题目特点
以物质独有的某些性质,选择适当的试剂和方法,准确观察反应中出现的特征现象,以颜色变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等为依据,经适当推理、判断后确定某物质的存在(检验)或将其与其他物质区别开来(鉴别)。
常对某些气体、溶液成分、固体中某种成分进行检验,特别是对溶液中的离子进行检验居多。常见题型有选择题、填空题和实验方案设计题等。
鉴别分不加试剂鉴别、一剂鉴别和任意鉴别等题型。以最简单的方法,用最少的试剂,得到最明显的现象为基本原则。
二、解题方法
解析检验或鉴别类试题的方法基本一样,具体步骤为分别取出少量待测物质(取样),加入少量试剂充分反应(加剂),观察反应现象(观察),根据现象分析、判断、得出结论(结论)。在设计方案时要注意试剂的选择及添加
试剂的顺序,避免因干扰而造成误判。
一般情况下,鉴别物质时首先要选择物理法鉴别,即根据物质的颜色、挥发性(气味)、溶解性、溶解时的吸放热等鉴别;若应用物理法鉴别无法达到目的,可选择化学法鉴别。若物质间有明显的溶解性差异、溶解时的热效应差异及水溶液的颜色差异时,可用“水”来鉴别;若物质间有明显的酸碱性差异,可用酸碱指示剂或pH试纸鉴别。若用常规方法无法鉴别,则可采用互滴法鉴别,即根据各物质的性质不同,互相滴加时产生的现象各
不相同而鉴别出来。
三、常见物质或离子的检验
1.常见气体的检验方法
2.常见离子的检验与鉴别
3.日常生活中一些物质的检验、鉴别方法
(1)棉(麻)织品、毛(丝)织品、合成纤维的鉴别——灼烧闻气味法
物质 现象
棉(麻) 直接燃烧,有烧纸的气味,产生灰色、细而软的灰烬
毛(丝) 起泡成球,不延续燃烧,有烧毛发的气味,产生易碎的黑褐色小球
合成 纤维 先熔化后燃烧或边熔化边燃烧,有特殊气味,产生黑色或褪色硬块
(2)硬水和软水的鉴别
硬水能降低肥皂水的起泡能力,生活中常用肥皂水鉴别硬水和软水:在水样中滴加肥皂水,若产生的泡沫较少、浮渣较多的水是硬水;产生泡沫较多的水是软水。
(3)常见化肥的鉴别
①看外观:常见的氮肥、钾肥都是白色晶体,磷肥是灰白色粉末。
②加水溶解:氮肥、钾肥都易溶于水;磷肥大多数不溶于水或部分溶于水。
③加熟石灰混合研磨:铵态氮肥(铵盐)能放出有刺激性氨味的气体,该气体能使湿润的红色石蕊试纸变蓝色。
(4)淀粉的检验:向样品溶液中加入碘水,若淀粉变蓝则可证明。此法可用于碘和淀粉的相互检验。
(5)加碘食盐的检验:向装有碘化钾和淀粉混合溶液的试管中,滴入稀盐酸(或稀硫酸、食醋等)将溶液酸化,再加入食盐,若溶液变蓝色则可
证明。
[例2](2023通辽) 下列操作或方法不能达到实验目的的是( )
C
选项 操作或方法 实验目的
A 闻气味 鉴别氯化钠溶液和白醋
B 将带火星的木条伸入集气瓶内观察 检验集气瓶内气体是否为氧气
C 加入足量铝粉 除去硝酸铜溶液中的硝酸银
D 将浓硫酸沿着烧杯壁,缓慢地注入水中,并用玻璃棒不停搅拌 稀释浓硫酸
物质的分离与除杂
一、题目特点
混合物的分离是将几种物质通过物理或化学方法分开并恢复原状;除杂则要求把不纯物质中的杂质除去,被提纯物要恢复原状但不要求杂质恢复原状。
判断分离或除杂方案是否正确、选择合适的除杂试剂与方法、设计分离或除杂方案等是常见的考查模式,试题多以选择题或实验题的形式
呈现。
二、解题方法
分离是根据混合物中不同成分的溶解性、溶解度受温度变化的影响不同、沸点差异等,多采用过滤、结晶、蒸发、蒸馏等物理方法将各成分分离。除杂最常用的方法是将杂质转化为被提纯物或将杂质转变成与被提纯物状态不同的物质,然后使其自行逸出或采用过滤、结晶等方法将其除去。
在选择除杂试剂时,要遵循不增、不减、易分、最佳等原则。不增即不能引入新的杂质;不减即不能减少被提纯物的量,要求除杂试剂只能与杂质反应而不与被提纯物反应;易分是指杂质转化后要与被提纯物易于分离;最佳是指若能将杂质转化为被提纯物则为最佳方案。对于除杂试剂的用量,一般是当除杂试剂的状态与被提纯物状态相同时,要用适量;除杂试剂
的状态与被提纯物状态不同时,可加过量。
1.混合物分离与提纯常用的方法
(1)物理方法
方法 适用范围 理论依据 举例
过滤 固、液混合物 物质的溶解性不同 粗盐中难溶性杂质的去除
结晶 可溶性固体混合物 物质的溶解度受温度变化的影响不同 硝酸钾和氯化钠
蒸馏 液体混合物 混合物中各成分的沸点不同 石油分馏、分离液态空气制氧气
(2)化学方法
方法 适用范围或原理 举例(括号内为杂质)
沉淀法 将杂质变为沉淀,然后过滤将沉淀除去 HNO3(H2SO4):加入适量的Ba(NO3)2溶液,过滤
化气法 加热或加入一种试剂将杂质变为气体逸出而除去 NaCl溶液(Na2CO3):加入适量的稀盐酸
转化法 将杂质转化为被提纯物质 CO2(CO):将混合气体通过盛有足量灼热的CuO
置换法 应用金属活动性顺序通过置换反应除去杂质 ZnSO4(CuSO4):加入过量的锌后,过滤
吸收法 利用混合物中各组分化学性质的差异,用试剂吸收其中的杂质 CO(CO2):将混合气体通入足量的NaOH溶液中
加热法 杂质受热易分解或加热时能与除杂试剂反应 CaO(CaCO3):高温
CuO(C):把混合物放在氧气流中加热
溶解法 用试剂与杂质反应、溶解过滤除去 Cu(CuO):加足量稀硫酸溶解、过滤
2.常见物质的分离提纯(或除杂)
(1)气态物质的分离提纯(括号内为杂质)
混合物 除杂方案
CO2(H2O) 通过浓硫酸
CO(CO2) 通过足量的氢氧化钠溶液,再通过浓硫酸
CO2(CO) 通过灼热的氧化铜
CO2(HCl) 通过饱和的NaHCO3溶液,再通过浓硫酸
H2(H2O) 通过浓硫酸或碱石灰(生石灰和烧碱的混合物)
H2或O2 (HCl、H2O) 通过盛有足量碱石灰的干燥管;或先通过足量的氢氧化钠溶液,再通过浓硫酸
N2(O2、H2O) 先通过灼热的铜网,再通过浓硫酸或碱石灰等
(2)液态物质的分离提纯(括号内为杂质)
混合物 除杂方案
NaOH溶液(Na2CO3) 加入适量的澄清石灰水,过滤
KCl溶液(K2CO3) 加入适量盐酸;或加入适量CaCl2溶液,过滤
NaCl溶液(Na2CO3) 加入适量的盐酸
NaCl溶液(NaOH) 加入足量的盐酸,蒸发
NaCl溶液(Na2SO4) 加入适量的BaCl2溶液,过滤
NaCl溶液(CuSO4) 加入适量的Ba(OH)2溶液,过滤
NaCl溶液(KNO3) 蒸发结晶,过滤后将滤渣溶解
CaCl2溶液(HCl) 加入过量碳酸钙,过滤
FeSO4溶液(CuSO4) 加足量铁粉,过滤
(3)固态物质的分离提纯(括号内为杂质)
混合物 除杂方案
CaO(CaCO3) 高温煅烧
CaCO3(CaO) 加入大量水、过滤
CuO(Cu) 在空气(或氧气流)中灼烧
Cu(CuO) 加入足量的稀硫酸,过滤;或在H2(或CO)流中加热
KCl(KClO3) 充分加热
MnO2(KCl) 溶解、过滤、洗涤、干燥
KCl(MnO2) 溶解、过滤、蒸发结晶
Cu(Fe) 加入足量的稀硫酸,过滤;或用磁铁吸引
Fe (Cu) 用磁铁吸引
[例3](2023包头)除去下列物质中含有的杂质,所用试剂和方法正确的
是( )
B
选项 物质(括号内为杂质) 除杂试剂和方法
A 稀盐酸(H2SO4) 加入足量Ba(NO3)2,过滤
B O2(水蒸气) 将气体通过足量的浓硫酸,干燥
C CaCO3(CaO) 高温煅烧
D NaOH溶液[Ca(OH)2] 加入过量Na2CO3溶液,过滤
1.(2022北京)下列方法能区分氮气和二氧化碳两瓶气体的是( )
A.闻气味
B.观察颜色
C.倒入适量澄清的石灰水
D.将燃着的木条伸入集气瓶中
C
2.(2023宜昌) 鉴别下列各组物质,所选试剂不正确的是( )
A.硬水和软水——肥皂水
B.黄铜和黄金——硝酸银溶液
C.纯碱和烧碱——酚酞溶液
D.氯化铵和氯化钾——熟石灰
3.(2022烟台)下列各组固体物质,只用加水溶解的方法不能鉴别的是
( )
A.NaCl、KCl
B.CaCO3、CaCl2
C.CuSO4、Na2CO3
D.NH4NO3、NaOH
C
A
4.(2023重庆B)鉴别是重要的实验技能。分别鉴别两组物质:①C、
CuO;②稀H2SO4、Na2CO3溶液。都能选用的试剂是( )
A.O2 B.NaOH溶液
C.铁片 D.稀H2SO4
5.由NaCl、CuCl2、Mg(OH)2组成的固体混合物,将其逐一进行分离,可选用的试剂是( )
A.水、氢氧化钠溶液
B.水、氢氧化钾溶液、稀盐酸
C.水、氢氧化钾溶液
D.水、氢氧化钠溶液、稀盐酸
D
D
6.(2023郴州)下列做法不正确的是( )
A.除去KNO3固体中少量NaCl:加水溶解、蒸发浓缩、冷却结晶、过滤
B.分离水和酒精:蒸馏
C.鉴别Na2CO3和Na2SO4:分别加入盐酸
D.除去CO2中的CO:通入O2点燃
D
7.(2023兰州)物质的鉴别和除杂是重要的实验技能。下列实验目的和实验操作不相符的是( )
D
选项 实验目的 实验操作
A 鉴别硬水和软水 加肥皂水、观察
B 除去氮气中混有的氧气 通过灼热的铜网,观察
C 鉴别硝酸铵和氢氧化钠固体 加适量水,搅拌,测量温度
D 除去氧化铜粉末中混有的炭粉 加入过量稀硫酸,过滤
8.(2022娄底)下列各组物质的溶液,不用其他试剂,用观察或组内物质相互混合的方法,不能将它们一一鉴别出来的是( )
A.CuSO4、NaOH、NaCl
B.Na2CO3、Ca(OH)2、HCl
C.FeCl3、FeSO4、NaNO3
D.Ba(NO3)2、NaCl、H2SO4
D
D
10.(2023赤峰)化学离不开实验,我们通过实验研究物质的性质和变化规律,探寻物质组成的奥秘。科学的方案设计是达到实验目的的前提。下列实验操作,不能达到实验目的的是( )
B
选项 实验目的 实验操作
A 鉴别氯化铵和氯化钾 加入熟石灰固体研磨,闻气味
B 检验NaOH溶液是否变质 滴加无色酚酞溶液,观察颜色
C 分离氯化钠中混有的少量泥沙 溶解、过滤、蒸发、结晶
D 除去氮气中混有的少量氧气 通过灼热的铜丝网
11.用如图装置来分离CO2和CO混合气体并干燥,现装置内空气已排尽。实验步骤为①关闭活塞b和止水夹d,打开止水夹a、c;②关闭止水夹a、c,打开活塞b和止水夹d。甲、乙、丙中分别盛放的试剂为( )
A
选项 甲 乙 丙
A NaOH溶液 稀H2SO4 浓H2SO4
B NaOH溶液 稀H2SO4 NaOH溶液
C 饱和NaHCO3溶液 浓盐酸 浓H2SO4
D 浓H2SO4 NaOH溶液 浓H2SO4
12.将下列括号内的杂质除去,选择合适的试剂并将其化学式填在横
线上。
(1)HNO3(HCl) 。
(2)NaOH[Ca(OH)2] 。
(3)Na2SO4(Na2CO3) 。
(4)Cu(CuO) 。
(5)KNO3(CuSO4) 。
(6)NaCl(CaCO3) 。
AgNO3
Na2CO3
H2SO4
CO(或H2、HCl或H2SO4等)
Ba(OH)2
H2O
13.现有A、B、C、D、E五种溶液,它们分别是氢氧化钠溶液、硫酸铜溶液、碳酸钠溶液、氯化钠溶液和稀硫酸中的一种。鉴别它们可按下图所示的步骤进行。
回答下列问题:
(1)B中的溶质是 (填化学式)。
(2)用X鉴别D、E时,X可以选用不同的物质。
①若X为稀盐酸,写出有气体生成的化学方程式: .
;
②若X为澄清石灰水,写出有沉淀生成的化学方程式: .
。
CuSO4
14.(2022常德)亚硝酸钠是一种工业用盐,它是有毒、有咸味的白色晶体,亚硝酸钠的水溶液无色、呈碱性。人误食会引起中毒,危害人体健康,甚至死亡。硝酸钠是常见的钠盐,其外形与亚硝酸钠相似,硝酸钠水溶液无色、呈中性。实验室有一瓶亚硝酸钠溶液和一瓶硝酸钠溶液,请设计实验鉴别(写出实验操作、实验现象、实验结论)。
实验操作 实验现象 实验结论
. . . . . . .
.
.
取两瓶中的其中一瓶试剂于试管中,向其中滴加无色酚酞溶液(或紫色石蕊溶液或用pH试纸测定溶液pH等,答案不唯一,合理即可,但所加试剂、现象、结论要保持一致)
溶液变红色(或无明显现象)
所取试剂为亚硝酸钠溶液(或所取试剂为硝酸钠溶液)
谢谢观赏!
同课章节目录
