2024年中考化学二轮复习 专题八 有关化学方程式的计算课件(共38张PPT)
文档属性
| 名称 | 2024年中考化学二轮复习 专题八 有关化学方程式的计算课件(共38张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-13 22:57:23 | ||
图片预览










文档简介
(共38张PPT)
专题八 有关化学方程式的计算
一、题目特点
根据化学方程式的计算是中考的常考知识点之一。该类试题常以文字叙述、坐标曲线、表格数据、实物(或流程)等形式出示数据,考查学生从文字、图形中获取数据信息的能力,以及定量思维和计算推理能力等。
根据化学方程式的计算类试题涉及反应中质量守恒定律的应用、含杂质的混合物计算、溶液中溶质的质量分数、溶解度等知识点,试题难度各异,但计算量相对较小。
二、解题方法
解析根据化学方程式计算类试题,一要认真审题,分析题意,推敲关键
词,找到核心反应方程式;二要读出不同呈现形式的数据并找准对应物质的量和关系;三是在解析过程中注意步骤完整、规范。
1.化学方程式的简单计算涉及的5个步骤:
(1)设未知量;
(2)正确书写化学方程式;
(3)寻找相关量、代入已知量;
(4)列比例式、计算
(5)简答计算结果。
2.注意
(1)化学方程式一定要配平。
(2)化学方程式的计算依据是质量守恒定律,若题中给出的量或要求的量是体积,一定要换算成质量计算。
(3)代入化学方程式中的相关量必须是纯净物的量,若给出的量含有杂质,需换算成纯量再代入化学方程式计算。
文字叙述型
[例1] (2023锦州)实验室有一瓶标签破损的稀硫酸,需要测定其溶质质量分数。现取10 g该稀硫酸于烧杯中,向其中逐滴加入溶质质量分数为4%的氢氧化钠溶液至恰好完全反应,共消耗氢氧化钠溶液20 g,请计算该稀硫酸的溶质质量分数(写出计算过程)。
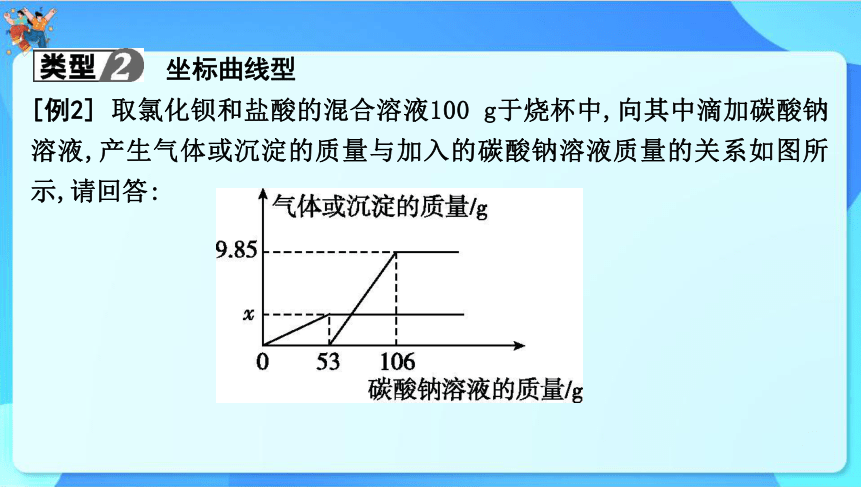
坐标曲线型
[例2] 取氯化钡和盐酸的混合溶液100 g于烧杯中,向其中滴加碳酸钠溶液,产生气体或沉淀的质量与加入的碳酸钠溶液质量的关系如图所
示,请回答:
(1)产生沉淀的质量为 g。
(2)x的值为 。
(3)求所用碳酸钠溶液中溶质的质量分数(请写出计算过程)。
9.85
2.2
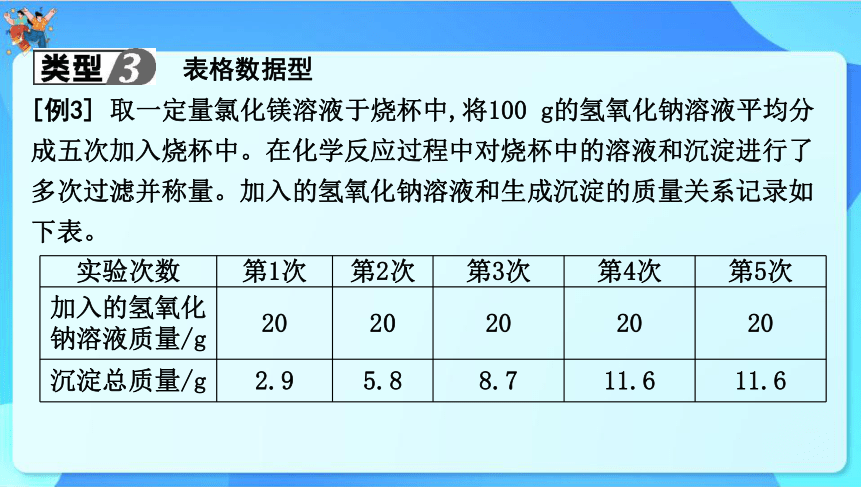
表格数据型
[例3] 取一定量氯化镁溶液于烧杯中,将100 g的氢氧化钠溶液平均分成五次加入烧杯中。在化学反应过程中对烧杯中的溶液和沉淀进行了多次过滤并称量。加入的氢氧化钠溶液和生成沉淀的质量关系记录如下表。
实验次数 第1次 第2次 第3次 第4次 第5次
加入的氢氧化钠溶液质量/g 20 20 20 20 20
沉淀总质量/g 2.9 5.8 8.7 11.6 11.6
分析上表中的数据,回答下列问题:
(1)第 次加完氢氧化钠溶液时,氯化镁和氢氧化钠恰好完全反应,此时生成沉淀质量为 g。
(2)恰好完全反应时,称量所得氯化钠溶液质量为168.4 g,求原氯化镁溶液中溶质的质量分数(请写出计算过程)。
4
11.6
实物/流程图型
[例4] 鸡蛋壳的主要成分是碳酸钙(其他成分不溶于水也不与酸反应)。某化学兴趣小组为了测定鸡蛋壳中碳酸钙的含量,做如下实验:
反应结束后,发现溶液呈酸性,为防止溶液腐蚀下水管道,过滤后向滤液中加入一定量的Ca(OH)2固体粉末至中性,蒸发溶液得固体33.3 g。
(1)该鸡蛋壳中碳酸钙的质量为多少 (写出计算过程)
(2)稀盐酸的溶质质量分数为 。
21.9%
综合型
[例5] 硝酸溶解废旧CPU所得溶液中含有Cu2+和Ag+,用适当浓度的盐酸、氯化钠溶液、氨水和铁粉,按照如下方法回收Cu和Ag(图中标注的试剂均不同)。
(1)加入过量Fe粉发生的主要反应为 .
(写化学方程式)。
(2)试剂1和试剂3的名称依次是 。
氯化钠溶液、氨水
(3)若向66 g物质1中加入100 g试剂2后,恰好完全反应,剩余固体质量为60.4 g,求所得溶液中溶质的质量分数(写出计算过程,计算结果精确到0.1%)。
2
2
1
2
(2)若该煤厂一次共加入280 t生石灰(含CaO 80%),则理论上最多可吸收SO2多少吨(写出计算过程)。
2.硝酸是一种重要的酸,可用于生产化肥、染料和炸药。工业上利用氮的氧化物、氧气与水反应制备硝酸。
(1)某常见氮的氧化物中N、O两种元素的质量比为7∶16,则该化合物的化学式为 。
(2)将该氮的氧化物23.0 g与足量的氧气缓慢通入一定量水中(NO2+O2+H2O→HNO3),得到60.0 g硝酸溶液的溶质质量分数为多少 (写
出计算过程)
NO2
3.(2022通辽)现有碳酸钠和氯化钠的混合物15 g,将其放入烧杯中加入100 g水,使其完全溶解。向所得溶液中加入溶质质量分数为9.8%的稀硫酸,烧杯中溶液的质量与加入稀硫酸的质量关系如图所示,请回答下列问题。
(1)B点时烧杯中溶液含有的阳离子是 (填离子符号)。
(2)恰好完全反应时加入稀硫酸的质量为 g。
Na+、H+
100
(3)混合物中氯化钠的质量是多少克 (写出具体计算过程)
4.根据下图所示的实验过程和提供的数据进行计算:
(1)原混合物中NaCl的质量。(要求写出计算过程)
(2)AgNO3溶液的溶质质量分数(计算结果精确到0.1%)。
5.铜锌合金外观似金子,某化学小组为检测其中锌的质量分数,按下列流程进行探究实验,充分反应,所得数据如图所示(忽略盐酸的挥
发)。求:
(1)生成氢气的总质量为 g。
0.2
(2)合金中锌的质量分数。
(3)稀盐酸中溶质的质量分数。
6.(2022包头)常温下,向盛有100 g NaOH溶液的烧杯中逐滴加入溶质质量分数为3.65%的稀盐酸,测得反应过程中溶液的pH与加入稀盐酸的
质量数据如下表:
(1)当溶液为中性时,消耗稀盐酸的质量为 g。
加入稀盐酸的质量/g 80 100 120
烧杯中溶液的pH 13.0 7.0 1.0
100
(2)计算该NaOH溶液中溶质的质量分数。
(3)计算恰好完全反应时,所得溶液的溶质质量分数。
7.(2023赤峰)某校实验室工作人员欲测定某氯酸钾样品中氯酸钾的质量分数,现取14 g该样品与2 g二氧化锰混合,放入试管中充分加热(杂质不发生反应),反应过程和数据如图所示。
请计算:
(1)生成氧气的质量为 g。
4.8
8.(2023呼和浩特)2022年国产技术打造的氢燃料客车,服务于北京冬奥会和冬残奥会,工业上大规模生产H2的一种方法是利用天然气中的甲烷和水进行反应,其微观示意图如下:
请计算:
(1)甲烷中碳元素的质量分数是 。
75%
(2)理论上生产2 t H2,所消耗的水的质量是多少吨
谢谢观赏!
专题八 有关化学方程式的计算
一、题目特点
根据化学方程式的计算是中考的常考知识点之一。该类试题常以文字叙述、坐标曲线、表格数据、实物(或流程)等形式出示数据,考查学生从文字、图形中获取数据信息的能力,以及定量思维和计算推理能力等。
根据化学方程式的计算类试题涉及反应中质量守恒定律的应用、含杂质的混合物计算、溶液中溶质的质量分数、溶解度等知识点,试题难度各异,但计算量相对较小。
二、解题方法
解析根据化学方程式计算类试题,一要认真审题,分析题意,推敲关键
词,找到核心反应方程式;二要读出不同呈现形式的数据并找准对应物质的量和关系;三是在解析过程中注意步骤完整、规范。
1.化学方程式的简单计算涉及的5个步骤:
(1)设未知量;
(2)正确书写化学方程式;
(3)寻找相关量、代入已知量;
(4)列比例式、计算
(5)简答计算结果。
2.注意
(1)化学方程式一定要配平。
(2)化学方程式的计算依据是质量守恒定律,若题中给出的量或要求的量是体积,一定要换算成质量计算。
(3)代入化学方程式中的相关量必须是纯净物的量,若给出的量含有杂质,需换算成纯量再代入化学方程式计算。
文字叙述型
[例1] (2023锦州)实验室有一瓶标签破损的稀硫酸,需要测定其溶质质量分数。现取10 g该稀硫酸于烧杯中,向其中逐滴加入溶质质量分数为4%的氢氧化钠溶液至恰好完全反应,共消耗氢氧化钠溶液20 g,请计算该稀硫酸的溶质质量分数(写出计算过程)。
坐标曲线型
[例2] 取氯化钡和盐酸的混合溶液100 g于烧杯中,向其中滴加碳酸钠溶液,产生气体或沉淀的质量与加入的碳酸钠溶液质量的关系如图所
示,请回答:
(1)产生沉淀的质量为 g。
(2)x的值为 。
(3)求所用碳酸钠溶液中溶质的质量分数(请写出计算过程)。
9.85
2.2
表格数据型
[例3] 取一定量氯化镁溶液于烧杯中,将100 g的氢氧化钠溶液平均分成五次加入烧杯中。在化学反应过程中对烧杯中的溶液和沉淀进行了多次过滤并称量。加入的氢氧化钠溶液和生成沉淀的质量关系记录如下表。
实验次数 第1次 第2次 第3次 第4次 第5次
加入的氢氧化钠溶液质量/g 20 20 20 20 20
沉淀总质量/g 2.9 5.8 8.7 11.6 11.6
分析上表中的数据,回答下列问题:
(1)第 次加完氢氧化钠溶液时,氯化镁和氢氧化钠恰好完全反应,此时生成沉淀质量为 g。
(2)恰好完全反应时,称量所得氯化钠溶液质量为168.4 g,求原氯化镁溶液中溶质的质量分数(请写出计算过程)。
4
11.6
实物/流程图型
[例4] 鸡蛋壳的主要成分是碳酸钙(其他成分不溶于水也不与酸反应)。某化学兴趣小组为了测定鸡蛋壳中碳酸钙的含量,做如下实验:
反应结束后,发现溶液呈酸性,为防止溶液腐蚀下水管道,过滤后向滤液中加入一定量的Ca(OH)2固体粉末至中性,蒸发溶液得固体33.3 g。
(1)该鸡蛋壳中碳酸钙的质量为多少 (写出计算过程)
(2)稀盐酸的溶质质量分数为 。
21.9%
综合型
[例5] 硝酸溶解废旧CPU所得溶液中含有Cu2+和Ag+,用适当浓度的盐酸、氯化钠溶液、氨水和铁粉,按照如下方法回收Cu和Ag(图中标注的试剂均不同)。
(1)加入过量Fe粉发生的主要反应为 .
(写化学方程式)。
(2)试剂1和试剂3的名称依次是 。
氯化钠溶液、氨水
(3)若向66 g物质1中加入100 g试剂2后,恰好完全反应,剩余固体质量为60.4 g,求所得溶液中溶质的质量分数(写出计算过程,计算结果精确到0.1%)。
2
2
1
2
(2)若该煤厂一次共加入280 t生石灰(含CaO 80%),则理论上最多可吸收SO2多少吨(写出计算过程)。
2.硝酸是一种重要的酸,可用于生产化肥、染料和炸药。工业上利用氮的氧化物、氧气与水反应制备硝酸。
(1)某常见氮的氧化物中N、O两种元素的质量比为7∶16,则该化合物的化学式为 。
(2)将该氮的氧化物23.0 g与足量的氧气缓慢通入一定量水中(NO2+O2+H2O→HNO3),得到60.0 g硝酸溶液的溶质质量分数为多少 (写
出计算过程)
NO2
3.(2022通辽)现有碳酸钠和氯化钠的混合物15 g,将其放入烧杯中加入100 g水,使其完全溶解。向所得溶液中加入溶质质量分数为9.8%的稀硫酸,烧杯中溶液的质量与加入稀硫酸的质量关系如图所示,请回答下列问题。
(1)B点时烧杯中溶液含有的阳离子是 (填离子符号)。
(2)恰好完全反应时加入稀硫酸的质量为 g。
Na+、H+
100
(3)混合物中氯化钠的质量是多少克 (写出具体计算过程)
4.根据下图所示的实验过程和提供的数据进行计算:
(1)原混合物中NaCl的质量。(要求写出计算过程)
(2)AgNO3溶液的溶质质量分数(计算结果精确到0.1%)。
5.铜锌合金外观似金子,某化学小组为检测其中锌的质量分数,按下列流程进行探究实验,充分反应,所得数据如图所示(忽略盐酸的挥
发)。求:
(1)生成氢气的总质量为 g。
0.2
(2)合金中锌的质量分数。
(3)稀盐酸中溶质的质量分数。
6.(2022包头)常温下,向盛有100 g NaOH溶液的烧杯中逐滴加入溶质质量分数为3.65%的稀盐酸,测得反应过程中溶液的pH与加入稀盐酸的
质量数据如下表:
(1)当溶液为中性时,消耗稀盐酸的质量为 g。
加入稀盐酸的质量/g 80 100 120
烧杯中溶液的pH 13.0 7.0 1.0
100
(2)计算该NaOH溶液中溶质的质量分数。
(3)计算恰好完全反应时,所得溶液的溶质质量分数。
7.(2023赤峰)某校实验室工作人员欲测定某氯酸钾样品中氯酸钾的质量分数,现取14 g该样品与2 g二氧化锰混合,放入试管中充分加热(杂质不发生反应),反应过程和数据如图所示。
请计算:
(1)生成氧气的质量为 g。
4.8
8.(2023呼和浩特)2022年国产技术打造的氢燃料客车,服务于北京冬奥会和冬残奥会,工业上大规模生产H2的一种方法是利用天然气中的甲烷和水进行反应,其微观示意图如下:
请计算:
(1)甲烷中碳元素的质量分数是 。
75%
(2)理论上生产2 t H2,所消耗的水的质量是多少吨
谢谢观赏!
同课章节目录
