2024年高考化学二轮复习回归基础训练专题13化学平衡常数的计算及应用(含解析)
文档属性
| 名称 | 2024年高考化学二轮复习回归基础训练专题13化学平衡常数的计算及应用(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-14 08:53:18 | ||
图片预览




文档简介
2024年高考化学二轮复习回归基础训练专题13化学平衡常数的计算及应用
一、单选题,共13小题
1.(23-24高三上·贵州贵阳·阶段练习)已知在T℃时高炉炼铁可发生如下反应:
① ,平衡常数为;
② ,平衡常数为。
以下说法正确的是
A.反应②的平衡常数表达式为
B.T℃时,反应的平衡常数
C.T℃时增大压强,减小、不变
D.T℃时,反应的平衡常数
2.(2023高三·全国·专题练习)在恒温条件下,向盛有食盐的2L恒容密闭容器中加入0.2molNO2、0.2moINO和0.1molCl2,发生如下两个反应:
①2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) △H1<0 平衡常数K1
②2NO(g)+Cl2(g) 2ClNO(g) △H2<0 平衡常数K2
10分钟时反应达到平衡,测得容器内体系的压强减少20%,10分钟内用ClNO(g)表示的平均反应速率v(ClNO)=7.5×10-3mol/(L·min)。下列说法正确的是
A.平衡时NO2的转化率为50%
B.平衡后c(NO)=2.5×10-2mol·L-1
C.其它条件保持不变,反应在恒压条件下进行,则平衡常数K2增大
D.反应4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数为K-K1
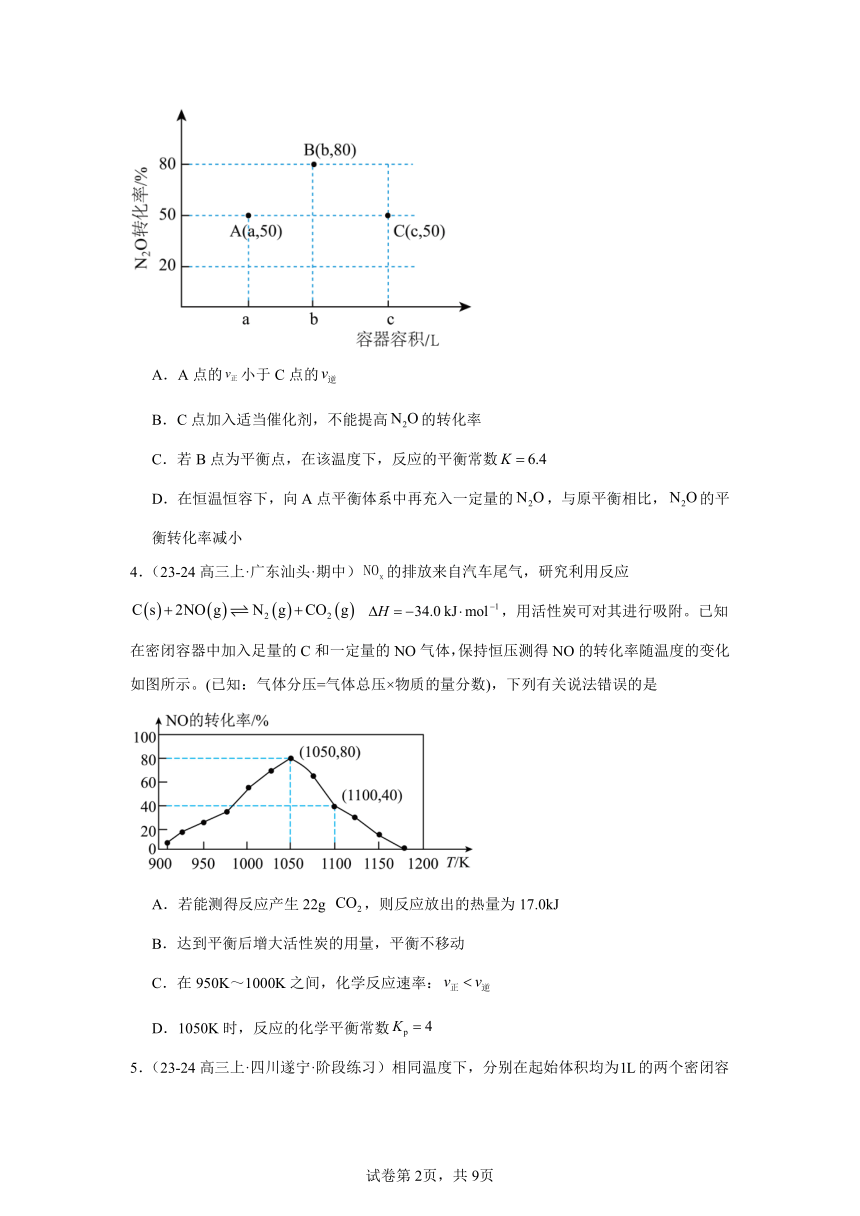
3.(23-24高三上·湖南长沙·阶段练习)是常见的环境污染性气体。一定温度下,向三个容积不等的恒容密闭容器中分别投入,发生反应:。反应相同时间内,三个容器中的转化率如图中A、B、C三点。下列叙述正确的是
A.A点的小于C点的
B.C点加入适当催化剂,不能提高的转化率
C.若B点为平衡点,在该温度下,反应的平衡常数
D.在恒温恒容下,向A点平衡体系中再充入一定量的,与原平衡相比,的平衡转化率减小
4.(23-24高三上·广东汕头·期中)的排放来自汽车尾气,研究利用反应 ,用活性炭可对其进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示。(已知:气体分压=气体总压×物质的量分数),下列有关说法错误的是
A.若能测得反应产生22g ,则反应放出的热量为17.0kJ
B.达到平衡后增大活性炭的用量,平衡不移动
C.在950K~1000K之间,化学反应速率:
D.1050K时,反应的化学平衡常数
5.(23-24高三上·四川遂宁·阶段练习)相同温度下,分别在起始体积均为的两个密闭容器中发生反应: ,实验测得反应的有关数据如下表。
容器 反应条件 起始物质的量/mol 达到平衡所用时间/min 达到平衡过程中的能量变化
X2 Y2 XY3
① 恒容 1 3 0 10 放热0.1akJ
② 恒压 1 3 0 t 放热bkJ
下列叙述正确的是
A.反应②的平衡常数K约为0.0046
B.①中:从开始至10min内的平均反应速率v(X2)=0.1mol-1·L·min-1
C.②中:X2的平衡转化率小于10%
D.b>0.1a
6.(23-24高二上·四川南充·期中)在恒容密闭容器中充入2 mol CO2和0.5 mol H2发生如下反应: CO2(g)+H2(g) CO(g)+H2O(g) ΔH>0如图所示为该反应正反应的平衡常数K正和逆反应的平衡常数K逆随温度变化的曲线。下列分析正确的是
A.曲线Ⅰ为K逆,曲线Ⅱ为K正
B.T2时,A点正>逆
C.T1时,CO2的平衡转化率为40%
D.其他条件不变,在原平衡基础上再充入2 mol CO2和1 mol H2,达新平衡时CO2转化率将减小
7.(2023·江苏·高考真题)金属硫化物()催化反应,既可以除去天然气中的,又可以获得。下列说法正确的是
A.该反应的
B.该反应的平衡常数
C.题图所示的反应机理中,步骤Ⅰ可理解为中带部分负电荷的S与催化剂中的M之间发生作用
D.该反应中每消耗,转移电子的数目约为
8.(2022·天津·高考真题)向恒温恒容密闭容器中通入2mol 和1mol ,反应达到平衡后,再通入一定量,达到新平衡时,下列有关判断错误的是
A.的平衡浓度增大 B.反应平衡常数增大
C.正向反应速率增大 D.的转化总量增大
9.(2022高三·全国·专题练习)某温度下,反应CH2=CH2(g)+H2O(g)CH3CH2OH(g)在密闭容器中达到平衡,下列说法正确的是
A.增大压强,,平衡常数增大
B.加入催化剂,平衡时的浓度增大
C.恒容下,充入一定量的,平衡向正反应方向移动
D.恒容下,充入一定量的,的平衡转化率增大
10.(2020·海南·高考真题)NO与CO是燃油汽车尾气中的两种有害气体,常温常压下它们之间的反应:
CO(g)+ NO(g)=CO2(g)+N2(g) ΔH= -374.3 kJ·mol-1 K=2.5×1060, 反应速率较小。有关该反应的说法正确的是
A.K很大,NO与CO在排入大气之前就已反应完全
B.增大压强,平衡将向右移动,K> 2.5×1060
C.升高温度,既增大反应速率又增大K
D.选用适宜催化剂可达到尾气排放标准
11.(2023·北京丰台·一模)下列三个化学反应焓变、平衡常数与温度的关系分别如下表所示。下列说法正确的是
化学反应 平衡常数 温度
973K 1173K
① 1.47 2.15
② 2.38 1.67
③ a b
A.1173K时,反应①起始,平衡时约为0.4
B.反应②是吸热反应,
C.反应③达平衡后,升高温度或缩小反应容器的容积平衡逆向移动
D.相同温度下,;
12.(14-15高三下·山东青岛·阶段练习)T℃时,在一固定容积的密闭容器中发生反应: ,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是
A.T℃时,该反应的平衡常数值为4 B.c点没有达到平衡,此时反应向逆向进行
C.若c点为平衡点,则此时容器内的温度高于T℃ D.T℃时,直线cd上的点均为平衡状态
13.(21-22高二上·浙江嘉兴·阶段练习)在可逆反应2SO2+O22SO3的平衡状态下,保持恒温、恒容向容器中加入一定量的O2,下列说法正确的是(K为平衡常数,Qc为浓度商)
A.K不变,QcC.K不变,Qc= K D.K变大, Qc= K
二、解答题,共1小题
14.(2024高三·全国·专题练习)汽车尾气中NO和CO的催化转化是目前化学研究热点。回答下列问题:
(1)已知下列反应的热化学方程式:
①
②
则反应的 ,平衡常数 (用、表示)。
(2)当起始物时,不同条件下达到平衡,设的转化率为,在下、下的关系如图2所示。
①图2中对应等温过程的曲线是 ,判断理由为 。
②M点的分压为 kPa,该温度下此反应的分压平衡常数 。
三、填空题,共4小题
15.(2024高三·全国·专题练习)NO和CO均为汽车尾气的成分,在催化转换器中二者可发生反应减少尾气污染。已知 。
一定温度下,向恒容容器中通入等物质的量的NO和CO气体,测得容器中压强随时间的变化关系如表所示:
t/min 0 1 2 3 4 5
p/kPa 200 185 173 165 160 160
该反应条件下的平衡常数 。
16.(2024高三·全国·专题练习)将SO2转化为SO3是工业上生产硫酸的关键步骤,发生的反应为2SO2(g)+O2(g)2SO3(g) △H=-196 kJ/mol,在450℃、100kPa的恒温恒压条件下,SO3的平衡体积分数随起始时投料的变化如图所示,用平衡压强(平衡压强=该物质的体积分数×总压强)代替平衡浓度,则450℃时,该反应的Kp= 。
17.(2024高三·全国·专题练习)减少排放并实现的有效转化是科研的热点。以下几种为常见的利用方法,回答下列问题:
利用干重整反应不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。该反应一般认为通过如下步骤来实现:
反应iii:主反应
反应iv:副反应
反应iii、iv的平衡常数的随的变化曲线如图所示:
由图可知,代表反应iii的曲线是 (填“”或“”),原因是 ;升高温度,反应iv的平衡常数 (填“增大”“减小”或“不变”)。
18.(2024高三·全国·专题练习)在机动车发动机中,燃料燃烧产生的高温会使空气中的氮气和氧气反应,生成氮氧化物,某些硝酸盐分解,也会产生氮氧化物,已知如下反应:
①
②
实验测得,,为速率常数且只受温度影响。则化学平衡常数K与速率常数的数学关系是 。若将容器的温度改变为时,其,则 (填“>”“<”或“=”)。
四、计算题,共2小题
19.(2024高三·全国·专题练习)“碳达峰·碳中和”是我国社会发展重大战略之一, CH4还原CO2是实现“双碳”经济的有效途径之一,相关的主要反应有:
I:CH4(g) + CO2(g) 2CO(g) + 2H2(g) ΔH = +247 kJ·mol 1
Ⅱ:CO2(g) + H2(g) CO(g) + H2O(g) ΔH = +41 kJ·mol 1
请回答下列问题:
恒温恒压条件下,1mol CH4(g)和1mol CO2 (g)反应达平衡时,CH4(g)的转化率为,H2O (g)的物质的量为bmol,则反应I的平衡常数Kx = (写出含有α、b的计算式;对于反应mA(g) + nB(g)pC(g) + qD(g),,x为物质的量分数)。
20.(2024高三·全国·专题练习)一定条件下,和可以发生如下两个平行反应:
I.
II.
保持温度恒定,向一定体积的密闭容器中按体积比1:3充入和,起始压强为4MPa.发生上述平行反应,达到平衡后压强为2.8MPa.已知达到平衡时的选择性为75%(反应中转化的中生成的百分比)。则:的转化率为 ;该条件下反应II的压强平衡常数为 。(用分压表示,分压=总压×物质的量分数)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.反应②的平衡常数表达式为,A错误;
B.反应的平衡常数应为,B错误;
C.平衡常数只与温度有关,与压强无关,增大压强不变,C错误;
D.根据盖斯定理,可由①×3+②得到,可知该反应的平衡常数,D正确;
故选D。
2.A
【详解】A.10min时反应达到平衡,测得容器内体系的压强减少20%,则平衡时混合气体总物质的量为(0.2+0.2+0.1)mol×(1-20%)=0.4mol,10min内用ClNO(g)表示的平均反应速率v(ClNO)=7.5×10-3mol/(L·min),则平衡时n(ClNO)=7.5×10-3mol/(L min)×10min×2L=0.15mol,设①中反应的NO2为x mol,②中反应的Cl2为ymol,则:,,则0.5x+2y=0.15,(0.2-x+0.2-2y+0.1-y)+0.5x+2y=0.4,联立方程,解得x=0.1、y=0.05,故平衡时NO2的转化率为,A选项正确;
B.由A项分析,平衡后c(NO)=,B选项错误;
C.平衡常数只受温度影响,温度不变,平衡常数不变,则其它条件保持不变,反应在恒压条件下进行,平衡常数K2不变,C选项错误;
D.①2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) △H1<0平衡常数K1;②2NO(g)+Cl2(g) 2ClNO(g) △H2<0平衡常数K2;由盖斯定律可知,由①×2-②可得反应4NO2(g)+2NaC1(s) 2NaNO3(s)+2NO(g)+Cl2(g),则4NO2(g)+2NaC1(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数,D选项错误;
答案选A。
3.D
【详解】A.A点体积小,压强大,反应速率快,故A错误;
B.由题干图像可知,容器的容积依次增大,反应速率依次减小可知,C点未达到平衡状态,使用催化剂可加快反应速率,提高的转化率,故B错误;
C.B点对应的体系为,的平衡转化率为80%,因此平衡常数,故C错误;
D.在恒温恒容下,向A点平衡体系中充入一定量的,等效于加压,平衡逆向移动,的平衡转化率减小,故D正确;
选D。
4.C
【详解】A. ,可知,每生成44g二氧化碳放出34kJ热量,若能测得反应产生22g ,则反应放出的热量为17.0kJ,故A正确;
B. 活性炭是固体,达到平衡后增大活性炭的用量,平衡不移动,故B正确;
C. 1050K前反应末达到平衡状态,随着温度升高,反应速率加快,反应正向进行,在950K~1000K之间,化学反应速率:,故C错误;
D. 在1050K、1.1×106Pa时,NO的转化率为80%,设n(NO)=xmol,消耗的n(NO)=0.8xmol,可逆反应
反应前后气体计量数之和不变,则反应前后气体总物质的量不变,为xmol,p(NO)=×1.1×106Pa=0.22×106Pa,p(N2)=p(CO2)=2p(NO)=2×0.22×106Pa=0.44×106Pa,该反应的平衡常数Kp==4,1050K时,反应的化学平衡常数,故D正确;
故选C。
5.D
【详解】A.①②中反应温度相同,平衡常数K的数值相同,故根据放出的热量值,可知参加反应的为0.1mol,则:
则反应①的平衡常数:0.0023,A错误;
B.①中反应放热0.1akJ,说明10min内X2反应了0.1mol,物质的量浓度改变量为0.1mol·L-1,所以其平均速率为v(X2)=0.01mol·L-1·min-1,B错误;
C.据容器①中数据,可算出X2的平衡转化率为10%,容器②是恒温恒压,容器①是恒温恒容,容器②相当于在容器①的基础上加压,平衡右移,所以X2的转化率大于10%,容器②放出的热量比容器①多,C错误;
D.结合C分析可知,b>0.1a,D正确;
故选D。
6.B
【分析】对于反应CO2(g)+H2(g) CO(g)+H2O(g)ΔH>0,正反应为吸热反应,则升高温度,平衡正向移动,正反应平衡常数增大,由图可知曲线Ⅰ为K正,曲线Ⅱ为K逆,结合外界条件对平衡移动的影响解答该题。
【详解】A.由以上分析可知曲线Ⅰ为K正,曲线Ⅱ为K逆,A错误;
B.T2时,A点K逆<K<K正,则反应正向移动,正>逆,B正确;
C.T1时,K逆=K正,因K逆×K正=1,则K正=1,设转化xmolCO2,三段式分析为:
则=1,x=,CO2的平衡转化率为20%,C错误;
D.其他条件不变,如在原平衡基础上再充入“2mol CO2和1mol H2”,将该充入量改为“2mol CO2和0.5mol H2+0.5mol H2”,若去掉后面的“0.5molH2“,根据等效平衡规律新平衡时的转化率与原平衡相同,平衡后再将后面“0.5molH2”加入,平衡正向移动,CO2转化率将增大,D错误;
故答案为:B。
7.C
【详解】A.左侧反应物气体计量数之和为3,右侧生成物气体计量数之和为5, ,A错误;
B.由方程形式知, ,B错误;
C.由题图知,经过步骤Ⅰ后,中带部分负电荷的S与催化剂中的M之间形成了作用力,C正确;
D.由方程式知,消耗同时生成,转移,数目为,D错误;
故选C。
【点睛】
8.B
【详解】A.平衡后,再通入一定量,平衡正向移动,的平衡浓度增大,A正确;
B.平衡常数是与温度有关的常数,温度不变,平衡常数不变,B错误;
C.通入一定量,反应物浓度增大,正向反应速率增大,C正确;
D.通入一定量,促进二氧化硫的转化,的转化总量增大,D正确;
故选B。
9.C
【详解】A.该反应是一个气体分子数减少的反应,增大压强可以加快化学反应速率,正反应速率增大的幅度大于逆反应的,故v正> v逆,平衡向正反应方向移动,但是因为温度不变,故平衡常数不变,A不正确;
B.催化剂不影响化学平衡状态,因此,加入催化剂不影响平衡时CH3CH2OH(g)的浓度,B不正确;
C.恒容下,充入一定量的H2O(g),H2O(g)的浓度增大,平衡向正反应方向移动,C正确;
D.恒容下,充入一定量的CH2=CH2 (g),平衡向正反应方向移动,但是CH2=CH2 (g)的平衡转化率减小,D不正确;
综上所述,本题选C。
10.D
【详解】A.平衡常数很大,表示该反应所能进行的程度大,由于NO与CO反应速率较小,在排入大气之前没有反应完全,故A错误;
B.平衡常数只与温度有关,增大压强,K不变,故B错误;
C.CO(g)+ NO(g)=CO2(g)+N2(g)正反应放热,升高温度,速率加快,平衡逆向移动,K减小,故C错误;
D.选用适宜催化剂可加快反应速率,使尾气得到净化,达到尾气排放标准,故D正确;
选D。
11.D
【详解】
A.1173K时,反应①起始,,,x≈0.4,平衡时约为0.2,A错误;
B.升温,化学平衡常数减小,说明平衡向逆反应方向移动,所以②的正反应为放热反应,,B错误;
C.根据盖斯定律可知②-①可得③,故,a=1.62,b=0.78,升温,化学平衡常数减小,说明平衡向逆反应方向移动,所以,反应③达平衡后,升高温度平衡逆向移动,但是由于反应两端气体的化学计量数之和相等缩小反应容器的容积化学平衡不移动,C错误;
D.相同温度下,根据盖斯定律可知②-①可得③,故;,D正确;
故选D。
12.C
【详解】A.根据平衡常数的表达式并结合图中曲线可知,,故A错误;
B.c点没有达到平衡,如果达到平衡,应向d点移动,A、B的浓度降低,说明平衡向正反应方向移动,故B错误;
C.如果c点达到平衡,此时的平衡常数小于T℃时的平衡常数,说明平衡向逆反应方向移动,即升高温度,故C正确;
D.平衡常数只受温度的影响,与浓度、压强无关,因此曲线b是平衡线,故D错误;
故选C。
13.A
【详解】当可逆反应2SO2+O2 2SO3达到平衡状态时,保持恒温恒容向容器中加入一定量的O2,氧气的浓度增大,浓度商Qc变小,平衡向右进行,氧气转化率减小,平衡常数只受温度影响,温度不变平衡常数不变;
故选A。
14.(1) -747
(2) a 等温过程增大压强平衡正向移动,增大,与曲线a的变化相符 25 (或//)
【详解】(1)根据盖斯定律,可得反应的;
反应①平衡常数,反应②平衡常数,该反应平衡常数=;
(2)该反应为气体体积减小的反应,温度相同时,增大压强,平衡正向移动,转化率 α(NO) 增大,则曲线a对应等温过程的曲线;
起始物 =1.25 时,假设n(NO)=1.25mol、n(CO)=1mol,M点达到平衡时,的转化率为0.4,消耗,列三段式为
气体总物质的量为,M点的分压为p=;
该温度下此反应的分压平衡常数=(或或或);
故答案为:a;等温过程增大压强平衡正向移动,增大,与曲线a的变化相符;25;(或//)。
15.1.6kPa-1
【详解】设起始投入的的NO和CO气体的物质的量为1mol,可得以下三段式:
,解x=0.4,则该反应条件下的平衡常数Kp=(kPa)-1。
16.0.05kPa-1
【详解】当反应物的投料比等于计量数之比时,生成物的体积分数最大,所以此条件下当时,平衡时SO3的体积分数为40%,则平衡时p(SO3)=40kPa,SO2和O2投料比为2:1;按照2:1的比例反应,所以平衡时二者的物质的量之比仍为2:1,则p(SO2)=40kPa,p(O2)=20kPa,。
17. Q 反应iii的,随温度升高,平衡常数减小,故随的增大而增大 增大
【详解】因为反应ⅲ的,随温度升高,平衡常数减小,故随的增大而增大,对应图中的Q曲线,另一条曲线是反应ⅳ的变化曲线,故,随温度升高平衡常数增大;
18. <
【详解】由反应达到平衡时,正逆反应速率相等可得:,整理可得:,由三段式数据可知,反应的平衡常数,若将容器的温度改变为时,其,则下平衡常数,平衡向逆反应方向移动,该反应为放热反应,升高温度,平衡向逆反应方向移动,则;
19.
【详解】恒温恒压条件下,1mol CH4(g)和1mol CO2 (g)反应达平衡时,CH4(g)的转化率为a,H2O (g)的物质的量为bmol,由三段式分析可知:
平衡时CH4、CO2、CO、H2的物质的量分数分别为:、、、,则反应Ⅰ的平衡常数Kx =。
20. 80% 2.4(MPa)-2
【详解】正反应气体系数和减小,容器内气体压强减小是因为发生反应,列三段式如下: 则求得a=0.6 MPa、b=1.8MPa、x= 0.6MPa、y= 0.6MPa;达到平衡时的选择性为75%,反应使CO2的压强降低=0.2 Mpa、氢气的压强降低0.2MPa、CO的压强增大0.2MPa、H2O的压强增大0.2MPa,容器中CO2的压强为(1-0.6-0.2)=0.2 MPa、H2的压强为(3-1.8-0.2)=1MPa、甲醇的压强为0.6MPa、H2O的压强为(0.6+0.2)=0.8MPa,CO2的转化率为;该条件下反应Ⅱ的压强平衡常数。
答案第1页,共2页
答案第1页,共2页
一、单选题,共13小题
1.(23-24高三上·贵州贵阳·阶段练习)已知在T℃时高炉炼铁可发生如下反应:
① ,平衡常数为;
② ,平衡常数为。
以下说法正确的是
A.反应②的平衡常数表达式为
B.T℃时,反应的平衡常数
C.T℃时增大压强,减小、不变
D.T℃时,反应的平衡常数
2.(2023高三·全国·专题练习)在恒温条件下,向盛有食盐的2L恒容密闭容器中加入0.2molNO2、0.2moINO和0.1molCl2,发生如下两个反应:
①2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) △H1<0 平衡常数K1
②2NO(g)+Cl2(g) 2ClNO(g) △H2<0 平衡常数K2
10分钟时反应达到平衡,测得容器内体系的压强减少20%,10分钟内用ClNO(g)表示的平均反应速率v(ClNO)=7.5×10-3mol/(L·min)。下列说法正确的是
A.平衡时NO2的转化率为50%
B.平衡后c(NO)=2.5×10-2mol·L-1
C.其它条件保持不变,反应在恒压条件下进行,则平衡常数K2增大
D.反应4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数为K-K1
3.(23-24高三上·湖南长沙·阶段练习)是常见的环境污染性气体。一定温度下,向三个容积不等的恒容密闭容器中分别投入,发生反应:。反应相同时间内,三个容器中的转化率如图中A、B、C三点。下列叙述正确的是
A.A点的小于C点的
B.C点加入适当催化剂,不能提高的转化率
C.若B点为平衡点,在该温度下,反应的平衡常数
D.在恒温恒容下,向A点平衡体系中再充入一定量的,与原平衡相比,的平衡转化率减小
4.(23-24高三上·广东汕头·期中)的排放来自汽车尾气,研究利用反应 ,用活性炭可对其进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示。(已知:气体分压=气体总压×物质的量分数),下列有关说法错误的是
A.若能测得反应产生22g ,则反应放出的热量为17.0kJ
B.达到平衡后增大活性炭的用量,平衡不移动
C.在950K~1000K之间,化学反应速率:
D.1050K时,反应的化学平衡常数
5.(23-24高三上·四川遂宁·阶段练习)相同温度下,分别在起始体积均为的两个密闭容器中发生反应: ,实验测得反应的有关数据如下表。
容器 反应条件 起始物质的量/mol 达到平衡所用时间/min 达到平衡过程中的能量变化
X2 Y2 XY3
① 恒容 1 3 0 10 放热0.1akJ
② 恒压 1 3 0 t 放热bkJ
下列叙述正确的是
A.反应②的平衡常数K约为0.0046
B.①中:从开始至10min内的平均反应速率v(X2)=0.1mol-1·L·min-1
C.②中:X2的平衡转化率小于10%
D.b>0.1a
6.(23-24高二上·四川南充·期中)在恒容密闭容器中充入2 mol CO2和0.5 mol H2发生如下反应: CO2(g)+H2(g) CO(g)+H2O(g) ΔH>0如图所示为该反应正反应的平衡常数K正和逆反应的平衡常数K逆随温度变化的曲线。下列分析正确的是
A.曲线Ⅰ为K逆,曲线Ⅱ为K正
B.T2时,A点正>逆
C.T1时,CO2的平衡转化率为40%
D.其他条件不变,在原平衡基础上再充入2 mol CO2和1 mol H2,达新平衡时CO2转化率将减小
7.(2023·江苏·高考真题)金属硫化物()催化反应,既可以除去天然气中的,又可以获得。下列说法正确的是
A.该反应的
B.该反应的平衡常数
C.题图所示的反应机理中,步骤Ⅰ可理解为中带部分负电荷的S与催化剂中的M之间发生作用
D.该反应中每消耗,转移电子的数目约为
8.(2022·天津·高考真题)向恒温恒容密闭容器中通入2mol 和1mol ,反应达到平衡后,再通入一定量,达到新平衡时,下列有关判断错误的是
A.的平衡浓度增大 B.反应平衡常数增大
C.正向反应速率增大 D.的转化总量增大
9.(2022高三·全国·专题练习)某温度下,反应CH2=CH2(g)+H2O(g)CH3CH2OH(g)在密闭容器中达到平衡,下列说法正确的是
A.增大压强,,平衡常数增大
B.加入催化剂,平衡时的浓度增大
C.恒容下,充入一定量的,平衡向正反应方向移动
D.恒容下,充入一定量的,的平衡转化率增大
10.(2020·海南·高考真题)NO与CO是燃油汽车尾气中的两种有害气体,常温常压下它们之间的反应:
CO(g)+ NO(g)=CO2(g)+N2(g) ΔH= -374.3 kJ·mol-1 K=2.5×1060, 反应速率较小。有关该反应的说法正确的是
A.K很大,NO与CO在排入大气之前就已反应完全
B.增大压强,平衡将向右移动,K> 2.5×1060
C.升高温度,既增大反应速率又增大K
D.选用适宜催化剂可达到尾气排放标准
11.(2023·北京丰台·一模)下列三个化学反应焓变、平衡常数与温度的关系分别如下表所示。下列说法正确的是
化学反应 平衡常数 温度
973K 1173K
① 1.47 2.15
② 2.38 1.67
③ a b
A.1173K时,反应①起始,平衡时约为0.4
B.反应②是吸热反应,
C.反应③达平衡后,升高温度或缩小反应容器的容积平衡逆向移动
D.相同温度下,;
12.(14-15高三下·山东青岛·阶段练习)T℃时,在一固定容积的密闭容器中发生反应: ,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是
A.T℃时,该反应的平衡常数值为4 B.c点没有达到平衡,此时反应向逆向进行
C.若c点为平衡点,则此时容器内的温度高于T℃ D.T℃时,直线cd上的点均为平衡状态
13.(21-22高二上·浙江嘉兴·阶段练习)在可逆反应2SO2+O22SO3的平衡状态下,保持恒温、恒容向容器中加入一定量的O2,下列说法正确的是(K为平衡常数,Qc为浓度商)
A.K不变,Qc
二、解答题,共1小题
14.(2024高三·全国·专题练习)汽车尾气中NO和CO的催化转化是目前化学研究热点。回答下列问题:
(1)已知下列反应的热化学方程式:
①
②
则反应的 ,平衡常数 (用、表示)。
(2)当起始物时,不同条件下达到平衡,设的转化率为,在下、下的关系如图2所示。
①图2中对应等温过程的曲线是 ,判断理由为 。
②M点的分压为 kPa,该温度下此反应的分压平衡常数 。
三、填空题,共4小题
15.(2024高三·全国·专题练习)NO和CO均为汽车尾气的成分,在催化转换器中二者可发生反应减少尾气污染。已知 。
一定温度下,向恒容容器中通入等物质的量的NO和CO气体,测得容器中压强随时间的变化关系如表所示:
t/min 0 1 2 3 4 5
p/kPa 200 185 173 165 160 160
该反应条件下的平衡常数 。
16.(2024高三·全国·专题练习)将SO2转化为SO3是工业上生产硫酸的关键步骤,发生的反应为2SO2(g)+O2(g)2SO3(g) △H=-196 kJ/mol,在450℃、100kPa的恒温恒压条件下,SO3的平衡体积分数随起始时投料的变化如图所示,用平衡压强(平衡压强=该物质的体积分数×总压强)代替平衡浓度,则450℃时,该反应的Kp= 。
17.(2024高三·全国·专题练习)减少排放并实现的有效转化是科研的热点。以下几种为常见的利用方法,回答下列问题:
利用干重整反应不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。该反应一般认为通过如下步骤来实现:
反应iii:主反应
反应iv:副反应
反应iii、iv的平衡常数的随的变化曲线如图所示:
由图可知,代表反应iii的曲线是 (填“”或“”),原因是 ;升高温度,反应iv的平衡常数 (填“增大”“减小”或“不变”)。
18.(2024高三·全国·专题练习)在机动车发动机中,燃料燃烧产生的高温会使空气中的氮气和氧气反应,生成氮氧化物,某些硝酸盐分解,也会产生氮氧化物,已知如下反应:
①
②
实验测得,,为速率常数且只受温度影响。则化学平衡常数K与速率常数的数学关系是 。若将容器的温度改变为时,其,则 (填“>”“<”或“=”)。
四、计算题,共2小题
19.(2024高三·全国·专题练习)“碳达峰·碳中和”是我国社会发展重大战略之一, CH4还原CO2是实现“双碳”经济的有效途径之一,相关的主要反应有:
I:CH4(g) + CO2(g) 2CO(g) + 2H2(g) ΔH = +247 kJ·mol 1
Ⅱ:CO2(g) + H2(g) CO(g) + H2O(g) ΔH = +41 kJ·mol 1
请回答下列问题:
恒温恒压条件下,1mol CH4(g)和1mol CO2 (g)反应达平衡时,CH4(g)的转化率为,H2O (g)的物质的量为bmol,则反应I的平衡常数Kx = (写出含有α、b的计算式;对于反应mA(g) + nB(g)pC(g) + qD(g),,x为物质的量分数)。
20.(2024高三·全国·专题练习)一定条件下,和可以发生如下两个平行反应:
I.
II.
保持温度恒定,向一定体积的密闭容器中按体积比1:3充入和,起始压强为4MPa.发生上述平行反应,达到平衡后压强为2.8MPa.已知达到平衡时的选择性为75%(反应中转化的中生成的百分比)。则:的转化率为 ;该条件下反应II的压强平衡常数为 。(用分压表示,分压=总压×物质的量分数)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.反应②的平衡常数表达式为,A错误;
B.反应的平衡常数应为,B错误;
C.平衡常数只与温度有关,与压强无关,增大压强不变,C错误;
D.根据盖斯定理,可由①×3+②得到,可知该反应的平衡常数,D正确;
故选D。
2.A
【详解】A.10min时反应达到平衡,测得容器内体系的压强减少20%,则平衡时混合气体总物质的量为(0.2+0.2+0.1)mol×(1-20%)=0.4mol,10min内用ClNO(g)表示的平均反应速率v(ClNO)=7.5×10-3mol/(L·min),则平衡时n(ClNO)=7.5×10-3mol/(L min)×10min×2L=0.15mol,设①中反应的NO2为x mol,②中反应的Cl2为ymol,则:,,则0.5x+2y=0.15,(0.2-x+0.2-2y+0.1-y)+0.5x+2y=0.4,联立方程,解得x=0.1、y=0.05,故平衡时NO2的转化率为,A选项正确;
B.由A项分析,平衡后c(NO)=,B选项错误;
C.平衡常数只受温度影响,温度不变,平衡常数不变,则其它条件保持不变,反应在恒压条件下进行,平衡常数K2不变,C选项错误;
D.①2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) △H1<0平衡常数K1;②2NO(g)+Cl2(g) 2ClNO(g) △H2<0平衡常数K2;由盖斯定律可知,由①×2-②可得反应4NO2(g)+2NaC1(s) 2NaNO3(s)+2NO(g)+Cl2(g),则4NO2(g)+2NaC1(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数,D选项错误;
答案选A。
3.D
【详解】A.A点体积小,压强大,反应速率快,故A错误;
B.由题干图像可知,容器的容积依次增大,反应速率依次减小可知,C点未达到平衡状态,使用催化剂可加快反应速率,提高的转化率,故B错误;
C.B点对应的体系为,的平衡转化率为80%,因此平衡常数,故C错误;
D.在恒温恒容下,向A点平衡体系中充入一定量的,等效于加压,平衡逆向移动,的平衡转化率减小,故D正确;
选D。
4.C
【详解】A. ,可知,每生成44g二氧化碳放出34kJ热量,若能测得反应产生22g ,则反应放出的热量为17.0kJ,故A正确;
B. 活性炭是固体,达到平衡后增大活性炭的用量,平衡不移动,故B正确;
C. 1050K前反应末达到平衡状态,随着温度升高,反应速率加快,反应正向进行,在950K~1000K之间,化学反应速率:,故C错误;
D. 在1050K、1.1×106Pa时,NO的转化率为80%,设n(NO)=xmol,消耗的n(NO)=0.8xmol,可逆反应
反应前后气体计量数之和不变,则反应前后气体总物质的量不变,为xmol,p(NO)=×1.1×106Pa=0.22×106Pa,p(N2)=p(CO2)=2p(NO)=2×0.22×106Pa=0.44×106Pa,该反应的平衡常数Kp==4,1050K时,反应的化学平衡常数,故D正确;
故选C。
5.D
【详解】A.①②中反应温度相同,平衡常数K的数值相同,故根据放出的热量值,可知参加反应的为0.1mol,则:
则反应①的平衡常数:0.0023,A错误;
B.①中反应放热0.1akJ,说明10min内X2反应了0.1mol,物质的量浓度改变量为0.1mol·L-1,所以其平均速率为v(X2)=0.01mol·L-1·min-1,B错误;
C.据容器①中数据,可算出X2的平衡转化率为10%,容器②是恒温恒压,容器①是恒温恒容,容器②相当于在容器①的基础上加压,平衡右移,所以X2的转化率大于10%,容器②放出的热量比容器①多,C错误;
D.结合C分析可知,b>0.1a,D正确;
故选D。
6.B
【分析】对于反应CO2(g)+H2(g) CO(g)+H2O(g)ΔH>0,正反应为吸热反应,则升高温度,平衡正向移动,正反应平衡常数增大,由图可知曲线Ⅰ为K正,曲线Ⅱ为K逆,结合外界条件对平衡移动的影响解答该题。
【详解】A.由以上分析可知曲线Ⅰ为K正,曲线Ⅱ为K逆,A错误;
B.T2时,A点K逆<K<K正,则反应正向移动,正>逆,B正确;
C.T1时,K逆=K正,因K逆×K正=1,则K正=1,设转化xmolCO2,三段式分析为:
则=1,x=,CO2的平衡转化率为20%,C错误;
D.其他条件不变,如在原平衡基础上再充入“2mol CO2和1mol H2”,将该充入量改为“2mol CO2和0.5mol H2+0.5mol H2”,若去掉后面的“0.5molH2“,根据等效平衡规律新平衡时的转化率与原平衡相同,平衡后再将后面“0.5molH2”加入,平衡正向移动,CO2转化率将增大,D错误;
故答案为:B。
7.C
【详解】A.左侧反应物气体计量数之和为3,右侧生成物气体计量数之和为5, ,A错误;
B.由方程形式知, ,B错误;
C.由题图知,经过步骤Ⅰ后,中带部分负电荷的S与催化剂中的M之间形成了作用力,C正确;
D.由方程式知,消耗同时生成,转移,数目为,D错误;
故选C。
【点睛】
8.B
【详解】A.平衡后,再通入一定量,平衡正向移动,的平衡浓度增大,A正确;
B.平衡常数是与温度有关的常数,温度不变,平衡常数不变,B错误;
C.通入一定量,反应物浓度增大,正向反应速率增大,C正确;
D.通入一定量,促进二氧化硫的转化,的转化总量增大,D正确;
故选B。
9.C
【详解】A.该反应是一个气体分子数减少的反应,增大压强可以加快化学反应速率,正反应速率增大的幅度大于逆反应的,故v正> v逆,平衡向正反应方向移动,但是因为温度不变,故平衡常数不变,A不正确;
B.催化剂不影响化学平衡状态,因此,加入催化剂不影响平衡时CH3CH2OH(g)的浓度,B不正确;
C.恒容下,充入一定量的H2O(g),H2O(g)的浓度增大,平衡向正反应方向移动,C正确;
D.恒容下,充入一定量的CH2=CH2 (g),平衡向正反应方向移动,但是CH2=CH2 (g)的平衡转化率减小,D不正确;
综上所述,本题选C。
10.D
【详解】A.平衡常数很大,表示该反应所能进行的程度大,由于NO与CO反应速率较小,在排入大气之前没有反应完全,故A错误;
B.平衡常数只与温度有关,增大压强,K不变,故B错误;
C.CO(g)+ NO(g)=CO2(g)+N2(g)正反应放热,升高温度,速率加快,平衡逆向移动,K减小,故C错误;
D.选用适宜催化剂可加快反应速率,使尾气得到净化,达到尾气排放标准,故D正确;
选D。
11.D
【详解】
A.1173K时,反应①起始,,,x≈0.4,平衡时约为0.2,A错误;
B.升温,化学平衡常数减小,说明平衡向逆反应方向移动,所以②的正反应为放热反应,,B错误;
C.根据盖斯定律可知②-①可得③,故,a=1.62,b=0.78,升温,化学平衡常数减小,说明平衡向逆反应方向移动,所以,反应③达平衡后,升高温度平衡逆向移动,但是由于反应两端气体的化学计量数之和相等缩小反应容器的容积化学平衡不移动,C错误;
D.相同温度下,根据盖斯定律可知②-①可得③,故;,D正确;
故选D。
12.C
【详解】A.根据平衡常数的表达式并结合图中曲线可知,,故A错误;
B.c点没有达到平衡,如果达到平衡,应向d点移动,A、B的浓度降低,说明平衡向正反应方向移动,故B错误;
C.如果c点达到平衡,此时的平衡常数小于T℃时的平衡常数,说明平衡向逆反应方向移动,即升高温度,故C正确;
D.平衡常数只受温度的影响,与浓度、压强无关,因此曲线b是平衡线,故D错误;
故选C。
13.A
【详解】当可逆反应2SO2+O2 2SO3达到平衡状态时,保持恒温恒容向容器中加入一定量的O2,氧气的浓度增大,浓度商Qc变小,平衡向右进行,氧气转化率减小,平衡常数只受温度影响,温度不变平衡常数不变;
故选A。
14.(1) -747
(2) a 等温过程增大压强平衡正向移动,增大,与曲线a的变化相符 25 (或//)
【详解】(1)根据盖斯定律,可得反应的;
反应①平衡常数,反应②平衡常数,该反应平衡常数=;
(2)该反应为气体体积减小的反应,温度相同时,增大压强,平衡正向移动,转化率 α(NO) 增大,则曲线a对应等温过程的曲线;
起始物 =1.25 时,假设n(NO)=1.25mol、n(CO)=1mol,M点达到平衡时,的转化率为0.4,消耗,列三段式为
气体总物质的量为,M点的分压为p=;
该温度下此反应的分压平衡常数=(或或或);
故答案为:a;等温过程增大压强平衡正向移动,增大,与曲线a的变化相符;25;(或//)。
15.1.6kPa-1
【详解】设起始投入的的NO和CO气体的物质的量为1mol,可得以下三段式:
,解x=0.4,则该反应条件下的平衡常数Kp=(kPa)-1。
16.0.05kPa-1
【详解】当反应物的投料比等于计量数之比时,生成物的体积分数最大,所以此条件下当时,平衡时SO3的体积分数为40%,则平衡时p(SO3)=40kPa,SO2和O2投料比为2:1;按照2:1的比例反应,所以平衡时二者的物质的量之比仍为2:1,则p(SO2)=40kPa,p(O2)=20kPa,。
17. Q 反应iii的,随温度升高,平衡常数减小,故随的增大而增大 增大
【详解】因为反应ⅲ的,随温度升高,平衡常数减小,故随的增大而增大,对应图中的Q曲线,另一条曲线是反应ⅳ的变化曲线,故,随温度升高平衡常数增大;
18. <
【详解】由反应达到平衡时,正逆反应速率相等可得:,整理可得:,由三段式数据可知,反应的平衡常数,若将容器的温度改变为时,其,则下平衡常数,平衡向逆反应方向移动,该反应为放热反应,升高温度,平衡向逆反应方向移动,则;
19.
【详解】恒温恒压条件下,1mol CH4(g)和1mol CO2 (g)反应达平衡时,CH4(g)的转化率为a,H2O (g)的物质的量为bmol,由三段式分析可知:
平衡时CH4、CO2、CO、H2的物质的量分数分别为:、、、,则反应Ⅰ的平衡常数Kx =。
20. 80% 2.4(MPa)-2
【详解】正反应气体系数和减小,容器内气体压强减小是因为发生反应,列三段式如下: 则求得a=0.6 MPa、b=1.8MPa、x= 0.6MPa、y= 0.6MPa;达到平衡时的选择性为75%,反应使CO2的压强降低=0.2 Mpa、氢气的压强降低0.2MPa、CO的压强增大0.2MPa、H2O的压强增大0.2MPa,容器中CO2的压强为(1-0.6-0.2)=0.2 MPa、H2的压强为(3-1.8-0.2)=1MPa、甲醇的压强为0.6MPa、H2O的压强为(0.6+0.2)=0.8MPa,CO2的转化率为;该条件下反应Ⅱ的压强平衡常数。
答案第1页,共2页
答案第1页,共2页
同课章节目录
