2024年高考化学二轮复习回归基础训练专题15沉淀溶解平衡及图分析(含解析)
文档属性
| 名称 | 2024年高考化学二轮复习回归基础训练专题15沉淀溶解平衡及图分析(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-14 08:54:01 | ||
图片预览



文档简介
2024年高考化学二轮复习回归基础训练专题15沉淀溶解平衡及图分析
一、单选题,共19小题
1.(21-22高二下·河南周口·阶段练习)如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,在T1温度下,下列说法不正确的是
A.加入Na2SO4可使溶液由a点变到b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
2.(2023·海南海口·模拟预测)已知:向难溶电解质饱和溶液中加入与该电解质没有相同离子的强电解质时,使难溶物溶解度增大的效应称为盐效应。常温下,在含大量BaSO4固体的浊液中加入0.01mol下列物质(忽略体积变化),溶液中c(Ba2+)由大到小的排序正确的是
①BaSO4 ②Na2SO4 ③KNO3
A.②①③ B.③②① C.③①② D.①③②
3.(23-24高二上·全国·课时练习)将浓盐酸加到NaCl饱和溶液中,会析出NaCl晶体,对这种现象正确的解释是
A.由于c平(Cl-)增加,使溶液中c平(Na+)·c平(Cl-)>Ksp(NaCl),故产生NaCl晶体
B.HCl是强酸,所以它能使NaCl沉淀出来
C.由于c平(Cl-)增加,使NaCl的溶解平衡向析出NaCl的方向移动,故有NaCl沉淀析出
D.酸的存在,降低了盐的溶解度
4.(21-22高二上·湖南·期中)下列有关沉淀溶解平衡的说法中错误的是
A.的溶度积常数表达式
B.难溶于水,溶液中没有和SO
C.升高温度,的溶解度增大
D.向悬浊液中加入固体,溶解的量减少
5.(23-24高三上·湖北·期末)下列实验方案中,能达到实验目的的是
选项 实验方案 实验目的
A 向含有苯和苯酚的混合溶液中滴入浓溴水,然后过滤 除去苯中的苯酚
B 向溶液中通入少量 证明氧化性:
C 向盛有2mL0.1mol/L的溶液中滴加2滴0.1mol/L的NaCl溶液,产生白色沉淀,再向其中滴加4滴0.1mol/L的KI溶液,有黄色沉淀生成 证明:
D 取2mL0.5mol/L的溶液于试管中,加热后溶液颜色发生变化 探究温度对化学平衡的影响
A.A B.B C.C D.D
6.(17-18高二上·吉林长春·期末)常温下几种难溶电解质的溶度积如下表所示:
物质名称 硫化亚铁 硫化铜 硫化锌
溶度积 6.3×10-18 6.3×10-36 1.6×10-24
向含有等物质的量浓度的FeCl2、CuSO4、ZnSO4混合溶液中滴加0.01 mol·L-1 Na2S液时,Fe2+、Cu2+、Zn2+沉淀的先后顺序为
A.Fe2+、Zn2+、Cu2+ B.Cu2+、Zn2+、Fe2+
C.Zn2+、Fe2+、Cu2+ D.Cu2+、Fe2+、Zn2+
7.(23-24高三上·宁夏银川·阶段练习)下列实验目的对应的实验方案设计、现象和结论都正确的是
选项 实验目的 实验方案设计 现象和结论
A 探究CH3COOH与HCl酸性的强弱 用pH计测量酸酸、盐酸的pH,比较溶液pH大小 盐酸的pH比醋酸小,则CH3COOH是弱酸
B 探究Cu(OH)2和Mg(OH)2溶度积的大小 向氢氧化钠溶液中先加入少量MgCl2溶液,充分反应后再加入少量CuSO4溶液 先产生白色沉淀,后产生蓝色沉淀,说明Cu(OH)2比Mg(OH)2的溶度积小
C 探究Fe2+有还原性 向盛有FeSO4溶液的试管中滴加几滴KSCN溶液,振荡,再滴加几滴新制氯水,观察溶液颜色变化 滴入KSCN溶液时,无明显变化,滴入新制氯水时溶液变血红色,Fe2+具有还原性
D 证明:非金属性:Cl>C>Si 锥形瓶中有气体产生,烧杯中液体变浑浊
A.A B.B C.C D.D
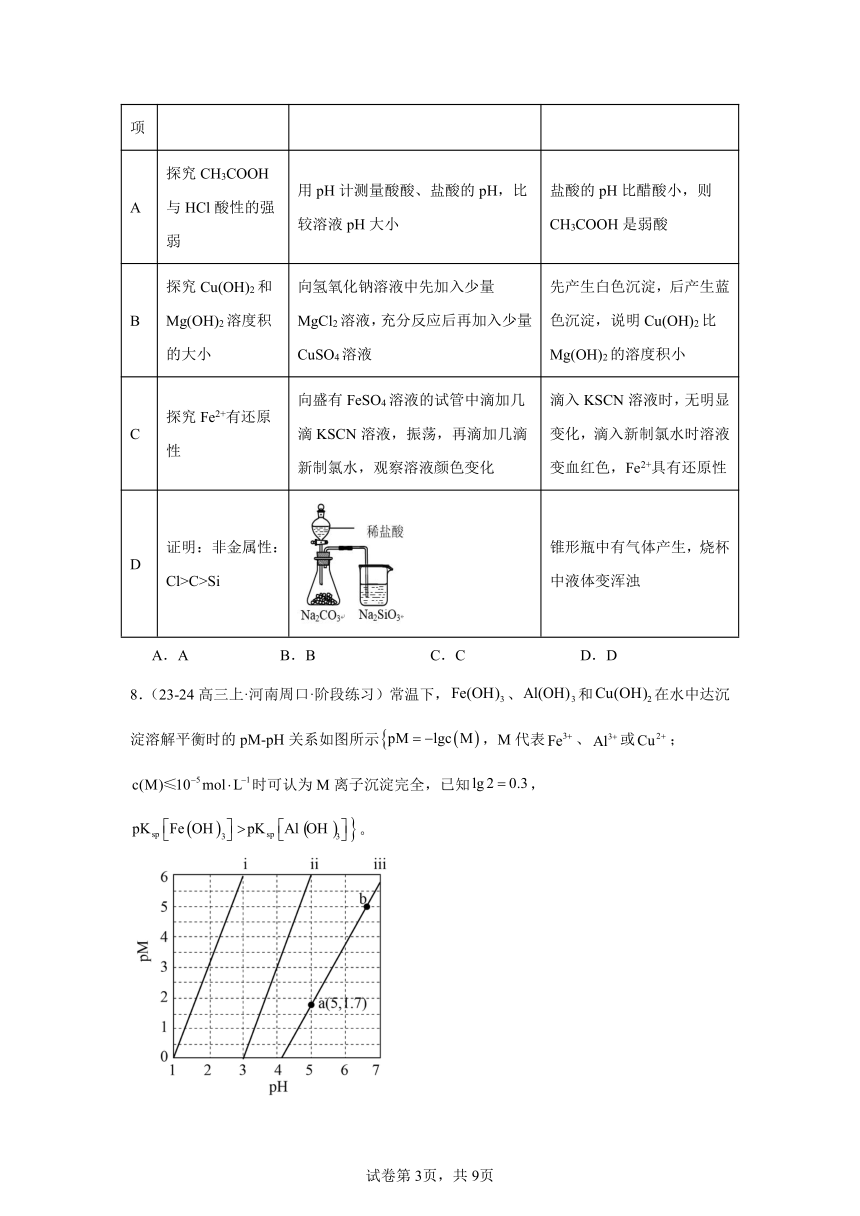
8.(23-24高三上·河南周口·阶段练习)常温下,、和在水中达沉淀溶解平衡时的pM-pH关系如图所示,M代表、或;时可认为M离子沉淀完全,已知,。
下列叙述正确的是
A.ⅰ曲线代表的是
B.a、b两点对应物质的和溶解度均相同
C.、的混合溶液中时二者能同时沉淀
D.“沉铜”时,若将pH从5.0提高到5.5,则铜损失的量降低至原来的10%
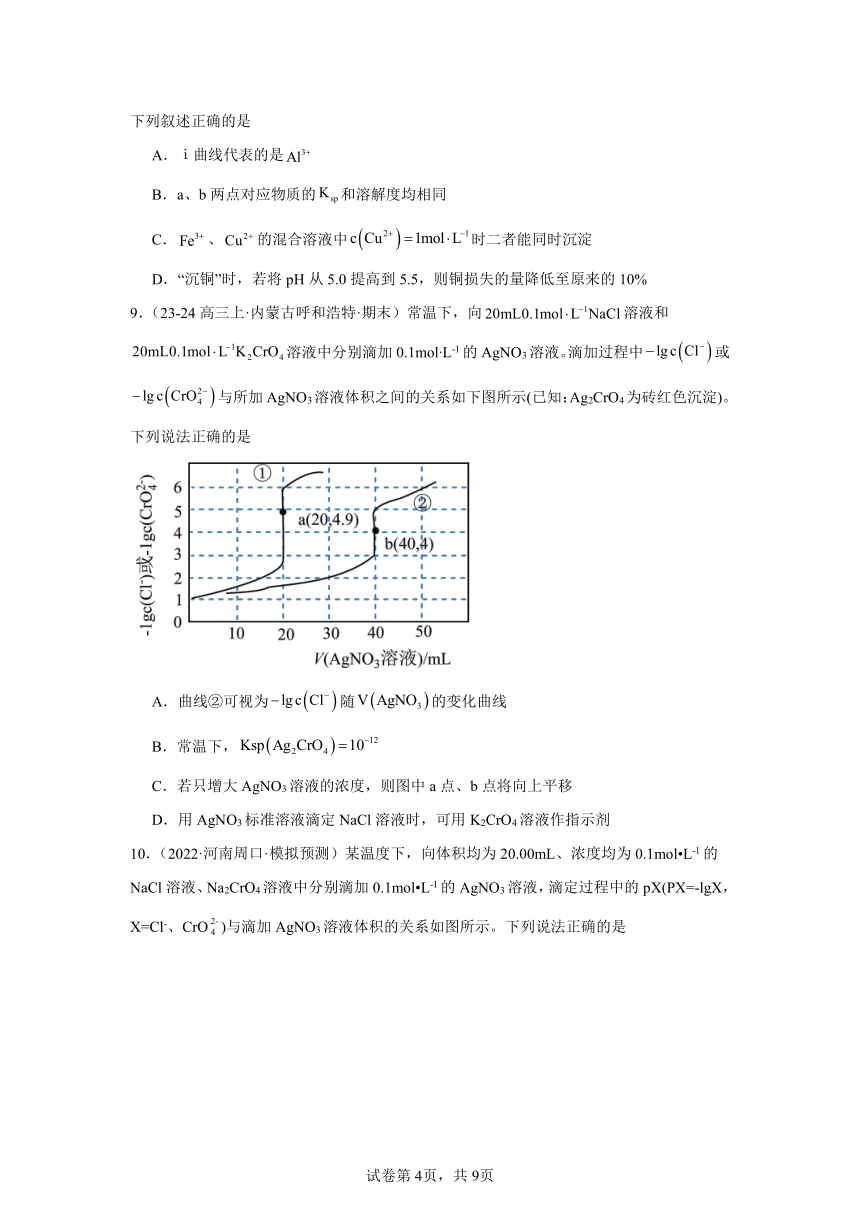
9.(23-24高三上·内蒙古呼和浩特·期末)常温下,向溶液和溶液中分别滴加0.1mol L-1的AgNO3溶液。滴加过程中或与所加AgNO3溶液体积之间的关系如下图所示(已知:Ag2CrO4为砖红色沉淀)。下列说法正确的是
A.曲线②可视为随的变化曲线
B.常温下,
C.若只增大AgNO3溶液的浓度,则图中a点、b点将向上平移
D.用AgNO3标准溶液滴定NaCl溶液时,可用K2CrO4溶液作指示剂
10.(2022·河南周口·模拟预测)某温度下,向体积均为20.00mL、浓度均为0.1mol L-1的NaCl溶液、Na2CrO4溶液中分别滴加0.1mol L-1的AgNO3溶液,滴定过程中的pX(PX=-lgX,X=Cl-、CrO)与滴加AgNO3溶液体积的关系如图所示。下列说法正确的是
A.曲线II表示AgNO3溶液滴定NaCl溶液的过程
B.Ksp(Ag2CrO4)=10-2b
C.其他条件不变,如果NaCl溶液浓度改为0.05mol L-1,则滴定终点向上移动
D.若a=5 b=4,则用AgNO3标准液滴定NaCl时可用K2CrO4溶液做指示剂
11.(2023·江苏·高考真题)室温下,用含少量的溶液制备的过程如题图所示。已知,。下列说法正确的是
A.溶液中:
B.“除镁”得到的上层清液中:
C.溶液中:
D.“沉锰”后的滤液中:
12.(2023·湖南·高考真题)处理某铜冶金污水(含)的部分流程如下:
已知:①溶液中金属离子开始沉淀和完全沉淀的如下表所示:
物质
开始沉淀 1.9 4.2 6.2 3.5
完全沉淀 3.2 6.7 8.2 4.6
②。
下列说法错误的是
A.“沉渣Ⅰ”中含有和
B.溶液呈碱性,其主要原因是
C.“沉淀池Ⅱ”中,当和完全沉淀时,溶液中
D.“出水”经阴离子交换树脂软化处理后,可用作工业冷却循环用水
13.(2022高三·全国·专题练习)某小组模拟成垢-除垢过程如图。
100mL0.1mol L-1CaCl2水溶液……
忽略体积变化,且步骤②中反应完全。下列说法正确的是
A.经过步骤①,溶液中c(Ca2+)+c(Na+)=c(Cl-)
B.经过步骤②,溶液中c(Na+)=4c(SO)
C.经过步骤②,溶液中c(Cl-)=c(CO)+c(HCO)+c(H2CO3)
D.经过步骤③,溶液中c(CH3COOH)+c(CH3COO-)=c(Cl-)
14.(2022高三·全国·专题练习)向AgCl浊液中滴加氨水后可得到澄清溶液,继续滴加浓硝酸后又有沉淀生成。经查资料得知:Ag++2NH3·H2OAg(NH3)+2H2O。下列分析不正确的是
A.浊液中存在沉淀溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq)
B.实验可以证明NH3结合Ag+能力比Cl-强
C.实验表明实验室可用氨水洗涤银镜反应后的试管
D.由资料信息可推知:加浓硝酸后生成的沉淀为AgCl
15.(2023·浙江·三模)都是重要的化工原料,已知:难溶于冷水,易溶于热水,﹔,,20℃时,在不同浓度盐酸中的最大溶解量如图所示下列说法正确的是
A.盐酸浓度越小,越小
B.x、y两点对应的溶液中相等
C.PbCl2和盐酸混合液中加入稀硫酸后得到,当时,为
D.当盐酸浓度小于时,随着浓度的增大,溶解量减小是因为浓度增大使溶解平衡逆向移动
16.(2023高三·全国·专题练习)已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入400mL0.01mol·L-1Na2SO4溶液,下列叙述正确的是
A.溶液中析出CaSO4固体沉淀,最终溶液中[]比原来的小
B.溶液中无沉淀析出,溶液中[Ca2+]、[]都变小
C.溶液中析出CaSO4固体沉淀,溶液中[Ca2+]、[]都变小
D.溶液中无沉淀析出,但最终溶液中[]比原来的大
17.(23-24高三上·山东济宁·期末)利用平衡移动原理,分析一定温度下在不同的体系中的可能产物。已知:图1中曲线表示体系中各含碳粒子的与的关系;图2中曲线Ⅰ的离子浓度关系符合;曲线Ⅱ的离子浓度关系符合[起始,不同下含碳粒子的浓度由图1得到]。
下列说法错误的是
A.由图1,时,
B.图2中,初始状态,平衡后溶液中存在:
C.图1和图2,初始状态,发生反应:
D.沉淀制备时,选用溶液比同浓度的产品纯度高
18.(23-24高三上·江苏扬州·期末)碳酸(H2CO3)是二元弱酸。某小组做如下两组实验:
实验I:往20mL0.1mol·L 1H2CO3溶液中滴加0.1mol·L 1氨水。
实验Ⅱ:往20mL0.1mol·L 1NaHCO3溶液中滴加0.1mol·L 1CaCl2溶液。
[已知:Ka1(H2CO3)=4.5×10 7,Ka2(H2CO3)=5.6×10 11,Kb(NH3·H2O)=1.8×10-5,Ksp(CaCO3)=3.6×10 9,溶液混合后体积变化忽略不计],下列说法正确的是
A.实验I中V(氨水)=20mL时,存在c(H2CO3)<c(CO)+c(NH3·H2O)
B.实验I中pH=8时,存在c(H2CO3)>c(CO)
C.实验Ⅱ中V(CaCl2)=10mL时,发生反应HCO+Ca2+=CaCO3↓+H+
D.实验Ⅱ中V(CaCl2)=80mL时,沉淀后的上层清液中:c(Ca2+)c(CO)>Ksp(CaCO3)
19.(23-24高三上·四川成都·阶段练习)常温下,用0.1000mol/L AgNO3标准溶液(pH≈5)分别滴定20.00 mL 0.1000mol/L的NaCl溶液和NaBr溶液,混合溶液的pAg[定义为pAg= -lgc(Ag+)]与AgNO3溶液体积的变化关系如图所示。下列说法不正确的是
A.常温时溶度积常数:Ksp(AgCl)>Ksp(AgBr)
B.相同实验条件下,若改用10.00 mL 0.2000mol/L NaCl溶液,则b点向a点移动
C.NaBr溶液在c点时:c(Ag+)+c(H+)=c(Br-)+c(OH-)
D.NaCl溶液在d点时:c()>c(Na+)>c(Ag+)>c(Cl-)>c(H+)
二、计算题,共1小题
20.(2023高三·全国·专题练习)取5 mL 0.002 mol·L-1 BaCl2与等体积的0.02 mol·L-1 Na2SO4的混合,是否有沉淀产生?若有,计算Ba2+是否沉淀完全。(该温度下BaSO4的Ksp=1.1×10-10)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.硫酸钡溶液中存在着溶解平衡,a点在平衡曲线上,加入Na2SO4,会增大c(SO),平衡左移,c(Ba2+)应降低,故A正确;
B.在曲线上方区域(不含曲线)任意一点时,Qc>Ksp,溶液过饱和,有沉淀析出,故B正确;
C.d点时溶液不饱和,蒸发溶剂水,c(SO)、c(Ba2+)均增大,所以可能使溶液变饱和、由d点变为曲线上a、b之间的某一点(不含a、b),故C正确;
D.升高温度, 促进溶解平衡右移,c(SO)、c(Ba2+)均增大,不会使溶液由b点变为d点,故D错误;
本题选D。
2.C
【详解】在含大量BaSO4固体的浊液中加入0.01mol①BaSO4时,对BaSO4的沉淀溶解平衡不产生任何影响,c(Ba2+)不变;加入0.01mol②Na2SO4时,增大了溶液中的c(),使BaSO4的沉淀溶解平衡逆向移动,c(Ba2+)减小;加入0.01mol③KNO3时,发生盐效应,使BaSO4的溶解度增大,从而使c(Ba2+)增大。综合以上分析,溶液中c(Ba2+)由大到小的排序③①②,故选C。
3.C
【详解】A.Ksp是针对难溶物的溶度积来谈的,NaCl是易溶于水的盐,不存在Ksp,故A错误;
B.NaCl沉淀出来与HCl是强酸无直接关系,故B错误;
C.加入盐酸,则c平(Cl-)增加,使NaCl的溶解平衡向析出NaCl的方向移动,故有NaCl沉淀析出,故C正确;
D.盐的溶解度是固定的,盐酸的存在,只是减少了饱和溶液中氯化钠的量,可能其余的酸不会减少饱和氯化钠溶解的量,故D错误。
综上所述,答案为C。
4.B
【详解】A.BaSO3难溶于水,悬浊液中存在BaSO3(s)Ba2+(aq)+SO(aq),根据溶度积数学表达式,推出Ksp=c(Ba2+)×c(SO),故A说法正确;
B.BaSO3虽难溶于水,BaSO3在水中溶解度较小,但溶液中有极少量的Ba2+和SO,故B说法错误;
C.多数物质的溶解度随着温度升高而升高,升高温度,BaSO3的溶解度增大,故C说法正确;
D.BaSO3悬浊液中存在BaSO3(s)Ba2+(aq)+SO(aq),加入Na2SO3固体,溶液中c(SO)增大,c(Ba2+)减少,BaSO3溶解的量减少,故D说法正确;
答案为B。
5.D
【详解】A.苯酚与溴水反应生成2,4,6-三溴苯酚,仍然与苯互溶,无法去除,故A不符合题意;
B.向溶液中通入少量,由于还原性I->Fe2+,故直接氧化I-,不能证明氧化性:,故B不符合题意;
C.硝酸银过量时,均为沉淀生成,不能比较Ksp的大小,故C不符合题意;
D.溶液中存在,加热平衡移动,溶液颜色变化,可探究温度化学平衡的影响,故D符合题意;
故答案选D。
6.B
【详解】等物质的量浓度的FeCl2、CuSO4、ZnSO4混合溶液中滴加0.01 mol·L-1 Na2S液时,哪种离子需要的硫离子浓度小,哪种金属离子先沉淀,又因为FeS、CuS、ZnS化学式相似,Fe2+、Cu2+、Zn2+离子浓度相等,KSP越小的,需要硫离子浓度越小就先沉淀。根据表中KSP大小,可得出离子沉淀的先后顺序为:Cu2+、Zn2+、Fe2+。
故答案为:B。
7.C
【详解】A.没有说明两份溶液的浓度,所以无法根据pH比较其酸性强弱,A错误;
B.MgCl2溶液少量,再加入少量CuSO4溶液,Cu2+与OH 直接反应生成沉淀,没有发生沉淀的转化,不能说明比的溶度积小,B错误;
C.向FeSO4溶液中滴加几滴KSCN溶液,溶液无明显变化说明溶液中无Fe3+,滴入新制氯水时溶液变血红色,说明生成了Fe3+,原溶液中存在Fe2+,Fe2+被氧化成Fe3+,Fe2+具有还原性,C正确;
D.挥发出的HCl也会使得硅酸钠生成硅酸沉淀,干扰了实验,且应通过比较最高价氧化物的水化物的酸性检验非金属性强弱,应用高氯酸而不是盐酸,D错误;
故选C。
8.D
【详解】A.、结构相似,pM-pH关系曲线平行,,则ⅰ表示Fe3+,ⅰⅰ表示Al3+,ⅰⅰⅰ表示Cu2+,故A错误;
B.a、b两点对应物质的相同,溶解度不相同,故B错误;
C.ⅰ表示Fe3+,ⅰⅰⅰ表示Cu2+,、的混合溶液中时,根据图示,当开始沉淀时,已经沉淀完全,二者不能同时沉淀,故C错误;
D.根据a点时,则 “沉铜”时,若将pH从5.0提高到5.5,,则铜损失的量降低至原来的10%,故D正确;
选D。
9.D
【分析】银离子浓度相同时,沉淀K2CrO4中的比沉淀NaCl中的Cl-所需AgNO3体积多,则图中曲线①为AgNO3溶液滴定NaCl溶液的曲线,曲线②为AgNO3溶液滴定K2CrO4溶液的曲线。
【详解】A.由分析可知,曲线①可视为随的变化曲线,A不正确;
B.常温下,采集图中信息,可得出AgNO3与K2CrO4刚好完全反应时,c()=10-4mol/L,c(Ag+)=2×10-4mol/L,,B不正确;
C.若只增大AgNO3溶液的浓度,则消耗NaCl、K2CrO4溶液的体积增大,但AgCl、Ag2CrO4的Ksp不变,所以图中a点、b点将向后平移,C不正确;
D.采集曲线a点信息,此时-lgc(Cl-)=4.9,则c(Cl-)=10-4.9mol/L,c(Ag+)=10-4.9mol/L,Ksp(AgCl)= 10-4.9×10-4.9=10-9.8>,则用AgNO3标准溶液滴定NaCl溶液时,可用K2CrO4溶液作指示剂,D正确;
故选D。
10.D
【详解】A.由图可知,pX=a或b时反应完全,并且二者的起始浓度、体积均相同,即二者溶质的起始物质的量相同,反应为NaCl+AgNO3=AgCl↓+NaNO3,Na2CrO4+AgNO3 = Ag2CrO4↓ +2NaNO3,完全反应时Na2CrO4消耗AgNO3溶液的体积是NaCl的2倍,所以曲线I表示NaCl溶液、曲线II表示Na2CrO4溶液,A选项错误;
B.曲线II表示Na2CrO4溶液,达到滴定终点时pX=b,即c(CrO)=10-bmol/L,Ag2CrO4(s) 2Ag+(aq)+CrO (aq),则c(Ag+)=2c(CrO)=2.0×10-bmol/L,Ksp(Ag2CrO4) = c2(Ag+) c(CrO)=(2.0×10-b)2×(10-b)=4.0×10-3b,B选项错误;
C.温度不变,氯化银的溶度积不变,若将NaCl溶液浓度改为0.05mol L-1,需要的硝酸银溶液的体积变成原来的一半,因此滴定终点会向左平移,C选项错误;
D.由数据可得出,Ksp(AgCl)=10-10,Ksp(Ag2CrO4)=4×10-12,当溶液中同时存在Cl-和CrO42-时,Cl-沉淀需要的Ag+少,先沉淀,用AgNO3标准液滴定NaCl时,可用K2CrO4溶液做指示剂,滴定至终点时,会生成砖红色的Ag2CrO4沉淀,D选项正确;
答案为D。
11.C
【详解】A.溶液中存在电荷守恒:,A错误;
B.“除镁”得到的上层清液中为的饱和溶液,有,故,B错误;
C.溶液中存在质子守恒:,故,C正确;
D.“沉锰”后的滤液中还存在F-、等离子,故电荷守恒中应增加其他离子使等式成立,D错误。
故选C。
【点睛】
12.D
【分析】污水中含有铜离子、三价铁离子、锌离子、铝离子,首先加入石灰乳除掉三价铁离子和铝离子,过滤后,加入硫化钠除去其中的铜离子和锌离子,再次过滤后即可达到除去其中的杂质,以此解题。
【详解】A.根据分析可知氢氧化铁当pH=1.9时开始沉淀,氢氧化铝当pH=3.5时开始沉淀,当pH=4时,则会生成氢氧化铝和氢氧化铁,即“沉渣I”中含有Fe(OH)3和Al(OH)3,A正确;
B.硫化钠溶液中的硫离子可以水解,产生氢氧根离子,使溶液显碱性,其第一步水解的方程式为:S2-+H2O HS-+OH-,B正确;
C.当铜离子和锌离子完全沉淀时,则硫化铜和硫化锌都达到了沉淀溶解平衡,则,C正确;
D.污水经过处理后其中含有较多的钙离子以及没有除净的铝离子,故“出水”应该经过阳离子交换树脂软化处理,达到工业冷却循环用水的标准后,才能使用,D错误;
故选D。
13.D
【详解】A.经过步骤①,100mL0.1mol L-1CaCl2水溶液和0.01molNa2SO4反应方程式为CaCl2+ Na2SO4=2NaCl+CaSO4↓,生成0.02mol NaCl和0.01molCaSO4,CaSO4微溶,则溶液中含有SO和Ca2+,则c(Ca2+)+c(Na+)>c(Cl-),故A错误;
B.步骤②中,CaSO4(s)+Na2CO3(aq)=CaCO3↓+NaSO4(aq),步骤②中反应完全,则反应后的溶质为0.01mol Na2SO4、0.01mol Na2CO3和0.02molNaCl,则c(Na+)=6c(SO),故B错误;
C.经过步骤②,反应后的溶质为0.01mol Na2SO4、0.01mol Na2CO3和0.02molNaCl,存在物料守恒:c(Cl-)=2c(CO)+2c(HCO)+2c(H2CO3),故C错误;
D.步骤③中,CaCO3+2CH3COOH=Ca(CH3COO)2+H2O+CO2↑,反应后的溶液中含有0.02molNaCl、0.01mol Ca(CH3COO)2,则c(CH3COOH)+c(CH3COO-)=c(Cl-),故D正确;
故选D。
14.C
【详解】A.氯化银为常见的难溶物,存在的溶解平衡为AgCl(s)Ag+(aq)+Cl-(aq),A正确;
B.向AgCl浊液中滴加氨水后,沉淀溶解,得到澄清溶液, Ag++2NH3·H2OAg(NH3+)2+2H2O,可知NH3结合Ag+能力比Cl-强,B正确;
C.实验室做完银镜反应的试验后,可用稀硝酸洗涤银镜反应后的试管,氨水能溶解氯化银沉淀,不能溶解银单质,C错误;
D.AgCl浊液中加氨水,形成了银氨溶液,加入浓硝酸后,浓硝酸与氨水反应,最终得到的物质为AgCl,D正确;
故选C。
15.D
【详解】A.温度能影响溶度积,浓度对溶度积无影响,盐酸浓度越小,温度不变,Ksp(PbCl2)不变,A项错误;
B.由图可知,x、y两点Cl-浓度不相等,两点Ksp(PbCl2)=c(Pb2+) c2(Cl-)相等,则x、y两点对应溶液中c(Pb2+)不相等,B项错误;
C.当c(Cl-)=0.1mol/L时,溶液中c(Pb2+)==mol/L=1.6×10-3mol/L,溶液中c()==mol/L=6.75×10-6mol/L,C项错误;
D.由图可知,当盐酸浓度小于1mol/L时,随着盐酸浓度的增大,PbCl2溶解量减少是因为Cl-浓度增大,使PbCl2的溶解平衡:PbCl2(s) Pb2+(aq)+2Cl-(aq)逆向移动,D项正确;
答案选D。
16.D
【详解】由图示可知,在该条件下,CaSO4饱和溶液中,c(Ca2+)=c( )=3.0×10-3 mol/L,Ksp(CaSO4)=9.0×10-6.当向100 mL该条件下的CaSO4饱和溶液中加入400 mL 0.01 mol/L的Na2SO4溶液后,混合液中c(Ca2+)==6.0×10-4 mol/L,c()==8.6×10-3 mol/L,溶液中Qc=c(Ca2+) c( )=5.16×10-6<Ksp(CaSO4)=9.0×10-6,所以混合液中无沉淀析出,最终溶液中硫酸根离子浓度增大;故选:D。
17.B
【分析】由图1可知:当碳酸和碳酸氢根离子浓度相等时,pH=6.37,此时可求得碳酸的电离平衡常数;碳酸根离子浓度和碳酸氢根离子浓度相等时pH=10.25,此时可求得碳酸的电离平衡常数。
【详解】A. 的平衡常数K=Ka1Ka2=10-16.62,时此时、pH=8.31,故A正确;
B.由2可知平衡态时则初始状态要发生碳酸根离子和镁离子生成碳酸镁沉淀,此时,故B错误;
C.图1和图2,初始状态,溶液中主要存在的时碳酸氢根离子,此时对应点在碳酸镁曲线下方、氢氧化镁曲线上方,发生反应:,故C正确;
D.沉淀制备时,选用溶液时发生,选用同浓度的除了由碳酸没生成外还有杂质氢氧化镁生成,前者产品纯度高,故D正确;
故答案为:B。
18.B
【详解】A.等体积等浓度的碳酸与氨水恰好反应生成碳酸氢铵溶液,由电离常数可知,碳酸氢铵溶液呈碱性,由电荷守恒可知,溶液中c(NH)+ c(H+)=2c(CO)+ c(HCO)+ c(OH—),由物料守恒可知溶液中c(H2CO3)+c(CO)+c(HCO)=c(NH3·H2O)+c(NH),整合可得c(H2CO3)+ c(H+)=c(CO)+c(NH3·H2O) + c(OH—),由碱性溶液中氢氧根离子浓度大于氢离子浓度可知,溶液中c(H2CO3) >c(CO)+c(NH3·H2O),故A错误;
B.由电离常数可得:Ka1(H2CO3)Ka2(H2CO3)= ,则溶液中==<1,故B正确;
C.实验Ⅱ中氯化钙溶液为10mL时,溶液中钙离子的浓度为=mol/L,溶液中碳酸根离子浓度为,若反应生成碳酸钙沉淀,由方程式可知,反应的平衡常数K====,则溶液中碳酸根离子浓度为≈0.47mol/L>,所以碳酸氢钠溶液与氯化钙溶液不可能生成碳酸钙沉淀,故C错误;
D.实验Ⅱ中氯化钙溶液为80mL时,溶液中钙离子的浓度为=0.08mol/L,溶液中碳酸根离子浓度为,则混合溶液中c(Ca2+)c(CO)=0.08mol/L×>Ksp(CaCO3),溶液中有碳酸钙沉淀生成,则上层清液中:c(Ca2+)c(CO)=Ksp(CaCO3),故D错误;
故选B。
19.D
【详解】A.由图可知,V(AgNO3溶液)=0mL时,等浓度的氯化钠溶液中银离子浓度大于溴化钠溶液,则溶度积的关系为Ksp(AgCl)>Ksp(AgBr),A正确;
B.相同实验条件下,若改用10.00mL0.2000mol/LNaCl溶液,未加入硝酸银溶液时,银离子浓度减小,消耗硝酸银溶液的体积增大,则滴定终点前的滴定曲线可能变为a,B正确;
C.当V(AgNO3溶液)=20mL时,NaBr溶液与硝酸银溶液恰好完全反应,溶液中钠离子浓度等于硝酸根离子浓度,由电荷守恒关系c(Ag+)+c(H+)+ c(Na+)=c(Br-)+c(OH-)+ 可得,溶液中c(Ag+)+c(H+)=c(Br-)+c(OH-),C正确;
D.由图可知,当V(AgNO3溶液)=30mL时,NaCl溶液中银离子浓度接近与0.1mol/L,由Ksp(AgCl)=c(Ag+)·c(Cl)可知,溶液中氯离子浓度小于氢离子,D错误;
故答案为:D。
20.有;沉淀完全
【详解】Qc=c(Ba2+)·c(SO)=1×10-5>Ksp,故有沉淀生成。两种溶液混合之后,c(SO)变为9×10-3 mol·L-1,根据Ksp=c(Ba2+)·c(SO),得c(Ba2+)=≈1.2×10-8 mol/L<1×10-5 mol/L,故可认为Ba2+已经沉淀完全;故答案为有;沉淀完全。
答案第1页,共2页
答案第1页,共2页
一、单选题,共19小题
1.(21-22高二下·河南周口·阶段练习)如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,在T1温度下,下列说法不正确的是
A.加入Na2SO4可使溶液由a点变到b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
2.(2023·海南海口·模拟预测)已知:向难溶电解质饱和溶液中加入与该电解质没有相同离子的强电解质时,使难溶物溶解度增大的效应称为盐效应。常温下,在含大量BaSO4固体的浊液中加入0.01mol下列物质(忽略体积变化),溶液中c(Ba2+)由大到小的排序正确的是
①BaSO4 ②Na2SO4 ③KNO3
A.②①③ B.③②① C.③①② D.①③②
3.(23-24高二上·全国·课时练习)将浓盐酸加到NaCl饱和溶液中,会析出NaCl晶体,对这种现象正确的解释是
A.由于c平(Cl-)增加,使溶液中c平(Na+)·c平(Cl-)>Ksp(NaCl),故产生NaCl晶体
B.HCl是强酸,所以它能使NaCl沉淀出来
C.由于c平(Cl-)增加,使NaCl的溶解平衡向析出NaCl的方向移动,故有NaCl沉淀析出
D.酸的存在,降低了盐的溶解度
4.(21-22高二上·湖南·期中)下列有关沉淀溶解平衡的说法中错误的是
A.的溶度积常数表达式
B.难溶于水,溶液中没有和SO
C.升高温度,的溶解度增大
D.向悬浊液中加入固体,溶解的量减少
5.(23-24高三上·湖北·期末)下列实验方案中,能达到实验目的的是
选项 实验方案 实验目的
A 向含有苯和苯酚的混合溶液中滴入浓溴水,然后过滤 除去苯中的苯酚
B 向溶液中通入少量 证明氧化性:
C 向盛有2mL0.1mol/L的溶液中滴加2滴0.1mol/L的NaCl溶液,产生白色沉淀,再向其中滴加4滴0.1mol/L的KI溶液,有黄色沉淀生成 证明:
D 取2mL0.5mol/L的溶液于试管中,加热后溶液颜色发生变化 探究温度对化学平衡的影响
A.A B.B C.C D.D
6.(17-18高二上·吉林长春·期末)常温下几种难溶电解质的溶度积如下表所示:
物质名称 硫化亚铁 硫化铜 硫化锌
溶度积 6.3×10-18 6.3×10-36 1.6×10-24
向含有等物质的量浓度的FeCl2、CuSO4、ZnSO4混合溶液中滴加0.01 mol·L-1 Na2S液时,Fe2+、Cu2+、Zn2+沉淀的先后顺序为
A.Fe2+、Zn2+、Cu2+ B.Cu2+、Zn2+、Fe2+
C.Zn2+、Fe2+、Cu2+ D.Cu2+、Fe2+、Zn2+
7.(23-24高三上·宁夏银川·阶段练习)下列实验目的对应的实验方案设计、现象和结论都正确的是
选项 实验目的 实验方案设计 现象和结论
A 探究CH3COOH与HCl酸性的强弱 用pH计测量酸酸、盐酸的pH,比较溶液pH大小 盐酸的pH比醋酸小,则CH3COOH是弱酸
B 探究Cu(OH)2和Mg(OH)2溶度积的大小 向氢氧化钠溶液中先加入少量MgCl2溶液,充分反应后再加入少量CuSO4溶液 先产生白色沉淀,后产生蓝色沉淀,说明Cu(OH)2比Mg(OH)2的溶度积小
C 探究Fe2+有还原性 向盛有FeSO4溶液的试管中滴加几滴KSCN溶液,振荡,再滴加几滴新制氯水,观察溶液颜色变化 滴入KSCN溶液时,无明显变化,滴入新制氯水时溶液变血红色,Fe2+具有还原性
D 证明:非金属性:Cl>C>Si 锥形瓶中有气体产生,烧杯中液体变浑浊
A.A B.B C.C D.D
8.(23-24高三上·河南周口·阶段练习)常温下,、和在水中达沉淀溶解平衡时的pM-pH关系如图所示,M代表、或;时可认为M离子沉淀完全,已知,。
下列叙述正确的是
A.ⅰ曲线代表的是
B.a、b两点对应物质的和溶解度均相同
C.、的混合溶液中时二者能同时沉淀
D.“沉铜”时,若将pH从5.0提高到5.5,则铜损失的量降低至原来的10%
9.(23-24高三上·内蒙古呼和浩特·期末)常温下,向溶液和溶液中分别滴加0.1mol L-1的AgNO3溶液。滴加过程中或与所加AgNO3溶液体积之间的关系如下图所示(已知:Ag2CrO4为砖红色沉淀)。下列说法正确的是
A.曲线②可视为随的变化曲线
B.常温下,
C.若只增大AgNO3溶液的浓度,则图中a点、b点将向上平移
D.用AgNO3标准溶液滴定NaCl溶液时,可用K2CrO4溶液作指示剂
10.(2022·河南周口·模拟预测)某温度下,向体积均为20.00mL、浓度均为0.1mol L-1的NaCl溶液、Na2CrO4溶液中分别滴加0.1mol L-1的AgNO3溶液,滴定过程中的pX(PX=-lgX,X=Cl-、CrO)与滴加AgNO3溶液体积的关系如图所示。下列说法正确的是
A.曲线II表示AgNO3溶液滴定NaCl溶液的过程
B.Ksp(Ag2CrO4)=10-2b
C.其他条件不变,如果NaCl溶液浓度改为0.05mol L-1,则滴定终点向上移动
D.若a=5 b=4,则用AgNO3标准液滴定NaCl时可用K2CrO4溶液做指示剂
11.(2023·江苏·高考真题)室温下,用含少量的溶液制备的过程如题图所示。已知,。下列说法正确的是
A.溶液中:
B.“除镁”得到的上层清液中:
C.溶液中:
D.“沉锰”后的滤液中:
12.(2023·湖南·高考真题)处理某铜冶金污水(含)的部分流程如下:
已知:①溶液中金属离子开始沉淀和完全沉淀的如下表所示:
物质
开始沉淀 1.9 4.2 6.2 3.5
完全沉淀 3.2 6.7 8.2 4.6
②。
下列说法错误的是
A.“沉渣Ⅰ”中含有和
B.溶液呈碱性,其主要原因是
C.“沉淀池Ⅱ”中,当和完全沉淀时,溶液中
D.“出水”经阴离子交换树脂软化处理后,可用作工业冷却循环用水
13.(2022高三·全国·专题练习)某小组模拟成垢-除垢过程如图。
100mL0.1mol L-1CaCl2水溶液……
忽略体积变化,且步骤②中反应完全。下列说法正确的是
A.经过步骤①,溶液中c(Ca2+)+c(Na+)=c(Cl-)
B.经过步骤②,溶液中c(Na+)=4c(SO)
C.经过步骤②,溶液中c(Cl-)=c(CO)+c(HCO)+c(H2CO3)
D.经过步骤③,溶液中c(CH3COOH)+c(CH3COO-)=c(Cl-)
14.(2022高三·全国·专题练习)向AgCl浊液中滴加氨水后可得到澄清溶液,继续滴加浓硝酸后又有沉淀生成。经查资料得知:Ag++2NH3·H2OAg(NH3)+2H2O。下列分析不正确的是
A.浊液中存在沉淀溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq)
B.实验可以证明NH3结合Ag+能力比Cl-强
C.实验表明实验室可用氨水洗涤银镜反应后的试管
D.由资料信息可推知:加浓硝酸后生成的沉淀为AgCl
15.(2023·浙江·三模)都是重要的化工原料,已知:难溶于冷水,易溶于热水,﹔,,20℃时,在不同浓度盐酸中的最大溶解量如图所示下列说法正确的是
A.盐酸浓度越小,越小
B.x、y两点对应的溶液中相等
C.PbCl2和盐酸混合液中加入稀硫酸后得到,当时,为
D.当盐酸浓度小于时,随着浓度的增大,溶解量减小是因为浓度增大使溶解平衡逆向移动
16.(2023高三·全国·专题练习)已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入400mL0.01mol·L-1Na2SO4溶液,下列叙述正确的是
A.溶液中析出CaSO4固体沉淀,最终溶液中[]比原来的小
B.溶液中无沉淀析出,溶液中[Ca2+]、[]都变小
C.溶液中析出CaSO4固体沉淀,溶液中[Ca2+]、[]都变小
D.溶液中无沉淀析出,但最终溶液中[]比原来的大
17.(23-24高三上·山东济宁·期末)利用平衡移动原理,分析一定温度下在不同的体系中的可能产物。已知:图1中曲线表示体系中各含碳粒子的与的关系;图2中曲线Ⅰ的离子浓度关系符合;曲线Ⅱ的离子浓度关系符合[起始,不同下含碳粒子的浓度由图1得到]。
下列说法错误的是
A.由图1,时,
B.图2中,初始状态,平衡后溶液中存在:
C.图1和图2,初始状态,发生反应:
D.沉淀制备时,选用溶液比同浓度的产品纯度高
18.(23-24高三上·江苏扬州·期末)碳酸(H2CO3)是二元弱酸。某小组做如下两组实验:
实验I:往20mL0.1mol·L 1H2CO3溶液中滴加0.1mol·L 1氨水。
实验Ⅱ:往20mL0.1mol·L 1NaHCO3溶液中滴加0.1mol·L 1CaCl2溶液。
[已知:Ka1(H2CO3)=4.5×10 7,Ka2(H2CO3)=5.6×10 11,Kb(NH3·H2O)=1.8×10-5,Ksp(CaCO3)=3.6×10 9,溶液混合后体积变化忽略不计],下列说法正确的是
A.实验I中V(氨水)=20mL时,存在c(H2CO3)<c(CO)+c(NH3·H2O)
B.实验I中pH=8时,存在c(H2CO3)>c(CO)
C.实验Ⅱ中V(CaCl2)=10mL时,发生反应HCO+Ca2+=CaCO3↓+H+
D.实验Ⅱ中V(CaCl2)=80mL时,沉淀后的上层清液中:c(Ca2+)c(CO)>Ksp(CaCO3)
19.(23-24高三上·四川成都·阶段练习)常温下,用0.1000mol/L AgNO3标准溶液(pH≈5)分别滴定20.00 mL 0.1000mol/L的NaCl溶液和NaBr溶液,混合溶液的pAg[定义为pAg= -lgc(Ag+)]与AgNO3溶液体积的变化关系如图所示。下列说法不正确的是
A.常温时溶度积常数:Ksp(AgCl)>Ksp(AgBr)
B.相同实验条件下,若改用10.00 mL 0.2000mol/L NaCl溶液,则b点向a点移动
C.NaBr溶液在c点时:c(Ag+)+c(H+)=c(Br-)+c(OH-)
D.NaCl溶液在d点时:c()>c(Na+)>c(Ag+)>c(Cl-)>c(H+)
二、计算题,共1小题
20.(2023高三·全国·专题练习)取5 mL 0.002 mol·L-1 BaCl2与等体积的0.02 mol·L-1 Na2SO4的混合,是否有沉淀产生?若有,计算Ba2+是否沉淀完全。(该温度下BaSO4的Ksp=1.1×10-10)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.硫酸钡溶液中存在着溶解平衡,a点在平衡曲线上,加入Na2SO4,会增大c(SO),平衡左移,c(Ba2+)应降低,故A正确;
B.在曲线上方区域(不含曲线)任意一点时,Qc>Ksp,溶液过饱和,有沉淀析出,故B正确;
C.d点时溶液不饱和,蒸发溶剂水,c(SO)、c(Ba2+)均增大,所以可能使溶液变饱和、由d点变为曲线上a、b之间的某一点(不含a、b),故C正确;
D.升高温度, 促进溶解平衡右移,c(SO)、c(Ba2+)均增大,不会使溶液由b点变为d点,故D错误;
本题选D。
2.C
【详解】在含大量BaSO4固体的浊液中加入0.01mol①BaSO4时,对BaSO4的沉淀溶解平衡不产生任何影响,c(Ba2+)不变;加入0.01mol②Na2SO4时,增大了溶液中的c(),使BaSO4的沉淀溶解平衡逆向移动,c(Ba2+)减小;加入0.01mol③KNO3时,发生盐效应,使BaSO4的溶解度增大,从而使c(Ba2+)增大。综合以上分析,溶液中c(Ba2+)由大到小的排序③①②,故选C。
3.C
【详解】A.Ksp是针对难溶物的溶度积来谈的,NaCl是易溶于水的盐,不存在Ksp,故A错误;
B.NaCl沉淀出来与HCl是强酸无直接关系,故B错误;
C.加入盐酸,则c平(Cl-)增加,使NaCl的溶解平衡向析出NaCl的方向移动,故有NaCl沉淀析出,故C正确;
D.盐的溶解度是固定的,盐酸的存在,只是减少了饱和溶液中氯化钠的量,可能其余的酸不会减少饱和氯化钠溶解的量,故D错误。
综上所述,答案为C。
4.B
【详解】A.BaSO3难溶于水,悬浊液中存在BaSO3(s)Ba2+(aq)+SO(aq),根据溶度积数学表达式,推出Ksp=c(Ba2+)×c(SO),故A说法正确;
B.BaSO3虽难溶于水,BaSO3在水中溶解度较小,但溶液中有极少量的Ba2+和SO,故B说法错误;
C.多数物质的溶解度随着温度升高而升高,升高温度,BaSO3的溶解度增大,故C说法正确;
D.BaSO3悬浊液中存在BaSO3(s)Ba2+(aq)+SO(aq),加入Na2SO3固体,溶液中c(SO)增大,c(Ba2+)减少,BaSO3溶解的量减少,故D说法正确;
答案为B。
5.D
【详解】A.苯酚与溴水反应生成2,4,6-三溴苯酚,仍然与苯互溶,无法去除,故A不符合题意;
B.向溶液中通入少量,由于还原性I->Fe2+,故直接氧化I-,不能证明氧化性:,故B不符合题意;
C.硝酸银过量时,均为沉淀生成,不能比较Ksp的大小,故C不符合题意;
D.溶液中存在,加热平衡移动,溶液颜色变化,可探究温度化学平衡的影响,故D符合题意;
故答案选D。
6.B
【详解】等物质的量浓度的FeCl2、CuSO4、ZnSO4混合溶液中滴加0.01 mol·L-1 Na2S液时,哪种离子需要的硫离子浓度小,哪种金属离子先沉淀,又因为FeS、CuS、ZnS化学式相似,Fe2+、Cu2+、Zn2+离子浓度相等,KSP越小的,需要硫离子浓度越小就先沉淀。根据表中KSP大小,可得出离子沉淀的先后顺序为:Cu2+、Zn2+、Fe2+。
故答案为:B。
7.C
【详解】A.没有说明两份溶液的浓度,所以无法根据pH比较其酸性强弱,A错误;
B.MgCl2溶液少量,再加入少量CuSO4溶液,Cu2+与OH 直接反应生成沉淀,没有发生沉淀的转化,不能说明比的溶度积小,B错误;
C.向FeSO4溶液中滴加几滴KSCN溶液,溶液无明显变化说明溶液中无Fe3+,滴入新制氯水时溶液变血红色,说明生成了Fe3+,原溶液中存在Fe2+,Fe2+被氧化成Fe3+,Fe2+具有还原性,C正确;
D.挥发出的HCl也会使得硅酸钠生成硅酸沉淀,干扰了实验,且应通过比较最高价氧化物的水化物的酸性检验非金属性强弱,应用高氯酸而不是盐酸,D错误;
故选C。
8.D
【详解】A.、结构相似,pM-pH关系曲线平行,,则ⅰ表示Fe3+,ⅰⅰ表示Al3+,ⅰⅰⅰ表示Cu2+,故A错误;
B.a、b两点对应物质的相同,溶解度不相同,故B错误;
C.ⅰ表示Fe3+,ⅰⅰⅰ表示Cu2+,、的混合溶液中时,根据图示,当开始沉淀时,已经沉淀完全,二者不能同时沉淀,故C错误;
D.根据a点时,则 “沉铜”时,若将pH从5.0提高到5.5,,则铜损失的量降低至原来的10%,故D正确;
选D。
9.D
【分析】银离子浓度相同时,沉淀K2CrO4中的比沉淀NaCl中的Cl-所需AgNO3体积多,则图中曲线①为AgNO3溶液滴定NaCl溶液的曲线,曲线②为AgNO3溶液滴定K2CrO4溶液的曲线。
【详解】A.由分析可知,曲线①可视为随的变化曲线,A不正确;
B.常温下,采集图中信息,可得出AgNO3与K2CrO4刚好完全反应时,c()=10-4mol/L,c(Ag+)=2×10-4mol/L,,B不正确;
C.若只增大AgNO3溶液的浓度,则消耗NaCl、K2CrO4溶液的体积增大,但AgCl、Ag2CrO4的Ksp不变,所以图中a点、b点将向后平移,C不正确;
D.采集曲线a点信息,此时-lgc(Cl-)=4.9,则c(Cl-)=10-4.9mol/L,c(Ag+)=10-4.9mol/L,Ksp(AgCl)= 10-4.9×10-4.9=10-9.8>,则用AgNO3标准溶液滴定NaCl溶液时,可用K2CrO4溶液作指示剂,D正确;
故选D。
10.D
【详解】A.由图可知,pX=a或b时反应完全,并且二者的起始浓度、体积均相同,即二者溶质的起始物质的量相同,反应为NaCl+AgNO3=AgCl↓+NaNO3,Na2CrO4+AgNO3 = Ag2CrO4↓ +2NaNO3,完全反应时Na2CrO4消耗AgNO3溶液的体积是NaCl的2倍,所以曲线I表示NaCl溶液、曲线II表示Na2CrO4溶液,A选项错误;
B.曲线II表示Na2CrO4溶液,达到滴定终点时pX=b,即c(CrO)=10-bmol/L,Ag2CrO4(s) 2Ag+(aq)+CrO (aq),则c(Ag+)=2c(CrO)=2.0×10-bmol/L,Ksp(Ag2CrO4) = c2(Ag+) c(CrO)=(2.0×10-b)2×(10-b)=4.0×10-3b,B选项错误;
C.温度不变,氯化银的溶度积不变,若将NaCl溶液浓度改为0.05mol L-1,需要的硝酸银溶液的体积变成原来的一半,因此滴定终点会向左平移,C选项错误;
D.由数据可得出,Ksp(AgCl)=10-10,Ksp(Ag2CrO4)=4×10-12,当溶液中同时存在Cl-和CrO42-时,Cl-沉淀需要的Ag+少,先沉淀,用AgNO3标准液滴定NaCl时,可用K2CrO4溶液做指示剂,滴定至终点时,会生成砖红色的Ag2CrO4沉淀,D选项正确;
答案为D。
11.C
【详解】A.溶液中存在电荷守恒:,A错误;
B.“除镁”得到的上层清液中为的饱和溶液,有,故,B错误;
C.溶液中存在质子守恒:,故,C正确;
D.“沉锰”后的滤液中还存在F-、等离子,故电荷守恒中应增加其他离子使等式成立,D错误。
故选C。
【点睛】
12.D
【分析】污水中含有铜离子、三价铁离子、锌离子、铝离子,首先加入石灰乳除掉三价铁离子和铝离子,过滤后,加入硫化钠除去其中的铜离子和锌离子,再次过滤后即可达到除去其中的杂质,以此解题。
【详解】A.根据分析可知氢氧化铁当pH=1.9时开始沉淀,氢氧化铝当pH=3.5时开始沉淀,当pH=4时,则会生成氢氧化铝和氢氧化铁,即“沉渣I”中含有Fe(OH)3和Al(OH)3,A正确;
B.硫化钠溶液中的硫离子可以水解,产生氢氧根离子,使溶液显碱性,其第一步水解的方程式为:S2-+H2O HS-+OH-,B正确;
C.当铜离子和锌离子完全沉淀时,则硫化铜和硫化锌都达到了沉淀溶解平衡,则,C正确;
D.污水经过处理后其中含有较多的钙离子以及没有除净的铝离子,故“出水”应该经过阳离子交换树脂软化处理,达到工业冷却循环用水的标准后,才能使用,D错误;
故选D。
13.D
【详解】A.经过步骤①,100mL0.1mol L-1CaCl2水溶液和0.01molNa2SO4反应方程式为CaCl2+ Na2SO4=2NaCl+CaSO4↓,生成0.02mol NaCl和0.01molCaSO4,CaSO4微溶,则溶液中含有SO和Ca2+,则c(Ca2+)+c(Na+)>c(Cl-),故A错误;
B.步骤②中,CaSO4(s)+Na2CO3(aq)=CaCO3↓+NaSO4(aq),步骤②中反应完全,则反应后的溶质为0.01mol Na2SO4、0.01mol Na2CO3和0.02molNaCl,则c(Na+)=6c(SO),故B错误;
C.经过步骤②,反应后的溶质为0.01mol Na2SO4、0.01mol Na2CO3和0.02molNaCl,存在物料守恒:c(Cl-)=2c(CO)+2c(HCO)+2c(H2CO3),故C错误;
D.步骤③中,CaCO3+2CH3COOH=Ca(CH3COO)2+H2O+CO2↑,反应后的溶液中含有0.02molNaCl、0.01mol Ca(CH3COO)2,则c(CH3COOH)+c(CH3COO-)=c(Cl-),故D正确;
故选D。
14.C
【详解】A.氯化银为常见的难溶物,存在的溶解平衡为AgCl(s)Ag+(aq)+Cl-(aq),A正确;
B.向AgCl浊液中滴加氨水后,沉淀溶解,得到澄清溶液, Ag++2NH3·H2OAg(NH3+)2+2H2O,可知NH3结合Ag+能力比Cl-强,B正确;
C.实验室做完银镜反应的试验后,可用稀硝酸洗涤银镜反应后的试管,氨水能溶解氯化银沉淀,不能溶解银单质,C错误;
D.AgCl浊液中加氨水,形成了银氨溶液,加入浓硝酸后,浓硝酸与氨水反应,最终得到的物质为AgCl,D正确;
故选C。
15.D
【详解】A.温度能影响溶度积,浓度对溶度积无影响,盐酸浓度越小,温度不变,Ksp(PbCl2)不变,A项错误;
B.由图可知,x、y两点Cl-浓度不相等,两点Ksp(PbCl2)=c(Pb2+) c2(Cl-)相等,则x、y两点对应溶液中c(Pb2+)不相等,B项错误;
C.当c(Cl-)=0.1mol/L时,溶液中c(Pb2+)==mol/L=1.6×10-3mol/L,溶液中c()==mol/L=6.75×10-6mol/L,C项错误;
D.由图可知,当盐酸浓度小于1mol/L时,随着盐酸浓度的增大,PbCl2溶解量减少是因为Cl-浓度增大,使PbCl2的溶解平衡:PbCl2(s) Pb2+(aq)+2Cl-(aq)逆向移动,D项正确;
答案选D。
16.D
【详解】由图示可知,在该条件下,CaSO4饱和溶液中,c(Ca2+)=c( )=3.0×10-3 mol/L,Ksp(CaSO4)=9.0×10-6.当向100 mL该条件下的CaSO4饱和溶液中加入400 mL 0.01 mol/L的Na2SO4溶液后,混合液中c(Ca2+)==6.0×10-4 mol/L,c()==8.6×10-3 mol/L,溶液中Qc=c(Ca2+) c( )=5.16×10-6<Ksp(CaSO4)=9.0×10-6,所以混合液中无沉淀析出,最终溶液中硫酸根离子浓度增大;故选:D。
17.B
【分析】由图1可知:当碳酸和碳酸氢根离子浓度相等时,pH=6.37,此时可求得碳酸的电离平衡常数;碳酸根离子浓度和碳酸氢根离子浓度相等时pH=10.25,此时可求得碳酸的电离平衡常数。
【详解】A. 的平衡常数K=Ka1Ka2=10-16.62,时此时、pH=8.31,故A正确;
B.由2可知平衡态时则初始状态要发生碳酸根离子和镁离子生成碳酸镁沉淀,此时,故B错误;
C.图1和图2,初始状态,溶液中主要存在的时碳酸氢根离子,此时对应点在碳酸镁曲线下方、氢氧化镁曲线上方,发生反应:,故C正确;
D.沉淀制备时,选用溶液时发生,选用同浓度的除了由碳酸没生成外还有杂质氢氧化镁生成,前者产品纯度高,故D正确;
故答案为:B。
18.B
【详解】A.等体积等浓度的碳酸与氨水恰好反应生成碳酸氢铵溶液,由电离常数可知,碳酸氢铵溶液呈碱性,由电荷守恒可知,溶液中c(NH)+ c(H+)=2c(CO)+ c(HCO)+ c(OH—),由物料守恒可知溶液中c(H2CO3)+c(CO)+c(HCO)=c(NH3·H2O)+c(NH),整合可得c(H2CO3)+ c(H+)=c(CO)+c(NH3·H2O) + c(OH—),由碱性溶液中氢氧根离子浓度大于氢离子浓度可知,溶液中c(H2CO3) >c(CO)+c(NH3·H2O),故A错误;
B.由电离常数可得:Ka1(H2CO3)Ka2(H2CO3)= ,则溶液中==<1,故B正确;
C.实验Ⅱ中氯化钙溶液为10mL时,溶液中钙离子的浓度为=mol/L,溶液中碳酸根离子浓度为,若反应生成碳酸钙沉淀,由方程式可知,反应的平衡常数K====,则溶液中碳酸根离子浓度为≈0.47mol/L>,所以碳酸氢钠溶液与氯化钙溶液不可能生成碳酸钙沉淀,故C错误;
D.实验Ⅱ中氯化钙溶液为80mL时,溶液中钙离子的浓度为=0.08mol/L,溶液中碳酸根离子浓度为,则混合溶液中c(Ca2+)c(CO)=0.08mol/L×>Ksp(CaCO3),溶液中有碳酸钙沉淀生成,则上层清液中:c(Ca2+)c(CO)=Ksp(CaCO3),故D错误;
故选B。
19.D
【详解】A.由图可知,V(AgNO3溶液)=0mL时,等浓度的氯化钠溶液中银离子浓度大于溴化钠溶液,则溶度积的关系为Ksp(AgCl)>Ksp(AgBr),A正确;
B.相同实验条件下,若改用10.00mL0.2000mol/LNaCl溶液,未加入硝酸银溶液时,银离子浓度减小,消耗硝酸银溶液的体积增大,则滴定终点前的滴定曲线可能变为a,B正确;
C.当V(AgNO3溶液)=20mL时,NaBr溶液与硝酸银溶液恰好完全反应,溶液中钠离子浓度等于硝酸根离子浓度,由电荷守恒关系c(Ag+)+c(H+)+ c(Na+)=c(Br-)+c(OH-)+ 可得,溶液中c(Ag+)+c(H+)=c(Br-)+c(OH-),C正确;
D.由图可知,当V(AgNO3溶液)=30mL时,NaCl溶液中银离子浓度接近与0.1mol/L,由Ksp(AgCl)=c(Ag+)·c(Cl)可知,溶液中氯离子浓度小于氢离子,D错误;
故答案为:D。
20.有;沉淀完全
【详解】Qc=c(Ba2+)·c(SO)=1×10-5>Ksp,故有沉淀生成。两种溶液混合之后,c(SO)变为9×10-3 mol·L-1,根据Ksp=c(Ba2+)·c(SO),得c(Ba2+)=≈1.2×10-8 mol/L<1×10-5 mol/L,故可认为Ba2+已经沉淀完全;故答案为有;沉淀完全。
答案第1页,共2页
答案第1页,共2页
同课章节目录
