2024年高考化学二轮复习回归基础训练专题16无机化工流程综合分析(含解析)
文档属性
| 名称 | 2024年高考化学二轮复习回归基础训练专题16无机化工流程综合分析(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-14 08:55:29 | ||
图片预览



文档简介
2024年高考化学二轮复习回归基础训练专题16无机化工流程综合分析
一、非选择题,共12小题
1.(23-24高一上·福建厦门·阶段练习)某工厂的工业废水中含有大量的FeSO4和较多的Cu2+。为了减少污染并变废为宝,工厂计划从该废水中回收FeSO4和金属铜。请根据以下流程图,回答下列问题:
(1)⑥操作方法的名称是 ;操作⑨包括:蒸发浓缩、 、过滤、洗涤、低温干燥。
(2)加入试剂⑤发生反应的离子方程式为 。
(3)试剂⑦的化学式为 。
(4)某兴趣小组同学欲鉴别④中的金属阳离子,设计如下实验:
甲同学取2.0mL④溶液,滴加氢氧化钠溶液,产生白色沉淀且很快变为灰绿色,最后变为红褐色沉淀,其中涉及氧化还原反应的化学方程式为 。
乙同学取物质③,加入FeCl3溶液,观察到物质③溶解,涉及的离子反应方程式为 。
(5)若按上述工艺处理1000L该工业废水,制得320g铜,则该工业废水中c(Cu2+)= mol/L。
2.(23-24高一上·云南红河·阶段练习)电子工业中,常用FeCl3溶液腐蚀覆盖在绝缘板上的铜箔制造印刷电路板。化学实验小组从腐蚀废液(含FeCl3、FeCl2、CuCl2)中回收得并重新获得FeCl3晶体的流程如图:
回答下列问题:
(1)FeCl3溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板的化学反应方程式 。
(2)腐蚀废液中含有Fe3+最好用KSCN溶液检验,该反应的离子方程式为: 。
(3)滤渣的成分是 (填化学式)。从滤渣中获得铜单质,可选用的试剂是 (填序号)。
A.稀盐酸 B.浓硫酸 C.稀硝酸 D.氯化铜溶液
(4)实际上Fe2+的还原性较强,实验室的FeCl2溶液常因氧化而变质。除杂的方法是 ,相关反应的离子方程式: 。
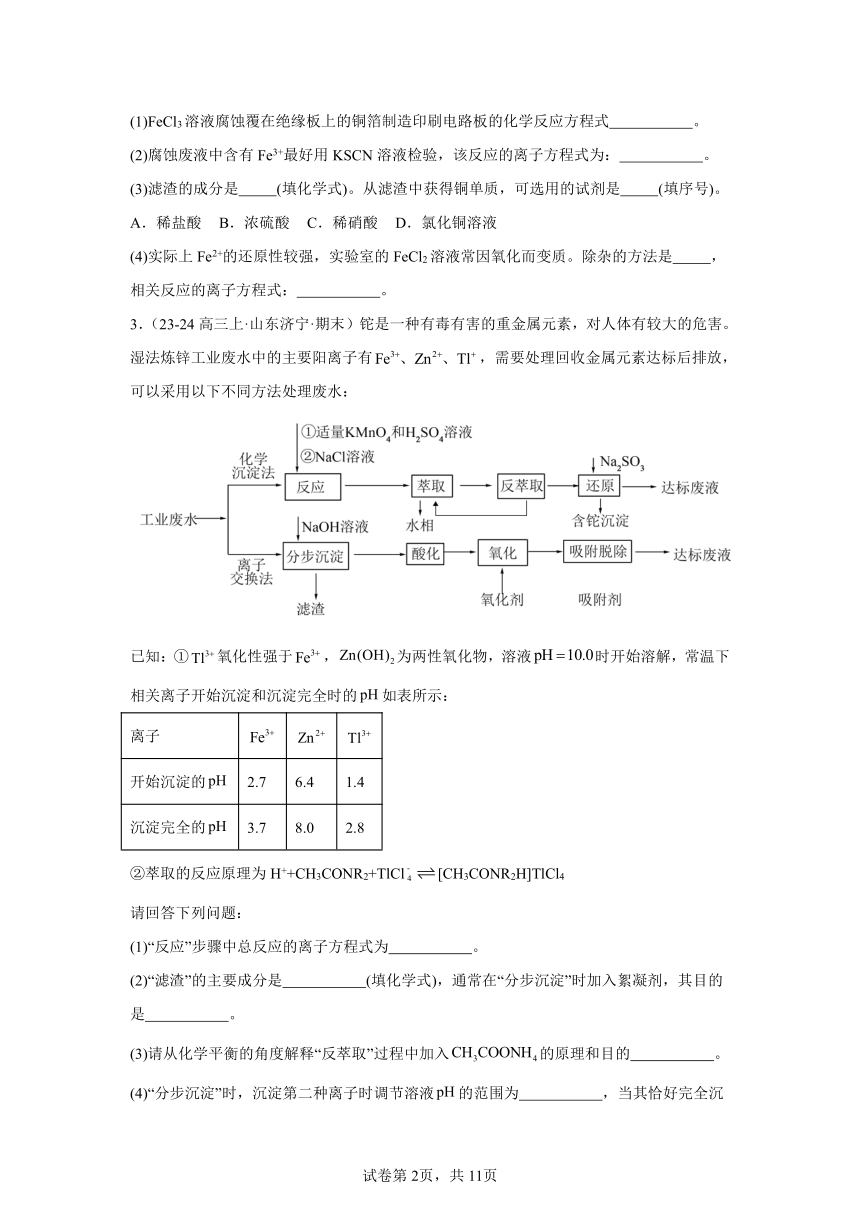
3.(23-24高三上·山东济宁·期末)铊是一种有毒有害的重金属元素,对人体有较大的危害。湿法炼锌工业废水中的主要阳离子有,需要处理回收金属元素达标后排放,可以采用以下不同方法处理废水:
已知:①氧化性强于,为两性氧化物,溶液时开始溶解,常温下相关离子开始沉淀和沉淀完全时的如表所示:
离子
开始沉淀的 2.7 6.4 1.4
沉淀完全的 3.7 8.0 2.8
②萃取的反应原理为H++CH3CONR2+TlCl[CH3CONR2H]TlCl4
请回答下列问题:
(1)“反应”步骤中总反应的离子方程式为 。
(2)“滤渣”的主要成分是 (填化学式),通常在“分步沉淀”时加入絮凝剂,其目的是 。
(3)请从化学平衡的角度解释“反萃取”过程中加入的原理和目的 。
(4)“分步沉淀”时,沉淀第二种离子时调节溶液的范围为 ,当其恰好完全沉淀,则溶液中先沉淀的离子浓度为 。
(5)废水中吸附过程如图所示,该树脂为 (填“阳离子”或“阴离子”)交换树脂,若使吸附剂再生,且回收,可将离子交换树脂浸入 溶液。
a. b. c.
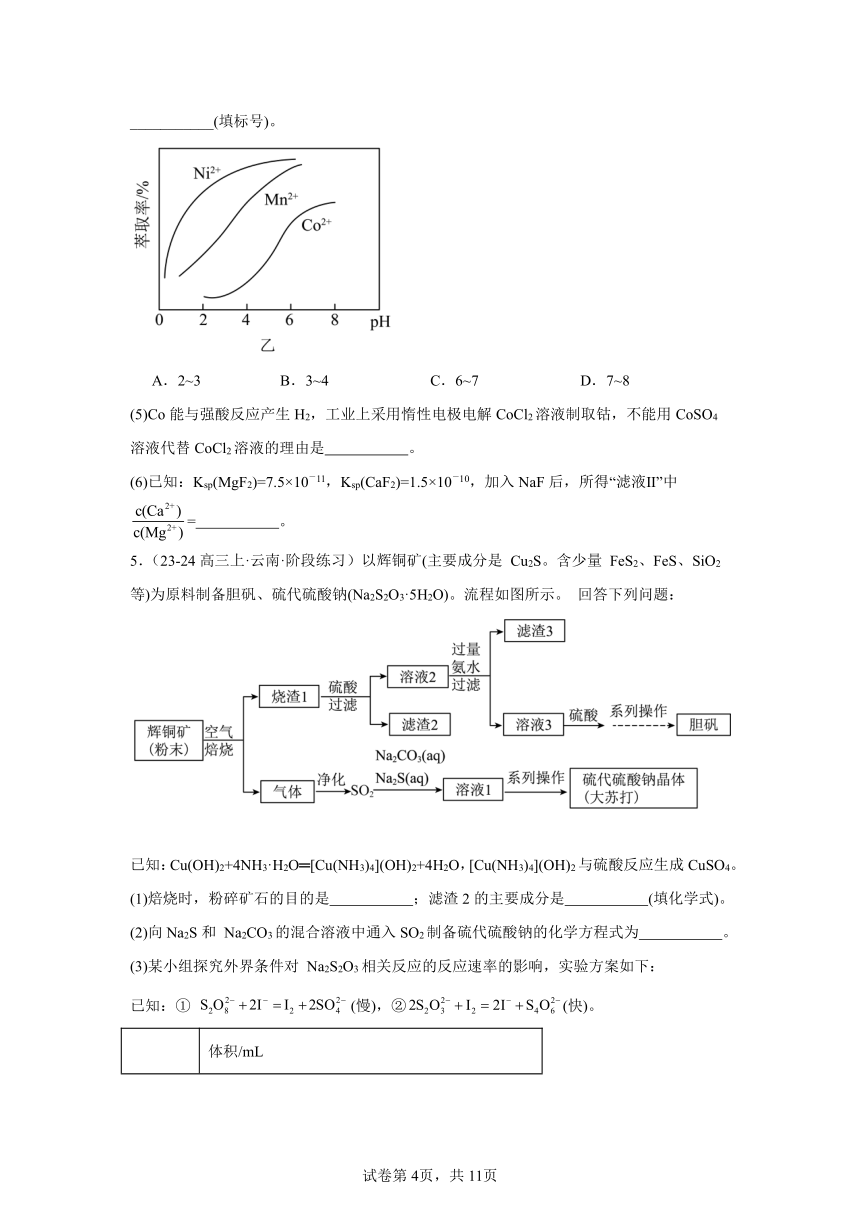
4.(23-24高三上·湖南长沙·阶段练习)水钴矿主要成分为CoOOH,同时含有少量Fe、Al、Mn、Mg、Ca、Ni的氧化物及其他杂质。用水钴矿制取Co的工艺流程如图甲所示:
已知部分阳离子形成氢氧化物沉淀时,溶液pH见下表:
沉淀物 Fe(OH)2 Fe(OH)3 Co(OH)2 Mn(OH)2 Al(OH)3
开始沉淀时的pH 7.0 2.7 7.6 7.7 4.0
沉淀完全时的pH 9.6 3.7 9.2 9.8 5.2
请回答下列问题:
(1)基态Co原子的价层电子排布式为 。
(2)“还原酸浸”中发生的氧化还原反应的化学方程式是 。浸出液中加入NaClO溶液的目的: (用离子方程式表示)。
(3)浸出过程中加入Na2CO3调pH的范围是 。
(4)如图乙所示,萃取剂可以把滤液Ⅱ中部分阳离子选择性分离。萃取剂合适的pH为___________(填标号)。
A.2~3 B.3~4 C.6~7 D.7~8
(5)Co能与强酸反应产生H2,工业上采用惰性电极电解CoCl2溶液制取钴,不能用CoSO4溶液代替CoCl2溶液的理由是 。
(6)已知:Ksp(MgF2)=7.5×10-11,Ksp(CaF2)=1.5×10-10,加入NaF后,所得“滤液Ⅱ”中= 。
5.(23-24高三上·云南·阶段练习)以辉铜矿(主要成分是 Cu2S。含少量 FeS2、FeS、SiO2等)为原料制备胆矾、硫代硫酸钠(Na2S2O3·5H2O)。流程如图所示。 回答下列问题:
已知:Cu(OH)2+4NH3·H2O═[Cu(NH3)4](OH)2+4H2O,[Cu(NH3)4](OH)2与硫酸反应生成CuSO4。
(1)焙烧时,粉碎矿石的目的是 ;滤渣2的主要成分是 (填化学式)。
(2)向Na2S和 Na2CO3的混合溶液中通入SO2制备硫代硫酸钠的化学方程式为 。
(3)某小组探究外界条件对 Na2S2O3相关反应的反应速率的影响,实验方案如下:
已知:① (慢),②(快)。
体积/mL
实验序号 K2S2O8溶液 KI溶液 Na2S2O3溶液 淀粉溶液
1 10.0 4.0 5.0 2.0
2 5.0 4.0 5.0 2.0
上述反应中,活化能较大的反应是 (填“①”或“②”)。下列叙述错误的是 (填标号)。
A.在KI-淀粉溶液中滴加过量 Na2S2O3溶液,溶液始终不会变蓝
B.上述方案可以探究浓度对反应速率的影响
C.当n(Na2S2O3):n(K2S2O8)的值小于2时会出现蓝色
(4)检验溶液2中含 Fe2+的试剂可能是___________(填标号)。
A.KSCN溶液 B.K3Fe(CN)6溶液 C.酸性 KMnO4溶液 D.NaOH 溶液
(5)25.0 g CuSO4·5H2O受热分解。残留固体的质量与温度的关系如图所示。
①1300 ℃时,固体的成分是 (填化学式)。
②已知580~1000℃之间产生了两种气体和一种固体,写出发生反应的化学方程式: 。
6.(23-24高三上·江苏泰州·期中)由菱锰矿(主要成分为,还含有少量Si、Fe、Ni等元素)制备一种新型锂电池正极材料的工艺流程如下:
已知:①,,,,。
②当溶液中离子浓度小于时,可视为沉淀完全。
③可溶于水。
(1)基态锰原子的核外电子排布式为 。
(2)加入少量的目的是氧化,实际生产中不用替代的原因是 。
(3)溶矿反应完成后,先向反应后溶液中加入石灰乳至溶液,再加进一步除去。加石灰乳调节溶液pH时,不直接将沉淀完全为的原因是 。
(4)若分离后的溶液中,要使完全除尽,则需控制的范围为 ;生产中也可用 (填化学式)代替除去,同时增加产量。
(5)电解废液中可循环利用的物质是 (填化学式)
(6)煅烧时,生成的化学方程式为 。
7.(2023·全国·高考真题)LiMn2O4作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(MnCO3,含有少量Si、Fe、Ni、Al等元素)制备LiMn2O4的流程如下:
已知:Ksp[Fe(OH)3]=2.8×10-39,Ksp[Al(OH)3]=1.3×10-33,Ksp[Ni(OH)2]=5.5×10-16。
回答下列问题:
(1)硫酸溶矿主要反应的化学方程式为 。为提高溶矿速率,可采取的措施 (举1例)。
(2)加入少量MnO2的作用是 。不宜使用H2O2替代MnO2,原因是 。
(3)溶矿反应完成后,反应器中溶液pH=4,此时c(Fe3+)= mol·L-1;用石灰乳调节至pH≈7,除去的金属离子是 。
(4)加入少量BaS溶液除去Ni2+,生成的沉淀有 。
(5)在电解槽中,发生电解反应的离子方程式为 。随着电解反应进行,为保持电解液成分稳定,应不断 。电解废液可在反应器中循环利用。
(6)煅烧窑中,生成LiMn2O4反应的化学方程式是 。
8.(2023·全国·高考真题)铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如下图所示:
已知:最高价铬酸根在酸性介质中以Cr2O存在,在碱性介质中以CrO存在。
回答下列问题:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为 (填化学式)。
(2)水浸渣中主要有SiO2和 。
(3)“沉淀”步骤调pH到弱碱性,主要除去的杂质是 。
(4)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH≈9以达到最好的除杂效果,若pH<9时,会导致 ;pH>9时,会导致 。
(5)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO或VO3+在碱性条件下,溶解为VO或VO,上述性质说明V2O5具有 (填标号)。
A.酸性 B.碱性 C.两性
(6)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为 。
9.(2023·山东·高考真题)盐湖卤水(主要含、和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备的工艺流程如下:
已知:常温下,。相关化合物的溶解度与温度的关系如图所示。
回答下列问题:
(1)含硼固体中的在水中存在平衡:(常温下,);与溶液反应可制备硼砂。常温下,在硼砂溶液中,水解生成等物质的量浓度的和,该水解反应的离子方程式为 ,该溶液 。
(2)滤渣Ⅰ的主要成分是 (填化学式);精制Ⅰ后溶液中的浓度为,则常温下精制Ⅱ过程中浓度应控制在 以下。若脱硼后直接进行精制Ⅰ,除无法回收外,还将增加 的用量(填化学式)。
(3)精制Ⅱ的目的是 ;进行操作时应选择的试剂是 ,若不进行该操作而直接浓缩,将导致 。
10.(23-24高一上·辽宁朝阳·期末)某实验小组同学利用某工业废弃矿石(主要成分为和,其他成分不参与反应制备硫酸铜晶体与硫酸铁铵晶体,工艺流程如下图所示:
回答下列问题:
(1)气体X的名称为 。
(2)“酸浸1”过程中红色固体被溶解的化学方程式为 。
(3)“酸浸2”得到的滤液为 (填主要物质的化学式)溶液,可以转移到 操作工序中循环利用。
(4)“氧化2”过程发生反应的离子方程式为 ,实际操作日所加的量要比理论计算值多,可能原因是 。
(5)“系列操作”包括 、 、过滤、洗涤、干燥,该系列操作所需的仪器铁架台、酒精灯、玻璃棒、蒸发皿、烧杯和 。
(6)若称取25.6 kg废弃矿石经过上述流程最终得到25 kg硫酸铜晶体,则矿石中Cu元的质量分数为 %(保留1位小数)。
11.(23-24高三上·湖南邵阳·阶段练习)碳酸锶( SrCO3)主要用于制造磁性材料、电子元件等。利用锶渣(主要成分SrSO4,含少量CaCO3、Fe2O3、Al2O3、MgCO3杂质),工业上制备超细碳酸锶的工艺如图1所示:
已知:①25°C时溶液中金属离子物质的量浓度c与溶液pH的关系如图2所示:
②Sr (OH)2、Ca(OH)2在不同温度下的溶解度表
温度/℃ 0 20 40 60 80 90 100
Ca(OH)2/g 0.19 0.17 0.14 0.12 0.09 0.08 0.07
Sr(OH)2/g 0.91 1.77 3.95 8.42 20.20 44.50 91.20
回答下列问题:
(1)“高温煅烧”得到的主要产物为锶的硫化物和一种可燃性气体。则“高温煅烧”的主要反应化学方程式为 。
(2)不设置步骤1的后果是 。
(3)“除铁铝”后溶液温度降至室温(25℃),溶液中c(Fe3+) 为 mol/L。
(4)“除镁钙”过程温度控制在95℃~100℃的目的是 。
(5)“沉锶”的离子反应方程式为 。
(6)“沉锶”过程中反应温度对锶转化率的影响如图3所示,温度高于60℃时,锶转化率降低的原因为 。
(7)从平衡移动的角度分析“沉锶”过程中控制pH≥10的原因 。
12.(2023·四川宜宾·一模)氟化镁()是用途广泛的无机化工原料。由菱镁矿(主要成分为,含少量Ca、Si、Fe、Mn和Al等元素)制备氟化镁的流程如下图:
已知:,。回答下列问题:
(1)“煅烧”时,菱镁矿主要成分发生反应的化学方程式是 。
(2)“蒸氨”过程中“尾气”的主要成分是 (填化学式)。
(3)溶液除“氧化除锰”外,还有 的作用。生产中,所需用量远超理论值的原因是 。
(4)“除铁铝”过程中,当恰好沉淀完全时,溶液中 (计算结果保留两位有效数字)。
(5)“除铁铝”时,用氨水调节溶液的pH,但pH不宜过高,原因是 。
(6)“沉淀”时,发生反应的离子方程式是 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.(1) 过滤 冷却结晶或降温结晶
(2)Cu2++Fe=Fe2++Cu
(3)H2SO4
(4) Cu+2Fe3+=2Fe2++Cu2+
(5)0.005
【分析】工业废水中加入过量的铁粉,铁置换出硫酸铜中的铜,过滤,得硫酸亚铁溶液和铁、铜的混合物,铁、铜混合物中加入过量硫酸,铁和硫酸反应生成硫酸亚铁和氢气,过滤出铜单质,蒸发浓缩硫酸亚铁溶液、冷却结晶,析出硫酸亚铁晶体。
【详解】(1)工业废水中加入过量的铁粉,铁置换出硫酸铜中的铜,过滤,得硫酸亚铁溶液和铁、铜的混合物,⑥操作方法的名称是过滤;蒸发浓缩硫酸亚铁溶液、冷却结晶,析出硫酸亚铁晶体,操作⑨包括:蒸发浓缩、冷却结晶、过滤、洗涤、低温干燥。
(2)工业废水中加入过量的铁粉,铁置换出硫酸铜中的铜,加入试剂⑤发生反应的离子方程式为Fe+Cu2+=Cu+Fe2+;
(3)铁、铜混合物中加入过量硫酸,铁和硫酸反应生成硫酸亚铁和氢气,过滤得到铜单质,所以试剂⑦是硫酸,化学式为H2SO4;
(4)④是硫酸亚铁溶液,甲同学取2.0mL④溶液,滴加氢氧化钠溶液,产生白色沉淀氢氧化亚铁,氢氧化亚铁被氧气氧化,很快变为灰绿色,最后变为红褐色氢氧化铁沉淀,反应的化学方程式为;
物质③是Cu,乙同学取Cu,加入氯化铁溶液,生成铜离子和亚铁离子,反应的离子方程式为2Fe3++Cu=Cu2++2Fe2+;
(5)若按上述工艺处理1000L该工业废水,制得320g铜,根据铜元素守恒,,则该工业废水中 。
【点睛】本题以工业废水中回收硫酸亚铁和金属铜为载体,考查混合物分离提纯实验方案的设计及化学方程式的书写,把握实验流程中的试剂及发生的反应、混合物分离方法为解答的关键,侧重分析与推断能力的考查。
2.(1)
(2)
(3) Fe、Cu AD
(4) 加入过量的铁粉,然后过滤分离出滤液
【分析】由流程可知,加入过量的 Fe与氯化铁、氯化铜反应生成氯化亚铁、铜,过滤进行分离出过量铁和生成铜,则滤液a为FeCl2,滤渣中含 Fe、Cu,滤液a中通入足量Cl2,将铁的化合物全部转化为FeCl3溶液,则滤液b为FeCl3溶液,由于Fe3+易水解,应在HCl气体氛围中蒸发结晶获取FeCl3晶体;
【详解】(1)氯化铁和铜生成氯化亚铁和氯化铜,;
(2)Fe3+与KSCN溶液络合生成Fe(SCN)3显血红色,则检验腐蚀废液中含有Fe3+常用试剂是KSCN溶液,反应离子方程式为:;
(3)由分析可知,滤渣的成分是Fe、Cu;铁和稀盐酸反应而铜不和稀盐酸反应;铁和氯化铜生成铜单质和氯化亚铁,过滤分离出铜;浓硫酸使得铁钝化且不和铜反应,稀硝酸和铜反应;故选可以选AD;
(4)Fe与氯化铁生成氯化亚铁,故可以加入过量的铁粉,然后过滤分离出滤液;反应为。
3.(1)
(2) 吸附沉淀,使沉淀颗粒变大,便于过滤除杂
(3)与反应,减小浓度,平衡逆向移动,使元素以形式重新进入水层
(4)
(5) 阳离子 b
【分析】由题给流程可知,向工业废水中先后加入适量酸性高锰酸钾溶液和氯化钠溶液,将溶液中的Tl+离子转化为TlCl离子,加入萃取剂CH3CONR2萃取溶液中的TlCl离子,分液得到水相和含有TlCl离子的有机相;向有机相中加入醋酸铵溶液反萃取、分液得到含有TlCl离子的溶液;向溶液中加入亚硫酸钠溶液,将溶液中的TlCl离子还原为含铊沉淀,过滤分离得到含铊沉淀和达标废液;向工业废水中加入氢氧化钠溶液和絮凝剂分步沉淀,将溶液中的铁离子、锌离子转化为氢氧化铁、氢氧化锌沉淀,过滤得到含有氢氧化铁、氢氧化锌的滤渣和含有Tl+离子的滤液;加入稀硫酸酸化滤液后,加入氧化剂将溶液中Tl+离子氧化为Tl3+离子,向氧化后的溶液中加入阳离子交换树脂吸附脱除Tl3+离子后得到达标废液。
【详解】(1)由分析可知,反应步骤中先后加入适量酸性高锰酸钾溶液和氯化钠溶液的目的是将溶液中的Tl+离子转化为TlCl离子,则总反应的离子方程式为,故答案为:;
(2)由分析可知,分步沉淀时加入氢氧化钠溶液和絮凝剂分步沉淀的目的是将溶液中的铁离子、锌离子转化为氢氧化铁、氢氧化锌沉淀,其中加入絮凝剂的作用是吸附沉淀,使沉淀颗粒变大,便于过滤除杂,故答案为:;吸附沉淀,使沉淀颗粒变大,便于过滤除杂;
(3)由萃取的反应原理可知,反萃取过程中加入醋酸铵溶液的作用是醋酸根离子与溶液中的氢离子反应,减小溶液中氢离子浓度,平衡向逆反应方向移动,使溶液中铊元素以TlCl离子重新进入水层,有利于加入亚硫酸钠溶液将TlCl离子还原为含铊沉淀,故答案为:与反应,减小浓度,平衡逆向移动,使元素以形式重新进入水层;
(4)由离子开始沉淀和沉淀完全时的pH可知,分步沉淀时,沉淀第二种离子为锌离子,为防止溶液pH为10时氢氧化锌溶解,加入氢氧化钠溶液应调节溶液pH的范围为;由铁离子完全沉淀的pH可知,氢氧化铁的溶度积为10—5×(10—10.3)3=10—35.9,由锌离子完全沉淀时溶液pH为8可知,溶液中铁离子浓度为mol/L=10—17.9 mol/L,故答案为:;10—17.9 mol/L;
(5)由分析可知,加入阳离子交换树脂的目的是吸附脱除Tl3+离子后得到达标废液,由吸附过程方程式和Tl3+离子的氧化性强于铁离子可知,若使吸附剂再生,且回收Tl3+离子,可将离子交换树脂浸入硫酸溶液中使平衡逆向移动,故答案为:阳离子;b。
4.(1)3d74s2
(2) 8CoOOH+Na2S2O3+7H2SO4=8CoSO4+Na2SO4+11H2O ClO-+2Fe2++2H+=Cl-+2Fe2++H2O
(3)5.2≤pH<7.6
(4)B
(5)若用CoSO4代替CoCl2,OH-在阳极放电,溶液酸性增强,H+与Co反应,导致Co产率降低
(6)2
【分析】由题给流程可知,向水钴矿中加入硫代硫酸钠溶液和稀硫酸,经还原酸浸、过滤得到含有可溶性硫酸盐的浸出液;向浸出液中加入次氯酸钠溶液,将亚铁离子氧化为铁离子,向氧化后的溶液中加入碳酸钠溶液调节溶液pH在5.2—7.6的范围内,将铁离子和铝离子转化为氢氧化铁沉淀和氢氧化铝沉淀,过滤得到含有氢氧化铁、氢氧化铝的滤渣和除去铁离子、铝离子的滤液Ⅰ;向滤液Ⅰ中加入氟化钠溶液,将溶液中钙离子和镁离子转化为氟化钙沉淀、氟化镁沉淀,过滤得到氟化钙沉淀、氟化镁沉淀和除去钙离子、镁离子的滤液Ⅱ;向滤液Ⅱ中加入有机萃取剂,分液得到除去镍离子、锰离子的萃后余液;向萃后余液中加入草酸铵溶液,将溶液中钴离子转化为二水草酸钴沉淀,过滤得到Ⅲ和二水草酸钴沉淀;向二水草酸钴沉淀中加入盐酸,将沉淀溶解得到氯化钴溶液;电解氯化钴溶液制得金属钴。
【详解】(1)Co为27号元素,故基态Co原子的价层电子排布式为3d74s2;
(2)由分析可知,还原酸浸中发生的氧化还原反应为酸性条件下,CoOOH与硫代硫酸钠溶液反应生成硫酸钠、硫酸钴和水,反应中硫元素化合价由+2变为+6、钴元素化合价由+3变为+2,结合电子守恒可知,化学方程式为8CoOOH+Na2S2O3+7H2SO4=8CoSO4+Na2SO4+11H2O;次氯酸钠具有强氧化性,浸出液中加入次氯酸钠溶液的目的是将亚铁离子氧化为铁离子,反应的离子方程式为ClO-+2Fe2++2H+=Cl-+2Fe2++H2O;
(3)由表格数据结合分析可知,浸出过程中加入碳酸钠溶液调节溶液pH在5.2—7.6的范围内,将铁离子和铝离子转化为氢氧化铁沉淀和氢氧化铝沉淀,除去杂质离子而钴离子、锰离子不沉淀;
(4)由图可知,萃取剂pH在3—4范围内镍离子、锰离子的萃取率很大,而钴离子的萃取率较小,则萃取剂合适的pH在3—4范围内,故选B;
(5)若用硫酸钴代替氯化钴,则阳极上水放电生成氧气、氢离子,使得硫酸钴溶液电解生成硫酸、钴和氧气,反应生成的硫酸能与钴反应,导致钴的产率降低,故答案为:若用CoSO4代替CoCl2,OH-在阳极放电,溶液酸性增强,H+与Co反应,导致Co产率降低;
(6)。
5.(1) 增大反应物的接触面积,加快反应速率 SiO2
(2)
(3) ① B
(4)BC
(5)
【分析】辉铜矿通入空气氧化焙烧,硫元素转化为二氧化硫气体,二氧化硫使用碳酸钠、硫化钠吸收得到硫代硫酸钠溶液,一系列操作得到硫代硫酸钠晶体;铜、铁元素转化为金属氧化物和不反应的二氧化硅进入烧渣1,烧渣加入硫酸,二氧化硅不反应得到滤渣2,铜、铁氧化物转化为盐溶液得到溶液2,加入过量氨水,铁转化为沉淀得到滤渣3,铜离子进入溶液3,加入硫酸经系列处理得到胆矾;
【详解】(1)焙烧时,粉碎矿石的目的是增大反应物的接触面积,加快反应速率;滤渣2的主要成分是不和稀硫酸反应的二氧化硅SiO2;
(2)向Na2S和 Na2CO3的混合溶液中通入SO2制备硫代硫酸钠,Na2S中硫元素化合价由-2变为+2、二氧化硫中硫元素化合价由+4变为+2,硫元素发生归中反应生成硫代硫酸钠,根据质量守恒可知还会生成二氧化碳,结合电子守恒可知,反应化学方程式为;
(3)活化能越小反应越快,活化能越大反应越慢,决定总反应速率的是慢反应,则上述反应中,活化能较大的反应是①;
A.在KI-淀粉溶液中滴加过量 Na2S2O3溶液,生成I2的反应为慢反应,消耗I2的反应为快反应,则溶液中碘单质被迅速转化,且生成的碘离子和Na2S2O3不反应,溶液始终不会变蓝,正确;
B.实验1、2加入的K2S2O8溶液的体积不同,溶液的总体积不同,K2S2O8溶液浓度大小无法确定,不能判断浓度对反应速率的影响,错误;
C.由反应①②可知,当n(Na2S2O3):n(K2S2O8)的值等于2时,恰好反应,溶液中碘元素以碘离子存在,n(Na2S2O3):n(K2S2O8)的值小于2时,生成的碘单质不会完全转化为碘离子,溶液会出现蓝色,正确;
故选B;
(4)溶液2中含 Fe2+、Fe3+,检验溶液2中含 Fe2+,需要考虑铁离子对亚铁离子的干扰,亚铁离子和K3Fe(CN)6溶液生成蓝色沉淀、和酸性 KMnO4溶液发生氧化还原反应使得溶液褪色,故选BC;
(5)①25.0 g CuSO4·5H2O受热会首先失去结晶水得到16.0gCuSO4,继续加热CuSO4会分解生成氧化铜,已知580~1000℃之间产生了两种气体和一种固体,则反应中硫元素化合价降低生成二氧化硫,氧元素化合价升高生成氧气,反应为,反应得到8.0g氧化铜;继续加热氧化铜会分解生成7.2g氧化亚铜和氧气,;故1300 ℃时,固体的成分是。
②由分析可知,580~1000℃之间反应为。
6.(1)或
(2)或能催化分解,利用率低
(3)完全沉淀为时,溶液中部分已经形成沉淀,产物的产率降低
(4) 或
(5)
(6)
【分析】菱锰矿中加入硫酸,其中的碳酸锰,少量的Fe、Ni元素均会溶于硫酸变成相应的离子,加入二氧化锰将亚铁离子氧化成铁离子,调节pH得到氢氧化铁沉淀,再加入硫化钡将镍离子转化为沉淀,分离沉淀得到的电解液中主要是锰离子,通过电解得到二氧化锰,再与碳酸锂共同煅烧形成最终产物。
【详解】(1)锰的原子序数为25,位于第四周期第ⅦB组,其基态锰原子的核外电子排布式为或。
(2)由于过氧化氢不稳定,或者可以催化其分解,导致过氧化氢的利用率降低;
(3)由于和相差不大,若直接将沉淀完全为,则溶液中部分已经形成沉淀,产物的产率降低。
(4)①要使完全除尽,其浓度最小为,则,又因为要求,则,所以
②由于,MnS可以向NiS转化,同时还可以增加浓度,进而增加的产量。
(5)电解过程中,阳极消耗氢氧根,生成氢离子,生成的氢离子和硫酸根形成硫酸,所以电解废液中可循环利用的物质是
(6)由流程可知,煅烧过程中,碳酸锂和二氧化锰反应,生成、二氧化碳和氧气,发生氧化还原反应,利用氧化还原规律配平,可得到化学方程式为:
7.(1) MnCO3+H2SO4=MnSO4+H2O+CO2↑ 粉碎菱锰矿
(2) 将Fe2+氧化为Fe3+ Fe3+可以催化H2O2分解
(3) 2.8×10-9 Al3+
(4)BaSO4、NiS
(5) Mn2++2H2OH2↑+MnO2↓+2H+ 加入Mn(OH)2
(6)2Li2CO3+8MnO24LiMn2O4+2CO2↑+O2↑
【分析】根据题给的流程,将菱锰矿置于反应器中,加入硫酸和MnO2,可将固体溶解为离子,将杂质中的Fe、Ni、Al等元素物质也转化为其离子形式,同时,加入的MnO2可以将溶液中的Fe2+氧化为Fe3+;随后将溶液pH调至制约等于7,此时,根据已知条件给出的三种氢氧化物的溶度积可以将溶液中的Al3+沉淀出来;随后加入BaS,可以将溶液中的Ni2+沉淀,得到相应的滤渣;后溶液中含有大量的Mn2+,将此溶液置于电解槽中电解,得到MnO2,将MnO2与碳酸锂共同煅烧得到最终产物LiMn2O4。
【详解】(1)菱锰矿中主要含有MnCO3,加入硫酸后可以与其反应,硫酸溶矿主要反应的化学方程式为:MnCO3+H2SO4=MnSO4+H2O+CO2↑;为提高溶矿速率,可以将菱锰矿粉碎;故答案为:MnCO3+H2SO4=MnSO4+H2O+CO2↑、粉碎菱锰矿。
(2)根据分析,加入MnO2的作用是将酸溶后溶液中含有的Fe2+氧化为Fe3+,但不宜使用H2O2氧化Fe2+,因为氧化后生成的Fe3+可以催化H2O2分解,不能使溶液中的Fe2+全部氧化为Fe3+;故答案为:将Fe2+氧化为Fe3+、Fe3+可以催化H2O2分解。
(3)溶矿完成以后,反应器中溶液pH=4,此时溶液中c(OH-)=1.0×10-10mol·L-1,此时体系中含有的c(Fe3+)==2.8×10-9mol·L-1,这时,溶液中的c(Fe3+)小于1.0×10-5,认为Fe3+已经沉淀完全;用石灰乳调节至pH≈7,这时溶液中c(OH-)=1.0×10-7mol·L-1,溶液中c(Al3+)=1.3×10-12mol·L-1,c(Ni2+)=5.5×10-2mol·L-1,c(Al3+)小于1.0×10-5,Al3+沉淀完全,这一阶段除去的金属离子是Al3+;故答案为:2.8×10-9、Al3+。
(4)加入少量BaS溶液除去Ni2+,此时溶液中发生的离子方程式为Ba2++S2-+Ni2++SO=BaSO4↓+NiS↓,生成的沉淀有BaSO4、NiS。
(5)在电解槽中,Mn2+发生反应生成MnO2,反应的离子方程式为Mn2++2H2OH2↑+MnO2↓+2H+;电解时电解液中Mn2+大量减少,H+大量增加,需要加入Mn(OH)2以保持电解液成分的稳定;故答案为:Mn2++2H2OH2↑+MnO2↓+2H+、加入Mn(OH)2。
(6)煅烧窑中MnO2与Li2CO3发生反应生成LiMn2O4,反应的化学方程式为2Li2CO3+8MnO24LiMn2O4+2CO2↑+O2↑;故答案为:2Li2CO3+8MnO24LiMn2O4+2CO2↑+O2↑。
8.(1)Na2CrO4
(2)Fe2O3
(3)Al(OH)3
(4) 磷酸根会与H+反应使其浓度降低导致MgNH4PO4无法完全沉淀,同时可能产生硅酸胶状沉淀不宜处理 会导镁离子生成氢氧化镁沉淀,不能形成MgSiO3沉淀,导致产品中混有杂质,同时溶液中铵根离子浓度降低导致MgNH4PO4无法完全沉淀
(5)C
(6)2Cr2O+3S2O+10H+=4Cr3++6SO+5H2O
【分析】由题给流程可知,铬钒渣在氢氧化钠和空气中煅烧,将钒、铬、铝、硅、磷等元素转化为相应的最高价含氧酸盐,煅烧渣加入水浸取、过滤得到含有二氧化硅、氧化铁的滤渣和滤液;向滤液中加入稀硫酸调节溶液pH将Al元素转化为氢氧化铝沉淀,过滤得到氢氧化铝滤渣和滤液;向滤液中加入硫酸镁溶液、硫酸铵溶液将硅元素、磷元素转化为MgSiO3和MgNH4PO4沉淀,过滤得到含有MgSiO3、MgNH4PO4的滤渣和滤液;向滤液中加入稀硫酸调节溶液pH将钒元素转化为五氧化二钒,过滤得到五氧化二钒和滤液;向滤液中焦亚硫酸钠溶液将铬元素转化为三价铬离子,调节溶液pH将铬元素转化为氢氧化铬沉淀,过滤得到氢氧化铬。
【详解】(1)由分析可知,煅烧过程中,铬元素转化为铬酸钠,故答案为:Na2CrO4;
(2)由分析可知,水浸渣中主要有二氧化硅、氧化铁,故答案为:Fe2O3;
(3)由分析可知,沉淀步骤调pH到弱碱性的目的是将Al元素转化为氢氧化铝沉淀,故答案为:Al(OH)3;
(4)由分析可知,加入硫酸镁溶液、硫酸铵溶液的目的是将硅元素、磷元素转化为MgSiO3和MgNH4PO4沉淀,若溶液pH<9时,磷酸根会与H+反应使其浓度降低导致MgNH4PO4无法完全沉淀,同时可能产生硅酸胶状沉淀不宜处理;若溶液pH>9时,会导镁离子生成氢氧化镁沉淀,不能形成MgSiO3沉淀,导致产品中混有杂质,同时溶液中铵根离子浓度降低导致MgNH4PO4无法完全沉淀,故答案为:磷酸根会与H+反应使其浓度降低导致MgNH4PO4,同时可能产生硅酸胶状沉淀不宜处理;会导镁离子生成氢氧化镁沉淀,不能形成MgSiO3沉淀,导致产品中混有杂质,同时溶液中铵根离子浓度降低导致MgNH4PO4无法完全沉淀;
(5)由题给信息可知,五氧化二钒水能与酸溶液反应生成盐和水,也能与碱溶液发生生成盐和水的两性氧化物,故选C;
(6)由题意可知,还原步骤中加入焦亚硫酸钠溶液的目的是将铬元素转化为铬离子,反应的离子方程式为2Cr2O+3S2O+10H+=4Cr3++6SO+5H2O,故答案为:2Cr2O+3S2O+10H+=4Cr3++6SO+5H2O。
9.(1)
(2) 、Mg(OH)2 CaO
(3) 加入纯碱将精制Ⅰ所得滤液中的转化为(或除去精制Ⅰ所得滤液中的),提高纯度 盐酸 浓缩液中因浓度过大使得过早沉淀,即浓缩结晶得到的中会混有,最终所得的产率减小
【分析】由流程可知,卤水中加入盐酸脱硼后过滤,所得滤液经浓缩结晶后得到晶体,该晶体中含有Na+、Li+、Cl-、等,焙烧后生成HCl气体;烧渣水浸后过滤,滤液中加生石灰后产生沉淀,滤渣Ⅰ的主要成分为Mg(OH)2、;精制Ⅰ所得滤液中再加纯碱又生成沉淀,则滤渣Ⅱ为、Mg(OH)2;精制Ⅱ所得滤液经操作X后,所得溶液经浓缩结晶、过滤得到氯化钠,浓缩后的滤液中加入饱和碳酸钠溶液沉锂,得到。
【详解】(1)含硼固体中的在水中存在平衡:(常温下,);与溶液反应可制备硼砂。常温下.在硼砂溶液中,水解生成等物质的量浓度的和,该水解反应的离子方程式为,由B元素守恒可知,和的浓度均为,,则该溶液。
(2)由分析可知,滤渣I的主要成分是、Mg(OH)2;精制I后溶液中的浓度为2.0,由可知,则常温下精制Ⅱ过程中浓度应控制在以下。若脱硼后直接进行精制Ⅰ,若不回收HCl,整个溶液将呈强酸性,因此为达到除Mg2+离子所需的碱性pH首先需要额外多消耗CaO,同时多引入的Ca2+离子需要更多的纯碱除去,因此,还将增加生石灰(CaO)和纯碱()的用量。
(3)精制Ⅰ中,烧渣水浸后的滤液中加生石灰后产生的滤渣Ⅰ的主要成分为;由于微溶于水,精制Ⅰ所得滤液中还含有一定浓度的,还需要除去,因此,精制Ⅱ的目的是:加入纯碱将精制Ⅰ所得滤液中的转化为(或除去精制Ⅰ所得滤液中的),提高纯度。操作X是为了除去剩余的碳酸根离子,为了防止引入杂质离子,应选择的试剂是盐酸;加入盐酸的目的是除去剩余的碳酸根离子,若不进行该操作而直接浓缩,将导致浓缩液中因浓度过大使得过早沉淀,即浓缩结晶得到的中会混有,最终所得的产率减小。
10.(1)二氧化硫
(2)
(3) 氧化2
(4) 易分解
(5) 蒸发浓缩 冷却结晶 漏斗
(6)25.0
【分析】工业废弃矿石(主要成分为CuS和Fe2O3),将其灼烧,CuS转化为CuO和SO2,所以气体X是SO2,残留固体是CuO和Fe2O3,向其中加入足量稀H2SO4,反应产生CuSO4、Fe2(SO4)3,然后加入过量铁粉,发生反应:CuSO4+Fe=FeSO4+Cu;Fe2(SO4)3+Fe=3FeSO4,然后过滤,所得滤液含有FeSO4,滤渣含有Fe、Cu,滤渣酸浸发生反应:Fe+H2SO4=FeSO4+H2↑;而Cu不发生反应,过滤,滤液与前边的滤液合并,向其中加入稀H2SO4、H2O2,反应产生Fe2(SO4)3,再向其中加入(NH4)2SO4,经系列操作可知反应产生硫酸铁铵;滤渣用H2SO4溶解,然后向溶液中鼓入O2,发生反应:2Cu+O2+2H2SO4=CuSO4+2H2O,然后将溶液蒸发浓缩冷却结晶获得硫酸铜晶体。
【详解】(1)根据上述分析可知气体X是SO2,名称是二氧化硫;
(2)“酸浸1”过程中红色固体Fe2O3与H2SO4反应产生Fe2(SO4)3、H2O,反应的化学方程式为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(3))“酸浸2”是Fe、Cu混合物中的Fe与硫酸反应得到FeSO4,Fe+H2SO4=FeSO4+H2↑,而Cu不能发生反应,则发生的滤液为FeSO4;
FeSO4可以被H2O2氧化产生Fe2(SO4)3,因此可以转移到氧化2操作工序中循环利用;
(4)“氧化2”过程中,Fe2+、H+、H2O2发生氧化还原反应产生Fe3+、H2O,发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
实际操作时,所加H2O2的量要比理论计算值多,可能原因是H2O2不稳定,受热易分解导致其被消耗,故H2O2易分解;
(5)CuSO4的溶解度受温度的影响变化较大,因此从溶液中获得CuSO4·5H2O,的系列操作包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥;该系列操作包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥所需的仪器铁架台、酒精灯、玻璃棒、蒸发皿、烧杯和漏斗;
(6))CuSO4·5H2O的式量是250,25 kg硫酸铜晶体的物质的量是n(CuSO4·5H2O)=,根据Cu元素守恒,可知废弃矿石中Cu的物质的量是100 mol,其质量是m(Cu)=100 mol×64 g/mol=6400 g=6.4 kg,故矿石中Cu元素的质量分数为。
11.(1)
(2)铁元素在“除铁铝”过程中不能除尽
(3)1.0×10﹣19.1
(4)氢氧化钙的溶解度较小,氢氧化锶的溶解度较大
(5)
(6)温度高于60°C时,NH4HCO3和氨水分解
(7)当pH≥10时,平衡 H++,正向移动浓度增大有利于生成SrCO3沉淀
【分析】由题干流程图可知,锶渣(主要成分SrSO4,含少量CaCO3、Fe2O3、Al2O3、MgCO3),高温焙烧生成SrS和一种可燃气体CO,CaCO3生成CaO,MgCO3生成MgO,加入稀盐酸酸浸,SrS产生H2S气体,滤液中含有Sr2+、Ca2+、Mg2+、Fe2+、Fe3+和Al3+,加入H2O2,将Fe2+氧化为Fe3+,加入NaOH调节pH=7.5,使Fe3+和Al3+形成Al(OH)3和Fe(OH)3沉淀而除去,再加NaOH溶液,加热至90℃-120℃,调节pH=12除去Ca2+、Mg2+,最后加入氨水和NH4HCO3生成SrCO3,据此分析结合各小问解题。
【详解】(1)高温焙烧SrSO4生成SrS和一种可燃气体CO,根据氧化还原反应配平可得,该反应化学方程式为SrSO4+4CSrS+4CO↑,故答案为:SrSO4+4CSrS+4CO↑;
(2)由分析可知,步骤1为加入H2O2,将Fe2+氧化为Fe3+,由Fe2+沉淀的pH可知,若不氧化,Fe2+除不尽,故答案为:铁元素在“除铁铝”过程中不能除尽;
(3)由图可知,当c(Fe3+)=1.0×10-2mol/L时,溶液的pH=1.8,则KSp[Fe(OH)3]=c(Fe3+)c3(OH-)=10-2×(10-12.2)3=10-38.6,若溶液的pH=7.5时,c(Fe2+)=mol/L=1×10-19.1mol/L,故答案为:1.0×10-19.1;
(4)根据表格数据,温度控制在95℃~100℃时,氢氧化钙的溶解度较小,氢氧化锶的溶解度较大,保证除钙完全,故答案为:氢氧化钙的溶解度较小,氢氧化锶的溶解度较大,保证除钙完全;
(5)由分析可知,沉思过程为:氨水和NH4HCO3生成SrCO3,离子反应方程式为:,故答案为:;
(6)NH4HCO3和氨水受热易分解,温度高于60℃时,NH4HCO3和氨水分解,锶转化率降低,故答案为:温度高于60℃时,NH4HCO3和氨水分解;
(7)“沉锶”过程中,当pH≥10时,平衡 H++正向移动,溶液中浓度增大,有利于生成SrCO3沉淀,故答案为:当pH≥10时,平衡 H++正向移动,溶液中浓度增大,有利于生成SrCO3沉淀。
12.(1)
(2)NH3
(3) 将Fe2+氧化为Fe3+ 生成的MnO2和Fe3+能催化H2O2分解,从而加大H2O2用量
(4)
(5)避免生成Mg(OH)2沉淀
(6)
【分析】由题给流程可知,菱镁矿(主要成分为,含少量Ca、Si、Fe、Mn和Al等元素)煅烧,转变为二氧化碳和各元素的氧化物,加入硝酸铵溶液“蒸氨”,各金属氧化物转变为硝酸盐溶液、二氧化硅不溶,则过滤得滤渣1为二氧化硅、尾气为氨气;向滤液加入过氧化氢“氧化除锰”,锰元素转变为沉淀MnO2,硝酸铵溶液呈酸性,酸性条件下过氧化氢将溶液中的亚铁离子转化为铁离子,则过滤所得滤渣2为MnO2,滤液中加入草酸溶液“除钙”,反应中产生草酸钙沉淀,则过滤所得滤渣3为CaC2O4,向滤液中加入氨水“除铁铝”:调节溶液pH,将溶液中铁离子、铝离子转化为氢氧化铁、氢氧化铝沉淀,则过滤得到滤渣4含有氢氧化铁、氢氧化铝,滤液所含主要阳离子为镁离子,向滤液中加入氢氟酸溶液,将溶液中镁离子转化为氟化镁沉淀,过滤即得到目标产物氟化镁。
【详解】(1)“煅烧”时,主要成分菱镁矿碳酸镁分解为氧化镁和二氧化碳,化学方程式是:。
(2)硝酸铵溶液水解呈酸性,反应中消耗氢离子促进铵离子水解,产生的一水合氨受热分解为氨气,则“蒸氨”过程中“尾气”的主要成分是NH3。
(3)溶液是绿色氧化剂,反应中除“氧化除锰”外,还有将Fe2+氧化为Fe3+的作用。过氧化氢不稳定易分解,则生产中所需用量远超理论值的原因是:生成的MnO2和Fe3+能催化H2O2分解,从而加大H2O2用量。
(4)“除铁铝”过程中,由,知:当恰好沉淀完全时,铁离子早已沉淀完全,则溶液中。
(5)“除铁铝”时,用氨水调节溶液的pH,但pH不宜过高的原因是:避免生成Mg(OH)2沉淀。
(6)HF为弱酸,则 “沉淀”时,反应产生氟化镁沉淀的离子方程式是:。
答案第1页,共2页
答案第1页,共2页
一、非选择题,共12小题
1.(23-24高一上·福建厦门·阶段练习)某工厂的工业废水中含有大量的FeSO4和较多的Cu2+。为了减少污染并变废为宝,工厂计划从该废水中回收FeSO4和金属铜。请根据以下流程图,回答下列问题:
(1)⑥操作方法的名称是 ;操作⑨包括:蒸发浓缩、 、过滤、洗涤、低温干燥。
(2)加入试剂⑤发生反应的离子方程式为 。
(3)试剂⑦的化学式为 。
(4)某兴趣小组同学欲鉴别④中的金属阳离子,设计如下实验:
甲同学取2.0mL④溶液,滴加氢氧化钠溶液,产生白色沉淀且很快变为灰绿色,最后变为红褐色沉淀,其中涉及氧化还原反应的化学方程式为 。
乙同学取物质③,加入FeCl3溶液,观察到物质③溶解,涉及的离子反应方程式为 。
(5)若按上述工艺处理1000L该工业废水,制得320g铜,则该工业废水中c(Cu2+)= mol/L。
2.(23-24高一上·云南红河·阶段练习)电子工业中,常用FeCl3溶液腐蚀覆盖在绝缘板上的铜箔制造印刷电路板。化学实验小组从腐蚀废液(含FeCl3、FeCl2、CuCl2)中回收得并重新获得FeCl3晶体的流程如图:
回答下列问题:
(1)FeCl3溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板的化学反应方程式 。
(2)腐蚀废液中含有Fe3+最好用KSCN溶液检验,该反应的离子方程式为: 。
(3)滤渣的成分是 (填化学式)。从滤渣中获得铜单质,可选用的试剂是 (填序号)。
A.稀盐酸 B.浓硫酸 C.稀硝酸 D.氯化铜溶液
(4)实际上Fe2+的还原性较强,实验室的FeCl2溶液常因氧化而变质。除杂的方法是 ,相关反应的离子方程式: 。
3.(23-24高三上·山东济宁·期末)铊是一种有毒有害的重金属元素,对人体有较大的危害。湿法炼锌工业废水中的主要阳离子有,需要处理回收金属元素达标后排放,可以采用以下不同方法处理废水:
已知:①氧化性强于,为两性氧化物,溶液时开始溶解,常温下相关离子开始沉淀和沉淀完全时的如表所示:
离子
开始沉淀的 2.7 6.4 1.4
沉淀完全的 3.7 8.0 2.8
②萃取的反应原理为H++CH3CONR2+TlCl[CH3CONR2H]TlCl4
请回答下列问题:
(1)“反应”步骤中总反应的离子方程式为 。
(2)“滤渣”的主要成分是 (填化学式),通常在“分步沉淀”时加入絮凝剂,其目的是 。
(3)请从化学平衡的角度解释“反萃取”过程中加入的原理和目的 。
(4)“分步沉淀”时,沉淀第二种离子时调节溶液的范围为 ,当其恰好完全沉淀,则溶液中先沉淀的离子浓度为 。
(5)废水中吸附过程如图所示,该树脂为 (填“阳离子”或“阴离子”)交换树脂,若使吸附剂再生,且回收,可将离子交换树脂浸入 溶液。
a. b. c.
4.(23-24高三上·湖南长沙·阶段练习)水钴矿主要成分为CoOOH,同时含有少量Fe、Al、Mn、Mg、Ca、Ni的氧化物及其他杂质。用水钴矿制取Co的工艺流程如图甲所示:
已知部分阳离子形成氢氧化物沉淀时,溶液pH见下表:
沉淀物 Fe(OH)2 Fe(OH)3 Co(OH)2 Mn(OH)2 Al(OH)3
开始沉淀时的pH 7.0 2.7 7.6 7.7 4.0
沉淀完全时的pH 9.6 3.7 9.2 9.8 5.2
请回答下列问题:
(1)基态Co原子的价层电子排布式为 。
(2)“还原酸浸”中发生的氧化还原反应的化学方程式是 。浸出液中加入NaClO溶液的目的: (用离子方程式表示)。
(3)浸出过程中加入Na2CO3调pH的范围是 。
(4)如图乙所示,萃取剂可以把滤液Ⅱ中部分阳离子选择性分离。萃取剂合适的pH为___________(填标号)。
A.2~3 B.3~4 C.6~7 D.7~8
(5)Co能与强酸反应产生H2,工业上采用惰性电极电解CoCl2溶液制取钴,不能用CoSO4溶液代替CoCl2溶液的理由是 。
(6)已知:Ksp(MgF2)=7.5×10-11,Ksp(CaF2)=1.5×10-10,加入NaF后,所得“滤液Ⅱ”中= 。
5.(23-24高三上·云南·阶段练习)以辉铜矿(主要成分是 Cu2S。含少量 FeS2、FeS、SiO2等)为原料制备胆矾、硫代硫酸钠(Na2S2O3·5H2O)。流程如图所示。 回答下列问题:
已知:Cu(OH)2+4NH3·H2O═[Cu(NH3)4](OH)2+4H2O,[Cu(NH3)4](OH)2与硫酸反应生成CuSO4。
(1)焙烧时,粉碎矿石的目的是 ;滤渣2的主要成分是 (填化学式)。
(2)向Na2S和 Na2CO3的混合溶液中通入SO2制备硫代硫酸钠的化学方程式为 。
(3)某小组探究外界条件对 Na2S2O3相关反应的反应速率的影响,实验方案如下:
已知:① (慢),②(快)。
体积/mL
实验序号 K2S2O8溶液 KI溶液 Na2S2O3溶液 淀粉溶液
1 10.0 4.0 5.0 2.0
2 5.0 4.0 5.0 2.0
上述反应中,活化能较大的反应是 (填“①”或“②”)。下列叙述错误的是 (填标号)。
A.在KI-淀粉溶液中滴加过量 Na2S2O3溶液,溶液始终不会变蓝
B.上述方案可以探究浓度对反应速率的影响
C.当n(Na2S2O3):n(K2S2O8)的值小于2时会出现蓝色
(4)检验溶液2中含 Fe2+的试剂可能是___________(填标号)。
A.KSCN溶液 B.K3Fe(CN)6溶液 C.酸性 KMnO4溶液 D.NaOH 溶液
(5)25.0 g CuSO4·5H2O受热分解。残留固体的质量与温度的关系如图所示。
①1300 ℃时,固体的成分是 (填化学式)。
②已知580~1000℃之间产生了两种气体和一种固体,写出发生反应的化学方程式: 。
6.(23-24高三上·江苏泰州·期中)由菱锰矿(主要成分为,还含有少量Si、Fe、Ni等元素)制备一种新型锂电池正极材料的工艺流程如下:
已知:①,,,,。
②当溶液中离子浓度小于时,可视为沉淀完全。
③可溶于水。
(1)基态锰原子的核外电子排布式为 。
(2)加入少量的目的是氧化,实际生产中不用替代的原因是 。
(3)溶矿反应完成后,先向反应后溶液中加入石灰乳至溶液,再加进一步除去。加石灰乳调节溶液pH时,不直接将沉淀完全为的原因是 。
(4)若分离后的溶液中,要使完全除尽,则需控制的范围为 ;生产中也可用 (填化学式)代替除去,同时增加产量。
(5)电解废液中可循环利用的物质是 (填化学式)
(6)煅烧时,生成的化学方程式为 。
7.(2023·全国·高考真题)LiMn2O4作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(MnCO3,含有少量Si、Fe、Ni、Al等元素)制备LiMn2O4的流程如下:
已知:Ksp[Fe(OH)3]=2.8×10-39,Ksp[Al(OH)3]=1.3×10-33,Ksp[Ni(OH)2]=5.5×10-16。
回答下列问题:
(1)硫酸溶矿主要反应的化学方程式为 。为提高溶矿速率,可采取的措施 (举1例)。
(2)加入少量MnO2的作用是 。不宜使用H2O2替代MnO2,原因是 。
(3)溶矿反应完成后,反应器中溶液pH=4,此时c(Fe3+)= mol·L-1;用石灰乳调节至pH≈7,除去的金属离子是 。
(4)加入少量BaS溶液除去Ni2+,生成的沉淀有 。
(5)在电解槽中,发生电解反应的离子方程式为 。随着电解反应进行,为保持电解液成分稳定,应不断 。电解废液可在反应器中循环利用。
(6)煅烧窑中,生成LiMn2O4反应的化学方程式是 。
8.(2023·全国·高考真题)铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如下图所示:
已知:最高价铬酸根在酸性介质中以Cr2O存在,在碱性介质中以CrO存在。
回答下列问题:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为 (填化学式)。
(2)水浸渣中主要有SiO2和 。
(3)“沉淀”步骤调pH到弱碱性,主要除去的杂质是 。
(4)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH≈9以达到最好的除杂效果,若pH<9时,会导致 ;pH>9时,会导致 。
(5)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO或VO3+在碱性条件下,溶解为VO或VO,上述性质说明V2O5具有 (填标号)。
A.酸性 B.碱性 C.两性
(6)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为 。
9.(2023·山东·高考真题)盐湖卤水(主要含、和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备的工艺流程如下:
已知:常温下,。相关化合物的溶解度与温度的关系如图所示。
回答下列问题:
(1)含硼固体中的在水中存在平衡:(常温下,);与溶液反应可制备硼砂。常温下,在硼砂溶液中,水解生成等物质的量浓度的和,该水解反应的离子方程式为 ,该溶液 。
(2)滤渣Ⅰ的主要成分是 (填化学式);精制Ⅰ后溶液中的浓度为,则常温下精制Ⅱ过程中浓度应控制在 以下。若脱硼后直接进行精制Ⅰ,除无法回收外,还将增加 的用量(填化学式)。
(3)精制Ⅱ的目的是 ;进行操作时应选择的试剂是 ,若不进行该操作而直接浓缩,将导致 。
10.(23-24高一上·辽宁朝阳·期末)某实验小组同学利用某工业废弃矿石(主要成分为和,其他成分不参与反应制备硫酸铜晶体与硫酸铁铵晶体,工艺流程如下图所示:
回答下列问题:
(1)气体X的名称为 。
(2)“酸浸1”过程中红色固体被溶解的化学方程式为 。
(3)“酸浸2”得到的滤液为 (填主要物质的化学式)溶液,可以转移到 操作工序中循环利用。
(4)“氧化2”过程发生反应的离子方程式为 ,实际操作日所加的量要比理论计算值多,可能原因是 。
(5)“系列操作”包括 、 、过滤、洗涤、干燥,该系列操作所需的仪器铁架台、酒精灯、玻璃棒、蒸发皿、烧杯和 。
(6)若称取25.6 kg废弃矿石经过上述流程最终得到25 kg硫酸铜晶体,则矿石中Cu元的质量分数为 %(保留1位小数)。
11.(23-24高三上·湖南邵阳·阶段练习)碳酸锶( SrCO3)主要用于制造磁性材料、电子元件等。利用锶渣(主要成分SrSO4,含少量CaCO3、Fe2O3、Al2O3、MgCO3杂质),工业上制备超细碳酸锶的工艺如图1所示:
已知:①25°C时溶液中金属离子物质的量浓度c与溶液pH的关系如图2所示:
②Sr (OH)2、Ca(OH)2在不同温度下的溶解度表
温度/℃ 0 20 40 60 80 90 100
Ca(OH)2/g 0.19 0.17 0.14 0.12 0.09 0.08 0.07
Sr(OH)2/g 0.91 1.77 3.95 8.42 20.20 44.50 91.20
回答下列问题:
(1)“高温煅烧”得到的主要产物为锶的硫化物和一种可燃性气体。则“高温煅烧”的主要反应化学方程式为 。
(2)不设置步骤1的后果是 。
(3)“除铁铝”后溶液温度降至室温(25℃),溶液中c(Fe3+) 为 mol/L。
(4)“除镁钙”过程温度控制在95℃~100℃的目的是 。
(5)“沉锶”的离子反应方程式为 。
(6)“沉锶”过程中反应温度对锶转化率的影响如图3所示,温度高于60℃时,锶转化率降低的原因为 。
(7)从平衡移动的角度分析“沉锶”过程中控制pH≥10的原因 。
12.(2023·四川宜宾·一模)氟化镁()是用途广泛的无机化工原料。由菱镁矿(主要成分为,含少量Ca、Si、Fe、Mn和Al等元素)制备氟化镁的流程如下图:
已知:,。回答下列问题:
(1)“煅烧”时,菱镁矿主要成分发生反应的化学方程式是 。
(2)“蒸氨”过程中“尾气”的主要成分是 (填化学式)。
(3)溶液除“氧化除锰”外,还有 的作用。生产中,所需用量远超理论值的原因是 。
(4)“除铁铝”过程中,当恰好沉淀完全时,溶液中 (计算结果保留两位有效数字)。
(5)“除铁铝”时,用氨水调节溶液的pH,但pH不宜过高,原因是 。
(6)“沉淀”时,发生反应的离子方程式是 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.(1) 过滤 冷却结晶或降温结晶
(2)Cu2++Fe=Fe2++Cu
(3)H2SO4
(4) Cu+2Fe3+=2Fe2++Cu2+
(5)0.005
【分析】工业废水中加入过量的铁粉,铁置换出硫酸铜中的铜,过滤,得硫酸亚铁溶液和铁、铜的混合物,铁、铜混合物中加入过量硫酸,铁和硫酸反应生成硫酸亚铁和氢气,过滤出铜单质,蒸发浓缩硫酸亚铁溶液、冷却结晶,析出硫酸亚铁晶体。
【详解】(1)工业废水中加入过量的铁粉,铁置换出硫酸铜中的铜,过滤,得硫酸亚铁溶液和铁、铜的混合物,⑥操作方法的名称是过滤;蒸发浓缩硫酸亚铁溶液、冷却结晶,析出硫酸亚铁晶体,操作⑨包括:蒸发浓缩、冷却结晶、过滤、洗涤、低温干燥。
(2)工业废水中加入过量的铁粉,铁置换出硫酸铜中的铜,加入试剂⑤发生反应的离子方程式为Fe+Cu2+=Cu+Fe2+;
(3)铁、铜混合物中加入过量硫酸,铁和硫酸反应生成硫酸亚铁和氢气,过滤得到铜单质,所以试剂⑦是硫酸,化学式为H2SO4;
(4)④是硫酸亚铁溶液,甲同学取2.0mL④溶液,滴加氢氧化钠溶液,产生白色沉淀氢氧化亚铁,氢氧化亚铁被氧气氧化,很快变为灰绿色,最后变为红褐色氢氧化铁沉淀,反应的化学方程式为;
物质③是Cu,乙同学取Cu,加入氯化铁溶液,生成铜离子和亚铁离子,反应的离子方程式为2Fe3++Cu=Cu2++2Fe2+;
(5)若按上述工艺处理1000L该工业废水,制得320g铜,根据铜元素守恒,,则该工业废水中 。
【点睛】本题以工业废水中回收硫酸亚铁和金属铜为载体,考查混合物分离提纯实验方案的设计及化学方程式的书写,把握实验流程中的试剂及发生的反应、混合物分离方法为解答的关键,侧重分析与推断能力的考查。
2.(1)
(2)
(3) Fe、Cu AD
(4) 加入过量的铁粉,然后过滤分离出滤液
【分析】由流程可知,加入过量的 Fe与氯化铁、氯化铜反应生成氯化亚铁、铜,过滤进行分离出过量铁和生成铜,则滤液a为FeCl2,滤渣中含 Fe、Cu,滤液a中通入足量Cl2,将铁的化合物全部转化为FeCl3溶液,则滤液b为FeCl3溶液,由于Fe3+易水解,应在HCl气体氛围中蒸发结晶获取FeCl3晶体;
【详解】(1)氯化铁和铜生成氯化亚铁和氯化铜,;
(2)Fe3+与KSCN溶液络合生成Fe(SCN)3显血红色,则检验腐蚀废液中含有Fe3+常用试剂是KSCN溶液,反应离子方程式为:;
(3)由分析可知,滤渣的成分是Fe、Cu;铁和稀盐酸反应而铜不和稀盐酸反应;铁和氯化铜生成铜单质和氯化亚铁,过滤分离出铜;浓硫酸使得铁钝化且不和铜反应,稀硝酸和铜反应;故选可以选AD;
(4)Fe与氯化铁生成氯化亚铁,故可以加入过量的铁粉,然后过滤分离出滤液;反应为。
3.(1)
(2) 吸附沉淀,使沉淀颗粒变大,便于过滤除杂
(3)与反应,减小浓度,平衡逆向移动,使元素以形式重新进入水层
(4)
(5) 阳离子 b
【分析】由题给流程可知,向工业废水中先后加入适量酸性高锰酸钾溶液和氯化钠溶液,将溶液中的Tl+离子转化为TlCl离子,加入萃取剂CH3CONR2萃取溶液中的TlCl离子,分液得到水相和含有TlCl离子的有机相;向有机相中加入醋酸铵溶液反萃取、分液得到含有TlCl离子的溶液;向溶液中加入亚硫酸钠溶液,将溶液中的TlCl离子还原为含铊沉淀,过滤分离得到含铊沉淀和达标废液;向工业废水中加入氢氧化钠溶液和絮凝剂分步沉淀,将溶液中的铁离子、锌离子转化为氢氧化铁、氢氧化锌沉淀,过滤得到含有氢氧化铁、氢氧化锌的滤渣和含有Tl+离子的滤液;加入稀硫酸酸化滤液后,加入氧化剂将溶液中Tl+离子氧化为Tl3+离子,向氧化后的溶液中加入阳离子交换树脂吸附脱除Tl3+离子后得到达标废液。
【详解】(1)由分析可知,反应步骤中先后加入适量酸性高锰酸钾溶液和氯化钠溶液的目的是将溶液中的Tl+离子转化为TlCl离子,则总反应的离子方程式为,故答案为:;
(2)由分析可知,分步沉淀时加入氢氧化钠溶液和絮凝剂分步沉淀的目的是将溶液中的铁离子、锌离子转化为氢氧化铁、氢氧化锌沉淀,其中加入絮凝剂的作用是吸附沉淀,使沉淀颗粒变大,便于过滤除杂,故答案为:;吸附沉淀,使沉淀颗粒变大,便于过滤除杂;
(3)由萃取的反应原理可知,反萃取过程中加入醋酸铵溶液的作用是醋酸根离子与溶液中的氢离子反应,减小溶液中氢离子浓度,平衡向逆反应方向移动,使溶液中铊元素以TlCl离子重新进入水层,有利于加入亚硫酸钠溶液将TlCl离子还原为含铊沉淀,故答案为:与反应,减小浓度,平衡逆向移动,使元素以形式重新进入水层;
(4)由离子开始沉淀和沉淀完全时的pH可知,分步沉淀时,沉淀第二种离子为锌离子,为防止溶液pH为10时氢氧化锌溶解,加入氢氧化钠溶液应调节溶液pH的范围为;由铁离子完全沉淀的pH可知,氢氧化铁的溶度积为10—5×(10—10.3)3=10—35.9,由锌离子完全沉淀时溶液pH为8可知,溶液中铁离子浓度为mol/L=10—17.9 mol/L,故答案为:;10—17.9 mol/L;
(5)由分析可知,加入阳离子交换树脂的目的是吸附脱除Tl3+离子后得到达标废液,由吸附过程方程式和Tl3+离子的氧化性强于铁离子可知,若使吸附剂再生,且回收Tl3+离子,可将离子交换树脂浸入硫酸溶液中使平衡逆向移动,故答案为:阳离子;b。
4.(1)3d74s2
(2) 8CoOOH+Na2S2O3+7H2SO4=8CoSO4+Na2SO4+11H2O ClO-+2Fe2++2H+=Cl-+2Fe2++H2O
(3)5.2≤pH<7.6
(4)B
(5)若用CoSO4代替CoCl2,OH-在阳极放电,溶液酸性增强,H+与Co反应,导致Co产率降低
(6)2
【分析】由题给流程可知,向水钴矿中加入硫代硫酸钠溶液和稀硫酸,经还原酸浸、过滤得到含有可溶性硫酸盐的浸出液;向浸出液中加入次氯酸钠溶液,将亚铁离子氧化为铁离子,向氧化后的溶液中加入碳酸钠溶液调节溶液pH在5.2—7.6的范围内,将铁离子和铝离子转化为氢氧化铁沉淀和氢氧化铝沉淀,过滤得到含有氢氧化铁、氢氧化铝的滤渣和除去铁离子、铝离子的滤液Ⅰ;向滤液Ⅰ中加入氟化钠溶液,将溶液中钙离子和镁离子转化为氟化钙沉淀、氟化镁沉淀,过滤得到氟化钙沉淀、氟化镁沉淀和除去钙离子、镁离子的滤液Ⅱ;向滤液Ⅱ中加入有机萃取剂,分液得到除去镍离子、锰离子的萃后余液;向萃后余液中加入草酸铵溶液,将溶液中钴离子转化为二水草酸钴沉淀,过滤得到Ⅲ和二水草酸钴沉淀;向二水草酸钴沉淀中加入盐酸,将沉淀溶解得到氯化钴溶液;电解氯化钴溶液制得金属钴。
【详解】(1)Co为27号元素,故基态Co原子的价层电子排布式为3d74s2;
(2)由分析可知,还原酸浸中发生的氧化还原反应为酸性条件下,CoOOH与硫代硫酸钠溶液反应生成硫酸钠、硫酸钴和水,反应中硫元素化合价由+2变为+6、钴元素化合价由+3变为+2,结合电子守恒可知,化学方程式为8CoOOH+Na2S2O3+7H2SO4=8CoSO4+Na2SO4+11H2O;次氯酸钠具有强氧化性,浸出液中加入次氯酸钠溶液的目的是将亚铁离子氧化为铁离子,反应的离子方程式为ClO-+2Fe2++2H+=Cl-+2Fe2++H2O;
(3)由表格数据结合分析可知,浸出过程中加入碳酸钠溶液调节溶液pH在5.2—7.6的范围内,将铁离子和铝离子转化为氢氧化铁沉淀和氢氧化铝沉淀,除去杂质离子而钴离子、锰离子不沉淀;
(4)由图可知,萃取剂pH在3—4范围内镍离子、锰离子的萃取率很大,而钴离子的萃取率较小,则萃取剂合适的pH在3—4范围内,故选B;
(5)若用硫酸钴代替氯化钴,则阳极上水放电生成氧气、氢离子,使得硫酸钴溶液电解生成硫酸、钴和氧气,反应生成的硫酸能与钴反应,导致钴的产率降低,故答案为:若用CoSO4代替CoCl2,OH-在阳极放电,溶液酸性增强,H+与Co反应,导致Co产率降低;
(6)。
5.(1) 增大反应物的接触面积,加快反应速率 SiO2
(2)
(3) ① B
(4)BC
(5)
【分析】辉铜矿通入空气氧化焙烧,硫元素转化为二氧化硫气体,二氧化硫使用碳酸钠、硫化钠吸收得到硫代硫酸钠溶液,一系列操作得到硫代硫酸钠晶体;铜、铁元素转化为金属氧化物和不反应的二氧化硅进入烧渣1,烧渣加入硫酸,二氧化硅不反应得到滤渣2,铜、铁氧化物转化为盐溶液得到溶液2,加入过量氨水,铁转化为沉淀得到滤渣3,铜离子进入溶液3,加入硫酸经系列处理得到胆矾;
【详解】(1)焙烧时,粉碎矿石的目的是增大反应物的接触面积,加快反应速率;滤渣2的主要成分是不和稀硫酸反应的二氧化硅SiO2;
(2)向Na2S和 Na2CO3的混合溶液中通入SO2制备硫代硫酸钠,Na2S中硫元素化合价由-2变为+2、二氧化硫中硫元素化合价由+4变为+2,硫元素发生归中反应生成硫代硫酸钠,根据质量守恒可知还会生成二氧化碳,结合电子守恒可知,反应化学方程式为;
(3)活化能越小反应越快,活化能越大反应越慢,决定总反应速率的是慢反应,则上述反应中,活化能较大的反应是①;
A.在KI-淀粉溶液中滴加过量 Na2S2O3溶液,生成I2的反应为慢反应,消耗I2的反应为快反应,则溶液中碘单质被迅速转化,且生成的碘离子和Na2S2O3不反应,溶液始终不会变蓝,正确;
B.实验1、2加入的K2S2O8溶液的体积不同,溶液的总体积不同,K2S2O8溶液浓度大小无法确定,不能判断浓度对反应速率的影响,错误;
C.由反应①②可知,当n(Na2S2O3):n(K2S2O8)的值等于2时,恰好反应,溶液中碘元素以碘离子存在,n(Na2S2O3):n(K2S2O8)的值小于2时,生成的碘单质不会完全转化为碘离子,溶液会出现蓝色,正确;
故选B;
(4)溶液2中含 Fe2+、Fe3+,检验溶液2中含 Fe2+,需要考虑铁离子对亚铁离子的干扰,亚铁离子和K3Fe(CN)6溶液生成蓝色沉淀、和酸性 KMnO4溶液发生氧化还原反应使得溶液褪色,故选BC;
(5)①25.0 g CuSO4·5H2O受热会首先失去结晶水得到16.0gCuSO4,继续加热CuSO4会分解生成氧化铜,已知580~1000℃之间产生了两种气体和一种固体,则反应中硫元素化合价降低生成二氧化硫,氧元素化合价升高生成氧气,反应为,反应得到8.0g氧化铜;继续加热氧化铜会分解生成7.2g氧化亚铜和氧气,;故1300 ℃时,固体的成分是。
②由分析可知,580~1000℃之间反应为。
6.(1)或
(2)或能催化分解,利用率低
(3)完全沉淀为时,溶液中部分已经形成沉淀,产物的产率降低
(4) 或
(5)
(6)
【分析】菱锰矿中加入硫酸,其中的碳酸锰,少量的Fe、Ni元素均会溶于硫酸变成相应的离子,加入二氧化锰将亚铁离子氧化成铁离子,调节pH得到氢氧化铁沉淀,再加入硫化钡将镍离子转化为沉淀,分离沉淀得到的电解液中主要是锰离子,通过电解得到二氧化锰,再与碳酸锂共同煅烧形成最终产物。
【详解】(1)锰的原子序数为25,位于第四周期第ⅦB组,其基态锰原子的核外电子排布式为或。
(2)由于过氧化氢不稳定,或者可以催化其分解,导致过氧化氢的利用率降低;
(3)由于和相差不大,若直接将沉淀完全为,则溶液中部分已经形成沉淀,产物的产率降低。
(4)①要使完全除尽,其浓度最小为,则,又因为要求,则,所以
②由于,MnS可以向NiS转化,同时还可以增加浓度,进而增加的产量。
(5)电解过程中,阳极消耗氢氧根,生成氢离子,生成的氢离子和硫酸根形成硫酸,所以电解废液中可循环利用的物质是
(6)由流程可知,煅烧过程中,碳酸锂和二氧化锰反应,生成、二氧化碳和氧气,发生氧化还原反应,利用氧化还原规律配平,可得到化学方程式为:
7.(1) MnCO3+H2SO4=MnSO4+H2O+CO2↑ 粉碎菱锰矿
(2) 将Fe2+氧化为Fe3+ Fe3+可以催化H2O2分解
(3) 2.8×10-9 Al3+
(4)BaSO4、NiS
(5) Mn2++2H2OH2↑+MnO2↓+2H+ 加入Mn(OH)2
(6)2Li2CO3+8MnO24LiMn2O4+2CO2↑+O2↑
【分析】根据题给的流程,将菱锰矿置于反应器中,加入硫酸和MnO2,可将固体溶解为离子,将杂质中的Fe、Ni、Al等元素物质也转化为其离子形式,同时,加入的MnO2可以将溶液中的Fe2+氧化为Fe3+;随后将溶液pH调至制约等于7,此时,根据已知条件给出的三种氢氧化物的溶度积可以将溶液中的Al3+沉淀出来;随后加入BaS,可以将溶液中的Ni2+沉淀,得到相应的滤渣;后溶液中含有大量的Mn2+,将此溶液置于电解槽中电解,得到MnO2,将MnO2与碳酸锂共同煅烧得到最终产物LiMn2O4。
【详解】(1)菱锰矿中主要含有MnCO3,加入硫酸后可以与其反应,硫酸溶矿主要反应的化学方程式为:MnCO3+H2SO4=MnSO4+H2O+CO2↑;为提高溶矿速率,可以将菱锰矿粉碎;故答案为:MnCO3+H2SO4=MnSO4+H2O+CO2↑、粉碎菱锰矿。
(2)根据分析,加入MnO2的作用是将酸溶后溶液中含有的Fe2+氧化为Fe3+,但不宜使用H2O2氧化Fe2+,因为氧化后生成的Fe3+可以催化H2O2分解,不能使溶液中的Fe2+全部氧化为Fe3+;故答案为:将Fe2+氧化为Fe3+、Fe3+可以催化H2O2分解。
(3)溶矿完成以后,反应器中溶液pH=4,此时溶液中c(OH-)=1.0×10-10mol·L-1,此时体系中含有的c(Fe3+)==2.8×10-9mol·L-1,这时,溶液中的c(Fe3+)小于1.0×10-5,认为Fe3+已经沉淀完全;用石灰乳调节至pH≈7,这时溶液中c(OH-)=1.0×10-7mol·L-1,溶液中c(Al3+)=1.3×10-12mol·L-1,c(Ni2+)=5.5×10-2mol·L-1,c(Al3+)小于1.0×10-5,Al3+沉淀完全,这一阶段除去的金属离子是Al3+;故答案为:2.8×10-9、Al3+。
(4)加入少量BaS溶液除去Ni2+,此时溶液中发生的离子方程式为Ba2++S2-+Ni2++SO=BaSO4↓+NiS↓,生成的沉淀有BaSO4、NiS。
(5)在电解槽中,Mn2+发生反应生成MnO2,反应的离子方程式为Mn2++2H2OH2↑+MnO2↓+2H+;电解时电解液中Mn2+大量减少,H+大量增加,需要加入Mn(OH)2以保持电解液成分的稳定;故答案为:Mn2++2H2OH2↑+MnO2↓+2H+、加入Mn(OH)2。
(6)煅烧窑中MnO2与Li2CO3发生反应生成LiMn2O4,反应的化学方程式为2Li2CO3+8MnO24LiMn2O4+2CO2↑+O2↑;故答案为:2Li2CO3+8MnO24LiMn2O4+2CO2↑+O2↑。
8.(1)Na2CrO4
(2)Fe2O3
(3)Al(OH)3
(4) 磷酸根会与H+反应使其浓度降低导致MgNH4PO4无法完全沉淀,同时可能产生硅酸胶状沉淀不宜处理 会导镁离子生成氢氧化镁沉淀,不能形成MgSiO3沉淀,导致产品中混有杂质,同时溶液中铵根离子浓度降低导致MgNH4PO4无法完全沉淀
(5)C
(6)2Cr2O+3S2O+10H+=4Cr3++6SO+5H2O
【分析】由题给流程可知,铬钒渣在氢氧化钠和空气中煅烧,将钒、铬、铝、硅、磷等元素转化为相应的最高价含氧酸盐,煅烧渣加入水浸取、过滤得到含有二氧化硅、氧化铁的滤渣和滤液;向滤液中加入稀硫酸调节溶液pH将Al元素转化为氢氧化铝沉淀,过滤得到氢氧化铝滤渣和滤液;向滤液中加入硫酸镁溶液、硫酸铵溶液将硅元素、磷元素转化为MgSiO3和MgNH4PO4沉淀,过滤得到含有MgSiO3、MgNH4PO4的滤渣和滤液;向滤液中加入稀硫酸调节溶液pH将钒元素转化为五氧化二钒,过滤得到五氧化二钒和滤液;向滤液中焦亚硫酸钠溶液将铬元素转化为三价铬离子,调节溶液pH将铬元素转化为氢氧化铬沉淀,过滤得到氢氧化铬。
【详解】(1)由分析可知,煅烧过程中,铬元素转化为铬酸钠,故答案为:Na2CrO4;
(2)由分析可知,水浸渣中主要有二氧化硅、氧化铁,故答案为:Fe2O3;
(3)由分析可知,沉淀步骤调pH到弱碱性的目的是将Al元素转化为氢氧化铝沉淀,故答案为:Al(OH)3;
(4)由分析可知,加入硫酸镁溶液、硫酸铵溶液的目的是将硅元素、磷元素转化为MgSiO3和MgNH4PO4沉淀,若溶液pH<9时,磷酸根会与H+反应使其浓度降低导致MgNH4PO4无法完全沉淀,同时可能产生硅酸胶状沉淀不宜处理;若溶液pH>9时,会导镁离子生成氢氧化镁沉淀,不能形成MgSiO3沉淀,导致产品中混有杂质,同时溶液中铵根离子浓度降低导致MgNH4PO4无法完全沉淀,故答案为:磷酸根会与H+反应使其浓度降低导致MgNH4PO4,同时可能产生硅酸胶状沉淀不宜处理;会导镁离子生成氢氧化镁沉淀,不能形成MgSiO3沉淀,导致产品中混有杂质,同时溶液中铵根离子浓度降低导致MgNH4PO4无法完全沉淀;
(5)由题给信息可知,五氧化二钒水能与酸溶液反应生成盐和水,也能与碱溶液发生生成盐和水的两性氧化物,故选C;
(6)由题意可知,还原步骤中加入焦亚硫酸钠溶液的目的是将铬元素转化为铬离子,反应的离子方程式为2Cr2O+3S2O+10H+=4Cr3++6SO+5H2O,故答案为:2Cr2O+3S2O+10H+=4Cr3++6SO+5H2O。
9.(1)
(2) 、Mg(OH)2 CaO
(3) 加入纯碱将精制Ⅰ所得滤液中的转化为(或除去精制Ⅰ所得滤液中的),提高纯度 盐酸 浓缩液中因浓度过大使得过早沉淀,即浓缩结晶得到的中会混有,最终所得的产率减小
【分析】由流程可知,卤水中加入盐酸脱硼后过滤,所得滤液经浓缩结晶后得到晶体,该晶体中含有Na+、Li+、Cl-、等,焙烧后生成HCl气体;烧渣水浸后过滤,滤液中加生石灰后产生沉淀,滤渣Ⅰ的主要成分为Mg(OH)2、;精制Ⅰ所得滤液中再加纯碱又生成沉淀,则滤渣Ⅱ为、Mg(OH)2;精制Ⅱ所得滤液经操作X后,所得溶液经浓缩结晶、过滤得到氯化钠,浓缩后的滤液中加入饱和碳酸钠溶液沉锂,得到。
【详解】(1)含硼固体中的在水中存在平衡:(常温下,);与溶液反应可制备硼砂。常温下.在硼砂溶液中,水解生成等物质的量浓度的和,该水解反应的离子方程式为,由B元素守恒可知,和的浓度均为,,则该溶液。
(2)由分析可知,滤渣I的主要成分是、Mg(OH)2;精制I后溶液中的浓度为2.0,由可知,则常温下精制Ⅱ过程中浓度应控制在以下。若脱硼后直接进行精制Ⅰ,若不回收HCl,整个溶液将呈强酸性,因此为达到除Mg2+离子所需的碱性pH首先需要额外多消耗CaO,同时多引入的Ca2+离子需要更多的纯碱除去,因此,还将增加生石灰(CaO)和纯碱()的用量。
(3)精制Ⅰ中,烧渣水浸后的滤液中加生石灰后产生的滤渣Ⅰ的主要成分为;由于微溶于水,精制Ⅰ所得滤液中还含有一定浓度的,还需要除去,因此,精制Ⅱ的目的是:加入纯碱将精制Ⅰ所得滤液中的转化为(或除去精制Ⅰ所得滤液中的),提高纯度。操作X是为了除去剩余的碳酸根离子,为了防止引入杂质离子,应选择的试剂是盐酸;加入盐酸的目的是除去剩余的碳酸根离子,若不进行该操作而直接浓缩,将导致浓缩液中因浓度过大使得过早沉淀,即浓缩结晶得到的中会混有,最终所得的产率减小。
10.(1)二氧化硫
(2)
(3) 氧化2
(4) 易分解
(5) 蒸发浓缩 冷却结晶 漏斗
(6)25.0
【分析】工业废弃矿石(主要成分为CuS和Fe2O3),将其灼烧,CuS转化为CuO和SO2,所以气体X是SO2,残留固体是CuO和Fe2O3,向其中加入足量稀H2SO4,反应产生CuSO4、Fe2(SO4)3,然后加入过量铁粉,发生反应:CuSO4+Fe=FeSO4+Cu;Fe2(SO4)3+Fe=3FeSO4,然后过滤,所得滤液含有FeSO4,滤渣含有Fe、Cu,滤渣酸浸发生反应:Fe+H2SO4=FeSO4+H2↑;而Cu不发生反应,过滤,滤液与前边的滤液合并,向其中加入稀H2SO4、H2O2,反应产生Fe2(SO4)3,再向其中加入(NH4)2SO4,经系列操作可知反应产生硫酸铁铵;滤渣用H2SO4溶解,然后向溶液中鼓入O2,发生反应:2Cu+O2+2H2SO4=CuSO4+2H2O,然后将溶液蒸发浓缩冷却结晶获得硫酸铜晶体。
【详解】(1)根据上述分析可知气体X是SO2,名称是二氧化硫;
(2)“酸浸1”过程中红色固体Fe2O3与H2SO4反应产生Fe2(SO4)3、H2O,反应的化学方程式为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(3))“酸浸2”是Fe、Cu混合物中的Fe与硫酸反应得到FeSO4,Fe+H2SO4=FeSO4+H2↑,而Cu不能发生反应,则发生的滤液为FeSO4;
FeSO4可以被H2O2氧化产生Fe2(SO4)3,因此可以转移到氧化2操作工序中循环利用;
(4)“氧化2”过程中,Fe2+、H+、H2O2发生氧化还原反应产生Fe3+、H2O,发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
实际操作时,所加H2O2的量要比理论计算值多,可能原因是H2O2不稳定,受热易分解导致其被消耗,故H2O2易分解;
(5)CuSO4的溶解度受温度的影响变化较大,因此从溶液中获得CuSO4·5H2O,的系列操作包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥;该系列操作包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥所需的仪器铁架台、酒精灯、玻璃棒、蒸发皿、烧杯和漏斗;
(6))CuSO4·5H2O的式量是250,25 kg硫酸铜晶体的物质的量是n(CuSO4·5H2O)=,根据Cu元素守恒,可知废弃矿石中Cu的物质的量是100 mol,其质量是m(Cu)=100 mol×64 g/mol=6400 g=6.4 kg,故矿石中Cu元素的质量分数为。
11.(1)
(2)铁元素在“除铁铝”过程中不能除尽
(3)1.0×10﹣19.1
(4)氢氧化钙的溶解度较小,氢氧化锶的溶解度较大
(5)
(6)温度高于60°C时,NH4HCO3和氨水分解
(7)当pH≥10时,平衡 H++,正向移动浓度增大有利于生成SrCO3沉淀
【分析】由题干流程图可知,锶渣(主要成分SrSO4,含少量CaCO3、Fe2O3、Al2O3、MgCO3),高温焙烧生成SrS和一种可燃气体CO,CaCO3生成CaO,MgCO3生成MgO,加入稀盐酸酸浸,SrS产生H2S气体,滤液中含有Sr2+、Ca2+、Mg2+、Fe2+、Fe3+和Al3+,加入H2O2,将Fe2+氧化为Fe3+,加入NaOH调节pH=7.5,使Fe3+和Al3+形成Al(OH)3和Fe(OH)3沉淀而除去,再加NaOH溶液,加热至90℃-120℃,调节pH=12除去Ca2+、Mg2+,最后加入氨水和NH4HCO3生成SrCO3,据此分析结合各小问解题。
【详解】(1)高温焙烧SrSO4生成SrS和一种可燃气体CO,根据氧化还原反应配平可得,该反应化学方程式为SrSO4+4CSrS+4CO↑,故答案为:SrSO4+4CSrS+4CO↑;
(2)由分析可知,步骤1为加入H2O2,将Fe2+氧化为Fe3+,由Fe2+沉淀的pH可知,若不氧化,Fe2+除不尽,故答案为:铁元素在“除铁铝”过程中不能除尽;
(3)由图可知,当c(Fe3+)=1.0×10-2mol/L时,溶液的pH=1.8,则KSp[Fe(OH)3]=c(Fe3+)c3(OH-)=10-2×(10-12.2)3=10-38.6,若溶液的pH=7.5时,c(Fe2+)=mol/L=1×10-19.1mol/L,故答案为:1.0×10-19.1;
(4)根据表格数据,温度控制在95℃~100℃时,氢氧化钙的溶解度较小,氢氧化锶的溶解度较大,保证除钙完全,故答案为:氢氧化钙的溶解度较小,氢氧化锶的溶解度较大,保证除钙完全;
(5)由分析可知,沉思过程为:氨水和NH4HCO3生成SrCO3,离子反应方程式为:,故答案为:;
(6)NH4HCO3和氨水受热易分解,温度高于60℃时,NH4HCO3和氨水分解,锶转化率降低,故答案为:温度高于60℃时,NH4HCO3和氨水分解;
(7)“沉锶”过程中,当pH≥10时,平衡 H++正向移动,溶液中浓度增大,有利于生成SrCO3沉淀,故答案为:当pH≥10时,平衡 H++正向移动,溶液中浓度增大,有利于生成SrCO3沉淀。
12.(1)
(2)NH3
(3) 将Fe2+氧化为Fe3+ 生成的MnO2和Fe3+能催化H2O2分解,从而加大H2O2用量
(4)
(5)避免生成Mg(OH)2沉淀
(6)
【分析】由题给流程可知,菱镁矿(主要成分为,含少量Ca、Si、Fe、Mn和Al等元素)煅烧,转变为二氧化碳和各元素的氧化物,加入硝酸铵溶液“蒸氨”,各金属氧化物转变为硝酸盐溶液、二氧化硅不溶,则过滤得滤渣1为二氧化硅、尾气为氨气;向滤液加入过氧化氢“氧化除锰”,锰元素转变为沉淀MnO2,硝酸铵溶液呈酸性,酸性条件下过氧化氢将溶液中的亚铁离子转化为铁离子,则过滤所得滤渣2为MnO2,滤液中加入草酸溶液“除钙”,反应中产生草酸钙沉淀,则过滤所得滤渣3为CaC2O4,向滤液中加入氨水“除铁铝”:调节溶液pH,将溶液中铁离子、铝离子转化为氢氧化铁、氢氧化铝沉淀,则过滤得到滤渣4含有氢氧化铁、氢氧化铝,滤液所含主要阳离子为镁离子,向滤液中加入氢氟酸溶液,将溶液中镁离子转化为氟化镁沉淀,过滤即得到目标产物氟化镁。
【详解】(1)“煅烧”时,主要成分菱镁矿碳酸镁分解为氧化镁和二氧化碳,化学方程式是:。
(2)硝酸铵溶液水解呈酸性,反应中消耗氢离子促进铵离子水解,产生的一水合氨受热分解为氨气,则“蒸氨”过程中“尾气”的主要成分是NH3。
(3)溶液是绿色氧化剂,反应中除“氧化除锰”外,还有将Fe2+氧化为Fe3+的作用。过氧化氢不稳定易分解,则生产中所需用量远超理论值的原因是:生成的MnO2和Fe3+能催化H2O2分解,从而加大H2O2用量。
(4)“除铁铝”过程中,由,知:当恰好沉淀完全时,铁离子早已沉淀完全,则溶液中。
(5)“除铁铝”时,用氨水调节溶液的pH,但pH不宜过高的原因是:避免生成Mg(OH)2沉淀。
(6)HF为弱酸,则 “沉淀”时,反应产生氟化镁沉淀的离子方程式是:。
答案第1页,共2页
答案第1页,共2页
同课章节目录
