2024年高考化学二轮复习回归基础专题15沉淀溶解平衡及图分析训练(含解析)
文档属性
| 名称 | 2024年高考化学二轮复习回归基础专题15沉淀溶解平衡及图分析训练(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-14 09:03:13 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2024年高考化学二轮复习回归基础专题15沉淀溶解平衡及图分析训练
一、单选题,共15小题
1.(20-21高三下·上海宝山·阶段练习)某温度下硫酸钡与水组成的混合物中加入少量硫酸钠固体,下列说法错误的是
A.BaSO4的电离程度减小 B.BaSO4溶解的量减小
C.c(Ba2+)与c(SO)的乘积不变 D.溶液的导电能力增强
2.(19-20高二下·河北衡水·期末)在温热气候条件下,浅海地区有厚层的石灰石沉积,而深海地区却很少。下列解析不正确的是
A.与深海地区相比,浅海地区水温较高,有利于游离的CO2增多、石灰石沉积
B.与浅海地区相比,深海地区压强大,石灰石岩层易被CO2溶解,沉积少
C.深海地区石灰石岩层的溶解反应为CaCO3(s)+H2O(l)+CO2(aq)=Ca(HCO3)2(aq)
D.海水呈弱碱性,大气中CO2浓度增加,会导致海水中浓度增大
3.(23-24高三上·河北保定·期末)下列方案设计、现象和结论有不正确的是
选项 实验 现象 结论
A 将海带灰溶解过滤后,取适量滤液于试管中,酸化后加入少量新制氯水,充分反应后加入1~2滴淀粉溶液 溶液变蓝 海带中含有碘元素
B 分别向饱和硼酸()溶液和稀硫酸溶液中加入少量粉末 前者无气泡冒出,后者有气泡冒出 非金属性:S>C>B
C 取少量乙酰水杨酸晶体,加入盛有3mL蒸馏水的试管中,加1~2滴1%氯化铁溶液 溶液出现紫色 乙酰水杨酸中含有水杨酸
D 将溶液滴入NaOH溶液中至不再有沉淀产生,再滴加溶液 先有白色沉淀生成,后变为浅蓝色沉淀
A.A B.B C.C D.D
4.(2023高三·全国·专题练习)下列说法正确的是
A.难溶电解质的溶度积Ksp越小,则它的溶解度越小
B.Ksp(Ag2CrO4)C.溶度积常数Ksp与温度有关,温度越高,溶度积越大
D.升高温度,某沉淀溶解平衡逆向移动,说明它的溶解度是减小的,Ksp也变小
5.(23-24高三上·陕西·阶段练习)下列说法正确的是
A.向AgI沉淀中加入饱和KCl溶液,有白色沉淀生成,说明AgCl比AgI更难溶
B.向浓度均为的和混合溶液中逐滴加入氨水,若先生成蓝色沉淀,则
C.向饱和溶液中加入饱和溶液,有白色沉淀产生,说明
D.向1mL的NaOH溶液中滴入1mL的溶液,产生白色沉淀后,再滴加2滴的溶液,又生成红褐色沉淀,说明在相同温度下的溶解度:
6.(23-24高三上·山东菏泽·阶段练习)在不同温度下的沉淀溶解平衡曲线如图所示()。下列说法不正确的是
A.温度为时, B.的溶解度:
C.的溶解过程吸收能量 D.将Z溶液升温可以得到Y溶液
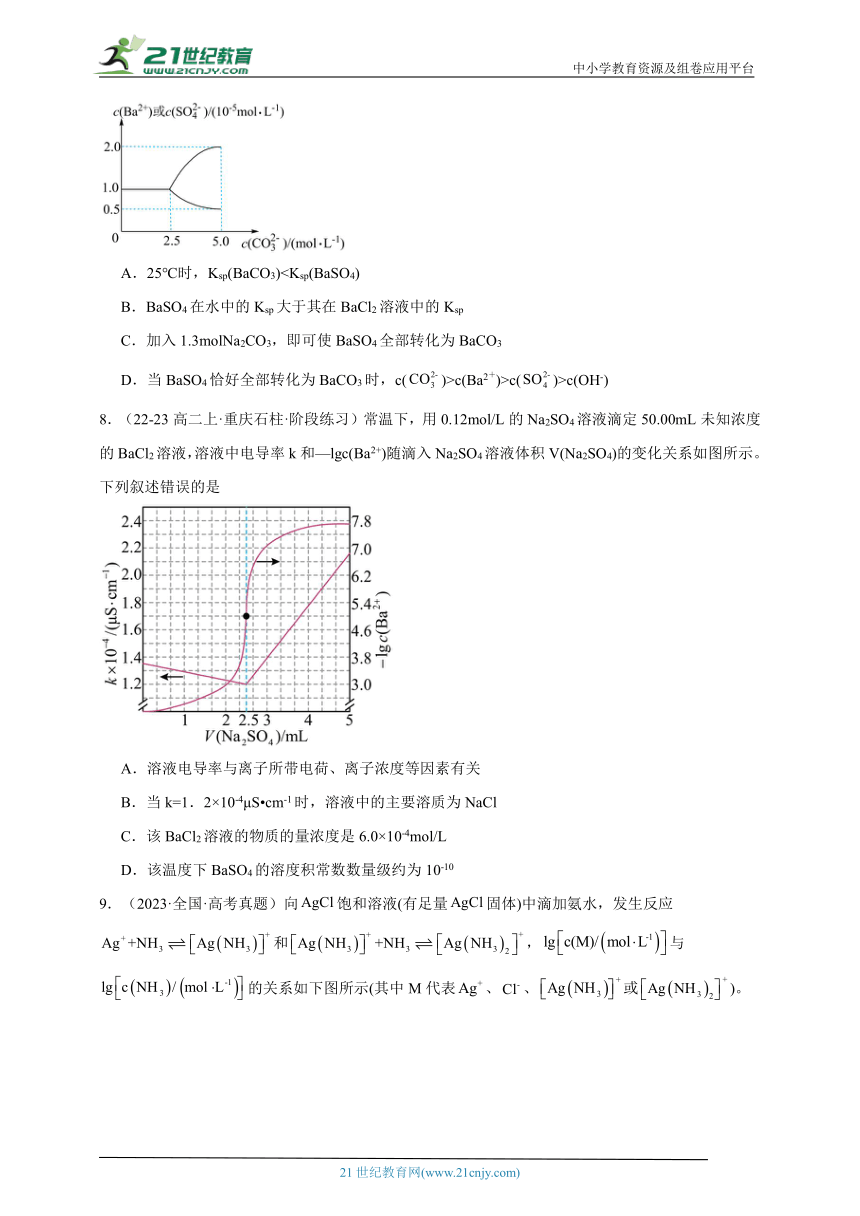
7.(2021·山东淄博·三模)25℃时,向2.5L蒸馏水中加入0.05molBaSO4固体粉末,再逐渐加入一定量的Na2CO3固体粉末,边加边搅拌(忽略溶液体积变化)。溶液中部分离子的浓度变化如图所示。下列说法正确的是
A.25℃时,Ksp(BaCO3)B.BaSO4在水中的Ksp大于其在BaCl2溶液中的Ksp
C.加入1.3molNa2CO3,即可使BaSO4全部转化为BaCO3
D.当BaSO4恰好全部转化为BaCO3时,c()>c(Ba2+)>c()>c(OH-)
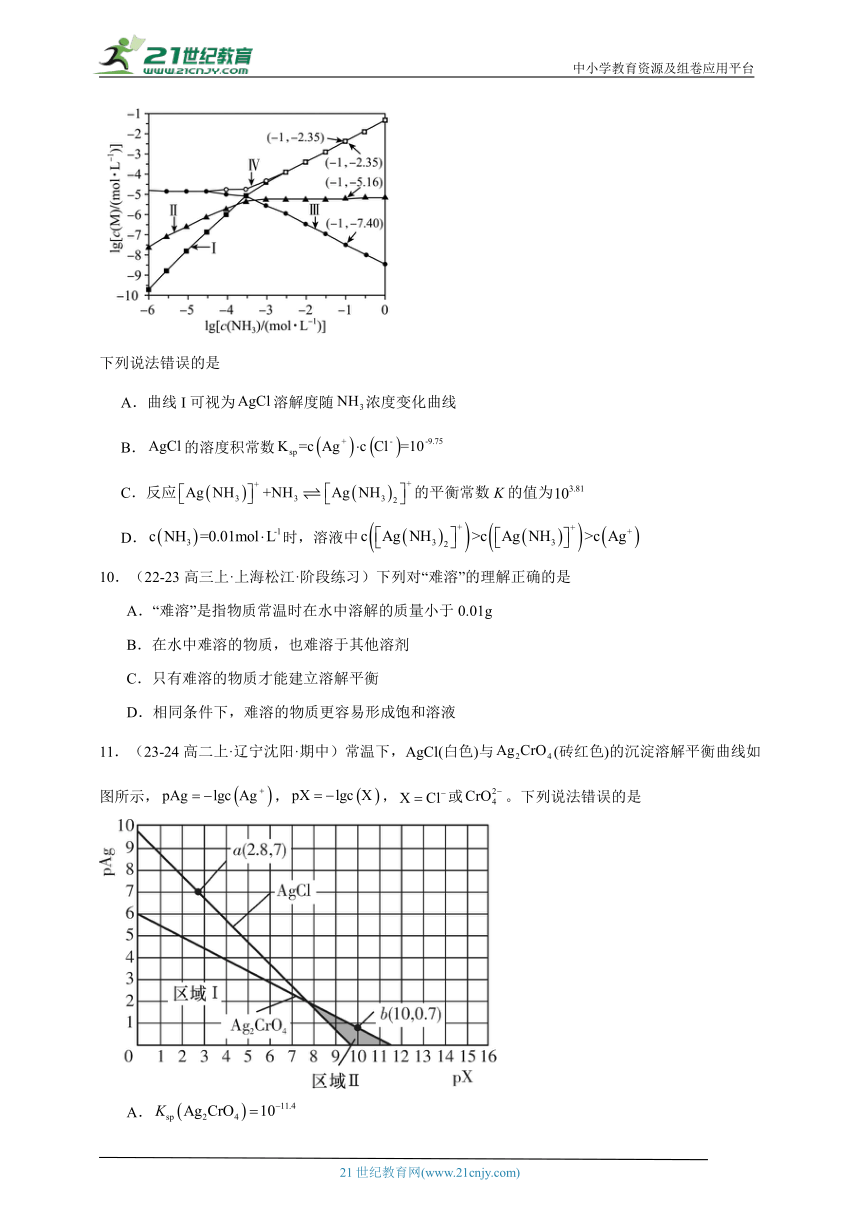
8.(22-23高二上·重庆石柱·阶段练习)常温下,用0.12mol/L的Na2SO4溶液滴定50.00mL未知浓度的BaCl2溶液,溶液中电导率k和—lgc(Ba2+)随滴入Na2SO4溶液体积V(Na2SO4)的变化关系如图所示。下列叙述错误的是
A.溶液电导率与离子所带电荷、离子浓度等因素有关
B.当k=1.2×10-4μS cm-1时,溶液中的主要溶质为NaCl
C.该BaCl2溶液的物质的量浓度是6.0×10-4mol/L
D.该温度下BaSO4的溶度积常数数量级约为10-10
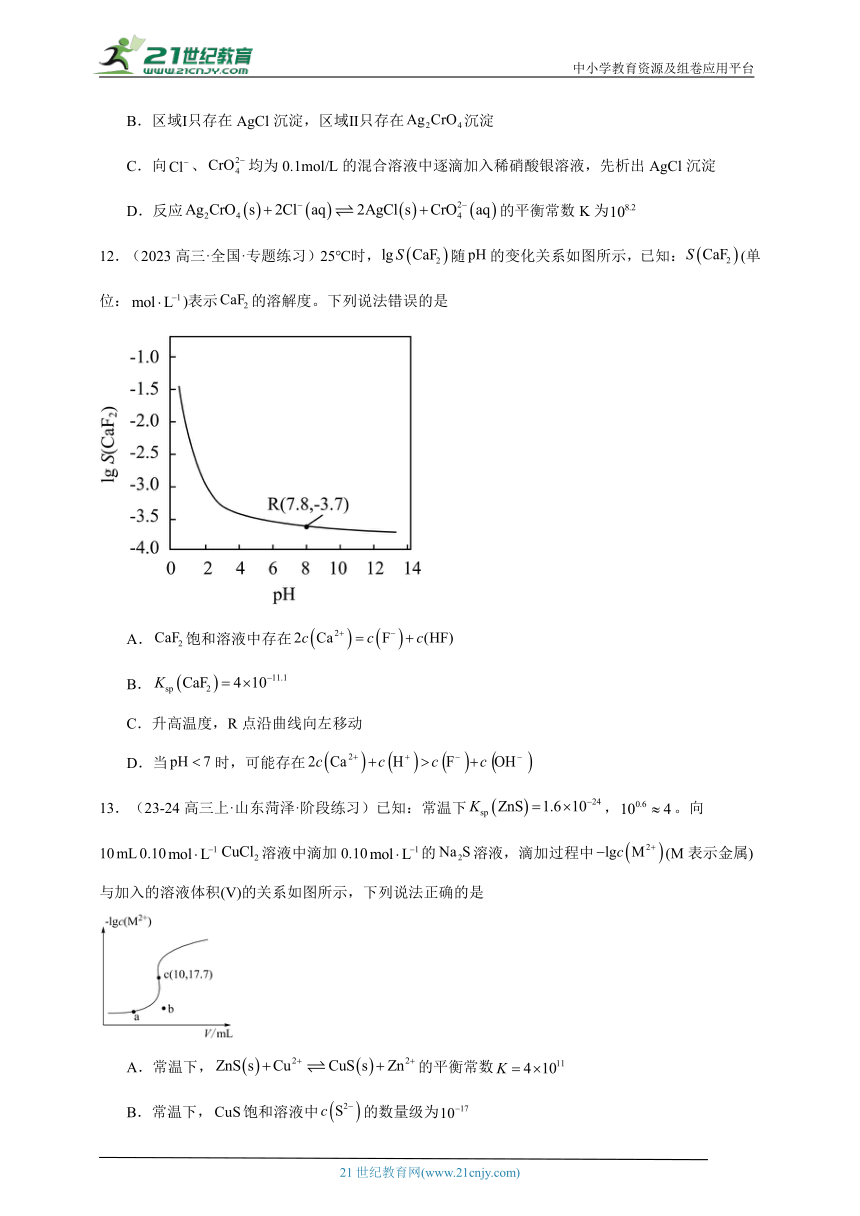
9.(2023·全国·高考真题)向饱和溶液(有足量固体)中滴加氨水,发生反应和,与的关系如下图所示(其中M代表、、或)。
下列说法错误的是
A.曲线I可视为溶解度随浓度变化曲线
B.的溶度积常数
C.反应的平衡常数K的值为
D.时,溶液中
10.(22-23高三上·上海松江·阶段练习)下列对“难溶”的理解正确的是
A.“难溶”是指物质常温时在水中溶解的质量小于0.01g
B.在水中难溶的物质,也难溶于其他溶剂
C.只有难溶的物质才能建立溶解平衡
D.相同条件下,难溶的物质更容易形成饱和溶液
11.(23-24高二上·辽宁沈阳·期中)常温下,AgCl(白色)与(砖红色)的沉淀溶解平衡曲线如图所示,,,或。下列说法错误的是
A.
B.区域Ⅰ只存在AgCl沉淀,区域Ⅱ只存在沉淀
C.向、均为0.1mol/L的混合溶液中逐滴加入稀硝酸银溶液,先析出AgCl沉淀
D.反应的平衡常数K为
12.(2023高三·全国·专题练习)25℃时,随的变化关系如图所示,已知:(单位:)表示的溶解度。下列说法错误的是
A.饱和溶液中存在
B.
C.升高温度,R点沿曲线向左移动
D.当时,可能存在
13.(23-24高三上·山东菏泽·阶段练习)已知:常温下,。向100.10溶液中滴加0.10的溶液,滴加过程中(M表示金属)与加入的溶液体积(V)的关系如图所示,下列说法正确的是
A.常温下,的平衡常数
B.常温下,饱和溶液中的数量级为
C.b点体系中,的溶解速率大于其生成速率
D.若用代替(其他不变),则c点应向下移动
14.(23-24高三上·河北沧州·阶段练习)一定温度下,和的沉淀溶解平衡曲线如图所示。
下列说法正确的是
A.,
B.a点能生成沉淀,不能生成沉淀
C.b点时,
D.向、均为的混合溶液中滴加溶液,先产生沉淀
15.(23-24高三上·黑龙江·期末)时,用溶液分别滴定等物质的量浓度的三种溶液pM[p表示负对数,表示]随溶液变化的关系如图所示。已知:常温下,。下列推断正确的是
A.曲线③代表与的关系曲线
B.调节时,可将废水中完全沉淀
C.滴定溶液至X点时,溶液中:
D.经计算,能完全溶于HR溶液
二、填空题,共1小题
16.(22-23高二上·全国·课时练习)向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液混合后体积的变化,请计算:
(1)完全沉淀后,溶液中= 。
(2)完全沉淀后,溶液的pH= 。
(3)如果向完全沉淀后的溶液中继续加入50 mL 0.001 mol·L-1的盐酸,是否有白色沉淀生成? (填“是”或“否”)。
(4)该温度下,AgCl饱和溶液的密度为1 g/cm3,则该温度下,AgCl在水中的溶解度约为 g。
三、计算题,共1小题
17.(2023高三·全国·专题练习)含Al(OH)溶液中的铝元素完全沉淀的pH为 。{通常认为溶液中离子浓度小于10-5 mol·L-1为沉淀完全:Al(OH)3+OH—Al(OH)K=100.63;Kw=10-14,Ksp[Al(OH)3]=10-33}
参考答案:
1.A
【详解】A.硫酸钡在溶液中完全电离,则加入硫酸钠后,硫酸钡的电离程度不变,仍然为100%,故A错误;
B.加入硫酸钠后,溶液中硫酸根离子浓度增大,溶解平衡向着逆向移动,导致硫酸钡的溶解的量减小,故B正确;
C.c(Ba2+)与c(SO)的乘积为溶度积,由于温度不变,则硫酸钡的溶度积不变,故C正确;
D.加入硫酸钠后,溶液中离子浓度增大,则溶液的导电性增强,故D正确;
故选:A。
2.D
【详解】A.与深海地区相比,浅海地区水温较高,CO2在海水中溶解度小,有利于游离的CO2增多,石灰石沉积,A项正确;
B.与浅海地区相比,深海地区压强大,CO2溶解度大,石灰石岩层易被CO2溶解,沉积少,B项正确;
C.题给反应为石灰石岩层的溶解反应,C项正确;
D.大气中CO2浓度增加,会导致海水中转化为HCO,导致浓度减小,D项错误。
故选D。
3.D
【详解】A.海带灰溶解过滤后,滤液中含碘离子,加入少量新制氯水,将碘离子氧化生成碘单质,碘单质与淀粉作用显蓝色,A正确;
B.分别向饱和硼酸()溶液和稀硫酸溶液中加入少量粉末,前者无气泡冒出,后者有气泡冒出,说明酸性:硫酸强于碳酸,碳酸强于硼酸,可证明:非金属性:S>C>B,B正确;
C.乙酰水杨酸中无酚羟基,水杨酸中含酚羟基,具有酚的性质,酚与氯化铁作用显紫色,C正确;
D.转化为,说明更难溶,其更小,D错误;
答案选D。
4.D
【详解】A.不同类型的电解质是无法由溶度积来比较溶解度大小的,同类型的难溶电解质Ksp越小,溶解度越小,A错误;
B.电解质类型不同,不能简单由Ksp的数值大小来比较溶解度,B错误;
C.溶度积常数Ksp与温度有关,温度越高,溶度积常数可能增大也可能减小,C错误;
D.升高温度,沉淀溶解平衡逆向移动,则说明它的溶解度是减小的,所以Ksp也变小,D正确;
故选D。
5.D
【详解】A.加入饱和KCl溶液,比较大,会导致,不能说明AgCl比AgI更难溶,A项错误;
B.溶解度小的先沉淀,能说明,B项错误;
C.加入饱和溶液,比较大,会导致,不能说明,C项错误;
D.加入溶液后,白色沉淀转化为红褐色沉淀,说明在相同温度下的溶解度:,D项正确;
答案选D。
6.D
【详解】A.由Y点可知,,A项正确;
B.X、Z、W是同一温度下的饱和溶液,相同,等体积的溶液中溶解的的物质的量的关系为,的溶解度的关系为,B项正确;
C.温度升高变大,说明的溶解是吸热的,C项正确;
D.将Z溶液升温,虽溶解度增大,但没加入,故得不到Y溶液,D项错误;
故选D。
7.C
【分析】结合题意及图像分析可知,在起点未加入碳酸钠时,,加入碳酸钠固体以后当溶液中碳酸根离子浓度为时,c(Ba2+)和开始发生变化,说明此时BaSO4沉淀开始转化为BaCO3沉淀,此时。
【详解】A.结合分析计算可知,Ksp(BaCO3)>Ksp(BaSO4),A错误;
B.溶质一定时,Ksp只受温度的影响,故BaSO4在水中的Ksp等于其在BaCl2溶液中的Ksp,B错误;
C.,此平衡的平衡常数,当硫酸钡全部转化为碳酸钡,此时溶液中,故,且溶解硫酸钡需要0.05mol碳酸钠,所以加入1.3molNa2CO3,即可使BaSO4全部转化为BaCO3,C正确;
D.根据C选项计算可知可知当BaSO4恰好全部转化为BaCO3时,>c(Ba2+),同时计算c(Ba2+)==5×10-9mol/L,而此时溶液中有大量碳酸根,呈碱性,c(OH-)>1×10-7mol/L,所以c(OH-)也大于c(Ba2+),D错误;
故选C。
8.C
【分析】溶液中电导率k随着硫酸钠溶液的加入先增大后减小,硫酸钠溶液为2.5mL时,电导率k最小,说明硫酸钠溶液与氯化钡溶液恰好反应生成硫酸钡沉淀和氯化钠,溶液中电导率k为1.2×10-4μS cm-1、钡离子浓度为1.0×10-5mol/L,则氯化钡溶液的浓度为=6.0×10-3mol/L,硫酸钡的溶度积Ksp=1.0×10-5×1.0×10-5=1.0×10-10。
【详解】A.溶液中电导率k随着硫酸钠溶液的加入先增大后减小,电导率k最小时,硫酸钠溶液与氯化钡溶液恰好反应生成硫酸钡沉淀和氯化钠,说明溶液电导率与离子所带电荷、离子浓度等因素有关,故A正确;
B.由上述分析可知,当溶液中电导率k为1.2×10-4μS cm-1时,硫酸钠溶液与氯化钡溶液恰好反应生成硫酸钡沉淀和氯化钠,溶液中的主要溶质为氯化钠,故B正确;
C.由上述分析可知,氯化钡溶液的浓度为=6.0×10-3mol/L,故C错误;
D.硫酸钡的溶度积Ksp=1.0×10-5×1.0×10-5=1.0×10-10,溶度积常数数量级为10-10,故D正确;
故答案选C。
9.A
【分析】氯化银饱和溶液中银离子和氯离子的浓度相等,向饱和溶液中滴加氨水,溶液中银离子浓度减小,氯离子浓度增大、一氨合银离子增大,继续滴加氨水,一氨合银离子增大的幅度小于二氨合银离子,则曲线I、Ⅱ、Ⅲ、Ⅳ分别表示二氨合银离子、一氨合银离子、银离子、氯离子与氨气浓度对数变化的曲线。
【详解】A.氨的浓度较小时AgCl(s)Ag+(aq)+Cl-(aq),浓度较大时AgCl(s)+2NH3(aq)+Cl-(aq),氯化银的溶解度曲线应与氯离子的曲线吻合,应该为曲线Ⅳ,故A错误;
B.由图可知,c(NH3)=10-1mol/L时,c(Cl-)=10-2.35mol/L,c(Ag+)=10-7.40mol/L,则氯化银的溶度积为10-2.35×10-7.40=10-9.75,故B正确;
C.由图可知,氨分子浓度对数为-1时,溶液中二氨合银离子和一氨合银离子的浓度分别为10-2.35mol/L和10-5.16mol/L,则的平衡常数K=
==,故C正确;
D.由分析可知,曲线I、Ⅱ、Ⅲ、Ⅳ分别表示二氨合银离子、一氨合银离子、银离子、氯离子与氨气浓度对数变化的曲线,则时,溶液中,故D正确;
故选A。
10.A
【详解】A.“难溶”是指物质常温时在水中溶解的质量小于0.01g,A正确;
B.在水中难溶的物质,不一定难溶于其他溶剂,B错误;
C.易溶、微溶、难溶的物质均能建立溶解平衡,C错误;
D.相同条件下,易溶的物质更容易形成饱和溶液,D错误;
故选A。
11.B
【详解】A.b点在的沉淀溶解平衡曲线上,根据该点的坐标可知,A正确;
B.横纵坐标数值为负对数值,越往右和越往上,浓度越小,区域Ⅰ内和AgCl的离子积均大于,故均能产生沉淀;区域Ⅱ处于的沉淀溶解平衡曲线的下方,离子积大于;处于AgCl沉淀溶解平衡曲线的上方,离子积小于(AgCl),因此区域Ⅰ只存在沉淀,B错误;
C.根据a点坐标可知,,则对于AgCl,形成沉淀时需要,对于,形成沉淀需要,显然形成AgCl沉淀需要的银离子浓度更低,故以先析出AgCl沉淀,C正确;
D.由上述分析可知,,,则反应的平衡常数,D正确;
答案选B。
12.C
【详解】A.在饱和溶液中,水解为,由物料守恒可知,正确;
B.R点时,,则,,,正确;
C.升高温度,的溶解度增大,增大,且的水解程度增大,溶液碱性增强,增大,故R点应脱离曲线向右上方移动,错误;
D.为强碱弱酸盐,溶液显碱性,必须加入酸才能满足,假设加入的酸为,则由电荷守恒可得,故,正确;
故选C。
13.AD
【详解】A.,的平衡常数,A项正确;
B.由图知,c点时,数量级为,B项错误;
C.b点时,,此时反应向形成沉淀方向进行,即生成的速率较大,C项错误;
D.用代替时,达到溶解平衡时,c点向下移,D项正确;
故答案为:AD。
14.D
【详解】A.由的沉淀溶解平衡曲线可知,c(Xx-)=10-4.8mol/L时,c(Ag+)=10-5mol/L,c(Ag+)=1mol/L时,c(Xx-)≈10-10mol/L,则Ksp(AgxX)=(10-5mol/L)x10-4.8mol/L=(1mol/L)x10-10mol/L,解得x=1;同理,同理由的沉淀溶解平衡曲线可知,c(Yy-)=10-1.7mol/L时,c(Ag+)=10-5mol/L,c(Yy-)=1mol/L时,c(Ag+)≈10-6mol/L,则Ksp(AgyY)=(10-5mol/L)y10-1.7mol/L=(10-6mol/L)y1mol/L,解得y=2;故A错误;
B.a点在的沉淀溶解平衡曲线的上方,为不饱和溶液,因此a点条件下不能生成沉淀,但a点在的沉淀溶解平衡曲线的下方,为过饱和溶液,因此a点条件下能生成沉淀,故B错误;
C.Ksp()=c(X-)c(Ag+),Ksp()=c(Y2-)c2(Ag+),b点时,,故C错误;
D.由图中数据可知Ksp()=c(X-)c(Ag+)=10-4.8mol/L×10-5mol/L =10-9.8,Ksp()=c(Y2-)c2(Ag+)=10-1.7mol/L×(10-5mol/L)2=10-11.7,当c(X-)=0.1mol/L,c(Ag+)= =10-8.8mol/L,开始产生AgX沉淀,当c(Y2 )=0.1mol/L,c(Ag+)==10-5.35mol/L>10-8.8mol/L,开始产生Ag2Y沉淀,向、均为的混合溶液中滴加溶液,先产生沉淀,故D正确;
故选D。
15.C
【分析】推出pGe3+=-lg,同理推出pGa3+=-lg。由于Ksp[Ge(OH)3]>Ksp[Ga(OH)3],即Ga(NO3)3、Ge(NO3)3两条线不可能相交,③为HR滴定曲线,而①、②分别为Ga(NO3)3、Ge(NO3)3滴定曲线。由4.1点c(OH-)=10-9.9mol/L推知Ksp[Ga(OH)3]=1×(10-9.9)3=10-29.7;同理7.3点推得Ksp[Ge(OH)3]=1×(10-6.7)3=10-20.1;由5.5点得出Ka(HR)=,据此回答。
【详解】A.由上分析知,③为HR的滴定曲线,A错误;
B.pH=8.5知c(OH-)=10-5.5mol/L,则溶液中c(Ge3+)==10-3.6mol/L>10-5mol/L,溶液中的Ge3+未完全沉淀,B错误;
C.X点成分为NaR、NaOH,该溶液呈碱性所以c(Na+)>c(OH-)>c(H+),C正确;
D.,,该反应的K小,即反应很难发生,所以Ga(OH)3不能完全溶于HR溶液,D错误;
故选C。
16.(1)1.0×10-7 mol/L
(2)2
(3)否
(4)1.435×10-4
【详解】(1)反应前,,
;反应后剩余的Cl-为0.1×10-3 mol,则混合溶液中, 。
(2)H+没有参与反应,沉淀完全后,,pH=2。
(3)因为加入的盐酸中和反应后所得溶液中的相同,没有改变,变小,所以,没有沉淀产生。
(4)
17.8.37
【详解】由方程式可知,反应Al(OH)3+OH—Al(OH)的平衡常数K==100.63,则Al(OH)溶液中的铝元素完全沉淀时,溶液的氢氧根离子浓度为=10-5.63 mol/L,则溶液的pH为8.37,故答案为:8.37。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024年高考化学二轮复习回归基础专题15沉淀溶解平衡及图分析训练
一、单选题,共15小题
1.(20-21高三下·上海宝山·阶段练习)某温度下硫酸钡与水组成的混合物中加入少量硫酸钠固体,下列说法错误的是
A.BaSO4的电离程度减小 B.BaSO4溶解的量减小
C.c(Ba2+)与c(SO)的乘积不变 D.溶液的导电能力增强
2.(19-20高二下·河北衡水·期末)在温热气候条件下,浅海地区有厚层的石灰石沉积,而深海地区却很少。下列解析不正确的是
A.与深海地区相比,浅海地区水温较高,有利于游离的CO2增多、石灰石沉积
B.与浅海地区相比,深海地区压强大,石灰石岩层易被CO2溶解,沉积少
C.深海地区石灰石岩层的溶解反应为CaCO3(s)+H2O(l)+CO2(aq)=Ca(HCO3)2(aq)
D.海水呈弱碱性,大气中CO2浓度增加,会导致海水中浓度增大
3.(23-24高三上·河北保定·期末)下列方案设计、现象和结论有不正确的是
选项 实验 现象 结论
A 将海带灰溶解过滤后,取适量滤液于试管中,酸化后加入少量新制氯水,充分反应后加入1~2滴淀粉溶液 溶液变蓝 海带中含有碘元素
B 分别向饱和硼酸()溶液和稀硫酸溶液中加入少量粉末 前者无气泡冒出,后者有气泡冒出 非金属性:S>C>B
C 取少量乙酰水杨酸晶体,加入盛有3mL蒸馏水的试管中,加1~2滴1%氯化铁溶液 溶液出现紫色 乙酰水杨酸中含有水杨酸
D 将溶液滴入NaOH溶液中至不再有沉淀产生,再滴加溶液 先有白色沉淀生成,后变为浅蓝色沉淀
A.A B.B C.C D.D
4.(2023高三·全国·专题练习)下列说法正确的是
A.难溶电解质的溶度积Ksp越小,则它的溶解度越小
B.Ksp(Ag2CrO4)
D.升高温度,某沉淀溶解平衡逆向移动,说明它的溶解度是减小的,Ksp也变小
5.(23-24高三上·陕西·阶段练习)下列说法正确的是
A.向AgI沉淀中加入饱和KCl溶液,有白色沉淀生成,说明AgCl比AgI更难溶
B.向浓度均为的和混合溶液中逐滴加入氨水,若先生成蓝色沉淀,则
C.向饱和溶液中加入饱和溶液,有白色沉淀产生,说明
D.向1mL的NaOH溶液中滴入1mL的溶液,产生白色沉淀后,再滴加2滴的溶液,又生成红褐色沉淀,说明在相同温度下的溶解度:
6.(23-24高三上·山东菏泽·阶段练习)在不同温度下的沉淀溶解平衡曲线如图所示()。下列说法不正确的是
A.温度为时, B.的溶解度:
C.的溶解过程吸收能量 D.将Z溶液升温可以得到Y溶液
7.(2021·山东淄博·三模)25℃时,向2.5L蒸馏水中加入0.05molBaSO4固体粉末,再逐渐加入一定量的Na2CO3固体粉末,边加边搅拌(忽略溶液体积变化)。溶液中部分离子的浓度变化如图所示。下列说法正确的是
A.25℃时,Ksp(BaCO3)
C.加入1.3molNa2CO3,即可使BaSO4全部转化为BaCO3
D.当BaSO4恰好全部转化为BaCO3时,c()>c(Ba2+)>c()>c(OH-)
8.(22-23高二上·重庆石柱·阶段练习)常温下,用0.12mol/L的Na2SO4溶液滴定50.00mL未知浓度的BaCl2溶液,溶液中电导率k和—lgc(Ba2+)随滴入Na2SO4溶液体积V(Na2SO4)的变化关系如图所示。下列叙述错误的是
A.溶液电导率与离子所带电荷、离子浓度等因素有关
B.当k=1.2×10-4μS cm-1时,溶液中的主要溶质为NaCl
C.该BaCl2溶液的物质的量浓度是6.0×10-4mol/L
D.该温度下BaSO4的溶度积常数数量级约为10-10
9.(2023·全国·高考真题)向饱和溶液(有足量固体)中滴加氨水,发生反应和,与的关系如下图所示(其中M代表、、或)。
下列说法错误的是
A.曲线I可视为溶解度随浓度变化曲线
B.的溶度积常数
C.反应的平衡常数K的值为
D.时,溶液中
10.(22-23高三上·上海松江·阶段练习)下列对“难溶”的理解正确的是
A.“难溶”是指物质常温时在水中溶解的质量小于0.01g
B.在水中难溶的物质,也难溶于其他溶剂
C.只有难溶的物质才能建立溶解平衡
D.相同条件下,难溶的物质更容易形成饱和溶液
11.(23-24高二上·辽宁沈阳·期中)常温下,AgCl(白色)与(砖红色)的沉淀溶解平衡曲线如图所示,,,或。下列说法错误的是
A.
B.区域Ⅰ只存在AgCl沉淀,区域Ⅱ只存在沉淀
C.向、均为0.1mol/L的混合溶液中逐滴加入稀硝酸银溶液,先析出AgCl沉淀
D.反应的平衡常数K为
12.(2023高三·全国·专题练习)25℃时,随的变化关系如图所示,已知:(单位:)表示的溶解度。下列说法错误的是
A.饱和溶液中存在
B.
C.升高温度,R点沿曲线向左移动
D.当时,可能存在
13.(23-24高三上·山东菏泽·阶段练习)已知:常温下,。向100.10溶液中滴加0.10的溶液,滴加过程中(M表示金属)与加入的溶液体积(V)的关系如图所示,下列说法正确的是
A.常温下,的平衡常数
B.常温下,饱和溶液中的数量级为
C.b点体系中,的溶解速率大于其生成速率
D.若用代替(其他不变),则c点应向下移动
14.(23-24高三上·河北沧州·阶段练习)一定温度下,和的沉淀溶解平衡曲线如图所示。
下列说法正确的是
A.,
B.a点能生成沉淀,不能生成沉淀
C.b点时,
D.向、均为的混合溶液中滴加溶液,先产生沉淀
15.(23-24高三上·黑龙江·期末)时,用溶液分别滴定等物质的量浓度的三种溶液pM[p表示负对数,表示]随溶液变化的关系如图所示。已知:常温下,。下列推断正确的是
A.曲线③代表与的关系曲线
B.调节时,可将废水中完全沉淀
C.滴定溶液至X点时,溶液中:
D.经计算,能完全溶于HR溶液
二、填空题,共1小题
16.(22-23高二上·全国·课时练习)向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液混合后体积的变化,请计算:
(1)完全沉淀后,溶液中= 。
(2)完全沉淀后,溶液的pH= 。
(3)如果向完全沉淀后的溶液中继续加入50 mL 0.001 mol·L-1的盐酸,是否有白色沉淀生成? (填“是”或“否”)。
(4)该温度下,AgCl饱和溶液的密度为1 g/cm3,则该温度下,AgCl在水中的溶解度约为 g。
三、计算题,共1小题
17.(2023高三·全国·专题练习)含Al(OH)溶液中的铝元素完全沉淀的pH为 。{通常认为溶液中离子浓度小于10-5 mol·L-1为沉淀完全:Al(OH)3+OH—Al(OH)K=100.63;Kw=10-14,Ksp[Al(OH)3]=10-33}
参考答案:
1.A
【详解】A.硫酸钡在溶液中完全电离,则加入硫酸钠后,硫酸钡的电离程度不变,仍然为100%,故A错误;
B.加入硫酸钠后,溶液中硫酸根离子浓度增大,溶解平衡向着逆向移动,导致硫酸钡的溶解的量减小,故B正确;
C.c(Ba2+)与c(SO)的乘积为溶度积,由于温度不变,则硫酸钡的溶度积不变,故C正确;
D.加入硫酸钠后,溶液中离子浓度增大,则溶液的导电性增强,故D正确;
故选:A。
2.D
【详解】A.与深海地区相比,浅海地区水温较高,CO2在海水中溶解度小,有利于游离的CO2增多,石灰石沉积,A项正确;
B.与浅海地区相比,深海地区压强大,CO2溶解度大,石灰石岩层易被CO2溶解,沉积少,B项正确;
C.题给反应为石灰石岩层的溶解反应,C项正确;
D.大气中CO2浓度增加,会导致海水中转化为HCO,导致浓度减小,D项错误。
故选D。
3.D
【详解】A.海带灰溶解过滤后,滤液中含碘离子,加入少量新制氯水,将碘离子氧化生成碘单质,碘单质与淀粉作用显蓝色,A正确;
B.分别向饱和硼酸()溶液和稀硫酸溶液中加入少量粉末,前者无气泡冒出,后者有气泡冒出,说明酸性:硫酸强于碳酸,碳酸强于硼酸,可证明:非金属性:S>C>B,B正确;
C.乙酰水杨酸中无酚羟基,水杨酸中含酚羟基,具有酚的性质,酚与氯化铁作用显紫色,C正确;
D.转化为,说明更难溶,其更小,D错误;
答案选D。
4.D
【详解】A.不同类型的电解质是无法由溶度积来比较溶解度大小的,同类型的难溶电解质Ksp越小,溶解度越小,A错误;
B.电解质类型不同,不能简单由Ksp的数值大小来比较溶解度,B错误;
C.溶度积常数Ksp与温度有关,温度越高,溶度积常数可能增大也可能减小,C错误;
D.升高温度,沉淀溶解平衡逆向移动,则说明它的溶解度是减小的,所以Ksp也变小,D正确;
故选D。
5.D
【详解】A.加入饱和KCl溶液,比较大,会导致,不能说明AgCl比AgI更难溶,A项错误;
B.溶解度小的先沉淀,能说明,B项错误;
C.加入饱和溶液,比较大,会导致,不能说明,C项错误;
D.加入溶液后,白色沉淀转化为红褐色沉淀,说明在相同温度下的溶解度:,D项正确;
答案选D。
6.D
【详解】A.由Y点可知,,A项正确;
B.X、Z、W是同一温度下的饱和溶液,相同,等体积的溶液中溶解的的物质的量的关系为,的溶解度的关系为,B项正确;
C.温度升高变大,说明的溶解是吸热的,C项正确;
D.将Z溶液升温,虽溶解度增大,但没加入,故得不到Y溶液,D项错误;
故选D。
7.C
【分析】结合题意及图像分析可知,在起点未加入碳酸钠时,,加入碳酸钠固体以后当溶液中碳酸根离子浓度为时,c(Ba2+)和开始发生变化,说明此时BaSO4沉淀开始转化为BaCO3沉淀,此时。
【详解】A.结合分析计算可知,Ksp(BaCO3)>Ksp(BaSO4),A错误;
B.溶质一定时,Ksp只受温度的影响,故BaSO4在水中的Ksp等于其在BaCl2溶液中的Ksp,B错误;
C.,此平衡的平衡常数,当硫酸钡全部转化为碳酸钡,此时溶液中,故,且溶解硫酸钡需要0.05mol碳酸钠,所以加入1.3molNa2CO3,即可使BaSO4全部转化为BaCO3,C正确;
D.根据C选项计算可知可知当BaSO4恰好全部转化为BaCO3时,>c(Ba2+),同时计算c(Ba2+)==5×10-9mol/L,而此时溶液中有大量碳酸根,呈碱性,c(OH-)>1×10-7mol/L,所以c(OH-)也大于c(Ba2+),D错误;
故选C。
8.C
【分析】溶液中电导率k随着硫酸钠溶液的加入先增大后减小,硫酸钠溶液为2.5mL时,电导率k最小,说明硫酸钠溶液与氯化钡溶液恰好反应生成硫酸钡沉淀和氯化钠,溶液中电导率k为1.2×10-4μS cm-1、钡离子浓度为1.0×10-5mol/L,则氯化钡溶液的浓度为=6.0×10-3mol/L,硫酸钡的溶度积Ksp=1.0×10-5×1.0×10-5=1.0×10-10。
【详解】A.溶液中电导率k随着硫酸钠溶液的加入先增大后减小,电导率k最小时,硫酸钠溶液与氯化钡溶液恰好反应生成硫酸钡沉淀和氯化钠,说明溶液电导率与离子所带电荷、离子浓度等因素有关,故A正确;
B.由上述分析可知,当溶液中电导率k为1.2×10-4μS cm-1时,硫酸钠溶液与氯化钡溶液恰好反应生成硫酸钡沉淀和氯化钠,溶液中的主要溶质为氯化钠,故B正确;
C.由上述分析可知,氯化钡溶液的浓度为=6.0×10-3mol/L,故C错误;
D.硫酸钡的溶度积Ksp=1.0×10-5×1.0×10-5=1.0×10-10,溶度积常数数量级为10-10,故D正确;
故答案选C。
9.A
【分析】氯化银饱和溶液中银离子和氯离子的浓度相等,向饱和溶液中滴加氨水,溶液中银离子浓度减小,氯离子浓度增大、一氨合银离子增大,继续滴加氨水,一氨合银离子增大的幅度小于二氨合银离子,则曲线I、Ⅱ、Ⅲ、Ⅳ分别表示二氨合银离子、一氨合银离子、银离子、氯离子与氨气浓度对数变化的曲线。
【详解】A.氨的浓度较小时AgCl(s)Ag+(aq)+Cl-(aq),浓度较大时AgCl(s)+2NH3(aq)+Cl-(aq),氯化银的溶解度曲线应与氯离子的曲线吻合,应该为曲线Ⅳ,故A错误;
B.由图可知,c(NH3)=10-1mol/L时,c(Cl-)=10-2.35mol/L,c(Ag+)=10-7.40mol/L,则氯化银的溶度积为10-2.35×10-7.40=10-9.75,故B正确;
C.由图可知,氨分子浓度对数为-1时,溶液中二氨合银离子和一氨合银离子的浓度分别为10-2.35mol/L和10-5.16mol/L,则的平衡常数K=
==,故C正确;
D.由分析可知,曲线I、Ⅱ、Ⅲ、Ⅳ分别表示二氨合银离子、一氨合银离子、银离子、氯离子与氨气浓度对数变化的曲线,则时,溶液中,故D正确;
故选A。
10.A
【详解】A.“难溶”是指物质常温时在水中溶解的质量小于0.01g,A正确;
B.在水中难溶的物质,不一定难溶于其他溶剂,B错误;
C.易溶、微溶、难溶的物质均能建立溶解平衡,C错误;
D.相同条件下,易溶的物质更容易形成饱和溶液,D错误;
故选A。
11.B
【详解】A.b点在的沉淀溶解平衡曲线上,根据该点的坐标可知,A正确;
B.横纵坐标数值为负对数值,越往右和越往上,浓度越小,区域Ⅰ内和AgCl的离子积均大于,故均能产生沉淀;区域Ⅱ处于的沉淀溶解平衡曲线的下方,离子积大于;处于AgCl沉淀溶解平衡曲线的上方,离子积小于(AgCl),因此区域Ⅰ只存在沉淀,B错误;
C.根据a点坐标可知,,则对于AgCl,形成沉淀时需要,对于,形成沉淀需要,显然形成AgCl沉淀需要的银离子浓度更低,故以先析出AgCl沉淀,C正确;
D.由上述分析可知,,,则反应的平衡常数,D正确;
答案选B。
12.C
【详解】A.在饱和溶液中,水解为,由物料守恒可知,正确;
B.R点时,,则,,,正确;
C.升高温度,的溶解度增大,增大,且的水解程度增大,溶液碱性增强,增大,故R点应脱离曲线向右上方移动,错误;
D.为强碱弱酸盐,溶液显碱性,必须加入酸才能满足,假设加入的酸为,则由电荷守恒可得,故,正确;
故选C。
13.AD
【详解】A.,的平衡常数,A项正确;
B.由图知,c点时,数量级为,B项错误;
C.b点时,,此时反应向形成沉淀方向进行,即生成的速率较大,C项错误;
D.用代替时,达到溶解平衡时,c点向下移,D项正确;
故答案为:AD。
14.D
【详解】A.由的沉淀溶解平衡曲线可知,c(Xx-)=10-4.8mol/L时,c(Ag+)=10-5mol/L,c(Ag+)=1mol/L时,c(Xx-)≈10-10mol/L,则Ksp(AgxX)=(10-5mol/L)x10-4.8mol/L=(1mol/L)x10-10mol/L,解得x=1;同理,同理由的沉淀溶解平衡曲线可知,c(Yy-)=10-1.7mol/L时,c(Ag+)=10-5mol/L,c(Yy-)=1mol/L时,c(Ag+)≈10-6mol/L,则Ksp(AgyY)=(10-5mol/L)y10-1.7mol/L=(10-6mol/L)y1mol/L,解得y=2;故A错误;
B.a点在的沉淀溶解平衡曲线的上方,为不饱和溶液,因此a点条件下不能生成沉淀,但a点在的沉淀溶解平衡曲线的下方,为过饱和溶液,因此a点条件下能生成沉淀,故B错误;
C.Ksp()=c(X-)c(Ag+),Ksp()=c(Y2-)c2(Ag+),b点时,,故C错误;
D.由图中数据可知Ksp()=c(X-)c(Ag+)=10-4.8mol/L×10-5mol/L =10-9.8,Ksp()=c(Y2-)c2(Ag+)=10-1.7mol/L×(10-5mol/L)2=10-11.7,当c(X-)=0.1mol/L,c(Ag+)= =10-8.8mol/L,开始产生AgX沉淀,当c(Y2 )=0.1mol/L,c(Ag+)==10-5.35mol/L>10-8.8mol/L,开始产生Ag2Y沉淀,向、均为的混合溶液中滴加溶液,先产生沉淀,故D正确;
故选D。
15.C
【分析】推出pGe3+=-lg,同理推出pGa3+=-lg。由于Ksp[Ge(OH)3]>Ksp[Ga(OH)3],即Ga(NO3)3、Ge(NO3)3两条线不可能相交,③为HR滴定曲线,而①、②分别为Ga(NO3)3、Ge(NO3)3滴定曲线。由4.1点c(OH-)=10-9.9mol/L推知Ksp[Ga(OH)3]=1×(10-9.9)3=10-29.7;同理7.3点推得Ksp[Ge(OH)3]=1×(10-6.7)3=10-20.1;由5.5点得出Ka(HR)=,据此回答。
【详解】A.由上分析知,③为HR的滴定曲线,A错误;
B.pH=8.5知c(OH-)=10-5.5mol/L,则溶液中c(Ge3+)==10-3.6mol/L>10-5mol/L,溶液中的Ge3+未完全沉淀,B错误;
C.X点成分为NaR、NaOH,该溶液呈碱性所以c(Na+)>c(OH-)>c(H+),C正确;
D.,,该反应的K小,即反应很难发生,所以Ga(OH)3不能完全溶于HR溶液,D错误;
故选C。
16.(1)1.0×10-7 mol/L
(2)2
(3)否
(4)1.435×10-4
【详解】(1)反应前,,
;反应后剩余的Cl-为0.1×10-3 mol,则混合溶液中, 。
(2)H+没有参与反应,沉淀完全后,,pH=2。
(3)因为加入的盐酸中和反应后所得溶液中的相同,没有改变,变小,所以,没有沉淀产生。
(4)
17.8.37
【详解】由方程式可知,反应Al(OH)3+OH—Al(OH)的平衡常数K==100.63,则Al(OH)溶液中的铝元素完全沉淀时,溶液的氢氧根离子浓度为=10-5.63 mol/L,则溶液的pH为8.37,故答案为:8.37。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
