2024年高考化学二轮复习回归基础专题14电解质溶液训练(含解析)
文档属性
| 名称 | 2024年高考化学二轮复习回归基础专题14电解质溶液训练(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-14 09:03:34 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2024年高考化学二轮复习回归基础专题14电解质溶液训练
一、选择题,共21小题
1.(23-24高三上·四川德阳·阶段练习)25℃,4种溶液的pH如下表所示:
编号 ① ② ③ ④
溶液 氨水 氢氧化钠溶液 醋酸 盐酸
pH 11 11 3 3
下列有关叙述中正确的是
A.溶液中水的电离程度由大到小的顺序为:①=③>②=④
B.向①、②中分别加入适量氯化铵晶体后,溶液的pH均减小
C.向③中加入少量醋酸钠固体,则溶液中将增大
D.将aL②与bL④混合,若所得溶液的pH=4,则a:b=11:9
2.(22-23高二上·湖南益阳·期末)下列说法正确的是
A.常温下,当水电离出的c(H+)为时,此溶液的pH可能为1
B.将的盐酸稀释至1000mL,所得溶液的pH为8
C.实验室可用pH试纸测定“84”消毒液的pH
D.在100℃时,pH约为6的纯水呈酸性
3.(23-24高二上·黑龙江哈尔滨·阶段练习)常温下,①的溶液、②的溶液、③的氨水、④的溶液,相同条件下,有关上述溶液的比较中错误的是
A.水电离的:①=④>②=③
B.将②③溶液等体积混合后
C.②④溶液混合后呈中性,则两溶液的体积关系是②:④=1:10
D.将①溶液和②溶液分别稀释10倍、100倍后,所得两溶液的相等
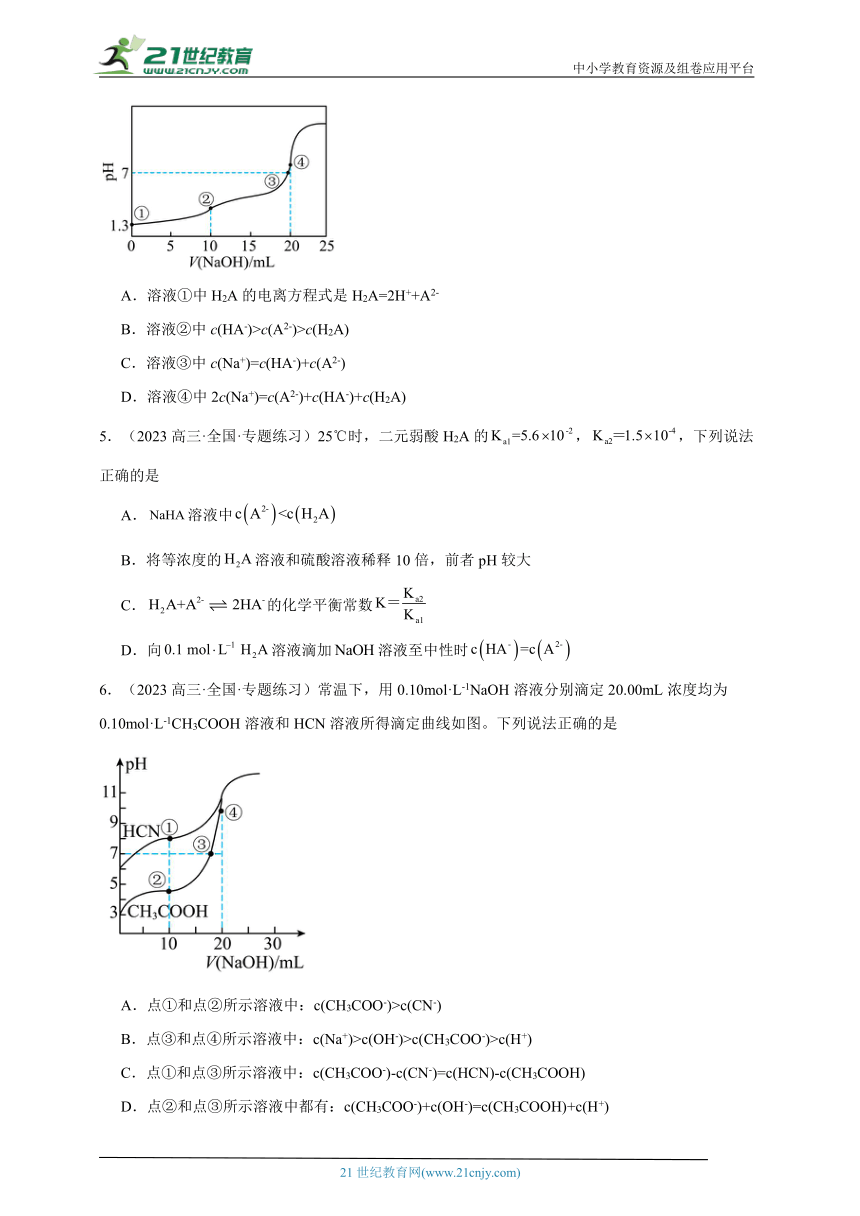
4.(21-22高三下·北京通州·开学考试)常温下,用0.10mol·L-1NaOH溶液滴定10 mL0.10mol·L-1H2A溶液,测得滴定曲线如图,下列说法正确的是
A.溶液①中H2A的电离方程式是H2A=2H++A2-
B.溶液②中c(HA-)>c(A2-)>c(H2A)
C.溶液③中c(Na+)=c(HA-)+c(A2-)
D.溶液④中2c(Na+)=c(A2-)+c(HA-)+c(H2A)
5.(2023高三·全国·专题练习)25℃时,二元弱酸H2A的,,下列说法正确的是
A.溶液中
B.将等浓度的溶液和硫酸溶液稀释10倍,前者pH较大
C.的化学平衡常数
D.向溶液滴加溶液至中性时
6.(2023高三·全国·专题练习)常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1CH3COOH溶液和HCN溶液所得滴定曲线如图。下列说法正确的是
A.点①和点②所示溶液中:c(CH3COO-)>c(CN-)
B.点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C.点①和点③所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
D.点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
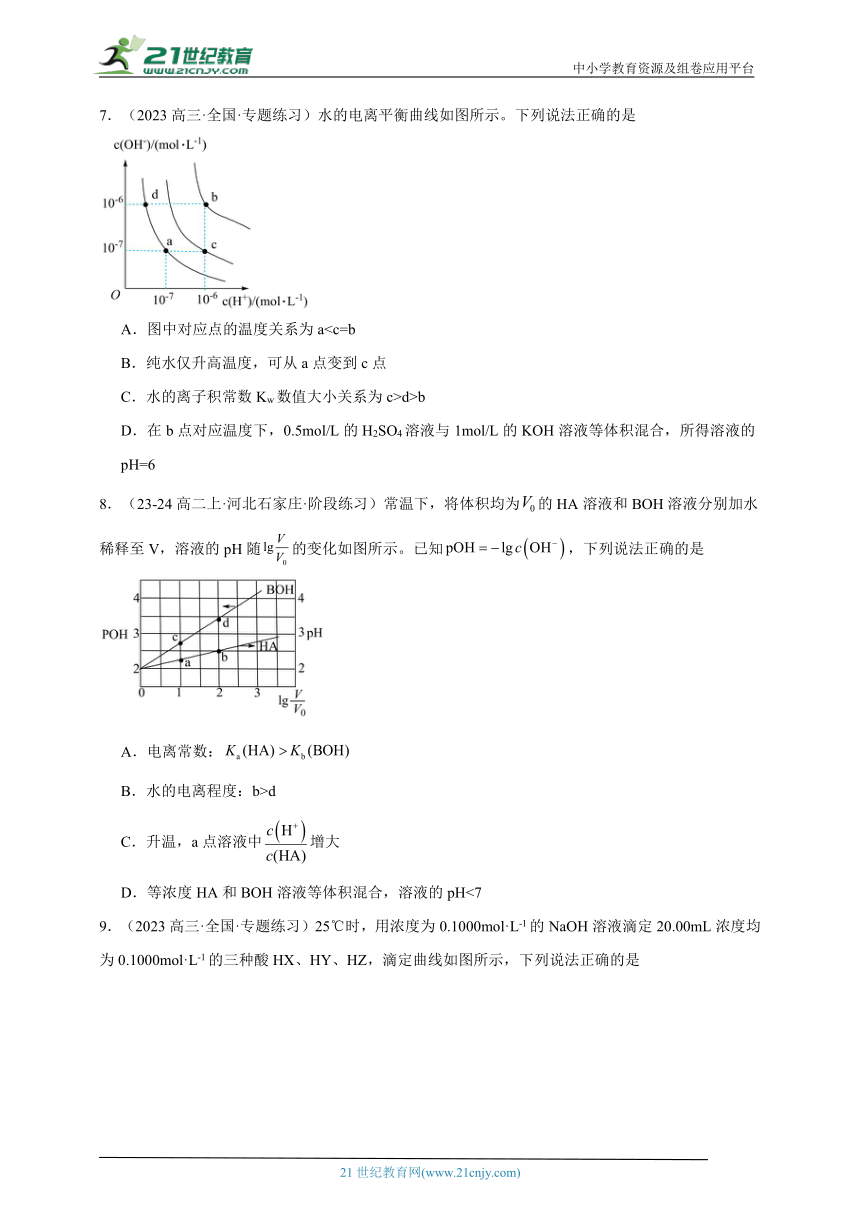
7.(2023高三·全国·专题练习)水的电离平衡曲线如图所示。下列说法正确的是
A.图中对应点的温度关系为aB.纯水仅升高温度,可从a点变到c点
C.水的离子积常数Kw数值大小关系为c>d>b
D.在b点对应温度下,0.5mol/L的H2SO4溶液与1mol/L的KOH溶液等体积混合,所得溶液的pH=6
8.(23-24高二上·河北石家庄·阶段练习)常温下,将体积均为的HA溶液和BOH溶液分别加水稀释至V,溶液的pH随的变化如图所示。已知,下列说法正确的是
A.电离常数:
B.水的电离程度:b>d
C.升温,a点溶液中增大
D.等浓度HA和BOH溶液等体积混合,溶液的pH<7
9.(2023高三·全国·专题练习)25℃时,用浓度为0.1000mol·L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol·L-1的三种酸HX、HY、HZ,滴定曲线如图所示,下列说法正确的是
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZB.根据滴定曲线,可得Ka(HY)=10-7
C.相同温度下,电离常数的关系:KHX>KHY
D.pH=7时,三种溶液中c(Z-)>c(Y-)>c(X-)
10.(23-24高三上·陕西·阶段练习)常温下,用浓度为的NaOH标准溶液滴定浓度均为的HCl和的混合溶液,滴定过程中溶液的pH随的变化曲线如图所示。下列说法错误的是
A.约为
B.水的电离程度:aC.点b:
D.点a:
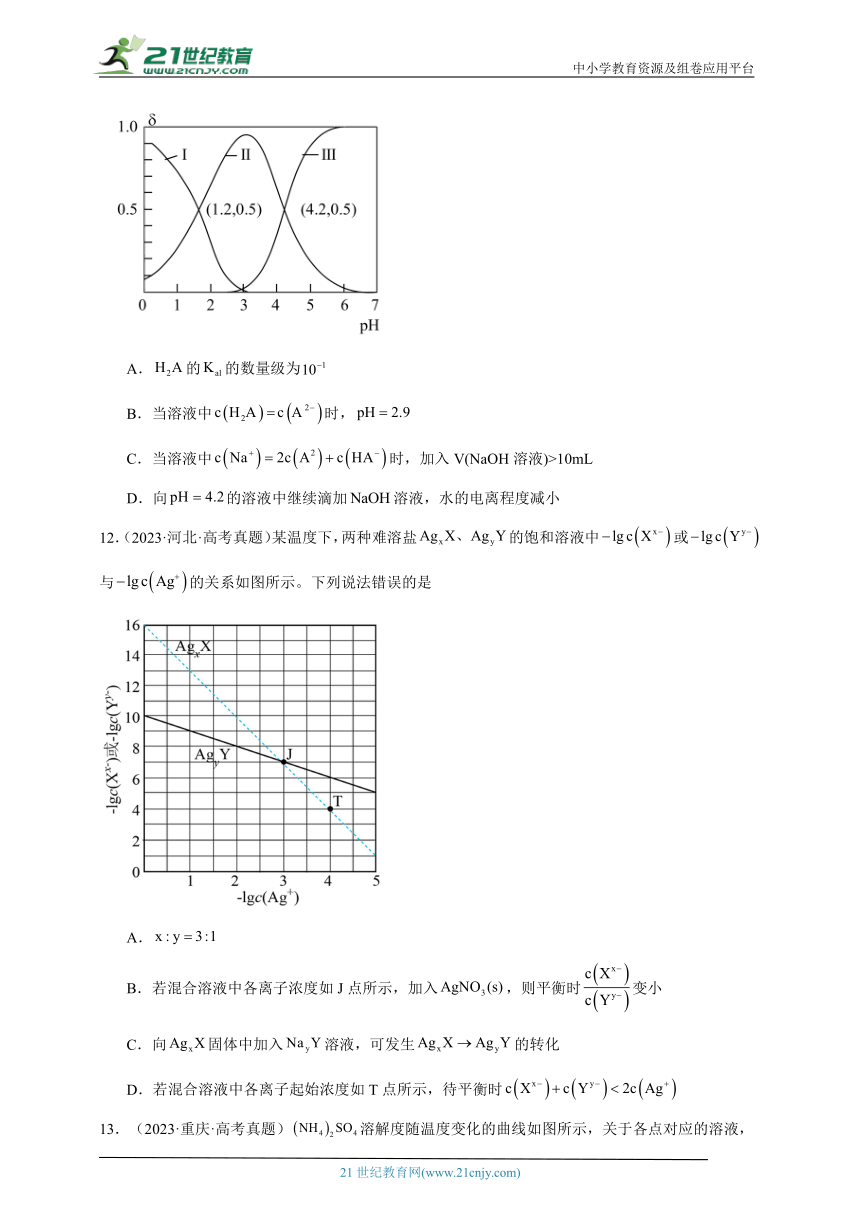
11.(23-24高三上·山西·阶段练习)为二元酸,其电离过程为:。常温时,向水溶液中逐滴滴加溶液,混合溶液中和的物质的量分数随变化的关系如图所示。下列说法正确的是
A.的的数量级为
B.当溶液中时,
C.当溶液中时,加入V(NaOH溶液)>10mL
D.向的溶液中继续滴加溶液,水的电离程度减小
12.(2023·河北·高考真题)某温度下,两种难溶盐的饱和溶液中或与的关系如图所示。下列说法错误的是
A.
B.若混合溶液中各离子浓度如J点所示,加入,则平衡时变小
C.向固体中加入溶液,可发生的转化
D.若混合溶液中各离子起始浓度如T点所示,待平衡时
13.(2023·重庆·高考真题)溶解度随温度变化的曲线如图所示,关于各点对应的溶液,下列说法正确的是
A.点等于点
B.点大于点
C.点降温过程中有2个平衡发生移动
D.点
14.(2023·浙江·高考真题)草酸()是二元弱酸。某小组做如下两组实验:
实验I:往溶液中滴加溶液。
实验Ⅱ:往溶液中滴加溶液。
[已知:的电离常数,溶液混合后体积变化忽略不计],下列说法正确的是
A.实验I可选用甲基橙作指示剂,指示反应终点
B.实验I中时,存在
C.实验Ⅱ中发生反应
D.实验Ⅱ中时,溶液中
15.(2023·湖北·高考真题)为某邻苯二酚类配体,其,。常温下构建溶液体系,其中,。体系中含Fe物种的组分分布系数δ与pH的关系如图所示,分布系数,已知,。下列说法正确的是
A.当时,体系中
B.pH在9.5~10.5之间,含L的物种主要为
C.的平衡常数的lgK约为14
D.当时,参与配位的
16.(2022高三·全国·专题练习)甘氨酸是人体必需氨基酸之一、在时,、和的分布分数【如】与溶液关系如图。下列说法错误的是
A.甘氨酸具有两性
B.曲线c代表
C.的平衡常数
D.
17.(20-21高三·湖北孝感·阶段练习)常温下,将溶液滴加到等浓度的某一元酸HA溶液中,测得混合溶液的pH与粒子浓度比值的负对数的变化关系如图所示下列叙述不正确的是
A.m点对应的溶液体积小于
B.的数量级为
C.l点所示溶液中:
D.各点的水溶液中水的电离程度大小关系:
18.(23-24高三上·北京·阶段练习)下列图示与对应叙述相符的是
A.图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则
B.图乙表示1L pH=2的溶液加水稀释至V L,pH随的变化
C.图丙表示在不同温度下水溶液中和浓度的变化曲线,图中温度
D.0.1mol/L 溶液的pH随温度变化的曲线如图丁中A所示
19.(23-24高三上·北京东城·期中)常温下,向新制氯水中滴加NaOH溶液,溶液中水电离出的浓度与NaOH溶液体积之间的关系如图所示。下列推断不正确的是
A.E、F点溶液的pH分别为3和7
B.F点对应的溶液中:
C.G点对应的溶液中:
D.F~H点对应的溶液中,为定值
20.(23-24高三上·安徽·阶段练习)已知H2R是二元弱酸。298K时,向一定浓度的KHR溶液中滴加盐酸,混合溶液中pX与pH的关系如图所示或下列说法错误的是
A.直线L 表示与pH的关系
B.的数量级为10-4
C.c点溶液中,
D.KHR和K2R的混合溶液可能呈中性
21.(23-24高三上·湖北·期末)常温下,用0.1mol/L的NaOH溶液滴定20mL0.1mol/LHA溶液。溶液中(或HA)的分布系数δ、NaOH溶液体积V与pH的关系如图所示[已知:]。下列说法正确的是
A.m点对应溶液中:
B.0.1mol/LHA溶液的pH约为3.1
C.p点对应溶液中:
D.m、p、n、q中,水的电离程度最大的是n点
参考答案:
1.B
【详解】A. 酸碱都抑制水电离,pH =11的氨水中c(H+)=10-11、c(OH-)=10-3,由水电离的c(H+)=10-11;pH =11的氢氧化钠溶液中c(H+)=10-11、c(OH-)=10-3,由水电离的c(H+)=10-11;pH =3的醋酸中c(H+)=10-3、c(OH-)=10-11,由水电离的c(H+)=10-11;pH =3的盐酸中c(H+)=10-3、c(OH-)=10-11,由水电离的c(H+)=10-11;溶液中水的电离程度由大到小的顺序为:①=③=②=④,故A错误;
B. 向①中加适量氯化铵晶体后,铵根离子浓度增大,一水合氨的电离平衡逆向移动,氢氧根离子浓度减小,pH减小;向②中加入适量氯化铵晶体后,铵根离子和氢氧根离子结合为一水合氨,氢氧根离子浓度减小,pH减小;故B正确;
C. 向③中加入少量醋酸钠固体,则溶液中,水的离子积醋酸、醋酸电离平衡常数只与温度有关,所以不变,故C错误;
D. 将aL②与bL④混合,若所得溶液的pH=4,则,则a:b=9:11,故D错误;
选B。
2.A
【详解】A.由水电离出的c(H+)=1.0×10-13mol/L,则水电离出的c(OH-)═1.0×10-13mol/L,溶液中c(H+)×c(OH-)=1.0×10-14mol/L,所以原来的溶液的c(H+)=0.1mol/L或者1.0×10-13mol/L,即溶液可能呈现强酸性或强碱性,强酸时pH=1,强碱时pH=13,故A正确;
B.酸溶液无论如何稀释,不能变为碱性,只能是无限接近中性,故将1mL 1×10-5mol L-1盐酸稀释至1000mL,所得溶液的pH小于7,故B错误;
C.“84”消毒液具有强氧化性,不能用pH试纸测量pH,需要用pH计测量,故C错误;
D.在100℃时,pH约为6的纯水中始终存在,溶液呈中性,故D错误;
故选A。
3.D
【详解】A.①的溶液中由水电离出、②的溶液中由水电离出、③的氨水中由水电离出、④的溶液中由水电离出,则水电离的:①=④>②=③,A正确;
B.由于的溶液完全电离、的氨水只能部分电离出,等体积混合后生成碱过量,,B正确;
C.的溶液和的溶液混合后呈中性,说明两溶液中氢离子和氢氧根离子的物质的量相等,则,C正确;
D.由于是弱酸,不能完全电离,加水稀释后电离程度增大,而是强酸,已经完全电离,故将的溶液和的溶液分别稀释10倍、100倍后,所得两溶液的不相等,D错误;
故选D。
4.B
【分析】由图可知,0.1mol/L H2A溶液的pH为1.3,则H2A为二元弱酸;氢氧化钠溶液体积为10mL时,氢氧化钠溶液与H2A溶液恰好反应得到NaHA溶液,溶液呈酸性说明HA-离子在溶液中的电离程度大于水解程度;氢氧化钠溶液与H2A溶液反应得到的中性溶液为NaHA和Na2A的混合溶液;氢氧化钠溶液体积为20mL时,氢氧化钠溶液与NaHA溶液恰好反应得到Na2A溶液。
【详解】A.由分析可知,H2A为二元弱酸,在溶液中分步电离,电离以一级为主,则溶液①中H2A的电离方程式是H2AH++HA-,故A错误;
B.由分析可知,溶液②为NaHA溶液,溶液呈酸性说明HA-离子在溶液中的电离程度大于水解程度,则溶液中微粒浓度的大小顺序为c(HA-)>c(A2-)>c(H2A),故B正确;
C.由分析可知,溶液③为NaHA和Na2A的混合溶液,溶液呈中性,溶液中氢离子浓度与氢氧根离子浓度相等,由电荷守恒关系c(Na+)+ c(H+)=c(HA-)+2c(A2-)+ c(OH—),则溶液中c(Na+)=c(HA-)+2c(A2-),故C错误;
D.由分析可知,溶液④为Na2A溶液,溶液中存在物料守恒关系c(Na+)=2c(A2-)+2c(HA-)+2c(H2A) ,故D错误;
故选B。
5.B
【详解】A.NaHA溶液中,HA-既有电离又有水解,HA-的电离平衡:,HA-的水解平衡:,电离大于水解,故c(A2-)>c(H2A),A错误;
B.等浓度的H2A溶液和硫酸溶液稀释10倍,浓度仍然相同,H2A是弱酸,部分电离,硫酸是强酸,完全电离,故pH前者较大,B正确;
C.的化学平衡常数,C错误;
D.,当c(HA-)=c(A2-)时,,溶液呈酸性,故向溶液滴加溶液至中性时,,D错误;
答案选B。
6.A
【分析】由图可知点①所示溶液为等浓度的NaCN、HCN混合溶液,点②所示溶液为等浓度的CH3COONa、CH3COOH混合溶液,点③所示溶液呈中性为CH3COONa、CH3COOH混合溶液,点④恰好生成醋酸钠,据此分析解答。
【详解】A.未加NaOH时HCN的pH大,可知HCN的酸性比醋酸弱,点①和点②含等量的NaCN、CH3COONa,CN-水解程度大,则c(CH3COO-)>c(CN-),故A正确;
B.点③中pH=7,则c(OH-)=c(H+),则点③中c(Na+)=c(CH3COO-)>c(H+)=c(OH-),点④恰好生成醋酸钠,水解显碱性,存在c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故B错误;
C.点①的溶液中存在物料守恒为c(HCN)+c(CN-)=2c(Na+),点②所示溶液中的物料守恒为c(CH3COOH)+c(CH3COO-)=2c(Na+),二者中钠离子浓度相同,则c(HCN)+c(CN-)=c(CH3COOH)+c(CH3COO-),即c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH),由点②到点③,继续加入NaOH,CH3COO-、CH3COOH浓度发生改变,故C错误;
D.点②和点③所示溶液中存在电荷守恒c(OH-)+c(CH3COO-)=c(Na+)+c(H+),但两溶液中都不存在c(CH3COOH)=c(Na+)的关系,故D错误;
故选:A。
7.D
【详解】A.温度越高,水的离子积常数越大,根据图象知,b点Kw=10-12,c点Kw=10-13,a点Kw=10-14,所以b>c>a,A错误;
B.a点和c点氢氧根离子的浓度相等,c点氢离子浓度大于氢氧根离子浓度,若纯水仅升高温度,氢氧根与氢离子浓度都增大,B错误;
C.a、d曲线温度相同,则离子积常数相同,即d点Kw=10-14,b点Kw=10-12,c点Kw=10-13,所以水的电离常数Kw数值大小关系为:b>c>d,C错误;
D.b点Kw=10-12,0.5mol/L的H2SO4溶液与1mol/L的KOH溶液等体积混合,氢离子浓度和氢氧根离子浓度相同,等体积混合溶液呈中性,pH=6,D正确;
故选D。
8.C
【分析】横坐标表示加水稀释倍,纵坐标pOH增大表示稀释过程中,BOH溶液的减小, pH增大表示稀释过程中AH溶液的减小。加水稀释相同倍数时,pOH或pH增大得越小,说明对应的碱或酸越弱,则相同条件下,BOH的电离程度大于HA的,据此答题。
【详解】A.根据分析知,相同条件下,BOH电离程度大于HA,则,A错误;
B.根据pOH和pH的相对大小知,b点时由HA电离产生的大于d点时BOH电离产生的,则b点时水的电离被抵制程度大于d点时,故水的电离程度bC.升温,促进HA的电离,溶液中增大,减小,故a点溶液中增大,C正确;
D.根据分析知,等浓度时,HA中小于BOH中的,等体积混合,未完全反应,故混合溶液pH>7,D错误;
故选C。
9.D
【详解】A.由图像可知酸性:HZ>HY>HX,因此同温同浓度时,三种酸溶液的导电能力顺序:HZ>HY>HX,A错误;
B.从滴定曲线可知,,B错误;
C.酸性:HY>HX,则KHY>KHX,C错误;
D.中和至pH=7时,HX、HY、HZ消耗的NaOH的物质的量依次增多,则c(Z-)>c(Y-)>c(X-),D正确;
答案选D。
10.B
【分析】NaOH溶液与HCl和的混酸反应时,先与HCl反应,再与反应。由滴定曲线可知,a点时NaOH溶液和HCl恰好完全反应生成NaCl和水,未发生反应,溶质成分为NaCl和;b点时NaOH溶液反应掉一半的,溶质成分为NaCl、和;c点时NaOH溶液与恰好完全反应,溶质成分为NaCl、;d点时NaOH过量,溶质成分为NaCl、和NaOH。
【详解】A.由以上分析可知,a点时,,,故A正确;
B.c点溶液中水解,促进水的电离,d点碱过量,抑制水的电离,则水的电离程度,故B错误;
C.点b溶液中含有NaCl及等浓度的和,由于,溶液显酸性,说明的电离程度大于的水解程度,则,故C正确;
D.a点溶液为等浓度的NaCl和混合溶液,存在物料守恒关系,故D正确;
故选B。
11.C
【分析】为二元酸,其电离过程为:,。常温时,向水溶液中逐滴滴加溶液,混合溶液中、和的物质的量分数随变化的关系如图所示,分析可知,Ⅰ为含量变化曲线,Ⅱ为含量变化曲线,Ⅲ为含量变化曲线。Ⅰ和Ⅱ的交点处,氢离子浓度即为此二元酸的第一级电离常数值,Ⅱ与Ⅲ交点处氢离子浓度即为此二元酸的第二级电离常数值,结合溶液中的三大守恒分析即可。
【详解】A.根据分析的=,数量级为,A错误;
B.根据分析,Ka1(H2A)=10-1.2,同理Ka2(H2A)=10-4.2,当c(H2A)=c(A2-)时,,此时c(H+)=1×10-2.7mol/L,pH=2.7,B错误;
C.当溶液中时,由电荷守恒分析此时溶液呈现中性,向水溶液中逐滴滴加溶液,若加入溶液体积等于10mL,此时形成NaHA溶液,其电离大于水解,溶液呈现酸性,故应在10mL的基础上多加溶液才有可能呈现中性,故加入V(NaOH溶液)>10mL,C正确;
D.向的溶液中继续滴加NaOH溶液,结合图分析,含量再减小,含量增大,故水的电离程度在增大,而氢氧化钠溶液过量则会导致水的电离受到抑制,故水的电离程度先变大后减小,D错误;
故选C。
12.D
【分析】对于沉淀,存在沉淀溶解平衡,则,在图像上任找两点(0,16),(3,7),转化成相应的离子浓度代入,由于温度不变,所以计算出的不变,可求得x=3,;对于沉淀,存在沉淀溶解平衡,,按照同样的方法,在图像上任找两点(0,10),(3,7),可求得y=1,。
【详解】A.根据分析可知,x=3,y=1,,A项正确;
B.由图像可知,若混合溶液中各离子浓度如J点所示,此时,加入,增大,减小,则,,变小,B项正确;
C.向固体中加入溶液,当达到了的溶度积常数,可发生→的转化,C项正确;
D.若混合溶液中各离子起始浓度如T点所示,由于沉淀达到沉淀溶解平衡,所以不发生变化,而要发生沉淀,和的物质的量按1:y减少,所以达到平衡时,D项错误;
故选D。
13.B
【详解】A.温度升高,水的电离程度增大,则点小于点,A错误;
B.升高温度促进铵根离子的电离,且N点铵根离子浓度更大,水解生成氢离子浓度更大,N点酸性更强,故点大于点,B正确;
C.点降温过程中有水的电离平衡、铵根离子的水解平衡、硫酸铵的溶解平衡3个平衡发生移动,C错误;
D.点为硫酸铵的不饱和溶液,由电荷守恒可知,,D错误;
故选B。
【点睛】
14.D
【详解】A.溶液被氢氧化钠溶液滴定到终点时生成显碱性的草酸钠溶液,为了减小实验误差要选用变色范围在碱性范围的指示剂,因此,实验I可选用酚酞作指示剂,指示反应终点,故A错误;
B.实验I中时,溶质是、且两者物质的量浓度相等,,,则草酸氢根的电离程度大于草酸根的水解程度,因此存在,故B错误;
C.实验Ⅱ中,由于开始滴加的氯化钙量较少而过量,因此该反应在初始阶段发生的是,该反应的平衡常数为,因为平衡常数很大,说明反应能够完全进行,当完全消耗后,再和发生反应,故C错误;
D.实验Ⅱ中时,溶液中的钙离子浓度为,溶液中,故D正确。
综上所述,答案为D。
15.C
【分析】从图给的分布分数图可以看出,在两曲线的交点横坐标值加和取平均值即为某型体含量最大时的pH,利用此规律解决本题。
【详解】A.从图中可以看出Fe(Ⅲ)主要与L2-进行络合,但在pH=1时,富含L的型体主要为H2L,此时电离出的HL-较少,根据H2L的一级电离常数可以简单计算pH=1时溶液中c(HL-)≈5×10-9.46,但pH=1时c(OH-)=10-13,因此这四种离子的浓度大小为c(H2L)>c([FeL]+)>c(HL-)>c(OH-),A错误;
B.根据图示的分布分数图可以推导出,H2L在pH≈9.9时HL-的含量最大,而H2L和L2-的含量最少,因此当pH在9.5~10.5之间时,含L的物种主要为HL-,B错误;
C.该反应的平衡常数K=,当[FeL2]-与[FeL]+分布分数相等时,可以将K简化为K=,此时体系的pH=4,在pH=4时可以计算溶液中c(L2-)=5.0×10-14.86,则该络合反应的平衡常数K≈1014.16,即lg K≈14,C正确;
D.根据图像,pH=10时溶液中主要的型体为[FeL3]3-和[FeL2(OH)]2-,其分布分数均约为0.5,因此可以得到c([FeL3]3-)=c([FeL2(OH)]2-)=1×10-4mol·L-1,此时形成[FeL3]3-消耗了3×10-4mol·L-1的L2-,形成[FeL2(OH)]2-消耗了2×10-4mol·L-1的L2-,共消耗了5×10-4mol·L-1的L2-,即参与配位的c(L2-)≈5×10-4,D错误;
故答案选C。
16.D
【详解】A.中存在和-COOH,所以溶液既有酸性又有碱性,故A正确;
B.氨基具有碱性,在酸性较强时会结合氢离子,羧基具有酸性,在碱性较强时与氢氧根离子反应,故曲线a表示 的分布分数随溶液pH的变化,曲b表示
的分布分数随溶液pH的变化,曲线c表示的分布分数随溶液pH的变化,故B正确;
C.的平衡常数,时,根据a,b曲线交点坐标可知,时,,则,故C正确;
D.由C项分析可知,,根据b,c曲线交点坐标坐标分析可得电离平衡的电离常数为K1=,,则,即,故D错误;
故答案选D。
17.D
【详解】A.NaOH与HA浓度相等,当NaOH溶液体积等于10mL时,得到的溶液中溶质为等浓度的HA和NaA的混合溶液,HA的电离程度大于A 的水解程度,所以c(A )>c(HA),而m点p=0,说明c(A )=c(HA),则m点对应的NaOH溶液的体积小于10mL,故A正确;
B.m点时c(A )=c(HA),此时,所以的数量级为,故B正确;
C.l点所示溶液显酸性,是NaA与HA的混合溶液,则根据元素质量守恒可得: ,故C正确;
D.l、m、n点各溶液均呈酸性,溶液的酸性越强,HA的浓度越大,对水电离的抑制作用就越强。由于酸性:l<m<n,则各点水的电离程度大小关系:l>m>n,故D错误;
故选D。
18.D
【详解】A.由图甲FeS和CuS的沉淀溶解平衡曲线可知,当硫离子浓度相同时,平衡时,铜离子浓度小于铁离子浓度,则,A错误;
B.醋酸是弱酸,存在电离平衡,加水稀释,会促进醋酸电离,变化小于n,所以1L pH=2的溶液加水稀释至V L,pH变化并不是图乙所示,B错误;
C.水的电离吸热,温度升高促进水电离,,C错误;
D.温度升高,促进溶液中的铝离子水解,溶液中水解产生的氢离子增多,如图所示减小,D正确;
故选D。
19.D
【分析】E 点未滴加 NaOH为新制氯水,对水的电离有抑制作用;G 点对应溶液中水的电离程度最大,溶质为等物质的量的 和,即氯水和NaOH 恰好完全反应,产生的 NaC1O 水解促进水的电离使溶液呈碱性;F和H点对应溶液中水的电离均未受影响,结合上述分析,F 点溶液呈中性,H点溶液呈碱性,H点溶液为 NaOH、和的混合溶液。
【详解】A.E 点对应溶液为新制氯水,溶液显酸性,由水电离出的,溶液中均由水电离,即溶液中,溶液pH=3;,F 点溶液呈中性pH=7,A正确;
B.F 点溶液呈中性,则,结合电荷守恒 可得,B正确;
C.G 点对应溶液中水的电离程度最大溶质为等物质的量的 和,其中的水解使溶液呈碱性,导致其浓度小于和,故有,C正确;
D.根据元素守恒可知, F~H点对应的溶液中溶液体积不断增大,不是定值,D错误;
故选D。
20.B
【分析】横轴表示pH,纵轴表示-lg或-lg,lgKa1==lg-pH,lgKa2== lg-pH,H2R的一级电离平衡常数Ka1远大于二级电离平衡常数Ka2,则直线L1、L2分别表示p[]、p[],根据a点数据可知,pH=3.85时,-lg=-pH- lgKa1=-1,则Ka1=1×10-2.85,根据b点数据可知,pH=4.66时,-lg=-pH- lgKa2=1,则Ka2=1×10-5.66,以此解答。
【详解】A.根据分析可知,直线L 表示与pH的关系,A正确;
B.根据分析可知,Ka1=1×10-2.85,其数量级为10-3,B错误;
C.c点pH>6,则,则,C正确;
D.HR-的水解常数=,则KHR溶液显酸性,K2R由于R2-水解,溶液显碱性,故KHR和K2R的混合溶液可能呈中性,D正确;
故选B。
21.B
【分析】用NaOH溶液滴定酸HA的过程中会发生反应:NaOH+HA=NaA+H2O,HA不断减少,NaA不断生成,则ab分别表示HA、A-的分布系数δ。溶液的pH不断增大,当加入20mLNaOH溶液时,恰好完全反应。
【详解】A.m点对应的溶液中的溶质为等量NaA和HA,此时溶液pH小于7即c(H+)>c(OH-),说明A-水解程度小于HA电离程度,则c(A-)>c(Na+),故A错误;
B.由图可知,曲线a、b的交点x表示HA和A-的分布系数相同,即溶液中c(HA)=c(A-),由电离平衡常数计算式Ka=,0.1mol/LHA溶液的,则pH约为3.1,故B正确;
C.p点加入15mL的等浓度NaOH溶液,起始是20mL等浓度的HA溶液,存在电荷守恒:c(Na+)+c(H+)=c(A-)+c(OH-),根据原子守恒,含Na和A的粒子总的浓度之比是3:4,故得到物料守恒:4 c(Na+)=3c(A-)+3 c(HA),结合两式可得:,故C错误;
D.由图可知,q点是NaOH和HA恰好完全反应的点,此时溶液中只有A-的水解促进水的电离,水的电离程度最大,故D错误;
故选B。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024年高考化学二轮复习回归基础专题14电解质溶液训练
一、选择题,共21小题
1.(23-24高三上·四川德阳·阶段练习)25℃,4种溶液的pH如下表所示:
编号 ① ② ③ ④
溶液 氨水 氢氧化钠溶液 醋酸 盐酸
pH 11 11 3 3
下列有关叙述中正确的是
A.溶液中水的电离程度由大到小的顺序为:①=③>②=④
B.向①、②中分别加入适量氯化铵晶体后,溶液的pH均减小
C.向③中加入少量醋酸钠固体,则溶液中将增大
D.将aL②与bL④混合,若所得溶液的pH=4,则a:b=11:9
2.(22-23高二上·湖南益阳·期末)下列说法正确的是
A.常温下,当水电离出的c(H+)为时,此溶液的pH可能为1
B.将的盐酸稀释至1000mL,所得溶液的pH为8
C.实验室可用pH试纸测定“84”消毒液的pH
D.在100℃时,pH约为6的纯水呈酸性
3.(23-24高二上·黑龙江哈尔滨·阶段练习)常温下,①的溶液、②的溶液、③的氨水、④的溶液,相同条件下,有关上述溶液的比较中错误的是
A.水电离的:①=④>②=③
B.将②③溶液等体积混合后
C.②④溶液混合后呈中性,则两溶液的体积关系是②:④=1:10
D.将①溶液和②溶液分别稀释10倍、100倍后,所得两溶液的相等
4.(21-22高三下·北京通州·开学考试)常温下,用0.10mol·L-1NaOH溶液滴定10 mL0.10mol·L-1H2A溶液,测得滴定曲线如图,下列说法正确的是
A.溶液①中H2A的电离方程式是H2A=2H++A2-
B.溶液②中c(HA-)>c(A2-)>c(H2A)
C.溶液③中c(Na+)=c(HA-)+c(A2-)
D.溶液④中2c(Na+)=c(A2-)+c(HA-)+c(H2A)
5.(2023高三·全国·专题练习)25℃时,二元弱酸H2A的,,下列说法正确的是
A.溶液中
B.将等浓度的溶液和硫酸溶液稀释10倍,前者pH较大
C.的化学平衡常数
D.向溶液滴加溶液至中性时
6.(2023高三·全国·专题练习)常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1CH3COOH溶液和HCN溶液所得滴定曲线如图。下列说法正确的是
A.点①和点②所示溶液中:c(CH3COO-)>c(CN-)
B.点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C.点①和点③所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
D.点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
7.(2023高三·全国·专题练习)水的电离平衡曲线如图所示。下列说法正确的是
A.图中对应点的温度关系为a
C.水的离子积常数Kw数值大小关系为c>d>b
D.在b点对应温度下,0.5mol/L的H2SO4溶液与1mol/L的KOH溶液等体积混合,所得溶液的pH=6
8.(23-24高二上·河北石家庄·阶段练习)常温下,将体积均为的HA溶液和BOH溶液分别加水稀释至V,溶液的pH随的变化如图所示。已知,下列说法正确的是
A.电离常数:
B.水的电离程度:b>d
C.升温,a点溶液中增大
D.等浓度HA和BOH溶液等体积混合,溶液的pH<7
9.(2023高三·全国·专题练习)25℃时,用浓度为0.1000mol·L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol·L-1的三种酸HX、HY、HZ,滴定曲线如图所示,下列说法正确的是
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ
C.相同温度下,电离常数的关系:KHX>KHY
D.pH=7时,三种溶液中c(Z-)>c(Y-)>c(X-)
10.(23-24高三上·陕西·阶段练习)常温下,用浓度为的NaOH标准溶液滴定浓度均为的HCl和的混合溶液,滴定过程中溶液的pH随的变化曲线如图所示。下列说法错误的是
A.约为
B.水的电离程度:a
D.点a:
11.(23-24高三上·山西·阶段练习)为二元酸,其电离过程为:。常温时,向水溶液中逐滴滴加溶液,混合溶液中和的物质的量分数随变化的关系如图所示。下列说法正确的是
A.的的数量级为
B.当溶液中时,
C.当溶液中时,加入V(NaOH溶液)>10mL
D.向的溶液中继续滴加溶液,水的电离程度减小
12.(2023·河北·高考真题)某温度下,两种难溶盐的饱和溶液中或与的关系如图所示。下列说法错误的是
A.
B.若混合溶液中各离子浓度如J点所示,加入,则平衡时变小
C.向固体中加入溶液,可发生的转化
D.若混合溶液中各离子起始浓度如T点所示,待平衡时
13.(2023·重庆·高考真题)溶解度随温度变化的曲线如图所示,关于各点对应的溶液,下列说法正确的是
A.点等于点
B.点大于点
C.点降温过程中有2个平衡发生移动
D.点
14.(2023·浙江·高考真题)草酸()是二元弱酸。某小组做如下两组实验:
实验I:往溶液中滴加溶液。
实验Ⅱ:往溶液中滴加溶液。
[已知:的电离常数,溶液混合后体积变化忽略不计],下列说法正确的是
A.实验I可选用甲基橙作指示剂,指示反应终点
B.实验I中时,存在
C.实验Ⅱ中发生反应
D.实验Ⅱ中时,溶液中
15.(2023·湖北·高考真题)为某邻苯二酚类配体,其,。常温下构建溶液体系,其中,。体系中含Fe物种的组分分布系数δ与pH的关系如图所示,分布系数,已知,。下列说法正确的是
A.当时,体系中
B.pH在9.5~10.5之间,含L的物种主要为
C.的平衡常数的lgK约为14
D.当时,参与配位的
16.(2022高三·全国·专题练习)甘氨酸是人体必需氨基酸之一、在时,、和的分布分数【如】与溶液关系如图。下列说法错误的是
A.甘氨酸具有两性
B.曲线c代表
C.的平衡常数
D.
17.(20-21高三·湖北孝感·阶段练习)常温下,将溶液滴加到等浓度的某一元酸HA溶液中,测得混合溶液的pH与粒子浓度比值的负对数的变化关系如图所示下列叙述不正确的是
A.m点对应的溶液体积小于
B.的数量级为
C.l点所示溶液中:
D.各点的水溶液中水的电离程度大小关系:
18.(23-24高三上·北京·阶段练习)下列图示与对应叙述相符的是
A.图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则
B.图乙表示1L pH=2的溶液加水稀释至V L,pH随的变化
C.图丙表示在不同温度下水溶液中和浓度的变化曲线,图中温度
D.0.1mol/L 溶液的pH随温度变化的曲线如图丁中A所示
19.(23-24高三上·北京东城·期中)常温下,向新制氯水中滴加NaOH溶液,溶液中水电离出的浓度与NaOH溶液体积之间的关系如图所示。下列推断不正确的是
A.E、F点溶液的pH分别为3和7
B.F点对应的溶液中:
C.G点对应的溶液中:
D.F~H点对应的溶液中,为定值
20.(23-24高三上·安徽·阶段练习)已知H2R是二元弱酸。298K时,向一定浓度的KHR溶液中滴加盐酸,混合溶液中pX与pH的关系如图所示或下列说法错误的是
A.直线L 表示与pH的关系
B.的数量级为10-4
C.c点溶液中,
D.KHR和K2R的混合溶液可能呈中性
21.(23-24高三上·湖北·期末)常温下,用0.1mol/L的NaOH溶液滴定20mL0.1mol/LHA溶液。溶液中(或HA)的分布系数δ、NaOH溶液体积V与pH的关系如图所示[已知:]。下列说法正确的是
A.m点对应溶液中:
B.0.1mol/LHA溶液的pH约为3.1
C.p点对应溶液中:
D.m、p、n、q中,水的电离程度最大的是n点
参考答案:
1.B
【详解】A. 酸碱都抑制水电离,pH =11的氨水中c(H+)=10-11、c(OH-)=10-3,由水电离的c(H+)=10-11;pH =11的氢氧化钠溶液中c(H+)=10-11、c(OH-)=10-3,由水电离的c(H+)=10-11;pH =3的醋酸中c(H+)=10-3、c(OH-)=10-11,由水电离的c(H+)=10-11;pH =3的盐酸中c(H+)=10-3、c(OH-)=10-11,由水电离的c(H+)=10-11;溶液中水的电离程度由大到小的顺序为:①=③=②=④,故A错误;
B. 向①中加适量氯化铵晶体后,铵根离子浓度增大,一水合氨的电离平衡逆向移动,氢氧根离子浓度减小,pH减小;向②中加入适量氯化铵晶体后,铵根离子和氢氧根离子结合为一水合氨,氢氧根离子浓度减小,pH减小;故B正确;
C. 向③中加入少量醋酸钠固体,则溶液中,水的离子积醋酸、醋酸电离平衡常数只与温度有关,所以不变,故C错误;
D. 将aL②与bL④混合,若所得溶液的pH=4,则,则a:b=9:11,故D错误;
选B。
2.A
【详解】A.由水电离出的c(H+)=1.0×10-13mol/L,则水电离出的c(OH-)═1.0×10-13mol/L,溶液中c(H+)×c(OH-)=1.0×10-14mol/L,所以原来的溶液的c(H+)=0.1mol/L或者1.0×10-13mol/L,即溶液可能呈现强酸性或强碱性,强酸时pH=1,强碱时pH=13,故A正确;
B.酸溶液无论如何稀释,不能变为碱性,只能是无限接近中性,故将1mL 1×10-5mol L-1盐酸稀释至1000mL,所得溶液的pH小于7,故B错误;
C.“84”消毒液具有强氧化性,不能用pH试纸测量pH,需要用pH计测量,故C错误;
D.在100℃时,pH约为6的纯水中始终存在,溶液呈中性,故D错误;
故选A。
3.D
【详解】A.①的溶液中由水电离出、②的溶液中由水电离出、③的氨水中由水电离出、④的溶液中由水电离出,则水电离的:①=④>②=③,A正确;
B.由于的溶液完全电离、的氨水只能部分电离出,等体积混合后生成碱过量,,B正确;
C.的溶液和的溶液混合后呈中性,说明两溶液中氢离子和氢氧根离子的物质的量相等,则,C正确;
D.由于是弱酸,不能完全电离,加水稀释后电离程度增大,而是强酸,已经完全电离,故将的溶液和的溶液分别稀释10倍、100倍后,所得两溶液的不相等,D错误;
故选D。
4.B
【分析】由图可知,0.1mol/L H2A溶液的pH为1.3,则H2A为二元弱酸;氢氧化钠溶液体积为10mL时,氢氧化钠溶液与H2A溶液恰好反应得到NaHA溶液,溶液呈酸性说明HA-离子在溶液中的电离程度大于水解程度;氢氧化钠溶液与H2A溶液反应得到的中性溶液为NaHA和Na2A的混合溶液;氢氧化钠溶液体积为20mL时,氢氧化钠溶液与NaHA溶液恰好反应得到Na2A溶液。
【详解】A.由分析可知,H2A为二元弱酸,在溶液中分步电离,电离以一级为主,则溶液①中H2A的电离方程式是H2AH++HA-,故A错误;
B.由分析可知,溶液②为NaHA溶液,溶液呈酸性说明HA-离子在溶液中的电离程度大于水解程度,则溶液中微粒浓度的大小顺序为c(HA-)>c(A2-)>c(H2A),故B正确;
C.由分析可知,溶液③为NaHA和Na2A的混合溶液,溶液呈中性,溶液中氢离子浓度与氢氧根离子浓度相等,由电荷守恒关系c(Na+)+ c(H+)=c(HA-)+2c(A2-)+ c(OH—),则溶液中c(Na+)=c(HA-)+2c(A2-),故C错误;
D.由分析可知,溶液④为Na2A溶液,溶液中存在物料守恒关系c(Na+)=2c(A2-)+2c(HA-)+2c(H2A) ,故D错误;
故选B。
5.B
【详解】A.NaHA溶液中,HA-既有电离又有水解,HA-的电离平衡:,HA-的水解平衡:,电离大于水解,故c(A2-)>c(H2A),A错误;
B.等浓度的H2A溶液和硫酸溶液稀释10倍,浓度仍然相同,H2A是弱酸,部分电离,硫酸是强酸,完全电离,故pH前者较大,B正确;
C.的化学平衡常数,C错误;
D.,当c(HA-)=c(A2-)时,,溶液呈酸性,故向溶液滴加溶液至中性时,,D错误;
答案选B。
6.A
【分析】由图可知点①所示溶液为等浓度的NaCN、HCN混合溶液,点②所示溶液为等浓度的CH3COONa、CH3COOH混合溶液,点③所示溶液呈中性为CH3COONa、CH3COOH混合溶液,点④恰好生成醋酸钠,据此分析解答。
【详解】A.未加NaOH时HCN的pH大,可知HCN的酸性比醋酸弱,点①和点②含等量的NaCN、CH3COONa,CN-水解程度大,则c(CH3COO-)>c(CN-),故A正确;
B.点③中pH=7,则c(OH-)=c(H+),则点③中c(Na+)=c(CH3COO-)>c(H+)=c(OH-),点④恰好生成醋酸钠,水解显碱性,存在c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故B错误;
C.点①的溶液中存在物料守恒为c(HCN)+c(CN-)=2c(Na+),点②所示溶液中的物料守恒为c(CH3COOH)+c(CH3COO-)=2c(Na+),二者中钠离子浓度相同,则c(HCN)+c(CN-)=c(CH3COOH)+c(CH3COO-),即c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH),由点②到点③,继续加入NaOH,CH3COO-、CH3COOH浓度发生改变,故C错误;
D.点②和点③所示溶液中存在电荷守恒c(OH-)+c(CH3COO-)=c(Na+)+c(H+),但两溶液中都不存在c(CH3COOH)=c(Na+)的关系,故D错误;
故选:A。
7.D
【详解】A.温度越高,水的离子积常数越大,根据图象知,b点Kw=10-12,c点Kw=10-13,a点Kw=10-14,所以b>c>a,A错误;
B.a点和c点氢氧根离子的浓度相等,c点氢离子浓度大于氢氧根离子浓度,若纯水仅升高温度,氢氧根与氢离子浓度都增大,B错误;
C.a、d曲线温度相同,则离子积常数相同,即d点Kw=10-14,b点Kw=10-12,c点Kw=10-13,所以水的电离常数Kw数值大小关系为:b>c>d,C错误;
D.b点Kw=10-12,0.5mol/L的H2SO4溶液与1mol/L的KOH溶液等体积混合,氢离子浓度和氢氧根离子浓度相同,等体积混合溶液呈中性,pH=6,D正确;
故选D。
8.C
【分析】横坐标表示加水稀释倍,纵坐标pOH增大表示稀释过程中,BOH溶液的减小, pH增大表示稀释过程中AH溶液的减小。加水稀释相同倍数时,pOH或pH增大得越小,说明对应的碱或酸越弱,则相同条件下,BOH的电离程度大于HA的,据此答题。
【详解】A.根据分析知,相同条件下,BOH电离程度大于HA,则,A错误;
B.根据pOH和pH的相对大小知,b点时由HA电离产生的大于d点时BOH电离产生的,则b点时水的电离被抵制程度大于d点时,故水的电离程度b
D.根据分析知,等浓度时,HA中小于BOH中的,等体积混合,未完全反应,故混合溶液pH>7,D错误;
故选C。
9.D
【详解】A.由图像可知酸性:HZ>HY>HX,因此同温同浓度时,三种酸溶液的导电能力顺序:HZ>HY>HX,A错误;
B.从滴定曲线可知,,B错误;
C.酸性:HY>HX,则KHY>KHX,C错误;
D.中和至pH=7时,HX、HY、HZ消耗的NaOH的物质的量依次增多,则c(Z-)>c(Y-)>c(X-),D正确;
答案选D。
10.B
【分析】NaOH溶液与HCl和的混酸反应时,先与HCl反应,再与反应。由滴定曲线可知,a点时NaOH溶液和HCl恰好完全反应生成NaCl和水,未发生反应,溶质成分为NaCl和;b点时NaOH溶液反应掉一半的,溶质成分为NaCl、和;c点时NaOH溶液与恰好完全反应,溶质成分为NaCl、;d点时NaOH过量,溶质成分为NaCl、和NaOH。
【详解】A.由以上分析可知,a点时,,,故A正确;
B.c点溶液中水解,促进水的电离,d点碱过量,抑制水的电离,则水的电离程度,故B错误;
C.点b溶液中含有NaCl及等浓度的和,由于,溶液显酸性,说明的电离程度大于的水解程度,则,故C正确;
D.a点溶液为等浓度的NaCl和混合溶液,存在物料守恒关系,故D正确;
故选B。
11.C
【分析】为二元酸,其电离过程为:,。常温时,向水溶液中逐滴滴加溶液,混合溶液中、和的物质的量分数随变化的关系如图所示,分析可知,Ⅰ为含量变化曲线,Ⅱ为含量变化曲线,Ⅲ为含量变化曲线。Ⅰ和Ⅱ的交点处,氢离子浓度即为此二元酸的第一级电离常数值,Ⅱ与Ⅲ交点处氢离子浓度即为此二元酸的第二级电离常数值,结合溶液中的三大守恒分析即可。
【详解】A.根据分析的=,数量级为,A错误;
B.根据分析,Ka1(H2A)=10-1.2,同理Ka2(H2A)=10-4.2,当c(H2A)=c(A2-)时,,此时c(H+)=1×10-2.7mol/L,pH=2.7,B错误;
C.当溶液中时,由电荷守恒分析此时溶液呈现中性,向水溶液中逐滴滴加溶液,若加入溶液体积等于10mL,此时形成NaHA溶液,其电离大于水解,溶液呈现酸性,故应在10mL的基础上多加溶液才有可能呈现中性,故加入V(NaOH溶液)>10mL,C正确;
D.向的溶液中继续滴加NaOH溶液,结合图分析,含量再减小,含量增大,故水的电离程度在增大,而氢氧化钠溶液过量则会导致水的电离受到抑制,故水的电离程度先变大后减小,D错误;
故选C。
12.D
【分析】对于沉淀,存在沉淀溶解平衡,则,在图像上任找两点(0,16),(3,7),转化成相应的离子浓度代入,由于温度不变,所以计算出的不变,可求得x=3,;对于沉淀,存在沉淀溶解平衡,,按照同样的方法,在图像上任找两点(0,10),(3,7),可求得y=1,。
【详解】A.根据分析可知,x=3,y=1,,A项正确;
B.由图像可知,若混合溶液中各离子浓度如J点所示,此时,加入,增大,减小,则,,变小,B项正确;
C.向固体中加入溶液,当达到了的溶度积常数,可发生→的转化,C项正确;
D.若混合溶液中各离子起始浓度如T点所示,由于沉淀达到沉淀溶解平衡,所以不发生变化,而要发生沉淀,和的物质的量按1:y减少,所以达到平衡时,D项错误;
故选D。
13.B
【详解】A.温度升高,水的电离程度增大,则点小于点,A错误;
B.升高温度促进铵根离子的电离,且N点铵根离子浓度更大,水解生成氢离子浓度更大,N点酸性更强,故点大于点,B正确;
C.点降温过程中有水的电离平衡、铵根离子的水解平衡、硫酸铵的溶解平衡3个平衡发生移动,C错误;
D.点为硫酸铵的不饱和溶液,由电荷守恒可知,,D错误;
故选B。
【点睛】
14.D
【详解】A.溶液被氢氧化钠溶液滴定到终点时生成显碱性的草酸钠溶液,为了减小实验误差要选用变色范围在碱性范围的指示剂,因此,实验I可选用酚酞作指示剂,指示反应终点,故A错误;
B.实验I中时,溶质是、且两者物质的量浓度相等,,,则草酸氢根的电离程度大于草酸根的水解程度,因此存在,故B错误;
C.实验Ⅱ中,由于开始滴加的氯化钙量较少而过量,因此该反应在初始阶段发生的是,该反应的平衡常数为,因为平衡常数很大,说明反应能够完全进行,当完全消耗后,再和发生反应,故C错误;
D.实验Ⅱ中时,溶液中的钙离子浓度为,溶液中,故D正确。
综上所述,答案为D。
15.C
【分析】从图给的分布分数图可以看出,在两曲线的交点横坐标值加和取平均值即为某型体含量最大时的pH,利用此规律解决本题。
【详解】A.从图中可以看出Fe(Ⅲ)主要与L2-进行络合,但在pH=1时,富含L的型体主要为H2L,此时电离出的HL-较少,根据H2L的一级电离常数可以简单计算pH=1时溶液中c(HL-)≈5×10-9.46,但pH=1时c(OH-)=10-13,因此这四种离子的浓度大小为c(H2L)>c([FeL]+)>c(HL-)>c(OH-),A错误;
B.根据图示的分布分数图可以推导出,H2L在pH≈9.9时HL-的含量最大,而H2L和L2-的含量最少,因此当pH在9.5~10.5之间时,含L的物种主要为HL-,B错误;
C.该反应的平衡常数K=,当[FeL2]-与[FeL]+分布分数相等时,可以将K简化为K=,此时体系的pH=4,在pH=4时可以计算溶液中c(L2-)=5.0×10-14.86,则该络合反应的平衡常数K≈1014.16,即lg K≈14,C正确;
D.根据图像,pH=10时溶液中主要的型体为[FeL3]3-和[FeL2(OH)]2-,其分布分数均约为0.5,因此可以得到c([FeL3]3-)=c([FeL2(OH)]2-)=1×10-4mol·L-1,此时形成[FeL3]3-消耗了3×10-4mol·L-1的L2-,形成[FeL2(OH)]2-消耗了2×10-4mol·L-1的L2-,共消耗了5×10-4mol·L-1的L2-,即参与配位的c(L2-)≈5×10-4,D错误;
故答案选C。
16.D
【详解】A.中存在和-COOH,所以溶液既有酸性又有碱性,故A正确;
B.氨基具有碱性,在酸性较强时会结合氢离子,羧基具有酸性,在碱性较强时与氢氧根离子反应,故曲线a表示 的分布分数随溶液pH的变化,曲b表示
的分布分数随溶液pH的变化,曲线c表示的分布分数随溶液pH的变化,故B正确;
C.的平衡常数,时,根据a,b曲线交点坐标可知,时,,则,故C正确;
D.由C项分析可知,,根据b,c曲线交点坐标坐标分析可得电离平衡的电离常数为K1=,,则,即,故D错误;
故答案选D。
17.D
【详解】A.NaOH与HA浓度相等,当NaOH溶液体积等于10mL时,得到的溶液中溶质为等浓度的HA和NaA的混合溶液,HA的电离程度大于A 的水解程度,所以c(A )>c(HA),而m点p=0,说明c(A )=c(HA),则m点对应的NaOH溶液的体积小于10mL,故A正确;
B.m点时c(A )=c(HA),此时,所以的数量级为,故B正确;
C.l点所示溶液显酸性,是NaA与HA的混合溶液,则根据元素质量守恒可得: ,故C正确;
D.l、m、n点各溶液均呈酸性,溶液的酸性越强,HA的浓度越大,对水电离的抑制作用就越强。由于酸性:l<m<n,则各点水的电离程度大小关系:l>m>n,故D错误;
故选D。
18.D
【详解】A.由图甲FeS和CuS的沉淀溶解平衡曲线可知,当硫离子浓度相同时,平衡时,铜离子浓度小于铁离子浓度,则,A错误;
B.醋酸是弱酸,存在电离平衡,加水稀释,会促进醋酸电离,变化小于n,所以1L pH=2的溶液加水稀释至V L,pH变化并不是图乙所示,B错误;
C.水的电离吸热,温度升高促进水电离,,C错误;
D.温度升高,促进溶液中的铝离子水解,溶液中水解产生的氢离子增多,如图所示减小,D正确;
故选D。
19.D
【分析】E 点未滴加 NaOH为新制氯水,对水的电离有抑制作用;G 点对应溶液中水的电离程度最大,溶质为等物质的量的 和,即氯水和NaOH 恰好完全反应,产生的 NaC1O 水解促进水的电离使溶液呈碱性;F和H点对应溶液中水的电离均未受影响,结合上述分析,F 点溶液呈中性,H点溶液呈碱性,H点溶液为 NaOH、和的混合溶液。
【详解】A.E 点对应溶液为新制氯水,溶液显酸性,由水电离出的,溶液中均由水电离,即溶液中,溶液pH=3;,F 点溶液呈中性pH=7,A正确;
B.F 点溶液呈中性,则,结合电荷守恒 可得,B正确;
C.G 点对应溶液中水的电离程度最大溶质为等物质的量的 和,其中的水解使溶液呈碱性,导致其浓度小于和,故有,C正确;
D.根据元素守恒可知, F~H点对应的溶液中溶液体积不断增大,不是定值,D错误;
故选D。
20.B
【分析】横轴表示pH,纵轴表示-lg或-lg,lgKa1==lg-pH,lgKa2== lg-pH,H2R的一级电离平衡常数Ka1远大于二级电离平衡常数Ka2,则直线L1、L2分别表示p[]、p[],根据a点数据可知,pH=3.85时,-lg=-pH- lgKa1=-1,则Ka1=1×10-2.85,根据b点数据可知,pH=4.66时,-lg=-pH- lgKa2=1,则Ka2=1×10-5.66,以此解答。
【详解】A.根据分析可知,直线L 表示与pH的关系,A正确;
B.根据分析可知,Ka1=1×10-2.85,其数量级为10-3,B错误;
C.c点pH>6,则,则,C正确;
D.HR-的水解常数=,则KHR溶液显酸性,K2R由于R2-水解,溶液显碱性,故KHR和K2R的混合溶液可能呈中性,D正确;
故选B。
21.B
【分析】用NaOH溶液滴定酸HA的过程中会发生反应:NaOH+HA=NaA+H2O,HA不断减少,NaA不断生成,则ab分别表示HA、A-的分布系数δ。溶液的pH不断增大,当加入20mLNaOH溶液时,恰好完全反应。
【详解】A.m点对应的溶液中的溶质为等量NaA和HA,此时溶液pH小于7即c(H+)>c(OH-),说明A-水解程度小于HA电离程度,则c(A-)>c(Na+),故A错误;
B.由图可知,曲线a、b的交点x表示HA和A-的分布系数相同,即溶液中c(HA)=c(A-),由电离平衡常数计算式Ka=,0.1mol/LHA溶液的,则pH约为3.1,故B正确;
C.p点加入15mL的等浓度NaOH溶液,起始是20mL等浓度的HA溶液,存在电荷守恒:c(Na+)+c(H+)=c(A-)+c(OH-),根据原子守恒,含Na和A的粒子总的浓度之比是3:4,故得到物料守恒:4 c(Na+)=3c(A-)+3 c(HA),结合两式可得:,故C错误;
D.由图可知,q点是NaOH和HA恰好完全反应的点,此时溶液中只有A-的水解促进水的电离,水的电离程度最大,故D错误;
故选B。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
