2024年高考化学二轮复习回归基础专题11新型电化学装置分析训练(含解析)
文档属性
| 名称 | 2024年高考化学二轮复习回归基础专题11新型电化学装置分析训练(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-14 09:05:27 | ||
图片预览

文档简介
中小学教育资源及组卷应用平台
2024年高考化学二轮复习回归基础专题11新型电化学装置分析训练
一、单选题,共22小题
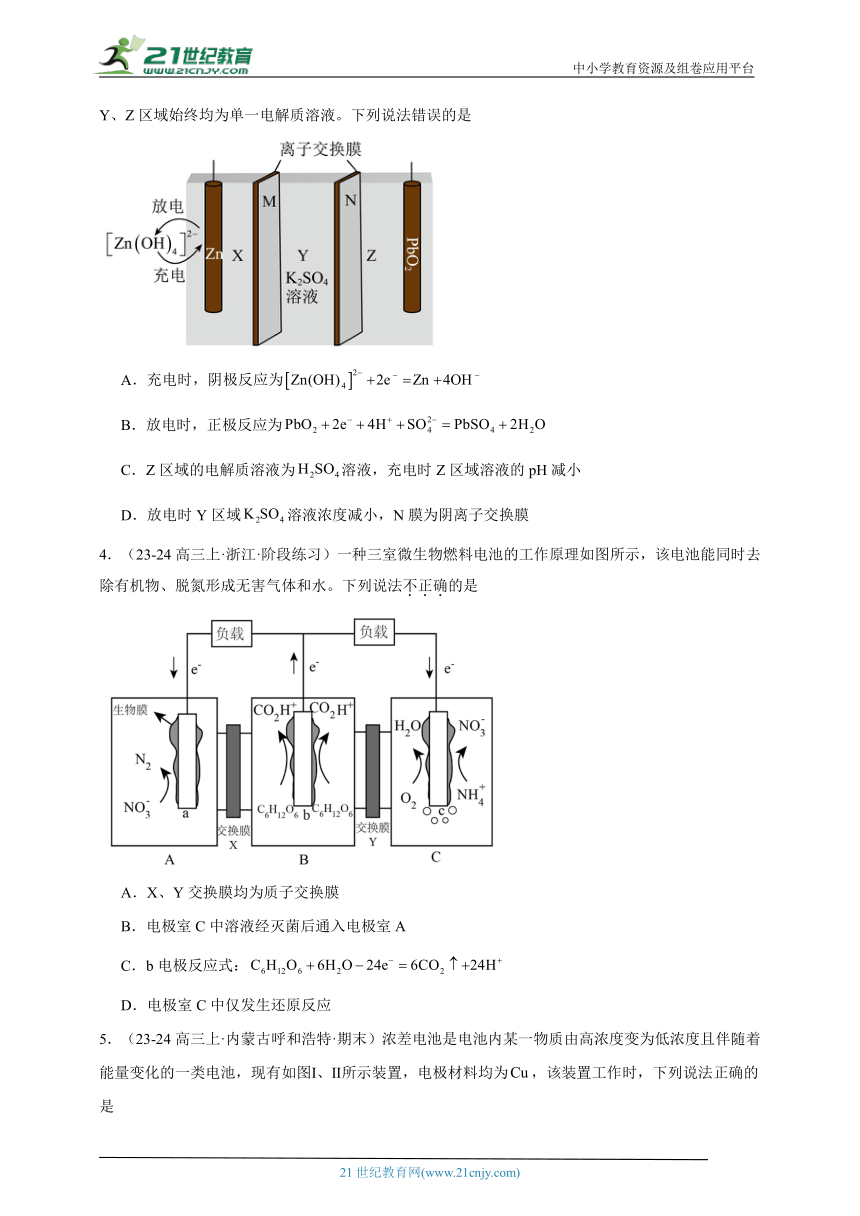
1.(23-24高三上·河北张家口·阶段练习)化学电源在日常生活和高科技领域中都有广泛应用。下列说法正确的是
A.甲:对比普通锌锰干电池,碱性锌锰电池的比能量和可储存时间均有所提高
B.乙:负极的电极反应式为
C.丙:锌筒作负极,发生氧化反应,消耗时内电路中有电子转移
D.丁:电池放电过程中,负极质量逐渐变轻
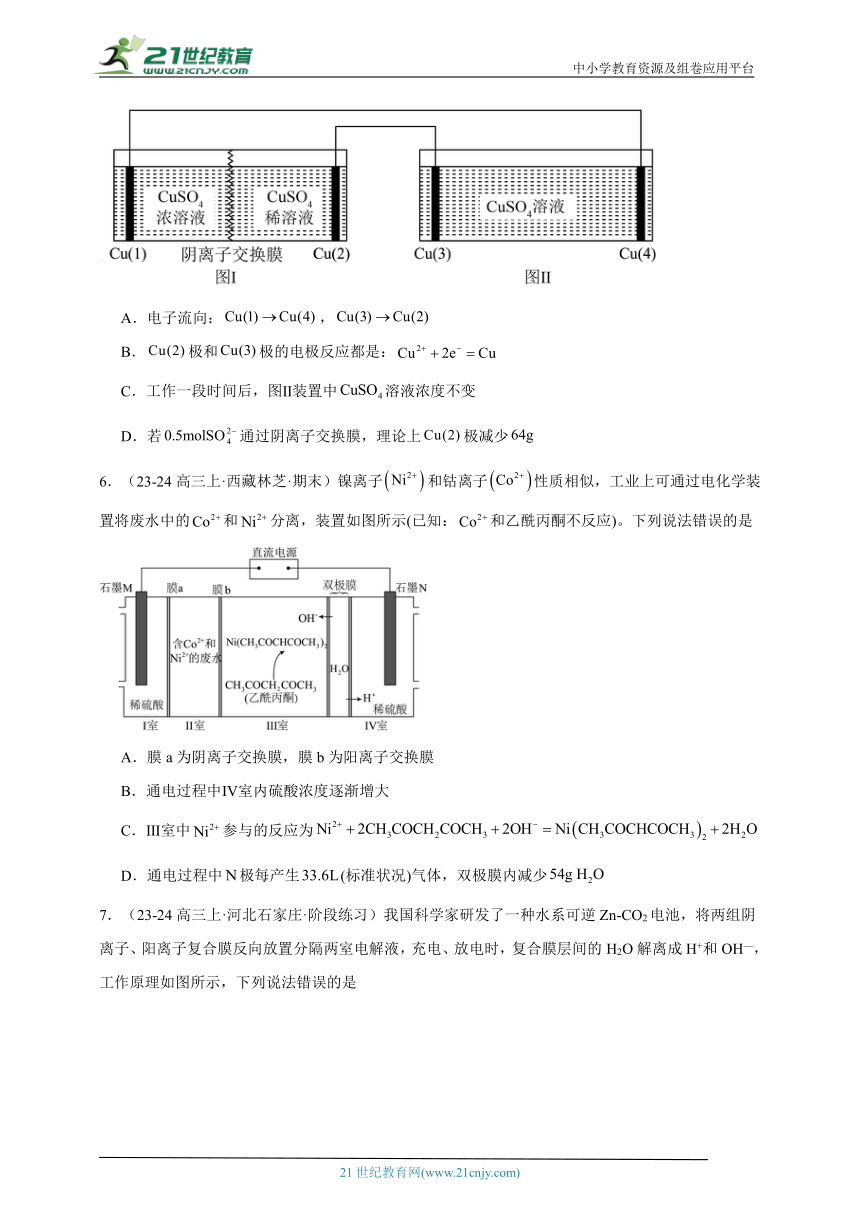
2.(23-24高三上·四川成都·阶段练习)以柏林绿Fe[Fe(CN)6]为代表的新型可充电钠离子电池,其放电工作原理如图所示。下列说法不正确的是
A.放电时,Na+通过交换膜从右室移向左室
B.放电时,Mo箔上的电势比Mg箔上的高
C.充电时,Mg箔接电源的负极
D.充电时,阴极反应式为Fe[Fe(CN)6]+2Na++2e-= Na2Fe[Fe(CN)6]
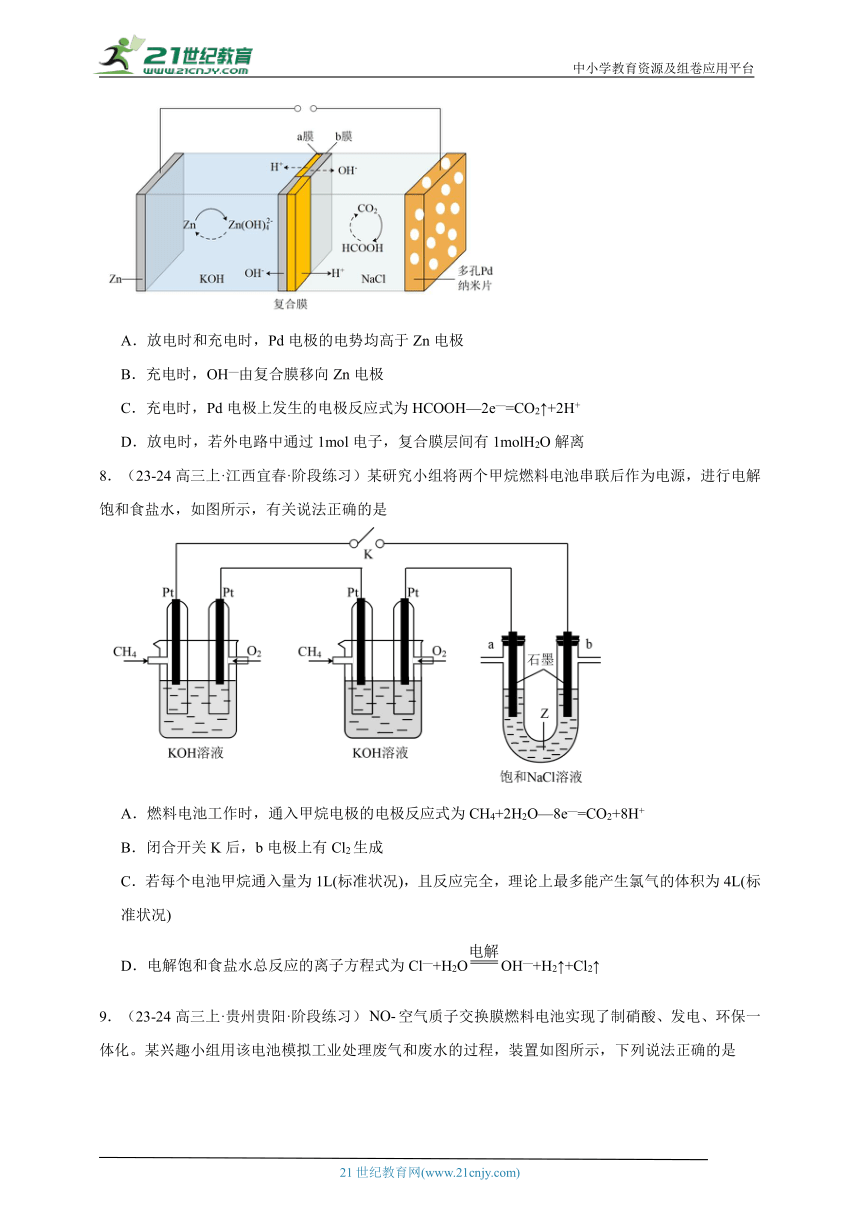
3.(23-24高三上·河南周口·阶段练习)我国科学家发明了一种二次电池,装置如图所示,X、Z区域的电解质溶液不同,各为溶液和KOH溶液中的一种。已知放电、充电过程中,X、Y、Z区域始终均为单一电解质溶液。下列说法错误的是
A.充电时,阴极反应为
B.放电时,正极反应为
C.Z区域的电解质溶液为溶液,充电时Z区域溶液的pH减小
D.放电时Y区域溶液浓度减小,N膜为阴离子交换膜
4.(23-24高三上·浙江·阶段练习)一种三室微生物燃料电池的工作原理如图所示,该电池能同时去除有机物、脱氮形成无害气体和水。下列说法不正确的是
A.X、Y交换膜均为质子交换膜
B.电极室C中溶液经灭菌后通入电极室A
C.b电极反应式:
D.电极室C中仅发生还原反应
5.(23-24高三上·内蒙古呼和浩特·期末)浓差电池是电池内某一物质由高浓度变为低浓度且伴随着能量变化的一类电池,现有如图Ⅰ、Ⅱ所示装置,电极材料均为,该装置工作时,下列说法正确的是
A.电子流向:,
B.极和极的电极反应都是:
C.工作一段时间后,图Ⅱ装置中溶液浓度不变
D.若通过阴离子交换膜,理论上极减少
6.(23-24高三上·西藏林芝·期末)镍离子和钴离子性质相似,工业上可通过电化学装置将废水中的和分离,装置如图所示(已知:和乙酰丙酮不反应)。下列说法错误的是
A.膜a为阴离子交换膜,膜b为阳离子交换膜
B.通电过程中Ⅳ室内硫酸浓度逐渐增大
C.Ⅲ室中参与的反应为
D.通电过程中极每产生(标准状况)气体,双极膜内减少
7.(23-24高三上·河北石家庄·阶段练习)我国科学家研发了一种水系可逆Zn-CO2电池,将两组阴离子、阳离子复合膜反向放置分隔两室电解液,充电、放电时,复合膜层间的H2O解离成H+和OH—,工作原理如图所示,下列说法错误的是
A.放电时和充电时,Pd电极的电势均高于Zn电极
B.充电时,OH—由复合膜移向Zn电极
C.充电时,Pd电极上发生的电极反应式为HCOOH—2e—=CO2↑+2H+
D.放电时,若外电路中通过1mol电子,复合膜层间有1molH2O解离
8.(23-24高三上·江西宜春·阶段练习)某研究小组将两个甲烷燃料电池串联后作为电源,进行电解饱和食盐水,如图所示,有关说法正确的是
A.燃料电池工作时,通入甲烷电极的电极反应式为CH4+2H2O—8e—=CO2+8H+
B.闭合开关K后,b电极上有Cl2生成
C.若每个电池甲烷通入量为1L(标准状况),且反应完全,理论上最多能产生氯气的体积为4L(标准状况)
D.电解饱和食盐水总反应的离子方程式为Cl—+H2OOH—+H2↑+Cl2↑
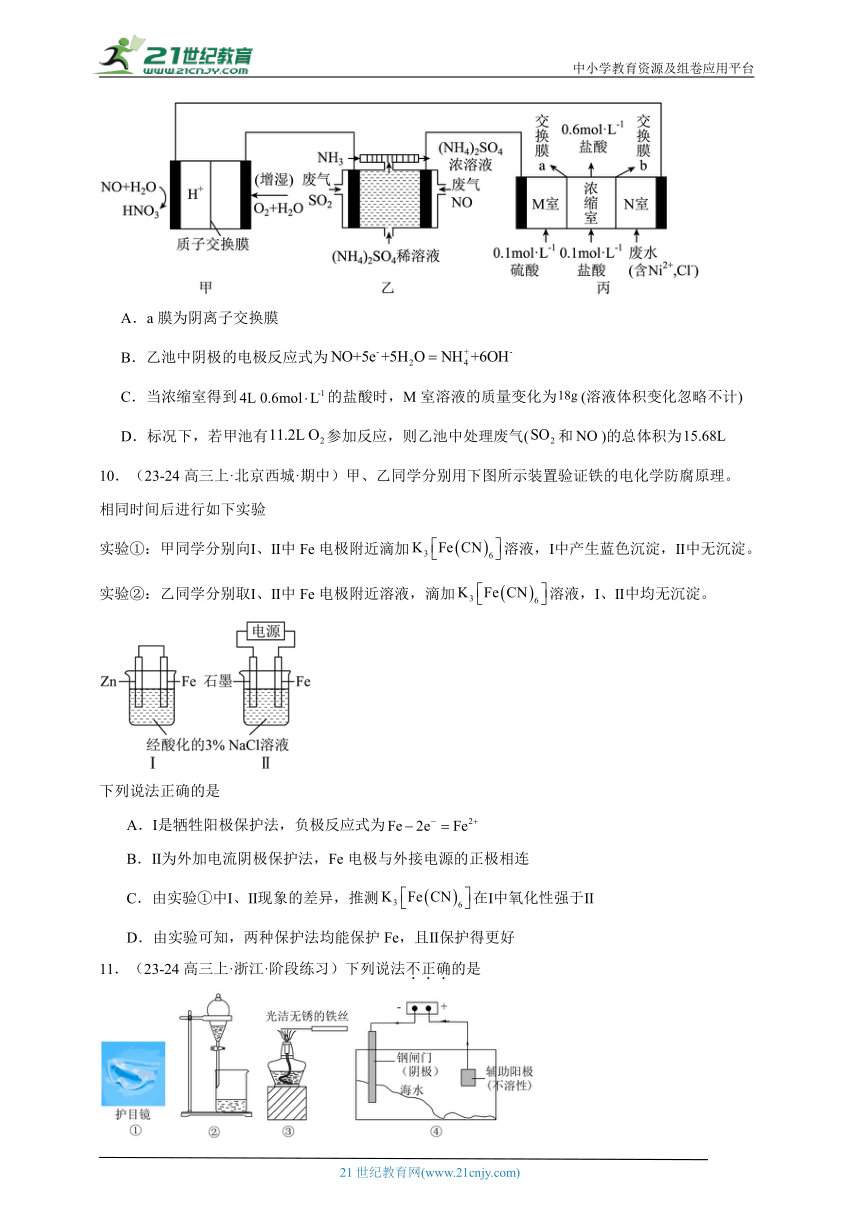
9.(23-24高三上·贵州贵阳·阶段练习)空气质子交换膜燃料电池实现了制硝酸、发电、环保一体化。某兴趣小组用该电池模拟工业处理废气和废水的过程,装置如图所示,下列说法正确的是
A.a膜为阴离子交换膜
B.乙池中阴极的电极反应式为
C.当浓缩室得到的盐酸时,M室溶液的质量变化为(溶液体积变化忽略不计)
D.标况下,若甲池有参加反应,则乙池中处理废气(和)的总体积为
10.(23-24高三上·北京西城·期中)甲、乙同学分别用下图所示装置验证铁的电化学防腐原理。
相同时间后进行如下实验
实验①:甲同学分别向Ⅰ、Ⅱ中Fe电极附近滴加溶液,Ⅰ中产生蓝色沉淀,Ⅱ中无沉淀。
实验②:乙同学分别取Ⅰ、Ⅱ中Fe电极附近溶液,滴加溶液,Ⅰ、Ⅱ中均无沉淀。
下列说法正确的是
A.Ⅰ是牺牲阳极保护法,负极反应式为
B.Ⅱ为外加电流阴极保护法,Fe电极与外接电源的正极相连
C.由实验①中Ⅰ、Ⅱ现象的差异,推测在Ⅰ中氧化性强于Ⅱ
D.由实验可知,两种保护法均能保护Fe,且Ⅱ保护得更好
11.(23-24高三上·浙江·阶段练习)下列说法不正确的是
A.图①:进行化学实验时,需要佩戴护目镜,以保护眼睛
B.图②:可用于分离植物油和水的混合液
C.图③:可用于硫酸钠的焰色试验
D.图④:牺牲阳极法保护钢铁设备的示意图
12.(2023·广西南宁·模拟预测)如图是利用甲醇燃料电池进行电化学研究的装置图,下列说法正确的是
A.甲池将化学能转化为电能,总反应为2CH3OH+3O2=2CO2+4H2O
B.乙池中的Ag不断溶解
C.反应一段时间后要使乙池恢复原状,可加入一定量CuO固体
D.当甲池中有22.4LO2参与反应时,乙池中理论上可析出12.8g固体
13.(2023·湖北武汉·模拟预测)设是阿伏加德罗常数的值。下列说法中正确的是
A.标准状况下,22.4LNO2所含质子数为
B.1mol与足量反应时,转移电子数为
C.50mL 12mol/L的盐酸与足量共热,生成水分子的数目为
D.铅酸蓄电池的正极质量增加3.2g时,电路中通过的电子数目为
14.(2023·广东·高考真题)负载有和的活性炭,可选择性去除实现废酸的纯化,其工作原理如图。下列说法正确的是
A.作原电池正极
B.电子由经活性炭流向
C.表面发生的电极反应:
D.每消耗标准状况下的,最多去除
15.(2023·辽宁·高考真题)某低成本储能电池原理如下图所示。下列说法正确的是
A.放电时负极质量减小
B.储能过程中电能转变为化学能
C.放电时右侧通过质子交换膜移向左侧
D.充电总反应:
16.(2022高三·全国·专题练习)某储能电池原理如图。下列说法正确的是
A.放电时负极反应:
B.放电时透过多孔活性炭电极向中迁移
C.放电时每转移电子,理论上吸收
D.充电过程中,溶液浓度增大
17.(2022·广东·高考真题)科学家基于易溶于的性质,发展了一种无需离子交换膜的新型氯流电池,可作储能设备(如图)。充电时电极a的反应为: 。下列说法正确的是
A.充电时电极b是阴极
B.放电时溶液的减小
C.放电时溶液的浓度增大
D.每生成,电极a质量理论上增加
18.(2022·浙江·高考真题)pH计是一种采用原电池原理测量溶液pH的仪器。如图所示,以玻璃电极(在特制玻璃薄膜球内放置已知浓度的HCl溶液,并插入Ag—AgCl电极)和另一Ag—AgCl电极插入待测溶液中组成电池,pH与电池的电动势E存在关系:pH=(E-常数)/0.059。下列说法正确的是
A.如果玻璃薄膜球内电极的电势低,则该电极反应式为:AgCl(s)+e-=Ag(s)+Cl-(0.1mol·L-1)
B.玻璃膜内外氢离子浓度的差异不会引起电动势的变化
C.分别测定含已知pH的标准溶液和未知溶液的电池的电动势,可得出未知溶液的pH
D.pH计工作时,电能转化为化学能
19.(23-24高三上·黑龙江·期末)钠离子电池比锂离子电池更稳定,造价更低。一种钠离子电池构造示意图如下,已知电池反应:放电,下列说法错误的是
A.钠离子电池比锂离子电池内阻大,短路时不易发热,具备更高安全性
B.充电时,阳极的电极反应式为
C.放电时,正极钠的化合价未发生改变
D.废旧钠离子电池进行“放电处理”让进入硬碳中而有利于回收
20.(23-24高三上·辽宁锦州·期末)盐酸羟胺()是一种常见的还原剂和显像剂,其化学性质类似。工业上采用图1装置进行制备,其电池装置中含Fe的催化电极反应机理如图2所示。不考虑溶液体积的变化,下列说法正确的是
A.电子从含Fe的催化电极流出沿导线流入Pt电极
B.图2中,X为和,Y为
C.电池工作一段时间后,正极区溶液的pH减小
D.理论上,当有标准状况下参与反应时,左室溶液质量增加3.3g
21.(23-24高二上·福建南平·期中)利用CH4燃料电池电解制备Ca(H2PO4)2并得到副产物NaOH、H2、Cl2,装置如图所示。下列说法正确的是
A.a极反应:CH4-8e-+4O2- = CO2+2H2O
B.A膜和C膜均为阴离子交换膜,B膜为阳离子交换膜
C.可用铁电极替换阳极的石墨电极
D.a极上通入2.24L甲烷,理论上产品室可新增0.4mol Ca(H2PO4)2
22.(2023·北京海淀·二模)甲、乙同学分别用如图所示装置验证铁的电化学防腐原理,相同时间后继续进行实验。
实验①:甲同学分别向Ⅰ、Ⅱ中Fe电极附近滴加K3[Fe(CN)6]溶液,Ⅰ中产生蓝色沉淀,Ⅱ中无沉淀。
实验②:乙同学分别取Ⅰ、Ⅱ中Fe电极附近溶液,滴加K3[Fe(CN)6]溶液,Ⅰ、Ⅱ中均无沉淀。
下列说法正确的是
A.Ⅰ是牺牲阳极保护法,正极反应式为
B.Ⅱ为外加电流阴极保护法,Fe电极与外接电源的正极相连
C.由实验①中Ⅰ、Ⅱ现象的差异,推测K3[Fe(CN)6]在Ⅰ中氧化性强于Ⅱ
D.由实验可知,两种保护法均能保护,且Ⅱ保护得更好
二、多选题,共1小题
23.(2022·山东·高考真题)设计如图装置回收金属钴。保持细菌所在环境pH稳定,借助其降解乙酸盐生成,将废旧锂离子电池的正极材料转化为,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法正确的是
A.装置工作时,甲室溶液pH逐渐增大
B.装置工作一段时间后,乙室应补充盐酸
C.乙室电极反应式为
D.若甲室减少,乙室增加,则此时已进行过溶液转移
参考答案:
1.A
【详解】A.对比普通锌锰干电池,碱性锌锰电池的比能量和可储存时间均有所提高,A正确;
B.乙装置中,为负极,B错误;
C.丙中锌较活泼,故锌为负极,锌失去电子发生氧化反应,锌筒会变薄,但是电子不会进入内电路,C错误;
D.电池放电过程中,铅和二氧化铅都反应生成硫酸铅,负极铅转化为硫酸铅,质量增加,D错误。
故选A。
2.D
【分析】根据图示,放电过程中,Mg变成[Mg2Cl2]2+,Mg被氧化,所以Mg箔为负极,Mo箔为正极;则充电时,Mg箔上发生还原反应,为阴极,Mo箔为阳极,由此分析解答。
【详解】C.放电时为原电池,Na+通过交换膜从右室(负极)移向左室(正极),故A正确;
B.放电时,Mg箔为负极,Mo箔为正极,Mo箔上的电势比Mg箔上的高,故B正确;
C.充电时为电解池,Mg箔为电解池阴极,与电源的负极相连,故C正确;
D.放电时为原电池,Mg箔为负极,发生氧化反应,电极反应式为2Mg+2Cl 4e =[Mg2Cl2]2+,则充电时Mg箔为阴极,发生得电子的还原反应,阴极反应式为[Mg2Cl2]2++4e =2Mg+4Cl ,故D错误;
故答案选D。
3.D
【分析】Zn为活泼金属,根据原电池工作原理,放电时Zn为负极,电极反应式为Zn-2e-+4OH-=,PbO2为正极,电极反应式为。
【详解】A.根据图示,放电时Zn变为,发生氧化反应,Zn电极为负极,则充电时Zn电极为阴极,阴极的电极反应为,A不符合题意;
B.放电时电极为正极,正极反应为,B不符合题意;
C.放电时,电极反应消耗,则Z区域的电解质溶液为溶液,充电时电极反应为,溶液中增大,故充电时Z区域溶液的pH减小,C不符合题意;
D.放电时,Zn电极反应为,电极反应为,为平衡X、Z区域的溶液电荷,同时保证X、Y、Z区域均为单一电解质溶液,则通过N膜移向Y区域,N膜为阴离子交换膜,通过M膜移向Y区域,M膜为阳离子交换膜,故放电时Y区域溶液浓度增大,D符合题意;
故选D。
4.D
【分析】根据图中电子的流向和电极上的变化可判断电极b电极上发生的反应为:,电极a上的反应为,而电池c上有两个变化过程分别为:,。
【详解】A.结合电极反应可判断X、Y交换膜均为质子交换膜,故A正确;
B.结合分析可知电极室C中溶液经灭菌后通入电极室A,故B正确;
C.b电极反应式:,故C正确;
D.结合电极上的变化,可知电极室C中既发生还原反应又发生了氧化反应,故D错误;
故选D。
5.C
【分析】由于浓差电池是物质从高浓度状态向低浓度状态转移而获得电动势,则根据溶液浓度可知从左侧经阴离子交换膜进入右侧,则Cu(1)是正极,铜离子得到电子发生还原反应生成铜单质,Cu(2)是负极,铜失去电子发生氧化反应生成铜离子,则Cu(3)为阴极、Cu(4)为阳极;
【详解】A.电子由负极流向阴极、由阳极流向正极,结合分析可知,电子流向为Cu(2)→Cu(3),Cu(4)→Cu(1),A错误;
B.极为负极,反应为:;极为阴极,反应为铜离子得到电子发生还原反应生成铜:,B错误;
C.Cu(3)为阴极,铜离子得到生成铜;Cu(4)为阳极,铜失去电子生成铜离子;工作一段时间后,图Ⅱ装置中溶液浓度不变,C正确;
D.0.5mol发生迁移,则转移电子的物质的量为1mol,根据电极反应Cu-2e-=Cu2+可知Cu(4)极0.5molCu反应,质量减少32g,D错误;
故选C。
6.B
【分析】该电化学装置是电解池,根据溶液中离子移动方向OH-移向阳极,左侧石墨为阳极,右侧石墨为阴极,Ⅱ室为原料室,膜b通过Ni2+和Co2+,为阳离子交换膜,膜a通过阴离子,为阴离子交换膜。
【详解】A. 、进入Ⅲ室,和乙酰丙酮不反应,和乙酰丙酮反应。膜a为阴离子交换膜,膜b为阳离子交换膜,A正确;
B.阴极的电极反应为,Ⅳ室内消耗的的物质的量与进入Ⅳ室的的物质的量相等,所以硫酸浓度不变,B错误;
C.由题中信息可知,Ⅲ室中参与的反应为,C正确;
D.通电过程中极每产生(标准状况)气体,即,则双极膜内有进入Ⅳ室,有进入Ⅲ室,故双极膜内减少,即减少,D正确;
答案选B。
7.B
【分析】由图可知,放电时锌电极为原电池的负极,复合膜层间水解离出的氢氧根离子移向负极,碱性条件下锌在负极失去电子发生氧化反应生成四羟基合锌离子,电极反应式为Zn+4OH——2e—=Zn(OH),钯电极为正极,复合膜层间水解离出的氢离子移向正极,酸性条件下二氧化碳在正极得到电子发生还原反应生成甲酸,电极反应式为CO2↑+2H++2e—=HCOOH,则电池的总反应为Zn+2OH—+2H2O+CO2= Zn(OH)+ HCOOH;充电时,与直流电源负极相连的锌电极为电解池的阴极,复合膜层间水解离出的氢离子移向阴极,钯电极为阳极,复合膜层间水解离出的氢氧根离子移向阳极。
【详解】A.由分析可知,放电时锌电极为原电池的负极,钯电极为正极,则钯电极的电势高于锌电极;充电时,与直流电源负极相连的锌电极为电解池的阴极,钯电极为阳极,则钯电极的电势高于锌电极,故A正确;
B.由分析可知,充电时,与直流电源负极相连的锌电极为电解池的阴极,钯电极为阳极,复合膜层间水解离出的氢氧根离子移向阳极,故B错误;
C.由分析可知,充电时,钯电极为阳极,甲酸在阳极失去电子发生氧化反应生成二氧化碳和氢离子,电极反应式为HCOOH—2e—=CO2↑+2H+,故C正确;
D.由分析可知,电池的总反应为Zn+2OH—+2H2O+CO2= Zn(OH)+ HCOOH,反应消耗2mol氢氧根离子时,反应转移3mol电子,则放电时,若外电路中通过1mol电子,复合膜层间有1mol水解离出1mol氢氧根离子,故D正确;
故选B。
8.C
【分析】由图可知,左侧两个装置为甲烷燃料电池,通入甲烷的铂电极为负极,碱性条件下甲烷在负极失去电子发生氧化反应生成碳酸根离子和水,通入氧气的铂电极为正极,水分子作用下氧气在正极得到电子发生还原反应生成氢氧根离子;右侧装置为电解饱和食盐水的电解池,与正极相连的a电极为电解池的阳极,氯离子在阳极失去电子发生氧化反应生成氯气,b电极为阴极,水分子在阴极得到电子发生还原反应生成氢气和氢氧根离子。
【详解】A.由分析可知,通入甲烷的铂电极为负极,碱性条件下甲烷在负极失去电子发生氧化反应生成碳酸根离子和水,电极反应式为CH4+10OH——8e—=CO+7H2O,故A错误;
B.由分析可知,闭合开关K后,与正极相连的a电极为电解池的阳极,氯离子在阳极失去电子发生氧化反应生成氯气,故B错误;
C.设标准状况下生成氯气的体积物VL,由得失电子数目守恒可得:×8=×2,解得V=4,故C正确;
D.由分析可知,右侧装置为电解饱和食盐水的电解池,与正极相连的a电极为电解池的阳极,氯离子在阳极失去电子发生氧化反应生成氯气,b电极为阴极,水分子在阴极得到电子发生还原反应生成氢气和氢氧根离子,则电解饱和食盐水总反应的离子方程式为2Cl—+2H2O2OH—+H2↑+Cl2↑,故D错误;
故选C。
9.C
【分析】由图可知,甲为原电池,乙和丙为电解池;甲中通入一氧化氮的电极为负极,通入氧气的电极为正极;乙池中通入二氧化硫的电极连为电解池的阳极,水分子作用二氧化硫在阳极上失去电子发生氧化反应生成硫酸根离子和氢离子,通入一氧化氮的电极为阳极,酸性条件下一氧化氮在阴极上得到电子发生还原反应生成铵根离子和水;丙池中,左侧电极为电解池的阳极,水在阳极上失去电子发生氧化反应生成氧气和氢离子,氢离子从M室通过阳离子交换膜a膜进入浓缩室,右侧电极为阴极,镍离子在阴极得到电子发生还原反应生成镍, N室中氯离子通过阴离子交换膜b膜进入浓缩室,最终在浓缩室得到较浓的盐酸。
【详解】A.由分析可知,a膜为阳离子交换膜,故A错误;
B.由分析可知,乙池中通入一氧化氮的电极为阳极,酸性条件下一氧化氮在阴极上得到电子发生还原反应生成铵根离子和水,电极反应式为,故B错误;
C.当浓缩室得到4L0.6mol/L盐酸时,从M室通过阳离子交换膜a膜进入浓缩室的氢离子物质的量为(0.6mol/L—0.1mol/L)×4L=2mol/L,则M室消耗水的质量为2mol/L××18g/mol=18g,故C正确;
D.由得失电子数目守恒可知,标况下,若甲池有11.2L氧气参加反应时,乙池中处理废气的体积为(×2+×)×22.4L/mol=31.36L,故D错误;
故选C。
10.D
【详解】A.由图可知,Fe电极是正极,Zn电极是负极,属于牺牲阳极的阴极保护法,由于电解质溶液呈酸性,故正极上氢离子得电子,负极是Zn失去电子,反应为:Zn-2e-═Zn2+,A错误;
B.外加电流阴极保护法中要保护的电极应与外接电源的负极相连,即Fe电极与外接电源的负极相连,B错误;
C.由于Ⅰ中Fe电极与电解质溶液直接接触,会有少量的Fe直接与酸反应生成Fe2+,与K3[Fe(CN)6]在Ⅰ、Ⅱ中的氧化性无关,C错误;
D.对比Ⅰ、Ⅱ现象的差异可知,两种保护法均能保护Fe,且电解法保护的更好,即Ⅱ保护得更好,D正确;
故答案为:D。
11.D
【详解】A.是护目镜,进行化学实验时,需要佩戴护目镜,以保护眼睛,故A正确;
B.植物油和水不互溶,可以利用分液分离。故B正确;
C.光洁的无锈铁丝焰色无色,可以用于硫酸钠的焰色试验,故C正确;
D.将闸门与电源的负极相连,属于外加电源阴极保护法,故D错误;
故答案为D。
12.C
【分析】由图可知,甲池为甲醇燃料原电池,是化学能转化为电能的装置,电解液为 KOH,甲醇发生氧化反应生成碳酸根离子,为负极;氧气发生还原反应生成氢氧根离子,为正极,总反应为;则石墨电极为阳极、银电极为阴极;
【详解】A.由分析可知,甲池将化学能转化为电能,总反应为,A错误;
B.银电极为阴极,铜离子得到电子发生还原反应生成铜单质,B错误;
C.乙池阳极水放电发生氧化反应生成氧气,则乙池减少的为铜和氧元素,故反应一段时间后要使乙池恢复原状,可加入一定量CuO固体,C正确;
D.没有标况,不能计算反应的氧气的物质的量,不能计算乙池析出物质质量,D错误;
故选C。
13.D
【详解】A.已知2NO2(g)N2O4(g),故无法计算标准状况下,22.4L即=1molNO2所含质子数,A错误;
B.根据反应方程式:2Na2O2+2CO2=2Na2CO3+O2可知,1mol与足量反应时,转移电子数为,B错误;
C.已知稀盐酸与MnO2不反应,即50mL 12mol/L的盐酸与足量共热,其中0.05L×12mol/L=0.6mol HCl不可能完全反应,无法计算生成水分子的数目,C错误;
D.铅酸蓄电池正极反应式为:,故当正极质量增加3.2g时,电路中通过的电子数目为,D正确;
故答案为:D。
14.B
【分析】在Pt得电子发生还原反应,Pt为正极,Ag失去电子与溶液中的Cl-反应,Ag为负极。
【详解】A.由分析可知,Ag失去电子与溶液中的Cl-反应生成AgCl,Ag为负极,A错误;
B.电子由负极经活性炭流向正极,B正确;
C.溶液为酸性,故表面发生的电极反应为,C错误;
D.每消耗标准状况下的,转移电子2mol,而失去2mol电子,故最多去除,D错误。
故选B。
15.B
【分析】该储能电池放电时,Pb为负极,失电子结合硫酸根离子生成PbSO4,则多孔碳电极为正极,正极上Fe3+得电子转化为Fe2+,充电时,多孔碳电极为阳极,Fe2+失电子生成Fe3+,PbSO4电极为阴极,PbSO4得电子生成Pb和硫酸。
【详解】A.放电时负极上Pb失电子结合硫酸根离子生成PbSO4附着在负极上,负极质量增大,A错误;
B.储能过程中,该装置为电解池,将电能转化为化学能,B正确;
C.放电时,右侧为正极,电解质溶液中的阳离子向正极移动,左侧的H+通过质子交换膜移向右侧,C错误;
D.充电时,总反应为PbSO4+2Fe2+=Pb++2Fe3+,D错误;
故答案选B。
16.A
【分析】放电时负极反应:,正极反应:Cl2+2e-=2Cl-,消耗氯气,放电时,阴离子移向负极,充电时阳极:2Cl--2e-=Cl2,由此解析。
【详解】A. 放电时负极失电子,发生氧化反应,电极反应:,故A正确;
B. 放电时,阴离子移向负极,放电时透过多孔活性炭电极向NaCl中迁移,故B错误;
C. 放电时每转移电子,正极:Cl2+2e-=2Cl-,理论上释放,故C错误;
D. 充电过程中,阳极:2Cl--2e-=Cl2,消耗氯离子,溶液浓度减小,故D错误;
故选A。
17.C
【详解】A.由充电时电极a的反应可知,充电时电极a发生还原反应,所以电极a是阴极,则电极b是阳极,故A错误;
B.放电时电极反应和充电时相反,则由放电时电极a的反应为可知,NaCl溶液的pH不变,故B错误;
C.放电时负极反应为,正极反应为,反应后Na+和Cl-浓度都增大,则放电时NaCl溶液的浓度增大,故C正确;
D.充电时阳极反应为,阴极反应为,由得失电子守恒可知,每生成1molCl2,电极a质量理论上增加23g/mol2mol=46g,故D错误;
答案选C。
18.C
【详解】A. 如果玻璃薄膜球内电极的电势低,则该电极为负极、负极发生氧化反应而不是还原反应,A错误;
B.已知:pH与电池的电动势E存在关系:pH=(E-常数)/0.059,则玻璃膜内外氢离子浓度的差异会引起电动势的变化,B错误;
C.pH与电池的电动势E存在关系:pH=(E-常数)/0.059,则分别测定含已知pH的标准溶液和未知溶液的电池的电动势,可得出未知溶液的pH,C正确;
D. pH计工作时,利用原电池原理,则化学能转化为电能,D错误;
答案选C。
19.D
【分析】由图可知,放电时,硬碳电极为原电池的负极,NaxCn在负极失去电子发生氧化反应生成钠离子和碳,Na1-xMnO2电极为正极,钠离子作用下Na1-xMnO2在正极得到电子发生还原反应生成NaMnO2;充电时,与直流电源负极相连的硬碳电极为阴极,Na1-xMnO2电极为阳极。
【详解】A.由钠离子电池比锂离子电池更稳定,造价更低可知,与锂离子电池相比,钠离子电池比锂离子电池内阻大,短路时瞬间发热量小于锂离子电池,具有不易发热,具备更高安全性的优点,故A正确;
B.由分析可知,充电时,Na1-xMnO2电极为阳极,NaMnO2在阳极失去电子发生氧化反应生成Na1-xMnO2和钠离子,电极反应式为,故B正确;
C.由电池反应可知,放电时Na1-xMnO2电极为正极,钠离子作用下Na1-xMnO2在正极得到电子发生还原反应生成NaMnO2,放电过程中钠元素的化合价未发生改变,故C正确;
D.废旧钠离子电池里面有残余电量,为了防止拆卸电池中发生意外,废旧钠离子电池进行“放电处理”时,应将硬碳中的钠转化为钠离子,故D错误;
故选D。
20.D
【分析】根据图2,在Fe的催化作用下,NO得电子和H+逐步生成盐酸羟胺,X为H+,Y为NH3OH+,则在图1中,含铁的催化电极为正极,电极反应式为;Pt电极为负极,电极反应式为,由此作答。
【详解】A.由分析知含Fe的催化电极为正极,即电子从负极Pt电极流出,沿导线流入含Fe的催化电极,A错误;
B.结合分析知图2中,X为,Y为,B错误;
C.原电池工作时,正极生成NH3OH+,消耗H+,pH增大,C错误;
D.结合电极反应,消耗标况3.36LH2共转移0.3mol电子,则必有0.3mol由右室流向左室,同时由NO变成盐酸羟胺(),结合可知参加反应的NO为0.1mol,故左室增加的质量包括0.1mol NO和0.3mol,其质量总和为3.3g,D正确;
故选D。
21.A
【分析】如图所示,左侧装置为电源,右侧装置为电解池,阳极接正极,故b极为正极,a极为负极。阳极室被电解生成,向产品室移动;阴极室被电解生成,原料室的向阴极室移动,向产品室移动。以此答题。
【详解】A.a极是负极,电极反应式为CH4-8e-+4O2- = CO2+2H2O,A正确;
B.由分析知,A膜和C膜均为阳离子交换膜,B膜为阴离子交换膜,B错误;
C.如用铁电极替换阳极的石墨电极,即形成活性阳极,电解时,铁电极失去电子生成,影响Ca(H2PO4)2的制备,C错误;
D.没有指明温度与压强,2.24L甲烷的物质的量不能确定,D错误;
故选A。
22.D
【详解】A.由图可知,Fe电极是正极,Zn电极是负极,属于牺牲阳极的阴极保护法,由于电解质溶液呈酸性,故正极上氢离子得电子,则正极的反应为:2H++2e-═H2↑,A错误;
B.外加电流阴极保护法中要保护的电极应与外接电源的负极相连,即Fe电极与外接电源的负极相连,B错误;
C.由实验②现象可知,反应能否发生与K3[Fe(CN)6]在Ⅰ、Ⅱ中的氧化性无关,C错误;
D.对比Ⅰ、Ⅱ现象的差异可知,两种保护法均能保护Fe,且电解法保护的更好,即Ⅱ保护得更好,D正确;
故答案为:D。
23.BD
【分析】由于乙室中两个电极的电势差比甲室大,所以乙室是原电池,甲室是电解池,然后根据原电池、电解池反应原理分析解答。
【详解】A.电池工作时,甲室中细菌上乙酸盐的阴离子失去电子被氧化为CO2气体,同时生成H+,电极反应式为CH3COO--8 e-+2 H2O =2CO2↑+7 H+,H+通过阳膜进入阴极室,甲室的电极反应式为Co2++2e-=Co,因此,甲室溶液pH逐渐减小,A错误;
B.对于乙室,正极上LiCoO2得到电子,被还原为Co2+,同时得到Li+,其中的O2-与溶液中的H+结合H2O,电极反应式为2LiCoO2+2e-+8H+=2Li++2Co2++4H2O,负极发生的反应为CH3COO--8 e-+2 H2O =2CO2↑+7 H+,负极产生的H+通过阳膜进入正极室,但是乙室的H+浓度仍然是减小的,因此电池工作一段时间后应该补充盐酸,B正确;
C.电解质溶液为酸性,不可能大量存在OH-,乙室电极反应式为:LiCoO2+e-+4H+=Li++Co2++2H2O,C错误;
D.若甲室Co2+减少200 mg,则电子转移物质的量为n(e-)= ;若乙室Co2+增加300 mg,则转移电子的物质的量为n(e-)=,由于电子转移的物质的量不等,说明此时已进行过溶液转移,即将乙室部分溶液转移至甲室,D正确;
故合理选项是BD。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024年高考化学二轮复习回归基础专题11新型电化学装置分析训练
一、单选题,共22小题
1.(23-24高三上·河北张家口·阶段练习)化学电源在日常生活和高科技领域中都有广泛应用。下列说法正确的是
A.甲:对比普通锌锰干电池,碱性锌锰电池的比能量和可储存时间均有所提高
B.乙:负极的电极反应式为
C.丙:锌筒作负极,发生氧化反应,消耗时内电路中有电子转移
D.丁:电池放电过程中,负极质量逐渐变轻
2.(23-24高三上·四川成都·阶段练习)以柏林绿Fe[Fe(CN)6]为代表的新型可充电钠离子电池,其放电工作原理如图所示。下列说法不正确的是
A.放电时,Na+通过交换膜从右室移向左室
B.放电时,Mo箔上的电势比Mg箔上的高
C.充电时,Mg箔接电源的负极
D.充电时,阴极反应式为Fe[Fe(CN)6]+2Na++2e-= Na2Fe[Fe(CN)6]
3.(23-24高三上·河南周口·阶段练习)我国科学家发明了一种二次电池,装置如图所示,X、Z区域的电解质溶液不同,各为溶液和KOH溶液中的一种。已知放电、充电过程中,X、Y、Z区域始终均为单一电解质溶液。下列说法错误的是
A.充电时,阴极反应为
B.放电时,正极反应为
C.Z区域的电解质溶液为溶液,充电时Z区域溶液的pH减小
D.放电时Y区域溶液浓度减小,N膜为阴离子交换膜
4.(23-24高三上·浙江·阶段练习)一种三室微生物燃料电池的工作原理如图所示,该电池能同时去除有机物、脱氮形成无害气体和水。下列说法不正确的是
A.X、Y交换膜均为质子交换膜
B.电极室C中溶液经灭菌后通入电极室A
C.b电极反应式:
D.电极室C中仅发生还原反应
5.(23-24高三上·内蒙古呼和浩特·期末)浓差电池是电池内某一物质由高浓度变为低浓度且伴随着能量变化的一类电池,现有如图Ⅰ、Ⅱ所示装置,电极材料均为,该装置工作时,下列说法正确的是
A.电子流向:,
B.极和极的电极反应都是:
C.工作一段时间后,图Ⅱ装置中溶液浓度不变
D.若通过阴离子交换膜,理论上极减少
6.(23-24高三上·西藏林芝·期末)镍离子和钴离子性质相似,工业上可通过电化学装置将废水中的和分离,装置如图所示(已知:和乙酰丙酮不反应)。下列说法错误的是
A.膜a为阴离子交换膜,膜b为阳离子交换膜
B.通电过程中Ⅳ室内硫酸浓度逐渐增大
C.Ⅲ室中参与的反应为
D.通电过程中极每产生(标准状况)气体,双极膜内减少
7.(23-24高三上·河北石家庄·阶段练习)我国科学家研发了一种水系可逆Zn-CO2电池,将两组阴离子、阳离子复合膜反向放置分隔两室电解液,充电、放电时,复合膜层间的H2O解离成H+和OH—,工作原理如图所示,下列说法错误的是
A.放电时和充电时,Pd电极的电势均高于Zn电极
B.充电时,OH—由复合膜移向Zn电极
C.充电时,Pd电极上发生的电极反应式为HCOOH—2e—=CO2↑+2H+
D.放电时,若外电路中通过1mol电子,复合膜层间有1molH2O解离
8.(23-24高三上·江西宜春·阶段练习)某研究小组将两个甲烷燃料电池串联后作为电源,进行电解饱和食盐水,如图所示,有关说法正确的是
A.燃料电池工作时,通入甲烷电极的电极反应式为CH4+2H2O—8e—=CO2+8H+
B.闭合开关K后,b电极上有Cl2生成
C.若每个电池甲烷通入量为1L(标准状况),且反应完全,理论上最多能产生氯气的体积为4L(标准状况)
D.电解饱和食盐水总反应的离子方程式为Cl—+H2OOH—+H2↑+Cl2↑
9.(23-24高三上·贵州贵阳·阶段练习)空气质子交换膜燃料电池实现了制硝酸、发电、环保一体化。某兴趣小组用该电池模拟工业处理废气和废水的过程,装置如图所示,下列说法正确的是
A.a膜为阴离子交换膜
B.乙池中阴极的电极反应式为
C.当浓缩室得到的盐酸时,M室溶液的质量变化为(溶液体积变化忽略不计)
D.标况下,若甲池有参加反应,则乙池中处理废气(和)的总体积为
10.(23-24高三上·北京西城·期中)甲、乙同学分别用下图所示装置验证铁的电化学防腐原理。
相同时间后进行如下实验
实验①:甲同学分别向Ⅰ、Ⅱ中Fe电极附近滴加溶液,Ⅰ中产生蓝色沉淀,Ⅱ中无沉淀。
实验②:乙同学分别取Ⅰ、Ⅱ中Fe电极附近溶液,滴加溶液,Ⅰ、Ⅱ中均无沉淀。
下列说法正确的是
A.Ⅰ是牺牲阳极保护法,负极反应式为
B.Ⅱ为外加电流阴极保护法,Fe电极与外接电源的正极相连
C.由实验①中Ⅰ、Ⅱ现象的差异,推测在Ⅰ中氧化性强于Ⅱ
D.由实验可知,两种保护法均能保护Fe,且Ⅱ保护得更好
11.(23-24高三上·浙江·阶段练习)下列说法不正确的是
A.图①:进行化学实验时,需要佩戴护目镜,以保护眼睛
B.图②:可用于分离植物油和水的混合液
C.图③:可用于硫酸钠的焰色试验
D.图④:牺牲阳极法保护钢铁设备的示意图
12.(2023·广西南宁·模拟预测)如图是利用甲醇燃料电池进行电化学研究的装置图,下列说法正确的是
A.甲池将化学能转化为电能,总反应为2CH3OH+3O2=2CO2+4H2O
B.乙池中的Ag不断溶解
C.反应一段时间后要使乙池恢复原状,可加入一定量CuO固体
D.当甲池中有22.4LO2参与反应时,乙池中理论上可析出12.8g固体
13.(2023·湖北武汉·模拟预测)设是阿伏加德罗常数的值。下列说法中正确的是
A.标准状况下,22.4LNO2所含质子数为
B.1mol与足量反应时,转移电子数为
C.50mL 12mol/L的盐酸与足量共热,生成水分子的数目为
D.铅酸蓄电池的正极质量增加3.2g时,电路中通过的电子数目为
14.(2023·广东·高考真题)负载有和的活性炭,可选择性去除实现废酸的纯化,其工作原理如图。下列说法正确的是
A.作原电池正极
B.电子由经活性炭流向
C.表面发生的电极反应:
D.每消耗标准状况下的,最多去除
15.(2023·辽宁·高考真题)某低成本储能电池原理如下图所示。下列说法正确的是
A.放电时负极质量减小
B.储能过程中电能转变为化学能
C.放电时右侧通过质子交换膜移向左侧
D.充电总反应:
16.(2022高三·全国·专题练习)某储能电池原理如图。下列说法正确的是
A.放电时负极反应:
B.放电时透过多孔活性炭电极向中迁移
C.放电时每转移电子,理论上吸收
D.充电过程中,溶液浓度增大
17.(2022·广东·高考真题)科学家基于易溶于的性质,发展了一种无需离子交换膜的新型氯流电池,可作储能设备(如图)。充电时电极a的反应为: 。下列说法正确的是
A.充电时电极b是阴极
B.放电时溶液的减小
C.放电时溶液的浓度增大
D.每生成,电极a质量理论上增加
18.(2022·浙江·高考真题)pH计是一种采用原电池原理测量溶液pH的仪器。如图所示,以玻璃电极(在特制玻璃薄膜球内放置已知浓度的HCl溶液,并插入Ag—AgCl电极)和另一Ag—AgCl电极插入待测溶液中组成电池,pH与电池的电动势E存在关系:pH=(E-常数)/0.059。下列说法正确的是
A.如果玻璃薄膜球内电极的电势低,则该电极反应式为:AgCl(s)+e-=Ag(s)+Cl-(0.1mol·L-1)
B.玻璃膜内外氢离子浓度的差异不会引起电动势的变化
C.分别测定含已知pH的标准溶液和未知溶液的电池的电动势,可得出未知溶液的pH
D.pH计工作时,电能转化为化学能
19.(23-24高三上·黑龙江·期末)钠离子电池比锂离子电池更稳定,造价更低。一种钠离子电池构造示意图如下,已知电池反应:放电,下列说法错误的是
A.钠离子电池比锂离子电池内阻大,短路时不易发热,具备更高安全性
B.充电时,阳极的电极反应式为
C.放电时,正极钠的化合价未发生改变
D.废旧钠离子电池进行“放电处理”让进入硬碳中而有利于回收
20.(23-24高三上·辽宁锦州·期末)盐酸羟胺()是一种常见的还原剂和显像剂,其化学性质类似。工业上采用图1装置进行制备,其电池装置中含Fe的催化电极反应机理如图2所示。不考虑溶液体积的变化,下列说法正确的是
A.电子从含Fe的催化电极流出沿导线流入Pt电极
B.图2中,X为和,Y为
C.电池工作一段时间后,正极区溶液的pH减小
D.理论上,当有标准状况下参与反应时,左室溶液质量增加3.3g
21.(23-24高二上·福建南平·期中)利用CH4燃料电池电解制备Ca(H2PO4)2并得到副产物NaOH、H2、Cl2,装置如图所示。下列说法正确的是
A.a极反应:CH4-8e-+4O2- = CO2+2H2O
B.A膜和C膜均为阴离子交换膜,B膜为阳离子交换膜
C.可用铁电极替换阳极的石墨电极
D.a极上通入2.24L甲烷,理论上产品室可新增0.4mol Ca(H2PO4)2
22.(2023·北京海淀·二模)甲、乙同学分别用如图所示装置验证铁的电化学防腐原理,相同时间后继续进行实验。
实验①:甲同学分别向Ⅰ、Ⅱ中Fe电极附近滴加K3[Fe(CN)6]溶液,Ⅰ中产生蓝色沉淀,Ⅱ中无沉淀。
实验②:乙同学分别取Ⅰ、Ⅱ中Fe电极附近溶液,滴加K3[Fe(CN)6]溶液,Ⅰ、Ⅱ中均无沉淀。
下列说法正确的是
A.Ⅰ是牺牲阳极保护法,正极反应式为
B.Ⅱ为外加电流阴极保护法,Fe电极与外接电源的正极相连
C.由实验①中Ⅰ、Ⅱ现象的差异,推测K3[Fe(CN)6]在Ⅰ中氧化性强于Ⅱ
D.由实验可知,两种保护法均能保护,且Ⅱ保护得更好
二、多选题,共1小题
23.(2022·山东·高考真题)设计如图装置回收金属钴。保持细菌所在环境pH稳定,借助其降解乙酸盐生成,将废旧锂离子电池的正极材料转化为,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法正确的是
A.装置工作时,甲室溶液pH逐渐增大
B.装置工作一段时间后,乙室应补充盐酸
C.乙室电极反应式为
D.若甲室减少,乙室增加,则此时已进行过溶液转移
参考答案:
1.A
【详解】A.对比普通锌锰干电池,碱性锌锰电池的比能量和可储存时间均有所提高,A正确;
B.乙装置中,为负极,B错误;
C.丙中锌较活泼,故锌为负极,锌失去电子发生氧化反应,锌筒会变薄,但是电子不会进入内电路,C错误;
D.电池放电过程中,铅和二氧化铅都反应生成硫酸铅,负极铅转化为硫酸铅,质量增加,D错误。
故选A。
2.D
【分析】根据图示,放电过程中,Mg变成[Mg2Cl2]2+,Mg被氧化,所以Mg箔为负极,Mo箔为正极;则充电时,Mg箔上发生还原反应,为阴极,Mo箔为阳极,由此分析解答。
【详解】C.放电时为原电池,Na+通过交换膜从右室(负极)移向左室(正极),故A正确;
B.放电时,Mg箔为负极,Mo箔为正极,Mo箔上的电势比Mg箔上的高,故B正确;
C.充电时为电解池,Mg箔为电解池阴极,与电源的负极相连,故C正确;
D.放电时为原电池,Mg箔为负极,发生氧化反应,电极反应式为2Mg+2Cl 4e =[Mg2Cl2]2+,则充电时Mg箔为阴极,发生得电子的还原反应,阴极反应式为[Mg2Cl2]2++4e =2Mg+4Cl ,故D错误;
故答案选D。
3.D
【分析】Zn为活泼金属,根据原电池工作原理,放电时Zn为负极,电极反应式为Zn-2e-+4OH-=,PbO2为正极,电极反应式为。
【详解】A.根据图示,放电时Zn变为,发生氧化反应,Zn电极为负极,则充电时Zn电极为阴极,阴极的电极反应为,A不符合题意;
B.放电时电极为正极,正极反应为,B不符合题意;
C.放电时,电极反应消耗,则Z区域的电解质溶液为溶液,充电时电极反应为,溶液中增大,故充电时Z区域溶液的pH减小,C不符合题意;
D.放电时,Zn电极反应为,电极反应为,为平衡X、Z区域的溶液电荷,同时保证X、Y、Z区域均为单一电解质溶液,则通过N膜移向Y区域,N膜为阴离子交换膜,通过M膜移向Y区域,M膜为阳离子交换膜,故放电时Y区域溶液浓度增大,D符合题意;
故选D。
4.D
【分析】根据图中电子的流向和电极上的变化可判断电极b电极上发生的反应为:,电极a上的反应为,而电池c上有两个变化过程分别为:,。
【详解】A.结合电极反应可判断X、Y交换膜均为质子交换膜,故A正确;
B.结合分析可知电极室C中溶液经灭菌后通入电极室A,故B正确;
C.b电极反应式:,故C正确;
D.结合电极上的变化,可知电极室C中既发生还原反应又发生了氧化反应,故D错误;
故选D。
5.C
【分析】由于浓差电池是物质从高浓度状态向低浓度状态转移而获得电动势,则根据溶液浓度可知从左侧经阴离子交换膜进入右侧,则Cu(1)是正极,铜离子得到电子发生还原反应生成铜单质,Cu(2)是负极,铜失去电子发生氧化反应生成铜离子,则Cu(3)为阴极、Cu(4)为阳极;
【详解】A.电子由负极流向阴极、由阳极流向正极,结合分析可知,电子流向为Cu(2)→Cu(3),Cu(4)→Cu(1),A错误;
B.极为负极,反应为:;极为阴极,反应为铜离子得到电子发生还原反应生成铜:,B错误;
C.Cu(3)为阴极,铜离子得到生成铜;Cu(4)为阳极,铜失去电子生成铜离子;工作一段时间后,图Ⅱ装置中溶液浓度不变,C正确;
D.0.5mol发生迁移,则转移电子的物质的量为1mol,根据电极反应Cu-2e-=Cu2+可知Cu(4)极0.5molCu反应,质量减少32g,D错误;
故选C。
6.B
【分析】该电化学装置是电解池,根据溶液中离子移动方向OH-移向阳极,左侧石墨为阳极,右侧石墨为阴极,Ⅱ室为原料室,膜b通过Ni2+和Co2+,为阳离子交换膜,膜a通过阴离子,为阴离子交换膜。
【详解】A. 、进入Ⅲ室,和乙酰丙酮不反应,和乙酰丙酮反应。膜a为阴离子交换膜,膜b为阳离子交换膜,A正确;
B.阴极的电极反应为,Ⅳ室内消耗的的物质的量与进入Ⅳ室的的物质的量相等,所以硫酸浓度不变,B错误;
C.由题中信息可知,Ⅲ室中参与的反应为,C正确;
D.通电过程中极每产生(标准状况)气体,即,则双极膜内有进入Ⅳ室,有进入Ⅲ室,故双极膜内减少,即减少,D正确;
答案选B。
7.B
【分析】由图可知,放电时锌电极为原电池的负极,复合膜层间水解离出的氢氧根离子移向负极,碱性条件下锌在负极失去电子发生氧化反应生成四羟基合锌离子,电极反应式为Zn+4OH——2e—=Zn(OH),钯电极为正极,复合膜层间水解离出的氢离子移向正极,酸性条件下二氧化碳在正极得到电子发生还原反应生成甲酸,电极反应式为CO2↑+2H++2e—=HCOOH,则电池的总反应为Zn+2OH—+2H2O+CO2= Zn(OH)+ HCOOH;充电时,与直流电源负极相连的锌电极为电解池的阴极,复合膜层间水解离出的氢离子移向阴极,钯电极为阳极,复合膜层间水解离出的氢氧根离子移向阳极。
【详解】A.由分析可知,放电时锌电极为原电池的负极,钯电极为正极,则钯电极的电势高于锌电极;充电时,与直流电源负极相连的锌电极为电解池的阴极,钯电极为阳极,则钯电极的电势高于锌电极,故A正确;
B.由分析可知,充电时,与直流电源负极相连的锌电极为电解池的阴极,钯电极为阳极,复合膜层间水解离出的氢氧根离子移向阳极,故B错误;
C.由分析可知,充电时,钯电极为阳极,甲酸在阳极失去电子发生氧化反应生成二氧化碳和氢离子,电极反应式为HCOOH—2e—=CO2↑+2H+,故C正确;
D.由分析可知,电池的总反应为Zn+2OH—+2H2O+CO2= Zn(OH)+ HCOOH,反应消耗2mol氢氧根离子时,反应转移3mol电子,则放电时,若外电路中通过1mol电子,复合膜层间有1mol水解离出1mol氢氧根离子,故D正确;
故选B。
8.C
【分析】由图可知,左侧两个装置为甲烷燃料电池,通入甲烷的铂电极为负极,碱性条件下甲烷在负极失去电子发生氧化反应生成碳酸根离子和水,通入氧气的铂电极为正极,水分子作用下氧气在正极得到电子发生还原反应生成氢氧根离子;右侧装置为电解饱和食盐水的电解池,与正极相连的a电极为电解池的阳极,氯离子在阳极失去电子发生氧化反应生成氯气,b电极为阴极,水分子在阴极得到电子发生还原反应生成氢气和氢氧根离子。
【详解】A.由分析可知,通入甲烷的铂电极为负极,碱性条件下甲烷在负极失去电子发生氧化反应生成碳酸根离子和水,电极反应式为CH4+10OH——8e—=CO+7H2O,故A错误;
B.由分析可知,闭合开关K后,与正极相连的a电极为电解池的阳极,氯离子在阳极失去电子发生氧化反应生成氯气,故B错误;
C.设标准状况下生成氯气的体积物VL,由得失电子数目守恒可得:×8=×2,解得V=4,故C正确;
D.由分析可知,右侧装置为电解饱和食盐水的电解池,与正极相连的a电极为电解池的阳极,氯离子在阳极失去电子发生氧化反应生成氯气,b电极为阴极,水分子在阴极得到电子发生还原反应生成氢气和氢氧根离子,则电解饱和食盐水总反应的离子方程式为2Cl—+2H2O2OH—+H2↑+Cl2↑,故D错误;
故选C。
9.C
【分析】由图可知,甲为原电池,乙和丙为电解池;甲中通入一氧化氮的电极为负极,通入氧气的电极为正极;乙池中通入二氧化硫的电极连为电解池的阳极,水分子作用二氧化硫在阳极上失去电子发生氧化反应生成硫酸根离子和氢离子,通入一氧化氮的电极为阳极,酸性条件下一氧化氮在阴极上得到电子发生还原反应生成铵根离子和水;丙池中,左侧电极为电解池的阳极,水在阳极上失去电子发生氧化反应生成氧气和氢离子,氢离子从M室通过阳离子交换膜a膜进入浓缩室,右侧电极为阴极,镍离子在阴极得到电子发生还原反应生成镍, N室中氯离子通过阴离子交换膜b膜进入浓缩室,最终在浓缩室得到较浓的盐酸。
【详解】A.由分析可知,a膜为阳离子交换膜,故A错误;
B.由分析可知,乙池中通入一氧化氮的电极为阳极,酸性条件下一氧化氮在阴极上得到电子发生还原反应生成铵根离子和水,电极反应式为,故B错误;
C.当浓缩室得到4L0.6mol/L盐酸时,从M室通过阳离子交换膜a膜进入浓缩室的氢离子物质的量为(0.6mol/L—0.1mol/L)×4L=2mol/L,则M室消耗水的质量为2mol/L××18g/mol=18g,故C正确;
D.由得失电子数目守恒可知,标况下,若甲池有11.2L氧气参加反应时,乙池中处理废气的体积为(×2+×)×22.4L/mol=31.36L,故D错误;
故选C。
10.D
【详解】A.由图可知,Fe电极是正极,Zn电极是负极,属于牺牲阳极的阴极保护法,由于电解质溶液呈酸性,故正极上氢离子得电子,负极是Zn失去电子,反应为:Zn-2e-═Zn2+,A错误;
B.外加电流阴极保护法中要保护的电极应与外接电源的负极相连,即Fe电极与外接电源的负极相连,B错误;
C.由于Ⅰ中Fe电极与电解质溶液直接接触,会有少量的Fe直接与酸反应生成Fe2+,与K3[Fe(CN)6]在Ⅰ、Ⅱ中的氧化性无关,C错误;
D.对比Ⅰ、Ⅱ现象的差异可知,两种保护法均能保护Fe,且电解法保护的更好,即Ⅱ保护得更好,D正确;
故答案为:D。
11.D
【详解】A.是护目镜,进行化学实验时,需要佩戴护目镜,以保护眼睛,故A正确;
B.植物油和水不互溶,可以利用分液分离。故B正确;
C.光洁的无锈铁丝焰色无色,可以用于硫酸钠的焰色试验,故C正确;
D.将闸门与电源的负极相连,属于外加电源阴极保护法,故D错误;
故答案为D。
12.C
【分析】由图可知,甲池为甲醇燃料原电池,是化学能转化为电能的装置,电解液为 KOH,甲醇发生氧化反应生成碳酸根离子,为负极;氧气发生还原反应生成氢氧根离子,为正极,总反应为;则石墨电极为阳极、银电极为阴极;
【详解】A.由分析可知,甲池将化学能转化为电能,总反应为,A错误;
B.银电极为阴极,铜离子得到电子发生还原反应生成铜单质,B错误;
C.乙池阳极水放电发生氧化反应生成氧气,则乙池减少的为铜和氧元素,故反应一段时间后要使乙池恢复原状,可加入一定量CuO固体,C正确;
D.没有标况,不能计算反应的氧气的物质的量,不能计算乙池析出物质质量,D错误;
故选C。
13.D
【详解】A.已知2NO2(g)N2O4(g),故无法计算标准状况下,22.4L即=1molNO2所含质子数,A错误;
B.根据反应方程式:2Na2O2+2CO2=2Na2CO3+O2可知,1mol与足量反应时,转移电子数为,B错误;
C.已知稀盐酸与MnO2不反应,即50mL 12mol/L的盐酸与足量共热,其中0.05L×12mol/L=0.6mol HCl不可能完全反应,无法计算生成水分子的数目,C错误;
D.铅酸蓄电池正极反应式为:,故当正极质量增加3.2g时,电路中通过的电子数目为,D正确;
故答案为:D。
14.B
【分析】在Pt得电子发生还原反应,Pt为正极,Ag失去电子与溶液中的Cl-反应,Ag为负极。
【详解】A.由分析可知,Ag失去电子与溶液中的Cl-反应生成AgCl,Ag为负极,A错误;
B.电子由负极经活性炭流向正极,B正确;
C.溶液为酸性,故表面发生的电极反应为,C错误;
D.每消耗标准状况下的,转移电子2mol,而失去2mol电子,故最多去除,D错误。
故选B。
15.B
【分析】该储能电池放电时,Pb为负极,失电子结合硫酸根离子生成PbSO4,则多孔碳电极为正极,正极上Fe3+得电子转化为Fe2+,充电时,多孔碳电极为阳极,Fe2+失电子生成Fe3+,PbSO4电极为阴极,PbSO4得电子生成Pb和硫酸。
【详解】A.放电时负极上Pb失电子结合硫酸根离子生成PbSO4附着在负极上,负极质量增大,A错误;
B.储能过程中,该装置为电解池,将电能转化为化学能,B正确;
C.放电时,右侧为正极,电解质溶液中的阳离子向正极移动,左侧的H+通过质子交换膜移向右侧,C错误;
D.充电时,总反应为PbSO4+2Fe2+=Pb++2Fe3+,D错误;
故答案选B。
16.A
【分析】放电时负极反应:,正极反应:Cl2+2e-=2Cl-,消耗氯气,放电时,阴离子移向负极,充电时阳极:2Cl--2e-=Cl2,由此解析。
【详解】A. 放电时负极失电子,发生氧化反应,电极反应:,故A正确;
B. 放电时,阴离子移向负极,放电时透过多孔活性炭电极向NaCl中迁移,故B错误;
C. 放电时每转移电子,正极:Cl2+2e-=2Cl-,理论上释放,故C错误;
D. 充电过程中,阳极:2Cl--2e-=Cl2,消耗氯离子,溶液浓度减小,故D错误;
故选A。
17.C
【详解】A.由充电时电极a的反应可知,充电时电极a发生还原反应,所以电极a是阴极,则电极b是阳极,故A错误;
B.放电时电极反应和充电时相反,则由放电时电极a的反应为可知,NaCl溶液的pH不变,故B错误;
C.放电时负极反应为,正极反应为,反应后Na+和Cl-浓度都增大,则放电时NaCl溶液的浓度增大,故C正确;
D.充电时阳极反应为,阴极反应为,由得失电子守恒可知,每生成1molCl2,电极a质量理论上增加23g/mol2mol=46g,故D错误;
答案选C。
18.C
【详解】A. 如果玻璃薄膜球内电极的电势低,则该电极为负极、负极发生氧化反应而不是还原反应,A错误;
B.已知:pH与电池的电动势E存在关系:pH=(E-常数)/0.059,则玻璃膜内外氢离子浓度的差异会引起电动势的变化,B错误;
C.pH与电池的电动势E存在关系:pH=(E-常数)/0.059,则分别测定含已知pH的标准溶液和未知溶液的电池的电动势,可得出未知溶液的pH,C正确;
D. pH计工作时,利用原电池原理,则化学能转化为电能,D错误;
答案选C。
19.D
【分析】由图可知,放电时,硬碳电极为原电池的负极,NaxCn在负极失去电子发生氧化反应生成钠离子和碳,Na1-xMnO2电极为正极,钠离子作用下Na1-xMnO2在正极得到电子发生还原反应生成NaMnO2;充电时,与直流电源负极相连的硬碳电极为阴极,Na1-xMnO2电极为阳极。
【详解】A.由钠离子电池比锂离子电池更稳定,造价更低可知,与锂离子电池相比,钠离子电池比锂离子电池内阻大,短路时瞬间发热量小于锂离子电池,具有不易发热,具备更高安全性的优点,故A正确;
B.由分析可知,充电时,Na1-xMnO2电极为阳极,NaMnO2在阳极失去电子发生氧化反应生成Na1-xMnO2和钠离子,电极反应式为,故B正确;
C.由电池反应可知,放电时Na1-xMnO2电极为正极,钠离子作用下Na1-xMnO2在正极得到电子发生还原反应生成NaMnO2,放电过程中钠元素的化合价未发生改变,故C正确;
D.废旧钠离子电池里面有残余电量,为了防止拆卸电池中发生意外,废旧钠离子电池进行“放电处理”时,应将硬碳中的钠转化为钠离子,故D错误;
故选D。
20.D
【分析】根据图2,在Fe的催化作用下,NO得电子和H+逐步生成盐酸羟胺,X为H+,Y为NH3OH+,则在图1中,含铁的催化电极为正极,电极反应式为;Pt电极为负极,电极反应式为,由此作答。
【详解】A.由分析知含Fe的催化电极为正极,即电子从负极Pt电极流出,沿导线流入含Fe的催化电极,A错误;
B.结合分析知图2中,X为,Y为,B错误;
C.原电池工作时,正极生成NH3OH+,消耗H+,pH增大,C错误;
D.结合电极反应,消耗标况3.36LH2共转移0.3mol电子,则必有0.3mol由右室流向左室,同时由NO变成盐酸羟胺(),结合可知参加反应的NO为0.1mol,故左室增加的质量包括0.1mol NO和0.3mol,其质量总和为3.3g,D正确;
故选D。
21.A
【分析】如图所示,左侧装置为电源,右侧装置为电解池,阳极接正极,故b极为正极,a极为负极。阳极室被电解生成,向产品室移动;阴极室被电解生成,原料室的向阴极室移动,向产品室移动。以此答题。
【详解】A.a极是负极,电极反应式为CH4-8e-+4O2- = CO2+2H2O,A正确;
B.由分析知,A膜和C膜均为阳离子交换膜,B膜为阴离子交换膜,B错误;
C.如用铁电极替换阳极的石墨电极,即形成活性阳极,电解时,铁电极失去电子生成,影响Ca(H2PO4)2的制备,C错误;
D.没有指明温度与压强,2.24L甲烷的物质的量不能确定,D错误;
故选A。
22.D
【详解】A.由图可知,Fe电极是正极,Zn电极是负极,属于牺牲阳极的阴极保护法,由于电解质溶液呈酸性,故正极上氢离子得电子,则正极的反应为:2H++2e-═H2↑,A错误;
B.外加电流阴极保护法中要保护的电极应与外接电源的负极相连,即Fe电极与外接电源的负极相连,B错误;
C.由实验②现象可知,反应能否发生与K3[Fe(CN)6]在Ⅰ、Ⅱ中的氧化性无关,C错误;
D.对比Ⅰ、Ⅱ现象的差异可知,两种保护法均能保护Fe,且电解法保护的更好,即Ⅱ保护得更好,D正确;
故答案为:D。
23.BD
【分析】由于乙室中两个电极的电势差比甲室大,所以乙室是原电池,甲室是电解池,然后根据原电池、电解池反应原理分析解答。
【详解】A.电池工作时,甲室中细菌上乙酸盐的阴离子失去电子被氧化为CO2气体,同时生成H+,电极反应式为CH3COO--8 e-+2 H2O =2CO2↑+7 H+,H+通过阳膜进入阴极室,甲室的电极反应式为Co2++2e-=Co,因此,甲室溶液pH逐渐减小,A错误;
B.对于乙室,正极上LiCoO2得到电子,被还原为Co2+,同时得到Li+,其中的O2-与溶液中的H+结合H2O,电极反应式为2LiCoO2+2e-+8H+=2Li++2Co2++4H2O,负极发生的反应为CH3COO--8 e-+2 H2O =2CO2↑+7 H+,负极产生的H+通过阳膜进入正极室,但是乙室的H+浓度仍然是减小的,因此电池工作一段时间后应该补充盐酸,B正确;
C.电解质溶液为酸性,不可能大量存在OH-,乙室电极反应式为:LiCoO2+e-+4H+=Li++Co2++2H2O,C错误;
D.若甲室Co2+减少200 mg,则电子转移物质的量为n(e-)= ;若乙室Co2+增加300 mg,则转移电子的物质的量为n(e-)=,由于电子转移的物质的量不等,说明此时已进行过溶液转移,即将乙室部分溶液转移至甲室,D正确;
故合理选项是BD。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
