北京市第四十三中学2023-2024学年高二下学期期中考试化学试题(PDF版含答案、答题卡)
文档属性
| 名称 | 北京市第四十三中学2023-2024学年高二下学期期中考试化学试题(PDF版含答案、答题卡) |  | |
| 格式 | |||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-14 08:22:25 | ||
图片预览


文档简介
班级:___________ 姓名:__________ 教育 ID:__________
6.某烃与氢气发生反应后能生成 ,则该烃不可能是
北京市第四十三中学 2023-2024 ...学年度第二学期期中考试
A. B.
高二年级化学 试卷 (时间:90分钟)
1. 本试卷共 4页,二道大题,20道小题。满分 100分。考试时间 90分钟。 C. D.
考 2. 在试卷和答题卡上准确填写班级、姓名和学号。
生 3. 试题答案一律填写在答题卡上,在试卷上作答无效。 7.有机化合物 X( )是合成维生素 B6的中间体。下列关于 X的
须 4. 在答题卡上,选择题须用 2B铅笔将选中项涂黑涂满,其他试题用黑色字迹签字笔作答。 说法不.正.确.的是知 5. 考试结束时,将答题卡按考场座位顺序上交。
A.分子式为 C4H8O2 B.可发生加成、取代、加聚、氧化反应
可能用到的相对原子质量:H 1 C 12 O 16 F 19 Ca 40 As 75 In 115 C.能使溴的四氯化碳溶液褪色 D.与 HOCH2CH2OH互为同系物
一、单项选择题(下列每小题的四个选项中只有一个选项符合题意。共 42 分,每小题 3 分) 8.维生素 C的结构如右图所示。下列说法不.正.确.的是
1.下列有机物存在顺反异构的是 A.分子式是 C6H8O6
A.1-丁烯 B.2-丁烯 B.分子中含有多个羟基,其水溶性较好
C.2-甲基-2-丁烯 D.2,3-二甲基-2-丁烯 C.能使酸性高锰酸钾溶液、溴的四氯化碳溶液褪色
2.下列说法中,正确的是 D.分子中含有碳碳双键、羟基、醚键 3种官能团
9.图为实验室制取乙炔并验证其性质的装置图。下列说法不.合.理.的是
A. 和 互为同系物
A.逐滴加入饱和食盐水可控制生成乙炔的速率
B. 乙醇和乙醚互为同分异构体
B. KMnO4酸性溶液褪色,说明乙炔有还原性
C. 可用溴水来区分乙烷和乙烯
C.用溴水验证乙炔的性质,不需要除杂
D. 甲醇、乙二醇、丙三醇互为同系物
D.将纯净的乙炔点燃,有浓烈的黑烟,说明乙炔
3.某烷烃的结构简式为 ,其系统命名正确的是
不饱和程度高
10. 乙酰苯胺是一种具有解热镇痛作用的白色晶体,20 ℃时在乙醇中的溶解度为 36.9 g,在水
A.3,3,4-三甲基戊烷 B.2,3,3-三甲基戊烷
中的溶解度如下表:
C.2,3-二甲基-2-乙基丁烷 D.2,3-二甲基-3-乙基丁烷
温度/℃ 25 50 80 100
4.下列有机化合物分子中,所有原子不.可.能.位于同一平面的是
溶解度/g 0.56 0.84 3.5 5.5
A.乙烯 B.乙炔 C. 甲苯 D.苯
已知:氯化钠可分散在乙醇中形成胶体。某种乙酰苯胺样品中混入了少量氯化钠杂质,下列
5.下列化学用语或模型不.正.确.的是
提纯乙酰苯胺的方法正确的是
A.苯的实验式:CH B.乙烯的结构简式:CH2CH2
A.用水溶解后分液 B.用乙醇溶解后过滤
C.乙炔的球棍模型: D.甲基的电子式:
第 1 页 共 6 页
{#{QQABSYCEogAAAJJAABgCQwlgCkMQkBGCAKoGwAAIsAAASQFABAA=}#}
班级:___________ 姓名:__________ 教育 ID:__________
C.用水做溶剂进行重结晶 D.用乙醇做溶剂进行重结晶 A.[Co(H2O)6]2+和[CoCl4]2-的 Co2+配位数之比为 2︰3
11. 下列各物质的晶体中,晶体类型相同的是 B.由实验①可知平衡逆向移动
A.SO2和 H2O B.HCl和 NaCl C.CO2和 SiO2 D.Cu 和 Ne C.由实验②可推知△H < 0
12.已知 H2O2分子的空间结构可在二面角中表示(如下图所示),则有关 H2O2结构的说法不. D.由实验③可知配离子的稳定性:[ZnCl4]2-< [CoCl4]2-
正.确.的是
A.H O 二、填空题(共 58分)2 2是非极性分子,难溶于水
B.分子中含有极性键和非极性键 15.(12分)CO2的资源化利用是解决温室效应的重要途径。科学家致力于 CO2与H2反应制 CH3OH
C.O采用 sp3杂化 的研究。
D.H—O与 O—O形成的键角小于 109°28
(1)CO2分子中碳原子的杂化轨道类型为______;干冰是很好的致冷剂,干冰升华时,CO2需
13.碱金属氯化物是典型的离子化合物,NaCl和 CsCl的晶胞结构如下图所示。其中的碱金属 要克服的作用力是______。
离子能够与冠醚形成超分子。 (2)CH3OH所含有的三种元素电负性从大到小的顺序为______(用元素符号表示)。
(3)CH3OH的沸点比 CO2高,主要原因是______。
(4)CH3OH被氧化为 HCHO,HCHO继续被氧化可生成 HCOOH。HCHO分子的空间结构为
______,HCOOH 分子内σ键与π键个数之比为______。
NaCl晶胞 CsCl晶胞 Na+与冠醚形成的超分子 16.(11分)砷化铟(InAs)是一种优良的半导体化合物,有广泛用途。
下列说法不正确的是 (1)基态 In的价层电子排布式为 5s25p1,In在周期表中的位置是______。...
A NaCl a Na+ (2)在 Ar保护下分别将 InCl3和 AsCl3在气化室中加热转化为蒸气,在反应室中混合反应,即. 晶胞中 为
可得到橘黄色的 InAs晶体。已知:AsCl3和 InCl3均为分子晶体;AsCl3气化室的温度为 130 ℃,
B.CsCl晶体中 Cs+周围紧邻 8个 Cl-
InCl3气化室的温度为 500℃。
C.碱金属离子与冠醚通过离子键形成超分子
① AsCl3分子的空间结构为______,中心原子 As的杂化轨道类型为______。
D.不同空穴尺寸的冠醚可以对不同碱金属离子进行识别
② AsCl3气化室温度低于 InCl3气化室温度的原因是______。
14.将 CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
③ InCl3晶体中分子间存在配位键,配位原子是______。
[Co(H2O)6]2+ + 4Cl- [CoCl4]2- + 6H2O △H。用该溶液做实验,溶液的颜色变化如下:
(3)InAs为原子之间以共价键的成键方式结合而成的晶体。其晶胞结构如下图所示。
① 一个晶胞中所含 As的个数为______。
② 已知该晶胞棱长为 a pm(1 pm=1×10-10 cm),阿伏加德罗常数
为 NA, InAs 的摩尔质量为 M g·mol-1,则该晶体的密度ρ
已知:[Co(H2O)6]2+ 粉红色 [CoCl4]2- 蓝色 [ZnCl4]2- 无色
=_____g·cm-3。
下列结论和解释正确的是
第 2 页 共 6 页
{#{QQABSYCEogAAAJJAABgCQwlgCkMQkBGCAKoGwAAIsAAASQFABAA=}#}
班级:___________ 姓名:__________ 教育 ID:__________
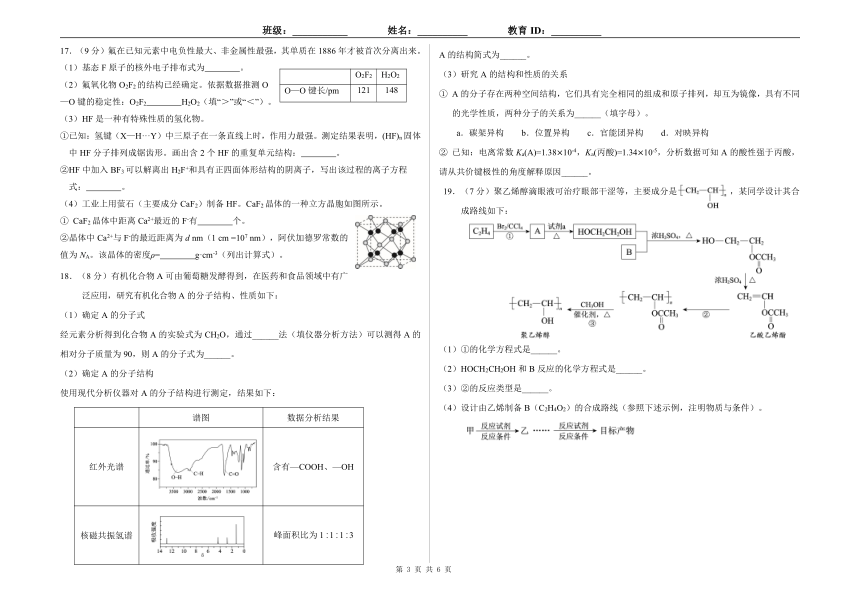
17.(9分)氟在已知元素中电负性最大、非金属性最强,其单质在 1886年才被首次分离出来。 A的结构简式为______。
(1)基态 F原子的核外电子排布式为 。
O2F2 H2O2 (3)研究 A的结构和性质的关系
(2)氟氧化物 O2F2的结构已经确定。依据数据推测 O O—O键长/pm 121 148 ① A的分子存在两种空间结构,它们具有完全相同的组成和原子排列,却互为镜像,具有不同
—O键的稳定性:O2F2 H2O2(填“>”或“<”)。
3 HF 的光学性质,两种分子的关系为______(填字母)。( ) 是一种有特殊性质的氢化物。
①已知:氢键(X—H···Y)中三原子在一条直线上时,作用力最强。测定结果表明,(HF)n固体 a.碳架异构 b.位置异构 c.官能团异构 d.对映异构
中 HF分子排列成锯齿形。画出含 2个 HF的重复单元结构: 。 ② 已知:电离常数 Ka(A)=1.38×10-4,Ka(丙酸)=1.34×10-5,分析数据可知 A的酸性强于丙酸,
②HF中加入 BF3可以解离出 H2F+和具有正四面体形结构的阴离子,写出该过程的离子方程 请从共价键极性的角度解释原因______。
式: 。 19.(7分)聚乙烯醇滴眼液可治疗眼部干涩等,主要成分是 ,某同学设计其合
(4)工业上用萤石(主要成分 CaF2)制备 HF。CaF2晶体的一种立方晶胞如图所示。
成路线如下:
① CaF2晶体中距离 Ca2+最近的 F-有 个。
②晶体中 Ca2+与 F-的最近距离为 d nm(1 cm =107 nm),阿伏加德罗常数的
值为 NA。该晶体的密度ρ= g·cm-3(列出计算式)。
18.(8 分)有机化合物 A可由葡萄糖发酵得到,在医药和食品领域中有广
泛应用,研究有机化合物 A的分子结构、性质如下:
(1)确定 A的分子式
经元素分析得到化合物 A的实验式为 CH2O,通过______法(填仪器分析方法)可以测得 A的
90 A ______ (1)①的化学方程式是______。相对分子质量为 ,则 的分子式为 。
2 A (2)HOCH2CH( )确定 的分子结构 2OH和 B反应的化学方程式是______。
A (3)②的反应类型是______。使用现代分析仪器对 的分子结构进行测定,结果如下:
(4)设计由乙烯制备 B(C2H4O2)的合成路线(参照下述示例,注明物质与条件)。
谱图 数据分析结果
红外光谱 含有—COOH、—OH
核磁共振氢谱 峰面积比为 1︰1︰1︰3
第 3 页 共 6 页
{#{QQABSYCEogAAAJJAABgCQwlgCkMQkBGCAKoGwAAIsAAASQFABAA=}#}
班级:___________ 姓名:__________ 教育 ID:__________
20.(11分)喹啉( )及其衍生物是合成药物的重要原料。化合物 G是一种取代
喹啉醇,合成路线如下:
已知:
(1)试剂 a是______。
(2)A→B的反应类型是______。
(3)C+Y→D的化学方程式是______。
(4)苯可以由三分子乙炔在一定条件下合成得到,而乙炔还可以合成聚氯乙烯等,其制备过程
如下:
写出 A、B和 C的结构简式:A____________;B______________;C______________。
写出反应③的反应类型为___________。
写出反应①和反应⑦的化学方程式
___________________________________,__________________________________。
第 4 页 共 6 页
{#{QQABSYCEogAAAJJAABgCQwlgCkMQkBGCAKoGwAAIsAAASQFABAA=}#}
班级:___________ 姓名:__________ 教育 ID:__________
北京市第四十三中学 2023—2024 学年度第二学期期中试卷
② (1分)
高二年级化学 答案及评分参考 2024.4
18. (8分)
一、单项选择题(每题 3分,共 42分) (1)质谱(1分) C3H6O3 (2分) (2) (2分)
题号 l 2 3 4 5 6 7 (3)①d(1分)
答案 B C B C B C D
②O的电负性大于 H,羟基的吸电子效应更强,A羧基中的羟基的极性增强,更易电离出氢离
子(2分)
题号 8 9 10 11 12 13 14
答案 D C C A A C B 19. (7分)
(1) (2分)
浓硫酸
二、填空题(共 58分)
(2)HOCH2CH2OH + CH3COOH H2O + CH3COOCH2CH2OH(2分)
15. (12分)
(3)加聚反应(1分)
(1)sp杂化(2分) 范德华力 (2分)
(2)O>C>H(2分) (4) (2分)
(3)CH3OH分子间存在氢键 (2分)
(4)平面三角形(2分) 4︰1 (2分)
20. (11分)
16. (11分)
1 IIIA 1 (1)浓硝酸、浓硫酸(2分) (2)还原反应(1分)( )第五周期 族( 分)
(2)①三角锥形(2分) sp3杂化(2分) (3)
②二者均为分子晶体,相对分子质量:AsCl3< InCl3,范德华力:AsCl3< InCl3,沸 (2分)
点:AsCl3< InCl3 (2分)
③Cl (1分)
30 3 (4)A:CH2=CH-Cl(1分) B:CH2=CH-CN(1分)(3)①4(1分) ②4M 10 /(NA a ) (2分) C:CH2=CH-C≡CH(1分) 加成反应(1分)
17. (9分) CH CH + HCl催→化剂≡ CH2=CHCl(1分)
(1)1s22s22p5 (1分) △
催化剂
(2)> (2分) nCH2=CH-CCl=CH2 → (1分)
△
(3)① (1分)
② BF3 + 2HF=H2F+ + [BF4]- (2分)
(4)① 8(2分)
第 5 页 共 6 页
{#{QQABSYCEogAAAJJAABgCQwlgCkMQkBGCAKoGwAAIsAAASQFABAA=}#}
班级:___________ 姓名:__________ 教育 ID:__________
第 6 页 共 6 页
{#{QQABSYCEogAAAJJAABgCQwlgCkMQkBGCAKoGwAAIsAAASQFABAA=}#}
6.某烃与氢气发生反应后能生成 ,则该烃不可能是
北京市第四十三中学 2023-2024 ...学年度第二学期期中考试
A. B.
高二年级化学 试卷 (时间:90分钟)
1. 本试卷共 4页,二道大题,20道小题。满分 100分。考试时间 90分钟。 C. D.
考 2. 在试卷和答题卡上准确填写班级、姓名和学号。
生 3. 试题答案一律填写在答题卡上,在试卷上作答无效。 7.有机化合物 X( )是合成维生素 B6的中间体。下列关于 X的
须 4. 在答题卡上,选择题须用 2B铅笔将选中项涂黑涂满,其他试题用黑色字迹签字笔作答。 说法不.正.确.的是知 5. 考试结束时,将答题卡按考场座位顺序上交。
A.分子式为 C4H8O2 B.可发生加成、取代、加聚、氧化反应
可能用到的相对原子质量:H 1 C 12 O 16 F 19 Ca 40 As 75 In 115 C.能使溴的四氯化碳溶液褪色 D.与 HOCH2CH2OH互为同系物
一、单项选择题(下列每小题的四个选项中只有一个选项符合题意。共 42 分,每小题 3 分) 8.维生素 C的结构如右图所示。下列说法不.正.确.的是
1.下列有机物存在顺反异构的是 A.分子式是 C6H8O6
A.1-丁烯 B.2-丁烯 B.分子中含有多个羟基,其水溶性较好
C.2-甲基-2-丁烯 D.2,3-二甲基-2-丁烯 C.能使酸性高锰酸钾溶液、溴的四氯化碳溶液褪色
2.下列说法中,正确的是 D.分子中含有碳碳双键、羟基、醚键 3种官能团
9.图为实验室制取乙炔并验证其性质的装置图。下列说法不.合.理.的是
A. 和 互为同系物
A.逐滴加入饱和食盐水可控制生成乙炔的速率
B. 乙醇和乙醚互为同分异构体
B. KMnO4酸性溶液褪色,说明乙炔有还原性
C. 可用溴水来区分乙烷和乙烯
C.用溴水验证乙炔的性质,不需要除杂
D. 甲醇、乙二醇、丙三醇互为同系物
D.将纯净的乙炔点燃,有浓烈的黑烟,说明乙炔
3.某烷烃的结构简式为 ,其系统命名正确的是
不饱和程度高
10. 乙酰苯胺是一种具有解热镇痛作用的白色晶体,20 ℃时在乙醇中的溶解度为 36.9 g,在水
A.3,3,4-三甲基戊烷 B.2,3,3-三甲基戊烷
中的溶解度如下表:
C.2,3-二甲基-2-乙基丁烷 D.2,3-二甲基-3-乙基丁烷
温度/℃ 25 50 80 100
4.下列有机化合物分子中,所有原子不.可.能.位于同一平面的是
溶解度/g 0.56 0.84 3.5 5.5
A.乙烯 B.乙炔 C. 甲苯 D.苯
已知:氯化钠可分散在乙醇中形成胶体。某种乙酰苯胺样品中混入了少量氯化钠杂质,下列
5.下列化学用语或模型不.正.确.的是
提纯乙酰苯胺的方法正确的是
A.苯的实验式:CH B.乙烯的结构简式:CH2CH2
A.用水溶解后分液 B.用乙醇溶解后过滤
C.乙炔的球棍模型: D.甲基的电子式:
第 1 页 共 6 页
{#{QQABSYCEogAAAJJAABgCQwlgCkMQkBGCAKoGwAAIsAAASQFABAA=}#}
班级:___________ 姓名:__________ 教育 ID:__________
C.用水做溶剂进行重结晶 D.用乙醇做溶剂进行重结晶 A.[Co(H2O)6]2+和[CoCl4]2-的 Co2+配位数之比为 2︰3
11. 下列各物质的晶体中,晶体类型相同的是 B.由实验①可知平衡逆向移动
A.SO2和 H2O B.HCl和 NaCl C.CO2和 SiO2 D.Cu 和 Ne C.由实验②可推知△H < 0
12.已知 H2O2分子的空间结构可在二面角中表示(如下图所示),则有关 H2O2结构的说法不. D.由实验③可知配离子的稳定性:[ZnCl4]2-< [CoCl4]2-
正.确.的是
A.H O 二、填空题(共 58分)2 2是非极性分子,难溶于水
B.分子中含有极性键和非极性键 15.(12分)CO2的资源化利用是解决温室效应的重要途径。科学家致力于 CO2与H2反应制 CH3OH
C.O采用 sp3杂化 的研究。
D.H—O与 O—O形成的键角小于 109°28
(1)CO2分子中碳原子的杂化轨道类型为______;干冰是很好的致冷剂,干冰升华时,CO2需
13.碱金属氯化物是典型的离子化合物,NaCl和 CsCl的晶胞结构如下图所示。其中的碱金属 要克服的作用力是______。
离子能够与冠醚形成超分子。 (2)CH3OH所含有的三种元素电负性从大到小的顺序为______(用元素符号表示)。
(3)CH3OH的沸点比 CO2高,主要原因是______。
(4)CH3OH被氧化为 HCHO,HCHO继续被氧化可生成 HCOOH。HCHO分子的空间结构为
______,HCOOH 分子内σ键与π键个数之比为______。
NaCl晶胞 CsCl晶胞 Na+与冠醚形成的超分子 16.(11分)砷化铟(InAs)是一种优良的半导体化合物,有广泛用途。
下列说法不正确的是 (1)基态 In的价层电子排布式为 5s25p1,In在周期表中的位置是______。...
A NaCl a Na+ (2)在 Ar保护下分别将 InCl3和 AsCl3在气化室中加热转化为蒸气,在反应室中混合反应,即. 晶胞中 为
可得到橘黄色的 InAs晶体。已知:AsCl3和 InCl3均为分子晶体;AsCl3气化室的温度为 130 ℃,
B.CsCl晶体中 Cs+周围紧邻 8个 Cl-
InCl3气化室的温度为 500℃。
C.碱金属离子与冠醚通过离子键形成超分子
① AsCl3分子的空间结构为______,中心原子 As的杂化轨道类型为______。
D.不同空穴尺寸的冠醚可以对不同碱金属离子进行识别
② AsCl3气化室温度低于 InCl3气化室温度的原因是______。
14.将 CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
③ InCl3晶体中分子间存在配位键,配位原子是______。
[Co(H2O)6]2+ + 4Cl- [CoCl4]2- + 6H2O △H。用该溶液做实验,溶液的颜色变化如下:
(3)InAs为原子之间以共价键的成键方式结合而成的晶体。其晶胞结构如下图所示。
① 一个晶胞中所含 As的个数为______。
② 已知该晶胞棱长为 a pm(1 pm=1×10-10 cm),阿伏加德罗常数
为 NA, InAs 的摩尔质量为 M g·mol-1,则该晶体的密度ρ
已知:[Co(H2O)6]2+ 粉红色 [CoCl4]2- 蓝色 [ZnCl4]2- 无色
=_____g·cm-3。
下列结论和解释正确的是
第 2 页 共 6 页
{#{QQABSYCEogAAAJJAABgCQwlgCkMQkBGCAKoGwAAIsAAASQFABAA=}#}
班级:___________ 姓名:__________ 教育 ID:__________
17.(9分)氟在已知元素中电负性最大、非金属性最强,其单质在 1886年才被首次分离出来。 A的结构简式为______。
(1)基态 F原子的核外电子排布式为 。
O2F2 H2O2 (3)研究 A的结构和性质的关系
(2)氟氧化物 O2F2的结构已经确定。依据数据推测 O O—O键长/pm 121 148 ① A的分子存在两种空间结构,它们具有完全相同的组成和原子排列,却互为镜像,具有不同
—O键的稳定性:O2F2 H2O2(填“>”或“<”)。
3 HF 的光学性质,两种分子的关系为______(填字母)。( ) 是一种有特殊性质的氢化物。
①已知:氢键(X—H···Y)中三原子在一条直线上时,作用力最强。测定结果表明,(HF)n固体 a.碳架异构 b.位置异构 c.官能团异构 d.对映异构
中 HF分子排列成锯齿形。画出含 2个 HF的重复单元结构: 。 ② 已知:电离常数 Ka(A)=1.38×10-4,Ka(丙酸)=1.34×10-5,分析数据可知 A的酸性强于丙酸,
②HF中加入 BF3可以解离出 H2F+和具有正四面体形结构的阴离子,写出该过程的离子方程 请从共价键极性的角度解释原因______。
式: 。 19.(7分)聚乙烯醇滴眼液可治疗眼部干涩等,主要成分是 ,某同学设计其合
(4)工业上用萤石(主要成分 CaF2)制备 HF。CaF2晶体的一种立方晶胞如图所示。
成路线如下:
① CaF2晶体中距离 Ca2+最近的 F-有 个。
②晶体中 Ca2+与 F-的最近距离为 d nm(1 cm =107 nm),阿伏加德罗常数的
值为 NA。该晶体的密度ρ= g·cm-3(列出计算式)。
18.(8 分)有机化合物 A可由葡萄糖发酵得到,在医药和食品领域中有广
泛应用,研究有机化合物 A的分子结构、性质如下:
(1)确定 A的分子式
经元素分析得到化合物 A的实验式为 CH2O,通过______法(填仪器分析方法)可以测得 A的
90 A ______ (1)①的化学方程式是______。相对分子质量为 ,则 的分子式为 。
2 A (2)HOCH2CH( )确定 的分子结构 2OH和 B反应的化学方程式是______。
A (3)②的反应类型是______。使用现代分析仪器对 的分子结构进行测定,结果如下:
(4)设计由乙烯制备 B(C2H4O2)的合成路线(参照下述示例,注明物质与条件)。
谱图 数据分析结果
红外光谱 含有—COOH、—OH
核磁共振氢谱 峰面积比为 1︰1︰1︰3
第 3 页 共 6 页
{#{QQABSYCEogAAAJJAABgCQwlgCkMQkBGCAKoGwAAIsAAASQFABAA=}#}
班级:___________ 姓名:__________ 教育 ID:__________
20.(11分)喹啉( )及其衍生物是合成药物的重要原料。化合物 G是一种取代
喹啉醇,合成路线如下:
已知:
(1)试剂 a是______。
(2)A→B的反应类型是______。
(3)C+Y→D的化学方程式是______。
(4)苯可以由三分子乙炔在一定条件下合成得到,而乙炔还可以合成聚氯乙烯等,其制备过程
如下:
写出 A、B和 C的结构简式:A____________;B______________;C______________。
写出反应③的反应类型为___________。
写出反应①和反应⑦的化学方程式
___________________________________,__________________________________。
第 4 页 共 6 页
{#{QQABSYCEogAAAJJAABgCQwlgCkMQkBGCAKoGwAAIsAAASQFABAA=}#}
班级:___________ 姓名:__________ 教育 ID:__________
北京市第四十三中学 2023—2024 学年度第二学期期中试卷
② (1分)
高二年级化学 答案及评分参考 2024.4
18. (8分)
一、单项选择题(每题 3分,共 42分) (1)质谱(1分) C3H6O3 (2分) (2) (2分)
题号 l 2 3 4 5 6 7 (3)①d(1分)
答案 B C B C B C D
②O的电负性大于 H,羟基的吸电子效应更强,A羧基中的羟基的极性增强,更易电离出氢离
子(2分)
题号 8 9 10 11 12 13 14
答案 D C C A A C B 19. (7分)
(1) (2分)
浓硫酸
二、填空题(共 58分)
(2)HOCH2CH2OH + CH3COOH H2O + CH3COOCH2CH2OH(2分)
15. (12分)
(3)加聚反应(1分)
(1)sp杂化(2分) 范德华力 (2分)
(2)O>C>H(2分) (4) (2分)
(3)CH3OH分子间存在氢键 (2分)
(4)平面三角形(2分) 4︰1 (2分)
20. (11分)
16. (11分)
1 IIIA 1 (1)浓硝酸、浓硫酸(2分) (2)还原反应(1分)( )第五周期 族( 分)
(2)①三角锥形(2分) sp3杂化(2分) (3)
②二者均为分子晶体,相对分子质量:AsCl3< InCl3,范德华力:AsCl3< InCl3,沸 (2分)
点:AsCl3< InCl3 (2分)
③Cl (1分)
30 3 (4)A:CH2=CH-Cl(1分) B:CH2=CH-CN(1分)(3)①4(1分) ②4M 10 /(NA a ) (2分) C:CH2=CH-C≡CH(1分) 加成反应(1分)
17. (9分) CH CH + HCl催→化剂≡ CH2=CHCl(1分)
(1)1s22s22p5 (1分) △
催化剂
(2)> (2分) nCH2=CH-CCl=CH2 → (1分)
△
(3)① (1分)
② BF3 + 2HF=H2F+ + [BF4]- (2分)
(4)① 8(2分)
第 5 页 共 6 页
{#{QQABSYCEogAAAJJAABgCQwlgCkMQkBGCAKoGwAAIsAAASQFABAA=}#}
班级:___________ 姓名:__________ 教育 ID:__________
第 6 页 共 6 页
{#{QQABSYCEogAAAJJAABgCQwlgCkMQkBGCAKoGwAAIsAAASQFABAA=}#}
同课章节目录
