3.3.2乙酸(共25张PPT)【任务驱动式】 化学鲁科版(2019)必修第二册
文档属性
| 名称 | 3.3.2乙酸(共25张PPT)【任务驱动式】 化学鲁科版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 40.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-14 09:46:36 | ||
图片预览






文档简介
(共25张PPT)
第3节 饮食中的有机物
第2课时 乙 酸
学习目标
1.通过了解我国醋文化和乙酸多方面的应用,增强文化自信和对学科价值的认同。
2.通过“多感官感受乙酸”的活动,了解乙酸的物理性质,培养综合多方信息归纳总结的意识,发展宏观辨识的核心素养。
3.通过自主设计实验进行探究、与乙醇结构比较探究酸性本质的推理,理解乙酸的酸性,知道官能团羧基,渗透“结构决定性质”的化学观念。
4.通过酯化反应实验的系列问题引导和模型拼插活动,认识酯化反应的原理和实验要点,建构有机物制备一般思路的认知模型,发展宏观辨识与微观探析、证据推理与模型认知的核心素养。
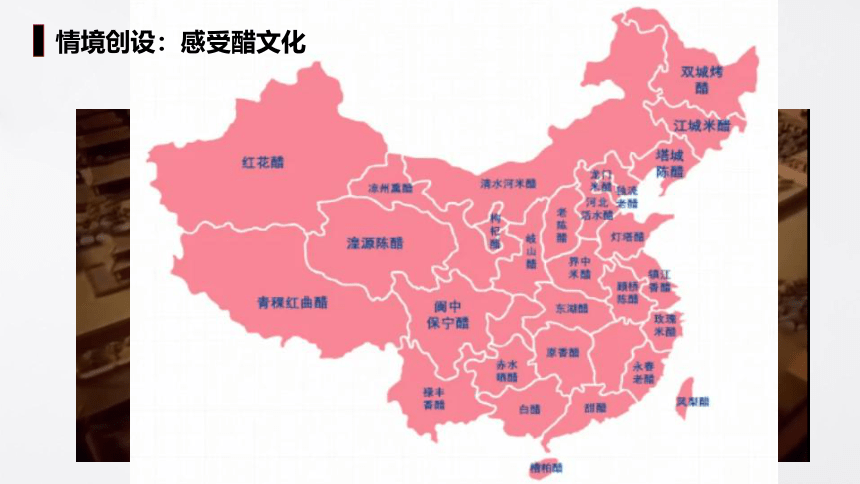
情境创设:感受醋文化
任务一
感 受 乙 酸
活动1
观察纯乙酸、乙酸溶液,结合生活经验,归纳乙酸的物理性质。
无色液体
颜色、状态:
气味:
有强烈刺激性气味
沸点:
117.9℃(易挥发)
熔点:
16.6℃
溶解性:
易溶于水、乙醇等溶剂
在温度较低时,无水乙酸就会凝结成像冰一样的晶体,所以纯乙酸又称为冰醋酸
任务二
探 究 醋 之“酸”
活动2
自主设计实验方案并实施,完成以下目的:
①比较乙酸与碳酸的酸性强弱;
②比较乙酸与盐酸的酸性强弱。
(说明:①、②分别设计一种实验方案即可)
实
验
用
品
1mol·L-1乙酸溶液、1mol·L-1盐酸、0.1mol·L-1乙酸溶液、0.1mol·L-1盐酸、Na2CO3、锌粒、pH试纸、CaO固体、石蕊溶液
小试管、药匙、玻璃棒、玻璃片
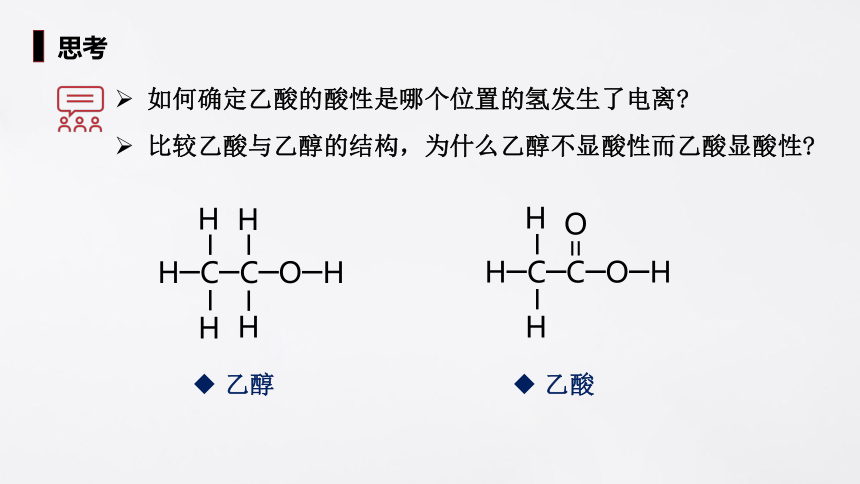
思考
如何确定乙酸的酸性是哪个位置的氢发生了电离
比较乙酸与乙醇的结构,为什么乙醇不显酸性而乙酸显酸性
H─C─C─O─H
─
─
=
H
O
H
H─C─C─O─H
─
─
─
─
H
H
H
H
乙醇
乙酸
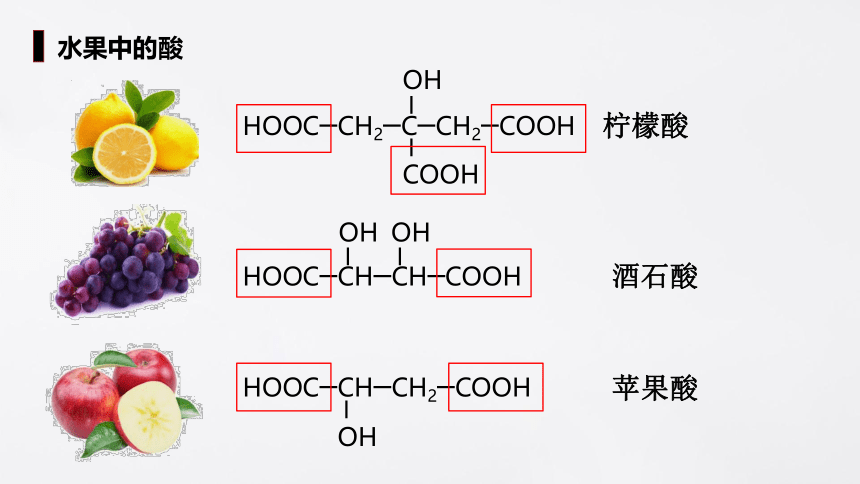
水果中的酸
柠檬酸
酒石酸
苹果酸
HOOC─CH2─C─CH2─COOH
─
─
COOH
OH
HOOC─CH─CH─COOH
─
OH
─
OH
HOOC─CH─CH2─COOH
─
OH
官能团
─C─O─H
=
O
羧 基
─COOH
羧
例:
甲酸 HCOOH
乙酸 CH3COOH
实际应用
除水垢
除铁锈
任务三
探 究 醋 香 来 源
文献资料
……散发着一种柔和醇厚的香味。主要的香味源于酯类物质,其中乙酸乙酯的含量最为丰富,这是酿制过程中产生的乙酸与乙醇一见钟情,发生酯化反应的结果。不管是哪种酿造醋,都要进行一定时间的陈化、后熟与熏醅,即所谓陈酿过程,诸多的化学反应在这一阶段悄然发生……
反应原理
CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
H─C─C
─
─
=
H
O
H
─O─C─C─H
─
─
─
─
H
H
H
H
乙酸乙酯
┃反应条件
思考:
若该反应在常温下进行,达到限度需要十几年。
哪些方法可以加快酯化反应的速率?
浓H2SO4
△
反应原理
┃反应条件
┃实验装置
思考:
该反应应该选用什么装置?
CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
浓H2SO4
△
物质 熔点/℃ 沸点/℃
乙酸 16.6 117.9
乙醇 -114.1 78.5
乙酸乙酯 -84 77.86
反应
收集
冷凝
液+液 低沸点液体
△
饱和Na2CO3溶液
①3mL无水乙醇
②2mL浓硫酸
③2mL冰醋酸
④几粒沸石
反应原理
┃反应条件
┃实验装置
思考:
制得的乙酸乙酯中可能含什么杂质
饱和Na2CO3溶液起什么作用
CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
浓H2SO4
△
物质 熔点/℃ 沸点/℃ 密度(g/cm3) 气味 水溶性 酸性
乙酸 16.6 117.9 1.05 刺激味 易溶于水 弱酸性
乙醇 -114.1 78.5 0.79 特殊香味 易溶于水 无
乙酸乙酯 -84 77.86 0.9 水果香味 微溶于水 无
┃产物净化
乙酸乙酯溶解度(20℃):水中:8.3g/100g,饱和碳酸钠溶液中:0.5g/100g
反应原理
┃反应条件
┃实验装置
CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
浓H2SO4
△
┃产物净化
┃反应机理
酯化反应
酸
醇
酯
水
活动3
拼插模型,思考酯化反应中可能的断键成键位置。
同位素示踪法
CH3─C─18O─H
=
O
CH3CH2─O─H
H218O
反应机理:酸脱羟基醇脱氢
CH3─C─OCH2CH3
=
O
+
+
学以致用
水杨酸甲酯( )俗称冬青油,具有消肿、消炎和镇痛的作用,可用于一些皮肤疾病的治疗,也常用作牙膏、化妆品中的香料。它可由冬青叶蒸馏或由水杨酸为原料而制得。
你认为由水杨酸( )制备冬青油还需要什么必需的原料,书写该合成反应的化学方程式。
小结
乙酸
性质
用途
结构
─C─O─H
=
O
酸性
酯化反应
调味
除水垢
中和碱性物质
制备酯类
制备醋酸纤维
巩固练习
1.通常我们会用食醋清除水壶中的少量水垢(CaCO3),这是由于醋酸具有( )
A.碱性
B.酸性
C.氧化性
D.还原性
巩固练习
2.下列物质中,不能用来鉴别乙醇和乙酸的是( )
A.碳酸钠溶液
B.紫色石蕊溶液
C.溴水
D.锌片
巩固练习
3.食醋中含有3%~5%的乙酸。下列分析不正确的是( )
A.乙酸与水互溶
B.乙酸易挥发,食醋应密闭保存
C.乙酸的分子式为C2H4O2,所含官能团为羟基
D.向少量纯碱中加入食醋会产生气泡
巩固练习
4.下列关于乙酸性质的叙述中,错误的是( )
A.乙酸的酸性比碳酸的强,所以它可以与碳酸盐溶液反应,产生CO2气体
B.乙酸具有酸性,所以能与钠反应放出H2
C.乙酸分子中含有碳氧双键所以它能使溴水褪色
D.乙酸在温度低于16.6℃时,就凝结成冰状晶体
巩固练习
5.下列关于乙酸性质的积述错误的是( )
A.常温下,乙酸是一种有强烈刺激性气味的无色液体
B.冰醋酸是无水乙酸,不是乙酸的水溶液
C.乙酸能跟碳酸钠溶液发生反应产生CO2
D.在发生酯化反应时,乙酸分子中羧基上的氢原子跟醇分子中的羟基结合生成水
本课结束
第3节 饮食中的有机物
第2课时 乙 酸
学习目标
1.通过了解我国醋文化和乙酸多方面的应用,增强文化自信和对学科价值的认同。
2.通过“多感官感受乙酸”的活动,了解乙酸的物理性质,培养综合多方信息归纳总结的意识,发展宏观辨识的核心素养。
3.通过自主设计实验进行探究、与乙醇结构比较探究酸性本质的推理,理解乙酸的酸性,知道官能团羧基,渗透“结构决定性质”的化学观念。
4.通过酯化反应实验的系列问题引导和模型拼插活动,认识酯化反应的原理和实验要点,建构有机物制备一般思路的认知模型,发展宏观辨识与微观探析、证据推理与模型认知的核心素养。
情境创设:感受醋文化
任务一
感 受 乙 酸
活动1
观察纯乙酸、乙酸溶液,结合生活经验,归纳乙酸的物理性质。
无色液体
颜色、状态:
气味:
有强烈刺激性气味
沸点:
117.9℃(易挥发)
熔点:
16.6℃
溶解性:
易溶于水、乙醇等溶剂
在温度较低时,无水乙酸就会凝结成像冰一样的晶体,所以纯乙酸又称为冰醋酸
任务二
探 究 醋 之“酸”
活动2
自主设计实验方案并实施,完成以下目的:
①比较乙酸与碳酸的酸性强弱;
②比较乙酸与盐酸的酸性强弱。
(说明:①、②分别设计一种实验方案即可)
实
验
用
品
1mol·L-1乙酸溶液、1mol·L-1盐酸、0.1mol·L-1乙酸溶液、0.1mol·L-1盐酸、Na2CO3、锌粒、pH试纸、CaO固体、石蕊溶液
小试管、药匙、玻璃棒、玻璃片
思考
如何确定乙酸的酸性是哪个位置的氢发生了电离
比较乙酸与乙醇的结构,为什么乙醇不显酸性而乙酸显酸性
H─C─C─O─H
─
─
=
H
O
H
H─C─C─O─H
─
─
─
─
H
H
H
H
乙醇
乙酸
水果中的酸
柠檬酸
酒石酸
苹果酸
HOOC─CH2─C─CH2─COOH
─
─
COOH
OH
HOOC─CH─CH─COOH
─
OH
─
OH
HOOC─CH─CH2─COOH
─
OH
官能团
─C─O─H
=
O
羧 基
─COOH
羧
例:
甲酸 HCOOH
乙酸 CH3COOH
实际应用
除水垢
除铁锈
任务三
探 究 醋 香 来 源
文献资料
……散发着一种柔和醇厚的香味。主要的香味源于酯类物质,其中乙酸乙酯的含量最为丰富,这是酿制过程中产生的乙酸与乙醇一见钟情,发生酯化反应的结果。不管是哪种酿造醋,都要进行一定时间的陈化、后熟与熏醅,即所谓陈酿过程,诸多的化学反应在这一阶段悄然发生……
反应原理
CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
H─C─C
─
─
=
H
O
H
─O─C─C─H
─
─
─
─
H
H
H
H
乙酸乙酯
┃反应条件
思考:
若该反应在常温下进行,达到限度需要十几年。
哪些方法可以加快酯化反应的速率?
浓H2SO4
△
反应原理
┃反应条件
┃实验装置
思考:
该反应应该选用什么装置?
CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
浓H2SO4
△
物质 熔点/℃ 沸点/℃
乙酸 16.6 117.9
乙醇 -114.1 78.5
乙酸乙酯 -84 77.86
反应
收集
冷凝
液+液 低沸点液体
△
饱和Na2CO3溶液
①3mL无水乙醇
②2mL浓硫酸
③2mL冰醋酸
④几粒沸石
反应原理
┃反应条件
┃实验装置
思考:
制得的乙酸乙酯中可能含什么杂质
饱和Na2CO3溶液起什么作用
CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
浓H2SO4
△
物质 熔点/℃ 沸点/℃ 密度(g/cm3) 气味 水溶性 酸性
乙酸 16.6 117.9 1.05 刺激味 易溶于水 弱酸性
乙醇 -114.1 78.5 0.79 特殊香味 易溶于水 无
乙酸乙酯 -84 77.86 0.9 水果香味 微溶于水 无
┃产物净化
乙酸乙酯溶解度(20℃):水中:8.3g/100g,饱和碳酸钠溶液中:0.5g/100g
反应原理
┃反应条件
┃实验装置
CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
浓H2SO4
△
┃产物净化
┃反应机理
酯化反应
酸
醇
酯
水
活动3
拼插模型,思考酯化反应中可能的断键成键位置。
同位素示踪法
CH3─C─18O─H
=
O
CH3CH2─O─H
H218O
反应机理:酸脱羟基醇脱氢
CH3─C─OCH2CH3
=
O
+
+
学以致用
水杨酸甲酯( )俗称冬青油,具有消肿、消炎和镇痛的作用,可用于一些皮肤疾病的治疗,也常用作牙膏、化妆品中的香料。它可由冬青叶蒸馏或由水杨酸为原料而制得。
你认为由水杨酸( )制备冬青油还需要什么必需的原料,书写该合成反应的化学方程式。
小结
乙酸
性质
用途
结构
─C─O─H
=
O
酸性
酯化反应
调味
除水垢
中和碱性物质
制备酯类
制备醋酸纤维
巩固练习
1.通常我们会用食醋清除水壶中的少量水垢(CaCO3),这是由于醋酸具有( )
A.碱性
B.酸性
C.氧化性
D.还原性
巩固练习
2.下列物质中,不能用来鉴别乙醇和乙酸的是( )
A.碳酸钠溶液
B.紫色石蕊溶液
C.溴水
D.锌片
巩固练习
3.食醋中含有3%~5%的乙酸。下列分析不正确的是( )
A.乙酸与水互溶
B.乙酸易挥发,食醋应密闭保存
C.乙酸的分子式为C2H4O2,所含官能团为羟基
D.向少量纯碱中加入食醋会产生气泡
巩固练习
4.下列关于乙酸性质的叙述中,错误的是( )
A.乙酸的酸性比碳酸的强,所以它可以与碳酸盐溶液反应,产生CO2气体
B.乙酸具有酸性,所以能与钠反应放出H2
C.乙酸分子中含有碳氧双键所以它能使溴水褪色
D.乙酸在温度低于16.6℃时,就凝结成冰状晶体
巩固练习
5.下列关于乙酸性质的积述错误的是( )
A.常温下,乙酸是一种有强烈刺激性气味的无色液体
B.冰醋酸是无水乙酸,不是乙酸的水溶液
C.乙酸能跟碳酸钠溶液发生反应产生CO2
D.在发生酯化反应时,乙酸分子中羧基上的氢原子跟醇分子中的羟基结合生成水
本课结束
