2025江苏版新教材化学高考第一轮基础练习--阶段检测练 化学反应原理(含答案)
文档属性
| 名称 | 2025江苏版新教材化学高考第一轮基础练习--阶段检测练 化学反应原理(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 686.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-16 00:00:00 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2025江苏版新教材化学高考第一轮
阶段检测练 化学反应原理
1.★★(2023南通、泰州等八市第二次调研,6)卤族元素单质及其化合物应用广泛。氟在自然界主要存在于萤石(CaF2)中,CaF2与浓硫酸反应可制取HF;氯、溴主要存在于海水中,工业上常通过电解NaCl饱和溶液制备Cl2,Cl2可用于制取漂白粉。卤水中Br-可通过Cl2氧化、Na2CO3溶液吸收;BrCl能发生水解反应。I2易升华,一种Li-I2二次电池正极界面反应机理如图所示。
下列化学反应表示正确的是( )
A.Li-I2电池正极放电时的电极反应有+2e- 3I-
B.电解饱和NaCl溶液:2NaCl 2Na+Cl2↑
C.BrCl与H2O反应:BrCl+H2O HCl+Br++OH-
D.Br2(g)用Na2CO3溶液吸收:Br2+C Br-+Br+CO2
答案 A
2.★★(2023常州教育学会学业水平监测,9)化工生产中常利用苯催化加氢制备环己烷。一定条件下,在管式反应器中发生反应:
(g)+3H2(g) (g) ΔH=-208.2 kJ·mol-1
下列说法不正确的是( )
A.低温有利于上述反应自发进行
B.上述反应中消耗1 mol苯,释放的热量为208.2 kJ
C.实际投料时,适当增加H2用量,可提高苯的利用率
D.由上述反应可推知,反应(g)+H2(g) (g)的ΔH约为-69.4 kJ·mol-1
答案 D
3.★★(2023南通四模,10)我国科学家研发的一种新型全氯液流电池可用于能量储存。该电池装置如图所示。释能时电极b的反应为Cl2+2e- 2Cl-,下列说法正确的是( )
A.储能时,电极a与电源正极相连
B.释能时,电极a发生的电极反应为NaTi2(PO4)3+2Na++2e- Na3Ti2(PO4)3
C.用Na2SO3溶液代替CCl4吸收Cl2,也能达到储能—释能的效果
D.释能时,吸收桶中溶液质量每减少71 g,理论上电极a应减少46 g
答案 D
4.★★(2023泰州期末,10)某MOFs多孔超分子材料的空腔大小适配N2O4可将其“固定”得到R(如图所示),实现从烟气中分离出N2O4并可制备HNO3。
已知反应2NO2(g) N2O4(g) ΔH<0。下列说法正确的是( )
A.图示过程属于氮的固定
B.高温、高压下有利于从烟气中分离出N2O4
C.R在O2中水洗,可制得HNO3同时实现MOFs再生
D.该MOFs材料也可用于储存H2
答案 C
5.★★(2023南京、盐城一模,10)活性炭基材料烟气脱硝技术备受当前研究者关注,其反应原理为C(s)+2NO(g) CO2(g)+N2(g) ΔH。下列说法错误的是( )
A.增大压强,平衡向脱硝方向移动
B.上述脱硝反应的平衡常数K=
C.若烟气中O2含量过高,可能会产生二次污染
D.每处理标准状况下2.24 L NO,转移电子0.2 mol
答案 A
6.★★(2023北京,4,3分)下列事实能用平衡移动原理解释的是( )
A.H2O2溶液中加入少量MnO2固体,促进H2O2分解
B.密闭烧瓶内的NO2和N2O4的混合气体,受热后颜色加深
C.铁钉放入浓HNO3中,待不再变化后,加热能产生大量红棕色气体
D.锌片与稀H2SO4反应过程中,加入少量CuSO4固体,促进H2的产生
答案 B
7.★★(2023连云港第一次调研,13)烯烃是一种应用广泛的化学原料。烯烃之间存在下列三个反应:
反应Ⅰ:3C4H8(g) 4C3H6(g) ΔH1=+78 kJ·mol-1
反应Ⅱ:2C3H6(g) 3C2H4(g) ΔH2=+117 kJ·mol-1
反应Ⅲ:C4H8(g) 2C2H4(g) ΔH3
在恒压密闭容器中,反应达平衡时,三种组分的物质的量分数x随温度T的变化关系如图所示。下列说法正确的是( )
A.反应Ⅲ的ΔH3=+195 kJ·mol-1
B.700 K时反应Ⅱ的平衡常数Kx<2.0×10-2(以物质的量分数代替平衡浓度)
C.提高C4H8物质的量分数,需研发低温条件下活性好且耐高压的催化剂
D.超过700 K后曲线a下降的原因可能是随着温度升高反应Ⅰ逆向移动,反应Ⅱ正向移动
答案 C
8.★★(2023如皋第一次适应性考试,13)以CO2为原料制取CH3OH是CO2资源化利用的重要途径。在催化剂作用下,以CO2、H2为原料制取CH3OH主要发生如下反应。
反应1:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
反应2:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
向装有催化剂的1 L恒容密闭容器中充入1 mol CO2和1.12 mol H2,测得平衡时CO2的转化率和CH3OH的选择性与温度的关系如图所示。
已知CH3OH的选择性=×100%。下列说法不正确的是( )
A.ΔH1<0、ΔH2>0
B.240 ℃平衡时容器中c(H2O)=0.4 mol·L-1
C.240~320 ℃,温度越高,平衡时CH3OH的物质的量越小
D.由图可知200~280 ℃时温度越高催化剂的活性越弱
答案 D
9.★★(2023前黄高级中学二模,12)亚砷酸(H3AsO3)可用于治疗白血病。亚砷酸在溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH的关系如图所示。下列说法不正确的是 ( )
A.人体血液的pH为7.35~7.45,给药后人体所含砷元素微粒主要是H3AsO3
B.NaH2AsO3可发生电离和水解,溶液显碱性
C.当溶液的pH=11时,3c(As)+2c(HAs)+c(H2As)+c(OH-)=c(H+)
D.用δ表示微粒的物质的量分数,pH=13时δ(As)+δ(HAs)+δ(H2As)≈1
答案 C
10.★★(2023无锡期终教学质量调研,17)乙醇用途广泛且需求量大,寻求制备乙醇的新方法是研究的热点。
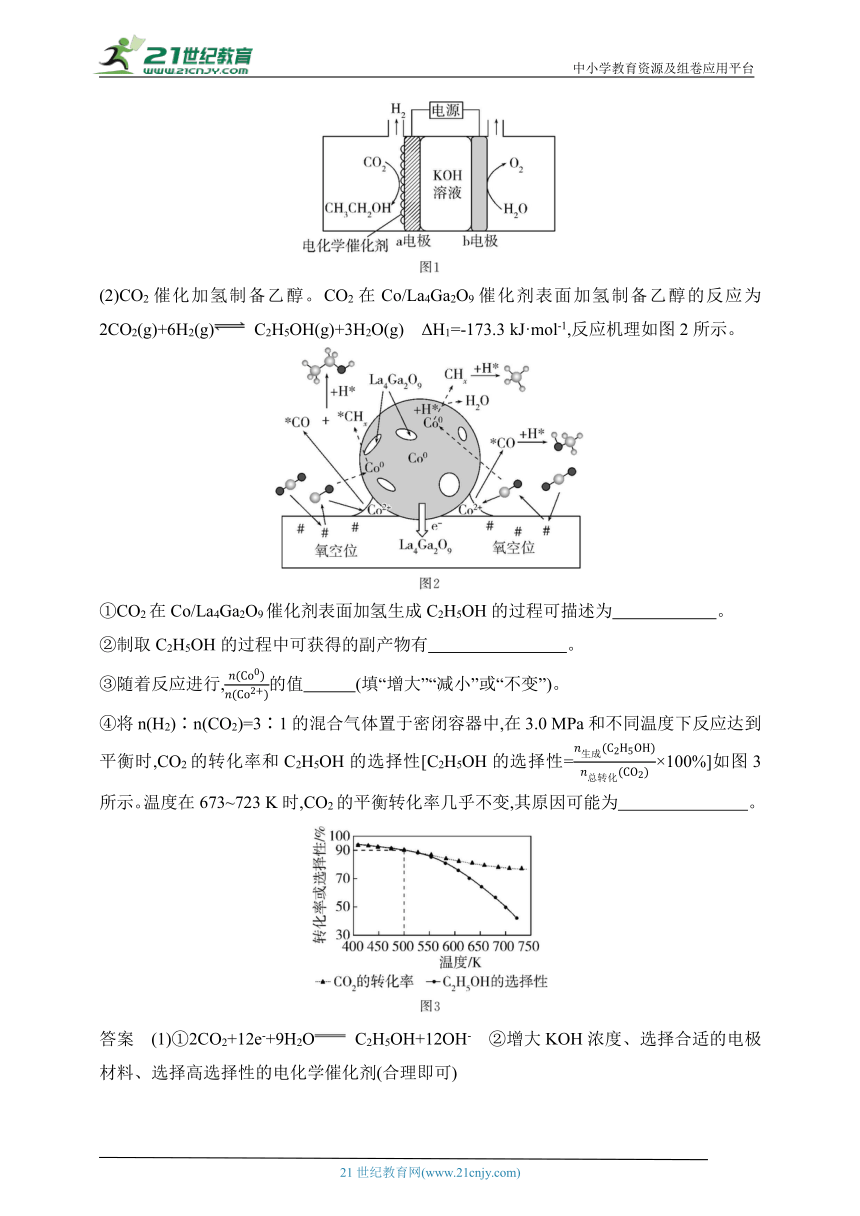
(1)CO2电催化制备乙醇。电解原理示意图如图1所示。
①a电极的电极反应式为 。
②有效抑制a电极发生析氢反应的措施有 。
(2)CO2催化加氢制备乙醇。CO2在Co/La4Ga2O9催化剂表面加氢制备乙醇的反应为2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g) ΔH1=-173.3 kJ·mol-1,反应机理如图2所示。
①CO2在Co/La4Ga2O9催化剂表面加氢生成C2H5OH的过程可描述为 。
②制取C2H5OH的过程中可获得的副产物有 。
③随着反应进行,的值 (填“增大”“减小”或“不变”)。
④将n(H2)∶n(CO2)=3∶1的混合气体置于密闭容器中,在3.0 MPa和不同温度下反应达到平衡时,CO2的转化率和C2H5OH的选择性[C2H5OH的选择性=×100%]如图3所示。温度在673~723 K时,CO2的平衡转化率几乎不变,其原因可能为 。
答案 (1)①2CO2+12e-+9H2O C2H5OH+12OH- ②增大KOH浓度、选择合适的电极材料、选择高选择性的电化学催化剂(合理即可)
(2)①CO2在La4Ga2O9的氧空位上失去氧原子变成CO,一部分CO在0价Co原子催化下结合*H转化为*CHx,一部分CO在Co2+催化下转化为*CO,*CO与*CHx结合*H生成乙醇 ②CH4、CH3OH(答CO不扣分) ③增大 ④温度的升高使生成C2H5OH的反应中CO2的平衡转化率下降,副反应中CO2的平衡转化率上升,且上升幅度与下降幅度相当
阶段检测练 化学反应原理
1.★★(2023南通、泰州等八市第二次调研,6)卤族元素单质及其化合物应用广泛。氟在自然界主要存在于萤石(CaF2)中,CaF2与浓硫酸反应可制取HF;氯、溴主要存在于海水中,工业上常通过电解NaCl饱和溶液制备Cl2,Cl2可用于制取漂白粉。卤水中Br-可通过Cl2氧化、Na2CO3溶液吸收;BrCl能发生水解反应。I2易升华,一种Li-I2二次电池正极界面反应机理如图所示。
下列化学反应表示正确的是( )
A.Li-I2电池正极放电时的电极反应有+2e- 3I-
B.电解饱和NaCl溶液:2NaCl 2Na+Cl2↑
C.BrCl与H2O反应:BrCl+H2O HCl+Br++OH-
D.Br2(g)用Na2CO3溶液吸收:Br2+C Br-+Br+CO2
答案 A
2.★★(2023常州教育学会学业水平监测,9)化工生产中常利用苯催化加氢制备环己烷。一定条件下,在管式反应器中发生反应:
(g)+3H2(g) (g) ΔH=-208.2 kJ·mol-1
下列说法不正确的是( )
A.低温有利于上述反应自发进行
B.上述反应中消耗1 mol苯,释放的热量为208.2 kJ
C.实际投料时,适当增加H2用量,可提高苯的利用率
D.由上述反应可推知,反应(g)+H2(g) (g)的ΔH约为-69.4 kJ·mol-1
答案 D
3.★★(2023南通四模,10)我国科学家研发的一种新型全氯液流电池可用于能量储存。该电池装置如图所示。释能时电极b的反应为Cl2+2e- 2Cl-,下列说法正确的是( )
A.储能时,电极a与电源正极相连
B.释能时,电极a发生的电极反应为NaTi2(PO4)3+2Na++2e- Na3Ti2(PO4)3
C.用Na2SO3溶液代替CCl4吸收Cl2,也能达到储能—释能的效果
D.释能时,吸收桶中溶液质量每减少71 g,理论上电极a应减少46 g
答案 D
4.★★(2023泰州期末,10)某MOFs多孔超分子材料的空腔大小适配N2O4可将其“固定”得到R(如图所示),实现从烟气中分离出N2O4并可制备HNO3。
已知反应2NO2(g) N2O4(g) ΔH<0。下列说法正确的是( )
A.图示过程属于氮的固定
B.高温、高压下有利于从烟气中分离出N2O4
C.R在O2中水洗,可制得HNO3同时实现MOFs再生
D.该MOFs材料也可用于储存H2
答案 C
5.★★(2023南京、盐城一模,10)活性炭基材料烟气脱硝技术备受当前研究者关注,其反应原理为C(s)+2NO(g) CO2(g)+N2(g) ΔH。下列说法错误的是( )
A.增大压强,平衡向脱硝方向移动
B.上述脱硝反应的平衡常数K=
C.若烟气中O2含量过高,可能会产生二次污染
D.每处理标准状况下2.24 L NO,转移电子0.2 mol
答案 A
6.★★(2023北京,4,3分)下列事实能用平衡移动原理解释的是( )
A.H2O2溶液中加入少量MnO2固体,促进H2O2分解
B.密闭烧瓶内的NO2和N2O4的混合气体,受热后颜色加深
C.铁钉放入浓HNO3中,待不再变化后,加热能产生大量红棕色气体
D.锌片与稀H2SO4反应过程中,加入少量CuSO4固体,促进H2的产生
答案 B
7.★★(2023连云港第一次调研,13)烯烃是一种应用广泛的化学原料。烯烃之间存在下列三个反应:
反应Ⅰ:3C4H8(g) 4C3H6(g) ΔH1=+78 kJ·mol-1
反应Ⅱ:2C3H6(g) 3C2H4(g) ΔH2=+117 kJ·mol-1
反应Ⅲ:C4H8(g) 2C2H4(g) ΔH3
在恒压密闭容器中,反应达平衡时,三种组分的物质的量分数x随温度T的变化关系如图所示。下列说法正确的是( )
A.反应Ⅲ的ΔH3=+195 kJ·mol-1
B.700 K时反应Ⅱ的平衡常数Kx<2.0×10-2(以物质的量分数代替平衡浓度)
C.提高C4H8物质的量分数,需研发低温条件下活性好且耐高压的催化剂
D.超过700 K后曲线a下降的原因可能是随着温度升高反应Ⅰ逆向移动,反应Ⅱ正向移动
答案 C
8.★★(2023如皋第一次适应性考试,13)以CO2为原料制取CH3OH是CO2资源化利用的重要途径。在催化剂作用下,以CO2、H2为原料制取CH3OH主要发生如下反应。
反应1:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
反应2:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
向装有催化剂的1 L恒容密闭容器中充入1 mol CO2和1.12 mol H2,测得平衡时CO2的转化率和CH3OH的选择性与温度的关系如图所示。
已知CH3OH的选择性=×100%。下列说法不正确的是( )
A.ΔH1<0、ΔH2>0
B.240 ℃平衡时容器中c(H2O)=0.4 mol·L-1
C.240~320 ℃,温度越高,平衡时CH3OH的物质的量越小
D.由图可知200~280 ℃时温度越高催化剂的活性越弱
答案 D
9.★★(2023前黄高级中学二模,12)亚砷酸(H3AsO3)可用于治疗白血病。亚砷酸在溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH的关系如图所示。下列说法不正确的是 ( )
A.人体血液的pH为7.35~7.45,给药后人体所含砷元素微粒主要是H3AsO3
B.NaH2AsO3可发生电离和水解,溶液显碱性
C.当溶液的pH=11时,3c(As)+2c(HAs)+c(H2As)+c(OH-)=c(H+)
D.用δ表示微粒的物质的量分数,pH=13时δ(As)+δ(HAs)+δ(H2As)≈1
答案 C
10.★★(2023无锡期终教学质量调研,17)乙醇用途广泛且需求量大,寻求制备乙醇的新方法是研究的热点。
(1)CO2电催化制备乙醇。电解原理示意图如图1所示。
①a电极的电极反应式为 。
②有效抑制a电极发生析氢反应的措施有 。
(2)CO2催化加氢制备乙醇。CO2在Co/La4Ga2O9催化剂表面加氢制备乙醇的反应为2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g) ΔH1=-173.3 kJ·mol-1,反应机理如图2所示。
①CO2在Co/La4Ga2O9催化剂表面加氢生成C2H5OH的过程可描述为 。
②制取C2H5OH的过程中可获得的副产物有 。
③随着反应进行,的值 (填“增大”“减小”或“不变”)。
④将n(H2)∶n(CO2)=3∶1的混合气体置于密闭容器中,在3.0 MPa和不同温度下反应达到平衡时,CO2的转化率和C2H5OH的选择性[C2H5OH的选择性=×100%]如图3所示。温度在673~723 K时,CO2的平衡转化率几乎不变,其原因可能为 。
答案 (1)①2CO2+12e-+9H2O C2H5OH+12OH- ②增大KOH浓度、选择合适的电极材料、选择高选择性的电化学催化剂(合理即可)
(2)①CO2在La4Ga2O9的氧空位上失去氧原子变成CO,一部分CO在0价Co原子催化下结合*H转化为*CHx,一部分CO在Co2+催化下转化为*CO,*CO与*CHx结合*H生成乙醇 ②CH4、CH3OH(答CO不扣分) ③增大 ④温度的升高使生成C2H5OH的反应中CO2的平衡转化率下降,副反应中CO2的平衡转化率上升,且上升幅度与下降幅度相当
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025江苏版新教材化学高考第一轮
阶段检测练 化学反应原理
1.★★(2023南通、泰州等八市第二次调研,6)卤族元素单质及其化合物应用广泛。氟在自然界主要存在于萤石(CaF2)中,CaF2与浓硫酸反应可制取HF;氯、溴主要存在于海水中,工业上常通过电解NaCl饱和溶液制备Cl2,Cl2可用于制取漂白粉。卤水中Br-可通过Cl2氧化、Na2CO3溶液吸收;BrCl能发生水解反应。I2易升华,一种Li-I2二次电池正极界面反应机理如图所示。
下列化学反应表示正确的是( )
A.Li-I2电池正极放电时的电极反应有+2e- 3I-
B.电解饱和NaCl溶液:2NaCl 2Na+Cl2↑
C.BrCl与H2O反应:BrCl+H2O HCl+Br++OH-
D.Br2(g)用Na2CO3溶液吸收:Br2+C Br-+Br+CO2
答案 A
2.★★(2023常州教育学会学业水平监测,9)化工生产中常利用苯催化加氢制备环己烷。一定条件下,在管式反应器中发生反应:
(g)+3H2(g) (g) ΔH=-208.2 kJ·mol-1
下列说法不正确的是( )
A.低温有利于上述反应自发进行
B.上述反应中消耗1 mol苯,释放的热量为208.2 kJ
C.实际投料时,适当增加H2用量,可提高苯的利用率
D.由上述反应可推知,反应(g)+H2(g) (g)的ΔH约为-69.4 kJ·mol-1
答案 D
3.★★(2023南通四模,10)我国科学家研发的一种新型全氯液流电池可用于能量储存。该电池装置如图所示。释能时电极b的反应为Cl2+2e- 2Cl-,下列说法正确的是( )
A.储能时,电极a与电源正极相连
B.释能时,电极a发生的电极反应为NaTi2(PO4)3+2Na++2e- Na3Ti2(PO4)3
C.用Na2SO3溶液代替CCl4吸收Cl2,也能达到储能—释能的效果
D.释能时,吸收桶中溶液质量每减少71 g,理论上电极a应减少46 g
答案 D
4.★★(2023泰州期末,10)某MOFs多孔超分子材料的空腔大小适配N2O4可将其“固定”得到R(如图所示),实现从烟气中分离出N2O4并可制备HNO3。
已知反应2NO2(g) N2O4(g) ΔH<0。下列说法正确的是( )
A.图示过程属于氮的固定
B.高温、高压下有利于从烟气中分离出N2O4
C.R在O2中水洗,可制得HNO3同时实现MOFs再生
D.该MOFs材料也可用于储存H2
答案 C
5.★★(2023南京、盐城一模,10)活性炭基材料烟气脱硝技术备受当前研究者关注,其反应原理为C(s)+2NO(g) CO2(g)+N2(g) ΔH。下列说法错误的是( )
A.增大压强,平衡向脱硝方向移动
B.上述脱硝反应的平衡常数K=
C.若烟气中O2含量过高,可能会产生二次污染
D.每处理标准状况下2.24 L NO,转移电子0.2 mol
答案 A
6.★★(2023北京,4,3分)下列事实能用平衡移动原理解释的是( )
A.H2O2溶液中加入少量MnO2固体,促进H2O2分解
B.密闭烧瓶内的NO2和N2O4的混合气体,受热后颜色加深
C.铁钉放入浓HNO3中,待不再变化后,加热能产生大量红棕色气体
D.锌片与稀H2SO4反应过程中,加入少量CuSO4固体,促进H2的产生
答案 B
7.★★(2023连云港第一次调研,13)烯烃是一种应用广泛的化学原料。烯烃之间存在下列三个反应:
反应Ⅰ:3C4H8(g) 4C3H6(g) ΔH1=+78 kJ·mol-1
反应Ⅱ:2C3H6(g) 3C2H4(g) ΔH2=+117 kJ·mol-1
反应Ⅲ:C4H8(g) 2C2H4(g) ΔH3
在恒压密闭容器中,反应达平衡时,三种组分的物质的量分数x随温度T的变化关系如图所示。下列说法正确的是( )
A.反应Ⅲ的ΔH3=+195 kJ·mol-1
B.700 K时反应Ⅱ的平衡常数Kx<2.0×10-2(以物质的量分数代替平衡浓度)
C.提高C4H8物质的量分数,需研发低温条件下活性好且耐高压的催化剂
D.超过700 K后曲线a下降的原因可能是随着温度升高反应Ⅰ逆向移动,反应Ⅱ正向移动
答案 C
8.★★(2023如皋第一次适应性考试,13)以CO2为原料制取CH3OH是CO2资源化利用的重要途径。在催化剂作用下,以CO2、H2为原料制取CH3OH主要发生如下反应。
反应1:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
反应2:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
向装有催化剂的1 L恒容密闭容器中充入1 mol CO2和1.12 mol H2,测得平衡时CO2的转化率和CH3OH的选择性与温度的关系如图所示。
已知CH3OH的选择性=×100%。下列说法不正确的是( )
A.ΔH1<0、ΔH2>0
B.240 ℃平衡时容器中c(H2O)=0.4 mol·L-1
C.240~320 ℃,温度越高,平衡时CH3OH的物质的量越小
D.由图可知200~280 ℃时温度越高催化剂的活性越弱
答案 D
9.★★(2023前黄高级中学二模,12)亚砷酸(H3AsO3)可用于治疗白血病。亚砷酸在溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH的关系如图所示。下列说法不正确的是 ( )
A.人体血液的pH为7.35~7.45,给药后人体所含砷元素微粒主要是H3AsO3
B.NaH2AsO3可发生电离和水解,溶液显碱性
C.当溶液的pH=11时,3c(As)+2c(HAs)+c(H2As)+c(OH-)=c(H+)
D.用δ表示微粒的物质的量分数,pH=13时δ(As)+δ(HAs)+δ(H2As)≈1
答案 C
10.★★(2023无锡期终教学质量调研,17)乙醇用途广泛且需求量大,寻求制备乙醇的新方法是研究的热点。
(1)CO2电催化制备乙醇。电解原理示意图如图1所示。
①a电极的电极反应式为 。
②有效抑制a电极发生析氢反应的措施有 。
(2)CO2催化加氢制备乙醇。CO2在Co/La4Ga2O9催化剂表面加氢制备乙醇的反应为2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g) ΔH1=-173.3 kJ·mol-1,反应机理如图2所示。
①CO2在Co/La4Ga2O9催化剂表面加氢生成C2H5OH的过程可描述为 。
②制取C2H5OH的过程中可获得的副产物有 。
③随着反应进行,的值 (填“增大”“减小”或“不变”)。
④将n(H2)∶n(CO2)=3∶1的混合气体置于密闭容器中,在3.0 MPa和不同温度下反应达到平衡时,CO2的转化率和C2H5OH的选择性[C2H5OH的选择性=×100%]如图3所示。温度在673~723 K时,CO2的平衡转化率几乎不变,其原因可能为 。
答案 (1)①2CO2+12e-+9H2O C2H5OH+12OH- ②增大KOH浓度、选择合适的电极材料、选择高选择性的电化学催化剂(合理即可)
(2)①CO2在La4Ga2O9的氧空位上失去氧原子变成CO,一部分CO在0价Co原子催化下结合*H转化为*CHx,一部分CO在Co2+催化下转化为*CO,*CO与*CHx结合*H生成乙醇 ②CH4、CH3OH(答CO不扣分) ③增大 ④温度的升高使生成C2H5OH的反应中CO2的平衡转化率下降,副反应中CO2的平衡转化率上升,且上升幅度与下降幅度相当
阶段检测练 化学反应原理
1.★★(2023南通、泰州等八市第二次调研,6)卤族元素单质及其化合物应用广泛。氟在自然界主要存在于萤石(CaF2)中,CaF2与浓硫酸反应可制取HF;氯、溴主要存在于海水中,工业上常通过电解NaCl饱和溶液制备Cl2,Cl2可用于制取漂白粉。卤水中Br-可通过Cl2氧化、Na2CO3溶液吸收;BrCl能发生水解反应。I2易升华,一种Li-I2二次电池正极界面反应机理如图所示。
下列化学反应表示正确的是( )
A.Li-I2电池正极放电时的电极反应有+2e- 3I-
B.电解饱和NaCl溶液:2NaCl 2Na+Cl2↑
C.BrCl与H2O反应:BrCl+H2O HCl+Br++OH-
D.Br2(g)用Na2CO3溶液吸收:Br2+C Br-+Br+CO2
答案 A
2.★★(2023常州教育学会学业水平监测,9)化工生产中常利用苯催化加氢制备环己烷。一定条件下,在管式反应器中发生反应:
(g)+3H2(g) (g) ΔH=-208.2 kJ·mol-1
下列说法不正确的是( )
A.低温有利于上述反应自发进行
B.上述反应中消耗1 mol苯,释放的热量为208.2 kJ
C.实际投料时,适当增加H2用量,可提高苯的利用率
D.由上述反应可推知,反应(g)+H2(g) (g)的ΔH约为-69.4 kJ·mol-1
答案 D
3.★★(2023南通四模,10)我国科学家研发的一种新型全氯液流电池可用于能量储存。该电池装置如图所示。释能时电极b的反应为Cl2+2e- 2Cl-,下列说法正确的是( )
A.储能时,电极a与电源正极相连
B.释能时,电极a发生的电极反应为NaTi2(PO4)3+2Na++2e- Na3Ti2(PO4)3
C.用Na2SO3溶液代替CCl4吸收Cl2,也能达到储能—释能的效果
D.释能时,吸收桶中溶液质量每减少71 g,理论上电极a应减少46 g
答案 D
4.★★(2023泰州期末,10)某MOFs多孔超分子材料的空腔大小适配N2O4可将其“固定”得到R(如图所示),实现从烟气中分离出N2O4并可制备HNO3。
已知反应2NO2(g) N2O4(g) ΔH<0。下列说法正确的是( )
A.图示过程属于氮的固定
B.高温、高压下有利于从烟气中分离出N2O4
C.R在O2中水洗,可制得HNO3同时实现MOFs再生
D.该MOFs材料也可用于储存H2
答案 C
5.★★(2023南京、盐城一模,10)活性炭基材料烟气脱硝技术备受当前研究者关注,其反应原理为C(s)+2NO(g) CO2(g)+N2(g) ΔH。下列说法错误的是( )
A.增大压强,平衡向脱硝方向移动
B.上述脱硝反应的平衡常数K=
C.若烟气中O2含量过高,可能会产生二次污染
D.每处理标准状况下2.24 L NO,转移电子0.2 mol
答案 A
6.★★(2023北京,4,3分)下列事实能用平衡移动原理解释的是( )
A.H2O2溶液中加入少量MnO2固体,促进H2O2分解
B.密闭烧瓶内的NO2和N2O4的混合气体,受热后颜色加深
C.铁钉放入浓HNO3中,待不再变化后,加热能产生大量红棕色气体
D.锌片与稀H2SO4反应过程中,加入少量CuSO4固体,促进H2的产生
答案 B
7.★★(2023连云港第一次调研,13)烯烃是一种应用广泛的化学原料。烯烃之间存在下列三个反应:
反应Ⅰ:3C4H8(g) 4C3H6(g) ΔH1=+78 kJ·mol-1
反应Ⅱ:2C3H6(g) 3C2H4(g) ΔH2=+117 kJ·mol-1
反应Ⅲ:C4H8(g) 2C2H4(g) ΔH3
在恒压密闭容器中,反应达平衡时,三种组分的物质的量分数x随温度T的变化关系如图所示。下列说法正确的是( )
A.反应Ⅲ的ΔH3=+195 kJ·mol-1
B.700 K时反应Ⅱ的平衡常数Kx<2.0×10-2(以物质的量分数代替平衡浓度)
C.提高C4H8物质的量分数,需研发低温条件下活性好且耐高压的催化剂
D.超过700 K后曲线a下降的原因可能是随着温度升高反应Ⅰ逆向移动,反应Ⅱ正向移动
答案 C
8.★★(2023如皋第一次适应性考试,13)以CO2为原料制取CH3OH是CO2资源化利用的重要途径。在催化剂作用下,以CO2、H2为原料制取CH3OH主要发生如下反应。
反应1:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
反应2:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
向装有催化剂的1 L恒容密闭容器中充入1 mol CO2和1.12 mol H2,测得平衡时CO2的转化率和CH3OH的选择性与温度的关系如图所示。
已知CH3OH的选择性=×100%。下列说法不正确的是( )
A.ΔH1<0、ΔH2>0
B.240 ℃平衡时容器中c(H2O)=0.4 mol·L-1
C.240~320 ℃,温度越高,平衡时CH3OH的物质的量越小
D.由图可知200~280 ℃时温度越高催化剂的活性越弱
答案 D
9.★★(2023前黄高级中学二模,12)亚砷酸(H3AsO3)可用于治疗白血病。亚砷酸在溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH的关系如图所示。下列说法不正确的是 ( )
A.人体血液的pH为7.35~7.45,给药后人体所含砷元素微粒主要是H3AsO3
B.NaH2AsO3可发生电离和水解,溶液显碱性
C.当溶液的pH=11时,3c(As)+2c(HAs)+c(H2As)+c(OH-)=c(H+)
D.用δ表示微粒的物质的量分数,pH=13时δ(As)+δ(HAs)+δ(H2As)≈1
答案 C
10.★★(2023无锡期终教学质量调研,17)乙醇用途广泛且需求量大,寻求制备乙醇的新方法是研究的热点。
(1)CO2电催化制备乙醇。电解原理示意图如图1所示。
①a电极的电极反应式为 。
②有效抑制a电极发生析氢反应的措施有 。
(2)CO2催化加氢制备乙醇。CO2在Co/La4Ga2O9催化剂表面加氢制备乙醇的反应为2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g) ΔH1=-173.3 kJ·mol-1,反应机理如图2所示。
①CO2在Co/La4Ga2O9催化剂表面加氢生成C2H5OH的过程可描述为 。
②制取C2H5OH的过程中可获得的副产物有 。
③随着反应进行,的值 (填“增大”“减小”或“不变”)。
④将n(H2)∶n(CO2)=3∶1的混合气体置于密闭容器中,在3.0 MPa和不同温度下反应达到平衡时,CO2的转化率和C2H5OH的选择性[C2H5OH的选择性=×100%]如图3所示。温度在673~723 K时,CO2的平衡转化率几乎不变,其原因可能为 。
答案 (1)①2CO2+12e-+9H2O C2H5OH+12OH- ②增大KOH浓度、选择合适的电极材料、选择高选择性的电化学催化剂(合理即可)
(2)①CO2在La4Ga2O9的氧空位上失去氧原子变成CO,一部分CO在0价Co原子催化下结合*H转化为*CHx,一部分CO在Co2+催化下转化为*CO,*CO与*CHx结合*H生成乙醇 ②CH4、CH3OH(答CO不扣分) ③增大 ④温度的升高使生成C2H5OH的反应中CO2的平衡转化率下降,副反应中CO2的平衡转化率上升,且上升幅度与下降幅度相当
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
