2025江苏版新教材化学高考第一轮基础练习--专题七 原子结构 元素周期律(含答案)
文档属性
| 名称 | 2025江苏版新教材化学高考第一轮基础练习--专题七 原子结构 元素周期律(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 437.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-16 00:00:00 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2025江苏版新教材化学高考第一轮
专题七 原子结构 元素周期律
五年高考
考点过关练
考点1 原子结构
1.★(2020江苏,2,2分)反应8NH3+3Cl2 6NH4Cl+N2可用于氯气管道的检漏。下列表示相关微粒的化学用语正确的是( )
A.中子数为9的氮原子N
B.N2分子的电子式:N N
C.Cl2分子的结构式:Cl—Cl
D.Cl-的结构示意图:
答案 C
2.★(2019江苏,2,2分)反应NH4Cl+NaNO2 NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是( )
A.中子数为18的氯原子Cl
B.N2的结构式:
C.Na+的结构示意图:
D.H2O的电子式:
答案 D
3.★(2021江苏,2,2分)反应Cl2+2NaOHNaClO+NaCl+H2O可用于制备含氯消毒剂。下列说法正确的是( )
A.Cl2是极性分子
B.NaOH的电子式为
C.NaClO既含离子键又含共价键
D.Cl-与Na+具有相同的电子层结构
答案 C
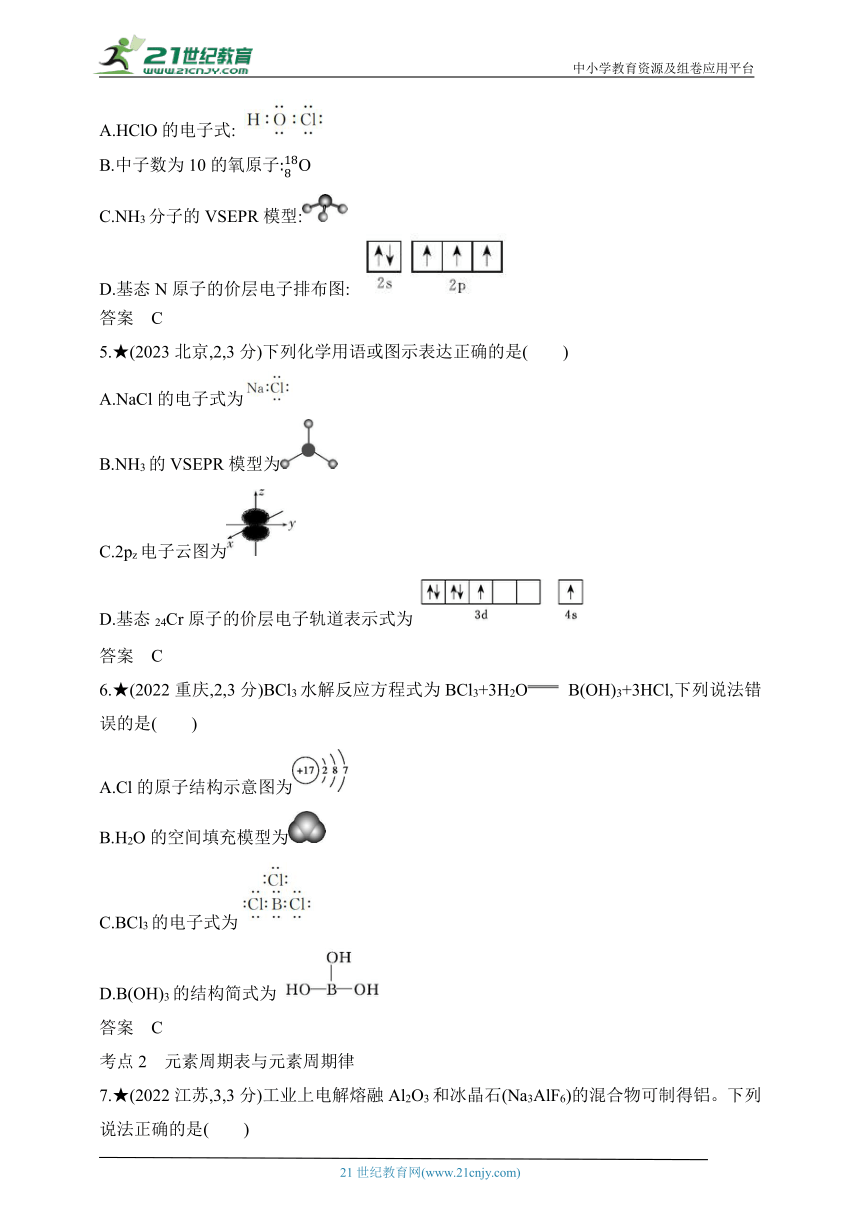
4.★(2023湖南,2,3分)下列化学用语表述错误的是 ( )
A.HClO的电子式:
B.中子数为10的氧原子O
C.NH3分子的VSEPR模型:
D.基态N原子的价层电子排布图:
答案 C
5.★(2023北京,2,3分)下列化学用语或图示表达正确的是( )
A.NaCl的电子式为
B.NH3的VSEPR模型为
C.2pz电子云图为
D.基态24Cr原子的价层电子轨道表示式为
答案 C
6.★(2022重庆,2,3分)BCl3水解反应方程式为BCl3+3H2O B(OH)3+3HCl,下列说法错误的是( )
A.Cl的原子结构示意图为
B.H2O的空间填充模型为
C.BCl3的电子式为
D.B(OH)3的结构简式为
答案 C
考点2 元素周期表与元素周期律
7.★(2022江苏,3,3分)工业上电解熔融Al2O3和冰晶石(Na3AlF6)的混合物可制得铝。下列说法正确的是( )
A.半径大小:r(Al3+)B.电负性大小:χ(F)< χ(O)
C.电离能大小:I1(O)D.碱性强弱:NaOH答案 A
8.★(2023江苏,4,3分)元素C、Si、Ge位于周期表中ⅣA族。下列说法正确的是( )
A.原子半径:r(C)>r(Si)>r(Ge)
B.第一电离能:I1(C)C.碳单质、晶体硅、SiC均为共价晶体
D.可在周期表中元素Si附近寻找新半导体材料
答案 D
9.★★(2023全国甲,11,6分)W、X、Y、Z为短周期主族元素,原子序数依次增大,最外层电子数之和为19。Y的最外层电子数与其K层电子数相等,WX2是形成酸雨的物质之一。下列说法正确的是( )
A.原子半径:X>W
B.简单氢化物的沸点:XC.Y与X可形成离子化合物
D.Z的最高价含氧酸是弱酸
答案 C
10.★★(2021江苏,5,3分)前4周期主族元素X、Y、Z、W的原子序数依次增大,X是空气中含量最多的元素,Y的周期序数与族序数相等,基态时Z原子3p原子轨道上有5个电子,W与Z处于同一主族。下列说法正确的是 ( )
A.原子半径:r(X)B.X的第一电离能比同周期相邻元素的大
C.Y的最高价氧化物对应水化物的酸性比Z的强
D.Z的简单气态氢化物的热稳定性比W的弱
答案 B
11.★★(2023湖北,6,3分)W、X、Y、Z为原子序数依次增加的同一短周期元素,其中X、Y、Z相邻,W的核外电子数与X的价层电子数相等,Z2是氧化性最强的单质,4种元素可形成离子化合物(XY)+(WZ4)-。下列说法正确的是( )
A.分子的极性:WZ3B.第一电离能:XC.氧化性:X2Y3D.键能:X2答案 A
12.★★(2022海南,11,4分)短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y同周期并相邻,Y是组成水的元素之一,Z在同周期主族元素中金属性最强,W原子在同周期主族元素中原子半径最小。下列判断正确的是( )
A.XW3是非极性分子
B.简单氢化物沸点:X>Y
C.Y与Z形成的化合物是离子化合物
D.X、Y、Z三种元素组成的化合物水溶液呈酸性
答案 C
13.★★(2023浙江6月选考,11,3分)X、Y、Z、W四种短周期主族元素,原子序数依次增大。X、Y与Z位于同一周期,且只有X、Y元素相邻。X基态原子核外有2个未成对电子,W原子在同周期中原子半径最大。下列说法不正确的是( )
A.第一电离能:Y>Z>X
B.电负性:Z>Y>X>W
C.Z、W原子形成稀有气体电子构型的简单离子的半径:WD.W2X2与水反应生成产物之一是非极性分子
答案 A
14.★★(2019江苏,8,2分)短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层有2个电子,Z的单质晶体是应用最广泛的半导体材料,W与X位于同一主族。下列说法正确的是 ( )
A.原子半径:r(W)>r(Z)>r(Y)>r(X)
B.由X、Y组成的化合物是离子化合物
C.Z的最高价氧化物对应水化物的酸性比W的强
D.W的简单气态氢化物的热稳定性比X的强
答案 B
15.★★(2023浙江1月选考,10,3分)X、Y、Z、M、Q五种短周期元素,原子序数依次增大。X的2s轨道全充满,Y的s能级电子数量是p能级的两倍,M是地壳中含量最多的元素,Q是纯碱中的一种元素。下列说法不正确的是( )
A.电负性:Z>X
B.最高正价:ZC.Q与M的化合物中可能含有非极性共价键
D.最高价氧化物对应水化物的酸性:Z>Y
答案 B
16.★★(2022辽宁,5,3分)短周期元素X、Y、Z、W、Q原子序数依次增大。基态X、Z、Q原子均有两个单电子,W简单离子在同周期离子中半径最小,Q与Z同主族。下列说法错误的是 ( )
A.X能与多种元素形成共价键
B.简单氢化物沸点:ZC.第一电离能:Y>Z
D.电负性:W答案 B
17.★★(2022福建,4,4分)某非线性光学晶体由钾元素(K)和原子序数依次增大的X、Y、Z、W四种短周期元素组成。X与Y、Z与W均为同周期相邻元素,X的核外电子总数为最外层电子数的2倍。Z为地壳中含量最多的元素。下列说法正确的是( )
A.简单氢化物沸点:Z>W
B.YW3分子的空间构型为三角锥形
C.原子半径:YD.最高价氧化物对应水化物的碱性:X答案 A
18.★★(2023全国乙,10,6分)一种矿物由短周期元素W、X、Y组成,溶于稀盐酸有无色无味气体生成。W、X、Y原子序数依次增大。简单离子X2-与Y2+具有相同的电子结构。下列叙述正确的是( )
A.X的常见化合价有-1、-2
B.原子半径大小为Y>X>W
C.YX的水合物具有两性
D.W单质只有4种同素异形体
答案 A
考法强化练
考法 元素推断题解题策略
1.★★(2021浙江6月选考,15,2分)已知短周期元素X、Y、Z、M、Q和R在周期表中的相对位置如图所示,其中Y的最高化合价为+3。下列说法不正确的是( )
A.还原性:ZQ2B.X能从ZO2中置换出Z
C.Y能与Fe2O3反应得到Fe
D.M最高价氧化物的水化物能与其最低价氢化物反应
答案 A
2.★★(2022河北,6,3分)中子轰击X原子的核反应为Xn→YH,其中Y可用于测定文物年代。下列说法错误的是( )
A.原子半径:Y>X
B.Y的电子式为
C.最高价含氧酸的酸性:Y>X
D.X与Y均能形成多种氢化物
答案 C
3.★★(2023广东,14,4分)化合物XYZ4ME4可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为nsn-1,X与M同周期,E在地壳中含量最多。下列说法正确的是( )
A.元素电负性:E>Y>Z
B.氢化物沸点:M>Y>E
C.第一电离能:X>E>Y
D.YZ3和Y的空间结构均为三角锥形
答案 A
4.★★(2022河北,10,4分)两种化合物的结构如下,其中X、Y、Z、R、Q是原子序数依次增大的五种短周期主族元素。下列说法错误的是 ( )
A.在两种化合物中,X、Y、Z、R、Q均满足最外层8电子稳定结构
B.X、Y、Z、R、Q中,R的非金属性及简单氢化物的稳定性均最强
C.将装有YZ2气体的透明密闭容器浸入冰水中,气体颜色变浅
D.Z的某种同素异形体在大气中的含量与环境污染密切相关
答案 A
5.★★(2021广东,13,4分)一种麻醉剂的分子结构式如图所示。其中,X的原子核只有1个质子;元素Y、Z、W原子序数依次增大,且均位于X的下一周期;元素E的原子比W原子多8个电子。下列说法不正确的是 ( )
A.XEZ4是一种强酸
B.原子半径:Y>W>E
C.非金属性:W>Z>Y
D.ZW2中,Z的化合价为+2价
答案 B
6.★★(2023湖南,6,3分)日光灯中用到的某种荧光粉的主要成分为3W3(ZX4)2·WY2。已知:X、Y、Z和W为原子序数依次增大的前20号元素,W为金属元素。基态X原子s轨道上的电子数和p轨道上的电子数相等,基态X、Y、Z原子的未成对电子数之比为2∶1∶3。下列说法正确的是( )
A.电负性:X>Y>Z>W
B.原子半径:XC.Y和W的单质都能与水反应生成气体
D.Z元素最高价氧化物对应的水化物具有强氧化性
答案 C
7.★★(2022全国乙,11,6分)化合物(YW4X5Z8·4W2Z)可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。YZ2分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在200 ℃以下热分解时无刺激性气体逸出。下列叙述正确的是( )
A.W、X、Y、Z的单质常温下均为气体
B.最高价氧化物的水化物酸性:YC.100~200 ℃阶段热分解失去4个W2Z
D.500 ℃热分解后生成固体化合物X2Z3
答案 D
三年模拟
考点强化练
考点1 原子结构
1.★(2024届无锡期中教学质量调研,2)向CuSO4溶液中通入H2S,发生反应:CuSO4+H2S CuS↓+H2SO4。下列有关说法正确的是 ( )
A.H2S的电子式为
B.S中硫原子的杂化类型为sp3
C.基态Cu2+的核外电子排布式为[Ar]3d10
D.基态O原子核外电子轨道表示式为
答案 B
2.★(2024届泰州中学期初调研,2)下列化学用语或图示表达正确的是( )
A.H2S分子的球棍模型:
B.NH3的VSEPR模型:
C.基态24Cr原子价层电子轨道表示式:
↑ ↑ ↑ ↑ ↑
D.2pz电子云轮廓图:
答案 D
3.★(2023南京二模,2)OF2是良好的氧化剂和氟化剂,可通过反应2F2+2NaOH 2NaF+H2O+OF2制备,下列说法正确的是( )
A.F2的电子式为F··F
B.OF2是非极性分子
C.NaF是共价化合物
D.基态Na原子的价层电子排布式为3s1
答案 D
4.★(2023苏锡常镇四市第一次调研,2)人们在金星大气中探测到PH3,据此推断金星大气层或存在生命。反应P4+3KOH+3H2O 3KH2PO2+PH3↑可制备PH3。下列说法正确的是( )
A.P4为极性分子
B.K+的结构示意图为
C.PH3的电子式为
D.KH2PO2中含有离子键和共价键
答案 D
5.★(2023泰州期末,2)胍()的盐是病毒核酸保存液的重要成分。下列说法正确的是( )
A.胍分子间能够形成氢键
B.胍中σ键与π键的数目之比为3∶1
C.氨基(—NH2)的电子式为
D.中子数为8的N原子可表示为N
答案 A
考点2 元素周期表与元素周期律
6.★(2024届盐城联盟校第一次调研,3)明矾[KAl(SO4)2·12H2O]可用于净水。下列说法正确的是( )
A.半径大小:r(K+)B.电负性大小:χ(S)<χ(O)
C.电离能大小:I1(O)D.碱性强弱:KOH答案 B
7.★(2024届南通海安开学考,4)元素P、As、Sb分别位于周期表中三、四、五周期ⅤA族。下列说法不正确的是( )
A.原子半径:r(P)B.第一电离能:I1(P)>I1(As)>I1(Sb)
C.P的简单气态氢化物的热稳定性比As的强
D.ⅤA族元素单质的晶体类型相同
答案 D
8.★(2024届南通如东开学考,4)元素Ge、As、Se是周期表中第四周期主族元素,下列说法正确的是( )
A.原子半径:r(Ge)B.电负性:χ(Ge)<χ(As)<χ(Se)
C.第一电离能:I1(Ge)D.古氏试砷法的原理是AsH3与硝酸银溶液反应生成银单质,体现了AsH3具有极强的氧化性
答案 B
9.★(2023南京、盐城二模,3)由SiCl4制备高纯SiH4的反应为SiCl4+LiAlH4 SiH4↑+LiCl+AlCl3。下列说法正确的是( )
A.热稳定性:HCl>SiH4
B.离子半径:r(Li+)>r(H-)
C.第一电离能:I1(Al)>I1(Cl)
D.共价键的极性:Si—Cl>Al—Cl
答案 A
10.★★(2024届扬州期初考试,4)CrSi、Ge-GaAs、ZnGeAs2和碳化硅都是重要的半导体化合物,下列说法错误的是( )
A.基态铬原子的价电子排布式为3d54s1
B.Ge-GaAs中元素Ge、Ga、As的第一电离能由大到小的顺序为As>Ga>Ge
C.ZnGeAs2中元素Zn、Ge、As的电负性由大到小的顺序为As>Ge>Zn
D.碳化硅属于共价晶体,其熔、沸点均大于晶体硅
答案 B
11.★★(2023南通、泰州等七市第三次调研,4)前四周期主族元素X、Y、Z、W的原子序数依次增大。X元素位于p区,且基态X原子中成对电子数是未成对电子数的2倍,金属元素Y的第一电离能比同周期相邻元素的大,Z元素单质常温下为黄绿色气体,W与Y同主族。下列说法正确的是( )
A.简单离子半径:W>Z>Y
B.化合物WX2中阴、阳离子个数比为2∶1
C.工业上常用钢瓶储运Z单质
D.最高价氧化物对应水化物的碱性:Y>W
答案 C
考法综合练
考法 元素推断题解题策略
1.★★(2024届海安高级中学第一次考试,4)X、Y、Z、W是原子序数依次增大的短周期元素。X和Y基态原子的s能级电子总数均等于其p能级电子总数,Z原子的最外层电子数是Y原子最外层电子数的2倍,W和X位于同一主族。下列说法正确的是( )
A.第一电离能:I1(X)B.最高价氧化物对应水化物的酸性:Z>W
C.原子半径:r(W)>r(Y)>r(X)
D.简单气态氢化物的热稳定性:X>Z
答案 D
2.★★(2023前黄、姜堰等四校联考,3)著名的观赏石——崂山绿石主要成分可表示为YxFey[Z4O10](OH)2·W3(OH)6,其中W、Y、Z表示三种原子序数依次增大的第三周期元素,W没有未成对电子,Z的最高正价与最低负价的代数和为0。下列说法不正确的是( )
A.Y的离子半径在同周期元素的简单离子中最小
B.W、Y、Z的最高价氧化物对应的水化物都属于弱电解质
C.Z的简单氢化物分子间存在氢键
D.三种元素的电负性由大到小的顺序为Z>Y>W
答案 C
3.★★(2023前黄高级中学二模,9)一种用作锂离子电池电解质的锂盐的阴离子结构如图所示,X、Y、Z、W为原子序数依次增大的短周期主族元素,W的核外电子中有3个未成对电子。下列说法正确的是( )
A.W元素最高价氧化物对应的水化物是强酸
B.该阴离子中不存在非极性键
C.X的氢化物沸点可能高于Z的氢化物
D.该离子中所有原子最外层均为8电子结构
答案 C
专题七 原子结构 元素周期律
五年高考
考点过关练
考点1 原子结构
1.★(2020江苏,2,2分)反应8NH3+3Cl2 6NH4Cl+N2可用于氯气管道的检漏。下列表示相关微粒的化学用语正确的是( )
A.中子数为9的氮原子N
B.N2分子的电子式:N N
C.Cl2分子的结构式:Cl—Cl
D.Cl-的结构示意图:
答案 C
2.★(2019江苏,2,2分)反应NH4Cl+NaNO2 NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是( )
A.中子数为18的氯原子Cl
B.N2的结构式:
C.Na+的结构示意图:
D.H2O的电子式:
答案 D
3.★(2021江苏,2,2分)反应Cl2+2NaOHNaClO+NaCl+H2O可用于制备含氯消毒剂。下列说法正确的是( )
A.Cl2是极性分子
B.NaOH的电子式为
C.NaClO既含离子键又含共价键
D.Cl-与Na+具有相同的电子层结构
答案 C
4.★(2023湖南,2,3分)下列化学用语表述错误的是 ( )
A.HClO的电子式:
B.中子数为10的氧原子O
C.NH3分子的VSEPR模型:
D.基态N原子的价层电子排布图:
答案 C
5.★(2023北京,2,3分)下列化学用语或图示表达正确的是( )
A.NaCl的电子式为
B.NH3的VSEPR模型为
C.2pz电子云图为
D.基态24Cr原子的价层电子轨道表示式为
答案 C
6.★(2022重庆,2,3分)BCl3水解反应方程式为BCl3+3H2O B(OH)3+3HCl,下列说法错误的是( )
A.Cl的原子结构示意图为
B.H2O的空间填充模型为
C.BCl3的电子式为
D.B(OH)3的结构简式为
答案 C
考点2 元素周期表与元素周期律
7.★(2022江苏,3,3分)工业上电解熔融Al2O3和冰晶石(Na3AlF6)的混合物可制得铝。下列说法正确的是( )
A.半径大小:r(Al3+)B.电负性大小:χ(F)< χ(O)
C.电离能大小:I1(O)D.碱性强弱:NaOH答案 A
8.★(2023江苏,4,3分)元素C、Si、Ge位于周期表中ⅣA族。下列说法正确的是( )
A.原子半径:r(C)>r(Si)>r(Ge)
B.第一电离能:I1(C)C.碳单质、晶体硅、SiC均为共价晶体
D.可在周期表中元素Si附近寻找新半导体材料
答案 D
9.★★(2023全国甲,11,6分)W、X、Y、Z为短周期主族元素,原子序数依次增大,最外层电子数之和为19。Y的最外层电子数与其K层电子数相等,WX2是形成酸雨的物质之一。下列说法正确的是( )
A.原子半径:X>W
B.简单氢化物的沸点:XC.Y与X可形成离子化合物
D.Z的最高价含氧酸是弱酸
答案 C
10.★★(2021江苏,5,3分)前4周期主族元素X、Y、Z、W的原子序数依次增大,X是空气中含量最多的元素,Y的周期序数与族序数相等,基态时Z原子3p原子轨道上有5个电子,W与Z处于同一主族。下列说法正确的是 ( )
A.原子半径:r(X)B.X的第一电离能比同周期相邻元素的大
C.Y的最高价氧化物对应水化物的酸性比Z的强
D.Z的简单气态氢化物的热稳定性比W的弱
答案 B
11.★★(2023湖北,6,3分)W、X、Y、Z为原子序数依次增加的同一短周期元素,其中X、Y、Z相邻,W的核外电子数与X的价层电子数相等,Z2是氧化性最强的单质,4种元素可形成离子化合物(XY)+(WZ4)-。下列说法正确的是( )
A.分子的极性:WZ3B.第一电离能:XC.氧化性:X2Y3D.键能:X2答案 A
12.★★(2022海南,11,4分)短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y同周期并相邻,Y是组成水的元素之一,Z在同周期主族元素中金属性最强,W原子在同周期主族元素中原子半径最小。下列判断正确的是( )
A.XW3是非极性分子
B.简单氢化物沸点:X>Y
C.Y与Z形成的化合物是离子化合物
D.X、Y、Z三种元素组成的化合物水溶液呈酸性
答案 C
13.★★(2023浙江6月选考,11,3分)X、Y、Z、W四种短周期主族元素,原子序数依次增大。X、Y与Z位于同一周期,且只有X、Y元素相邻。X基态原子核外有2个未成对电子,W原子在同周期中原子半径最大。下列说法不正确的是( )
A.第一电离能:Y>Z>X
B.电负性:Z>Y>X>W
C.Z、W原子形成稀有气体电子构型的简单离子的半径:WD.W2X2与水反应生成产物之一是非极性分子
答案 A
14.★★(2019江苏,8,2分)短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层有2个电子,Z的单质晶体是应用最广泛的半导体材料,W与X位于同一主族。下列说法正确的是 ( )
A.原子半径:r(W)>r(Z)>r(Y)>r(X)
B.由X、Y组成的化合物是离子化合物
C.Z的最高价氧化物对应水化物的酸性比W的强
D.W的简单气态氢化物的热稳定性比X的强
答案 B
15.★★(2023浙江1月选考,10,3分)X、Y、Z、M、Q五种短周期元素,原子序数依次增大。X的2s轨道全充满,Y的s能级电子数量是p能级的两倍,M是地壳中含量最多的元素,Q是纯碱中的一种元素。下列说法不正确的是( )
A.电负性:Z>X
B.最高正价:ZC.Q与M的化合物中可能含有非极性共价键
D.最高价氧化物对应水化物的酸性:Z>Y
答案 B
16.★★(2022辽宁,5,3分)短周期元素X、Y、Z、W、Q原子序数依次增大。基态X、Z、Q原子均有两个单电子,W简单离子在同周期离子中半径最小,Q与Z同主族。下列说法错误的是 ( )
A.X能与多种元素形成共价键
B.简单氢化物沸点:ZC.第一电离能:Y>Z
D.电负性:W答案 B
17.★★(2022福建,4,4分)某非线性光学晶体由钾元素(K)和原子序数依次增大的X、Y、Z、W四种短周期元素组成。X与Y、Z与W均为同周期相邻元素,X的核外电子总数为最外层电子数的2倍。Z为地壳中含量最多的元素。下列说法正确的是( )
A.简单氢化物沸点:Z>W
B.YW3分子的空间构型为三角锥形
C.原子半径:YD.最高价氧化物对应水化物的碱性:X答案 A
18.★★(2023全国乙,10,6分)一种矿物由短周期元素W、X、Y组成,溶于稀盐酸有无色无味气体生成。W、X、Y原子序数依次增大。简单离子X2-与Y2+具有相同的电子结构。下列叙述正确的是( )
A.X的常见化合价有-1、-2
B.原子半径大小为Y>X>W
C.YX的水合物具有两性
D.W单质只有4种同素异形体
答案 A
考法强化练
考法 元素推断题解题策略
1.★★(2021浙江6月选考,15,2分)已知短周期元素X、Y、Z、M、Q和R在周期表中的相对位置如图所示,其中Y的最高化合价为+3。下列说法不正确的是( )
A.还原性:ZQ2B.X能从ZO2中置换出Z
C.Y能与Fe2O3反应得到Fe
D.M最高价氧化物的水化物能与其最低价氢化物反应
答案 A
2.★★(2022河北,6,3分)中子轰击X原子的核反应为Xn→YH,其中Y可用于测定文物年代。下列说法错误的是( )
A.原子半径:Y>X
B.Y的电子式为
C.最高价含氧酸的酸性:Y>X
D.X与Y均能形成多种氢化物
答案 C
3.★★(2023广东,14,4分)化合物XYZ4ME4可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为nsn-1,X与M同周期,E在地壳中含量最多。下列说法正确的是( )
A.元素电负性:E>Y>Z
B.氢化物沸点:M>Y>E
C.第一电离能:X>E>Y
D.YZ3和Y的空间结构均为三角锥形
答案 A
4.★★(2022河北,10,4分)两种化合物的结构如下,其中X、Y、Z、R、Q是原子序数依次增大的五种短周期主族元素。下列说法错误的是 ( )
A.在两种化合物中,X、Y、Z、R、Q均满足最外层8电子稳定结构
B.X、Y、Z、R、Q中,R的非金属性及简单氢化物的稳定性均最强
C.将装有YZ2气体的透明密闭容器浸入冰水中,气体颜色变浅
D.Z的某种同素异形体在大气中的含量与环境污染密切相关
答案 A
5.★★(2021广东,13,4分)一种麻醉剂的分子结构式如图所示。其中,X的原子核只有1个质子;元素Y、Z、W原子序数依次增大,且均位于X的下一周期;元素E的原子比W原子多8个电子。下列说法不正确的是 ( )
A.XEZ4是一种强酸
B.原子半径:Y>W>E
C.非金属性:W>Z>Y
D.ZW2中,Z的化合价为+2价
答案 B
6.★★(2023湖南,6,3分)日光灯中用到的某种荧光粉的主要成分为3W3(ZX4)2·WY2。已知:X、Y、Z和W为原子序数依次增大的前20号元素,W为金属元素。基态X原子s轨道上的电子数和p轨道上的电子数相等,基态X、Y、Z原子的未成对电子数之比为2∶1∶3。下列说法正确的是( )
A.电负性:X>Y>Z>W
B.原子半径:XC.Y和W的单质都能与水反应生成气体
D.Z元素最高价氧化物对应的水化物具有强氧化性
答案 C
7.★★(2022全国乙,11,6分)化合物(YW4X5Z8·4W2Z)可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。YZ2分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在200 ℃以下热分解时无刺激性气体逸出。下列叙述正确的是( )
A.W、X、Y、Z的单质常温下均为气体
B.最高价氧化物的水化物酸性:YC.100~200 ℃阶段热分解失去4个W2Z
D.500 ℃热分解后生成固体化合物X2Z3
答案 D
三年模拟
考点强化练
考点1 原子结构
1.★(2024届无锡期中教学质量调研,2)向CuSO4溶液中通入H2S,发生反应:CuSO4+H2S CuS↓+H2SO4。下列有关说法正确的是 ( )
A.H2S的电子式为
B.S中硫原子的杂化类型为sp3
C.基态Cu2+的核外电子排布式为[Ar]3d10
D.基态O原子核外电子轨道表示式为
答案 B
2.★(2024届泰州中学期初调研,2)下列化学用语或图示表达正确的是( )
A.H2S分子的球棍模型:
B.NH3的VSEPR模型:
C.基态24Cr原子价层电子轨道表示式:
↑ ↑ ↑ ↑ ↑
D.2pz电子云轮廓图:
答案 D
3.★(2023南京二模,2)OF2是良好的氧化剂和氟化剂,可通过反应2F2+2NaOH 2NaF+H2O+OF2制备,下列说法正确的是( )
A.F2的电子式为F··F
B.OF2是非极性分子
C.NaF是共价化合物
D.基态Na原子的价层电子排布式为3s1
答案 D
4.★(2023苏锡常镇四市第一次调研,2)人们在金星大气中探测到PH3,据此推断金星大气层或存在生命。反应P4+3KOH+3H2O 3KH2PO2+PH3↑可制备PH3。下列说法正确的是( )
A.P4为极性分子
B.K+的结构示意图为
C.PH3的电子式为
D.KH2PO2中含有离子键和共价键
答案 D
5.★(2023泰州期末,2)胍()的盐是病毒核酸保存液的重要成分。下列说法正确的是( )
A.胍分子间能够形成氢键
B.胍中σ键与π键的数目之比为3∶1
C.氨基(—NH2)的电子式为
D.中子数为8的N原子可表示为N
答案 A
考点2 元素周期表与元素周期律
6.★(2024届盐城联盟校第一次调研,3)明矾[KAl(SO4)2·12H2O]可用于净水。下列说法正确的是( )
A.半径大小:r(K+)B.电负性大小:χ(S)<χ(O)
C.电离能大小:I1(O)D.碱性强弱:KOH答案 B
7.★(2024届南通海安开学考,4)元素P、As、Sb分别位于周期表中三、四、五周期ⅤA族。下列说法不正确的是( )
A.原子半径:r(P)B.第一电离能:I1(P)>I1(As)>I1(Sb)
C.P的简单气态氢化物的热稳定性比As的强
D.ⅤA族元素单质的晶体类型相同
答案 D
8.★(2024届南通如东开学考,4)元素Ge、As、Se是周期表中第四周期主族元素,下列说法正确的是( )
A.原子半径:r(Ge)B.电负性:χ(Ge)<χ(As)<χ(Se)
C.第一电离能:I1(Ge)D.古氏试砷法的原理是AsH3与硝酸银溶液反应生成银单质,体现了AsH3具有极强的氧化性
答案 B
9.★(2023南京、盐城二模,3)由SiCl4制备高纯SiH4的反应为SiCl4+LiAlH4 SiH4↑+LiCl+AlCl3。下列说法正确的是( )
A.热稳定性:HCl>SiH4
B.离子半径:r(Li+)>r(H-)
C.第一电离能:I1(Al)>I1(Cl)
D.共价键的极性:Si—Cl>Al—Cl
答案 A
10.★★(2024届扬州期初考试,4)CrSi、Ge-GaAs、ZnGeAs2和碳化硅都是重要的半导体化合物,下列说法错误的是( )
A.基态铬原子的价电子排布式为3d54s1
B.Ge-GaAs中元素Ge、Ga、As的第一电离能由大到小的顺序为As>Ga>Ge
C.ZnGeAs2中元素Zn、Ge、As的电负性由大到小的顺序为As>Ge>Zn
D.碳化硅属于共价晶体,其熔、沸点均大于晶体硅
答案 B
11.★★(2023南通、泰州等七市第三次调研,4)前四周期主族元素X、Y、Z、W的原子序数依次增大。X元素位于p区,且基态X原子中成对电子数是未成对电子数的2倍,金属元素Y的第一电离能比同周期相邻元素的大,Z元素单质常温下为黄绿色气体,W与Y同主族。下列说法正确的是( )
A.简单离子半径:W>Z>Y
B.化合物WX2中阴、阳离子个数比为2∶1
C.工业上常用钢瓶储运Z单质
D.最高价氧化物对应水化物的碱性:Y>W
答案 C
考法综合练
考法 元素推断题解题策略
1.★★(2024届海安高级中学第一次考试,4)X、Y、Z、W是原子序数依次增大的短周期元素。X和Y基态原子的s能级电子总数均等于其p能级电子总数,Z原子的最外层电子数是Y原子最外层电子数的2倍,W和X位于同一主族。下列说法正确的是( )
A.第一电离能:I1(X)B.最高价氧化物对应水化物的酸性:Z>W
C.原子半径:r(W)>r(Y)>r(X)
D.简单气态氢化物的热稳定性:X>Z
答案 D
2.★★(2023前黄、姜堰等四校联考,3)著名的观赏石——崂山绿石主要成分可表示为YxFey[Z4O10](OH)2·W3(OH)6,其中W、Y、Z表示三种原子序数依次增大的第三周期元素,W没有未成对电子,Z的最高正价与最低负价的代数和为0。下列说法不正确的是( )
A.Y的离子半径在同周期元素的简单离子中最小
B.W、Y、Z的最高价氧化物对应的水化物都属于弱电解质
C.Z的简单氢化物分子间存在氢键
D.三种元素的电负性由大到小的顺序为Z>Y>W
答案 C
3.★★(2023前黄高级中学二模,9)一种用作锂离子电池电解质的锂盐的阴离子结构如图所示,X、Y、Z、W为原子序数依次增大的短周期主族元素,W的核外电子中有3个未成对电子。下列说法正确的是( )
A.W元素最高价氧化物对应的水化物是强酸
B.该阴离子中不存在非极性键
C.X的氢化物沸点可能高于Z的氢化物
D.该离子中所有原子最外层均为8电子结构
答案 C
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025江苏版新教材化学高考第一轮
专题七 原子结构 元素周期律
五年高考
考点过关练
考点1 原子结构
1.★(2020江苏,2,2分)反应8NH3+3Cl2 6NH4Cl+N2可用于氯气管道的检漏。下列表示相关微粒的化学用语正确的是( )
A.中子数为9的氮原子N
B.N2分子的电子式:N N
C.Cl2分子的结构式:Cl—Cl
D.Cl-的结构示意图:
答案 C
2.★(2019江苏,2,2分)反应NH4Cl+NaNO2 NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是( )
A.中子数为18的氯原子Cl
B.N2的结构式:
C.Na+的结构示意图:
D.H2O的电子式:
答案 D
3.★(2021江苏,2,2分)反应Cl2+2NaOHNaClO+NaCl+H2O可用于制备含氯消毒剂。下列说法正确的是( )
A.Cl2是极性分子
B.NaOH的电子式为
C.NaClO既含离子键又含共价键
D.Cl-与Na+具有相同的电子层结构
答案 C
4.★(2023湖南,2,3分)下列化学用语表述错误的是 ( )
A.HClO的电子式:
B.中子数为10的氧原子O
C.NH3分子的VSEPR模型:
D.基态N原子的价层电子排布图:
答案 C
5.★(2023北京,2,3分)下列化学用语或图示表达正确的是( )
A.NaCl的电子式为
B.NH3的VSEPR模型为
C.2pz电子云图为
D.基态24Cr原子的价层电子轨道表示式为
答案 C
6.★(2022重庆,2,3分)BCl3水解反应方程式为BCl3+3H2O B(OH)3+3HCl,下列说法错误的是( )
A.Cl的原子结构示意图为
B.H2O的空间填充模型为
C.BCl3的电子式为
D.B(OH)3的结构简式为
答案 C
考点2 元素周期表与元素周期律
7.★(2022江苏,3,3分)工业上电解熔融Al2O3和冰晶石(Na3AlF6)的混合物可制得铝。下列说法正确的是( )
A.半径大小:r(Al3+)
C.电离能大小:I1(O)
8.★(2023江苏,4,3分)元素C、Si、Ge位于周期表中ⅣA族。下列说法正确的是( )
A.原子半径:r(C)>r(Si)>r(Ge)
B.第一电离能:I1(C)
D.可在周期表中元素Si附近寻找新半导体材料
答案 D
9.★★(2023全国甲,11,6分)W、X、Y、Z为短周期主族元素,原子序数依次增大,最外层电子数之和为19。Y的最外层电子数与其K层电子数相等,WX2是形成酸雨的物质之一。下列说法正确的是( )
A.原子半径:X>W
B.简单氢化物的沸点:X
D.Z的最高价含氧酸是弱酸
答案 C
10.★★(2021江苏,5,3分)前4周期主族元素X、Y、Z、W的原子序数依次增大,X是空气中含量最多的元素,Y的周期序数与族序数相等,基态时Z原子3p原子轨道上有5个电子,W与Z处于同一主族。下列说法正确的是 ( )
A.原子半径:r(X)
C.Y的最高价氧化物对应水化物的酸性比Z的强
D.Z的简单气态氢化物的热稳定性比W的弱
答案 B
11.★★(2023湖北,6,3分)W、X、Y、Z为原子序数依次增加的同一短周期元素,其中X、Y、Z相邻,W的核外电子数与X的价层电子数相等,Z2是氧化性最强的单质,4种元素可形成离子化合物(XY)+(WZ4)-。下列说法正确的是( )
A.分子的极性:WZ3
12.★★(2022海南,11,4分)短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y同周期并相邻,Y是组成水的元素之一,Z在同周期主族元素中金属性最强,W原子在同周期主族元素中原子半径最小。下列判断正确的是( )
A.XW3是非极性分子
B.简单氢化物沸点:X>Y
C.Y与Z形成的化合物是离子化合物
D.X、Y、Z三种元素组成的化合物水溶液呈酸性
答案 C
13.★★(2023浙江6月选考,11,3分)X、Y、Z、W四种短周期主族元素,原子序数依次增大。X、Y与Z位于同一周期,且只有X、Y元素相邻。X基态原子核外有2个未成对电子,W原子在同周期中原子半径最大。下列说法不正确的是( )
A.第一电离能:Y>Z>X
B.电负性:Z>Y>X>W
C.Z、W原子形成稀有气体电子构型的简单离子的半径:W
答案 A
14.★★(2019江苏,8,2分)短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层有2个电子,Z的单质晶体是应用最广泛的半导体材料,W与X位于同一主族。下列说法正确的是 ( )
A.原子半径:r(W)>r(Z)>r(Y)>r(X)
B.由X、Y组成的化合物是离子化合物
C.Z的最高价氧化物对应水化物的酸性比W的强
D.W的简单气态氢化物的热稳定性比X的强
答案 B
15.★★(2023浙江1月选考,10,3分)X、Y、Z、M、Q五种短周期元素,原子序数依次增大。X的2s轨道全充满,Y的s能级电子数量是p能级的两倍,M是地壳中含量最多的元素,Q是纯碱中的一种元素。下列说法不正确的是( )
A.电负性:Z>X
B.最高正价:Z
D.最高价氧化物对应水化物的酸性:Z>Y
答案 B
16.★★(2022辽宁,5,3分)短周期元素X、Y、Z、W、Q原子序数依次增大。基态X、Z、Q原子均有两个单电子,W简单离子在同周期离子中半径最小,Q与Z同主族。下列说法错误的是 ( )
A.X能与多种元素形成共价键
B.简单氢化物沸点:Z
D.电负性:W
17.★★(2022福建,4,4分)某非线性光学晶体由钾元素(K)和原子序数依次增大的X、Y、Z、W四种短周期元素组成。X与Y、Z与W均为同周期相邻元素,X的核外电子总数为最外层电子数的2倍。Z为地壳中含量最多的元素。下列说法正确的是( )
A.简单氢化物沸点:Z>W
B.YW3分子的空间构型为三角锥形
C.原子半径:Y
18.★★(2023全国乙,10,6分)一种矿物由短周期元素W、X、Y组成,溶于稀盐酸有无色无味气体生成。W、X、Y原子序数依次增大。简单离子X2-与Y2+具有相同的电子结构。下列叙述正确的是( )
A.X的常见化合价有-1、-2
B.原子半径大小为Y>X>W
C.YX的水合物具有两性
D.W单质只有4种同素异形体
答案 A
考法强化练
考法 元素推断题解题策略
1.★★(2021浙江6月选考,15,2分)已知短周期元素X、Y、Z、M、Q和R在周期表中的相对位置如图所示,其中Y的最高化合价为+3。下列说法不正确的是( )
A.还原性:ZQ2
C.Y能与Fe2O3反应得到Fe
D.M最高价氧化物的水化物能与其最低价氢化物反应
答案 A
2.★★(2022河北,6,3分)中子轰击X原子的核反应为Xn→YH,其中Y可用于测定文物年代。下列说法错误的是( )
A.原子半径:Y>X
B.Y的电子式为
C.最高价含氧酸的酸性:Y>X
D.X与Y均能形成多种氢化物
答案 C
3.★★(2023广东,14,4分)化合物XYZ4ME4可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为nsn-1,X与M同周期,E在地壳中含量最多。下列说法正确的是( )
A.元素电负性:E>Y>Z
B.氢化物沸点:M>Y>E
C.第一电离能:X>E>Y
D.YZ3和Y的空间结构均为三角锥形
答案 A
4.★★(2022河北,10,4分)两种化合物的结构如下,其中X、Y、Z、R、Q是原子序数依次增大的五种短周期主族元素。下列说法错误的是 ( )
A.在两种化合物中,X、Y、Z、R、Q均满足最外层8电子稳定结构
B.X、Y、Z、R、Q中,R的非金属性及简单氢化物的稳定性均最强
C.将装有YZ2气体的透明密闭容器浸入冰水中,气体颜色变浅
D.Z的某种同素异形体在大气中的含量与环境污染密切相关
答案 A
5.★★(2021广东,13,4分)一种麻醉剂的分子结构式如图所示。其中,X的原子核只有1个质子;元素Y、Z、W原子序数依次增大,且均位于X的下一周期;元素E的原子比W原子多8个电子。下列说法不正确的是 ( )
A.XEZ4是一种强酸
B.原子半径:Y>W>E
C.非金属性:W>Z>Y
D.ZW2中,Z的化合价为+2价
答案 B
6.★★(2023湖南,6,3分)日光灯中用到的某种荧光粉的主要成分为3W3(ZX4)2·WY2。已知:X、Y、Z和W为原子序数依次增大的前20号元素,W为金属元素。基态X原子s轨道上的电子数和p轨道上的电子数相等,基态X、Y、Z原子的未成对电子数之比为2∶1∶3。下列说法正确的是( )
A.电负性:X>Y>Z>W
B.原子半径:X
D.Z元素最高价氧化物对应的水化物具有强氧化性
答案 C
7.★★(2022全国乙,11,6分)化合物(YW4X5Z8·4W2Z)可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。YZ2分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在200 ℃以下热分解时无刺激性气体逸出。下列叙述正确的是( )
A.W、X、Y、Z的单质常温下均为气体
B.最高价氧化物的水化物酸性:Y
D.500 ℃热分解后生成固体化合物X2Z3
答案 D
三年模拟
考点强化练
考点1 原子结构
1.★(2024届无锡期中教学质量调研,2)向CuSO4溶液中通入H2S,发生反应:CuSO4+H2S CuS↓+H2SO4。下列有关说法正确的是 ( )
A.H2S的电子式为
B.S中硫原子的杂化类型为sp3
C.基态Cu2+的核外电子排布式为[Ar]3d10
D.基态O原子核外电子轨道表示式为
答案 B
2.★(2024届泰州中学期初调研,2)下列化学用语或图示表达正确的是( )
A.H2S分子的球棍模型:
B.NH3的VSEPR模型:
C.基态24Cr原子价层电子轨道表示式:
↑ ↑ ↑ ↑ ↑
D.2pz电子云轮廓图:
答案 D
3.★(2023南京二模,2)OF2是良好的氧化剂和氟化剂,可通过反应2F2+2NaOH 2NaF+H2O+OF2制备,下列说法正确的是( )
A.F2的电子式为F··F
B.OF2是非极性分子
C.NaF是共价化合物
D.基态Na原子的价层电子排布式为3s1
答案 D
4.★(2023苏锡常镇四市第一次调研,2)人们在金星大气中探测到PH3,据此推断金星大气层或存在生命。反应P4+3KOH+3H2O 3KH2PO2+PH3↑可制备PH3。下列说法正确的是( )
A.P4为极性分子
B.K+的结构示意图为
C.PH3的电子式为
D.KH2PO2中含有离子键和共价键
答案 D
5.★(2023泰州期末,2)胍()的盐是病毒核酸保存液的重要成分。下列说法正确的是( )
A.胍分子间能够形成氢键
B.胍中σ键与π键的数目之比为3∶1
C.氨基(—NH2)的电子式为
D.中子数为8的N原子可表示为N
答案 A
考点2 元素周期表与元素周期律
6.★(2024届盐城联盟校第一次调研,3)明矾[KAl(SO4)2·12H2O]可用于净水。下列说法正确的是( )
A.半径大小:r(K+)
C.电离能大小:I1(O)
7.★(2024届南通海安开学考,4)元素P、As、Sb分别位于周期表中三、四、五周期ⅤA族。下列说法不正确的是( )
A.原子半径:r(P)
C.P的简单气态氢化物的热稳定性比As的强
D.ⅤA族元素单质的晶体类型相同
答案 D
8.★(2024届南通如东开学考,4)元素Ge、As、Se是周期表中第四周期主族元素,下列说法正确的是( )
A.原子半径:r(Ge)
C.第一电离能:I1(Ge)
答案 B
9.★(2023南京、盐城二模,3)由SiCl4制备高纯SiH4的反应为SiCl4+LiAlH4 SiH4↑+LiCl+AlCl3。下列说法正确的是( )
A.热稳定性:HCl>SiH4
B.离子半径:r(Li+)>r(H-)
C.第一电离能:I1(Al)>I1(Cl)
D.共价键的极性:Si—Cl>Al—Cl
答案 A
10.★★(2024届扬州期初考试,4)CrSi、Ge-GaAs、ZnGeAs2和碳化硅都是重要的半导体化合物,下列说法错误的是( )
A.基态铬原子的价电子排布式为3d54s1
B.Ge-GaAs中元素Ge、Ga、As的第一电离能由大到小的顺序为As>Ga>Ge
C.ZnGeAs2中元素Zn、Ge、As的电负性由大到小的顺序为As>Ge>Zn
D.碳化硅属于共价晶体,其熔、沸点均大于晶体硅
答案 B
11.★★(2023南通、泰州等七市第三次调研,4)前四周期主族元素X、Y、Z、W的原子序数依次增大。X元素位于p区,且基态X原子中成对电子数是未成对电子数的2倍,金属元素Y的第一电离能比同周期相邻元素的大,Z元素单质常温下为黄绿色气体,W与Y同主族。下列说法正确的是( )
A.简单离子半径:W>Z>Y
B.化合物WX2中阴、阳离子个数比为2∶1
C.工业上常用钢瓶储运Z单质
D.最高价氧化物对应水化物的碱性:Y>W
答案 C
考法综合练
考法 元素推断题解题策略
1.★★(2024届海安高级中学第一次考试,4)X、Y、Z、W是原子序数依次增大的短周期元素。X和Y基态原子的s能级电子总数均等于其p能级电子总数,Z原子的最外层电子数是Y原子最外层电子数的2倍,W和X位于同一主族。下列说法正确的是( )
A.第一电离能:I1(X)
C.原子半径:r(W)>r(Y)>r(X)
D.简单气态氢化物的热稳定性:X>Z
答案 D
2.★★(2023前黄、姜堰等四校联考,3)著名的观赏石——崂山绿石主要成分可表示为YxFey[Z4O10](OH)2·W3(OH)6,其中W、Y、Z表示三种原子序数依次增大的第三周期元素,W没有未成对电子,Z的最高正价与最低负价的代数和为0。下列说法不正确的是( )
A.Y的离子半径在同周期元素的简单离子中最小
B.W、Y、Z的最高价氧化物对应的水化物都属于弱电解质
C.Z的简单氢化物分子间存在氢键
D.三种元素的电负性由大到小的顺序为Z>Y>W
答案 C
3.★★(2023前黄高级中学二模,9)一种用作锂离子电池电解质的锂盐的阴离子结构如图所示,X、Y、Z、W为原子序数依次增大的短周期主族元素,W的核外电子中有3个未成对电子。下列说法正确的是( )
A.W元素最高价氧化物对应的水化物是强酸
B.该阴离子中不存在非极性键
C.X的氢化物沸点可能高于Z的氢化物
D.该离子中所有原子最外层均为8电子结构
答案 C
专题七 原子结构 元素周期律
五年高考
考点过关练
考点1 原子结构
1.★(2020江苏,2,2分)反应8NH3+3Cl2 6NH4Cl+N2可用于氯气管道的检漏。下列表示相关微粒的化学用语正确的是( )
A.中子数为9的氮原子N
B.N2分子的电子式:N N
C.Cl2分子的结构式:Cl—Cl
D.Cl-的结构示意图:
答案 C
2.★(2019江苏,2,2分)反应NH4Cl+NaNO2 NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是( )
A.中子数为18的氯原子Cl
B.N2的结构式:
C.Na+的结构示意图:
D.H2O的电子式:
答案 D
3.★(2021江苏,2,2分)反应Cl2+2NaOHNaClO+NaCl+H2O可用于制备含氯消毒剂。下列说法正确的是( )
A.Cl2是极性分子
B.NaOH的电子式为
C.NaClO既含离子键又含共价键
D.Cl-与Na+具有相同的电子层结构
答案 C
4.★(2023湖南,2,3分)下列化学用语表述错误的是 ( )
A.HClO的电子式:
B.中子数为10的氧原子O
C.NH3分子的VSEPR模型:
D.基态N原子的价层电子排布图:
答案 C
5.★(2023北京,2,3分)下列化学用语或图示表达正确的是( )
A.NaCl的电子式为
B.NH3的VSEPR模型为
C.2pz电子云图为
D.基态24Cr原子的价层电子轨道表示式为
答案 C
6.★(2022重庆,2,3分)BCl3水解反应方程式为BCl3+3H2O B(OH)3+3HCl,下列说法错误的是( )
A.Cl的原子结构示意图为
B.H2O的空间填充模型为
C.BCl3的电子式为
D.B(OH)3的结构简式为
答案 C
考点2 元素周期表与元素周期律
7.★(2022江苏,3,3分)工业上电解熔融Al2O3和冰晶石(Na3AlF6)的混合物可制得铝。下列说法正确的是( )
A.半径大小:r(Al3+)
C.电离能大小:I1(O)
8.★(2023江苏,4,3分)元素C、Si、Ge位于周期表中ⅣA族。下列说法正确的是( )
A.原子半径:r(C)>r(Si)>r(Ge)
B.第一电离能:I1(C)
D.可在周期表中元素Si附近寻找新半导体材料
答案 D
9.★★(2023全国甲,11,6分)W、X、Y、Z为短周期主族元素,原子序数依次增大,最外层电子数之和为19。Y的最外层电子数与其K层电子数相等,WX2是形成酸雨的物质之一。下列说法正确的是( )
A.原子半径:X>W
B.简单氢化物的沸点:X
D.Z的最高价含氧酸是弱酸
答案 C
10.★★(2021江苏,5,3分)前4周期主族元素X、Y、Z、W的原子序数依次增大,X是空气中含量最多的元素,Y的周期序数与族序数相等,基态时Z原子3p原子轨道上有5个电子,W与Z处于同一主族。下列说法正确的是 ( )
A.原子半径:r(X)
C.Y的最高价氧化物对应水化物的酸性比Z的强
D.Z的简单气态氢化物的热稳定性比W的弱
答案 B
11.★★(2023湖北,6,3分)W、X、Y、Z为原子序数依次增加的同一短周期元素,其中X、Y、Z相邻,W的核外电子数与X的价层电子数相等,Z2是氧化性最强的单质,4种元素可形成离子化合物(XY)+(WZ4)-。下列说法正确的是( )
A.分子的极性:WZ3
12.★★(2022海南,11,4分)短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y同周期并相邻,Y是组成水的元素之一,Z在同周期主族元素中金属性最强,W原子在同周期主族元素中原子半径最小。下列判断正确的是( )
A.XW3是非极性分子
B.简单氢化物沸点:X>Y
C.Y与Z形成的化合物是离子化合物
D.X、Y、Z三种元素组成的化合物水溶液呈酸性
答案 C
13.★★(2023浙江6月选考,11,3分)X、Y、Z、W四种短周期主族元素,原子序数依次增大。X、Y与Z位于同一周期,且只有X、Y元素相邻。X基态原子核外有2个未成对电子,W原子在同周期中原子半径最大。下列说法不正确的是( )
A.第一电离能:Y>Z>X
B.电负性:Z>Y>X>W
C.Z、W原子形成稀有气体电子构型的简单离子的半径:W
答案 A
14.★★(2019江苏,8,2分)短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层有2个电子,Z的单质晶体是应用最广泛的半导体材料,W与X位于同一主族。下列说法正确的是 ( )
A.原子半径:r(W)>r(Z)>r(Y)>r(X)
B.由X、Y组成的化合物是离子化合物
C.Z的最高价氧化物对应水化物的酸性比W的强
D.W的简单气态氢化物的热稳定性比X的强
答案 B
15.★★(2023浙江1月选考,10,3分)X、Y、Z、M、Q五种短周期元素,原子序数依次增大。X的2s轨道全充满,Y的s能级电子数量是p能级的两倍,M是地壳中含量最多的元素,Q是纯碱中的一种元素。下列说法不正确的是( )
A.电负性:Z>X
B.最高正价:Z
D.最高价氧化物对应水化物的酸性:Z>Y
答案 B
16.★★(2022辽宁,5,3分)短周期元素X、Y、Z、W、Q原子序数依次增大。基态X、Z、Q原子均有两个单电子,W简单离子在同周期离子中半径最小,Q与Z同主族。下列说法错误的是 ( )
A.X能与多种元素形成共价键
B.简单氢化物沸点:Z
D.电负性:W
17.★★(2022福建,4,4分)某非线性光学晶体由钾元素(K)和原子序数依次增大的X、Y、Z、W四种短周期元素组成。X与Y、Z与W均为同周期相邻元素,X的核外电子总数为最外层电子数的2倍。Z为地壳中含量最多的元素。下列说法正确的是( )
A.简单氢化物沸点:Z>W
B.YW3分子的空间构型为三角锥形
C.原子半径:Y
18.★★(2023全国乙,10,6分)一种矿物由短周期元素W、X、Y组成,溶于稀盐酸有无色无味气体生成。W、X、Y原子序数依次增大。简单离子X2-与Y2+具有相同的电子结构。下列叙述正确的是( )
A.X的常见化合价有-1、-2
B.原子半径大小为Y>X>W
C.YX的水合物具有两性
D.W单质只有4种同素异形体
答案 A
考法强化练
考法 元素推断题解题策略
1.★★(2021浙江6月选考,15,2分)已知短周期元素X、Y、Z、M、Q和R在周期表中的相对位置如图所示,其中Y的最高化合价为+3。下列说法不正确的是( )
A.还原性:ZQ2
C.Y能与Fe2O3反应得到Fe
D.M最高价氧化物的水化物能与其最低价氢化物反应
答案 A
2.★★(2022河北,6,3分)中子轰击X原子的核反应为Xn→YH,其中Y可用于测定文物年代。下列说法错误的是( )
A.原子半径:Y>X
B.Y的电子式为
C.最高价含氧酸的酸性:Y>X
D.X与Y均能形成多种氢化物
答案 C
3.★★(2023广东,14,4分)化合物XYZ4ME4可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为nsn-1,X与M同周期,E在地壳中含量最多。下列说法正确的是( )
A.元素电负性:E>Y>Z
B.氢化物沸点:M>Y>E
C.第一电离能:X>E>Y
D.YZ3和Y的空间结构均为三角锥形
答案 A
4.★★(2022河北,10,4分)两种化合物的结构如下,其中X、Y、Z、R、Q是原子序数依次增大的五种短周期主族元素。下列说法错误的是 ( )
A.在两种化合物中,X、Y、Z、R、Q均满足最外层8电子稳定结构
B.X、Y、Z、R、Q中,R的非金属性及简单氢化物的稳定性均最强
C.将装有YZ2气体的透明密闭容器浸入冰水中,气体颜色变浅
D.Z的某种同素异形体在大气中的含量与环境污染密切相关
答案 A
5.★★(2021广东,13,4分)一种麻醉剂的分子结构式如图所示。其中,X的原子核只有1个质子;元素Y、Z、W原子序数依次增大,且均位于X的下一周期;元素E的原子比W原子多8个电子。下列说法不正确的是 ( )
A.XEZ4是一种强酸
B.原子半径:Y>W>E
C.非金属性:W>Z>Y
D.ZW2中,Z的化合价为+2价
答案 B
6.★★(2023湖南,6,3分)日光灯中用到的某种荧光粉的主要成分为3W3(ZX4)2·WY2。已知:X、Y、Z和W为原子序数依次增大的前20号元素,W为金属元素。基态X原子s轨道上的电子数和p轨道上的电子数相等,基态X、Y、Z原子的未成对电子数之比为2∶1∶3。下列说法正确的是( )
A.电负性:X>Y>Z>W
B.原子半径:X
D.Z元素最高价氧化物对应的水化物具有强氧化性
答案 C
7.★★(2022全国乙,11,6分)化合物(YW4X5Z8·4W2Z)可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。YZ2分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在200 ℃以下热分解时无刺激性气体逸出。下列叙述正确的是( )
A.W、X、Y、Z的单质常温下均为气体
B.最高价氧化物的水化物酸性:Y
D.500 ℃热分解后生成固体化合物X2Z3
答案 D
三年模拟
考点强化练
考点1 原子结构
1.★(2024届无锡期中教学质量调研,2)向CuSO4溶液中通入H2S,发生反应:CuSO4+H2S CuS↓+H2SO4。下列有关说法正确的是 ( )
A.H2S的电子式为
B.S中硫原子的杂化类型为sp3
C.基态Cu2+的核外电子排布式为[Ar]3d10
D.基态O原子核外电子轨道表示式为
答案 B
2.★(2024届泰州中学期初调研,2)下列化学用语或图示表达正确的是( )
A.H2S分子的球棍模型:
B.NH3的VSEPR模型:
C.基态24Cr原子价层电子轨道表示式:
↑ ↑ ↑ ↑ ↑
D.2pz电子云轮廓图:
答案 D
3.★(2023南京二模,2)OF2是良好的氧化剂和氟化剂,可通过反应2F2+2NaOH 2NaF+H2O+OF2制备,下列说法正确的是( )
A.F2的电子式为F··F
B.OF2是非极性分子
C.NaF是共价化合物
D.基态Na原子的价层电子排布式为3s1
答案 D
4.★(2023苏锡常镇四市第一次调研,2)人们在金星大气中探测到PH3,据此推断金星大气层或存在生命。反应P4+3KOH+3H2O 3KH2PO2+PH3↑可制备PH3。下列说法正确的是( )
A.P4为极性分子
B.K+的结构示意图为
C.PH3的电子式为
D.KH2PO2中含有离子键和共价键
答案 D
5.★(2023泰州期末,2)胍()的盐是病毒核酸保存液的重要成分。下列说法正确的是( )
A.胍分子间能够形成氢键
B.胍中σ键与π键的数目之比为3∶1
C.氨基(—NH2)的电子式为
D.中子数为8的N原子可表示为N
答案 A
考点2 元素周期表与元素周期律
6.★(2024届盐城联盟校第一次调研,3)明矾[KAl(SO4)2·12H2O]可用于净水。下列说法正确的是( )
A.半径大小:r(K+)
C.电离能大小:I1(O)
7.★(2024届南通海安开学考,4)元素P、As、Sb分别位于周期表中三、四、五周期ⅤA族。下列说法不正确的是( )
A.原子半径:r(P)
C.P的简单气态氢化物的热稳定性比As的强
D.ⅤA族元素单质的晶体类型相同
答案 D
8.★(2024届南通如东开学考,4)元素Ge、As、Se是周期表中第四周期主族元素,下列说法正确的是( )
A.原子半径:r(Ge)
C.第一电离能:I1(Ge)
答案 B
9.★(2023南京、盐城二模,3)由SiCl4制备高纯SiH4的反应为SiCl4+LiAlH4 SiH4↑+LiCl+AlCl3。下列说法正确的是( )
A.热稳定性:HCl>SiH4
B.离子半径:r(Li+)>r(H-)
C.第一电离能:I1(Al)>I1(Cl)
D.共价键的极性:Si—Cl>Al—Cl
答案 A
10.★★(2024届扬州期初考试,4)CrSi、Ge-GaAs、ZnGeAs2和碳化硅都是重要的半导体化合物,下列说法错误的是( )
A.基态铬原子的价电子排布式为3d54s1
B.Ge-GaAs中元素Ge、Ga、As的第一电离能由大到小的顺序为As>Ga>Ge
C.ZnGeAs2中元素Zn、Ge、As的电负性由大到小的顺序为As>Ge>Zn
D.碳化硅属于共价晶体,其熔、沸点均大于晶体硅
答案 B
11.★★(2023南通、泰州等七市第三次调研,4)前四周期主族元素X、Y、Z、W的原子序数依次增大。X元素位于p区,且基态X原子中成对电子数是未成对电子数的2倍,金属元素Y的第一电离能比同周期相邻元素的大,Z元素单质常温下为黄绿色气体,W与Y同主族。下列说法正确的是( )
A.简单离子半径:W>Z>Y
B.化合物WX2中阴、阳离子个数比为2∶1
C.工业上常用钢瓶储运Z单质
D.最高价氧化物对应水化物的碱性:Y>W
答案 C
考法综合练
考法 元素推断题解题策略
1.★★(2024届海安高级中学第一次考试,4)X、Y、Z、W是原子序数依次增大的短周期元素。X和Y基态原子的s能级电子总数均等于其p能级电子总数,Z原子的最外层电子数是Y原子最外层电子数的2倍,W和X位于同一主族。下列说法正确的是( )
A.第一电离能:I1(X)
C.原子半径:r(W)>r(Y)>r(X)
D.简单气态氢化物的热稳定性:X>Z
答案 D
2.★★(2023前黄、姜堰等四校联考,3)著名的观赏石——崂山绿石主要成分可表示为YxFey[Z4O10](OH)2·W3(OH)6,其中W、Y、Z表示三种原子序数依次增大的第三周期元素,W没有未成对电子,Z的最高正价与最低负价的代数和为0。下列说法不正确的是( )
A.Y的离子半径在同周期元素的简单离子中最小
B.W、Y、Z的最高价氧化物对应的水化物都属于弱电解质
C.Z的简单氢化物分子间存在氢键
D.三种元素的电负性由大到小的顺序为Z>Y>W
答案 C
3.★★(2023前黄高级中学二模,9)一种用作锂离子电池电解质的锂盐的阴离子结构如图所示,X、Y、Z、W为原子序数依次增大的短周期主族元素,W的核外电子中有3个未成对电子。下列说法正确的是( )
A.W元素最高价氧化物对应的水化物是强酸
B.该阴离子中不存在非极性键
C.X的氢化物沸点可能高于Z的氢化物
D.该离子中所有原子最外层均为8电子结构
答案 C
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
