2025江苏版新教材化学高考第一轮基础练习--专题十七 实验方案的设计与评价
文档属性
| 名称 | 2025江苏版新教材化学高考第一轮基础练习--专题十七 实验方案的设计与评价 | 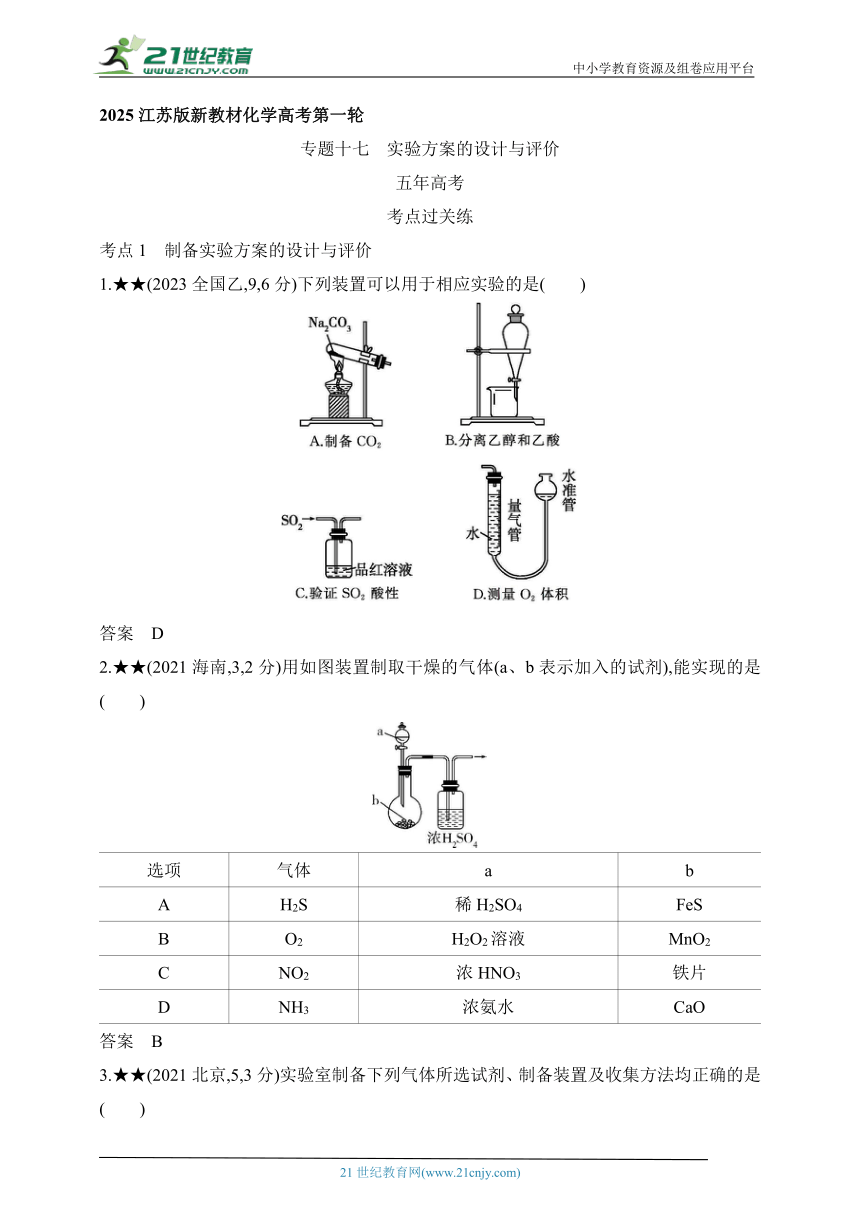 | |
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-16 16:07:02 | ||
图片预览





文档简介
中小学教育资源及组卷应用平台
2025江苏版新教材化学高考第一轮
专题十七 实验方案的设计与评价
五年高考
考点过关练
考点1 制备实验方案的设计与评价
1.★★(2023全国乙,9,6分)下列装置可以用于相应实验的是( )
答案 D
2.★★(2021海南,3,2分)用如图装置制取干燥的气体(a、b表示加入的试剂),能实现的是( )
选项 气体 a b
A H2S 稀H2SO4 FeS
B O2 H2O2溶液 MnO2
C NO2 浓HNO3 铁片
D NH3 浓氨水 CaO
答案 B
3.★★(2021北京,5,3分)实验室制备下列气体所选试剂、制备装置及收集方法均正确的是 ( )
a b
c d e
气体 试剂 制备装置 收集方法
A O2 KMnO4 a d
B H2 Zn+稀H2SO4 b e
C NO Cu+稀HNO3 b c
D CO2 石灰石+稀H2SO4 b c
答案 B
4.★★★(2021江苏,17,15分)以软锰矿粉(含MnO2及少量Fe、Al、Si、Ca、Mg等的氧化物)为原料制备电池级MnO2。
图1
(1)浸取。将一定量软锰矿粉与Na2SO3、H2SO4溶液中的一种配成悬浊液,加入三颈瓶中(装置如图1),70 ℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中的溶液是 ;MnO2转化为Mn2+的离子方程为 。
(2)除杂。向已经除去Fe、Al、Si的MnSO4溶液(pH约为5)中加入NH4F溶液,溶液中的Ca2+、Mg2+形成氟化物沉淀。若沉淀后上层清液中c(F-)=0.05 mol·L-1,则c(Ca2+)/c(Mg2+)= 。[Ksp(MgF2)=5×10-11,Ksp(CaF2)=5×10-9]
(3)制备MnCO3。在搅拌下向100 mL 1 mol·L-1 MnSO4溶液中缓慢滴加1 mol·L-1 NH4HCO3溶液,过滤、洗涤、干燥,得到MnCO3固体。需加入NH4HCO3溶液的体积约为 。
(4)制备MnO2。MnCO3经热解、酸浸等步骤可制备MnO2。MnCO3在空气气流中热解得到三种价态锰的氧化物,锰元素所占比例(×100%)随热解温度变化的曲线如图2所示。已知:MnO与酸反应生成Mn2+;Mn2O3氧化性强于Cl2,在加热条件下Mn2O3在酸性溶液中转化为MnO2和Mn2+。
图2
为获得较高产率的MnO2,请补充实验方案:取一定量MnCO3置于热解装置中,通空气气流, ,固体干燥,得到MnO2。(可选用的试剂:1 mol·L-1 H2SO4溶液、2 mol·L-1 HCl溶液、BaCl2溶液、AgNO3溶液)
答案 (1)H2SO4溶液 MnO2+S+2H+Mn2++S+H2O (2)100 (3)200 mL
(4)加热至约450 ℃分解一段时间,将冷却后的固体加入至适量1 mol·L-1H2SO4溶液中,加热,搅拌反应一段时间,过滤,用水洗涤,取最后一次洗涤滤液,向其中滴加BaCl2溶液,无白色沉淀生成
5.★★★(2022海南,15,10分)胆矾(CuSO4·5H2O)是一种重要化工原料。某研究小组以生锈的铜屑为原料[主要成分是Cu,含有少量的油污、CuO、CuCO3、Cu(OH)2]制备胆矾。流程如下:
回答问题:
(1)步骤①的目的是 。
(2)步骤②中,若仅用浓H2SO4溶解固体B,将生成 (填化学式)污染环境。
(3)步骤②中,在H2O2存在下Cu溶于稀H2SO4,反应的化学方程式为 。
(4)经步骤④得到的胆矾,不能用水洗涤的主要原因是 。
(5)实验证明,滤液D能将I-氧化为I2。
ⅰ.甲同学认为不可能是步骤②中过量H2O2将I-氧化为I2,理由是 。
ⅱ.乙同学通过实验证实,只能是Cu2+将I-氧化为I2,写出乙同学的实验方案及结果
(不要求写具体操作过程)。
答案 (1)除油污 (2)SO2
(3)Cu+H2O2+H2SO4 CuSO4+2H2O
(4)胆矾晶体易溶于水
(5)ⅰ.溶液C经步骤③加热浓缩后H2O2已完全分解
ⅱ.取滤液,向其中加入适量硫化钠,使铜离子恰好完全沉淀,再加入I-,不能被氧化
6.★★★(2023新课标,28,14分)实验室由安息香制备二苯乙二酮的反应式如下:
相关信息列表如下:
物质 性状 熔点/℃ 沸点/℃ 溶解性
安息香 白色固体 133 344 难溶于冷水 溶于热水、乙醇、乙酸
二苯乙 二酮 淡黄色固体 95 347 不溶于水 溶于乙醇、苯、乙酸
冰乙酸 无色液体 17 118 与水、乙醇互溶
装置示意图如图所示,实验步骤:
①在圆底烧瓶中加入10 mL冰乙酸、5 mL水及9.0 g FeCl3·6H2O,边搅拌边加热,至固体全部溶解。
②停止加热,待沸腾平息后加入2.0 g安息香,加热回流45~60 min。
③加入50 mL水,煮沸后冷却,有黄色固体析出。
④过滤,并用冷水洗涤固体3次,得到粗品。
⑤粗品用75%的乙醇重结晶,干燥后得淡黄色结晶1.6 g。
回答下列问题:
(1)仪器A中应加入 (填“水”或“油”)作为热传导介质。
(2)仪器B的名称是 ;冷却水应从 (填“a”或“b”)口通入。
(3)实验步骤②中,安息香必须待沸腾平息后方可加入,其主要目的是 。
(4)在本实验中,FeCl3为氧化剂且过量,其还原产物为 ;某同学尝试改进本实验:采用催化量的FeCl3并通入空气制备二苯乙二酮。该方案是否可行 简述判断理由: 。
(5)本实验步骤①~③在乙酸体系中进行,乙酸除作溶剂外,另一主要作用是防止 。
(6)若粗品中混有少量未氧化的安息香,可用少量 洗涤的方法除去(填标号)。若要得到更高纯度的产品,可用重结晶的方法进一步提纯。
a.热水 b.乙酸 c.冷水 d.乙醇
(7)本实验的产率最接近于 (填标号)。
a.85% b.80% c.75% d.70%
答案 (1)油 (2)球形冷凝管 a
(3)防止暴沸 (4)FeCl2[Fe2+/Fe(Ⅱ)/Fe(CH3COO)2均可] 可行,空气中的O2可将Fe2+氧化为Fe3+,从而实现催化循环 (5)FeCl3水解[生成Fe(OH)3/Fe(OH)3胶体均可] (6)a (7)b
7.★★★(2023辽宁,17,13分)2-噻吩乙醇(Mr=128)是抗血栓药物氯吡格雷的重要中间体,其制备方法如下:
Ⅰ.制钠砂。向烧瓶中加入300 mL液体A和4.60 g金属钠,加热至钠熔化后,盖紧塞子,振荡至大量微小钠珠出现。
Ⅱ.制噻吩钠。降温至10 ℃,加入25 mL噻吩,反应至钠砂消失。
Ⅲ.制噻吩乙醇钠。降温至-10 ℃,加入稍过量的环氧乙烷的四氢呋喃溶液,反应30 min。
Ⅳ.水解。恢复至室温,加入70 mL水,搅拌30 min;加盐酸调pH至4~6,继续反应2 h,分液;用水洗涤有机相,二次分液。
Ⅴ.分离。向有机相中加入无水MgSO4,静置,过滤,对滤液进行蒸馏,蒸出四氢呋喃、噻吩和液体A后,得到产品17.92 g。
回答下列问题:
(1)步骤Ⅰ中液体A可以选择 。
a.乙醇 b.水 c.甲苯 d.液氨
(2)噻吩沸点低于吡咯()的原因是 。
(3)步骤Ⅱ的化学方程式为 。
(4)步骤Ⅲ中反应放热,为防止温度过高引发副反应,加入环氧乙烷的四氢呋喃溶液的方法是 。
(5)步骤Ⅳ中用盐酸调节pH的目的是 。
(6)下列仪器在步骤Ⅴ中无需使用的是 (填名称);无水MgSO4的作用为 。
(7)产品的产率为 (用Na计算,精确至0.1%)。
答案 (1)c (2)吡咯可以形成分子间氢键,而噻吩不能形成分子间氢键
(3)
(4)向烧瓶中缓慢滴入稍过量的环氧乙烷的四氢呋喃溶液,并不断搅拌 (5)与水解产生的NaOH反应,提高转化率 (6)球形冷凝管、分液漏斗 去除有机相中少量的水
(7)70.0%
8.★★★(2023山东,18,12分)三氯甲硅烷(SiHCl3)是制取高纯硅的重要原料,常温下为无色液体,沸点为31.8 ℃,熔点为-126.5 ℃,易水解。实验室根据反应Si+3HCl SiHCl3+H2,利用如下装置制备SiHCl3粗品(加热及夹持装置略)。回答下列问题:
(1)制备SiHCl3时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入HCl,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为 ;判断制备反应结束的实验现象是 。图示装置存在的两处缺陷是 。
(2)已知电负性Cl>H>Si,SiHCl3在浓NaOH溶液中发生反应的化学方程式为 。
(3)采用如下方法测定溶有少量HCl的SiHCl3纯度。
m1 g样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:① ,
② (填操作名称),③称量等操作,测得所得固体氧化物质量为m2 g。从下列仪器中选出①、②中需使用的仪器,依次为 (填标号)。测得样品纯度为 (用含m1、m2的代数式表示)。
A B C D
答案 (1)连接好装置,并检查装置的气密性 装置C的蒸馏烧瓶中不再有液体滴下 装置C、D之间缺少干燥装置,缺少处理尾气H2的装置 (2)SiHCl3+5NaOH Na2SiO3+3NaCl+H2↑+2H2O (3)灼烧 冷却 A、C ×100%
考点2 探究实验方案的设计与评价
9.★★(2019江苏,13,4分)室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 实验操作和现象 结论
A 向X溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液变为红色 X溶液中一定含有Fe2+
B 向浓度均为0.05 mol·L-1的NaI、NaCl混合溶液中滴加少量AgNO3溶液,有黄色沉淀生成 Ksp(AgI)>Ksp(AgCl)
C 向3 mL KI溶液中滴加几滴溴水,振荡,再滴加1 mL淀粉溶液,溶液显蓝色 Br2的氧化性比I2的强
D 用pH试纸测得:CH3COONa溶液的pH约为9,NaNO2溶液的pH约为8 HNO2电离出H+的能力比CH3COOH的强
答案 C
10.(2022江苏,11,3分)室温下,下列实验探究方案不能达到探究目的的是( )
选项 探究方案 探究目的
A 向盛有FeSO4溶液的试管中滴加几滴KSCN溶液,振荡,再滴加几滴新制氯水,观察溶液颜色变化 Fe2+具有还原性
B 向盛有SO2水溶液的试管中滴加几滴品红溶液,振荡,加热试管,观察溶液颜色变化 SO2具有漂白性
C 向盛有淀粉-KI溶液的试管中滴加几滴溴水,振荡,观察溶液颜色变化 Br2的氧化性比I2的强
D 用pH计测量醋酸、盐酸的pH,比较溶液pH大小 CH3COOH是弱电解质
答案 D
11.★★(2023新课标,11,6分)根据实验操作及现象,下列结论中正确的是( )
选项 实验操作及现象 结论
A 常温下将铁片分别插入稀硝酸和浓硝酸中,前者产生无色气体,后者无明显现象 稀硝酸的氧化性比浓硝酸强
B 取一定量Na2SO3样品,溶解后加入BaCl2溶液,产生白色沉淀。加入浓HNO3,仍有沉淀 此样品中含有S
C 将银和AgNO3溶液与铜和Na2SO4溶液组成原电池。连通后银表面有银白色金属沉积,铜电极附近溶液逐渐变蓝 Cu的金属性比Ag强
D 向溴水中加入苯,振荡后静置,水层颜色变浅 溴与苯发生了加成反应
答案 C
12.★★(2023辽宁,13,3分)某小组进行实验,向10 mL 蒸馏水中加入0.4 g I2,充分振荡,溶液呈浅棕色,再加入0.2 g锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知(aq)为棕色,下列关于颜色变化的解释错误的是( )
选项 颜色变化 解释
A 溶液呈浅棕色 I2在水中溶解度较小
B 溶液颜色加深 发生了反应:I2+I-
C 紫黑色晶体消失 I2(aq)的消耗使溶解平衡I2(s) I2(aq)右移
D 溶液褪色 Zn与有色物质发生了置换反应
答案 D
13.★★(2020江苏,13,2分)根据下列实验操作和现象所得到的结论正确的是( )
选项 实验操作和现象 结论
A 向淀粉溶液中加适量20%H2SO4溶液,加热,冷却后加NaOH溶液至中性,再滴加少量碘水,溶液变蓝 淀粉未水解
B 室温下,向0.1 mol·L-1 HCl溶液中加入少量镁粉,产生大量气泡,测得溶液温度上升 镁与盐酸反应放热
C 室温下,向浓度均为0.1 mol·L-1的BaCl2和CaCl2混合溶液中加入Na2CO3溶液,出现白色沉淀 白色沉淀是BaCO3
D 向0.1 mol·L-1 H2O2溶液中滴加0.01 mol·L-1 KMnO4溶液,溶液褪色 H2O2具有氧化性
答案 B
14.★★★(2023北京,19,14分)资料显示,I2可以将Cu氧化为Cu2+。某小组同学设计实验探究Cu被I2氧化的产物及铜元素的价态。
已知:I2易溶于KI溶液,发生反应I2+I- (红棕色);I2和氧化性几乎相同。
(1)将等体积的KI溶液加入m mol铜粉和n mol I2(n>m)的固体混合物中,振荡。实验记录如下:
c(KI) 实验现象
实验Ⅰ 0.01 mol·L-1 极少量I2溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色
实验Ⅱ 0.1 mol·L-1 部分I2溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色
实验Ⅲ 4 mol·L-1 I2完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色
①初始阶段,Cu被氧化的反应速率:实验Ⅰ 实验Ⅱ(填“>”“<”或“=”)。
②实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有[Cu(H2O)4]2+ (蓝色)或[CuI2]- (无色),进行以下实验探究:
步骤a.取实验Ⅲ的深红棕色溶液,加入CCl4,多次萃取、分液。
步骤b.取分液后的无色水溶液,滴入浓氨水,溶液颜色变浅蓝色,并逐渐变深。
ⅰ.步骤a的目的是 。
ⅱ.查阅资料,2Cu2++4I-2CuI↓+I2,[Cu(NH3)2]+ (无色)容易被空气氧化。用离子方程式解释步骤b的溶液中发生的变化: 。
③结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是CuI,实验Ⅰ中铜被氧化的化学方程式是 。分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入浓KI溶液, (填实验现象),观察到少量红色的铜。分析铜未完全反应的原因是 。
(2)上述实验结果,I2仅将Cu氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了I2能将Cu氧化为Cu2+。装置如图所示,a、b分别是 。
(3)运用氧化还原反应规律,分析在上述实验中Cu被I2氧化的产物中价态不同的原因: 。
答案 (1)①< ②ⅰ.加入CCl4萃取溶液中的I2,使c(I2)下降,导致I2+I- 平衡逆向移动,多次萃取、分液可使c()降至极低,即可避免的红棕色对Cu的氧化产物的判断造成干扰 ⅱ.[CuI2]-+2NH3·H2O [Cu(NH3)2]++2I-+2H2O,生成的[Cu(NH3)2]+被空气氧化:4[Cu(NH3)2]++O2+8NH3·H2O 4[Cu(NH3)4]2++4OH-+6H2O ③2Cu+KI3 2CuI+KI 白色沉淀溶解并得到无色溶液 产生的CuI沉淀覆盖在Cu的表面,阻碍Cu进一步反应 (2)Cu、4 mol·L-1 KI溶液和n mol I2的混合物 (3)Cu-e-+I- CuI,I-的存在可提升Cu的还原性,同理Cu2++e-+I- CuI↓,I-的存在可提升Cu2+的氧化性,故当I-存在时,Cu更易被氧化为+1价;而当I-不与Cu和Cu2+直接接触时,才能发生反应Cu+I2 Cu2++2I-,Cu被氧化为+2价
15.★★★(2022福建,12,14分)某兴趣小组设计实验探究Ce-MnOx催化空气氧化CO的效率。回答下列问题:
步骤Ⅰ 制备CO
在通风橱中用下图装置制备CO(加热及夹持装置省略),反应方程式如下:
HCOOH CO↑+H2O
(1)装置A中盛放甲酸的仪器的名称是 。
(2)从B、C、D中选择合适的装置收集CO,正确的接口连接顺序为a→ → → → →h(每空填一个接口标号)。
步骤Ⅱ 检验CO
将CO通入新制银氨溶液中,有黑色沉淀生成。
(3)该反应的化学方程式为 。
步骤Ⅲ 探究Ce-MnOx催化空气氧化CO的效率
将一定量CO与空气混合,得到CO体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至120 ℃,按一定流速通入气体样品。(已知:I2O5是白色固体,易吸水潮解;5CO+I2O5 I2+5CO2)
(4)通入11.2 L(已折算为标准状况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了0.101 6 g I2。
①能证明CO被空气氧化的现象是 ;
②CO被催化氧化的百分率为 ;
③若未通入氮气,②的结果将 (填“偏大”“偏小”或“无影响”)。
(5)探究气体与催化剂接触时长对催化氧化效率的影响时,采用 方法可以缩短接触时长。
(6)步骤Ⅲ装置存在的不足之处是 。
答案 (1)分液漏斗 (2)d e c b(全部写对才可得分) (3)CO+2[Ag(NH3)2]OH 2Ag↓+(NH4)2CO3+2NH3(或其他合理答案) (4)①石灰水变浑浊 ②60% ③偏大 (5)增大气体样品流速 (6)尾气出口未加防潮装置(或其他相似表述)
16.★★★(2021广东,17,15分)含氯物质在生产生活中有重要作用。1774年,舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。
(1)实验室沿用舍勒的方法制取Cl2的化学方程式为 。
(2)实验室制取干燥Cl2时,净化与收集Cl2所需装置的接口连接顺序为 。
(3)某氯水久置后不能使品红溶液褪色,可推测氯水中 已分解。检验此久置氯水中Cl-存在的操作及现象是 。
(4)某合作学习小组进行以下实验探究。
①实验任务 通过测定溶液电导率,探究温度对AgCl溶解度的影响。
②查阅资料 电导率是表征电解质溶液导电能力的物理量。温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;离子浓度一定时,稀溶液电导率随温度的升高而增大。25 ℃时,Ksp(AgCl)=1.8×10-10。
③提出猜想 猜想a:较高温度的AgCl饱和溶液的电导率较大。
猜想b:AgCl在水中的溶解度S(45 ℃)>S(35 ℃)>S(25 ℃)。
④设计实验、验证猜想 取试样Ⅰ、Ⅱ、Ⅲ(不同温度下配制的AgCl饱和溶液),在设定的测试温度下,进行表1中实验1~3,记录数据。
表1
实验序号 试样 测试温度/℃ 电导率/(μS/cm)
1 Ⅰ:25 ℃的AgCl饱和溶液 25 A1
2 Ⅱ:35 ℃的AgCl饱和溶液 35 A2
3 Ⅲ:45 ℃的AgCl饱和溶液 45 A3
⑤数据分析、交流讨论 25 ℃的AgCl饱和溶液中,c(Cl-)= mol/L。
实验结果为A3>A2>A1。小组同学认为,此结果可以证明③中的猜想a成立,但不足以证明猜想b成立。结合②中信息,猜想b不足以成立的理由有 。
⑥优化实验 小组同学为进一步验证猜想b,在实验1~3的基础上完善方案,进行实验4和5。请完成表2中内容。
表2
实验序号 试样 测试温度/℃ 电导率/(μS/cm)
4 Ⅰ B1
5 B2
⑦实验总结 根据实验1~5的结果,并结合②中信息,小组同学认为猜想b也成立。猜想b成立的判断依据是 。
答案 (1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(2)cdbae (3)HClO 取少量久置氯水于试管中,滴加稀硝酸酸化,再滴加硝酸银溶液,产生白色沉淀 (4)⑤1.34×10-5 即使离子浓度相同,温度升高,电导率也会增大;温度升高,水的电离程度增大 ⑥35 Ⅱ 45(或 45 Ⅱ 45) ⑦A2>B1,A3>B2(或A3>B2>B1)
三年模拟
考点强化练
考点1 制备实验方案的设计与评价
1.★(2024届苏州期初调研,3)下列有关实验室制取、收集NO2并制备Cu(NO3)2·6H2O的实验原理和装置正确的是( )
A.用装置甲制取NO2
B.用装置丁收集NO2
C.用装置丙吸收NO2
D.用装置乙蒸干溶液获得Cu(NO3)2·6H2O
答案 C
2.★★(2023连云港第一次调研,7)实验室制备无水FeCl2的装置如图所示(加热及夹持装置略)。已知SOCl2沸点为76 ℃,遇水极易反应生成两种酸性气体。下列说法错误的是( )
A.实验开始时通入N2的目的是排出装置中的O2,防止FeCl2被氧化
B.可先给b加热,再用水浴加热的方式给a加热
C.装置c、d的作用是冷凝回流SOCl2
D.装置f的作用是吸收反应生成的HCl和SO2
答案 B
3.★★(2024届苏州期中,16节选)GeO2粗品中常含有少量As2O3。为了提纯GeO2,可先将其转化为GeCl4,再在0 ℃下水解GeCl4得到高纯GeO2。已知:
①GeO2与As2O3均为两性氧化物,部分晶型的GeO2难溶于盐酸;
②GeCl4常温下是液体,沸点为84 ℃,易与AsCl3共沸;
③AsCl3在pH为0.4~0.6时有还原性。
现有已知As含量的粗品GeO2,补充完整提纯的实验方案:向粗品中分批加入4 mol·L-1 NaOH溶液,直至粗品完全溶解, ,
过滤,洗涤2~3次,干燥。(实验中须使用的试剂:10 mol·L-1盐酸、氯酸钠固体、蒸馏水)
答案 向溶液中加入10 mol·L-1盐酸至pH=0.5(0.4~0.6间的任意数均可),随后加入足量NaClO3固体充分反应;在84 ℃蒸馏,将馏分冷却后,与0 ℃的蒸馏水混合,充分搅拌直至无沉淀生成
4.★★(2024届南通如东开学考,16节选)已知:2[Cu(NH3)4]2++N2H4·H2O+4OH- 2Cu↓+N2↑+8NH3↑+5H2O。铜粉沉淀率与水合肼溶液初始浓度的关系如图所示。请设计由铜氨废液回收铜粉的实验方案:取一定体积6 mol·L-1水合肼溶液, ,静置、过滤、洗涤、干燥。(须使用的试剂:2 mol·L-1 H2SO4溶液、NaOH固体、铜氨废液、蒸馏水)
答案 加入蒸馏水稀释水合肼溶液至3.0~3.25 mol·L-1,加入适量NaOH固体,边搅拌边逐滴加入铜氨废液,加热使其充分反应,同时用2 mol·L-1 H2SO4溶液吸收反应中放出的NH3,直至溶液中无气泡产生,停止滴加
5.★★(2024届扬州中学开学考,16节选)钛酸钡(BaTiO3)是制备电子陶瓷材料的基础原料。
实验室模拟制备钛酸钡的过程如下:
已知:TiCl4能水解生成TiO2+,TiO2+能进一步水解生成TiO2;BaTiO3能与浓硫酸反应生成TiO2+。草酸氧钛钡晶体的化学式为BaTiO(C2O4)2·4H2O。
①Ti(Ⅳ)的存在形式(相对含量分数)与溶液pH的关系如图1所示。“沉钛”时,需加入氨水调节溶液的pH在2~3之间,理由是 。
②由草酸氧钛钡晶体(相对分子质量为449)煅烧制得钛酸钡分为三个阶段。现称取44.9 g草酸氧钛钡晶体进行热重分析,测得残留固体质量与温度的变化关系如图2所示。C点残留固体中含有碳酸钡和钛氧化物,则阶段Ⅱ发生反应的化学方程式为 。
答案 ①pH在2~3之间时,Ti(Ⅳ)主要以[TiO(C2O4)2]2-的形式存在,可直接与Ba2+反应,有利于草酸氧钛钡晶体的生成 ②BaTiO(C2O4)2 BaCO3+TiO2+2CO↑+CO2↑
6.★★★(2023苏州学业质量阳光指标调研,16)实验室以工业级硫酸锰粉末(含少量Ca、Co等的硫酸盐)为原料获得电池级MnSO4,并制备催化剂的载体Mn3O4。
(1)将工业级硫酸锰溶于水,蒸发结晶,趁热过滤除去部分杂质。过程中杂质去除率随MnSO4结晶率[×100%]的变化如图1所示。杂质去除率随MnSO4结晶率的增大反而下降的原因是 。
(2)将除去部分杂质的MnSO4溶于水,先后加入MnF2和MnS分别除去溶液中的Ca2+和Co2+,获得电池级硫酸锰。
①MnF2可将溶液中的Ca2+转化为CaF2。CaF2的晶胞如图2所示,Ca2+周围距离最近且相等的F-个数为 。
②“除钴”时,发生反应Co2++MnS(s) CoS(s)+Mn2+。反应完全后,上层清液中c(Mn2+)/c(Co2+)= 。[Ksp(MnS)=2×10-13,Ksp(CoS)=2×10-25]
(3)MnSO4溶液在碱性条件下通入空气氧化获得Mn3O4,产物中Mn元素质量分数(Mn%)随反应时间和温度变化如图3和图4所示。
①图3所示反应时间超过8 h,Mn%降低的原因是 。
②请设计由MnSO4溶液制备较纯Mn3O4的实验方案: 。
(需用到的试剂:1 mol·L-1NaOH溶液、BaCl2溶液)
答案 (1)水分大量蒸发,硫酸盐杂质结晶析出量增加 (2)①8 ②1012 (3)①Mn3O4被氧化成更高价态锰的氧化物(Mn2O3或MnO2) ②向MnSO4溶液中加入一定量1 mol·L-1NaOH溶液,边搅拌边通入空气,控制75 ℃加热8 h左右,过滤,洗涤,取最后一次洗涤滤液并加入BaCl2溶液,无浑浊
7.★★★(2023南通、淮安等五市第一次调研,16)KIO3是重要的食品添加剂。实验室模拟工业制备KIO3的部分实验流程如下:
(1)“氧化”反应在图1所示装置中进行。先将KClO3与I2混合后放入气密性良好的三颈烧瓶中,加水充分溶解,在90 ℃下边搅拌边滴加20 mL 1 mol·L-1盐酸引发反应,停止滴加盐酸后持续搅拌40 min以上,得到热的KH(IO3)2溶液。
已知:KH(IO3)2不溶于有机溶剂。几种物质的溶解度随温度的变化如图2所示。
①用12 mol·L-1盐酸配制100 mL 1.00 mol·L-1盐酸须使用的玻璃仪器有烧杯、玻璃棒、酸式滴定管、 。
②检查图1所示装置气密性的操作为 。
③“氧化”过程中有少量黄绿色的气态副产物产生。用热的KOH溶液可吸收该气体并实现原料的循环利用。写出该吸收过程中发生反应的化学方程式: 。
④能说明反应已经进行完全的标志是 。
⑤实际工业进行“氧化”反应时,需要在反应设备上连接冷凝回流装置,其目的是 。
(2)除去KH(IO3)2溶液中稍过量I2的实验方法是 。
(3)利用提纯得到的KH(IO3)2粗品(含少量KCl)制备纯净KIO3的实验方案为 。
(须使用的实验药品:KOH溶液、稀硝酸、AgNO3溶液、冰水)
答案 (1)①100 mL容量瓶、胶头滴管 ②连接好装置,关闭分液漏斗活塞,将导管用乳胶管连接后插入水中,微热烧瓶,在导管口有气泡产生 ③3Cl2+6KOH 5KCl+KClO3+3H2O ④溶液的pH不再变化 ⑤冷凝回流I2和HCl,提高原料利用率并防止污染空气 (2)用CCl4萃取后分液 (3)将KH(IO3)2溶于水,向其中滴加KOH溶液至溶液pH>7,加热浓缩、冷却结晶,过滤,用冰水洗涤,直至最后一次洗涤滤液中加入稀硝酸和硝酸银溶液无沉淀产生
8.★★★(2023如皋第一次适应性考试,16)一种以磷铁渣(主要含FeP,以及少量Fe2O3、SiO2等杂质)、KMnO4为原料制备磷酸锰[Mn3(PO4)2]的实验过程如下:
(1)溶解。将一定量的磷铁渣加入如图1所示装置的三颈烧瓶中,维持温度60 ℃,边搅拌边向三颈烧瓶中加入一定量的稀硫酸和KMnO4溶液,反应后有Fe3+、Mn2+和H3PO4生成。反应后过滤。
①写出FeP反应的离子方程式: 。
②实验中当观察到某种现象时可不再加入KMnO4溶液,该现象是 。
③FePO4难溶于水,反应Fe3++H3PO4 FePO4+3H+的平衡常数为 。
[已知Ksp(FePO4)=1×10-22,H3PO4的电离平衡常数=8×10-3、=6×10-8、=4×10-13]
④实验中需不断补充稀硫酸控制溶液的pH。pH过大会降低Fe的浸出率和消耗过多的KMnO4,原因是 。
(2)除铁。向所得滤液中加入萃取剂(由磷酸酯和煤油混合而成,磷酸酯易溶于煤油,难溶于水)萃取溶液中的Fe3+。萃取结束后取有机层,经过反萃取操作,可回收萃取剂重复使用。已知萃取剂中磷酸酯(用HA表示)萃取溶液中Fe3+时发生如下反应:
Fe3++3(HA)2(有机层) Fe(HA2)3(有机层)+3H+
反萃取回收萃取剂的方法是 。
(3)制Mn3(PO4)2。请补充完整由萃取后所得水层中Mn2+、H3PO4制纯净Mn3(PO4)2固体的实验方案:取萃取后所得水层溶液100 mL[其中c(Mn2+)=1.2 mol·L-1], ,干燥沉淀,得Mn3(PO4)2固体。{已知溶液的pH对所得沉淀中锰磷比[]和Mn的沉淀率影响如图2所示。实验中需使用的实验试剂有0.1 mol·L-1H3PO4溶液、NaOH溶液、盐酸、BaCl2溶液}
答案 (1)①5FeP+8Mn+39H+ 5Fe3++8Mn2++5H3PO4+12H2O ②三颈烧瓶中加入KMnO4溶液后浅红色不消失 ③1.92 ④pH过大,Fe3+水解生成Fe(OH)3或转化为FePO4沉淀造成Fe的浸出率降低,KMnO4转化为MnO2,氧化等量的FeP消耗的KMnO4更多 (2)向萃取后所得有机层中(分批次)加入一定量的稀硫酸,充分振荡后静置分液,取有机层 (3)向其中滴加50 mL 0.1 mol·L-1H3PO4溶液,再滴加NaOH溶液,至溶液pH=7,过滤,洗涤沉淀至最后一次洗涤滤液中加入盐酸和BaCl2溶液无沉淀生成
考点2 探究实验方案的设计与评价
9.★★(2024届无锡期中教学质量调研,11)室温下,下列实验方案不能达到探究目的的是( )
选项 实验方案 探究目的
A 向Fe(NO3)3溶液中滴入淀粉,再滴加HI溶液,观察溶液颜色变化 探究I2与Fe3+氧化性强弱
B 用pH计分别测定等物质的量浓度的CH3COOH溶液和CCl3COOH溶液的pH 探究键的极性对羧酸酸性的影响
C 向大小形状完全相同的打磨过的镁条和铝条中加入2 mL 3 mol·L-1盐酸,观察反应剧烈程度 探究镁、铝金属性的强弱
D 向MgCl2溶液中先加入少量氢氧化钠溶液,充分反应后再加入少量CuSO4溶液,观察沉淀颜色的变化 探究Cu(OH)2与Mg(OH)2溶度积的大小
答案 A
10.★★(2024届盐城联盟校第一次调研,13)室温下,下列实验探究方案及现象能达到探究目的的是( )
选项 探究方案及现象 探究目的
A 用pH计测量HF溶液、盐酸的pH,比较溶液pH大小 HF是弱电解质
B 向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀,再加入足量稀盐酸,部分沉淀溶解 Na2SO3不能被空气氧化
C 向NaBr溶液中滴加过量氯水,溶液变橙色,再加入淀粉KI溶液,溶液变蓝色 氧化性: Cl2>Br2>I2
D 向盛有FeSO4溶液的试管中滴加几滴KSCN溶液,振荡,再滴加几滴新制氯水,观察溶液颜色变化 Fe2+具有还原性
答案 D
11.★★(2024届南通如东开学考,11)常温下,根据下列实验操作和现象得出的结论正确的是( )
选项 实验操作和现象 实验结论
A 分别测量浓度均为0.1 mol·L-1 Na2CO3溶液和Na[Al(OH)4]溶液的pH,后者pH更大 [Al(OH)4]-比C更容易结合H+
B 将亚硫酸钠样品溶于水,加入盐酸酸化的Ba(NO3)2溶液,出现白色沉淀 亚硫酸钠样品已变质
C 将盐酸滴入Na2CO3溶液产生无色气体,将产生的气体直接通入Na2SiO3溶液 非金属性:Cl>C>Si
D 向BaCl2溶液中通入SO2和气体X,出现白色沉淀 气体X一定具有氧化性
答案 A
12.★★(2024届苏州期初调研,11)下列实验方案能达到探究目的的是( )
选项 探究目的 实验方案
A 酸性:CH3COOH>HCN 用pH计测量浓度均为0.1 mol·L-1的CH3COONa溶液和NaCN溶液的pH,比较溶液pH大小
B H2O2具有氧化性 向0.1 mol·L-1 H2O2溶液中滴加0.1 mol·L-1 KMnO4溶液,观察溶液颜色变化
C Ksp(AgI)D 提纯含有少量乙酸的乙酸乙酯 向含有少量乙酸的乙酸乙酯中加入过量NaOH溶液,振荡后静置分液
答案 A
13.★★(2023苏锡常镇四市第一次调研,11)根据下列实验操作和现象得出的结论不正确的是( )
选项 实验操作和现象 实验结论
A 向溶有SO2的 BaCl2 溶液中通入气体X,出现白色沉淀 X具有氧化性
B 向0.1 mol·L-1 FeCl3溶液中滴加KI淀粉溶液,溶液变蓝 氧化性:Fe3+>I2
C 向NaHCO3溶液中加入等浓度、等体积的NaAlO2溶液,出现白色沉淀 Al比C更容易结合H+
D 将溴乙烷、乙醇和烧碱的混合物加热,产生的气体经水洗后,再通入酸性KMnO4溶液中,溶液褪色 溴乙烷发生了消去反应
答案 A
14.★★(2023南京二模,10)下列实验探究方案不能达到探究目的的是( )
选项 探究方案 探究目的
A 向两支分别盛有2 mL苯和2 mL甲苯的试管中各加入几滴酸性高锰酸钾溶液,用力振荡,观察现象 探究有机物中基团间的相互作用
B 用分液漏斗向盛有Na2CO3固体的锥形瓶中滴加乙酸溶液,将产生的气体通入盛有苯酚钠溶液的试管中,观察现象 探究乙酸、碳酸和苯酚的酸性强弱
C 向两支试管中各加入2 mL 0.1 mol·L-1 Na2S2O3溶液,分别放入盛有冷水和热水的两个烧杯中,再同时分别向两支试管中加入2 mL 0.1 mol·L-1 H2SO4溶液,振荡,观察现象 探究温度对化学反应速率的影响
D 以Zn、Fe为电极,以酸化的3%NaCl溶液作电解质溶液,连接成原电池装置。过一段时间,从Fe电极区取少量溶液于试管中,再向试管中滴入2滴K3[Fe(CN)6]溶液,观察现象 探究金属的电化学保护法
答案 B
微专题 实验方案设计的文字叙述
1.★★★(2023江苏,16,15分)实验室模拟“镁法工业烟气脱硫”并制备MgSO4·H2O,其实验过程可表示为
(1)在搅拌下向氧化镁浆料中匀速缓慢通入SO2气体,生成MgSO3,反应为
Mg(OH)2+H2SO3 MgSO3+2H2O
其平衡常数K与Ksp[Mg(OH)2]、Ksp(MgSO3)、(H2SO3)、(H2SO3)的代数关系式为K= ;下列实验操作一定能提高氧化镁浆料吸收SO2效率的有 (填序号)。
A.水浴加热氧化镁浆料
B.加快搅拌速率
C.降低通入SO2气体的速率
D.通过多孔球泡向氧化镁浆料中通SO2
(2)在催化剂作用下MgSO3被O2氧化为MgSO4。已知MgSO3的溶解度为0.57 g(20 ℃),O2氧化溶液中S的离子方程式为 ;在其他条件相同时,以负载钴的分子筛为催化剂,浆料中MgSO3被O2氧化的速率随pH的变化如图1所示。在pH=6~8范围内,pH增大,浆料中MgSO3的氧化速率增大,其主要原因是 。
图1
图2
(3)制取MgSO4·H2O晶体。在如图2所示的实验装置中,搅拌下,使一定量的MgSO3浆料与H2SO4溶液充分反应。MgSO3浆料与H2SO4溶液的加料方式是 ;
补充完整制取MgSO4·H2O晶体的实验方案:向含有少量Fe3+、Al3+的MgSO4溶液中, 。
[已知:Fe3+、Al3+在pH≥5时完全转化为氢氧化物沉淀;室温下从MgSO4饱和溶液中结晶出MgSO4·7H2O,MgSO4·7H2O在150~170 ℃下干燥得到MgSO4·H2O,实验中需要使用MgO粉末。]
答案 (1) BD
(2)2S+O2 2S pH增大,c(S)增大,氧化速率加快
(3)用滴液漏斗向盛有MgSO3浆料的三颈瓶中缓慢滴加H2SO4溶液 分批加入少量MgO粉末,搅拌,直至用pH试纸测得pH≥5,过滤;将滤液蒸发浓缩、降温至室温结晶,过滤,所得晶体在150~170 ℃干燥
2.★★★(2023湖南,15,14分)金属Ni对H2有强吸附作用,被广泛用于硝基或羰基等不饱和基团的催化氢化反应。将块状Ni转化成多孔型雷尼Ni后,其催化活性显著提高。
已知:①雷尼Ni暴露在空气中可以自燃,在制备和使用时,需用水或有机溶剂保持其表面“湿润”;
②邻硝基苯胺在极性有机溶剂中更有利于反应的进行。
某实验小组制备雷尼Ni并探究其催化氢化性能的实验如下:
步骤1:雷尼Ni的制备
Ni/Al合金颗粒雷尼Ni混合物 雷尼Ni悬浮液
步骤2:邻硝基苯胺的催化氢化反应
反应的原理和实验装置图如下(夹持装置和搅拌装置略)。装置Ⅰ用于储存H2和监测反应过程。
回答下列问题:
(1)操作(a)中,反应的离子方程式是 ;
(2)操作(d)中,判断雷尼Ni被水洗净的方法是 ;
(3)操作(e)中,下列溶剂中最有利于步骤2中氢化反应的是 ;
A.丙酮 B.四氯化碳
C.乙醇 D.正己烷
(4)向集气管中充入H2时,三通阀的孔路位置如下图所示;发生氢化反应时,集气管向装置Ⅱ供气,此时孔路位置需调节为 ;
(5)仪器M的名称是 ;
(6)反应前应向装置Ⅱ中通入N2一段时间,目的是 ;
(7)如果将三颈瓶N中的导气管口插入液面以下,可能导致的后果是 ;
(8)判断氢化反应完全的现象是 。
答案 (1)2Al+2OH-+2H2O 2Al+3H2↑
(2)取最后一次洗涤液,利用pH试纸测定pH,若洗涤液呈中性,则洗涤干净 (3)C (4)B (5)恒压分液(滴液)漏斗 (6)将装置中空气排出,防止雷尼Ni自燃 (7)倒吸 (8)装置Ⅰ中集气管液面高度不再变化
3.★★★(2022河北,14,14分)某研究小组为了更准确检测香菇中添加剂亚硫酸盐的含量,设计实验如下:
①三颈烧瓶中加入10.00 g香菇样品和400 mL水;锥形瓶中加入125 mL水、1 mL淀粉溶液,并预加0.30 mL 0.010 00 mol·L-1的碘标准溶液,搅拌。
②以0.2 L·min-1流速通氮气,再加入过量磷酸,加热并保持微沸,同时用碘标准溶液滴定,至终点时滴定消耗了1.00 mL碘标准溶液。
③做空白实验,消耗了0.10 mL碘标准溶液。
④用适量Na2SO3替代香菇样品,重复上述步骤,测得SO2的平均回收率为95%。
已知:(H3PO4)=7.1×10-3,(H2SO3)=1.3×10-2。
回答下列问题:
(1)装置图中仪器a、b的名称分别为 、 。
(2)三颈烧瓶适宜的规格为 (填标号)。
A.250 mL B.500 mL C.1 000 mL
(3)解释加入H3PO4能够生成SO2的原因 。
(4)滴定管在使用前需要 、洗涤、润洗;滴定终点时溶液的颜色为 ;滴定反应的离子方程式为 。
(5)若先加磷酸再通氮气,会使测定结果 (填“偏高”“偏低”或“无影响”)。
(6)该样品中亚硫酸盐含量为 mg·kg-1(以SO2计,结果保留三位有效数字)。
答案 (1)球形冷凝管 酸式滴定管 (2)C (3)2H3PO4+S 2H2P+H2SO3,生成的H2SO3在加热条件下分解为SO2和H2O,SO2逸出,溶液中c(H2SO3)减小,促进2H3PO4+S 2H2P+H2SO3平衡正向移动 (4)检验其是否漏水 蓝色 I2+SO2+2H2O 2I-+4H++S (5)偏低 (6)80.8
4.★★★(2019江苏,19,15分)实验室以工业废渣(主要含CaSO4·2H2O,还含少量SiO2、Al2O3、Fe2O3)为原料制取轻质CaCO3和(NH4)2SO4晶体,其实验流程如下:
室温下,反应CaSO4(s)+C(aq)CaCO3(s)+S(aq)达到平衡,则溶液中= [Ksp(CaSO4)=4.8×10-5,Ksp(CaCO3)=3×10-9]。
(2)将氨水和NH4HCO3溶液混合,可制得(NH4)2CO3溶液,其离子方程式为 ;浸取废渣时,向(NH4)2CO3溶液中加入适量浓氨水的目的是 。
(3)废渣浸取在如图所示的装置中进行。控制反应温度在60~70 ℃,搅拌,反应3小时。温度过高将会导致CaSO4的转化率下降,其原因是 ;保持温度、反应时间、反应物和溶剂的量不变,实验中提高CaSO4转化率的操作有 。
(4)滤渣水洗后,经多步处理得到制备轻质CaCO3所需的CaCl2溶液。设计以水洗后的滤渣为原料,制取CaCl2溶液的实验方案:
[已知pH=5时Fe(OH)3和Al(OH)3沉淀完全;pH=8.5时Al(OH)3开始溶解。实验中必须使用的试剂:盐酸和Ca(OH)2]。
答案 (1)1.6×104 (2)HC+NH3·H2O N+C+H2O 增加溶液中C的浓度,促进CaSO4的转化 (3)温度过高,(NH4)2CO3分解 加快搅拌速率 (4)在搅拌下向足量稀盐酸中分批加入滤渣,待观察不到气泡产生后,过滤,向滤液中分批加入少量Ca(OH)2,用pH试纸测量溶液pH,当pH介于5~8.5时,过滤
5.★★★(2020江苏,19,15分)实验室由炼钢污泥(简称铁泥,主要成分为铁的氧化物)制备软磁性材料α-Fe2O3。其主要实验流程如下:
(1)酸浸。用一定浓度的H2SO4溶液浸取铁泥中的铁元素。若其他条件不变,实验中采取下列措施能提高铁元素浸出率的有 (填序号)。
A.适当升高酸浸温度
B.适当加快搅拌速度
C.适当缩短酸浸时间
(2)还原。向“酸浸”后的滤液中加入过量铁粉,使Fe3+完全转化为Fe2+。“还原”过程中除生成Fe2+外,还会生成 (填化学式);检验Fe3+是否还原完全的实验操作是 。
(3)除杂。向“还原”后的滤液中加入NH4F溶液,使Ca2+转化为CaF2沉淀除去。若溶液的pH偏低,将会导致CaF2沉淀不完全,其原因是 [Ksp(CaF2)=5.3×10-9,Ka(HF)=6.3×10-4]。
(4)沉铁。将提纯后的FeSO4溶液与氨水-NH4HCO3混合溶液反应,生成FeCO3沉淀。
①生成FeCO3沉淀的离子方程式为 。
②设计以FeSO4溶液、氨水-NH4HCO3混合溶液为原料,制备FeCO3的实验方案:
[FeCO3沉淀需“洗涤完全”,Fe(OH)2开始沉淀的pH=6.5]。
答案 (1)AB (2)H2 取少量清液,向其中滴加几滴KSCN溶液,观察溶液颜色是否呈血红色 (3)pH偏低形成HF,导致溶液中F-浓度减小,CaF2沉淀不完全
(4)①Fe2++HC+NH3·H2O FeCO3↓+N+H2O或Fe2++HC+NH3 FeCO3↓+N ②在搅拌下向FeSO4溶液中缓慢加入氨水-NH4HCO3混合溶液,控制溶液pH不大于6.5;静置后过滤,所得沉淀用蒸馏水洗涤2~3次;取最后一次洗涤后的滤液,滴加盐酸酸化的BaCl2溶液,不出现白色沉淀
6.★★★(2023南京、盐城一模,16)实验室以氟碳铈矿(主要成分为CeFCO3)为原料制备CeO2粗品,并测定粗品中CeO2的含量。
(1)酸洗。氟碳铈矿和浓硫酸发生反应,生成Ce2(SO4)3等。酸洗不宜在玻璃器皿中进行,其原因是 。
(2)焙烧。Ce2(SO4)3在空气中高温焙烧可得到CeO2和SO3,其反应的化学方程式为 。
(3)测定粗品中CeO2的含量。部分实验操作如下:
步骤Ⅰ 称取0.500 0 g样品置于锥形瓶中,加入蒸馏水和浓硫酸,边搅拌边加入双氧水,低温加热至样品反应完全。
步骤Ⅱ 煮沸,冷却后滴入催化剂硝酸银溶液,加入过量的(NH4)2S2O8溶液,将Ce(Ⅲ)氧化为Ce(Ⅳ),低温加热至锥形瓶中无气体产生[2(NH4)2S2O8+2H2O 4NH4HSO4+O2↑]。再次煮沸、冷却,用硫酸亚铁铵标准溶液滴定。
①“步骤Ⅰ”中加入双氧水的作用是 。
②“步骤Ⅱ”中“再次煮沸”的时间不宜太短,其原因是 。
③请补充完整制备(NH4)2Fe(SO4)2·6H2O晶体的实验方案:称取一定质量的铁粉, ,低温干燥,即可得到硫酸亚铁铵晶体。
已知:(NH4)2SO4+FeSO4+6H2O (NH4)2Fe(SO4)2·6H2O。
必须使用的试剂:1 mol·L-1H2SO4溶液、95%的乙醇溶液、(NH4)2SO4固体。
答案 (1)反应生成的HF会腐蚀玻璃
(2)2Ce2(SO4)3+O2 4CeO2+6SO3
(3)①在H2SO4酸性环境下H2O2将CeO2还原为Ce(Ⅲ)(或Ce3+)
②防止没有分解的(NH4)2S2O8与硫酸亚铁铵反应,使硫酸亚铁铵滴定量增多,造成CeO2含量的测定结果偏大
③加入适量1 mol·L-1 H2SO4溶液反应至无明显气泡产生,过滤、洗涤,称量残余固体质量,向滤液中加入计算量的(NH4)2SO4固体,充分溶解,加热浓缩,冷却结晶,过滤,用95%的乙醇溶液洗涤晶体
7.★★★(2023前黄、姜堰等四校联考,16)硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol-1)易溶于水,难溶于乙醇,在中性和碱性环境中稳定,在酸性环境中易分解,在40 ℃~50 ℃熔化,48 ℃分解。用两种方法制取Na2S2O3·5H2O并加以应用。
Ⅰ.制备Na2S2O3·5H2O
方法一:亚硫酸钠法,反应原理:S+Na2SO3 Na2S2O3。
实验步骤:称取一定量的Na2SO3固体于烧杯中,溶于煮沸过的蒸馏水。另取过量硫粉,加入少量乙醇充分搅拌均匀后,加到上述溶液中。水浴加热,微沸,反应后趁热过滤。滤液蒸发浓缩、冷却结晶析出Na2S2O3·5H2O晶体。再进行减压过滤、洗涤并低温干燥。
(1)S2中心硫原子的杂化方式为 。
(2)向硫粉中加入少量乙醇充分搅拌均匀的目的是 。
方法二:硫化碱法,装置如下图所示。
(3)①装置C中,将Na2S和Na2CO3以2∶1的物质的量之比配成溶液再通入SO2,便可制得Na2S2O3和CO2。反应的化学方程式为 。
②三颈烧瓶中两种固体溶解时,需先将Na2CO3固体溶于水配成溶液,再将Na2S固体溶于Na2CO3溶液中,其目的是 。
③实验过程中,装置C中的澄清溶液先变浑浊,后变澄清时生成大量的Na2S2O3,一段时间后,再次出现少量浑浊,此时须立刻停止通入SO2。为了保证Na2S2O3·5H2O的产量,实验中通入的SO2不能过量,原因是 。
Ⅱ.Na2S2O3的应用
(4)某消毒液中含有ClO2和Cl2两种主要成分。请补充完整用Na2S2O3标准溶液测定该消毒液中ClO2含量的实验方案:量取5.00 mL消毒液于锥形瓶中,加蒸馏水稀释到25.00 mL, ,重复实验2~3次,取实验平均值计算ClO2含量。
已知:①2ClO2+2KI 2KClO2+I2;
②KClO2+4KI+2H2SO4 KCl+2K2SO4+2I2+2H2O,该反应在pH=3时进行;
③2Na2S2O3+I2 Na2S4O6+2NaI。
(必须使用的试剂:0.100 0 mol·L-1 Na2S2O3标准溶液、淀粉溶液、KI溶液、稀硫酸)
(5)设计以下实验测定粗产品中Na2S2O3·5H2O的含量:
步骤1:准确称取8.000 g样品溶于水,加入5 mL甲醛,配成100 mL溶液。
步骤2:准确称取0.294 0 g K2Cr2O7固体于碘量瓶中,加入20 mL蒸馏水溶解,再加入10 mL 2 mol·L-1 H2SO4和20 mL 10% KI溶液使铬元素完全转化为Cr3+,加水稀释至100 mL。
步骤3:向碘量瓶中加入1 mL 1%淀粉,用待测Na2S2O3溶液滴定碘量瓶中溶液至滴定终点,消耗Na2S2O3溶液20.00 mL。(已知:I2+2S2 2I-+S4)
试计算Na2S2O3·5H2O的纯度。(写出计算过程)
答案 (1)sp3 (2)硫粉微溶于乙醇,在乙醇中有一定的溶解度,从而增大反应物的接触面积,加快反应速率
(3)①4SO2+2Na2S+Na2CO3 3Na2S2O3+CO2
②Na2CO3溶液显碱性,可以抑制Na2S水解,防止产生H2S气体 ③若SO2过量,溶液显酸性,产物分解
(4)向其中加入过量KI溶液,充分振荡,以淀粉溶液为指示剂,用0.100 0 mol·L-1 Na2S2O3标准溶液滴定至终点,加入稀硫酸调节溶液pH=3,再以淀粉溶液为指示剂,用0.100 0 mol·L-1 Na2S2O3标准溶液滴定至终点,记录第二次滴定消耗Na2S2O3溶液的体积
(5)根据Cr2+6I-+14H+ 2Cr3++3I2+7H2O、I2+2S2 2I-+S4可得关系式Cr2~3I2~6S2,n(K2Cr2O7)==1.000×10-3 mol,n(Na2S2O3·5H2O)=6n(K2Cr2O7)=1.000×10-3 mol×6=6.000×10-3 mol,样品中m(Na2S2O3·5H2O)=6.000×10-3 mol×248 g·mol-1×=7.440 g,样品中Na2S2O3·5H2O的纯度为×100%=93.00%。
8.★★★(2023扬州期初调研,16)纳米铁粉可去除水中的Cr(Ⅵ)。由于其活性较强,制备时常使其表面形成保护性氧化膜。
(1)纳米铁粉的制备。实验室以NaBH4溶液(碱性)与FeSO4溶液为原料制备纳米铁粉(装置如图1),将A溶液加入三颈烧瓶中,通过滴液漏斗缓慢加入B溶液,产生大量H2。反应结束后将三颈烧瓶分别放置0、2、4、6小时,待纳米铁粉表面产生不同厚度的氧化膜后,分别取出固体,洗涤、干燥,得4种纳米铁粉(以Fe-0、Fe-2、Fe-4、Fe-6表示)。滴液漏斗内的B溶液是 。NaBH4中B为+3价,理论上每生成1 mol Fe,与FeSO4反应的NaBH4的物质的量是 mol。
(2)研究放置时间对纳米铁粉性能的影响。实验一:室温下,取相同质量的4种纳米铁粉分别投入相同体积、含Cr(Ⅵ)浓度相同的污水中,一段时间后测量Cr(Ⅵ)去除率;
实验二:取4份相同体积的蒸馏水分别置于三颈烧瓶中,再各加入相同质量的4种纳米铁粉,搅拌,相同时间后测量溶液中c(Fe2+),结果如图2所示。请对纳米铁粉制备时放置时间、使用时溶出的少量Fe2+与Cr(Ⅵ)去除率之间的关系作出猜想: 。
(3)研究影响纳米铁粉溶出c(Fe2+)的因素。取一定量蒸馏水,用HCl调节pH约为6。将其分为相同体积的两份并分别置于三颈烧瓶中,向其中一份通入N2;再各加入相同质量的纳米铁粉,搅拌,一段时间后测得未通N2的三颈烧瓶内溶液中c(Fe2+)大于通入N2的。
①该条件下纳米铁粉溶出Fe2+的原因是 。
②实验时不将蒸馏水调节至较低pH,理由是 。
(4)纳米铁粉去除Cr(Ⅵ)主要是经过“吸附→反应→共沉淀”的过程。pH<8.6,纳米铁粉颗粒表面带正电荷;pH=8.6,纳米铁粉颗粒表面不带电;pH>8.6,纳米铁粉颗粒表面带负电荷。在水溶液中Cr(Ⅵ)主要存在微粒平衡浓度占Cr(Ⅵ)总浓度的百分数与pH的关系如图3。以实验室制得的纳米铁粉去除pH=4的水样中的Cr(Ⅵ),请补充完整实验方案:将一定量水样置于烧杯中, ,
反应一段时间,测量溶液中c[Cr(Ⅵ)],待c[Cr(Ⅵ)]小于1×10-3 mol·L-1,分离出固体。(还可使用的试剂:0.1 mol·L-1 NaOH溶液,0.1 mol·L-1 盐酸)
答案 (1)NaBH4溶液 0.5 (2)纳米铁粉制备时放置时间越长,表面形成的氧化膜越厚;一定厚度的氧化膜有利于纳米铁粉使用时溶出Fe2+,厚度过大或过小均不利于其使用时溶出Fe2+;纳米铁粉使用时溶出的Fe2+有助于Cr(Ⅵ)的去除 (3)①水中溶解的O2在弱酸性条件下与纳米铁粉反应生成Fe2+ ②溶液pH过低,c(H+)过大,纳米铁粉直接与H+反应 (4)用0.1 mol·L-1 NaOH溶液调节水样pH约为6(略小于8.6),向其中加入适量Fe-4纳米铁粉,搅拌
9.★★★(2024届南京学情调研,16)实验室制备NaClO溶液并用于处理含氨氮废水。
(1)低温下将Cl2通入NaOH溶液中制得NaClO溶液,装置如图1所示。
①装置B中盛放的试剂是 。
②为了防止装置C温度升高生成副产物NaClO3,可采取的操作为 。
(2)NaClO溶液处理含氨氮废水(pH为6.0~7.0)。室温下,分别取200 mL预处理后的废水,将初始pH调节至不同值,加入等量NaClO溶液,30分钟后检测剩余氨氮浓度。不同初始pH对NaClO氧化脱除氨氮效果的影响如图2所示,不同初始pH对应反应结束后的pH如图3所示。
①NaClO将废水中NH3氧化为无污染气体,反应的化学方程式为 ,实验中NaClO溶液的实际投入量大于理论计算量,其原因是 。
②处理后的废水pH在6.0~9.0之间才能排放。NaClO溶液处理含氨氮废水初始pH设置为7.0而不是2.0的原因是 。
(3)用滴定法测定NaClO溶液中有效氯含量的原理为ClO-+2I-+2H+ I2+Cl-+H2O;I2+2S2 S4+2I-。请补充完整该实验方案:取5.00 mL NaClO溶液样品配制成250 mL溶液,取25.00 mL待测液于碘量瓶中,加入10 mL 2 mol·L-1 H2SO4溶液和过量KI溶液,密封在暗处静置5 min; 。(须使用的试剂:0.050 0 mol·L-1 Na2S2O3溶液、淀粉溶液)
答案 (1)①饱和食盐水 ②装置C使用冰水浴冷却,向装置A中缓慢滴加浓盐酸 (2)①2NH3+3NaClO N2↑+3H2O+3NaCl NaClO(或HClO)不稳定,易分解 ②pH为7.0时氨氮去除率高,反应后pH约为9且调节pH所需的酸更少
(3)用0.050 0 mol·L-1 Na2S2O3溶液滴定至溶液呈微黄色,加入2~3滴淀粉溶液,继续滴定至加入最后半滴Na2S2O3溶液后,溶液蓝色褪去,且30 s内不恢复原来的颜色。平行滴定三次,记录消耗Na2S2O3溶液的体积
10.★★★(2023如皋第二次适应性考试,16)碘及碘化钾是实验室中的常见试剂,含碘废液中碘元素通常以I-、、I2和I中的一种或多种形式存在,回收碘具有很好的经济价值。
(1)为检验某实验室酸性废液中是否含I-,现进行如下实验:取少量废液,向其中滴加淀粉溶液,溶液不变蓝。另取少量废液, ,则溶液中含有I-。请补充完整该实验方案,实验中可以选用的试剂有FeCl3溶液、FeCl2溶液、淀粉溶液、KSCN溶液、K3[Fe(CN)6]溶液。
(2)一种由含I-的废液制取单质碘的流程如下:
①沉碘时应向废液中加入足量的Na2S2O3溶液,再加入CuSO4溶液至沉淀不再增加。
a.沉碘时有CuI沉淀和Na2S4O6生成,写出该反应的离子方程式: 。
b.若不加入Na2S2O3溶液,仅加入CuSO4溶液也可生成CuI沉淀。沉碘时不是仅加入CuSO4溶液的原因是 。
②氧化、蒸发的装置如图所示。
a.球形干燥管的作用是 。
b.蒸发出的碘蒸气冷却后易凝固。实验过程中,若发现玻璃导管中有单质碘凝固析出,为防止堵塞,可以采取的方法是 。
(3)若废液中含有I2,可以用CCl4进行萃取,萃取后所得有机层可以用KOH溶液进行反萃取。反萃取后所得水层中的溶质为KIO3和KI。请补充完整由反萃取后所得水层制取KI晶体的实验方案:取反萃取后所得水层, 。
(已知KI易溶于水;氧化性:KIO3>S。实验中可以选用的试剂有H2S气体、NaOH溶液、稀硫酸)
(4)某含碘废液中,碘元素以I形式存在,为测定I的浓度,现进行如下实验:准确量取20.00 mL废液,加水稀释配成100 mL溶液,取20.00 mL溶液,加入盐酸,加入足量KI晶体,以淀粉为指示剂,用0.100 0 mol·L-1 Na2S2O3溶液滴定I2至恰好完全反应,消耗Na2S2O3溶液24.00 mL。已知测定过程中发生的反应为I+I-+H+——I2+H2O(未配平);I2+S2——I-+S4(未配平)。计算废液中I的物质的量浓度,并写出计算过程。
答案 (1)向其中滴加几滴淀粉溶液,再滴入FeCl3溶液,若溶液变蓝 (2)①a.2Cu2++2I-+2S2 2CuI↓+S4 b.仅加入CuSO4溶液,生成的CuI沉淀的量将减少一半,最终回收的I2也将减少一半 ②a.防止倒吸 b.用酒精灯加热有单质碘析出的导管部位 (3)向其中边搅拌边通入H2S气体,至静置后向上层清液中通入H2S气体时,不再有沉淀生成,停止通入;过滤,将所得溶液蒸发结晶,得到KI晶体,同时将蒸发所得的气体通入NaOH溶液中 (4)n(S2)=0.100 0 mol·L-1×24.00 mL×10-3 mL·L-1=2.4×10-3 mol n(I2)=n(S2)=×2.4×10-3 mol=1.2×10-3 mol 原废液中n(I)=n(I2)×=×1.2×10-3 mol×5=2.0×10-3 mol 废液中c(I)==0.10 mol·L-1
专题十七 实验方案的设计与评价
五年高考
考点过关练
考点1 制备实验方案的设计与评价
1.★★(2023全国乙,9,6分)下列装置可以用于相应实验的是( )
答案 D
2.★★(2021海南,3,2分)用如图装置制取干燥的气体(a、b表示加入的试剂),能实现的是( )
选项 气体 a b
A H2S 稀H2SO4 FeS
B O2 H2O2溶液 MnO2
C NO2 浓HNO3 铁片
D NH3 浓氨水 CaO
答案 B
3.★★(2021北京,5,3分)实验室制备下列气体所选试剂、制备装置及收集方法均正确的是 ( )
a b
c d e
气体 试剂 制备装置 收集方法
A O2 KMnO4 a d
B H2 Zn+稀H2SO4 b e
C NO Cu+稀HNO3 b c
D CO2 石灰石+稀H2SO4 b c
答案 B
4.★★★(2021江苏,17,15分)以软锰矿粉(含MnO2及少量Fe、Al、Si、Ca、Mg等的氧化物)为原料制备电池级MnO2。
图1
(1)浸取。将一定量软锰矿粉与Na2SO3、H2SO4溶液中的一种配成悬浊液,加入三颈瓶中(装置如图1),70 ℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中的溶液是 ;MnO2转化为Mn2+的离子方程为 。
(2)除杂。向已经除去Fe、Al、Si的MnSO4溶液(pH约为5)中加入NH4F溶液,溶液中的Ca2+、Mg2+形成氟化物沉淀。若沉淀后上层清液中c(F-)=0.05 mol·L-1,则c(Ca2+)/c(Mg2+)= 。[Ksp(MgF2)=5×10-11,Ksp(CaF2)=5×10-9]
(3)制备MnCO3。在搅拌下向100 mL 1 mol·L-1 MnSO4溶液中缓慢滴加1 mol·L-1 NH4HCO3溶液,过滤、洗涤、干燥,得到MnCO3固体。需加入NH4HCO3溶液的体积约为 。
(4)制备MnO2。MnCO3经热解、酸浸等步骤可制备MnO2。MnCO3在空气气流中热解得到三种价态锰的氧化物,锰元素所占比例(×100%)随热解温度变化的曲线如图2所示。已知:MnO与酸反应生成Mn2+;Mn2O3氧化性强于Cl2,在加热条件下Mn2O3在酸性溶液中转化为MnO2和Mn2+。
图2
为获得较高产率的MnO2,请补充实验方案:取一定量MnCO3置于热解装置中,通空气气流, ,固体干燥,得到MnO2。(可选用的试剂:1 mol·L-1 H2SO4溶液、2 mol·L-1 HCl溶液、BaCl2溶液、AgNO3溶液)
答案 (1)H2SO4溶液 MnO2+S+2H+Mn2++S+H2O (2)100 (3)200 mL
(4)加热至约450 ℃分解一段时间,将冷却后的固体加入至适量1 mol·L-1H2SO4溶液中,加热,搅拌反应一段时间,过滤,用水洗涤,取最后一次洗涤滤液,向其中滴加BaCl2溶液,无白色沉淀生成
5.★★★(2022海南,15,10分)胆矾(CuSO4·5H2O)是一种重要化工原料。某研究小组以生锈的铜屑为原料[主要成分是Cu,含有少量的油污、CuO、CuCO3、Cu(OH)2]制备胆矾。流程如下:
回答问题:
(1)步骤①的目的是 。
(2)步骤②中,若仅用浓H2SO4溶解固体B,将生成 (填化学式)污染环境。
(3)步骤②中,在H2O2存在下Cu溶于稀H2SO4,反应的化学方程式为 。
(4)经步骤④得到的胆矾,不能用水洗涤的主要原因是 。
(5)实验证明,滤液D能将I-氧化为I2。
ⅰ.甲同学认为不可能是步骤②中过量H2O2将I-氧化为I2,理由是 。
ⅱ.乙同学通过实验证实,只能是Cu2+将I-氧化为I2,写出乙同学的实验方案及结果
(不要求写具体操作过程)。
答案 (1)除油污 (2)SO2
(3)Cu+H2O2+H2SO4 CuSO4+2H2O
(4)胆矾晶体易溶于水
(5)ⅰ.溶液C经步骤③加热浓缩后H2O2已完全分解
ⅱ.取滤液,向其中加入适量硫化钠,使铜离子恰好完全沉淀,再加入I-,不能被氧化
6.★★★(2023新课标,28,14分)实验室由安息香制备二苯乙二酮的反应式如下:
相关信息列表如下:
物质 性状 熔点/℃ 沸点/℃ 溶解性
安息香 白色固体 133 344 难溶于冷水 溶于热水、乙醇、乙酸
二苯乙 二酮 淡黄色固体 95 347 不溶于水 溶于乙醇、苯、乙酸
冰乙酸 无色液体 17 118 与水、乙醇互溶
装置示意图如图所示,实验步骤:
①在圆底烧瓶中加入10 mL冰乙酸、5 mL水及9.0 g FeCl3·6H2O,边搅拌边加热,至固体全部溶解。
②停止加热,待沸腾平息后加入2.0 g安息香,加热回流45~60 min。
③加入50 mL水,煮沸后冷却,有黄色固体析出。
④过滤,并用冷水洗涤固体3次,得到粗品。
⑤粗品用75%的乙醇重结晶,干燥后得淡黄色结晶1.6 g。
回答下列问题:
(1)仪器A中应加入 (填“水”或“油”)作为热传导介质。
(2)仪器B的名称是 ;冷却水应从 (填“a”或“b”)口通入。
(3)实验步骤②中,安息香必须待沸腾平息后方可加入,其主要目的是 。
(4)在本实验中,FeCl3为氧化剂且过量,其还原产物为 ;某同学尝试改进本实验:采用催化量的FeCl3并通入空气制备二苯乙二酮。该方案是否可行 简述判断理由: 。
(5)本实验步骤①~③在乙酸体系中进行,乙酸除作溶剂外,另一主要作用是防止 。
(6)若粗品中混有少量未氧化的安息香,可用少量 洗涤的方法除去(填标号)。若要得到更高纯度的产品,可用重结晶的方法进一步提纯。
a.热水 b.乙酸 c.冷水 d.乙醇
(7)本实验的产率最接近于 (填标号)。
a.85% b.80% c.75% d.70%
答案 (1)油 (2)球形冷凝管 a
(3)防止暴沸 (4)FeCl2[Fe2+/Fe(Ⅱ)/Fe(CH3COO)2均可] 可行,空气中的O2可将Fe2+氧化为Fe3+,从而实现催化循环 (5)FeCl3水解[生成Fe(OH)3/Fe(OH)3胶体均可] (6)a (7)b
7.★★★(2023辽宁,17,13分)2-噻吩乙醇(Mr=128)是抗血栓药物氯吡格雷的重要中间体,其制备方法如下:
Ⅰ.制钠砂。向烧瓶中加入300 mL液体A和4.60 g金属钠,加热至钠熔化后,盖紧塞子,振荡至大量微小钠珠出现。
Ⅱ.制噻吩钠。降温至10 ℃,加入25 mL噻吩,反应至钠砂消失。
Ⅲ.制噻吩乙醇钠。降温至-10 ℃,加入稍过量的环氧乙烷的四氢呋喃溶液,反应30 min。
Ⅳ.水解。恢复至室温,加入70 mL水,搅拌30 min;加盐酸调pH至4~6,继续反应2 h,分液;用水洗涤有机相,二次分液。
Ⅴ.分离。向有机相中加入无水MgSO4,静置,过滤,对滤液进行蒸馏,蒸出四氢呋喃、噻吩和液体A后,得到产品17.92 g。
回答下列问题:
(1)步骤Ⅰ中液体A可以选择 。
a.乙醇 b.水 c.甲苯 d.液氨
(2)噻吩沸点低于吡咯()的原因是 。
(3)步骤Ⅱ的化学方程式为 。
(4)步骤Ⅲ中反应放热,为防止温度过高引发副反应,加入环氧乙烷的四氢呋喃溶液的方法是 。
(5)步骤Ⅳ中用盐酸调节pH的目的是 。
(6)下列仪器在步骤Ⅴ中无需使用的是 (填名称);无水MgSO4的作用为 。
(7)产品的产率为 (用Na计算,精确至0.1%)。
答案 (1)c (2)吡咯可以形成分子间氢键,而噻吩不能形成分子间氢键
(3)
(4)向烧瓶中缓慢滴入稍过量的环氧乙烷的四氢呋喃溶液,并不断搅拌 (5)与水解产生的NaOH反应,提高转化率 (6)球形冷凝管、分液漏斗 去除有机相中少量的水
(7)70.0%
8.★★★(2023山东,18,12分)三氯甲硅烷(SiHCl3)是制取高纯硅的重要原料,常温下为无色液体,沸点为31.8 ℃,熔点为-126.5 ℃,易水解。实验室根据反应Si+3HCl SiHCl3+H2,利用如下装置制备SiHCl3粗品(加热及夹持装置略)。回答下列问题:
(1)制备SiHCl3时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入HCl,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为 ;判断制备反应结束的实验现象是 。图示装置存在的两处缺陷是 。
(2)已知电负性Cl>H>Si,SiHCl3在浓NaOH溶液中发生反应的化学方程式为 。
(3)采用如下方法测定溶有少量HCl的SiHCl3纯度。
m1 g样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:① ,
② (填操作名称),③称量等操作,测得所得固体氧化物质量为m2 g。从下列仪器中选出①、②中需使用的仪器,依次为 (填标号)。测得样品纯度为 (用含m1、m2的代数式表示)。
A B C D
答案 (1)连接好装置,并检查装置的气密性 装置C的蒸馏烧瓶中不再有液体滴下 装置C、D之间缺少干燥装置,缺少处理尾气H2的装置 (2)SiHCl3+5NaOH Na2SiO3+3NaCl+H2↑+2H2O (3)灼烧 冷却 A、C ×100%
考点2 探究实验方案的设计与评价
9.★★(2019江苏,13,4分)室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 实验操作和现象 结论
A 向X溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液变为红色 X溶液中一定含有Fe2+
B 向浓度均为0.05 mol·L-1的NaI、NaCl混合溶液中滴加少量AgNO3溶液,有黄色沉淀生成 Ksp(AgI)>Ksp(AgCl)
C 向3 mL KI溶液中滴加几滴溴水,振荡,再滴加1 mL淀粉溶液,溶液显蓝色 Br2的氧化性比I2的强
D 用pH试纸测得:CH3COONa溶液的pH约为9,NaNO2溶液的pH约为8 HNO2电离出H+的能力比CH3COOH的强
答案 C
10.(2022江苏,11,3分)室温下,下列实验探究方案不能达到探究目的的是( )
选项 探究方案 探究目的
A 向盛有FeSO4溶液的试管中滴加几滴KSCN溶液,振荡,再滴加几滴新制氯水,观察溶液颜色变化 Fe2+具有还原性
B 向盛有SO2水溶液的试管中滴加几滴品红溶液,振荡,加热试管,观察溶液颜色变化 SO2具有漂白性
C 向盛有淀粉-KI溶液的试管中滴加几滴溴水,振荡,观察溶液颜色变化 Br2的氧化性比I2的强
D 用pH计测量醋酸、盐酸的pH,比较溶液pH大小 CH3COOH是弱电解质
答案 D
11.★★(2023新课标,11,6分)根据实验操作及现象,下列结论中正确的是( )
选项 实验操作及现象 结论
A 常温下将铁片分别插入稀硝酸和浓硝酸中,前者产生无色气体,后者无明显现象 稀硝酸的氧化性比浓硝酸强
B 取一定量Na2SO3样品,溶解后加入BaCl2溶液,产生白色沉淀。加入浓HNO3,仍有沉淀 此样品中含有S
C 将银和AgNO3溶液与铜和Na2SO4溶液组成原电池。连通后银表面有银白色金属沉积,铜电极附近溶液逐渐变蓝 Cu的金属性比Ag强
D 向溴水中加入苯,振荡后静置,水层颜色变浅 溴与苯发生了加成反应
答案 C
12.★★(2023辽宁,13,3分)某小组进行实验,向10 mL 蒸馏水中加入0.4 g I2,充分振荡,溶液呈浅棕色,再加入0.2 g锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知(aq)为棕色,下列关于颜色变化的解释错误的是( )
选项 颜色变化 解释
A 溶液呈浅棕色 I2在水中溶解度较小
B 溶液颜色加深 发生了反应:I2+I-
C 紫黑色晶体消失 I2(aq)的消耗使溶解平衡I2(s) I2(aq)右移
D 溶液褪色 Zn与有色物质发生了置换反应
答案 D
13.★★(2020江苏,13,2分)根据下列实验操作和现象所得到的结论正确的是( )
选项 实验操作和现象 结论
A 向淀粉溶液中加适量20%H2SO4溶液,加热,冷却后加NaOH溶液至中性,再滴加少量碘水,溶液变蓝 淀粉未水解
B 室温下,向0.1 mol·L-1 HCl溶液中加入少量镁粉,产生大量气泡,测得溶液温度上升 镁与盐酸反应放热
C 室温下,向浓度均为0.1 mol·L-1的BaCl2和CaCl2混合溶液中加入Na2CO3溶液,出现白色沉淀 白色沉淀是BaCO3
D 向0.1 mol·L-1 H2O2溶液中滴加0.01 mol·L-1 KMnO4溶液,溶液褪色 H2O2具有氧化性
答案 B
14.★★★(2023北京,19,14分)资料显示,I2可以将Cu氧化为Cu2+。某小组同学设计实验探究Cu被I2氧化的产物及铜元素的价态。
已知:I2易溶于KI溶液,发生反应I2+I- (红棕色);I2和氧化性几乎相同。
(1)将等体积的KI溶液加入m mol铜粉和n mol I2(n>m)的固体混合物中,振荡。实验记录如下:
c(KI) 实验现象
实验Ⅰ 0.01 mol·L-1 极少量I2溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色
实验Ⅱ 0.1 mol·L-1 部分I2溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色
实验Ⅲ 4 mol·L-1 I2完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色
①初始阶段,Cu被氧化的反应速率:实验Ⅰ 实验Ⅱ(填“>”“<”或“=”)。
②实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有[Cu(H2O)4]2+ (蓝色)或[CuI2]- (无色),进行以下实验探究:
步骤a.取实验Ⅲ的深红棕色溶液,加入CCl4,多次萃取、分液。
步骤b.取分液后的无色水溶液,滴入浓氨水,溶液颜色变浅蓝色,并逐渐变深。
ⅰ.步骤a的目的是 。
ⅱ.查阅资料,2Cu2++4I-2CuI↓+I2,[Cu(NH3)2]+ (无色)容易被空气氧化。用离子方程式解释步骤b的溶液中发生的变化: 。
③结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是CuI,实验Ⅰ中铜被氧化的化学方程式是 。分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入浓KI溶液, (填实验现象),观察到少量红色的铜。分析铜未完全反应的原因是 。
(2)上述实验结果,I2仅将Cu氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了I2能将Cu氧化为Cu2+。装置如图所示,a、b分别是 。
(3)运用氧化还原反应规律,分析在上述实验中Cu被I2氧化的产物中价态不同的原因: 。
答案 (1)①< ②ⅰ.加入CCl4萃取溶液中的I2,使c(I2)下降,导致I2+I- 平衡逆向移动,多次萃取、分液可使c()降至极低,即可避免的红棕色对Cu的氧化产物的判断造成干扰 ⅱ.[CuI2]-+2NH3·H2O [Cu(NH3)2]++2I-+2H2O,生成的[Cu(NH3)2]+被空气氧化:4[Cu(NH3)2]++O2+8NH3·H2O 4[Cu(NH3)4]2++4OH-+6H2O ③2Cu+KI3 2CuI+KI 白色沉淀溶解并得到无色溶液 产生的CuI沉淀覆盖在Cu的表面,阻碍Cu进一步反应 (2)Cu、4 mol·L-1 KI溶液和n mol I2的混合物 (3)Cu-e-+I- CuI,I-的存在可提升Cu的还原性,同理Cu2++e-+I- CuI↓,I-的存在可提升Cu2+的氧化性,故当I-存在时,Cu更易被氧化为+1价;而当I-不与Cu和Cu2+直接接触时,才能发生反应Cu+I2 Cu2++2I-,Cu被氧化为+2价
15.★★★(2022福建,12,14分)某兴趣小组设计实验探究Ce-MnOx催化空气氧化CO的效率。回答下列问题:
步骤Ⅰ 制备CO
在通风橱中用下图装置制备CO(加热及夹持装置省略),反应方程式如下:
HCOOH CO↑+H2O
(1)装置A中盛放甲酸的仪器的名称是 。
(2)从B、C、D中选择合适的装置收集CO,正确的接口连接顺序为a→ → → → →h(每空填一个接口标号)。
步骤Ⅱ 检验CO
将CO通入新制银氨溶液中,有黑色沉淀生成。
(3)该反应的化学方程式为 。
步骤Ⅲ 探究Ce-MnOx催化空气氧化CO的效率
将一定量CO与空气混合,得到CO体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至120 ℃,按一定流速通入气体样品。(已知:I2O5是白色固体,易吸水潮解;5CO+I2O5 I2+5CO2)
(4)通入11.2 L(已折算为标准状况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了0.101 6 g I2。
①能证明CO被空气氧化的现象是 ;
②CO被催化氧化的百分率为 ;
③若未通入氮气,②的结果将 (填“偏大”“偏小”或“无影响”)。
(5)探究气体与催化剂接触时长对催化氧化效率的影响时,采用 方法可以缩短接触时长。
(6)步骤Ⅲ装置存在的不足之处是 。
答案 (1)分液漏斗 (2)d e c b(全部写对才可得分) (3)CO+2[Ag(NH3)2]OH 2Ag↓+(NH4)2CO3+2NH3(或其他合理答案) (4)①石灰水变浑浊 ②60% ③偏大 (5)增大气体样品流速 (6)尾气出口未加防潮装置(或其他相似表述)
16.★★★(2021广东,17,15分)含氯物质在生产生活中有重要作用。1774年,舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。
(1)实验室沿用舍勒的方法制取Cl2的化学方程式为 。
(2)实验室制取干燥Cl2时,净化与收集Cl2所需装置的接口连接顺序为 。
(3)某氯水久置后不能使品红溶液褪色,可推测氯水中 已分解。检验此久置氯水中Cl-存在的操作及现象是 。
(4)某合作学习小组进行以下实验探究。
①实验任务 通过测定溶液电导率,探究温度对AgCl溶解度的影响。
②查阅资料 电导率是表征电解质溶液导电能力的物理量。温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;离子浓度一定时,稀溶液电导率随温度的升高而增大。25 ℃时,Ksp(AgCl)=1.8×10-10。
③提出猜想 猜想a:较高温度的AgCl饱和溶液的电导率较大。
猜想b:AgCl在水中的溶解度S(45 ℃)>S(35 ℃)>S(25 ℃)。
④设计实验、验证猜想 取试样Ⅰ、Ⅱ、Ⅲ(不同温度下配制的AgCl饱和溶液),在设定的测试温度下,进行表1中实验1~3,记录数据。
表1
实验序号 试样 测试温度/℃ 电导率/(μS/cm)
1 Ⅰ:25 ℃的AgCl饱和溶液 25 A1
2 Ⅱ:35 ℃的AgCl饱和溶液 35 A2
3 Ⅲ:45 ℃的AgCl饱和溶液 45 A3
⑤数据分析、交流讨论 25 ℃的AgCl饱和溶液中,c(Cl-)= mol/L。
实验结果为A3>A2>A1。小组同学认为,此结果可以证明③中的猜想a成立,但不足以证明猜想b成立。结合②中信息,猜想b不足以成立的理由有 。
⑥优化实验 小组同学为进一步验证猜想b,在实验1~3的基础上完善方案,进行实验4和5。请完成表2中内容。
表2
实验序号 试样 测试温度/℃ 电导率/(μS/cm)
4 Ⅰ B1
5 B2
⑦实验总结 根据实验1~5的结果,并结合②中信息,小组同学认为猜想b也成立。猜想b成立的判断依据是 。
答案 (1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(2)cdbae (3)HClO 取少量久置氯水于试管中,滴加稀硝酸酸化,再滴加硝酸银溶液,产生白色沉淀 (4)⑤1.34×10-5 即使离子浓度相同,温度升高,电导率也会增大;温度升高,水的电离程度增大 ⑥35 Ⅱ 45(或 45 Ⅱ 45) ⑦A2>B1,A3>B2(或A3>B2>B1)
三年模拟
考点强化练
考点1 制备实验方案的设计与评价
1.★(2024届苏州期初调研,3)下列有关实验室制取、收集NO2并制备Cu(NO3)2·6H2O的实验原理和装置正确的是( )
A.用装置甲制取NO2
B.用装置丁收集NO2
C.用装置丙吸收NO2
D.用装置乙蒸干溶液获得Cu(NO3)2·6H2O
答案 C
2.★★(2023连云港第一次调研,7)实验室制备无水FeCl2的装置如图所示(加热及夹持装置略)。已知SOCl2沸点为76 ℃,遇水极易反应生成两种酸性气体。下列说法错误的是( )
A.实验开始时通入N2的目的是排出装置中的O2,防止FeCl2被氧化
B.可先给b加热,再用水浴加热的方式给a加热
C.装置c、d的作用是冷凝回流SOCl2
D.装置f的作用是吸收反应生成的HCl和SO2
答案 B
3.★★(2024届苏州期中,16节选)GeO2粗品中常含有少量As2O3。为了提纯GeO2,可先将其转化为GeCl4,再在0 ℃下水解GeCl4得到高纯GeO2。已知:
①GeO2与As2O3均为两性氧化物,部分晶型的GeO2难溶于盐酸;
②GeCl4常温下是液体,沸点为84 ℃,易与AsCl3共沸;
③AsCl3在pH为0.4~0.6时有还原性。
现有已知As含量的粗品GeO2,补充完整提纯的实验方案:向粗品中分批加入4 mol·L-1 NaOH溶液,直至粗品完全溶解, ,
过滤,洗涤2~3次,干燥。(实验中须使用的试剂:10 mol·L-1盐酸、氯酸钠固体、蒸馏水)
答案 向溶液中加入10 mol·L-1盐酸至pH=0.5(0.4~0.6间的任意数均可),随后加入足量NaClO3固体充分反应;在84 ℃蒸馏,将馏分冷却后,与0 ℃的蒸馏水混合,充分搅拌直至无沉淀生成
4.★★(2024届南通如东开学考,16节选)已知:2[Cu(NH3)4]2++N2H4·H2O+4OH- 2Cu↓+N2↑+8NH3↑+5H2O。铜粉沉淀率与水合肼溶液初始浓度的关系如图所示。请设计由铜氨废液回收铜粉的实验方案:取一定体积6 mol·L-1水合肼溶液, ,静置、过滤、洗涤、干燥。(须使用的试剂:2 mol·L-1 H2SO4溶液、NaOH固体、铜氨废液、蒸馏水)
答案 加入蒸馏水稀释水合肼溶液至3.0~3.25 mol·L-1,加入适量NaOH固体,边搅拌边逐滴加入铜氨废液,加热使其充分反应,同时用2 mol·L-1 H2SO4溶液吸收反应中放出的NH3,直至溶液中无气泡产生,停止滴加
5.★★(2024届扬州中学开学考,16节选)钛酸钡(BaTiO3)是制备电子陶瓷材料的基础原料。
实验室模拟制备钛酸钡的过程如下:
已知:TiCl4能水解生成TiO2+,TiO2+能进一步水解生成TiO2;BaTiO3能与浓硫酸反应生成TiO2+。草酸氧钛钡晶体的化学式为BaTiO(C2O4)2·4H2O。
①Ti(Ⅳ)的存在形式(相对含量分数)与溶液pH的关系如图1所示。“沉钛”时,需加入氨水调节溶液的pH在2~3之间,理由是 。
②由草酸氧钛钡晶体(相对分子质量为449)煅烧制得钛酸钡分为三个阶段。现称取44.9 g草酸氧钛钡晶体进行热重分析,测得残留固体质量与温度的变化关系如图2所示。C点残留固体中含有碳酸钡和钛氧化物,则阶段Ⅱ发生反应的化学方程式为 。
答案 ①pH在2~3之间时,Ti(Ⅳ)主要以[TiO(C2O4)2]2-的形式存在,可直接与Ba2+反应,有利于草酸氧钛钡晶体的生成 ②BaTiO(C2O4)2 BaCO3+TiO2+2CO↑+CO2↑
6.★★★(2023苏州学业质量阳光指标调研,16)实验室以工业级硫酸锰粉末(含少量Ca、Co等的硫酸盐)为原料获得电池级MnSO4,并制备催化剂的载体Mn3O4。
(1)将工业级硫酸锰溶于水,蒸发结晶,趁热过滤除去部分杂质。过程中杂质去除率随MnSO4结晶率[×100%]的变化如图1所示。杂质去除率随MnSO4结晶率的增大反而下降的原因是 。
(2)将除去部分杂质的MnSO4溶于水,先后加入MnF2和MnS分别除去溶液中的Ca2+和Co2+,获得电池级硫酸锰。
①MnF2可将溶液中的Ca2+转化为CaF2。CaF2的晶胞如图2所示,Ca2+周围距离最近且相等的F-个数为 。
②“除钴”时,发生反应Co2++MnS(s) CoS(s)+Mn2+。反应完全后,上层清液中c(Mn2+)/c(Co2+)= 。[Ksp(MnS)=2×10-13,Ksp(CoS)=2×10-25]
(3)MnSO4溶液在碱性条件下通入空气氧化获得Mn3O4,产物中Mn元素质量分数(Mn%)随反应时间和温度变化如图3和图4所示。
①图3所示反应时间超过8 h,Mn%降低的原因是 。
②请设计由MnSO4溶液制备较纯Mn3O4的实验方案: 。
(需用到的试剂:1 mol·L-1NaOH溶液、BaCl2溶液)
答案 (1)水分大量蒸发,硫酸盐杂质结晶析出量增加 (2)①8 ②1012 (3)①Mn3O4被氧化成更高价态锰的氧化物(Mn2O3或MnO2) ②向MnSO4溶液中加入一定量1 mol·L-1NaOH溶液,边搅拌边通入空气,控制75 ℃加热8 h左右,过滤,洗涤,取最后一次洗涤滤液并加入BaCl2溶液,无浑浊
7.★★★(2023南通、淮安等五市第一次调研,16)KIO3是重要的食品添加剂。实验室模拟工业制备KIO3的部分实验流程如下:
(1)“氧化”反应在图1所示装置中进行。先将KClO3与I2混合后放入气密性良好的三颈烧瓶中,加水充分溶解,在90 ℃下边搅拌边滴加20 mL 1 mol·L-1盐酸引发反应,停止滴加盐酸后持续搅拌40 min以上,得到热的KH(IO3)2溶液。
已知:KH(IO3)2不溶于有机溶剂。几种物质的溶解度随温度的变化如图2所示。
①用12 mol·L-1盐酸配制100 mL 1.00 mol·L-1盐酸须使用的玻璃仪器有烧杯、玻璃棒、酸式滴定管、 。
②检查图1所示装置气密性的操作为 。
③“氧化”过程中有少量黄绿色的气态副产物产生。用热的KOH溶液可吸收该气体并实现原料的循环利用。写出该吸收过程中发生反应的化学方程式: 。
④能说明反应已经进行完全的标志是 。
⑤实际工业进行“氧化”反应时,需要在反应设备上连接冷凝回流装置,其目的是 。
(2)除去KH(IO3)2溶液中稍过量I2的实验方法是 。
(3)利用提纯得到的KH(IO3)2粗品(含少量KCl)制备纯净KIO3的实验方案为 。
(须使用的实验药品:KOH溶液、稀硝酸、AgNO3溶液、冰水)
答案 (1)①100 mL容量瓶、胶头滴管 ②连接好装置,关闭分液漏斗活塞,将导管用乳胶管连接后插入水中,微热烧瓶,在导管口有气泡产生 ③3Cl2+6KOH 5KCl+KClO3+3H2O ④溶液的pH不再变化 ⑤冷凝回流I2和HCl,提高原料利用率并防止污染空气 (2)用CCl4萃取后分液 (3)将KH(IO3)2溶于水,向其中滴加KOH溶液至溶液pH>7,加热浓缩、冷却结晶,过滤,用冰水洗涤,直至最后一次洗涤滤液中加入稀硝酸和硝酸银溶液无沉淀产生
8.★★★(2023如皋第一次适应性考试,16)一种以磷铁渣(主要含FeP,以及少量Fe2O3、SiO2等杂质)、KMnO4为原料制备磷酸锰[Mn3(PO4)2]的实验过程如下:
(1)溶解。将一定量的磷铁渣加入如图1所示装置的三颈烧瓶中,维持温度60 ℃,边搅拌边向三颈烧瓶中加入一定量的稀硫酸和KMnO4溶液,反应后有Fe3+、Mn2+和H3PO4生成。反应后过滤。
①写出FeP反应的离子方程式: 。
②实验中当观察到某种现象时可不再加入KMnO4溶液,该现象是 。
③FePO4难溶于水,反应Fe3++H3PO4 FePO4+3H+的平衡常数为 。
[已知Ksp(FePO4)=1×10-22,H3PO4的电离平衡常数=8×10-3、=6×10-8、=4×10-13]
④实验中需不断补充稀硫酸控制溶液的pH。pH过大会降低Fe的浸出率和消耗过多的KMnO4,原因是 。
(2)除铁。向所得滤液中加入萃取剂(由磷酸酯和煤油混合而成,磷酸酯易溶于煤油,难溶于水)萃取溶液中的Fe3+。萃取结束后取有机层,经过反萃取操作,可回收萃取剂重复使用。已知萃取剂中磷酸酯(用HA表示)萃取溶液中Fe3+时发生如下反应:
Fe3++3(HA)2(有机层) Fe(HA2)3(有机层)+3H+
反萃取回收萃取剂的方法是 。
(3)制Mn3(PO4)2。请补充完整由萃取后所得水层中Mn2+、H3PO4制纯净Mn3(PO4)2固体的实验方案:取萃取后所得水层溶液100 mL[其中c(Mn2+)=1.2 mol·L-1], ,干燥沉淀,得Mn3(PO4)2固体。{已知溶液的pH对所得沉淀中锰磷比[]和Mn的沉淀率影响如图2所示。实验中需使用的实验试剂有0.1 mol·L-1H3PO4溶液、NaOH溶液、盐酸、BaCl2溶液}
答案 (1)①5FeP+8Mn+39H+ 5Fe3++8Mn2++5H3PO4+12H2O ②三颈烧瓶中加入KMnO4溶液后浅红色不消失 ③1.92 ④pH过大,Fe3+水解生成Fe(OH)3或转化为FePO4沉淀造成Fe的浸出率降低,KMnO4转化为MnO2,氧化等量的FeP消耗的KMnO4更多 (2)向萃取后所得有机层中(分批次)加入一定量的稀硫酸,充分振荡后静置分液,取有机层 (3)向其中滴加50 mL 0.1 mol·L-1H3PO4溶液,再滴加NaOH溶液,至溶液pH=7,过滤,洗涤沉淀至最后一次洗涤滤液中加入盐酸和BaCl2溶液无沉淀生成
考点2 探究实验方案的设计与评价
9.★★(2024届无锡期中教学质量调研,11)室温下,下列实验方案不能达到探究目的的是( )
选项 实验方案 探究目的
A 向Fe(NO3)3溶液中滴入淀粉,再滴加HI溶液,观察溶液颜色变化 探究I2与Fe3+氧化性强弱
B 用pH计分别测定等物质的量浓度的CH3COOH溶液和CCl3COOH溶液的pH 探究键的极性对羧酸酸性的影响
C 向大小形状完全相同的打磨过的镁条和铝条中加入2 mL 3 mol·L-1盐酸,观察反应剧烈程度 探究镁、铝金属性的强弱
D 向MgCl2溶液中先加入少量氢氧化钠溶液,充分反应后再加入少量CuSO4溶液,观察沉淀颜色的变化 探究Cu(OH)2与Mg(OH)2溶度积的大小
答案 A
10.★★(2024届盐城联盟校第一次调研,13)室温下,下列实验探究方案及现象能达到探究目的的是( )
选项 探究方案及现象 探究目的
A 用pH计测量HF溶液、盐酸的pH,比较溶液pH大小 HF是弱电解质
B 向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀,再加入足量稀盐酸,部分沉淀溶解 Na2SO3不能被空气氧化
C 向NaBr溶液中滴加过量氯水,溶液变橙色,再加入淀粉KI溶液,溶液变蓝色 氧化性: Cl2>Br2>I2
D 向盛有FeSO4溶液的试管中滴加几滴KSCN溶液,振荡,再滴加几滴新制氯水,观察溶液颜色变化 Fe2+具有还原性
答案 D
11.★★(2024届南通如东开学考,11)常温下,根据下列实验操作和现象得出的结论正确的是( )
选项 实验操作和现象 实验结论
A 分别测量浓度均为0.1 mol·L-1 Na2CO3溶液和Na[Al(OH)4]溶液的pH,后者pH更大 [Al(OH)4]-比C更容易结合H+
B 将亚硫酸钠样品溶于水,加入盐酸酸化的Ba(NO3)2溶液,出现白色沉淀 亚硫酸钠样品已变质
C 将盐酸滴入Na2CO3溶液产生无色气体,将产生的气体直接通入Na2SiO3溶液 非金属性:Cl>C>Si
D 向BaCl2溶液中通入SO2和气体X,出现白色沉淀 气体X一定具有氧化性
答案 A
12.★★(2024届苏州期初调研,11)下列实验方案能达到探究目的的是( )
选项 探究目的 实验方案
A 酸性:CH3COOH>HCN 用pH计测量浓度均为0.1 mol·L-1的CH3COONa溶液和NaCN溶液的pH,比较溶液pH大小
B H2O2具有氧化性 向0.1 mol·L-1 H2O2溶液中滴加0.1 mol·L-1 KMnO4溶液,观察溶液颜色变化
C Ksp(AgI)D 提纯含有少量乙酸的乙酸乙酯 向含有少量乙酸的乙酸乙酯中加入过量NaOH溶液,振荡后静置分液
答案 A
13.★★(2023苏锡常镇四市第一次调研,11)根据下列实验操作和现象得出的结论不正确的是( )
选项 实验操作和现象 实验结论
A 向溶有SO2的 BaCl2 溶液中通入气体X,出现白色沉淀 X具有氧化性
B 向0.1 mol·L-1 FeCl3溶液中滴加KI淀粉溶液,溶液变蓝 氧化性:Fe3+>I2
C 向NaHCO3溶液中加入等浓度、等体积的NaAlO2溶液,出现白色沉淀 Al比C更容易结合H+
D 将溴乙烷、乙醇和烧碱的混合物加热,产生的气体经水洗后,再通入酸性KMnO4溶液中,溶液褪色 溴乙烷发生了消去反应
答案 A
14.★★(2023南京二模,10)下列实验探究方案不能达到探究目的的是( )
选项 探究方案 探究目的
A 向两支分别盛有2 mL苯和2 mL甲苯的试管中各加入几滴酸性高锰酸钾溶液,用力振荡,观察现象 探究有机物中基团间的相互作用
B 用分液漏斗向盛有Na2CO3固体的锥形瓶中滴加乙酸溶液,将产生的气体通入盛有苯酚钠溶液的试管中,观察现象 探究乙酸、碳酸和苯酚的酸性强弱
C 向两支试管中各加入2 mL 0.1 mo
2025江苏版新教材化学高考第一轮
专题十七 实验方案的设计与评价
五年高考
考点过关练
考点1 制备实验方案的设计与评价
1.★★(2023全国乙,9,6分)下列装置可以用于相应实验的是( )
答案 D
2.★★(2021海南,3,2分)用如图装置制取干燥的气体(a、b表示加入的试剂),能实现的是( )
选项 气体 a b
A H2S 稀H2SO4 FeS
B O2 H2O2溶液 MnO2
C NO2 浓HNO3 铁片
D NH3 浓氨水 CaO
答案 B
3.★★(2021北京,5,3分)实验室制备下列气体所选试剂、制备装置及收集方法均正确的是 ( )
a b
c d e
气体 试剂 制备装置 收集方法
A O2 KMnO4 a d
B H2 Zn+稀H2SO4 b e
C NO Cu+稀HNO3 b c
D CO2 石灰石+稀H2SO4 b c
答案 B
4.★★★(2021江苏,17,15分)以软锰矿粉(含MnO2及少量Fe、Al、Si、Ca、Mg等的氧化物)为原料制备电池级MnO2。
图1
(1)浸取。将一定量软锰矿粉与Na2SO3、H2SO4溶液中的一种配成悬浊液,加入三颈瓶中(装置如图1),70 ℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中的溶液是 ;MnO2转化为Mn2+的离子方程为 。
(2)除杂。向已经除去Fe、Al、Si的MnSO4溶液(pH约为5)中加入NH4F溶液,溶液中的Ca2+、Mg2+形成氟化物沉淀。若沉淀后上层清液中c(F-)=0.05 mol·L-1,则c(Ca2+)/c(Mg2+)= 。[Ksp(MgF2)=5×10-11,Ksp(CaF2)=5×10-9]
(3)制备MnCO3。在搅拌下向100 mL 1 mol·L-1 MnSO4溶液中缓慢滴加1 mol·L-1 NH4HCO3溶液,过滤、洗涤、干燥,得到MnCO3固体。需加入NH4HCO3溶液的体积约为 。
(4)制备MnO2。MnCO3经热解、酸浸等步骤可制备MnO2。MnCO3在空气气流中热解得到三种价态锰的氧化物,锰元素所占比例(×100%)随热解温度变化的曲线如图2所示。已知:MnO与酸反应生成Mn2+;Mn2O3氧化性强于Cl2,在加热条件下Mn2O3在酸性溶液中转化为MnO2和Mn2+。
图2
为获得较高产率的MnO2,请补充实验方案:取一定量MnCO3置于热解装置中,通空气气流, ,固体干燥,得到MnO2。(可选用的试剂:1 mol·L-1 H2SO4溶液、2 mol·L-1 HCl溶液、BaCl2溶液、AgNO3溶液)
答案 (1)H2SO4溶液 MnO2+S+2H+Mn2++S+H2O (2)100 (3)200 mL
(4)加热至约450 ℃分解一段时间,将冷却后的固体加入至适量1 mol·L-1H2SO4溶液中,加热,搅拌反应一段时间,过滤,用水洗涤,取最后一次洗涤滤液,向其中滴加BaCl2溶液,无白色沉淀生成
5.★★★(2022海南,15,10分)胆矾(CuSO4·5H2O)是一种重要化工原料。某研究小组以生锈的铜屑为原料[主要成分是Cu,含有少量的油污、CuO、CuCO3、Cu(OH)2]制备胆矾。流程如下:
回答问题:
(1)步骤①的目的是 。
(2)步骤②中,若仅用浓H2SO4溶解固体B,将生成 (填化学式)污染环境。
(3)步骤②中,在H2O2存在下Cu溶于稀H2SO4,反应的化学方程式为 。
(4)经步骤④得到的胆矾,不能用水洗涤的主要原因是 。
(5)实验证明,滤液D能将I-氧化为I2。
ⅰ.甲同学认为不可能是步骤②中过量H2O2将I-氧化为I2,理由是 。
ⅱ.乙同学通过实验证实,只能是Cu2+将I-氧化为I2,写出乙同学的实验方案及结果
(不要求写具体操作过程)。
答案 (1)除油污 (2)SO2
(3)Cu+H2O2+H2SO4 CuSO4+2H2O
(4)胆矾晶体易溶于水
(5)ⅰ.溶液C经步骤③加热浓缩后H2O2已完全分解
ⅱ.取滤液,向其中加入适量硫化钠,使铜离子恰好完全沉淀,再加入I-,不能被氧化
6.★★★(2023新课标,28,14分)实验室由安息香制备二苯乙二酮的反应式如下:
相关信息列表如下:
物质 性状 熔点/℃ 沸点/℃ 溶解性
安息香 白色固体 133 344 难溶于冷水 溶于热水、乙醇、乙酸
二苯乙 二酮 淡黄色固体 95 347 不溶于水 溶于乙醇、苯、乙酸
冰乙酸 无色液体 17 118 与水、乙醇互溶
装置示意图如图所示,实验步骤:
①在圆底烧瓶中加入10 mL冰乙酸、5 mL水及9.0 g FeCl3·6H2O,边搅拌边加热,至固体全部溶解。
②停止加热,待沸腾平息后加入2.0 g安息香,加热回流45~60 min。
③加入50 mL水,煮沸后冷却,有黄色固体析出。
④过滤,并用冷水洗涤固体3次,得到粗品。
⑤粗品用75%的乙醇重结晶,干燥后得淡黄色结晶1.6 g。
回答下列问题:
(1)仪器A中应加入 (填“水”或“油”)作为热传导介质。
(2)仪器B的名称是 ;冷却水应从 (填“a”或“b”)口通入。
(3)实验步骤②中,安息香必须待沸腾平息后方可加入,其主要目的是 。
(4)在本实验中,FeCl3为氧化剂且过量,其还原产物为 ;某同学尝试改进本实验:采用催化量的FeCl3并通入空气制备二苯乙二酮。该方案是否可行 简述判断理由: 。
(5)本实验步骤①~③在乙酸体系中进行,乙酸除作溶剂外,另一主要作用是防止 。
(6)若粗品中混有少量未氧化的安息香,可用少量 洗涤的方法除去(填标号)。若要得到更高纯度的产品,可用重结晶的方法进一步提纯。
a.热水 b.乙酸 c.冷水 d.乙醇
(7)本实验的产率最接近于 (填标号)。
a.85% b.80% c.75% d.70%
答案 (1)油 (2)球形冷凝管 a
(3)防止暴沸 (4)FeCl2[Fe2+/Fe(Ⅱ)/Fe(CH3COO)2均可] 可行,空气中的O2可将Fe2+氧化为Fe3+,从而实现催化循环 (5)FeCl3水解[生成Fe(OH)3/Fe(OH)3胶体均可] (6)a (7)b
7.★★★(2023辽宁,17,13分)2-噻吩乙醇(Mr=128)是抗血栓药物氯吡格雷的重要中间体,其制备方法如下:
Ⅰ.制钠砂。向烧瓶中加入300 mL液体A和4.60 g金属钠,加热至钠熔化后,盖紧塞子,振荡至大量微小钠珠出现。
Ⅱ.制噻吩钠。降温至10 ℃,加入25 mL噻吩,反应至钠砂消失。
Ⅲ.制噻吩乙醇钠。降温至-10 ℃,加入稍过量的环氧乙烷的四氢呋喃溶液,反应30 min。
Ⅳ.水解。恢复至室温,加入70 mL水,搅拌30 min;加盐酸调pH至4~6,继续反应2 h,分液;用水洗涤有机相,二次分液。
Ⅴ.分离。向有机相中加入无水MgSO4,静置,过滤,对滤液进行蒸馏,蒸出四氢呋喃、噻吩和液体A后,得到产品17.92 g。
回答下列问题:
(1)步骤Ⅰ中液体A可以选择 。
a.乙醇 b.水 c.甲苯 d.液氨
(2)噻吩沸点低于吡咯()的原因是 。
(3)步骤Ⅱ的化学方程式为 。
(4)步骤Ⅲ中反应放热,为防止温度过高引发副反应,加入环氧乙烷的四氢呋喃溶液的方法是 。
(5)步骤Ⅳ中用盐酸调节pH的目的是 。
(6)下列仪器在步骤Ⅴ中无需使用的是 (填名称);无水MgSO4的作用为 。
(7)产品的产率为 (用Na计算,精确至0.1%)。
答案 (1)c (2)吡咯可以形成分子间氢键,而噻吩不能形成分子间氢键
(3)
(4)向烧瓶中缓慢滴入稍过量的环氧乙烷的四氢呋喃溶液,并不断搅拌 (5)与水解产生的NaOH反应,提高转化率 (6)球形冷凝管、分液漏斗 去除有机相中少量的水
(7)70.0%
8.★★★(2023山东,18,12分)三氯甲硅烷(SiHCl3)是制取高纯硅的重要原料,常温下为无色液体,沸点为31.8 ℃,熔点为-126.5 ℃,易水解。实验室根据反应Si+3HCl SiHCl3+H2,利用如下装置制备SiHCl3粗品(加热及夹持装置略)。回答下列问题:
(1)制备SiHCl3时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入HCl,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为 ;判断制备反应结束的实验现象是 。图示装置存在的两处缺陷是 。
(2)已知电负性Cl>H>Si,SiHCl3在浓NaOH溶液中发生反应的化学方程式为 。
(3)采用如下方法测定溶有少量HCl的SiHCl3纯度。
m1 g样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:① ,
② (填操作名称),③称量等操作,测得所得固体氧化物质量为m2 g。从下列仪器中选出①、②中需使用的仪器,依次为 (填标号)。测得样品纯度为 (用含m1、m2的代数式表示)。
A B C D
答案 (1)连接好装置,并检查装置的气密性 装置C的蒸馏烧瓶中不再有液体滴下 装置C、D之间缺少干燥装置,缺少处理尾气H2的装置 (2)SiHCl3+5NaOH Na2SiO3+3NaCl+H2↑+2H2O (3)灼烧 冷却 A、C ×100%
考点2 探究实验方案的设计与评价
9.★★(2019江苏,13,4分)室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 实验操作和现象 结论
A 向X溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液变为红色 X溶液中一定含有Fe2+
B 向浓度均为0.05 mol·L-1的NaI、NaCl混合溶液中滴加少量AgNO3溶液,有黄色沉淀生成 Ksp(AgI)>Ksp(AgCl)
C 向3 mL KI溶液中滴加几滴溴水,振荡,再滴加1 mL淀粉溶液,溶液显蓝色 Br2的氧化性比I2的强
D 用pH试纸测得:CH3COONa溶液的pH约为9,NaNO2溶液的pH约为8 HNO2电离出H+的能力比CH3COOH的强
答案 C
10.(2022江苏,11,3分)室温下,下列实验探究方案不能达到探究目的的是( )
选项 探究方案 探究目的
A 向盛有FeSO4溶液的试管中滴加几滴KSCN溶液,振荡,再滴加几滴新制氯水,观察溶液颜色变化 Fe2+具有还原性
B 向盛有SO2水溶液的试管中滴加几滴品红溶液,振荡,加热试管,观察溶液颜色变化 SO2具有漂白性
C 向盛有淀粉-KI溶液的试管中滴加几滴溴水,振荡,观察溶液颜色变化 Br2的氧化性比I2的强
D 用pH计测量醋酸、盐酸的pH,比较溶液pH大小 CH3COOH是弱电解质
答案 D
11.★★(2023新课标,11,6分)根据实验操作及现象,下列结论中正确的是( )
选项 实验操作及现象 结论
A 常温下将铁片分别插入稀硝酸和浓硝酸中,前者产生无色气体,后者无明显现象 稀硝酸的氧化性比浓硝酸强
B 取一定量Na2SO3样品,溶解后加入BaCl2溶液,产生白色沉淀。加入浓HNO3,仍有沉淀 此样品中含有S
C 将银和AgNO3溶液与铜和Na2SO4溶液组成原电池。连通后银表面有银白色金属沉积,铜电极附近溶液逐渐变蓝 Cu的金属性比Ag强
D 向溴水中加入苯,振荡后静置,水层颜色变浅 溴与苯发生了加成反应
答案 C
12.★★(2023辽宁,13,3分)某小组进行实验,向10 mL 蒸馏水中加入0.4 g I2,充分振荡,溶液呈浅棕色,再加入0.2 g锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知(aq)为棕色,下列关于颜色变化的解释错误的是( )
选项 颜色变化 解释
A 溶液呈浅棕色 I2在水中溶解度较小
B 溶液颜色加深 发生了反应:I2+I-
C 紫黑色晶体消失 I2(aq)的消耗使溶解平衡I2(s) I2(aq)右移
D 溶液褪色 Zn与有色物质发生了置换反应
答案 D
13.★★(2020江苏,13,2分)根据下列实验操作和现象所得到的结论正确的是( )
选项 实验操作和现象 结论
A 向淀粉溶液中加适量20%H2SO4溶液,加热,冷却后加NaOH溶液至中性,再滴加少量碘水,溶液变蓝 淀粉未水解
B 室温下,向0.1 mol·L-1 HCl溶液中加入少量镁粉,产生大量气泡,测得溶液温度上升 镁与盐酸反应放热
C 室温下,向浓度均为0.1 mol·L-1的BaCl2和CaCl2混合溶液中加入Na2CO3溶液,出现白色沉淀 白色沉淀是BaCO3
D 向0.1 mol·L-1 H2O2溶液中滴加0.01 mol·L-1 KMnO4溶液,溶液褪色 H2O2具有氧化性
答案 B
14.★★★(2023北京,19,14分)资料显示,I2可以将Cu氧化为Cu2+。某小组同学设计实验探究Cu被I2氧化的产物及铜元素的价态。
已知:I2易溶于KI溶液,发生反应I2+I- (红棕色);I2和氧化性几乎相同。
(1)将等体积的KI溶液加入m mol铜粉和n mol I2(n>m)的固体混合物中,振荡。实验记录如下:
c(KI) 实验现象
实验Ⅰ 0.01 mol·L-1 极少量I2溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色
实验Ⅱ 0.1 mol·L-1 部分I2溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色
实验Ⅲ 4 mol·L-1 I2完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色
①初始阶段,Cu被氧化的反应速率:实验Ⅰ 实验Ⅱ(填“>”“<”或“=”)。
②实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有[Cu(H2O)4]2+ (蓝色)或[CuI2]- (无色),进行以下实验探究:
步骤a.取实验Ⅲ的深红棕色溶液,加入CCl4,多次萃取、分液。
步骤b.取分液后的无色水溶液,滴入浓氨水,溶液颜色变浅蓝色,并逐渐变深。
ⅰ.步骤a的目的是 。
ⅱ.查阅资料,2Cu2++4I-2CuI↓+I2,[Cu(NH3)2]+ (无色)容易被空气氧化。用离子方程式解释步骤b的溶液中发生的变化: 。
③结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是CuI,实验Ⅰ中铜被氧化的化学方程式是 。分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入浓KI溶液, (填实验现象),观察到少量红色的铜。分析铜未完全反应的原因是 。
(2)上述实验结果,I2仅将Cu氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了I2能将Cu氧化为Cu2+。装置如图所示,a、b分别是 。
(3)运用氧化还原反应规律,分析在上述实验中Cu被I2氧化的产物中价态不同的原因: 。
答案 (1)①< ②ⅰ.加入CCl4萃取溶液中的I2,使c(I2)下降,导致I2+I- 平衡逆向移动,多次萃取、分液可使c()降至极低,即可避免的红棕色对Cu的氧化产物的判断造成干扰 ⅱ.[CuI2]-+2NH3·H2O [Cu(NH3)2]++2I-+2H2O,生成的[Cu(NH3)2]+被空气氧化:4[Cu(NH3)2]++O2+8NH3·H2O 4[Cu(NH3)4]2++4OH-+6H2O ③2Cu+KI3 2CuI+KI 白色沉淀溶解并得到无色溶液 产生的CuI沉淀覆盖在Cu的表面,阻碍Cu进一步反应 (2)Cu、4 mol·L-1 KI溶液和n mol I2的混合物 (3)Cu-e-+I- CuI,I-的存在可提升Cu的还原性,同理Cu2++e-+I- CuI↓,I-的存在可提升Cu2+的氧化性,故当I-存在时,Cu更易被氧化为+1价;而当I-不与Cu和Cu2+直接接触时,才能发生反应Cu+I2 Cu2++2I-,Cu被氧化为+2价
15.★★★(2022福建,12,14分)某兴趣小组设计实验探究Ce-MnOx催化空气氧化CO的效率。回答下列问题:
步骤Ⅰ 制备CO
在通风橱中用下图装置制备CO(加热及夹持装置省略),反应方程式如下:
HCOOH CO↑+H2O
(1)装置A中盛放甲酸的仪器的名称是 。
(2)从B、C、D中选择合适的装置收集CO,正确的接口连接顺序为a→ → → → →h(每空填一个接口标号)。
步骤Ⅱ 检验CO
将CO通入新制银氨溶液中,有黑色沉淀生成。
(3)该反应的化学方程式为 。
步骤Ⅲ 探究Ce-MnOx催化空气氧化CO的效率
将一定量CO与空气混合,得到CO体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至120 ℃,按一定流速通入气体样品。(已知:I2O5是白色固体,易吸水潮解;5CO+I2O5 I2+5CO2)
(4)通入11.2 L(已折算为标准状况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了0.101 6 g I2。
①能证明CO被空气氧化的现象是 ;
②CO被催化氧化的百分率为 ;
③若未通入氮气,②的结果将 (填“偏大”“偏小”或“无影响”)。
(5)探究气体与催化剂接触时长对催化氧化效率的影响时,采用 方法可以缩短接触时长。
(6)步骤Ⅲ装置存在的不足之处是 。
答案 (1)分液漏斗 (2)d e c b(全部写对才可得分) (3)CO+2[Ag(NH3)2]OH 2Ag↓+(NH4)2CO3+2NH3(或其他合理答案) (4)①石灰水变浑浊 ②60% ③偏大 (5)增大气体样品流速 (6)尾气出口未加防潮装置(或其他相似表述)
16.★★★(2021广东,17,15分)含氯物质在生产生活中有重要作用。1774年,舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。
(1)实验室沿用舍勒的方法制取Cl2的化学方程式为 。
(2)实验室制取干燥Cl2时,净化与收集Cl2所需装置的接口连接顺序为 。
(3)某氯水久置后不能使品红溶液褪色,可推测氯水中 已分解。检验此久置氯水中Cl-存在的操作及现象是 。
(4)某合作学习小组进行以下实验探究。
①实验任务 通过测定溶液电导率,探究温度对AgCl溶解度的影响。
②查阅资料 电导率是表征电解质溶液导电能力的物理量。温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;离子浓度一定时,稀溶液电导率随温度的升高而增大。25 ℃时,Ksp(AgCl)=1.8×10-10。
③提出猜想 猜想a:较高温度的AgCl饱和溶液的电导率较大。
猜想b:AgCl在水中的溶解度S(45 ℃)>S(35 ℃)>S(25 ℃)。
④设计实验、验证猜想 取试样Ⅰ、Ⅱ、Ⅲ(不同温度下配制的AgCl饱和溶液),在设定的测试温度下,进行表1中实验1~3,记录数据。
表1
实验序号 试样 测试温度/℃ 电导率/(μS/cm)
1 Ⅰ:25 ℃的AgCl饱和溶液 25 A1
2 Ⅱ:35 ℃的AgCl饱和溶液 35 A2
3 Ⅲ:45 ℃的AgCl饱和溶液 45 A3
⑤数据分析、交流讨论 25 ℃的AgCl饱和溶液中,c(Cl-)= mol/L。
实验结果为A3>A2>A1。小组同学认为,此结果可以证明③中的猜想a成立,但不足以证明猜想b成立。结合②中信息,猜想b不足以成立的理由有 。
⑥优化实验 小组同学为进一步验证猜想b,在实验1~3的基础上完善方案,进行实验4和5。请完成表2中内容。
表2
实验序号 试样 测试温度/℃ 电导率/(μS/cm)
4 Ⅰ B1
5 B2
⑦实验总结 根据实验1~5的结果,并结合②中信息,小组同学认为猜想b也成立。猜想b成立的判断依据是 。
答案 (1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(2)cdbae (3)HClO 取少量久置氯水于试管中,滴加稀硝酸酸化,再滴加硝酸银溶液,产生白色沉淀 (4)⑤1.34×10-5 即使离子浓度相同,温度升高,电导率也会增大;温度升高,水的电离程度增大 ⑥35 Ⅱ 45(或 45 Ⅱ 45) ⑦A2>B1,A3>B2(或A3>B2>B1)
三年模拟
考点强化练
考点1 制备实验方案的设计与评价
1.★(2024届苏州期初调研,3)下列有关实验室制取、收集NO2并制备Cu(NO3)2·6H2O的实验原理和装置正确的是( )
A.用装置甲制取NO2
B.用装置丁收集NO2
C.用装置丙吸收NO2
D.用装置乙蒸干溶液获得Cu(NO3)2·6H2O
答案 C
2.★★(2023连云港第一次调研,7)实验室制备无水FeCl2的装置如图所示(加热及夹持装置略)。已知SOCl2沸点为76 ℃,遇水极易反应生成两种酸性气体。下列说法错误的是( )
A.实验开始时通入N2的目的是排出装置中的O2,防止FeCl2被氧化
B.可先给b加热,再用水浴加热的方式给a加热
C.装置c、d的作用是冷凝回流SOCl2
D.装置f的作用是吸收反应生成的HCl和SO2
答案 B
3.★★(2024届苏州期中,16节选)GeO2粗品中常含有少量As2O3。为了提纯GeO2,可先将其转化为GeCl4,再在0 ℃下水解GeCl4得到高纯GeO2。已知:
①GeO2与As2O3均为两性氧化物,部分晶型的GeO2难溶于盐酸;
②GeCl4常温下是液体,沸点为84 ℃,易与AsCl3共沸;
③AsCl3在pH为0.4~0.6时有还原性。
现有已知As含量的粗品GeO2,补充完整提纯的实验方案:向粗品中分批加入4 mol·L-1 NaOH溶液,直至粗品完全溶解, ,
过滤,洗涤2~3次,干燥。(实验中须使用的试剂:10 mol·L-1盐酸、氯酸钠固体、蒸馏水)
答案 向溶液中加入10 mol·L-1盐酸至pH=0.5(0.4~0.6间的任意数均可),随后加入足量NaClO3固体充分反应;在84 ℃蒸馏,将馏分冷却后,与0 ℃的蒸馏水混合,充分搅拌直至无沉淀生成
4.★★(2024届南通如东开学考,16节选)已知:2[Cu(NH3)4]2++N2H4·H2O+4OH- 2Cu↓+N2↑+8NH3↑+5H2O。铜粉沉淀率与水合肼溶液初始浓度的关系如图所示。请设计由铜氨废液回收铜粉的实验方案:取一定体积6 mol·L-1水合肼溶液, ,静置、过滤、洗涤、干燥。(须使用的试剂:2 mol·L-1 H2SO4溶液、NaOH固体、铜氨废液、蒸馏水)
答案 加入蒸馏水稀释水合肼溶液至3.0~3.25 mol·L-1,加入适量NaOH固体,边搅拌边逐滴加入铜氨废液,加热使其充分反应,同时用2 mol·L-1 H2SO4溶液吸收反应中放出的NH3,直至溶液中无气泡产生,停止滴加
5.★★(2024届扬州中学开学考,16节选)钛酸钡(BaTiO3)是制备电子陶瓷材料的基础原料。
实验室模拟制备钛酸钡的过程如下:
已知:TiCl4能水解生成TiO2+,TiO2+能进一步水解生成TiO2;BaTiO3能与浓硫酸反应生成TiO2+。草酸氧钛钡晶体的化学式为BaTiO(C2O4)2·4H2O。
①Ti(Ⅳ)的存在形式(相对含量分数)与溶液pH的关系如图1所示。“沉钛”时,需加入氨水调节溶液的pH在2~3之间,理由是 。
②由草酸氧钛钡晶体(相对分子质量为449)煅烧制得钛酸钡分为三个阶段。现称取44.9 g草酸氧钛钡晶体进行热重分析,测得残留固体质量与温度的变化关系如图2所示。C点残留固体中含有碳酸钡和钛氧化物,则阶段Ⅱ发生反应的化学方程式为 。
答案 ①pH在2~3之间时,Ti(Ⅳ)主要以[TiO(C2O4)2]2-的形式存在,可直接与Ba2+反应,有利于草酸氧钛钡晶体的生成 ②BaTiO(C2O4)2 BaCO3+TiO2+2CO↑+CO2↑
6.★★★(2023苏州学业质量阳光指标调研,16)实验室以工业级硫酸锰粉末(含少量Ca、Co等的硫酸盐)为原料获得电池级MnSO4,并制备催化剂的载体Mn3O4。
(1)将工业级硫酸锰溶于水,蒸发结晶,趁热过滤除去部分杂质。过程中杂质去除率随MnSO4结晶率[×100%]的变化如图1所示。杂质去除率随MnSO4结晶率的增大反而下降的原因是 。
(2)将除去部分杂质的MnSO4溶于水,先后加入MnF2和MnS分别除去溶液中的Ca2+和Co2+,获得电池级硫酸锰。
①MnF2可将溶液中的Ca2+转化为CaF2。CaF2的晶胞如图2所示,Ca2+周围距离最近且相等的F-个数为 。
②“除钴”时,发生反应Co2++MnS(s) CoS(s)+Mn2+。反应完全后,上层清液中c(Mn2+)/c(Co2+)= 。[Ksp(MnS)=2×10-13,Ksp(CoS)=2×10-25]
(3)MnSO4溶液在碱性条件下通入空气氧化获得Mn3O4,产物中Mn元素质量分数(Mn%)随反应时间和温度变化如图3和图4所示。
①图3所示反应时间超过8 h,Mn%降低的原因是 。
②请设计由MnSO4溶液制备较纯Mn3O4的实验方案: 。
(需用到的试剂:1 mol·L-1NaOH溶液、BaCl2溶液)
答案 (1)水分大量蒸发,硫酸盐杂质结晶析出量增加 (2)①8 ②1012 (3)①Mn3O4被氧化成更高价态锰的氧化物(Mn2O3或MnO2) ②向MnSO4溶液中加入一定量1 mol·L-1NaOH溶液,边搅拌边通入空气,控制75 ℃加热8 h左右,过滤,洗涤,取最后一次洗涤滤液并加入BaCl2溶液,无浑浊
7.★★★(2023南通、淮安等五市第一次调研,16)KIO3是重要的食品添加剂。实验室模拟工业制备KIO3的部分实验流程如下:
(1)“氧化”反应在图1所示装置中进行。先将KClO3与I2混合后放入气密性良好的三颈烧瓶中,加水充分溶解,在90 ℃下边搅拌边滴加20 mL 1 mol·L-1盐酸引发反应,停止滴加盐酸后持续搅拌40 min以上,得到热的KH(IO3)2溶液。
已知:KH(IO3)2不溶于有机溶剂。几种物质的溶解度随温度的变化如图2所示。
①用12 mol·L-1盐酸配制100 mL 1.00 mol·L-1盐酸须使用的玻璃仪器有烧杯、玻璃棒、酸式滴定管、 。
②检查图1所示装置气密性的操作为 。
③“氧化”过程中有少量黄绿色的气态副产物产生。用热的KOH溶液可吸收该气体并实现原料的循环利用。写出该吸收过程中发生反应的化学方程式: 。
④能说明反应已经进行完全的标志是 。
⑤实际工业进行“氧化”反应时,需要在反应设备上连接冷凝回流装置,其目的是 。
(2)除去KH(IO3)2溶液中稍过量I2的实验方法是 。
(3)利用提纯得到的KH(IO3)2粗品(含少量KCl)制备纯净KIO3的实验方案为 。
(须使用的实验药品:KOH溶液、稀硝酸、AgNO3溶液、冰水)
答案 (1)①100 mL容量瓶、胶头滴管 ②连接好装置,关闭分液漏斗活塞,将导管用乳胶管连接后插入水中,微热烧瓶,在导管口有气泡产生 ③3Cl2+6KOH 5KCl+KClO3+3H2O ④溶液的pH不再变化 ⑤冷凝回流I2和HCl,提高原料利用率并防止污染空气 (2)用CCl4萃取后分液 (3)将KH(IO3)2溶于水,向其中滴加KOH溶液至溶液pH>7,加热浓缩、冷却结晶,过滤,用冰水洗涤,直至最后一次洗涤滤液中加入稀硝酸和硝酸银溶液无沉淀产生
8.★★★(2023如皋第一次适应性考试,16)一种以磷铁渣(主要含FeP,以及少量Fe2O3、SiO2等杂质)、KMnO4为原料制备磷酸锰[Mn3(PO4)2]的实验过程如下:
(1)溶解。将一定量的磷铁渣加入如图1所示装置的三颈烧瓶中,维持温度60 ℃,边搅拌边向三颈烧瓶中加入一定量的稀硫酸和KMnO4溶液,反应后有Fe3+、Mn2+和H3PO4生成。反应后过滤。
①写出FeP反应的离子方程式: 。
②实验中当观察到某种现象时可不再加入KMnO4溶液,该现象是 。
③FePO4难溶于水,反应Fe3++H3PO4 FePO4+3H+的平衡常数为 。
[已知Ksp(FePO4)=1×10-22,H3PO4的电离平衡常数=8×10-3、=6×10-8、=4×10-13]
④实验中需不断补充稀硫酸控制溶液的pH。pH过大会降低Fe的浸出率和消耗过多的KMnO4,原因是 。
(2)除铁。向所得滤液中加入萃取剂(由磷酸酯和煤油混合而成,磷酸酯易溶于煤油,难溶于水)萃取溶液中的Fe3+。萃取结束后取有机层,经过反萃取操作,可回收萃取剂重复使用。已知萃取剂中磷酸酯(用HA表示)萃取溶液中Fe3+时发生如下反应:
Fe3++3(HA)2(有机层) Fe(HA2)3(有机层)+3H+
反萃取回收萃取剂的方法是 。
(3)制Mn3(PO4)2。请补充完整由萃取后所得水层中Mn2+、H3PO4制纯净Mn3(PO4)2固体的实验方案:取萃取后所得水层溶液100 mL[其中c(Mn2+)=1.2 mol·L-1], ,干燥沉淀,得Mn3(PO4)2固体。{已知溶液的pH对所得沉淀中锰磷比[]和Mn的沉淀率影响如图2所示。实验中需使用的实验试剂有0.1 mol·L-1H3PO4溶液、NaOH溶液、盐酸、BaCl2溶液}
答案 (1)①5FeP+8Mn+39H+ 5Fe3++8Mn2++5H3PO4+12H2O ②三颈烧瓶中加入KMnO4溶液后浅红色不消失 ③1.92 ④pH过大,Fe3+水解生成Fe(OH)3或转化为FePO4沉淀造成Fe的浸出率降低,KMnO4转化为MnO2,氧化等量的FeP消耗的KMnO4更多 (2)向萃取后所得有机层中(分批次)加入一定量的稀硫酸,充分振荡后静置分液,取有机层 (3)向其中滴加50 mL 0.1 mol·L-1H3PO4溶液,再滴加NaOH溶液,至溶液pH=7,过滤,洗涤沉淀至最后一次洗涤滤液中加入盐酸和BaCl2溶液无沉淀生成
考点2 探究实验方案的设计与评价
9.★★(2024届无锡期中教学质量调研,11)室温下,下列实验方案不能达到探究目的的是( )
选项 实验方案 探究目的
A 向Fe(NO3)3溶液中滴入淀粉,再滴加HI溶液,观察溶液颜色变化 探究I2与Fe3+氧化性强弱
B 用pH计分别测定等物质的量浓度的CH3COOH溶液和CCl3COOH溶液的pH 探究键的极性对羧酸酸性的影响
C 向大小形状完全相同的打磨过的镁条和铝条中加入2 mL 3 mol·L-1盐酸,观察反应剧烈程度 探究镁、铝金属性的强弱
D 向MgCl2溶液中先加入少量氢氧化钠溶液,充分反应后再加入少量CuSO4溶液,观察沉淀颜色的变化 探究Cu(OH)2与Mg(OH)2溶度积的大小
答案 A
10.★★(2024届盐城联盟校第一次调研,13)室温下,下列实验探究方案及现象能达到探究目的的是( )
选项 探究方案及现象 探究目的
A 用pH计测量HF溶液、盐酸的pH,比较溶液pH大小 HF是弱电解质
B 向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀,再加入足量稀盐酸,部分沉淀溶解 Na2SO3不能被空气氧化
C 向NaBr溶液中滴加过量氯水,溶液变橙色,再加入淀粉KI溶液,溶液变蓝色 氧化性: Cl2>Br2>I2
D 向盛有FeSO4溶液的试管中滴加几滴KSCN溶液,振荡,再滴加几滴新制氯水,观察溶液颜色变化 Fe2+具有还原性
答案 D
11.★★(2024届南通如东开学考,11)常温下,根据下列实验操作和现象得出的结论正确的是( )
选项 实验操作和现象 实验结论
A 分别测量浓度均为0.1 mol·L-1 Na2CO3溶液和Na[Al(OH)4]溶液的pH,后者pH更大 [Al(OH)4]-比C更容易结合H+
B 将亚硫酸钠样品溶于水,加入盐酸酸化的Ba(NO3)2溶液,出现白色沉淀 亚硫酸钠样品已变质
C 将盐酸滴入Na2CO3溶液产生无色气体,将产生的气体直接通入Na2SiO3溶液 非金属性:Cl>C>Si
D 向BaCl2溶液中通入SO2和气体X,出现白色沉淀 气体X一定具有氧化性
答案 A
12.★★(2024届苏州期初调研,11)下列实验方案能达到探究目的的是( )
选项 探究目的 实验方案
A 酸性:CH3COOH>HCN 用pH计测量浓度均为0.1 mol·L-1的CH3COONa溶液和NaCN溶液的pH,比较溶液pH大小
B H2O2具有氧化性 向0.1 mol·L-1 H2O2溶液中滴加0.1 mol·L-1 KMnO4溶液,观察溶液颜色变化
C Ksp(AgI)
答案 A
13.★★(2023苏锡常镇四市第一次调研,11)根据下列实验操作和现象得出的结论不正确的是( )
选项 实验操作和现象 实验结论
A 向溶有SO2的 BaCl2 溶液中通入气体X,出现白色沉淀 X具有氧化性
B 向0.1 mol·L-1 FeCl3溶液中滴加KI淀粉溶液,溶液变蓝 氧化性:Fe3+>I2
C 向NaHCO3溶液中加入等浓度、等体积的NaAlO2溶液,出现白色沉淀 Al比C更容易结合H+
D 将溴乙烷、乙醇和烧碱的混合物加热,产生的气体经水洗后,再通入酸性KMnO4溶液中,溶液褪色 溴乙烷发生了消去反应
答案 A
14.★★(2023南京二模,10)下列实验探究方案不能达到探究目的的是( )
选项 探究方案 探究目的
A 向两支分别盛有2 mL苯和2 mL甲苯的试管中各加入几滴酸性高锰酸钾溶液,用力振荡,观察现象 探究有机物中基团间的相互作用
B 用分液漏斗向盛有Na2CO3固体的锥形瓶中滴加乙酸溶液,将产生的气体通入盛有苯酚钠溶液的试管中,观察现象 探究乙酸、碳酸和苯酚的酸性强弱
C 向两支试管中各加入2 mL 0.1 mol·L-1 Na2S2O3溶液,分别放入盛有冷水和热水的两个烧杯中,再同时分别向两支试管中加入2 mL 0.1 mol·L-1 H2SO4溶液,振荡,观察现象 探究温度对化学反应速率的影响
D 以Zn、Fe为电极,以酸化的3%NaCl溶液作电解质溶液,连接成原电池装置。过一段时间,从Fe电极区取少量溶液于试管中,再向试管中滴入2滴K3[Fe(CN)6]溶液,观察现象 探究金属的电化学保护法
答案 B
微专题 实验方案设计的文字叙述
1.★★★(2023江苏,16,15分)实验室模拟“镁法工业烟气脱硫”并制备MgSO4·H2O,其实验过程可表示为
(1)在搅拌下向氧化镁浆料中匀速缓慢通入SO2气体,生成MgSO3,反应为
Mg(OH)2+H2SO3 MgSO3+2H2O
其平衡常数K与Ksp[Mg(OH)2]、Ksp(MgSO3)、(H2SO3)、(H2SO3)的代数关系式为K= ;下列实验操作一定能提高氧化镁浆料吸收SO2效率的有 (填序号)。
A.水浴加热氧化镁浆料
B.加快搅拌速率
C.降低通入SO2气体的速率
D.通过多孔球泡向氧化镁浆料中通SO2
(2)在催化剂作用下MgSO3被O2氧化为MgSO4。已知MgSO3的溶解度为0.57 g(20 ℃),O2氧化溶液中S的离子方程式为 ;在其他条件相同时,以负载钴的分子筛为催化剂,浆料中MgSO3被O2氧化的速率随pH的变化如图1所示。在pH=6~8范围内,pH增大,浆料中MgSO3的氧化速率增大,其主要原因是 。
图1
图2
(3)制取MgSO4·H2O晶体。在如图2所示的实验装置中,搅拌下,使一定量的MgSO3浆料与H2SO4溶液充分反应。MgSO3浆料与H2SO4溶液的加料方式是 ;
补充完整制取MgSO4·H2O晶体的实验方案:向含有少量Fe3+、Al3+的MgSO4溶液中, 。
[已知:Fe3+、Al3+在pH≥5时完全转化为氢氧化物沉淀;室温下从MgSO4饱和溶液中结晶出MgSO4·7H2O,MgSO4·7H2O在150~170 ℃下干燥得到MgSO4·H2O,实验中需要使用MgO粉末。]
答案 (1) BD
(2)2S+O2 2S pH增大,c(S)增大,氧化速率加快
(3)用滴液漏斗向盛有MgSO3浆料的三颈瓶中缓慢滴加H2SO4溶液 分批加入少量MgO粉末,搅拌,直至用pH试纸测得pH≥5,过滤;将滤液蒸发浓缩、降温至室温结晶,过滤,所得晶体在150~170 ℃干燥
2.★★★(2023湖南,15,14分)金属Ni对H2有强吸附作用,被广泛用于硝基或羰基等不饱和基团的催化氢化反应。将块状Ni转化成多孔型雷尼Ni后,其催化活性显著提高。
已知:①雷尼Ni暴露在空气中可以自燃,在制备和使用时,需用水或有机溶剂保持其表面“湿润”;
②邻硝基苯胺在极性有机溶剂中更有利于反应的进行。
某实验小组制备雷尼Ni并探究其催化氢化性能的实验如下:
步骤1:雷尼Ni的制备
Ni/Al合金颗粒雷尼Ni混合物 雷尼Ni悬浮液
步骤2:邻硝基苯胺的催化氢化反应
反应的原理和实验装置图如下(夹持装置和搅拌装置略)。装置Ⅰ用于储存H2和监测反应过程。
回答下列问题:
(1)操作(a)中,反应的离子方程式是 ;
(2)操作(d)中,判断雷尼Ni被水洗净的方法是 ;
(3)操作(e)中,下列溶剂中最有利于步骤2中氢化反应的是 ;
A.丙酮 B.四氯化碳
C.乙醇 D.正己烷
(4)向集气管中充入H2时,三通阀的孔路位置如下图所示;发生氢化反应时,集气管向装置Ⅱ供气,此时孔路位置需调节为 ;
(5)仪器M的名称是 ;
(6)反应前应向装置Ⅱ中通入N2一段时间,目的是 ;
(7)如果将三颈瓶N中的导气管口插入液面以下,可能导致的后果是 ;
(8)判断氢化反应完全的现象是 。
答案 (1)2Al+2OH-+2H2O 2Al+3H2↑
(2)取最后一次洗涤液,利用pH试纸测定pH,若洗涤液呈中性,则洗涤干净 (3)C (4)B (5)恒压分液(滴液)漏斗 (6)将装置中空气排出,防止雷尼Ni自燃 (7)倒吸 (8)装置Ⅰ中集气管液面高度不再变化
3.★★★(2022河北,14,14分)某研究小组为了更准确检测香菇中添加剂亚硫酸盐的含量,设计实验如下:
①三颈烧瓶中加入10.00 g香菇样品和400 mL水;锥形瓶中加入125 mL水、1 mL淀粉溶液,并预加0.30 mL 0.010 00 mol·L-1的碘标准溶液,搅拌。
②以0.2 L·min-1流速通氮气,再加入过量磷酸,加热并保持微沸,同时用碘标准溶液滴定,至终点时滴定消耗了1.00 mL碘标准溶液。
③做空白实验,消耗了0.10 mL碘标准溶液。
④用适量Na2SO3替代香菇样品,重复上述步骤,测得SO2的平均回收率为95%。
已知:(H3PO4)=7.1×10-3,(H2SO3)=1.3×10-2。
回答下列问题:
(1)装置图中仪器a、b的名称分别为 、 。
(2)三颈烧瓶适宜的规格为 (填标号)。
A.250 mL B.500 mL C.1 000 mL
(3)解释加入H3PO4能够生成SO2的原因 。
(4)滴定管在使用前需要 、洗涤、润洗;滴定终点时溶液的颜色为 ;滴定反应的离子方程式为 。
(5)若先加磷酸再通氮气,会使测定结果 (填“偏高”“偏低”或“无影响”)。
(6)该样品中亚硫酸盐含量为 mg·kg-1(以SO2计,结果保留三位有效数字)。
答案 (1)球形冷凝管 酸式滴定管 (2)C (3)2H3PO4+S 2H2P+H2SO3,生成的H2SO3在加热条件下分解为SO2和H2O,SO2逸出,溶液中c(H2SO3)减小,促进2H3PO4+S 2H2P+H2SO3平衡正向移动 (4)检验其是否漏水 蓝色 I2+SO2+2H2O 2I-+4H++S (5)偏低 (6)80.8
4.★★★(2019江苏,19,15分)实验室以工业废渣(主要含CaSO4·2H2O,还含少量SiO2、Al2O3、Fe2O3)为原料制取轻质CaCO3和(NH4)2SO4晶体,其实验流程如下:
室温下,反应CaSO4(s)+C(aq)CaCO3(s)+S(aq)达到平衡,则溶液中= [Ksp(CaSO4)=4.8×10-5,Ksp(CaCO3)=3×10-9]。
(2)将氨水和NH4HCO3溶液混合,可制得(NH4)2CO3溶液,其离子方程式为 ;浸取废渣时,向(NH4)2CO3溶液中加入适量浓氨水的目的是 。
(3)废渣浸取在如图所示的装置中进行。控制反应温度在60~70 ℃,搅拌,反应3小时。温度过高将会导致CaSO4的转化率下降,其原因是 ;保持温度、反应时间、反应物和溶剂的量不变,实验中提高CaSO4转化率的操作有 。
(4)滤渣水洗后,经多步处理得到制备轻质CaCO3所需的CaCl2溶液。设计以水洗后的滤渣为原料,制取CaCl2溶液的实验方案:
[已知pH=5时Fe(OH)3和Al(OH)3沉淀完全;pH=8.5时Al(OH)3开始溶解。实验中必须使用的试剂:盐酸和Ca(OH)2]。
答案 (1)1.6×104 (2)HC+NH3·H2O N+C+H2O 增加溶液中C的浓度,促进CaSO4的转化 (3)温度过高,(NH4)2CO3分解 加快搅拌速率 (4)在搅拌下向足量稀盐酸中分批加入滤渣,待观察不到气泡产生后,过滤,向滤液中分批加入少量Ca(OH)2,用pH试纸测量溶液pH,当pH介于5~8.5时,过滤
5.★★★(2020江苏,19,15分)实验室由炼钢污泥(简称铁泥,主要成分为铁的氧化物)制备软磁性材料α-Fe2O3。其主要实验流程如下:
(1)酸浸。用一定浓度的H2SO4溶液浸取铁泥中的铁元素。若其他条件不变,实验中采取下列措施能提高铁元素浸出率的有 (填序号)。
A.适当升高酸浸温度
B.适当加快搅拌速度
C.适当缩短酸浸时间
(2)还原。向“酸浸”后的滤液中加入过量铁粉,使Fe3+完全转化为Fe2+。“还原”过程中除生成Fe2+外,还会生成 (填化学式);检验Fe3+是否还原完全的实验操作是 。
(3)除杂。向“还原”后的滤液中加入NH4F溶液,使Ca2+转化为CaF2沉淀除去。若溶液的pH偏低,将会导致CaF2沉淀不完全,其原因是 [Ksp(CaF2)=5.3×10-9,Ka(HF)=6.3×10-4]。
(4)沉铁。将提纯后的FeSO4溶液与氨水-NH4HCO3混合溶液反应,生成FeCO3沉淀。
①生成FeCO3沉淀的离子方程式为 。
②设计以FeSO4溶液、氨水-NH4HCO3混合溶液为原料,制备FeCO3的实验方案:
[FeCO3沉淀需“洗涤完全”,Fe(OH)2开始沉淀的pH=6.5]。
答案 (1)AB (2)H2 取少量清液,向其中滴加几滴KSCN溶液,观察溶液颜色是否呈血红色 (3)pH偏低形成HF,导致溶液中F-浓度减小,CaF2沉淀不完全
(4)①Fe2++HC+NH3·H2O FeCO3↓+N+H2O或Fe2++HC+NH3 FeCO3↓+N ②在搅拌下向FeSO4溶液中缓慢加入氨水-NH4HCO3混合溶液,控制溶液pH不大于6.5;静置后过滤,所得沉淀用蒸馏水洗涤2~3次;取最后一次洗涤后的滤液,滴加盐酸酸化的BaCl2溶液,不出现白色沉淀
6.★★★(2023南京、盐城一模,16)实验室以氟碳铈矿(主要成分为CeFCO3)为原料制备CeO2粗品,并测定粗品中CeO2的含量。
(1)酸洗。氟碳铈矿和浓硫酸发生反应,生成Ce2(SO4)3等。酸洗不宜在玻璃器皿中进行,其原因是 。
(2)焙烧。Ce2(SO4)3在空气中高温焙烧可得到CeO2和SO3,其反应的化学方程式为 。
(3)测定粗品中CeO2的含量。部分实验操作如下:
步骤Ⅰ 称取0.500 0 g样品置于锥形瓶中,加入蒸馏水和浓硫酸,边搅拌边加入双氧水,低温加热至样品反应完全。
步骤Ⅱ 煮沸,冷却后滴入催化剂硝酸银溶液,加入过量的(NH4)2S2O8溶液,将Ce(Ⅲ)氧化为Ce(Ⅳ),低温加热至锥形瓶中无气体产生[2(NH4)2S2O8+2H2O 4NH4HSO4+O2↑]。再次煮沸、冷却,用硫酸亚铁铵标准溶液滴定。
①“步骤Ⅰ”中加入双氧水的作用是 。
②“步骤Ⅱ”中“再次煮沸”的时间不宜太短,其原因是 。
③请补充完整制备(NH4)2Fe(SO4)2·6H2O晶体的实验方案:称取一定质量的铁粉, ,低温干燥,即可得到硫酸亚铁铵晶体。
已知:(NH4)2SO4+FeSO4+6H2O (NH4)2Fe(SO4)2·6H2O。
必须使用的试剂:1 mol·L-1H2SO4溶液、95%的乙醇溶液、(NH4)2SO4固体。
答案 (1)反应生成的HF会腐蚀玻璃
(2)2Ce2(SO4)3+O2 4CeO2+6SO3
(3)①在H2SO4酸性环境下H2O2将CeO2还原为Ce(Ⅲ)(或Ce3+)
②防止没有分解的(NH4)2S2O8与硫酸亚铁铵反应,使硫酸亚铁铵滴定量增多,造成CeO2含量的测定结果偏大
③加入适量1 mol·L-1 H2SO4溶液反应至无明显气泡产生,过滤、洗涤,称量残余固体质量,向滤液中加入计算量的(NH4)2SO4固体,充分溶解,加热浓缩,冷却结晶,过滤,用95%的乙醇溶液洗涤晶体
7.★★★(2023前黄、姜堰等四校联考,16)硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol-1)易溶于水,难溶于乙醇,在中性和碱性环境中稳定,在酸性环境中易分解,在40 ℃~50 ℃熔化,48 ℃分解。用两种方法制取Na2S2O3·5H2O并加以应用。
Ⅰ.制备Na2S2O3·5H2O
方法一:亚硫酸钠法,反应原理:S+Na2SO3 Na2S2O3。
实验步骤:称取一定量的Na2SO3固体于烧杯中,溶于煮沸过的蒸馏水。另取过量硫粉,加入少量乙醇充分搅拌均匀后,加到上述溶液中。水浴加热,微沸,反应后趁热过滤。滤液蒸发浓缩、冷却结晶析出Na2S2O3·5H2O晶体。再进行减压过滤、洗涤并低温干燥。
(1)S2中心硫原子的杂化方式为 。
(2)向硫粉中加入少量乙醇充分搅拌均匀的目的是 。
方法二:硫化碱法,装置如下图所示。
(3)①装置C中,将Na2S和Na2CO3以2∶1的物质的量之比配成溶液再通入SO2,便可制得Na2S2O3和CO2。反应的化学方程式为 。
②三颈烧瓶中两种固体溶解时,需先将Na2CO3固体溶于水配成溶液,再将Na2S固体溶于Na2CO3溶液中,其目的是 。
③实验过程中,装置C中的澄清溶液先变浑浊,后变澄清时生成大量的Na2S2O3,一段时间后,再次出现少量浑浊,此时须立刻停止通入SO2。为了保证Na2S2O3·5H2O的产量,实验中通入的SO2不能过量,原因是 。
Ⅱ.Na2S2O3的应用
(4)某消毒液中含有ClO2和Cl2两种主要成分。请补充完整用Na2S2O3标准溶液测定该消毒液中ClO2含量的实验方案:量取5.00 mL消毒液于锥形瓶中,加蒸馏水稀释到25.00 mL, ,重复实验2~3次,取实验平均值计算ClO2含量。
已知:①2ClO2+2KI 2KClO2+I2;
②KClO2+4KI+2H2SO4 KCl+2K2SO4+2I2+2H2O,该反应在pH=3时进行;
③2Na2S2O3+I2 Na2S4O6+2NaI。
(必须使用的试剂:0.100 0 mol·L-1 Na2S2O3标准溶液、淀粉溶液、KI溶液、稀硫酸)
(5)设计以下实验测定粗产品中Na2S2O3·5H2O的含量:
步骤1:准确称取8.000 g样品溶于水,加入5 mL甲醛,配成100 mL溶液。
步骤2:准确称取0.294 0 g K2Cr2O7固体于碘量瓶中,加入20 mL蒸馏水溶解,再加入10 mL 2 mol·L-1 H2SO4和20 mL 10% KI溶液使铬元素完全转化为Cr3+,加水稀释至100 mL。
步骤3:向碘量瓶中加入1 mL 1%淀粉,用待测Na2S2O3溶液滴定碘量瓶中溶液至滴定终点,消耗Na2S2O3溶液20.00 mL。(已知:I2+2S2 2I-+S4)
试计算Na2S2O3·5H2O的纯度。(写出计算过程)
答案 (1)sp3 (2)硫粉微溶于乙醇,在乙醇中有一定的溶解度,从而增大反应物的接触面积,加快反应速率
(3)①4SO2+2Na2S+Na2CO3 3Na2S2O3+CO2
②Na2CO3溶液显碱性,可以抑制Na2S水解,防止产生H2S气体 ③若SO2过量,溶液显酸性,产物分解
(4)向其中加入过量KI溶液,充分振荡,以淀粉溶液为指示剂,用0.100 0 mol·L-1 Na2S2O3标准溶液滴定至终点,加入稀硫酸调节溶液pH=3,再以淀粉溶液为指示剂,用0.100 0 mol·L-1 Na2S2O3标准溶液滴定至终点,记录第二次滴定消耗Na2S2O3溶液的体积
(5)根据Cr2+6I-+14H+ 2Cr3++3I2+7H2O、I2+2S2 2I-+S4可得关系式Cr2~3I2~6S2,n(K2Cr2O7)==1.000×10-3 mol,n(Na2S2O3·5H2O)=6n(K2Cr2O7)=1.000×10-3 mol×6=6.000×10-3 mol,样品中m(Na2S2O3·5H2O)=6.000×10-3 mol×248 g·mol-1×=7.440 g,样品中Na2S2O3·5H2O的纯度为×100%=93.00%。
8.★★★(2023扬州期初调研,16)纳米铁粉可去除水中的Cr(Ⅵ)。由于其活性较强,制备时常使其表面形成保护性氧化膜。
(1)纳米铁粉的制备。实验室以NaBH4溶液(碱性)与FeSO4溶液为原料制备纳米铁粉(装置如图1),将A溶液加入三颈烧瓶中,通过滴液漏斗缓慢加入B溶液,产生大量H2。反应结束后将三颈烧瓶分别放置0、2、4、6小时,待纳米铁粉表面产生不同厚度的氧化膜后,分别取出固体,洗涤、干燥,得4种纳米铁粉(以Fe-0、Fe-2、Fe-4、Fe-6表示)。滴液漏斗内的B溶液是 。NaBH4中B为+3价,理论上每生成1 mol Fe,与FeSO4反应的NaBH4的物质的量是 mol。
(2)研究放置时间对纳米铁粉性能的影响。实验一:室温下,取相同质量的4种纳米铁粉分别投入相同体积、含Cr(Ⅵ)浓度相同的污水中,一段时间后测量Cr(Ⅵ)去除率;
实验二:取4份相同体积的蒸馏水分别置于三颈烧瓶中,再各加入相同质量的4种纳米铁粉,搅拌,相同时间后测量溶液中c(Fe2+),结果如图2所示。请对纳米铁粉制备时放置时间、使用时溶出的少量Fe2+与Cr(Ⅵ)去除率之间的关系作出猜想: 。
(3)研究影响纳米铁粉溶出c(Fe2+)的因素。取一定量蒸馏水,用HCl调节pH约为6。将其分为相同体积的两份并分别置于三颈烧瓶中,向其中一份通入N2;再各加入相同质量的纳米铁粉,搅拌,一段时间后测得未通N2的三颈烧瓶内溶液中c(Fe2+)大于通入N2的。
①该条件下纳米铁粉溶出Fe2+的原因是 。
②实验时不将蒸馏水调节至较低pH,理由是 。
(4)纳米铁粉去除Cr(Ⅵ)主要是经过“吸附→反应→共沉淀”的过程。pH<8.6,纳米铁粉颗粒表面带正电荷;pH=8.6,纳米铁粉颗粒表面不带电;pH>8.6,纳米铁粉颗粒表面带负电荷。在水溶液中Cr(Ⅵ)主要存在微粒平衡浓度占Cr(Ⅵ)总浓度的百分数与pH的关系如图3。以实验室制得的纳米铁粉去除pH=4的水样中的Cr(Ⅵ),请补充完整实验方案:将一定量水样置于烧杯中, ,
反应一段时间,测量溶液中c[Cr(Ⅵ)],待c[Cr(Ⅵ)]小于1×10-3 mol·L-1,分离出固体。(还可使用的试剂:0.1 mol·L-1 NaOH溶液,0.1 mol·L-1 盐酸)
答案 (1)NaBH4溶液 0.5 (2)纳米铁粉制备时放置时间越长,表面形成的氧化膜越厚;一定厚度的氧化膜有利于纳米铁粉使用时溶出Fe2+,厚度过大或过小均不利于其使用时溶出Fe2+;纳米铁粉使用时溶出的Fe2+有助于Cr(Ⅵ)的去除 (3)①水中溶解的O2在弱酸性条件下与纳米铁粉反应生成Fe2+ ②溶液pH过低,c(H+)过大,纳米铁粉直接与H+反应 (4)用0.1 mol·L-1 NaOH溶液调节水样pH约为6(略小于8.6),向其中加入适量Fe-4纳米铁粉,搅拌
9.★★★(2024届南京学情调研,16)实验室制备NaClO溶液并用于处理含氨氮废水。
(1)低温下将Cl2通入NaOH溶液中制得NaClO溶液,装置如图1所示。
①装置B中盛放的试剂是 。
②为了防止装置C温度升高生成副产物NaClO3,可采取的操作为 。
(2)NaClO溶液处理含氨氮废水(pH为6.0~7.0)。室温下,分别取200 mL预处理后的废水,将初始pH调节至不同值,加入等量NaClO溶液,30分钟后检测剩余氨氮浓度。不同初始pH对NaClO氧化脱除氨氮效果的影响如图2所示,不同初始pH对应反应结束后的pH如图3所示。
①NaClO将废水中NH3氧化为无污染气体,反应的化学方程式为 ,实验中NaClO溶液的实际投入量大于理论计算量,其原因是 。
②处理后的废水pH在6.0~9.0之间才能排放。NaClO溶液处理含氨氮废水初始pH设置为7.0而不是2.0的原因是 。
(3)用滴定法测定NaClO溶液中有效氯含量的原理为ClO-+2I-+2H+ I2+Cl-+H2O;I2+2S2 S4+2I-。请补充完整该实验方案:取5.00 mL NaClO溶液样品配制成250 mL溶液,取25.00 mL待测液于碘量瓶中,加入10 mL 2 mol·L-1 H2SO4溶液和过量KI溶液,密封在暗处静置5 min; 。(须使用的试剂:0.050 0 mol·L-1 Na2S2O3溶液、淀粉溶液)
答案 (1)①饱和食盐水 ②装置C使用冰水浴冷却,向装置A中缓慢滴加浓盐酸 (2)①2NH3+3NaClO N2↑+3H2O+3NaCl NaClO(或HClO)不稳定,易分解 ②pH为7.0时氨氮去除率高,反应后pH约为9且调节pH所需的酸更少
(3)用0.050 0 mol·L-1 Na2S2O3溶液滴定至溶液呈微黄色,加入2~3滴淀粉溶液,继续滴定至加入最后半滴Na2S2O3溶液后,溶液蓝色褪去,且30 s内不恢复原来的颜色。平行滴定三次,记录消耗Na2S2O3溶液的体积
10.★★★(2023如皋第二次适应性考试,16)碘及碘化钾是实验室中的常见试剂,含碘废液中碘元素通常以I-、、I2和I中的一种或多种形式存在,回收碘具有很好的经济价值。
(1)为检验某实验室酸性废液中是否含I-,现进行如下实验:取少量废液,向其中滴加淀粉溶液,溶液不变蓝。另取少量废液, ,则溶液中含有I-。请补充完整该实验方案,实验中可以选用的试剂有FeCl3溶液、FeCl2溶液、淀粉溶液、KSCN溶液、K3[Fe(CN)6]溶液。
(2)一种由含I-的废液制取单质碘的流程如下:
①沉碘时应向废液中加入足量的Na2S2O3溶液,再加入CuSO4溶液至沉淀不再增加。
a.沉碘时有CuI沉淀和Na2S4O6生成,写出该反应的离子方程式: 。
b.若不加入Na2S2O3溶液,仅加入CuSO4溶液也可生成CuI沉淀。沉碘时不是仅加入CuSO4溶液的原因是 。
②氧化、蒸发的装置如图所示。
a.球形干燥管的作用是 。
b.蒸发出的碘蒸气冷却后易凝固。实验过程中,若发现玻璃导管中有单质碘凝固析出,为防止堵塞,可以采取的方法是 。
(3)若废液中含有I2,可以用CCl4进行萃取,萃取后所得有机层可以用KOH溶液进行反萃取。反萃取后所得水层中的溶质为KIO3和KI。请补充完整由反萃取后所得水层制取KI晶体的实验方案:取反萃取后所得水层, 。
(已知KI易溶于水;氧化性:KIO3>S。实验中可以选用的试剂有H2S气体、NaOH溶液、稀硫酸)
(4)某含碘废液中,碘元素以I形式存在,为测定I的浓度,现进行如下实验:准确量取20.00 mL废液,加水稀释配成100 mL溶液,取20.00 mL溶液,加入盐酸,加入足量KI晶体,以淀粉为指示剂,用0.100 0 mol·L-1 Na2S2O3溶液滴定I2至恰好完全反应,消耗Na2S2O3溶液24.00 mL。已知测定过程中发生的反应为I+I-+H+——I2+H2O(未配平);I2+S2——I-+S4(未配平)。计算废液中I的物质的量浓度,并写出计算过程。
答案 (1)向其中滴加几滴淀粉溶液,再滴入FeCl3溶液,若溶液变蓝 (2)①a.2Cu2++2I-+2S2 2CuI↓+S4 b.仅加入CuSO4溶液,生成的CuI沉淀的量将减少一半,最终回收的I2也将减少一半 ②a.防止倒吸 b.用酒精灯加热有单质碘析出的导管部位 (3)向其中边搅拌边通入H2S气体,至静置后向上层清液中通入H2S气体时,不再有沉淀生成,停止通入;过滤,将所得溶液蒸发结晶,得到KI晶体,同时将蒸发所得的气体通入NaOH溶液中 (4)n(S2)=0.100 0 mol·L-1×24.00 mL×10-3 mL·L-1=2.4×10-3 mol n(I2)=n(S2)=×2.4×10-3 mol=1.2×10-3 mol 原废液中n(I)=n(I2)×=×1.2×10-3 mol×5=2.0×10-3 mol 废液中c(I)==0.10 mol·L-1
专题十七 实验方案的设计与评价
五年高考
考点过关练
考点1 制备实验方案的设计与评价
1.★★(2023全国乙,9,6分)下列装置可以用于相应实验的是( )
答案 D
2.★★(2021海南,3,2分)用如图装置制取干燥的气体(a、b表示加入的试剂),能实现的是( )
选项 气体 a b
A H2S 稀H2SO4 FeS
B O2 H2O2溶液 MnO2
C NO2 浓HNO3 铁片
D NH3 浓氨水 CaO
答案 B
3.★★(2021北京,5,3分)实验室制备下列气体所选试剂、制备装置及收集方法均正确的是 ( )
a b
c d e
气体 试剂 制备装置 收集方法
A O2 KMnO4 a d
B H2 Zn+稀H2SO4 b e
C NO Cu+稀HNO3 b c
D CO2 石灰石+稀H2SO4 b c
答案 B
4.★★★(2021江苏,17,15分)以软锰矿粉(含MnO2及少量Fe、Al、Si、Ca、Mg等的氧化物)为原料制备电池级MnO2。
图1
(1)浸取。将一定量软锰矿粉与Na2SO3、H2SO4溶液中的一种配成悬浊液,加入三颈瓶中(装置如图1),70 ℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中的溶液是 ;MnO2转化为Mn2+的离子方程为 。
(2)除杂。向已经除去Fe、Al、Si的MnSO4溶液(pH约为5)中加入NH4F溶液,溶液中的Ca2+、Mg2+形成氟化物沉淀。若沉淀后上层清液中c(F-)=0.05 mol·L-1,则c(Ca2+)/c(Mg2+)= 。[Ksp(MgF2)=5×10-11,Ksp(CaF2)=5×10-9]
(3)制备MnCO3。在搅拌下向100 mL 1 mol·L-1 MnSO4溶液中缓慢滴加1 mol·L-1 NH4HCO3溶液,过滤、洗涤、干燥,得到MnCO3固体。需加入NH4HCO3溶液的体积约为 。
(4)制备MnO2。MnCO3经热解、酸浸等步骤可制备MnO2。MnCO3在空气气流中热解得到三种价态锰的氧化物,锰元素所占比例(×100%)随热解温度变化的曲线如图2所示。已知:MnO与酸反应生成Mn2+;Mn2O3氧化性强于Cl2,在加热条件下Mn2O3在酸性溶液中转化为MnO2和Mn2+。
图2
为获得较高产率的MnO2,请补充实验方案:取一定量MnCO3置于热解装置中,通空气气流, ,固体干燥,得到MnO2。(可选用的试剂:1 mol·L-1 H2SO4溶液、2 mol·L-1 HCl溶液、BaCl2溶液、AgNO3溶液)
答案 (1)H2SO4溶液 MnO2+S+2H+Mn2++S+H2O (2)100 (3)200 mL
(4)加热至约450 ℃分解一段时间,将冷却后的固体加入至适量1 mol·L-1H2SO4溶液中,加热,搅拌反应一段时间,过滤,用水洗涤,取最后一次洗涤滤液,向其中滴加BaCl2溶液,无白色沉淀生成
5.★★★(2022海南,15,10分)胆矾(CuSO4·5H2O)是一种重要化工原料。某研究小组以生锈的铜屑为原料[主要成分是Cu,含有少量的油污、CuO、CuCO3、Cu(OH)2]制备胆矾。流程如下:
回答问题:
(1)步骤①的目的是 。
(2)步骤②中,若仅用浓H2SO4溶解固体B,将生成 (填化学式)污染环境。
(3)步骤②中,在H2O2存在下Cu溶于稀H2SO4,反应的化学方程式为 。
(4)经步骤④得到的胆矾,不能用水洗涤的主要原因是 。
(5)实验证明,滤液D能将I-氧化为I2。
ⅰ.甲同学认为不可能是步骤②中过量H2O2将I-氧化为I2,理由是 。
ⅱ.乙同学通过实验证实,只能是Cu2+将I-氧化为I2,写出乙同学的实验方案及结果
(不要求写具体操作过程)。
答案 (1)除油污 (2)SO2
(3)Cu+H2O2+H2SO4 CuSO4+2H2O
(4)胆矾晶体易溶于水
(5)ⅰ.溶液C经步骤③加热浓缩后H2O2已完全分解
ⅱ.取滤液,向其中加入适量硫化钠,使铜离子恰好完全沉淀,再加入I-,不能被氧化
6.★★★(2023新课标,28,14分)实验室由安息香制备二苯乙二酮的反应式如下:
相关信息列表如下:
物质 性状 熔点/℃ 沸点/℃ 溶解性
安息香 白色固体 133 344 难溶于冷水 溶于热水、乙醇、乙酸
二苯乙 二酮 淡黄色固体 95 347 不溶于水 溶于乙醇、苯、乙酸
冰乙酸 无色液体 17 118 与水、乙醇互溶
装置示意图如图所示,实验步骤:
①在圆底烧瓶中加入10 mL冰乙酸、5 mL水及9.0 g FeCl3·6H2O,边搅拌边加热,至固体全部溶解。
②停止加热,待沸腾平息后加入2.0 g安息香,加热回流45~60 min。
③加入50 mL水,煮沸后冷却,有黄色固体析出。
④过滤,并用冷水洗涤固体3次,得到粗品。
⑤粗品用75%的乙醇重结晶,干燥后得淡黄色结晶1.6 g。
回答下列问题:
(1)仪器A中应加入 (填“水”或“油”)作为热传导介质。
(2)仪器B的名称是 ;冷却水应从 (填“a”或“b”)口通入。
(3)实验步骤②中,安息香必须待沸腾平息后方可加入,其主要目的是 。
(4)在本实验中,FeCl3为氧化剂且过量,其还原产物为 ;某同学尝试改进本实验:采用催化量的FeCl3并通入空气制备二苯乙二酮。该方案是否可行 简述判断理由: 。
(5)本实验步骤①~③在乙酸体系中进行,乙酸除作溶剂外,另一主要作用是防止 。
(6)若粗品中混有少量未氧化的安息香,可用少量 洗涤的方法除去(填标号)。若要得到更高纯度的产品,可用重结晶的方法进一步提纯。
a.热水 b.乙酸 c.冷水 d.乙醇
(7)本实验的产率最接近于 (填标号)。
a.85% b.80% c.75% d.70%
答案 (1)油 (2)球形冷凝管 a
(3)防止暴沸 (4)FeCl2[Fe2+/Fe(Ⅱ)/Fe(CH3COO)2均可] 可行,空气中的O2可将Fe2+氧化为Fe3+,从而实现催化循环 (5)FeCl3水解[生成Fe(OH)3/Fe(OH)3胶体均可] (6)a (7)b
7.★★★(2023辽宁,17,13分)2-噻吩乙醇(Mr=128)是抗血栓药物氯吡格雷的重要中间体,其制备方法如下:
Ⅰ.制钠砂。向烧瓶中加入300 mL液体A和4.60 g金属钠,加热至钠熔化后,盖紧塞子,振荡至大量微小钠珠出现。
Ⅱ.制噻吩钠。降温至10 ℃,加入25 mL噻吩,反应至钠砂消失。
Ⅲ.制噻吩乙醇钠。降温至-10 ℃,加入稍过量的环氧乙烷的四氢呋喃溶液,反应30 min。
Ⅳ.水解。恢复至室温,加入70 mL水,搅拌30 min;加盐酸调pH至4~6,继续反应2 h,分液;用水洗涤有机相,二次分液。
Ⅴ.分离。向有机相中加入无水MgSO4,静置,过滤,对滤液进行蒸馏,蒸出四氢呋喃、噻吩和液体A后,得到产品17.92 g。
回答下列问题:
(1)步骤Ⅰ中液体A可以选择 。
a.乙醇 b.水 c.甲苯 d.液氨
(2)噻吩沸点低于吡咯()的原因是 。
(3)步骤Ⅱ的化学方程式为 。
(4)步骤Ⅲ中反应放热,为防止温度过高引发副反应,加入环氧乙烷的四氢呋喃溶液的方法是 。
(5)步骤Ⅳ中用盐酸调节pH的目的是 。
(6)下列仪器在步骤Ⅴ中无需使用的是 (填名称);无水MgSO4的作用为 。
(7)产品的产率为 (用Na计算,精确至0.1%)。
答案 (1)c (2)吡咯可以形成分子间氢键,而噻吩不能形成分子间氢键
(3)
(4)向烧瓶中缓慢滴入稍过量的环氧乙烷的四氢呋喃溶液,并不断搅拌 (5)与水解产生的NaOH反应,提高转化率 (6)球形冷凝管、分液漏斗 去除有机相中少量的水
(7)70.0%
8.★★★(2023山东,18,12分)三氯甲硅烷(SiHCl3)是制取高纯硅的重要原料,常温下为无色液体,沸点为31.8 ℃,熔点为-126.5 ℃,易水解。实验室根据反应Si+3HCl SiHCl3+H2,利用如下装置制备SiHCl3粗品(加热及夹持装置略)。回答下列问题:
(1)制备SiHCl3时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入HCl,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为 ;判断制备反应结束的实验现象是 。图示装置存在的两处缺陷是 。
(2)已知电负性Cl>H>Si,SiHCl3在浓NaOH溶液中发生反应的化学方程式为 。
(3)采用如下方法测定溶有少量HCl的SiHCl3纯度。
m1 g样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:① ,
② (填操作名称),③称量等操作,测得所得固体氧化物质量为m2 g。从下列仪器中选出①、②中需使用的仪器,依次为 (填标号)。测得样品纯度为 (用含m1、m2的代数式表示)。
A B C D
答案 (1)连接好装置,并检查装置的气密性 装置C的蒸馏烧瓶中不再有液体滴下 装置C、D之间缺少干燥装置,缺少处理尾气H2的装置 (2)SiHCl3+5NaOH Na2SiO3+3NaCl+H2↑+2H2O (3)灼烧 冷却 A、C ×100%
考点2 探究实验方案的设计与评价
9.★★(2019江苏,13,4分)室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 实验操作和现象 结论
A 向X溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液变为红色 X溶液中一定含有Fe2+
B 向浓度均为0.05 mol·L-1的NaI、NaCl混合溶液中滴加少量AgNO3溶液,有黄色沉淀生成 Ksp(AgI)>Ksp(AgCl)
C 向3 mL KI溶液中滴加几滴溴水,振荡,再滴加1 mL淀粉溶液,溶液显蓝色 Br2的氧化性比I2的强
D 用pH试纸测得:CH3COONa溶液的pH约为9,NaNO2溶液的pH约为8 HNO2电离出H+的能力比CH3COOH的强
答案 C
10.(2022江苏,11,3分)室温下,下列实验探究方案不能达到探究目的的是( )
选项 探究方案 探究目的
A 向盛有FeSO4溶液的试管中滴加几滴KSCN溶液,振荡,再滴加几滴新制氯水,观察溶液颜色变化 Fe2+具有还原性
B 向盛有SO2水溶液的试管中滴加几滴品红溶液,振荡,加热试管,观察溶液颜色变化 SO2具有漂白性
C 向盛有淀粉-KI溶液的试管中滴加几滴溴水,振荡,观察溶液颜色变化 Br2的氧化性比I2的强
D 用pH计测量醋酸、盐酸的pH,比较溶液pH大小 CH3COOH是弱电解质
答案 D
11.★★(2023新课标,11,6分)根据实验操作及现象,下列结论中正确的是( )
选项 实验操作及现象 结论
A 常温下将铁片分别插入稀硝酸和浓硝酸中,前者产生无色气体,后者无明显现象 稀硝酸的氧化性比浓硝酸强
B 取一定量Na2SO3样品,溶解后加入BaCl2溶液,产生白色沉淀。加入浓HNO3,仍有沉淀 此样品中含有S
C 将银和AgNO3溶液与铜和Na2SO4溶液组成原电池。连通后银表面有银白色金属沉积,铜电极附近溶液逐渐变蓝 Cu的金属性比Ag强
D 向溴水中加入苯,振荡后静置,水层颜色变浅 溴与苯发生了加成反应
答案 C
12.★★(2023辽宁,13,3分)某小组进行实验,向10 mL 蒸馏水中加入0.4 g I2,充分振荡,溶液呈浅棕色,再加入0.2 g锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知(aq)为棕色,下列关于颜色变化的解释错误的是( )
选项 颜色变化 解释
A 溶液呈浅棕色 I2在水中溶解度较小
B 溶液颜色加深 发生了反应:I2+I-
C 紫黑色晶体消失 I2(aq)的消耗使溶解平衡I2(s) I2(aq)右移
D 溶液褪色 Zn与有色物质发生了置换反应
答案 D
13.★★(2020江苏,13,2分)根据下列实验操作和现象所得到的结论正确的是( )
选项 实验操作和现象 结论
A 向淀粉溶液中加适量20%H2SO4溶液,加热,冷却后加NaOH溶液至中性,再滴加少量碘水,溶液变蓝 淀粉未水解
B 室温下,向0.1 mol·L-1 HCl溶液中加入少量镁粉,产生大量气泡,测得溶液温度上升 镁与盐酸反应放热
C 室温下,向浓度均为0.1 mol·L-1的BaCl2和CaCl2混合溶液中加入Na2CO3溶液,出现白色沉淀 白色沉淀是BaCO3
D 向0.1 mol·L-1 H2O2溶液中滴加0.01 mol·L-1 KMnO4溶液,溶液褪色 H2O2具有氧化性
答案 B
14.★★★(2023北京,19,14分)资料显示,I2可以将Cu氧化为Cu2+。某小组同学设计实验探究Cu被I2氧化的产物及铜元素的价态。
已知:I2易溶于KI溶液,发生反应I2+I- (红棕色);I2和氧化性几乎相同。
(1)将等体积的KI溶液加入m mol铜粉和n mol I2(n>m)的固体混合物中,振荡。实验记录如下:
c(KI) 实验现象
实验Ⅰ 0.01 mol·L-1 极少量I2溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色
实验Ⅱ 0.1 mol·L-1 部分I2溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色
实验Ⅲ 4 mol·L-1 I2完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色
①初始阶段,Cu被氧化的反应速率:实验Ⅰ 实验Ⅱ(填“>”“<”或“=”)。
②实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有[Cu(H2O)4]2+ (蓝色)或[CuI2]- (无色),进行以下实验探究:
步骤a.取实验Ⅲ的深红棕色溶液,加入CCl4,多次萃取、分液。
步骤b.取分液后的无色水溶液,滴入浓氨水,溶液颜色变浅蓝色,并逐渐变深。
ⅰ.步骤a的目的是 。
ⅱ.查阅资料,2Cu2++4I-2CuI↓+I2,[Cu(NH3)2]+ (无色)容易被空气氧化。用离子方程式解释步骤b的溶液中发生的变化: 。
③结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是CuI,实验Ⅰ中铜被氧化的化学方程式是 。分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入浓KI溶液, (填实验现象),观察到少量红色的铜。分析铜未完全反应的原因是 。
(2)上述实验结果,I2仅将Cu氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了I2能将Cu氧化为Cu2+。装置如图所示,a、b分别是 。
(3)运用氧化还原反应规律,分析在上述实验中Cu被I2氧化的产物中价态不同的原因: 。
答案 (1)①< ②ⅰ.加入CCl4萃取溶液中的I2,使c(I2)下降,导致I2+I- 平衡逆向移动,多次萃取、分液可使c()降至极低,即可避免的红棕色对Cu的氧化产物的判断造成干扰 ⅱ.[CuI2]-+2NH3·H2O [Cu(NH3)2]++2I-+2H2O,生成的[Cu(NH3)2]+被空气氧化:4[Cu(NH3)2]++O2+8NH3·H2O 4[Cu(NH3)4]2++4OH-+6H2O ③2Cu+KI3 2CuI+KI 白色沉淀溶解并得到无色溶液 产生的CuI沉淀覆盖在Cu的表面,阻碍Cu进一步反应 (2)Cu、4 mol·L-1 KI溶液和n mol I2的混合物 (3)Cu-e-+I- CuI,I-的存在可提升Cu的还原性,同理Cu2++e-+I- CuI↓,I-的存在可提升Cu2+的氧化性,故当I-存在时,Cu更易被氧化为+1价;而当I-不与Cu和Cu2+直接接触时,才能发生反应Cu+I2 Cu2++2I-,Cu被氧化为+2价
15.★★★(2022福建,12,14分)某兴趣小组设计实验探究Ce-MnOx催化空气氧化CO的效率。回答下列问题:
步骤Ⅰ 制备CO
在通风橱中用下图装置制备CO(加热及夹持装置省略),反应方程式如下:
HCOOH CO↑+H2O
(1)装置A中盛放甲酸的仪器的名称是 。
(2)从B、C、D中选择合适的装置收集CO,正确的接口连接顺序为a→ → → → →h(每空填一个接口标号)。
步骤Ⅱ 检验CO
将CO通入新制银氨溶液中,有黑色沉淀生成。
(3)该反应的化学方程式为 。
步骤Ⅲ 探究Ce-MnOx催化空气氧化CO的效率
将一定量CO与空气混合,得到CO体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至120 ℃,按一定流速通入气体样品。(已知:I2O5是白色固体,易吸水潮解;5CO+I2O5 I2+5CO2)
(4)通入11.2 L(已折算为标准状况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了0.101 6 g I2。
①能证明CO被空气氧化的现象是 ;
②CO被催化氧化的百分率为 ;
③若未通入氮气,②的结果将 (填“偏大”“偏小”或“无影响”)。
(5)探究气体与催化剂接触时长对催化氧化效率的影响时,采用 方法可以缩短接触时长。
(6)步骤Ⅲ装置存在的不足之处是 。
答案 (1)分液漏斗 (2)d e c b(全部写对才可得分) (3)CO+2[Ag(NH3)2]OH 2Ag↓+(NH4)2CO3+2NH3(或其他合理答案) (4)①石灰水变浑浊 ②60% ③偏大 (5)增大气体样品流速 (6)尾气出口未加防潮装置(或其他相似表述)
16.★★★(2021广东,17,15分)含氯物质在生产生活中有重要作用。1774年,舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。
(1)实验室沿用舍勒的方法制取Cl2的化学方程式为 。
(2)实验室制取干燥Cl2时,净化与收集Cl2所需装置的接口连接顺序为 。
(3)某氯水久置后不能使品红溶液褪色,可推测氯水中 已分解。检验此久置氯水中Cl-存在的操作及现象是 。
(4)某合作学习小组进行以下实验探究。
①实验任务 通过测定溶液电导率,探究温度对AgCl溶解度的影响。
②查阅资料 电导率是表征电解质溶液导电能力的物理量。温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;离子浓度一定时,稀溶液电导率随温度的升高而增大。25 ℃时,Ksp(AgCl)=1.8×10-10。
③提出猜想 猜想a:较高温度的AgCl饱和溶液的电导率较大。
猜想b:AgCl在水中的溶解度S(45 ℃)>S(35 ℃)>S(25 ℃)。
④设计实验、验证猜想 取试样Ⅰ、Ⅱ、Ⅲ(不同温度下配制的AgCl饱和溶液),在设定的测试温度下,进行表1中实验1~3,记录数据。
表1
实验序号 试样 测试温度/℃ 电导率/(μS/cm)
1 Ⅰ:25 ℃的AgCl饱和溶液 25 A1
2 Ⅱ:35 ℃的AgCl饱和溶液 35 A2
3 Ⅲ:45 ℃的AgCl饱和溶液 45 A3
⑤数据分析、交流讨论 25 ℃的AgCl饱和溶液中,c(Cl-)= mol/L。
实验结果为A3>A2>A1。小组同学认为,此结果可以证明③中的猜想a成立,但不足以证明猜想b成立。结合②中信息,猜想b不足以成立的理由有 。
⑥优化实验 小组同学为进一步验证猜想b,在实验1~3的基础上完善方案,进行实验4和5。请完成表2中内容。
表2
实验序号 试样 测试温度/℃ 电导率/(μS/cm)
4 Ⅰ B1
5 B2
⑦实验总结 根据实验1~5的结果,并结合②中信息,小组同学认为猜想b也成立。猜想b成立的判断依据是 。
答案 (1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(2)cdbae (3)HClO 取少量久置氯水于试管中,滴加稀硝酸酸化,再滴加硝酸银溶液,产生白色沉淀 (4)⑤1.34×10-5 即使离子浓度相同,温度升高,电导率也会增大;温度升高,水的电离程度增大 ⑥35 Ⅱ 45(或 45 Ⅱ 45) ⑦A2>B1,A3>B2(或A3>B2>B1)
三年模拟
考点强化练
考点1 制备实验方案的设计与评价
1.★(2024届苏州期初调研,3)下列有关实验室制取、收集NO2并制备Cu(NO3)2·6H2O的实验原理和装置正确的是( )
A.用装置甲制取NO2
B.用装置丁收集NO2
C.用装置丙吸收NO2
D.用装置乙蒸干溶液获得Cu(NO3)2·6H2O
答案 C
2.★★(2023连云港第一次调研,7)实验室制备无水FeCl2的装置如图所示(加热及夹持装置略)。已知SOCl2沸点为76 ℃,遇水极易反应生成两种酸性气体。下列说法错误的是( )
A.实验开始时通入N2的目的是排出装置中的O2,防止FeCl2被氧化
B.可先给b加热,再用水浴加热的方式给a加热
C.装置c、d的作用是冷凝回流SOCl2
D.装置f的作用是吸收反应生成的HCl和SO2
答案 B
3.★★(2024届苏州期中,16节选)GeO2粗品中常含有少量As2O3。为了提纯GeO2,可先将其转化为GeCl4,再在0 ℃下水解GeCl4得到高纯GeO2。已知:
①GeO2与As2O3均为两性氧化物,部分晶型的GeO2难溶于盐酸;
②GeCl4常温下是液体,沸点为84 ℃,易与AsCl3共沸;
③AsCl3在pH为0.4~0.6时有还原性。
现有已知As含量的粗品GeO2,补充完整提纯的实验方案:向粗品中分批加入4 mol·L-1 NaOH溶液,直至粗品完全溶解, ,
过滤,洗涤2~3次,干燥。(实验中须使用的试剂:10 mol·L-1盐酸、氯酸钠固体、蒸馏水)
答案 向溶液中加入10 mol·L-1盐酸至pH=0.5(0.4~0.6间的任意数均可),随后加入足量NaClO3固体充分反应;在84 ℃蒸馏,将馏分冷却后,与0 ℃的蒸馏水混合,充分搅拌直至无沉淀生成
4.★★(2024届南通如东开学考,16节选)已知:2[Cu(NH3)4]2++N2H4·H2O+4OH- 2Cu↓+N2↑+8NH3↑+5H2O。铜粉沉淀率与水合肼溶液初始浓度的关系如图所示。请设计由铜氨废液回收铜粉的实验方案:取一定体积6 mol·L-1水合肼溶液, ,静置、过滤、洗涤、干燥。(须使用的试剂:2 mol·L-1 H2SO4溶液、NaOH固体、铜氨废液、蒸馏水)
答案 加入蒸馏水稀释水合肼溶液至3.0~3.25 mol·L-1,加入适量NaOH固体,边搅拌边逐滴加入铜氨废液,加热使其充分反应,同时用2 mol·L-1 H2SO4溶液吸收反应中放出的NH3,直至溶液中无气泡产生,停止滴加
5.★★(2024届扬州中学开学考,16节选)钛酸钡(BaTiO3)是制备电子陶瓷材料的基础原料。
实验室模拟制备钛酸钡的过程如下:
已知:TiCl4能水解生成TiO2+,TiO2+能进一步水解生成TiO2;BaTiO3能与浓硫酸反应生成TiO2+。草酸氧钛钡晶体的化学式为BaTiO(C2O4)2·4H2O。
①Ti(Ⅳ)的存在形式(相对含量分数)与溶液pH的关系如图1所示。“沉钛”时,需加入氨水调节溶液的pH在2~3之间,理由是 。
②由草酸氧钛钡晶体(相对分子质量为449)煅烧制得钛酸钡分为三个阶段。现称取44.9 g草酸氧钛钡晶体进行热重分析,测得残留固体质量与温度的变化关系如图2所示。C点残留固体中含有碳酸钡和钛氧化物,则阶段Ⅱ发生反应的化学方程式为 。
答案 ①pH在2~3之间时,Ti(Ⅳ)主要以[TiO(C2O4)2]2-的形式存在,可直接与Ba2+反应,有利于草酸氧钛钡晶体的生成 ②BaTiO(C2O4)2 BaCO3+TiO2+2CO↑+CO2↑
6.★★★(2023苏州学业质量阳光指标调研,16)实验室以工业级硫酸锰粉末(含少量Ca、Co等的硫酸盐)为原料获得电池级MnSO4,并制备催化剂的载体Mn3O4。
(1)将工业级硫酸锰溶于水,蒸发结晶,趁热过滤除去部分杂质。过程中杂质去除率随MnSO4结晶率[×100%]的变化如图1所示。杂质去除率随MnSO4结晶率的增大反而下降的原因是 。
(2)将除去部分杂质的MnSO4溶于水,先后加入MnF2和MnS分别除去溶液中的Ca2+和Co2+,获得电池级硫酸锰。
①MnF2可将溶液中的Ca2+转化为CaF2。CaF2的晶胞如图2所示,Ca2+周围距离最近且相等的F-个数为 。
②“除钴”时,发生反应Co2++MnS(s) CoS(s)+Mn2+。反应完全后,上层清液中c(Mn2+)/c(Co2+)= 。[Ksp(MnS)=2×10-13,Ksp(CoS)=2×10-25]
(3)MnSO4溶液在碱性条件下通入空气氧化获得Mn3O4,产物中Mn元素质量分数(Mn%)随反应时间和温度变化如图3和图4所示。
①图3所示反应时间超过8 h,Mn%降低的原因是 。
②请设计由MnSO4溶液制备较纯Mn3O4的实验方案: 。
(需用到的试剂:1 mol·L-1NaOH溶液、BaCl2溶液)
答案 (1)水分大量蒸发,硫酸盐杂质结晶析出量增加 (2)①8 ②1012 (3)①Mn3O4被氧化成更高价态锰的氧化物(Mn2O3或MnO2) ②向MnSO4溶液中加入一定量1 mol·L-1NaOH溶液,边搅拌边通入空气,控制75 ℃加热8 h左右,过滤,洗涤,取最后一次洗涤滤液并加入BaCl2溶液,无浑浊
7.★★★(2023南通、淮安等五市第一次调研,16)KIO3是重要的食品添加剂。实验室模拟工业制备KIO3的部分实验流程如下:
(1)“氧化”反应在图1所示装置中进行。先将KClO3与I2混合后放入气密性良好的三颈烧瓶中,加水充分溶解,在90 ℃下边搅拌边滴加20 mL 1 mol·L-1盐酸引发反应,停止滴加盐酸后持续搅拌40 min以上,得到热的KH(IO3)2溶液。
已知:KH(IO3)2不溶于有机溶剂。几种物质的溶解度随温度的变化如图2所示。
①用12 mol·L-1盐酸配制100 mL 1.00 mol·L-1盐酸须使用的玻璃仪器有烧杯、玻璃棒、酸式滴定管、 。
②检查图1所示装置气密性的操作为 。
③“氧化”过程中有少量黄绿色的气态副产物产生。用热的KOH溶液可吸收该气体并实现原料的循环利用。写出该吸收过程中发生反应的化学方程式: 。
④能说明反应已经进行完全的标志是 。
⑤实际工业进行“氧化”反应时,需要在反应设备上连接冷凝回流装置,其目的是 。
(2)除去KH(IO3)2溶液中稍过量I2的实验方法是 。
(3)利用提纯得到的KH(IO3)2粗品(含少量KCl)制备纯净KIO3的实验方案为 。
(须使用的实验药品:KOH溶液、稀硝酸、AgNO3溶液、冰水)
答案 (1)①100 mL容量瓶、胶头滴管 ②连接好装置,关闭分液漏斗活塞,将导管用乳胶管连接后插入水中,微热烧瓶,在导管口有气泡产生 ③3Cl2+6KOH 5KCl+KClO3+3H2O ④溶液的pH不再变化 ⑤冷凝回流I2和HCl,提高原料利用率并防止污染空气 (2)用CCl4萃取后分液 (3)将KH(IO3)2溶于水,向其中滴加KOH溶液至溶液pH>7,加热浓缩、冷却结晶,过滤,用冰水洗涤,直至最后一次洗涤滤液中加入稀硝酸和硝酸银溶液无沉淀产生
8.★★★(2023如皋第一次适应性考试,16)一种以磷铁渣(主要含FeP,以及少量Fe2O3、SiO2等杂质)、KMnO4为原料制备磷酸锰[Mn3(PO4)2]的实验过程如下:
(1)溶解。将一定量的磷铁渣加入如图1所示装置的三颈烧瓶中,维持温度60 ℃,边搅拌边向三颈烧瓶中加入一定量的稀硫酸和KMnO4溶液,反应后有Fe3+、Mn2+和H3PO4生成。反应后过滤。
①写出FeP反应的离子方程式: 。
②实验中当观察到某种现象时可不再加入KMnO4溶液,该现象是 。
③FePO4难溶于水,反应Fe3++H3PO4 FePO4+3H+的平衡常数为 。
[已知Ksp(FePO4)=1×10-22,H3PO4的电离平衡常数=8×10-3、=6×10-8、=4×10-13]
④实验中需不断补充稀硫酸控制溶液的pH。pH过大会降低Fe的浸出率和消耗过多的KMnO4,原因是 。
(2)除铁。向所得滤液中加入萃取剂(由磷酸酯和煤油混合而成,磷酸酯易溶于煤油,难溶于水)萃取溶液中的Fe3+。萃取结束后取有机层,经过反萃取操作,可回收萃取剂重复使用。已知萃取剂中磷酸酯(用HA表示)萃取溶液中Fe3+时发生如下反应:
Fe3++3(HA)2(有机层) Fe(HA2)3(有机层)+3H+
反萃取回收萃取剂的方法是 。
(3)制Mn3(PO4)2。请补充完整由萃取后所得水层中Mn2+、H3PO4制纯净Mn3(PO4)2固体的实验方案:取萃取后所得水层溶液100 mL[其中c(Mn2+)=1.2 mol·L-1], ,干燥沉淀,得Mn3(PO4)2固体。{已知溶液的pH对所得沉淀中锰磷比[]和Mn的沉淀率影响如图2所示。实验中需使用的实验试剂有0.1 mol·L-1H3PO4溶液、NaOH溶液、盐酸、BaCl2溶液}
答案 (1)①5FeP+8Mn+39H+ 5Fe3++8Mn2++5H3PO4+12H2O ②三颈烧瓶中加入KMnO4溶液后浅红色不消失 ③1.92 ④pH过大,Fe3+水解生成Fe(OH)3或转化为FePO4沉淀造成Fe的浸出率降低,KMnO4转化为MnO2,氧化等量的FeP消耗的KMnO4更多 (2)向萃取后所得有机层中(分批次)加入一定量的稀硫酸,充分振荡后静置分液,取有机层 (3)向其中滴加50 mL 0.1 mol·L-1H3PO4溶液,再滴加NaOH溶液,至溶液pH=7,过滤,洗涤沉淀至最后一次洗涤滤液中加入盐酸和BaCl2溶液无沉淀生成
考点2 探究实验方案的设计与评价
9.★★(2024届无锡期中教学质量调研,11)室温下,下列实验方案不能达到探究目的的是( )
选项 实验方案 探究目的
A 向Fe(NO3)3溶液中滴入淀粉,再滴加HI溶液,观察溶液颜色变化 探究I2与Fe3+氧化性强弱
B 用pH计分别测定等物质的量浓度的CH3COOH溶液和CCl3COOH溶液的pH 探究键的极性对羧酸酸性的影响
C 向大小形状完全相同的打磨过的镁条和铝条中加入2 mL 3 mol·L-1盐酸,观察反应剧烈程度 探究镁、铝金属性的强弱
D 向MgCl2溶液中先加入少量氢氧化钠溶液,充分反应后再加入少量CuSO4溶液,观察沉淀颜色的变化 探究Cu(OH)2与Mg(OH)2溶度积的大小
答案 A
10.★★(2024届盐城联盟校第一次调研,13)室温下,下列实验探究方案及现象能达到探究目的的是( )
选项 探究方案及现象 探究目的
A 用pH计测量HF溶液、盐酸的pH,比较溶液pH大小 HF是弱电解质
B 向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀,再加入足量稀盐酸,部分沉淀溶解 Na2SO3不能被空气氧化
C 向NaBr溶液中滴加过量氯水,溶液变橙色,再加入淀粉KI溶液,溶液变蓝色 氧化性: Cl2>Br2>I2
D 向盛有FeSO4溶液的试管中滴加几滴KSCN溶液,振荡,再滴加几滴新制氯水,观察溶液颜色变化 Fe2+具有还原性
答案 D
11.★★(2024届南通如东开学考,11)常温下,根据下列实验操作和现象得出的结论正确的是( )
选项 实验操作和现象 实验结论
A 分别测量浓度均为0.1 mol·L-1 Na2CO3溶液和Na[Al(OH)4]溶液的pH,后者pH更大 [Al(OH)4]-比C更容易结合H+
B 将亚硫酸钠样品溶于水,加入盐酸酸化的Ba(NO3)2溶液,出现白色沉淀 亚硫酸钠样品已变质
C 将盐酸滴入Na2CO3溶液产生无色气体,将产生的气体直接通入Na2SiO3溶液 非金属性:Cl>C>Si
D 向BaCl2溶液中通入SO2和气体X,出现白色沉淀 气体X一定具有氧化性
答案 A
12.★★(2024届苏州期初调研,11)下列实验方案能达到探究目的的是( )
选项 探究目的 实验方案
A 酸性:CH3COOH>HCN 用pH计测量浓度均为0.1 mol·L-1的CH3COONa溶液和NaCN溶液的pH,比较溶液pH大小
B H2O2具有氧化性 向0.1 mol·L-1 H2O2溶液中滴加0.1 mol·L-1 KMnO4溶液,观察溶液颜色变化
C Ksp(AgI)
答案 A
13.★★(2023苏锡常镇四市第一次调研,11)根据下列实验操作和现象得出的结论不正确的是( )
选项 实验操作和现象 实验结论
A 向溶有SO2的 BaCl2 溶液中通入气体X,出现白色沉淀 X具有氧化性
B 向0.1 mol·L-1 FeCl3溶液中滴加KI淀粉溶液,溶液变蓝 氧化性:Fe3+>I2
C 向NaHCO3溶液中加入等浓度、等体积的NaAlO2溶液,出现白色沉淀 Al比C更容易结合H+
D 将溴乙烷、乙醇和烧碱的混合物加热,产生的气体经水洗后,再通入酸性KMnO4溶液中,溶液褪色 溴乙烷发生了消去反应
答案 A
14.★★(2023南京二模,10)下列实验探究方案不能达到探究目的的是( )
选项 探究方案 探究目的
A 向两支分别盛有2 mL苯和2 mL甲苯的试管中各加入几滴酸性高锰酸钾溶液,用力振荡,观察现象 探究有机物中基团间的相互作用
B 用分液漏斗向盛有Na2CO3固体的锥形瓶中滴加乙酸溶液,将产生的气体通入盛有苯酚钠溶液的试管中,观察现象 探究乙酸、碳酸和苯酚的酸性强弱
C 向两支试管中各加入2 mL 0.1 mo
同课章节目录
