2025江苏版新教材化学高考第一轮基础练习--专题十三 盐类水解和沉淀溶解平衡(含答案)
文档属性
| 名称 | 2025江苏版新教材化学高考第一轮基础练习--专题十三 盐类水解和沉淀溶解平衡(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-16 16:09:15 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2025江苏版新教材化学高考第一轮
专题十三 盐类水解和沉淀溶解平衡
五年高考
考点过关练
考点1 盐类水解
1.★★(2021天津,10,3分)常温下,下列有关电解质溶液的叙述正确的是( )
A.在0.1 mol·L-1 H3PO4溶液中,c(H3PO4)>c(H2P)>c(HP)>c(P)
B.在0.1 mol·L-1 Na2C2O4溶液中,c(Na+)+c(H+)=c(OH-)+c(HC2)+c(C2)
C.在0.1 mol·L-1 NaHCO3溶液中,c(H2CO3)+c(HC)=0.1 mol·L-1
D.氨水和NH4Cl溶液混合,形成pH=9的溶液中,c(Cl-)>c(N)>c(OH-)>c(H+)
答案 A
2.★★(2022海南,13,4分)(双选)NaClO溶液具有漂白能力。已知25 ℃时,Ka(HClO)=4.0×10-8。下列关于NaClO溶液说法正确的是( )
A.0.01 mol·L-1溶液中,c(ClO-)<0.01 mol·L-1
B.长期露置在空气中,释放Cl2,漂白能力减弱
C.通入过量SO2,反应的离子方程式为SO2+ClO-+H2O HS+HClO
D.25 ℃,pH=7.0的NaClO和HClO的混合溶液中,c(HClO)>c(ClO-)=c(Na+)
答案 AD
3.★★(2022浙江6月选考,17,2分)25 ℃时,苯酚(C6H5OH)的Ka=1.0×10-10,下列说法正确的是 ( )
A.相同温度下,等pH的C6H5ONa和CH3COONa溶液中,c(C6H5O-)>c(CH3COO-)
B.将浓度均为0.10 mol·L-1的C6H5ONa和NaOH溶液加热,两种溶液的pH均变大
C.25 ℃时,C6H5OH溶液与NaOH溶液混合,测得pH=10.00,则此时溶液中c(C6H5O-)=c(C6H5OH)
D.25 ℃时,0.10 mol·L-1的C6H5OH溶液中加少量C6H5ONa固体,水的电离程度变小
答案 C
4.★★(2021北京,12,3分)下列实验中,均产生白色沉淀。
下列分析不正确的是( )
A.Na2CO3与NaHCO3溶液中所含微粒种类相同
B.CaCl2 能促进Na2CO3、NaHCO3水解
C.Al2(SO4)3能促进Na2CO3、NaHCO3水解
D.4个实验中,溶液滴入后,试管中溶液pH均降低
答案 B
5.★★(2021河北,6,3分)BiOCl是一种具有珍珠光泽的材料,利用金属Bi制备BiOCl的工艺流程如图:
下列说法错误的是( )
A.酸浸工序中分次加入稀HNO3可降低反应剧烈程度
B.转化工序中加入稀HCl可抑制生成BiONO3
C.水解工序中加入少量CH3COONa(s)可提高Bi3+水解程度
D.水解工序中加入少量NH4NO3(s)有利于BiOCl的生成
答案 D
6.★★(2021浙江6月选考,23,2分)取两份10 mL 0.05 mol·L-1的NaHCO3溶液,一份滴加0.05 mol·L-1的盐酸,另一份滴加0.05 mol·L-1 NaOH溶液,溶液的pH随加入酸(或碱)体积的变化如图。下列说法不正确的是( )
A.由a点可知:NaHCO3溶液中HC的水解程度大于电离程度
B.a→b→c过程中:c(HC)+2c(C)+c(OH-)逐渐减小
C.a→d→e过程中:c(Na+)D.令c点的c(Na+)+c(H+)=x,e点的c(Na+)+c(H+)=y,则x>y
答案 C
考点2 沉淀溶解平衡
7.★★(2021江苏,13,3分)室温下,用0.5 mol·L-1 Na2CO3溶液浸泡CaSO4粉末,一段时间后过滤,向滤渣中加稀醋酸,产生气泡。已知Ksp(CaSO4)=5×10-5,Ksp(CaCO3)=3×10-9。下列说法正确的是( )
A.0.5 mol·L-1 Na2CO3溶液中存在:c(OH-)=c(H+)+c(HC)+c(H2CO3)
B.反应CaSO4+CCaCO3+S正向进行,需满足>×104
C.过滤后所得清液中一定存在:c(Ca2+)=且c(Ca2+)≤
D.滤渣中加入稀醋酸发生反应的离子方程式:CaCO3+2H+ Ca2++CO2↑+H2O
答案 C
8.★★(2022海南,14,4分)(双选)某元素M的氢氧化物M(OH)2(s)在水中的溶解反应为:
M(OH)2(s) M2+(aq)+2OH-(aq)
M(OH)2(s)+2OH-(aq) M(OH(aq)
25 ℃,-lgc与pH的关系如图所示,c为M2+或M(OH 浓度的值。下列说法错误的是( )
A.曲线①代表-lgc(M2+)与pH的关系
B.M(OH)2的Ksp约为1×10-10
C.向c(M2+)=0.1 mol·L-1的溶液中加入NaOH溶液至pH=9.0,体系中元素M主要以M(OH)2(s)存在
D.向c[M(OH]=0.1 mol·L-1的溶液中加入等体积0.4 mol·L-1的HCl后,体系中元素M主要以M2+存在
答案 BD
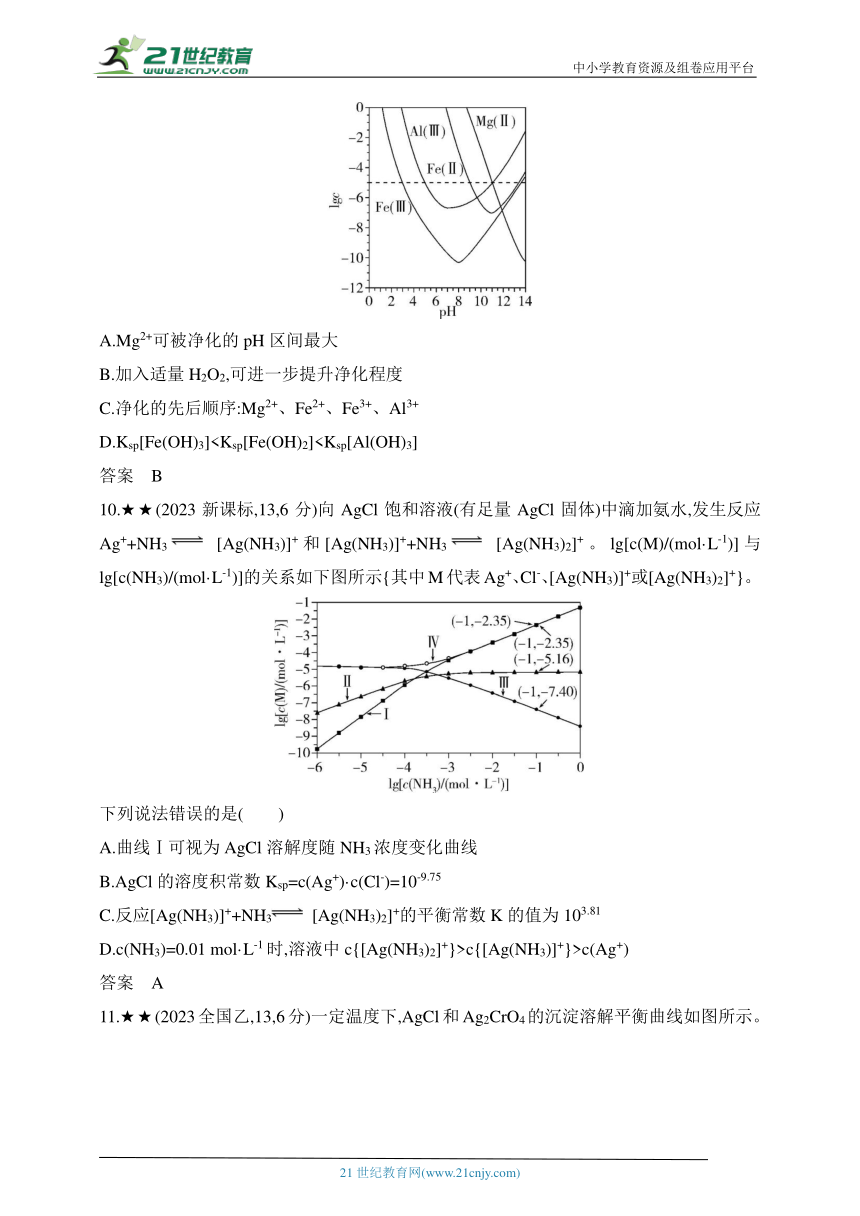
9.★★★(2022福建,7,4分)锂辉石是锂的重要来源,其焙烧后的酸性浸出液中含有Fe3+、Al3+、Fe2+和Mg2+杂质离子,可在0~14范围内调节pH对其净化(即相关离子浓度c<10-5 mol·L-1)。25 ℃时,lgc与pH关系见图[碱性过强时Fe(OH)3和Fe(OH)2会部分溶解]。下列说法正确的是( )
A.Mg2+可被净化的pH区间最大
B.加入适量H2O2,可进一步提升净化程度
C.净化的先后顺序:Mg2+、Fe2+、Fe3+、Al3+
D.Ksp[Fe(OH)3]答案 B
10.★★(2023新课标,13,6分)向AgCl饱和溶液(有足量AgCl固体)中滴加氨水,发生反应Ag++NH3 [Ag(NH3)]+和[Ag(NH3)]++NH3 [Ag(NH3)2]+。lg[c(M)/(mol·L-1)]与lg[c(NH3)/(mol·L-1)]的关系如下图所示{其中M代表Ag+、Cl-、[Ag(NH3)]+或[Ag(NH3)2]+}。
下列说法错误的是( )
A.曲线Ⅰ可视为AgCl溶解度随NH3浓度变化曲线
B.AgCl的溶度积常数Ksp=c(Ag+)·c(Cl-)=10-9.75
C.反应[Ag(NH3)]++NH3 [Ag(NH3)2]+的平衡常数K的值为103.81
D.c(NH3)=0.01 mol·L-1时,溶液中c{[Ag(NH3)2]+}>c{[Ag(NH3)]+}>c(Ag+)
答案 A
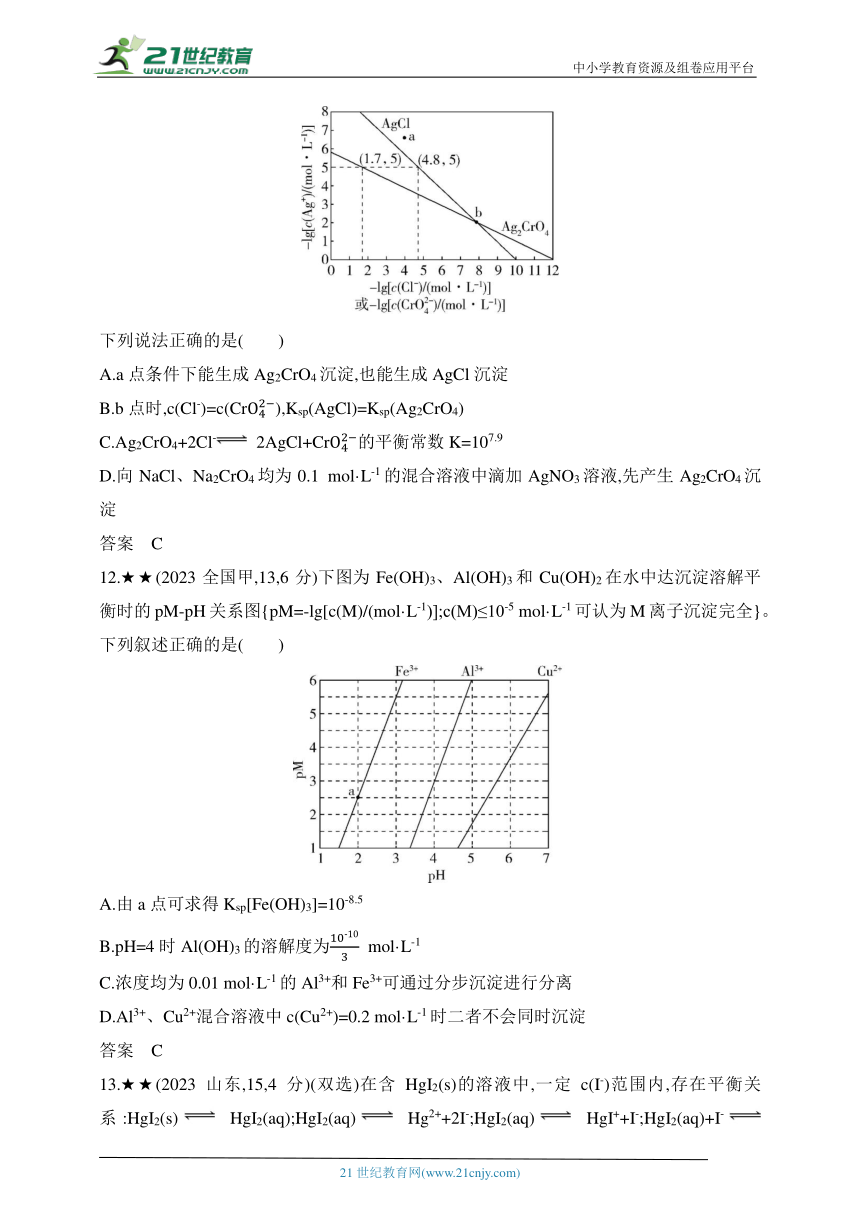
11.★★(2023全国乙,13,6分)一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。
下列说法正确的是( )
A.a点条件下能生成Ag2CrO4沉淀,也能生成AgCl沉淀
B.b点时,c(Cl-)=c(Cr),Ksp(AgCl)=Ksp(Ag2CrO4)
C.Ag2CrO4+2Cl- 2AgCl+Cr的平衡常数K=107.9
D.向NaCl、Na2CrO4均为0.1 mol·L-1的混合溶液中滴加AgNO3溶液,先产生Ag2CrO4沉淀
答案 C
12.★★(2023全国甲,13,6分)下图为Fe(OH)3、Al(OH)3和Cu(OH)2在水中达沉淀溶解平衡时的pM-pH关系图{pM=-lg[c(M)/(mol·L-1)];c(M)≤10-5 mol·L-1可认为M离子沉淀完全}。下列叙述正确的是( )
A.由a点可求得Ksp[Fe(OH)3]=10-8.5
B.pH=4时Al(OH)3的溶解度为 mol·L-1
C.浓度均为0.01 mol·L-1的Al3+和Fe3+可通过分步沉淀进行分离
D.Al3+、Cu2+混合溶液中c(Cu2+)=0.2 mol·L-1时二者不会同时沉淀
答案 C
13.★★(2023山东,15,4分)(双选)在含HgI2(s)的溶液中,一定c(I-)范围内,存在平衡关系:HgI2(s) HgI2(aq);HgI2(aq) Hg2++2I-;HgI2(aq) HgI++I-;HgI2(aq)+I- Hg;HgI2(aq)+2I- Hg,平衡常数依次为K0、K1、K2、K3、K4。已知lgc(Hg2+)、lgc(HgI+)、lgc(Hg)、lgc(Hg)随lgc(I-)的变化关系如图所示,下列说法错误的是( )
A.线L表示lgc(Hg)的变化情况
B.随c(I-)增大,c[HgI2(aq)]先增大后减小
C.a=lg
D.溶液中I与Hg的物质的量之比始终为2∶1
答案 BD
14.★★(2023辽宁,15,3分)某废水处理过程中始终保持H2S饱和,即c(H2S)=0.1 mol·L-1,通过调节pH使Ni2+和Cd2+形成硫化物而分离,体系中pH与-lgc关系如图所示,c为HS-、S2-、Ni2+和Cd2+的浓度,单位为mol·L-1。已知Ksp(NiS)>Ksp(CdS),下列说法正确的是( )
A.Ksp(CdS)=10-18.4
B.③为pH与-lgc(HS-)的关系曲线
C.(H2S)=10-8.1
D.(H2S)=10-14.7
答案 D
考法强化练
考法 溶液中微粒浓度关系及平衡常数分析
1.★★(2023江苏,12,3分)室温下,用含少量Mg2+的MnSO4溶液制备MnCO3的过程如图所示。已知Ksp(MgF2)=5.2×10-11,Ka(HF)=6.3×10-4。下列说法正确的是( )
A.0.1 mol·L-1 NaF溶液中:c(F-)=c(Na+)+c(H+)
B.“除镁”得到的上层清液中:c(Mg2+)=
C.0.1 mol·L-1 NaHCO3溶液中:c(C)=c(H+)+c(H2CO3)-c(OH-)
D.“沉锰”后的滤液中:c(Na+)+c(H+)=c(OH-)+c(HC)+2c(C)
答案 C
2.★★(2022重庆,11,3分)某小组模拟成垢—除垢过程如下。
100 mL 0.1 mol·L-1 CaCl2水溶液
……
忽略体积变化,且步骤②中反应完全。下列说法正确的是( )
A.经过步骤①,溶液中c(Ca2+)+c(Na+)=c(Cl-)
B.经过步骤②,溶液中c(Na+)=4c(S)
C.经过步骤②,溶液中c(Cl-)=c(C)+c(HC)+c(H2CO3)
D.经过步骤③,溶液中c(CH3COOH)+c(CH3COO-)=c(Cl-)
答案 D
3.★★(2023浙江6月选考,15,3分)草酸(H2C2O4)是二元弱酸。某小组做如下两组实验:
实验Ⅰ:往20 mL 0.1 mol·L-1 NaHC2O4溶液中滴加0.1 mol·L-1 NaOH溶液。
实验Ⅱ:往20 mL 0.10 mol·L-1 NaHC2O4溶液中滴加0.10 mol·L-1 CaCl2溶液。
[已知:H2C2O4的电离常数=5.4×10-2,=5.4×10-5,Ksp(CaC2O4)=2.4×10-9,溶液混合后体积变化忽略不计],下列说法正确的是( )
A.实验Ⅰ可选用甲基橙作指示剂,指示反应终点
B.实验Ⅰ中V(NaOH)=10 mL时,存在c(C2)C.实验Ⅱ中发生反应HC2+Ca2+ CaC2O4↓+H+
D.实验Ⅱ中V(CaCl2)=80 mL时,溶液中c(C2)=4.0×10-8 mol·L-1
答案 D
4.★★(2022江苏,12,3分)一种捕集烟气中CO2的过程如图所示。室温下以0.1 mol·L-1KOH溶液吸收CO2,若通入CO2所引起的溶液体积变化和H2O挥发可忽略,溶液中含碳物种的浓度c总=c(H2CO3)+c(HC)+c(C)。H2CO3电离常数分别为=4.4×10-7、=4.4×10-11。
下列说法正确的是( )
A.KOH吸收CO2所得到的溶液中:c(H2CO3)>c(HC )
B.KOH完全转化为K2CO3时,溶液中:c(OH-)=c(H+)+c(HC)+c(H2CO3)
C.KOH溶液吸收CO2,c总=0.1 mol·L-1溶液中:c(H2CO3)>c(C)
D.题图所示的“吸收”“转化”过程中,溶液的温度下降
答案 C
5.★★★(2020江苏,14,4分)(双选)室温下,将两种浓度均为0.10 mol·L-1的溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是 ( )
A.NaHCO3-Na2CO3混合溶液(pH=10.30):c(Na+)>c(HC)>c(C)>c(OH-)
B.氨水-NH4Cl混合溶液(pH=9.25):c(N)+c(H+)=c(NH3·H2O)+c(OH-)
C.CH3COOH-CH3COONa混合溶液(pH=4.76):c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)
D.H2C2O4-NaHC2O4混合溶液(pH=1.68,H2C2O4为二元弱酸):c(H+)+c(H2C2O4)=c(Na+)+c(C2)+c(OH-)
答案 AD
6.★★★(2019江苏,14,4分)(双选)室温下,反应HC+H2O H2CO3+OH-的平衡常数K=2.2×10-8。将NH4HCO3溶液和氨水按一定比例混合,可用于浸取废渣中的ZnO。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
A.0.2 mol·L-1氨水:c(NH3·H2O)>c(N)>c(OH-)>c(H+)
B.0.2 mol·L-1NH4HCO3溶液(pH>7):c(N)>c(HC)>c(H2CO3)>c(NH3·H2O)
C.0.2 mol·L-1氨水和0.2 mol·L-1NH4HCO3溶液等体积混合:c(N)+c(NH3·H2O)=c(H2CO3)+c(HC)+c(C)
D.0.6 mol·L-1氨水和0.2 mol·L-1NH4HCO3溶液等体积混合:c(NH3·H2O)+c(C)+c(OH-)=0.3 mol·L-1+c(H2CO3)+c(H+)
答案 BD
三年模拟
考点强化练
考点1 盐类水解
1.★★(2024届扬州高邮开学考,12)燃煤烟气中的CO2捕集可通过如图所示的物质转化实现。已知:(H2CO3)=4.5×10-7、(H2CO3)=4.7×10-11。下列说法正确的是( )
A.KOH吸收CO2所得到的溶液中:c(H2CO3)>c(HC)
B.KOH完全转化为KHCO3时,溶液中存在:(H2CO3)·(H2CO3)C.“吸收”后所得溶液中:c(K+)D.“转化”后得到的上层清液中:c(Ca2+)·c(C)答案 B
2.★★(2024届苏州期中,12)室温下,用0.1 mol·L-1Na2SO3溶液吸收废气中的SO2,并获得BaSO3的过程如图所示。忽略吸收废气所引起的溶液体积变化和H2O的挥发,溶液中含硫物种的浓度c总=c(H2SO3)+c(HS)+c(S)。已知:(H2SO3)=1.54×10-2,(H2SO3)=1.02×10-7。下列说法正确的是 ( )
A.0.1 mol·L-1 Na2SO3溶液吸收SO2至pH=7的溶液:c(HS)B.吸收SO2后c总=0.2 mol·L-1的溶液:c(H+)+c(S)=c(OH-)+c(H2SO3)
C.沉淀后的上层清液:c(Ba2+)>
D.沉淀后的上层清液久置:2c(Ba2+)+c(Na+)+c(H+)=c(OH-)+2c(S)+c(HS)
答案 A
3.★★(2023南京、盐城一模,12)一种吸收SO2再经氧化得到硫酸盐的过程如图所示。室温下,用0.1 mol·L-1NaOH溶液吸收SO2,若通入SO2所引起的溶液体积变化和H2O挥发可忽略,溶液中含硫物种的浓度c总=c(H2SO3)+c(HS)+c(S)。H2SO3的电离常数分别为=1.29×10-2、=6.24×10-8。下列说法正确的是( )
A.“吸收”应在较高的温度下进行
B.“吸收”所得溶液中:c(Na+)+c(H+)=c(HS)+c(S)+c(OH-)
C.“吸收”所得c总=0.1 mol·L-1溶液中:c(H2SO3)>c(S)
D.“氧化”调节溶液pH约为5,主要发生反应2HS+O2 2S+2H+
答案 D
4.★★(2023南京、盐城二模,11)用一定浓度NaOH溶液吸收H2S可制备Na2S或NaHS。若通入H2S所引起的溶液体积变化和H2O挥发可忽略,溶液中含硫物种的浓度c总=c(H2S)+c(HS-)+c(S2-)。室温下,H2S的电离常数分别为=1.1×10-7、=1.3×10-13。下列说法正确的是( )
A.Na2S溶液显碱性的原因:S2-+2H2O H2S+2OH-
B.NaOH恰好转化为Na2S的溶液中:c(OH-)=c(H+)+c(HS-)+c(S2-)
C.吸收所得c总=c(Na+)的溶液中:c(H2S)>c(S2-)
D.NaOH溶液吸收H2S过程中,溶液的温度下降
答案 C
5.★★(2023泰州期末,12)室温下,某兴趣小组通过下列实验制备少量NaHCO3并探究其性质。
实验1:测得100 mL 14 mol·L-1氨水的pH约为12。
实验2:向上述氨水中加NaCl粉末至饱和,通入足量CO2后析出晶体。
实验3:将所得混合物静置后过滤、洗涤、干燥,得到NaHCO3。
实验4:配制100 mL一定浓度的NaHCO3溶液,测得pH为8.0。
下列说法正确的是( )
A.依据实验1推测Kb(NH3·H2O)约为7×10-26
B.依据实验2推测溶解度:NaHCO3>NaCl
C.实验3所得滤液中:c(N)+c(H+)=c(Cl-)+c(OH-)
D.实验4的溶液中:c(H2CO3)-c(C)=9.9×10-7 mol·L-1
答案 D
考点2 沉淀溶解平衡
6.★★(2024届淮安开学考,12)室温下,用FeSO4溶液制备FeCO3的过程如图所示。已知:Kb(NH3·H2O)=1.8×10-5,(H2CO3)=4.5×10-7,(H2CO3)=4.7×10-11,Ksp[Fe(OH)2]=8.0×10-16,Ksp(FeCO3)=3.1×10-11。下列说法正确的是( )
A.0.1 mol·L-1 NH4HCO3溶液中:c(NH3·H2O)>c(H2CO3)
B.(NH4)2SO4溶液中:c(H+)=2c(NH3·H2O)+c(OH-)
C.制备FeCO3的离子方程式为Fe2++NH3·H2O+HC FeCO3↓+N+H2O
D.c(Fe2+)=0.08 mol·L-1时,应控制pH≤8
答案 C
7.★★★(2023如皋第一次适应性考试,12)水体中的重金属离子如Cu2+、Sn2+等可以转化为CuS、SnS沉淀除去。已知:室温下(H2S)=9×10-8,(H2S)=1×10-12。下列说法正确的是( )
A.0.1 mol·L-1 Na2S溶液中:c(OH-)=c(H2S)+c(HS-)+c(H+)
B.0.1 mol·L-1 NaHS溶液中:c(Na+)C.向10 mL 0.001 mol·L-1 CuSO4溶液中加入10 mL 0.001 mol·L-1 Na2S溶液,有沉淀析出。忽略混合时溶液体积的变化,说明Ksp(CuS)>2.5×10-7
D.室温时,向0.001 mol SnS粉末中加入10 mL 0.1 mol·L-1 CuSO4溶液,充分浸出后所得溶液中c(Cu2+)答案 D
8.★★★(2023连云港第一次调研,12)工业上利用反应SrSO4(s)+C(aq) SrCO3(s)+S(aq)生产SrCO3。现有含SrCO3(s)的0.1 mol·L-1 Na2CO3溶液和含SrSO4(s)的0.1 mol·L-1 Na2SO4溶液,在一定pH范围内,两种溶液中lg[c(Sr2+)]随pH的变化关系如图所示。下列说法正确的是( )
A.含有SrCO3(s)的0.1 mol·L-1 Na2CO3溶液中:c(Na+)+c(H+)=2c(C)+c(HC)+c(OH-)
B.①代表含SrCO3(s)的0.1 mol·L-1 Na2CO3溶液的变化曲线
C.若a=-6.5,则虚线可表示含SrSO4(s)的1.0 mol·L-1 Na2SO4溶液
D.对含SrSO4(s)且Na2SO4和Na2CO3初始浓度均为0.1 mol·L-1的混合溶液,pH≥7.7时才发生沉淀转化
答案 C
9.★★(2024届南京学情调研,14节选)MnSO4可用于制备多种物质。
25 ℃时,相关物质的Ksp见下表。
物质 Fe(OH)2 Fe(OH)3 Al(OH)3 Mn(OH)2
Ksp 8.0×10-16 3.0×10-39 1.0×10-33 1.0×10-13
由软锰矿粉(主要成分为MnO2,含少量Fe2O3、Al2O3、SiO2)制备MnSO4的过程可表示如下:
①浸取。保持温度、各物质投料量及浓度不变,能提高Mn2+浸出率的措施有 。
②沉淀。室温下,浸取后溶液中Mn2+浓度为0.1 mol·L-1,欲使溶液中Fe3+、Al3+的浓度均小于1.0×10-6 mol·L-1,则需加入MnO调节pH的范围为 。
③过滤。滤渣的主要成分有 。
答案 ①搅拌、延长反应时间 ②5~8 ③Fe(OH)3、Al(OH)3、SiO2
10.★★★(1)(2023南师附中一模,15节选)将1.8 mol PbSO4加到1 L含有0.12 mol/L H2C2O4的废水中,发生的离子反应为PbSO4(s)+H2C2O4(aq) PbC2O4(s)+2H+(aq)+S(aq),该反应的平衡常数K= 。
已知:25 ℃时,部分物质的相关信息如表所示:
Ksp(PbSO4) Ksp(PbC2O4) (H2C2O4) (H2C2O4)
2.0×10-8 5.0×10-10 6.0×10-2 6.25×10-5
(2)(2023南师附中江宁分校期末,17节选)三氯化六氨合钴[Co(NH3)6]Cl3是一种重要的化工原料。利用含钴废料(含少量Fe、Al等杂质)制取[Co(NH3)6]Cl3的工艺流程如图所示:
已知:a.“酸浸”过滤后的滤液中含有Co2+、Fe2+、Fe3+、Al3+等。
b.Ksp[Co(OH)2]=1×10-14.2、Ksp[Co(OH)3]=1×10-43.7、Ksp[Fe(OH)3]=1×10-37.4、Ksp[Al(OH)3]=1×10-32.9,溶液中金属离子物质的量浓度低于1.0×10-5 mol/L时,可认为沉淀完全。
c.[Co(NH3)6]2+具有较强还原性。
回答下列问题:
①Co2+的价电子排布式为 。
②“除杂”过程中加Na2CO3调节pH后会生成两种沉淀,同时得到含c(Co2+)=0.1 mol/L的滤液,调节pH的范围为 。
(3)(2023海安期末,16节选)钴及其化合物在工业生产中有着广阔的应用前景。
从锂钴废料(主要成分为LiCoO2)分离Co2+。
“净化”时,加NaF固体是将Li+转化为沉淀,“净化”后溶液中c(F-)=4.0×10-2 mol/L。若“过滤1”后溶液中Li+浓度为1.0 mol/L,则“净化”后c(Na+)= 。[溶液体积变化忽略不计,不考虑其他离子影响。25 ℃时Ksp(LiF)=2.0×10-3]
答案 (1)1.5×10-4 (2)①3d7 ②4.7~7.4 (3)0.99 mol/L
考法综合练
考法 溶液中微粒浓度关系及平衡常数分析
1.★★(2024届南通海安开学考,13)CuC2O4是一种重要的催化剂。以Na2C2O4为原料制备CuC2O4的反应方程式为Na2C2O4+CuSO4 CuC2O4↓+Na2SO4。已知室温下:(H2C2O4)=10-1.23、(H2C2O4)=10-4.27。下列说法正确的是( )
A.为确认C2已完全沉淀,将反应后的混合物静置,向上层清液中加CaCl2溶液,观察是否有沉淀产生
B.为获得纯度较高的CuC2O4,可向Na2C2O4溶液中滴加CuSO4溶液
C.0.1 mol/L Na2C2O4溶液中存在c(OH-)=c(H+)+c(H2C2O4)+c(HC2)
D.加水稀释一定浓度的NaHC2O4溶液,溶液中的值逐渐变大
答案 B
2.★★(2024届常州高级中学开学考,12)室温下,通过下列实验探究Na2CO3的性质。已知:25 ℃时,H2SO3的=1.4×10-2、=1.0×10-7,H2CO3的=4.3×10-7、=5.6×10-11。
实验1:配制50 mL 0.1 mol·L-1 Na2CO3溶液,测得溶液pH约为12;
实验2:取10 mL 0.1 mol·L-1 Na2CO3溶液,向其中加入一定量CaSO4固体充分搅拌,一段时间后过滤,向滤渣中加入足量稀盐酸,固体部分溶解;
实验3:取10 mL 0.1 mol·L-1 Na2CO3溶液,向其中缓慢滴入等体积0.1 mol·L-1稀盐酸。
下列说法正确的是( )
A.实验1所得溶液中,c(Na+)B.实验2加入稀盐酸后的上层清液中c(Ca2+)=c(S)
C.实验3反应后溶液中存在:c(Na+)=c(C)+c(HC)+c(H2CO3)
D.25 ℃时,反应C+H2SO3 HC+HS的平衡常数K=2.5×108
答案 D
3.★★★(2023南通、淮安等五市第一次调研,12)常温下,将FeSO4溶液与NH4HCO3溶液混合,可制得FeCO3,混合过程中有气体产生。已知:Kb(NH3·H2O)=1.8×10-5,(H2CO3)=4.5×10-7,(H2CO3)=4.7×10-11,Ksp(FeCO3)=3.13×10-11。下列说法不正确的是( )
A.向100 mL pH=10的氨水中通入少量CO2,反应后溶液中存在:c(C)>c(HC)
B.0.1 mol·L-1 NH4HCO3溶液中:c(H2CO3)>c(C)+c(NH3·H2O)
C.生成FeCO3的离子方程式为Fe2++2HC FeCO3↓+CO2↑+H2O
D.生成FeCO3沉淀后的上层清液中:c(Fe2+)·c(C)=Ksp(FeCO3)
答案 A
4.★★★(2023苏州期中调研,12)室温下,将H2C2O4溶液和NaOH溶液按一定比例混合,可用于测定溶液中钙的含量。
测定原理:①Ca2++C2 CaC2O4↓;②CaC2O4+H2SO4 CaSO4+H2C2O4;③用稀硫酸酸化的KMnO4溶液滴定②中H2C2O4。已知:室温下(H2C2O4)=5.90×10-2,(H2C2O4)=6.40×10-5,Ksp(CaC2O4)=2.34×10-9。下列说法正确的是( )
A.NaHC2O4溶液中:c(H2C2O4)B.NaOH完全转化为Na2C2O4时,溶液中:c(OH-)=c(H+)+c(HC2)+c(H2C2O4)
C.①中反应静置后的上层清液中:c(Ca2+)·c(C2)>Ksp(CaC2O4)
D.③发生反应的离子方程式:5C2+2Mn+16H+ 2Mn2++10CO2↑+8H2O
答案 A
专题十三 盐类水解和沉淀溶解平衡
五年高考
考点过关练
考点1 盐类水解
1.★★(2021天津,10,3分)常温下,下列有关电解质溶液的叙述正确的是( )
A.在0.1 mol·L-1 H3PO4溶液中,c(H3PO4)>c(H2P)>c(HP)>c(P)
B.在0.1 mol·L-1 Na2C2O4溶液中,c(Na+)+c(H+)=c(OH-)+c(HC2)+c(C2)
C.在0.1 mol·L-1 NaHCO3溶液中,c(H2CO3)+c(HC)=0.1 mol·L-1
D.氨水和NH4Cl溶液混合,形成pH=9的溶液中,c(Cl-)>c(N)>c(OH-)>c(H+)
答案 A
2.★★(2022海南,13,4分)(双选)NaClO溶液具有漂白能力。已知25 ℃时,Ka(HClO)=4.0×10-8。下列关于NaClO溶液说法正确的是( )
A.0.01 mol·L-1溶液中,c(ClO-)<0.01 mol·L-1
B.长期露置在空气中,释放Cl2,漂白能力减弱
C.通入过量SO2,反应的离子方程式为SO2+ClO-+H2O HS+HClO
D.25 ℃,pH=7.0的NaClO和HClO的混合溶液中,c(HClO)>c(ClO-)=c(Na+)
答案 AD
3.★★(2022浙江6月选考,17,2分)25 ℃时,苯酚(C6H5OH)的Ka=1.0×10-10,下列说法正确的是 ( )
A.相同温度下,等pH的C6H5ONa和CH3COONa溶液中,c(C6H5O-)>c(CH3COO-)
B.将浓度均为0.10 mol·L-1的C6H5ONa和NaOH溶液加热,两种溶液的pH均变大
C.25 ℃时,C6H5OH溶液与NaOH溶液混合,测得pH=10.00,则此时溶液中c(C6H5O-)=c(C6H5OH)
D.25 ℃时,0.10 mol·L-1的C6H5OH溶液中加少量C6H5ONa固体,水的电离程度变小
答案 C
4.★★(2021北京,12,3分)下列实验中,均产生白色沉淀。
下列分析不正确的是( )
A.Na2CO3与NaHCO3溶液中所含微粒种类相同
B.CaCl2 能促进Na2CO3、NaHCO3水解
C.Al2(SO4)3能促进Na2CO3、NaHCO3水解
D.4个实验中,溶液滴入后,试管中溶液pH均降低
答案 B
5.★★(2021河北,6,3分)BiOCl是一种具有珍珠光泽的材料,利用金属Bi制备BiOCl的工艺流程如图:
下列说法错误的是( )
A.酸浸工序中分次加入稀HNO3可降低反应剧烈程度
B.转化工序中加入稀HCl可抑制生成BiONO3
C.水解工序中加入少量CH3COONa(s)可提高Bi3+水解程度
D.水解工序中加入少量NH4NO3(s)有利于BiOCl的生成
答案 D
6.★★(2021浙江6月选考,23,2分)取两份10 mL 0.05 mol·L-1的NaHCO3溶液,一份滴加0.05 mol·L-1的盐酸,另一份滴加0.05 mol·L-1 NaOH溶液,溶液的pH随加入酸(或碱)体积的变化如图。下列说法不正确的是( )
A.由a点可知:NaHCO3溶液中HC的水解程度大于电离程度
B.a→b→c过程中:c(HC)+2c(C)+c(OH-)逐渐减小
C.a→d→e过程中:c(Na+)D.令c点的c(Na+)+c(H+)=x,e点的c(Na+)+c(H+)=y,则x>y
答案 C
考点2 沉淀溶解平衡
7.★★(2021江苏,13,3分)室温下,用0.5 mol·L-1 Na2CO3溶液浸泡CaSO4粉末,一段时间后过滤,向滤渣中加稀醋酸,产生气泡。已知Ksp(CaSO4)=5×10-5,Ksp(CaCO3)=3×10-9。下列说法正确的是( )
A.0.5 mol·L-1 Na2CO3溶液中存在:c(OH-)=c(H+)+c(HC)+c(H2CO3)
B.反应CaSO4+CCaCO3+S正向进行,需满足>×104
C.过滤后所得清液中一定存在:c(Ca2+)=且c(Ca2+)≤
D.滤渣中加入稀醋酸发生反应的离子方程式:CaCO3+2H+ Ca2++CO2↑+H2O
答案 C
8.★★(2022海南,14,4分)(双选)某元素M的氢氧化物M(OH)2(s)在水中的溶解反应为:
M(OH)2(s) M2+(aq)+2OH-(aq)
M(OH)2(s)+2OH-(aq) M(OH(aq)
25 ℃,-lgc与pH的关系如图所示,c为M2+或M(OH 浓度的值。下列说法错误的是( )
A.曲线①代表-lgc(M2+)与pH的关系
B.M(OH)2的Ksp约为1×10-10
C.向c(M2+)=0.1 mol·L-1的溶液中加入NaOH溶液至pH=9.0,体系中元素M主要以M(OH)2(s)存在
D.向c[M(OH]=0.1 mol·L-1的溶液中加入等体积0.4 mol·L-1的HCl后,体系中元素M主要以M2+存在
答案 BD
9.★★★(2022福建,7,4分)锂辉石是锂的重要来源,其焙烧后的酸性浸出液中含有Fe3+、Al3+、Fe2+和Mg2+杂质离子,可在0~14范围内调节pH对其净化(即相关离子浓度c<10-5 mol·L-1)。25 ℃时,lgc与pH关系见图[碱性过强时Fe(OH)3和Fe(OH)2会部分溶解]。下列说法正确的是( )
A.Mg2+可被净化的pH区间最大
B.加入适量H2O2,可进一步提升净化程度
C.净化的先后顺序:Mg2+、Fe2+、Fe3+、Al3+
D.Ksp[Fe(OH)3]答案 B
10.★★(2023新课标,13,6分)向AgCl饱和溶液(有足量AgCl固体)中滴加氨水,发生反应Ag++NH3 [Ag(NH3)]+和[Ag(NH3)]++NH3 [Ag(NH3)2]+。lg[c(M)/(mol·L-1)]与lg[c(NH3)/(mol·L-1)]的关系如下图所示{其中M代表Ag+、Cl-、[Ag(NH3)]+或[Ag(NH3)2]+}。
下列说法错误的是( )
A.曲线Ⅰ可视为AgCl溶解度随NH3浓度变化曲线
B.AgCl的溶度积常数Ksp=c(Ag+)·c(Cl-)=10-9.75
C.反应[Ag(NH3)]++NH3 [Ag(NH3)2]+的平衡常数K的值为103.81
D.c(NH3)=0.01 mol·L-1时,溶液中c{[Ag(NH3)2]+}>c{[Ag(NH3)]+}>c(Ag+)
答案 A
11.★★(2023全国乙,13,6分)一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。
下列说法正确的是( )
A.a点条件下能生成Ag2CrO4沉淀,也能生成AgCl沉淀
B.b点时,c(Cl-)=c(Cr),Ksp(AgCl)=Ksp(Ag2CrO4)
C.Ag2CrO4+2Cl- 2AgCl+Cr的平衡常数K=107.9
D.向NaCl、Na2CrO4均为0.1 mol·L-1的混合溶液中滴加AgNO3溶液,先产生Ag2CrO4沉淀
答案 C
12.★★(2023全国甲,13,6分)下图为Fe(OH)3、Al(OH)3和Cu(OH)2在水中达沉淀溶解平衡时的pM-pH关系图{pM=-lg[c(M)/(mol·L-1)];c(M)≤10-5 mol·L-1可认为M离子沉淀完全}。下列叙述正确的是( )
A.由a点可求得Ksp[Fe(OH)3]=10-8.5
B.pH=4时Al(OH)3的溶解度为 mol·L-1
C.浓度均为0.01 mol·L-1的Al3+和Fe3+可通过分步沉淀进行分离
D.Al3+、Cu2+混合溶液中c(Cu2+)=0.2 mol·L-1时二者不会同时沉淀
答案 C
13.★★(2023山东,15,4分)(双选)在含HgI2(s)的溶液中,一定c(I-)范围内,存在平衡关系:HgI2(s) HgI2(aq);HgI2(aq) Hg2++2I-;HgI2(aq) HgI++I-;HgI2(aq)+I- Hg;HgI2(aq)+2I- Hg,平衡常数依次为K0、K1、K2、K3、K4。已知lgc(Hg2+)、lgc(HgI+)、lgc(Hg)、lgc(Hg)随lgc(I-)的变化关系如图所示,下列说法错误的是( )
A.线L表示lgc(Hg)的变化情况
B.随c(I-)增大,c[HgI2(aq)]先增大后减小
C.a=lg
D.溶液中I与Hg的物质的量之比始终为2∶1
答案 BD
14.★★(2023辽宁,15,3分)某废水处理过程中始终保持H2S饱和,即c(H2S)=0.1 mol·L-1,通过调节pH使Ni2+和Cd2+形成硫化物而分离,体系中pH与-lgc关系如图所示,c为HS-、S2-、Ni2+和Cd2+的浓度,单位为mol·L-1。已知Ksp(NiS)>Ksp(CdS),下列说法正确的是( )
A.Ksp(CdS)=10-18.4
B.③为pH与-lgc(HS-)的关系曲线
C.(H2S)=10-8.1
D.(H2S)=10-14.7
答案 D
考法强化练
考法 溶液中微粒浓度关系及平衡常数分析
1.★★(2023江苏,12,3分)室温下,用含少量Mg2+的MnSO4溶液制备MnCO3的过程如图所示。已知Ksp(MgF2)=5.2×10-11,Ka(HF)=6.3×10-4。下列说法正确的是( )
A.0.1 mol·L-1 NaF溶液中:c(F-)=c(Na+)+c(H+)
B.“除镁”得到的上层清液中:c(Mg2+)=
C.0.1 mol·L-1 NaHCO3溶液中:c(C)=c(H+)+c(H2CO3)-c(OH-)
D.“沉锰”后的滤液中:c(Na+)+c(H+)=c(OH-)+c(HC)+2c(C)
答案 C
2.★★(2022重庆,11,3分)某小组模拟成垢—除垢过程如下。
100 mL 0.1 mol·L-1 CaCl2水溶液
……
忽略体积变化,且步骤②中反应完全。下列说法正确的是( )
A.经过步骤①,溶液中c(Ca2+)+c(Na+)=c(Cl-)
B.经过步骤②,溶液中c(Na+)=4c(S)
C.经过步骤②,溶液中c(Cl-)=c(C)+c(HC)+c(H2CO3)
D.经过步骤③,溶液中c(CH3COOH)+c(CH3COO-)=c(Cl-)
答案 D
3.★★(2023浙江6月选考,15,3分)草酸(H2C2O4)是二元弱酸。某小组做如下两组实验:
实验Ⅰ:往20 mL 0.1 mol·L-1 NaHC2O4溶液中滴加0.1 mol·L-1 NaOH溶液。
实验Ⅱ:往20 mL 0.10 mol·L-1 NaHC2O4溶液中滴加0.10 mol·L-1 CaCl2溶液。
[已知:H2C2O4的电离常数=5.4×10-2,=5.4×10-5,Ksp(CaC2O4)=2.4×10-9,溶液混合后体积变化忽略不计],下列说法正确的是( )
A.实验Ⅰ可选用甲基橙作指示剂,指示反应终点
B.实验Ⅰ中V(NaOH)=10 mL时,存在c(C2)C.实验Ⅱ中发生反应HC2+Ca2+ CaC2O4↓+H+
D.实验Ⅱ中V(CaCl2)=80 mL时,溶液中c(C2)=4.0×10-8 mol·L-1
答案 D
4.★★(2022江苏,12,3分)一种捕集烟气中CO2的过程如图所示。室温下以0.1 mol·L-1KOH溶液吸收CO2,若通入CO2所引起的溶液体积变化和H2O挥发可忽略,溶液中含碳物种的浓度c总=c(H2CO3)+c(HC)+c(C)。H2CO3电离常数分别为=4.4×10-7、=4.4×10-11。
下列说法正确的是( )
A.KOH吸收CO2所得到的溶液中:c(H2CO3)>c(HC )
B.KOH完全转化为K2CO3时,溶液中:c(OH-)=c(H+)+c(HC)+c(H2CO3)
C.KOH溶液吸收CO2,c总=0.1 mol·L-1溶液中:c(H2CO3)>c(C)
D.题图所示的“吸收”“转化”过程中,溶液的温度下降
答案 C
5.★★★(2020江苏,14,4分)(双选)室温下,将两种浓度均为0.10 mol·L-1的溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是 ( )
A.NaHCO3-Na2CO3混合溶液(pH=10.30):c(Na+)>c(HC)>c(C)>c(OH-)
B.氨水-NH4Cl混合溶液(pH=9.25):c(N)+c(H+)=c(NH3·H2O)+c(OH-)
C.CH3COOH-CH3COONa混合溶液(pH=4.76):c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)
D.H2C2O4-NaHC2O4混合溶液(pH=1.68,H2C2O4为二元弱酸):c(H+)+c(H2C2O4)=c(Na+)+c(C2)+c(OH-)
答案 AD
6.★★★(2019江苏,14,4分)(双选)室温下,反应HC+H2O H2CO3+OH-的平衡常数K=2.2×10-8。将NH4HCO3溶液和氨水按一定比例混合,可用于浸取废渣中的ZnO。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
A.0.2 mol·L-1氨水:c(NH3·H2O)>c(N)>c(OH-)>c(H+)
B.0.2 mol·L-1NH4HCO3溶液(pH>7):c(N)>c(HC)>c(H2CO3)>c(NH3·H2O)
C.0.2 mol·L-1氨水和0.2 mol·L-1NH4HCO3溶液等体积混合:c(N)+c(NH3·H2O)=c(H2CO3)+c(HC)+c(C)
D.0.6 mol·L-1氨水和0.2 mol·L-1NH4HCO3溶液等体积混合:c(NH3·H2O)+c(C)+c(OH-)=0.3 mol·L-1+c(H2CO3)+c(H+)
答案 BD
三年模拟
考点强化练
考点1 盐类水解
1.★★(2024届扬州高邮开学考,12)燃煤烟气中的CO2捕集可通过如图所示的物质转化实现。已知:(H2CO3)=4.5×10-7、(H2CO3)=4.7×10-11。下列说法正确的是( )
A.KOH吸收CO2所得到的溶液中:c(H2CO3)>c(HC)
B.KOH完全转化为KHCO3时,溶液中存在:(H2CO3)·(H2CO3)C.“吸收”后所得溶液中:c(K+)D.“转化”后得到的上层清液中:c(Ca2+)·c(C)答案 B
2.★★(2024届苏州期中,12)室温下,用0.1 mol·L-1Na2SO3溶液吸收废气中的SO2,并获得BaSO3的过程如图所示。忽略吸收废气所引起的溶液体积变化和H2O的挥发,溶液中含硫物种的浓度c总=c(H2SO3)+c(HS)+c(S)。已知:(H2SO3)=1.54×10-2,(H2SO3)=1.02×10-7。下列说法正确的是 ( )
A.0.1 mol·L-1 Na2SO3溶液吸收SO2至pH=7的溶液:c(HS)B.吸收SO2后c总=0.2 mol·L-1的溶液:c(H+)+c(S)=c(OH-)+c(H2SO3)
C.沉淀后的上层清液:c(Ba2+)>
D.沉淀后的上层清液久置:2c(Ba2+)+c(Na+)+c(H+)=c(OH-)+2c(S)+c(HS)
答案 A
3.★★(2023南京、盐城一模,12)一种吸收SO2再经氧化得到硫酸盐的过程如图所示。室温下,用0.1 mol·L-1NaOH溶液吸收SO2,若通入SO2所引起的溶液体积变化和H2O挥发可忽略,溶液中含硫物种的浓度c总=c(H2SO3)+c(HS)+c(S)。H2SO3的电离常数分别为=1.29×10-2、=6.24×10-8。下列说法正确的是( )
A.“吸收”应在较高的温度下进行
B.“吸收”所得溶液中:c(Na+)+c(H+)=c(HS)+c(S)+c(OH-)
C.“吸收”所得c总=0.1 mol·L-1溶液中:c(H2SO3)>c(S)
D.“氧化”调节溶液pH约为5,主要发生反应2HS+O2 2S+2H+
答案 D
4.★★(2023南京、盐城二模,11)用一定浓度NaOH溶液吸收H2S可制备Na2S或NaHS。若通入H2S所引起的溶液体积变化和H2O挥发可忽略,溶液中含硫物种的浓度c总=c(H2S)+c(HS-)+c(S2-)。室温下,H2S的电离常数分别为=1.1×10-7、=1.3×10-13。下列说法正确的是( )
A.Na2S溶液显碱性的原因:S2-+2H2O H2S+2OH-
B.NaOH恰好转化为Na2S的溶液中:c(OH-)=c(H+)+c(HS-)+c(S2-)
C.吸收所得c总=c(Na+)的溶液中:c(H2S)>c(S2-)
D.NaOH溶液吸收H2S过程中,溶液的温度下降
答案 C
5.★★(2023泰州期末,12)室温下,某兴趣小组通过下列实验制备少量NaHCO3并探究其性质。
实验1:测得100 mL 14 mol·L-1氨水的pH约为12。
实验2:向上述氨水中加NaCl粉末至饱和,通入足量CO2后析出晶体。
实验3:将所得混合物静置后过滤、洗涤、干燥,得到NaHCO3。
实验4:配制100 mL一定浓度的NaHCO3溶液,测得pH为8.0。
下列说法正确的是( )
A.依据实验1推测Kb(NH3·H2O)约为7×10-26
B.依据实验2推测溶解度:NaHCO3>NaCl
C.实验3所得滤液中:c(N)+c(H+)=c(Cl-)+c(OH-)
D.实验4的溶液中:c(H2CO3)-c(C)=9.9×10-7 mol·L-1
答案 D
考点2 沉淀溶解平衡
6.★★(2024届淮安开学考,12)室温下,用FeSO4溶液制备FeCO3的过程如图所示。已知:Kb(NH3·H2O)=1.8×10-5,(H2CO3)=4.5×10-7,(H2CO3)=4.7×10-11,Ksp[Fe(OH)2]=8.0×10-16,Ksp(FeCO3)=3.1×10-11。下列说法正确的是( )
A.0.1 mol·L-1 NH4HCO3溶液中:c(NH3·H2O)>c(H2CO3)
B.(NH4)2SO4溶液中:c(H+)=2c(NH3·H2O)+c(OH-)
C.制备FeCO3的离子方程式为Fe2++NH3·H2O+HC FeCO3↓+N+H2O
D.c(Fe2+)=0.08 mol·L-1时,应控制pH≤8
答案 C
7.★★★(2023如皋第一次适应性考试,12)水体中的重金属离子如Cu2+、Sn2+等可以转化为CuS、SnS沉淀除去。已知:室温下(H2S)=9×10-8,(H2S)=1×10-12。下列说法正确的是( )
A.0.1 mol·L-1 Na2S溶液中:c(OH-)=c(H2S)+c(HS-)+c(H+)
B.0.1 mol·L-1 NaHS溶液中:c(Na+)C.向10 mL 0.001 mol·L-1 CuSO4溶液中加入10 mL 0.001 mol·L-1 Na2S溶液,有沉淀析出。忽略混合时溶液体积的变化,说明Ksp(CuS)>2.5×10-7
D.室温时,向0.001 mol SnS粉末中加入10 mL 0.1 mol·L-1 CuSO4溶液,充分浸出后所得溶液中c(Cu2+)答案 D
8.★★★(2023连云港第一次调研,12)工业上利用反应SrSO4(s)+C(aq) SrCO3(s)+S(aq)生产SrCO3。现有含SrCO3(s)的0.1 mol·L-1 Na2CO3溶液和含SrSO4(s)的0.1 mol·L-1 Na2SO4溶液,在一定pH范围内,两种溶液中lg[c(Sr2+)]随pH的变化关系如图所示。下列说法正确的是( )
A.含有SrCO3(s)的0.1 mol·L-1 Na2CO3溶液中:c(Na+)+c(H+)=2c(C)+c(HC)+c(OH-)
B.①代表含SrCO3(s)的0.1 mol·L-1 Na2CO3溶液的变化曲线
C.若a=-6.5,则虚线可表示含SrSO4(s)的1.0 mol·L-1 Na2SO4溶液
D.对含SrSO4(s)且Na2SO4和Na2CO3初始浓度均为0.1 mol·L-1的混合溶液,pH≥7.7时才发生沉淀转化
答案 C
9.★★(2024届南京学情调研,14节选)MnSO4可用于制备多种物质。
25 ℃时,相关物质的Ksp见下表。
物质 Fe(OH)2 Fe(OH)3 Al(OH)3 Mn(OH)2
Ksp 8.0×10-16 3.0×10-39 1.0×10-33 1.0×10-13
由软锰矿粉(主要成分为MnO2,含少量Fe2O3、Al2O3、SiO2)制备MnSO4的过程可表示如下:
①浸取。保持温度、各物质投料量及浓度不变,能提高Mn2+浸出率的措施有 。
②沉淀。室温下,浸取后溶液中Mn2+浓度为0.1 mol·L-1,欲使溶液中Fe3+、Al3+的浓度均小于1.0×10-6 mol·L-1,则需加入MnO调节pH的范围为 。
③过滤。滤渣的主要成分有 。
答案 ①搅拌、延长反应时间 ②5~8 ③Fe(OH)3、Al(OH)3、SiO2
10.★★★(1)(2023南师附中一模,15节选)将1.8 mol PbSO4加到1 L含有0.12 mol/L H2C2O4的废水中,发生的离子反应为PbSO4(s)+H2C2O4(aq) PbC2O4(s)+2H+(aq)+S(aq),该反应的平衡常数K= 。
已知:25 ℃时,部分物质的相关信息如表所示:
Ksp(PbSO4) Ksp(PbC2O4) (H2C2O4) (H2C2O4)
2.0×10-8 5.0×10-10 6.0×10-2 6.25×10-5
(2)(2023南师附中江宁分校期末,17节选)三氯化六氨合钴[Co(NH3)6]Cl3是一种重要的化工原料。利用含钴废料(含少量Fe、Al等杂质)制取[Co(NH3)6]Cl3的工艺流程如图所示:
已知:a.“酸浸”过滤后的滤液中含有Co2+、Fe2+、Fe3+、Al3+等。
b.Ksp[Co(OH)2]=1×10-14.2、Ksp[Co(OH)3]=1×10-43.7、Ksp[Fe(OH)3]=1×10-37.4、Ksp[Al(OH)3]=1×10-32.9,溶液中金属离子物质的量浓度低于1.0×10-5 mol/L时,可认为沉淀完全。
c.[Co(NH3)6]2+具有较强还原性。
回答下列问题:
①Co2+的价电子排布式为 。
②“除杂”过程中加Na2CO3调节pH后会生成两种沉淀,同时得到含c(Co2+)=0.1 mol/L的滤液,调节pH的范围为 。
(3)(2023海安期末,16节选)钴及其化合物在工业生产中有着广阔的应用前景。
从锂钴废料(主要成分为LiCoO2)分离Co2+。
“净化”时,加NaF固体是将Li+转化为沉淀,“净化”后溶液中c(F-)=4.0×10-2 mol/L。若“过滤1”后溶液中Li+浓度为1.0 mol/L,则“净化”后c(Na+)= 。[溶液体积变化忽略不计,不考虑其他离子影响。25 ℃时Ksp(LiF)=2.0×10-3]
答案 (1)1.5×10-4 (2)①3d7 ②4.7~7.4 (3)0.99 mol/L
考法综合练
考法 溶液中微粒浓度关系及平衡常数分析
1.★★(2024届南通海安开学考,13)CuC2O4是一种重要的催化剂。以Na2C2O4为原料制备CuC2O4的反应方程式为Na2C2O4+CuSO4 CuC2O4↓+Na2SO4。已知室温下:(H2C2O4)=10-1.23、(H2C2O4)=10-4.27。下列说法正确的是( )
A.为确认C2已完全沉淀,将反应后的混合物静置,向上层清液中加CaCl2溶液,观察是否有沉淀产生
B.为获得纯度较高的CuC2O4,可向Na2C2O4溶液中滴加CuSO4溶液
C.0.1 mol/L Na2C2O4溶液中存在c(OH-)=c(H+)+c(H2C2O4)+c(HC2)
D.加水稀释一定浓度的NaHC2O4溶液,溶液中的值逐渐变大
答案 B
2.★★(2024届常州高级中学开学考,12)室温下,通过下列实验探究Na2CO3的性质。已知:25 ℃时,H2SO3的=1.4×10-2、=1.0×10-7,H2CO3的=4.3×10-7、=5.6×10-11。
实验1:配制50 mL 0.1 mol·L-1 Na2CO3溶液,测得溶液pH约为12;
实验2:取10 mL 0.1 mol·L-1 Na2CO3溶液,向其中加入一定量CaSO4固体充分搅拌,一段时间后过滤,向滤渣中加入足量稀盐酸,固体部分溶解;
实验3:取10 mL 0.1 mol·L-1 Na2CO3溶液,向其中缓慢滴入等体积0.1 mol·L-1稀盐酸。
下列说法正确的是( )
A.实验1所得溶液中,c(Na+)B.实验2加入稀盐酸后的上层清液中c(Ca2+)=c(S)
C.实验3反应后溶液中存在:c(Na+)=c(C)+c(HC)+c(H2CO3)
D.25 ℃时,反应C+H2SO3 HC+HS的平衡常数K=2.5×108
答案 D
3.★★★(2023南通、淮安等五市第一次调研,12)常温下,将FeSO4溶液与NH4HCO3溶液混合,可制得FeCO3,混合过程中有气体产生。已知:Kb(NH3·H2O)=1.8×10-5,(H2CO3)=4.5×10-7,(H2CO3)=4.7×10-11,Ksp(FeCO3)=3.13×10-11。下列说法不正确的是( )
A.向100 mL pH=10的氨水中通入少量CO2,反应后溶液中存在:c(C)>c(HC)
B.0.1 mol·L-1 NH4HCO3溶液中:c(H2CO3)>c(C)+c(NH3·H2O)
C.生成FeCO3的离子方程式为Fe2++2HC FeCO3↓+CO2↑+H2O
D.生成FeCO3沉淀后的上层清液中:c(Fe2+)·c(C)=Ksp(FeCO3)
答案 A
4.★★★(2023苏州期中调研,12)室温下,将H2C2O4溶液和NaOH溶液按一定比例混合,可用于测定溶液中钙的含量。
测定原理:①Ca2++C2 CaC2O4↓;②CaC2O4+H2SO4 CaSO4+H2C2O4;③用稀硫酸酸化的KMnO4溶液滴定②中H2C2O4。已知:室温下(H2C2O4)=5.90×10-2,(H2C2O4)=6.40×10-5,Ksp(CaC2O4)=2.34×10-9。下列说法正确的是( )
A.NaHC2O4溶液中:c(H2C2O4)B.NaOH完全转化为Na2C2O4时,溶液中:c(OH-)=c(H+)+c(HC2)+c(H2C2O4)
C.①中反应静置后的上层清液中:c(Ca2+)·c(C2)>Ksp(CaC2O4)
D.③发生反应的离子方程式:5C2+2Mn+16H+ 2Mn2++10CO2↑+8H2O
答案 A
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025江苏版新教材化学高考第一轮
专题十三 盐类水解和沉淀溶解平衡
五年高考
考点过关练
考点1 盐类水解
1.★★(2021天津,10,3分)常温下,下列有关电解质溶液的叙述正确的是( )
A.在0.1 mol·L-1 H3PO4溶液中,c(H3PO4)>c(H2P)>c(HP)>c(P)
B.在0.1 mol·L-1 Na2C2O4溶液中,c(Na+)+c(H+)=c(OH-)+c(HC2)+c(C2)
C.在0.1 mol·L-1 NaHCO3溶液中,c(H2CO3)+c(HC)=0.1 mol·L-1
D.氨水和NH4Cl溶液混合,形成pH=9的溶液中,c(Cl-)>c(N)>c(OH-)>c(H+)
答案 A
2.★★(2022海南,13,4分)(双选)NaClO溶液具有漂白能力。已知25 ℃时,Ka(HClO)=4.0×10-8。下列关于NaClO溶液说法正确的是( )
A.0.01 mol·L-1溶液中,c(ClO-)<0.01 mol·L-1
B.长期露置在空气中,释放Cl2,漂白能力减弱
C.通入过量SO2,反应的离子方程式为SO2+ClO-+H2O HS+HClO
D.25 ℃,pH=7.0的NaClO和HClO的混合溶液中,c(HClO)>c(ClO-)=c(Na+)
答案 AD
3.★★(2022浙江6月选考,17,2分)25 ℃时,苯酚(C6H5OH)的Ka=1.0×10-10,下列说法正确的是 ( )
A.相同温度下,等pH的C6H5ONa和CH3COONa溶液中,c(C6H5O-)>c(CH3COO-)
B.将浓度均为0.10 mol·L-1的C6H5ONa和NaOH溶液加热,两种溶液的pH均变大
C.25 ℃时,C6H5OH溶液与NaOH溶液混合,测得pH=10.00,则此时溶液中c(C6H5O-)=c(C6H5OH)
D.25 ℃时,0.10 mol·L-1的C6H5OH溶液中加少量C6H5ONa固体,水的电离程度变小
答案 C
4.★★(2021北京,12,3分)下列实验中,均产生白色沉淀。
下列分析不正确的是( )
A.Na2CO3与NaHCO3溶液中所含微粒种类相同
B.CaCl2 能促进Na2CO3、NaHCO3水解
C.Al2(SO4)3能促进Na2CO3、NaHCO3水解
D.4个实验中,溶液滴入后,试管中溶液pH均降低
答案 B
5.★★(2021河北,6,3分)BiOCl是一种具有珍珠光泽的材料,利用金属Bi制备BiOCl的工艺流程如图:
下列说法错误的是( )
A.酸浸工序中分次加入稀HNO3可降低反应剧烈程度
B.转化工序中加入稀HCl可抑制生成BiONO3
C.水解工序中加入少量CH3COONa(s)可提高Bi3+水解程度
D.水解工序中加入少量NH4NO3(s)有利于BiOCl的生成
答案 D
6.★★(2021浙江6月选考,23,2分)取两份10 mL 0.05 mol·L-1的NaHCO3溶液,一份滴加0.05 mol·L-1的盐酸,另一份滴加0.05 mol·L-1 NaOH溶液,溶液的pH随加入酸(或碱)体积的变化如图。下列说法不正确的是( )
A.由a点可知:NaHCO3溶液中HC的水解程度大于电离程度
B.a→b→c过程中:c(HC)+2c(C)+c(OH-)逐渐减小
C.a→d→e过程中:c(Na+)
答案 C
考点2 沉淀溶解平衡
7.★★(2021江苏,13,3分)室温下,用0.5 mol·L-1 Na2CO3溶液浸泡CaSO4粉末,一段时间后过滤,向滤渣中加稀醋酸,产生气泡。已知Ksp(CaSO4)=5×10-5,Ksp(CaCO3)=3×10-9。下列说法正确的是( )
A.0.5 mol·L-1 Na2CO3溶液中存在:c(OH-)=c(H+)+c(HC)+c(H2CO3)
B.反应CaSO4+CCaCO3+S正向进行,需满足>×104
C.过滤后所得清液中一定存在:c(Ca2+)=且c(Ca2+)≤
D.滤渣中加入稀醋酸发生反应的离子方程式:CaCO3+2H+ Ca2++CO2↑+H2O
答案 C
8.★★(2022海南,14,4分)(双选)某元素M的氢氧化物M(OH)2(s)在水中的溶解反应为:
M(OH)2(s) M2+(aq)+2OH-(aq)
M(OH)2(s)+2OH-(aq) M(OH(aq)
25 ℃,-lgc与pH的关系如图所示,c为M2+或M(OH 浓度的值。下列说法错误的是( )
A.曲线①代表-lgc(M2+)与pH的关系
B.M(OH)2的Ksp约为1×10-10
C.向c(M2+)=0.1 mol·L-1的溶液中加入NaOH溶液至pH=9.0,体系中元素M主要以M(OH)2(s)存在
D.向c[M(OH]=0.1 mol·L-1的溶液中加入等体积0.4 mol·L-1的HCl后,体系中元素M主要以M2+存在
答案 BD
9.★★★(2022福建,7,4分)锂辉石是锂的重要来源,其焙烧后的酸性浸出液中含有Fe3+、Al3+、Fe2+和Mg2+杂质离子,可在0~14范围内调节pH对其净化(即相关离子浓度c<10-5 mol·L-1)。25 ℃时,lgc与pH关系见图[碱性过强时Fe(OH)3和Fe(OH)2会部分溶解]。下列说法正确的是( )
A.Mg2+可被净化的pH区间最大
B.加入适量H2O2,可进一步提升净化程度
C.净化的先后顺序:Mg2+、Fe2+、Fe3+、Al3+
D.Ksp[Fe(OH)3]
10.★★(2023新课标,13,6分)向AgCl饱和溶液(有足量AgCl固体)中滴加氨水,发生反应Ag++NH3 [Ag(NH3)]+和[Ag(NH3)]++NH3 [Ag(NH3)2]+。lg[c(M)/(mol·L-1)]与lg[c(NH3)/(mol·L-1)]的关系如下图所示{其中M代表Ag+、Cl-、[Ag(NH3)]+或[Ag(NH3)2]+}。
下列说法错误的是( )
A.曲线Ⅰ可视为AgCl溶解度随NH3浓度变化曲线
B.AgCl的溶度积常数Ksp=c(Ag+)·c(Cl-)=10-9.75
C.反应[Ag(NH3)]++NH3 [Ag(NH3)2]+的平衡常数K的值为103.81
D.c(NH3)=0.01 mol·L-1时,溶液中c{[Ag(NH3)2]+}>c{[Ag(NH3)]+}>c(Ag+)
答案 A
11.★★(2023全国乙,13,6分)一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。
下列说法正确的是( )
A.a点条件下能生成Ag2CrO4沉淀,也能生成AgCl沉淀
B.b点时,c(Cl-)=c(Cr),Ksp(AgCl)=Ksp(Ag2CrO4)
C.Ag2CrO4+2Cl- 2AgCl+Cr的平衡常数K=107.9
D.向NaCl、Na2CrO4均为0.1 mol·L-1的混合溶液中滴加AgNO3溶液,先产生Ag2CrO4沉淀
答案 C
12.★★(2023全国甲,13,6分)下图为Fe(OH)3、Al(OH)3和Cu(OH)2在水中达沉淀溶解平衡时的pM-pH关系图{pM=-lg[c(M)/(mol·L-1)];c(M)≤10-5 mol·L-1可认为M离子沉淀完全}。下列叙述正确的是( )
A.由a点可求得Ksp[Fe(OH)3]=10-8.5
B.pH=4时Al(OH)3的溶解度为 mol·L-1
C.浓度均为0.01 mol·L-1的Al3+和Fe3+可通过分步沉淀进行分离
D.Al3+、Cu2+混合溶液中c(Cu2+)=0.2 mol·L-1时二者不会同时沉淀
答案 C
13.★★(2023山东,15,4分)(双选)在含HgI2(s)的溶液中,一定c(I-)范围内,存在平衡关系:HgI2(s) HgI2(aq);HgI2(aq) Hg2++2I-;HgI2(aq) HgI++I-;HgI2(aq)+I- Hg;HgI2(aq)+2I- Hg,平衡常数依次为K0、K1、K2、K3、K4。已知lgc(Hg2+)、lgc(HgI+)、lgc(Hg)、lgc(Hg)随lgc(I-)的变化关系如图所示,下列说法错误的是( )
A.线L表示lgc(Hg)的变化情况
B.随c(I-)增大,c[HgI2(aq)]先增大后减小
C.a=lg
D.溶液中I与Hg的物质的量之比始终为2∶1
答案 BD
14.★★(2023辽宁,15,3分)某废水处理过程中始终保持H2S饱和,即c(H2S)=0.1 mol·L-1,通过调节pH使Ni2+和Cd2+形成硫化物而分离,体系中pH与-lgc关系如图所示,c为HS-、S2-、Ni2+和Cd2+的浓度,单位为mol·L-1。已知Ksp(NiS)>Ksp(CdS),下列说法正确的是( )
A.Ksp(CdS)=10-18.4
B.③为pH与-lgc(HS-)的关系曲线
C.(H2S)=10-8.1
D.(H2S)=10-14.7
答案 D
考法强化练
考法 溶液中微粒浓度关系及平衡常数分析
1.★★(2023江苏,12,3分)室温下,用含少量Mg2+的MnSO4溶液制备MnCO3的过程如图所示。已知Ksp(MgF2)=5.2×10-11,Ka(HF)=6.3×10-4。下列说法正确的是( )
A.0.1 mol·L-1 NaF溶液中:c(F-)=c(Na+)+c(H+)
B.“除镁”得到的上层清液中:c(Mg2+)=
C.0.1 mol·L-1 NaHCO3溶液中:c(C)=c(H+)+c(H2CO3)-c(OH-)
D.“沉锰”后的滤液中:c(Na+)+c(H+)=c(OH-)+c(HC)+2c(C)
答案 C
2.★★(2022重庆,11,3分)某小组模拟成垢—除垢过程如下。
100 mL 0.1 mol·L-1 CaCl2水溶液
……
忽略体积变化,且步骤②中反应完全。下列说法正确的是( )
A.经过步骤①,溶液中c(Ca2+)+c(Na+)=c(Cl-)
B.经过步骤②,溶液中c(Na+)=4c(S)
C.经过步骤②,溶液中c(Cl-)=c(C)+c(HC)+c(H2CO3)
D.经过步骤③,溶液中c(CH3COOH)+c(CH3COO-)=c(Cl-)
答案 D
3.★★(2023浙江6月选考,15,3分)草酸(H2C2O4)是二元弱酸。某小组做如下两组实验:
实验Ⅰ:往20 mL 0.1 mol·L-1 NaHC2O4溶液中滴加0.1 mol·L-1 NaOH溶液。
实验Ⅱ:往20 mL 0.10 mol·L-1 NaHC2O4溶液中滴加0.10 mol·L-1 CaCl2溶液。
[已知:H2C2O4的电离常数=5.4×10-2,=5.4×10-5,Ksp(CaC2O4)=2.4×10-9,溶液混合后体积变化忽略不计],下列说法正确的是( )
A.实验Ⅰ可选用甲基橙作指示剂,指示反应终点
B.实验Ⅰ中V(NaOH)=10 mL时,存在c(C2)
D.实验Ⅱ中V(CaCl2)=80 mL时,溶液中c(C2)=4.0×10-8 mol·L-1
答案 D
4.★★(2022江苏,12,3分)一种捕集烟气中CO2的过程如图所示。室温下以0.1 mol·L-1KOH溶液吸收CO2,若通入CO2所引起的溶液体积变化和H2O挥发可忽略,溶液中含碳物种的浓度c总=c(H2CO3)+c(HC)+c(C)。H2CO3电离常数分别为=4.4×10-7、=4.4×10-11。
下列说法正确的是( )
A.KOH吸收CO2所得到的溶液中:c(H2CO3)>c(HC )
B.KOH完全转化为K2CO3时,溶液中:c(OH-)=c(H+)+c(HC)+c(H2CO3)
C.KOH溶液吸收CO2,c总=0.1 mol·L-1溶液中:c(H2CO3)>c(C)
D.题图所示的“吸收”“转化”过程中,溶液的温度下降
答案 C
5.★★★(2020江苏,14,4分)(双选)室温下,将两种浓度均为0.10 mol·L-1的溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是 ( )
A.NaHCO3-Na2CO3混合溶液(pH=10.30):c(Na+)>c(HC)>c(C)>c(OH-)
B.氨水-NH4Cl混合溶液(pH=9.25):c(N)+c(H+)=c(NH3·H2O)+c(OH-)
C.CH3COOH-CH3COONa混合溶液(pH=4.76):c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)
D.H2C2O4-NaHC2O4混合溶液(pH=1.68,H2C2O4为二元弱酸):c(H+)+c(H2C2O4)=c(Na+)+c(C2)+c(OH-)
答案 AD
6.★★★(2019江苏,14,4分)(双选)室温下,反应HC+H2O H2CO3+OH-的平衡常数K=2.2×10-8。将NH4HCO3溶液和氨水按一定比例混合,可用于浸取废渣中的ZnO。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
A.0.2 mol·L-1氨水:c(NH3·H2O)>c(N)>c(OH-)>c(H+)
B.0.2 mol·L-1NH4HCO3溶液(pH>7):c(N)>c(HC)>c(H2CO3)>c(NH3·H2O)
C.0.2 mol·L-1氨水和0.2 mol·L-1NH4HCO3溶液等体积混合:c(N)+c(NH3·H2O)=c(H2CO3)+c(HC)+c(C)
D.0.6 mol·L-1氨水和0.2 mol·L-1NH4HCO3溶液等体积混合:c(NH3·H2O)+c(C)+c(OH-)=0.3 mol·L-1+c(H2CO3)+c(H+)
答案 BD
三年模拟
考点强化练
考点1 盐类水解
1.★★(2024届扬州高邮开学考,12)燃煤烟气中的CO2捕集可通过如图所示的物质转化实现。已知:(H2CO3)=4.5×10-7、(H2CO3)=4.7×10-11。下列说法正确的是( )
A.KOH吸收CO2所得到的溶液中:c(H2CO3)>c(HC)
B.KOH完全转化为KHCO3时,溶液中存在:(H2CO3)·(H2CO3)
2.★★(2024届苏州期中,12)室温下,用0.1 mol·L-1Na2SO3溶液吸收废气中的SO2,并获得BaSO3的过程如图所示。忽略吸收废气所引起的溶液体积变化和H2O的挥发,溶液中含硫物种的浓度c总=c(H2SO3)+c(HS)+c(S)。已知:(H2SO3)=1.54×10-2,(H2SO3)=1.02×10-7。下列说法正确的是 ( )
A.0.1 mol·L-1 Na2SO3溶液吸收SO2至pH=7的溶液:c(HS)
C.沉淀后的上层清液:c(Ba2+)>
D.沉淀后的上层清液久置:2c(Ba2+)+c(Na+)+c(H+)=c(OH-)+2c(S)+c(HS)
答案 A
3.★★(2023南京、盐城一模,12)一种吸收SO2再经氧化得到硫酸盐的过程如图所示。室温下,用0.1 mol·L-1NaOH溶液吸收SO2,若通入SO2所引起的溶液体积变化和H2O挥发可忽略,溶液中含硫物种的浓度c总=c(H2SO3)+c(HS)+c(S)。H2SO3的电离常数分别为=1.29×10-2、=6.24×10-8。下列说法正确的是( )
A.“吸收”应在较高的温度下进行
B.“吸收”所得溶液中:c(Na+)+c(H+)=c(HS)+c(S)+c(OH-)
C.“吸收”所得c总=0.1 mol·L-1溶液中:c(H2SO3)>c(S)
D.“氧化”调节溶液pH约为5,主要发生反应2HS+O2 2S+2H+
答案 D
4.★★(2023南京、盐城二模,11)用一定浓度NaOH溶液吸收H2S可制备Na2S或NaHS。若通入H2S所引起的溶液体积变化和H2O挥发可忽略,溶液中含硫物种的浓度c总=c(H2S)+c(HS-)+c(S2-)。室温下,H2S的电离常数分别为=1.1×10-7、=1.3×10-13。下列说法正确的是( )
A.Na2S溶液显碱性的原因:S2-+2H2O H2S+2OH-
B.NaOH恰好转化为Na2S的溶液中:c(OH-)=c(H+)+c(HS-)+c(S2-)
C.吸收所得c总=c(Na+)的溶液中:c(H2S)>c(S2-)
D.NaOH溶液吸收H2S过程中,溶液的温度下降
答案 C
5.★★(2023泰州期末,12)室温下,某兴趣小组通过下列实验制备少量NaHCO3并探究其性质。
实验1:测得100 mL 14 mol·L-1氨水的pH约为12。
实验2:向上述氨水中加NaCl粉末至饱和,通入足量CO2后析出晶体。
实验3:将所得混合物静置后过滤、洗涤、干燥,得到NaHCO3。
实验4:配制100 mL一定浓度的NaHCO3溶液,测得pH为8.0。
下列说法正确的是( )
A.依据实验1推测Kb(NH3·H2O)约为7×10-26
B.依据实验2推测溶解度:NaHCO3>NaCl
C.实验3所得滤液中:c(N)+c(H+)=c(Cl-)+c(OH-)
D.实验4的溶液中:c(H2CO3)-c(C)=9.9×10-7 mol·L-1
答案 D
考点2 沉淀溶解平衡
6.★★(2024届淮安开学考,12)室温下,用FeSO4溶液制备FeCO3的过程如图所示。已知:Kb(NH3·H2O)=1.8×10-5,(H2CO3)=4.5×10-7,(H2CO3)=4.7×10-11,Ksp[Fe(OH)2]=8.0×10-16,Ksp(FeCO3)=3.1×10-11。下列说法正确的是( )
A.0.1 mol·L-1 NH4HCO3溶液中:c(NH3·H2O)>c(H2CO3)
B.(NH4)2SO4溶液中:c(H+)=2c(NH3·H2O)+c(OH-)
C.制备FeCO3的离子方程式为Fe2++NH3·H2O+HC FeCO3↓+N+H2O
D.c(Fe2+)=0.08 mol·L-1时,应控制pH≤8
答案 C
7.★★★(2023如皋第一次适应性考试,12)水体中的重金属离子如Cu2+、Sn2+等可以转化为CuS、SnS沉淀除去。已知:室温下(H2S)=9×10-8,(H2S)=1×10-12。下列说法正确的是( )
A.0.1 mol·L-1 Na2S溶液中:c(OH-)=c(H2S)+c(HS-)+c(H+)
B.0.1 mol·L-1 NaHS溶液中:c(Na+)
D.室温时,向0.001 mol SnS粉末中加入10 mL 0.1 mol·L-1 CuSO4溶液,充分浸出后所得溶液中c(Cu2+)
8.★★★(2023连云港第一次调研,12)工业上利用反应SrSO4(s)+C(aq) SrCO3(s)+S(aq)生产SrCO3。现有含SrCO3(s)的0.1 mol·L-1 Na2CO3溶液和含SrSO4(s)的0.1 mol·L-1 Na2SO4溶液,在一定pH范围内,两种溶液中lg[c(Sr2+)]随pH的变化关系如图所示。下列说法正确的是( )
A.含有SrCO3(s)的0.1 mol·L-1 Na2CO3溶液中:c(Na+)+c(H+)=2c(C)+c(HC)+c(OH-)
B.①代表含SrCO3(s)的0.1 mol·L-1 Na2CO3溶液的变化曲线
C.若a=-6.5,则虚线可表示含SrSO4(s)的1.0 mol·L-1 Na2SO4溶液
D.对含SrSO4(s)且Na2SO4和Na2CO3初始浓度均为0.1 mol·L-1的混合溶液,pH≥7.7时才发生沉淀转化
答案 C
9.★★(2024届南京学情调研,14节选)MnSO4可用于制备多种物质。
25 ℃时,相关物质的Ksp见下表。
物质 Fe(OH)2 Fe(OH)3 Al(OH)3 Mn(OH)2
Ksp 8.0×10-16 3.0×10-39 1.0×10-33 1.0×10-13
由软锰矿粉(主要成分为MnO2,含少量Fe2O3、Al2O3、SiO2)制备MnSO4的过程可表示如下:
①浸取。保持温度、各物质投料量及浓度不变,能提高Mn2+浸出率的措施有 。
②沉淀。室温下,浸取后溶液中Mn2+浓度为0.1 mol·L-1,欲使溶液中Fe3+、Al3+的浓度均小于1.0×10-6 mol·L-1,则需加入MnO调节pH的范围为 。
③过滤。滤渣的主要成分有 。
答案 ①搅拌、延长反应时间 ②5~8 ③Fe(OH)3、Al(OH)3、SiO2
10.★★★(1)(2023南师附中一模,15节选)将1.8 mol PbSO4加到1 L含有0.12 mol/L H2C2O4的废水中,发生的离子反应为PbSO4(s)+H2C2O4(aq) PbC2O4(s)+2H+(aq)+S(aq),该反应的平衡常数K= 。
已知:25 ℃时,部分物质的相关信息如表所示:
Ksp(PbSO4) Ksp(PbC2O4) (H2C2O4) (H2C2O4)
2.0×10-8 5.0×10-10 6.0×10-2 6.25×10-5
(2)(2023南师附中江宁分校期末,17节选)三氯化六氨合钴[Co(NH3)6]Cl3是一种重要的化工原料。利用含钴废料(含少量Fe、Al等杂质)制取[Co(NH3)6]Cl3的工艺流程如图所示:
已知:a.“酸浸”过滤后的滤液中含有Co2+、Fe2+、Fe3+、Al3+等。
b.Ksp[Co(OH)2]=1×10-14.2、Ksp[Co(OH)3]=1×10-43.7、Ksp[Fe(OH)3]=1×10-37.4、Ksp[Al(OH)3]=1×10-32.9,溶液中金属离子物质的量浓度低于1.0×10-5 mol/L时,可认为沉淀完全。
c.[Co(NH3)6]2+具有较强还原性。
回答下列问题:
①Co2+的价电子排布式为 。
②“除杂”过程中加Na2CO3调节pH后会生成两种沉淀,同时得到含c(Co2+)=0.1 mol/L的滤液,调节pH的范围为 。
(3)(2023海安期末,16节选)钴及其化合物在工业生产中有着广阔的应用前景。
从锂钴废料(主要成分为LiCoO2)分离Co2+。
“净化”时,加NaF固体是将Li+转化为沉淀,“净化”后溶液中c(F-)=4.0×10-2 mol/L。若“过滤1”后溶液中Li+浓度为1.0 mol/L,则“净化”后c(Na+)= 。[溶液体积变化忽略不计,不考虑其他离子影响。25 ℃时Ksp(LiF)=2.0×10-3]
答案 (1)1.5×10-4 (2)①3d7 ②4.7~7.4 (3)0.99 mol/L
考法综合练
考法 溶液中微粒浓度关系及平衡常数分析
1.★★(2024届南通海安开学考,13)CuC2O4是一种重要的催化剂。以Na2C2O4为原料制备CuC2O4的反应方程式为Na2C2O4+CuSO4 CuC2O4↓+Na2SO4。已知室温下:(H2C2O4)=10-1.23、(H2C2O4)=10-4.27。下列说法正确的是( )
A.为确认C2已完全沉淀,将反应后的混合物静置,向上层清液中加CaCl2溶液,观察是否有沉淀产生
B.为获得纯度较高的CuC2O4,可向Na2C2O4溶液中滴加CuSO4溶液
C.0.1 mol/L Na2C2O4溶液中存在c(OH-)=c(H+)+c(H2C2O4)+c(HC2)
D.加水稀释一定浓度的NaHC2O4溶液,溶液中的值逐渐变大
答案 B
2.★★(2024届常州高级中学开学考,12)室温下,通过下列实验探究Na2CO3的性质。已知:25 ℃时,H2SO3的=1.4×10-2、=1.0×10-7,H2CO3的=4.3×10-7、=5.6×10-11。
实验1:配制50 mL 0.1 mol·L-1 Na2CO3溶液,测得溶液pH约为12;
实验2:取10 mL 0.1 mol·L-1 Na2CO3溶液,向其中加入一定量CaSO4固体充分搅拌,一段时间后过滤,向滤渣中加入足量稀盐酸,固体部分溶解;
实验3:取10 mL 0.1 mol·L-1 Na2CO3溶液,向其中缓慢滴入等体积0.1 mol·L-1稀盐酸。
下列说法正确的是( )
A.实验1所得溶液中,c(Na+)
C.实验3反应后溶液中存在:c(Na+)=c(C)+c(HC)+c(H2CO3)
D.25 ℃时,反应C+H2SO3 HC+HS的平衡常数K=2.5×108
答案 D
3.★★★(2023南通、淮安等五市第一次调研,12)常温下,将FeSO4溶液与NH4HCO3溶液混合,可制得FeCO3,混合过程中有气体产生。已知:Kb(NH3·H2O)=1.8×10-5,(H2CO3)=4.5×10-7,(H2CO3)=4.7×10-11,Ksp(FeCO3)=3.13×10-11。下列说法不正确的是( )
A.向100 mL pH=10的氨水中通入少量CO2,反应后溶液中存在:c(C)>c(HC)
B.0.1 mol·L-1 NH4HCO3溶液中:c(H2CO3)>c(C)+c(NH3·H2O)
C.生成FeCO3的离子方程式为Fe2++2HC FeCO3↓+CO2↑+H2O
D.生成FeCO3沉淀后的上层清液中:c(Fe2+)·c(C)=Ksp(FeCO3)
答案 A
4.★★★(2023苏州期中调研,12)室温下,将H2C2O4溶液和NaOH溶液按一定比例混合,可用于测定溶液中钙的含量。
测定原理:①Ca2++C2 CaC2O4↓;②CaC2O4+H2SO4 CaSO4+H2C2O4;③用稀硫酸酸化的KMnO4溶液滴定②中H2C2O4。已知:室温下(H2C2O4)=5.90×10-2,(H2C2O4)=6.40×10-5,Ksp(CaC2O4)=2.34×10-9。下列说法正确的是( )
A.NaHC2O4溶液中:c(H2C2O4)
C.①中反应静置后的上层清液中:c(Ca2+)·c(C2)>Ksp(CaC2O4)
D.③发生反应的离子方程式:5C2+2Mn+16H+ 2Mn2++10CO2↑+8H2O
答案 A
专题十三 盐类水解和沉淀溶解平衡
五年高考
考点过关练
考点1 盐类水解
1.★★(2021天津,10,3分)常温下,下列有关电解质溶液的叙述正确的是( )
A.在0.1 mol·L-1 H3PO4溶液中,c(H3PO4)>c(H2P)>c(HP)>c(P)
B.在0.1 mol·L-1 Na2C2O4溶液中,c(Na+)+c(H+)=c(OH-)+c(HC2)+c(C2)
C.在0.1 mol·L-1 NaHCO3溶液中,c(H2CO3)+c(HC)=0.1 mol·L-1
D.氨水和NH4Cl溶液混合,形成pH=9的溶液中,c(Cl-)>c(N)>c(OH-)>c(H+)
答案 A
2.★★(2022海南,13,4分)(双选)NaClO溶液具有漂白能力。已知25 ℃时,Ka(HClO)=4.0×10-8。下列关于NaClO溶液说法正确的是( )
A.0.01 mol·L-1溶液中,c(ClO-)<0.01 mol·L-1
B.长期露置在空气中,释放Cl2,漂白能力减弱
C.通入过量SO2,反应的离子方程式为SO2+ClO-+H2O HS+HClO
D.25 ℃,pH=7.0的NaClO和HClO的混合溶液中,c(HClO)>c(ClO-)=c(Na+)
答案 AD
3.★★(2022浙江6月选考,17,2分)25 ℃时,苯酚(C6H5OH)的Ka=1.0×10-10,下列说法正确的是 ( )
A.相同温度下,等pH的C6H5ONa和CH3COONa溶液中,c(C6H5O-)>c(CH3COO-)
B.将浓度均为0.10 mol·L-1的C6H5ONa和NaOH溶液加热,两种溶液的pH均变大
C.25 ℃时,C6H5OH溶液与NaOH溶液混合,测得pH=10.00,则此时溶液中c(C6H5O-)=c(C6H5OH)
D.25 ℃时,0.10 mol·L-1的C6H5OH溶液中加少量C6H5ONa固体,水的电离程度变小
答案 C
4.★★(2021北京,12,3分)下列实验中,均产生白色沉淀。
下列分析不正确的是( )
A.Na2CO3与NaHCO3溶液中所含微粒种类相同
B.CaCl2 能促进Na2CO3、NaHCO3水解
C.Al2(SO4)3能促进Na2CO3、NaHCO3水解
D.4个实验中,溶液滴入后,试管中溶液pH均降低
答案 B
5.★★(2021河北,6,3分)BiOCl是一种具有珍珠光泽的材料,利用金属Bi制备BiOCl的工艺流程如图:
下列说法错误的是( )
A.酸浸工序中分次加入稀HNO3可降低反应剧烈程度
B.转化工序中加入稀HCl可抑制生成BiONO3
C.水解工序中加入少量CH3COONa(s)可提高Bi3+水解程度
D.水解工序中加入少量NH4NO3(s)有利于BiOCl的生成
答案 D
6.★★(2021浙江6月选考,23,2分)取两份10 mL 0.05 mol·L-1的NaHCO3溶液,一份滴加0.05 mol·L-1的盐酸,另一份滴加0.05 mol·L-1 NaOH溶液,溶液的pH随加入酸(或碱)体积的变化如图。下列说法不正确的是( )
A.由a点可知:NaHCO3溶液中HC的水解程度大于电离程度
B.a→b→c过程中:c(HC)+2c(C)+c(OH-)逐渐减小
C.a→d→e过程中:c(Na+)
答案 C
考点2 沉淀溶解平衡
7.★★(2021江苏,13,3分)室温下,用0.5 mol·L-1 Na2CO3溶液浸泡CaSO4粉末,一段时间后过滤,向滤渣中加稀醋酸,产生气泡。已知Ksp(CaSO4)=5×10-5,Ksp(CaCO3)=3×10-9。下列说法正确的是( )
A.0.5 mol·L-1 Na2CO3溶液中存在:c(OH-)=c(H+)+c(HC)+c(H2CO3)
B.反应CaSO4+CCaCO3+S正向进行,需满足>×104
C.过滤后所得清液中一定存在:c(Ca2+)=且c(Ca2+)≤
D.滤渣中加入稀醋酸发生反应的离子方程式:CaCO3+2H+ Ca2++CO2↑+H2O
答案 C
8.★★(2022海南,14,4分)(双选)某元素M的氢氧化物M(OH)2(s)在水中的溶解反应为:
M(OH)2(s) M2+(aq)+2OH-(aq)
M(OH)2(s)+2OH-(aq) M(OH(aq)
25 ℃,-lgc与pH的关系如图所示,c为M2+或M(OH 浓度的值。下列说法错误的是( )
A.曲线①代表-lgc(M2+)与pH的关系
B.M(OH)2的Ksp约为1×10-10
C.向c(M2+)=0.1 mol·L-1的溶液中加入NaOH溶液至pH=9.0,体系中元素M主要以M(OH)2(s)存在
D.向c[M(OH]=0.1 mol·L-1的溶液中加入等体积0.4 mol·L-1的HCl后,体系中元素M主要以M2+存在
答案 BD
9.★★★(2022福建,7,4分)锂辉石是锂的重要来源,其焙烧后的酸性浸出液中含有Fe3+、Al3+、Fe2+和Mg2+杂质离子,可在0~14范围内调节pH对其净化(即相关离子浓度c<10-5 mol·L-1)。25 ℃时,lgc与pH关系见图[碱性过强时Fe(OH)3和Fe(OH)2会部分溶解]。下列说法正确的是( )
A.Mg2+可被净化的pH区间最大
B.加入适量H2O2,可进一步提升净化程度
C.净化的先后顺序:Mg2+、Fe2+、Fe3+、Al3+
D.Ksp[Fe(OH)3]
10.★★(2023新课标,13,6分)向AgCl饱和溶液(有足量AgCl固体)中滴加氨水,发生反应Ag++NH3 [Ag(NH3)]+和[Ag(NH3)]++NH3 [Ag(NH3)2]+。lg[c(M)/(mol·L-1)]与lg[c(NH3)/(mol·L-1)]的关系如下图所示{其中M代表Ag+、Cl-、[Ag(NH3)]+或[Ag(NH3)2]+}。
下列说法错误的是( )
A.曲线Ⅰ可视为AgCl溶解度随NH3浓度变化曲线
B.AgCl的溶度积常数Ksp=c(Ag+)·c(Cl-)=10-9.75
C.反应[Ag(NH3)]++NH3 [Ag(NH3)2]+的平衡常数K的值为103.81
D.c(NH3)=0.01 mol·L-1时,溶液中c{[Ag(NH3)2]+}>c{[Ag(NH3)]+}>c(Ag+)
答案 A
11.★★(2023全国乙,13,6分)一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。
下列说法正确的是( )
A.a点条件下能生成Ag2CrO4沉淀,也能生成AgCl沉淀
B.b点时,c(Cl-)=c(Cr),Ksp(AgCl)=Ksp(Ag2CrO4)
C.Ag2CrO4+2Cl- 2AgCl+Cr的平衡常数K=107.9
D.向NaCl、Na2CrO4均为0.1 mol·L-1的混合溶液中滴加AgNO3溶液,先产生Ag2CrO4沉淀
答案 C
12.★★(2023全国甲,13,6分)下图为Fe(OH)3、Al(OH)3和Cu(OH)2在水中达沉淀溶解平衡时的pM-pH关系图{pM=-lg[c(M)/(mol·L-1)];c(M)≤10-5 mol·L-1可认为M离子沉淀完全}。下列叙述正确的是( )
A.由a点可求得Ksp[Fe(OH)3]=10-8.5
B.pH=4时Al(OH)3的溶解度为 mol·L-1
C.浓度均为0.01 mol·L-1的Al3+和Fe3+可通过分步沉淀进行分离
D.Al3+、Cu2+混合溶液中c(Cu2+)=0.2 mol·L-1时二者不会同时沉淀
答案 C
13.★★(2023山东,15,4分)(双选)在含HgI2(s)的溶液中,一定c(I-)范围内,存在平衡关系:HgI2(s) HgI2(aq);HgI2(aq) Hg2++2I-;HgI2(aq) HgI++I-;HgI2(aq)+I- Hg;HgI2(aq)+2I- Hg,平衡常数依次为K0、K1、K2、K3、K4。已知lgc(Hg2+)、lgc(HgI+)、lgc(Hg)、lgc(Hg)随lgc(I-)的变化关系如图所示,下列说法错误的是( )
A.线L表示lgc(Hg)的变化情况
B.随c(I-)增大,c[HgI2(aq)]先增大后减小
C.a=lg
D.溶液中I与Hg的物质的量之比始终为2∶1
答案 BD
14.★★(2023辽宁,15,3分)某废水处理过程中始终保持H2S饱和,即c(H2S)=0.1 mol·L-1,通过调节pH使Ni2+和Cd2+形成硫化物而分离,体系中pH与-lgc关系如图所示,c为HS-、S2-、Ni2+和Cd2+的浓度,单位为mol·L-1。已知Ksp(NiS)>Ksp(CdS),下列说法正确的是( )
A.Ksp(CdS)=10-18.4
B.③为pH与-lgc(HS-)的关系曲线
C.(H2S)=10-8.1
D.(H2S)=10-14.7
答案 D
考法强化练
考法 溶液中微粒浓度关系及平衡常数分析
1.★★(2023江苏,12,3分)室温下,用含少量Mg2+的MnSO4溶液制备MnCO3的过程如图所示。已知Ksp(MgF2)=5.2×10-11,Ka(HF)=6.3×10-4。下列说法正确的是( )
A.0.1 mol·L-1 NaF溶液中:c(F-)=c(Na+)+c(H+)
B.“除镁”得到的上层清液中:c(Mg2+)=
C.0.1 mol·L-1 NaHCO3溶液中:c(C)=c(H+)+c(H2CO3)-c(OH-)
D.“沉锰”后的滤液中:c(Na+)+c(H+)=c(OH-)+c(HC)+2c(C)
答案 C
2.★★(2022重庆,11,3分)某小组模拟成垢—除垢过程如下。
100 mL 0.1 mol·L-1 CaCl2水溶液
……
忽略体积变化,且步骤②中反应完全。下列说法正确的是( )
A.经过步骤①,溶液中c(Ca2+)+c(Na+)=c(Cl-)
B.经过步骤②,溶液中c(Na+)=4c(S)
C.经过步骤②,溶液中c(Cl-)=c(C)+c(HC)+c(H2CO3)
D.经过步骤③,溶液中c(CH3COOH)+c(CH3COO-)=c(Cl-)
答案 D
3.★★(2023浙江6月选考,15,3分)草酸(H2C2O4)是二元弱酸。某小组做如下两组实验:
实验Ⅰ:往20 mL 0.1 mol·L-1 NaHC2O4溶液中滴加0.1 mol·L-1 NaOH溶液。
实验Ⅱ:往20 mL 0.10 mol·L-1 NaHC2O4溶液中滴加0.10 mol·L-1 CaCl2溶液。
[已知:H2C2O4的电离常数=5.4×10-2,=5.4×10-5,Ksp(CaC2O4)=2.4×10-9,溶液混合后体积变化忽略不计],下列说法正确的是( )
A.实验Ⅰ可选用甲基橙作指示剂,指示反应终点
B.实验Ⅰ中V(NaOH)=10 mL时,存在c(C2)
D.实验Ⅱ中V(CaCl2)=80 mL时,溶液中c(C2)=4.0×10-8 mol·L-1
答案 D
4.★★(2022江苏,12,3分)一种捕集烟气中CO2的过程如图所示。室温下以0.1 mol·L-1KOH溶液吸收CO2,若通入CO2所引起的溶液体积变化和H2O挥发可忽略,溶液中含碳物种的浓度c总=c(H2CO3)+c(HC)+c(C)。H2CO3电离常数分别为=4.4×10-7、=4.4×10-11。
下列说法正确的是( )
A.KOH吸收CO2所得到的溶液中:c(H2CO3)>c(HC )
B.KOH完全转化为K2CO3时,溶液中:c(OH-)=c(H+)+c(HC)+c(H2CO3)
C.KOH溶液吸收CO2,c总=0.1 mol·L-1溶液中:c(H2CO3)>c(C)
D.题图所示的“吸收”“转化”过程中,溶液的温度下降
答案 C
5.★★★(2020江苏,14,4分)(双选)室温下,将两种浓度均为0.10 mol·L-1的溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是 ( )
A.NaHCO3-Na2CO3混合溶液(pH=10.30):c(Na+)>c(HC)>c(C)>c(OH-)
B.氨水-NH4Cl混合溶液(pH=9.25):c(N)+c(H+)=c(NH3·H2O)+c(OH-)
C.CH3COOH-CH3COONa混合溶液(pH=4.76):c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)
D.H2C2O4-NaHC2O4混合溶液(pH=1.68,H2C2O4为二元弱酸):c(H+)+c(H2C2O4)=c(Na+)+c(C2)+c(OH-)
答案 AD
6.★★★(2019江苏,14,4分)(双选)室温下,反应HC+H2O H2CO3+OH-的平衡常数K=2.2×10-8。将NH4HCO3溶液和氨水按一定比例混合,可用于浸取废渣中的ZnO。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
A.0.2 mol·L-1氨水:c(NH3·H2O)>c(N)>c(OH-)>c(H+)
B.0.2 mol·L-1NH4HCO3溶液(pH>7):c(N)>c(HC)>c(H2CO3)>c(NH3·H2O)
C.0.2 mol·L-1氨水和0.2 mol·L-1NH4HCO3溶液等体积混合:c(N)+c(NH3·H2O)=c(H2CO3)+c(HC)+c(C)
D.0.6 mol·L-1氨水和0.2 mol·L-1NH4HCO3溶液等体积混合:c(NH3·H2O)+c(C)+c(OH-)=0.3 mol·L-1+c(H2CO3)+c(H+)
答案 BD
三年模拟
考点强化练
考点1 盐类水解
1.★★(2024届扬州高邮开学考,12)燃煤烟气中的CO2捕集可通过如图所示的物质转化实现。已知:(H2CO3)=4.5×10-7、(H2CO3)=4.7×10-11。下列说法正确的是( )
A.KOH吸收CO2所得到的溶液中:c(H2CO3)>c(HC)
B.KOH完全转化为KHCO3时,溶液中存在:(H2CO3)·(H2CO3)
2.★★(2024届苏州期中,12)室温下,用0.1 mol·L-1Na2SO3溶液吸收废气中的SO2,并获得BaSO3的过程如图所示。忽略吸收废气所引起的溶液体积变化和H2O的挥发,溶液中含硫物种的浓度c总=c(H2SO3)+c(HS)+c(S)。已知:(H2SO3)=1.54×10-2,(H2SO3)=1.02×10-7。下列说法正确的是 ( )
A.0.1 mol·L-1 Na2SO3溶液吸收SO2至pH=7的溶液:c(HS)
C.沉淀后的上层清液:c(Ba2+)>
D.沉淀后的上层清液久置:2c(Ba2+)+c(Na+)+c(H+)=c(OH-)+2c(S)+c(HS)
答案 A
3.★★(2023南京、盐城一模,12)一种吸收SO2再经氧化得到硫酸盐的过程如图所示。室温下,用0.1 mol·L-1NaOH溶液吸收SO2,若通入SO2所引起的溶液体积变化和H2O挥发可忽略,溶液中含硫物种的浓度c总=c(H2SO3)+c(HS)+c(S)。H2SO3的电离常数分别为=1.29×10-2、=6.24×10-8。下列说法正确的是( )
A.“吸收”应在较高的温度下进行
B.“吸收”所得溶液中:c(Na+)+c(H+)=c(HS)+c(S)+c(OH-)
C.“吸收”所得c总=0.1 mol·L-1溶液中:c(H2SO3)>c(S)
D.“氧化”调节溶液pH约为5,主要发生反应2HS+O2 2S+2H+
答案 D
4.★★(2023南京、盐城二模,11)用一定浓度NaOH溶液吸收H2S可制备Na2S或NaHS。若通入H2S所引起的溶液体积变化和H2O挥发可忽略,溶液中含硫物种的浓度c总=c(H2S)+c(HS-)+c(S2-)。室温下,H2S的电离常数分别为=1.1×10-7、=1.3×10-13。下列说法正确的是( )
A.Na2S溶液显碱性的原因:S2-+2H2O H2S+2OH-
B.NaOH恰好转化为Na2S的溶液中:c(OH-)=c(H+)+c(HS-)+c(S2-)
C.吸收所得c总=c(Na+)的溶液中:c(H2S)>c(S2-)
D.NaOH溶液吸收H2S过程中,溶液的温度下降
答案 C
5.★★(2023泰州期末,12)室温下,某兴趣小组通过下列实验制备少量NaHCO3并探究其性质。
实验1:测得100 mL 14 mol·L-1氨水的pH约为12。
实验2:向上述氨水中加NaCl粉末至饱和,通入足量CO2后析出晶体。
实验3:将所得混合物静置后过滤、洗涤、干燥,得到NaHCO3。
实验4:配制100 mL一定浓度的NaHCO3溶液,测得pH为8.0。
下列说法正确的是( )
A.依据实验1推测Kb(NH3·H2O)约为7×10-26
B.依据实验2推测溶解度:NaHCO3>NaCl
C.实验3所得滤液中:c(N)+c(H+)=c(Cl-)+c(OH-)
D.实验4的溶液中:c(H2CO3)-c(C)=9.9×10-7 mol·L-1
答案 D
考点2 沉淀溶解平衡
6.★★(2024届淮安开学考,12)室温下,用FeSO4溶液制备FeCO3的过程如图所示。已知:Kb(NH3·H2O)=1.8×10-5,(H2CO3)=4.5×10-7,(H2CO3)=4.7×10-11,Ksp[Fe(OH)2]=8.0×10-16,Ksp(FeCO3)=3.1×10-11。下列说法正确的是( )
A.0.1 mol·L-1 NH4HCO3溶液中:c(NH3·H2O)>c(H2CO3)
B.(NH4)2SO4溶液中:c(H+)=2c(NH3·H2O)+c(OH-)
C.制备FeCO3的离子方程式为Fe2++NH3·H2O+HC FeCO3↓+N+H2O
D.c(Fe2+)=0.08 mol·L-1时,应控制pH≤8
答案 C
7.★★★(2023如皋第一次适应性考试,12)水体中的重金属离子如Cu2+、Sn2+等可以转化为CuS、SnS沉淀除去。已知:室温下(H2S)=9×10-8,(H2S)=1×10-12。下列说法正确的是( )
A.0.1 mol·L-1 Na2S溶液中:c(OH-)=c(H2S)+c(HS-)+c(H+)
B.0.1 mol·L-1 NaHS溶液中:c(Na+)
D.室温时,向0.001 mol SnS粉末中加入10 mL 0.1 mol·L-1 CuSO4溶液,充分浸出后所得溶液中c(Cu2+)
8.★★★(2023连云港第一次调研,12)工业上利用反应SrSO4(s)+C(aq) SrCO3(s)+S(aq)生产SrCO3。现有含SrCO3(s)的0.1 mol·L-1 Na2CO3溶液和含SrSO4(s)的0.1 mol·L-1 Na2SO4溶液,在一定pH范围内,两种溶液中lg[c(Sr2+)]随pH的变化关系如图所示。下列说法正确的是( )
A.含有SrCO3(s)的0.1 mol·L-1 Na2CO3溶液中:c(Na+)+c(H+)=2c(C)+c(HC)+c(OH-)
B.①代表含SrCO3(s)的0.1 mol·L-1 Na2CO3溶液的变化曲线
C.若a=-6.5,则虚线可表示含SrSO4(s)的1.0 mol·L-1 Na2SO4溶液
D.对含SrSO4(s)且Na2SO4和Na2CO3初始浓度均为0.1 mol·L-1的混合溶液,pH≥7.7时才发生沉淀转化
答案 C
9.★★(2024届南京学情调研,14节选)MnSO4可用于制备多种物质。
25 ℃时,相关物质的Ksp见下表。
物质 Fe(OH)2 Fe(OH)3 Al(OH)3 Mn(OH)2
Ksp 8.0×10-16 3.0×10-39 1.0×10-33 1.0×10-13
由软锰矿粉(主要成分为MnO2,含少量Fe2O3、Al2O3、SiO2)制备MnSO4的过程可表示如下:
①浸取。保持温度、各物质投料量及浓度不变,能提高Mn2+浸出率的措施有 。
②沉淀。室温下,浸取后溶液中Mn2+浓度为0.1 mol·L-1,欲使溶液中Fe3+、Al3+的浓度均小于1.0×10-6 mol·L-1,则需加入MnO调节pH的范围为 。
③过滤。滤渣的主要成分有 。
答案 ①搅拌、延长反应时间 ②5~8 ③Fe(OH)3、Al(OH)3、SiO2
10.★★★(1)(2023南师附中一模,15节选)将1.8 mol PbSO4加到1 L含有0.12 mol/L H2C2O4的废水中,发生的离子反应为PbSO4(s)+H2C2O4(aq) PbC2O4(s)+2H+(aq)+S(aq),该反应的平衡常数K= 。
已知:25 ℃时,部分物质的相关信息如表所示:
Ksp(PbSO4) Ksp(PbC2O4) (H2C2O4) (H2C2O4)
2.0×10-8 5.0×10-10 6.0×10-2 6.25×10-5
(2)(2023南师附中江宁分校期末,17节选)三氯化六氨合钴[Co(NH3)6]Cl3是一种重要的化工原料。利用含钴废料(含少量Fe、Al等杂质)制取[Co(NH3)6]Cl3的工艺流程如图所示:
已知:a.“酸浸”过滤后的滤液中含有Co2+、Fe2+、Fe3+、Al3+等。
b.Ksp[Co(OH)2]=1×10-14.2、Ksp[Co(OH)3]=1×10-43.7、Ksp[Fe(OH)3]=1×10-37.4、Ksp[Al(OH)3]=1×10-32.9,溶液中金属离子物质的量浓度低于1.0×10-5 mol/L时,可认为沉淀完全。
c.[Co(NH3)6]2+具有较强还原性。
回答下列问题:
①Co2+的价电子排布式为 。
②“除杂”过程中加Na2CO3调节pH后会生成两种沉淀,同时得到含c(Co2+)=0.1 mol/L的滤液,调节pH的范围为 。
(3)(2023海安期末,16节选)钴及其化合物在工业生产中有着广阔的应用前景。
从锂钴废料(主要成分为LiCoO2)分离Co2+。
“净化”时,加NaF固体是将Li+转化为沉淀,“净化”后溶液中c(F-)=4.0×10-2 mol/L。若“过滤1”后溶液中Li+浓度为1.0 mol/L,则“净化”后c(Na+)= 。[溶液体积变化忽略不计,不考虑其他离子影响。25 ℃时Ksp(LiF)=2.0×10-3]
答案 (1)1.5×10-4 (2)①3d7 ②4.7~7.4 (3)0.99 mol/L
考法综合练
考法 溶液中微粒浓度关系及平衡常数分析
1.★★(2024届南通海安开学考,13)CuC2O4是一种重要的催化剂。以Na2C2O4为原料制备CuC2O4的反应方程式为Na2C2O4+CuSO4 CuC2O4↓+Na2SO4。已知室温下:(H2C2O4)=10-1.23、(H2C2O4)=10-4.27。下列说法正确的是( )
A.为确认C2已完全沉淀,将反应后的混合物静置,向上层清液中加CaCl2溶液,观察是否有沉淀产生
B.为获得纯度较高的CuC2O4,可向Na2C2O4溶液中滴加CuSO4溶液
C.0.1 mol/L Na2C2O4溶液中存在c(OH-)=c(H+)+c(H2C2O4)+c(HC2)
D.加水稀释一定浓度的NaHC2O4溶液,溶液中的值逐渐变大
答案 B
2.★★(2024届常州高级中学开学考,12)室温下,通过下列实验探究Na2CO3的性质。已知:25 ℃时,H2SO3的=1.4×10-2、=1.0×10-7,H2CO3的=4.3×10-7、=5.6×10-11。
实验1:配制50 mL 0.1 mol·L-1 Na2CO3溶液,测得溶液pH约为12;
实验2:取10 mL 0.1 mol·L-1 Na2CO3溶液,向其中加入一定量CaSO4固体充分搅拌,一段时间后过滤,向滤渣中加入足量稀盐酸,固体部分溶解;
实验3:取10 mL 0.1 mol·L-1 Na2CO3溶液,向其中缓慢滴入等体积0.1 mol·L-1稀盐酸。
下列说法正确的是( )
A.实验1所得溶液中,c(Na+)
C.实验3反应后溶液中存在:c(Na+)=c(C)+c(HC)+c(H2CO3)
D.25 ℃时,反应C+H2SO3 HC+HS的平衡常数K=2.5×108
答案 D
3.★★★(2023南通、淮安等五市第一次调研,12)常温下,将FeSO4溶液与NH4HCO3溶液混合,可制得FeCO3,混合过程中有气体产生。已知:Kb(NH3·H2O)=1.8×10-5,(H2CO3)=4.5×10-7,(H2CO3)=4.7×10-11,Ksp(FeCO3)=3.13×10-11。下列说法不正确的是( )
A.向100 mL pH=10的氨水中通入少量CO2,反应后溶液中存在:c(C)>c(HC)
B.0.1 mol·L-1 NH4HCO3溶液中:c(H2CO3)>c(C)+c(NH3·H2O)
C.生成FeCO3的离子方程式为Fe2++2HC FeCO3↓+CO2↑+H2O
D.生成FeCO3沉淀后的上层清液中:c(Fe2+)·c(C)=Ksp(FeCO3)
答案 A
4.★★★(2023苏州期中调研,12)室温下,将H2C2O4溶液和NaOH溶液按一定比例混合,可用于测定溶液中钙的含量。
测定原理:①Ca2++C2 CaC2O4↓;②CaC2O4+H2SO4 CaSO4+H2C2O4;③用稀硫酸酸化的KMnO4溶液滴定②中H2C2O4。已知:室温下(H2C2O4)=5.90×10-2,(H2C2O4)=6.40×10-5,Ksp(CaC2O4)=2.34×10-9。下列说法正确的是( )
A.NaHC2O4溶液中:c(H2C2O4)
C.①中反应静置后的上层清液中:c(Ca2+)·c(C2)>Ksp(CaC2O4)
D.③发生反应的离子方程式:5C2+2Mn+16H+ 2Mn2++10CO2↑+8H2O
答案 A
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
