4.1常见的金属材料课时2 金属矿物及其冶炼课件(共22张PPT)
文档属性
| 名称 | 4.1常见的金属材料课时2 金属矿物及其冶炼课件(共22张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-17 00:00:00 | ||
图片预览








文档简介
(共22张PPT)
第一节 常见的金属材料
课时2 金属矿物及其冶炼
学习目标
1.了解金属在自然界的存在以及常见的铁矿石、铝矿石。
2.通过对炼铁矿石选择、化学反应、实验装置的分析,理解还原法炼铁原理并了解还原反应和还原剂。
3.通过用铁矿石炼铁的有关实际计算了解有关不纯物质的计算方法。
4.通过金属冶炼的方法与原理的学习,进一步认识到化学是认识物质、改造物质、应用物质的一门科学。
情景导入
在日常生活中我们经常用到用铁制成的工具,如剪刀、钉子、铁轨、铁丝等,大家知道铁是怎么来的吗?铁是自然界中直接存在的吗?
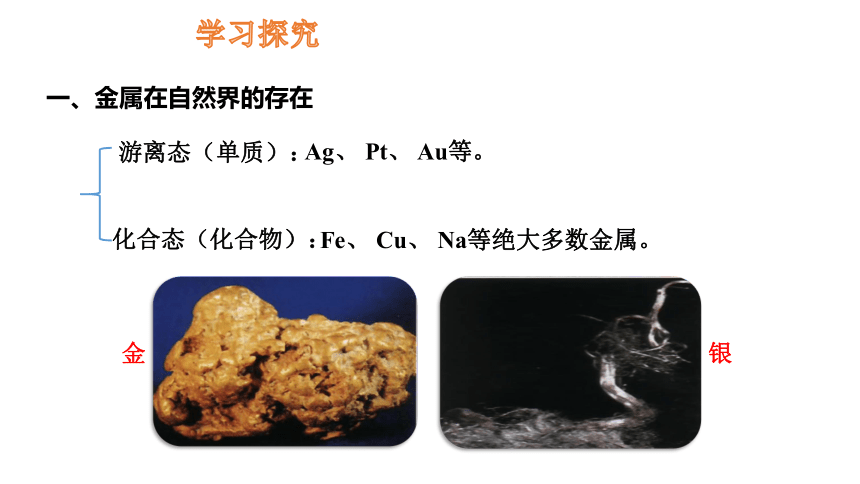
一、金属在自然界的存在
游离态(单质):
学习探究
化合态(化合物):
Ag、 Pt、 Au等。
Fe、 Cu、 Na等绝大多数金属。
金
银
1.地壳中含量最高的金属——铝(化合物形式存在)
钾长石
明矾石
铝土矿Al2O3
2.常见的铁矿石
菱铁矿
黄铁矿
赤铁矿
磁铁矿(主要成分Fe3O4)
赤铁矿(主要成分Fe2O3)
菱铁矿(主要成分FeCO3)
常见的
铁矿石
黄铁矿(主要成分FeS2)
磁铁矿
1.如何选择炼铁的原料矿石
黄铁矿
主要成分 FeS2
菱铁矿
主要成分FeCO3
磁铁矿
主要成分 Fe3O4
主要成分 Fe2O3
赤铁矿
70%
72%
48%
46%
主要成分中的含铁量
二、一氧化碳还原氧化铁
2.原理
(1)实验操作
①检查装置的气密性。
②装药品。
③先通一氧化碳,再点燃酒精喷灯。
目的:
④先停止加热,再通一会一氧化碳,直至玻璃管冷却。
目的:
Fe2O3 + 3CO ==== 2Fe + 3CO2
高温
排出玻璃管中的空气,防止发生爆炸。
防止生成的铁被氧化。
(2)现象
玻璃管内红色的粉末逐渐变黑,同时产生使石灰水变浑浊的气体。
巧记:一氧化碳早来晚走,酒精喷灯迟到早退。
问题讨论
(1)如何判断反应中生成了什么物质?
将产生的气体通入到澄清石灰水中,澄清石灰水变浑浊,则生成二氧化碳:CO2+Ca(OH)2====CaCO3↓+H2O ;红色粉末变黑色,用磁铁检验,证明黑色粉末为铁。
问题讨论
(2)装置中右边的气球起什么作用?
收集尾气,防止污染空气。
(3)石灰水的作用有哪些?
澄清石灰水用来检验生成物二氧化碳,并吸收二氧化碳便于处理尾气。
实验改进
可将上述装置除尾气的部分,改成用气球或方便袋收集,这样收集得到的未燃一氧化碳气体可重复利用。
把尾气烧掉,防
止污染空气。
B
例1 某化学兴趣小组用以下装置探究炼铁原理,关于该装置和反应过程描述错误的是( )
A. 盛装药品前应先检查装置气密性
B. 加热前要先通CO,加热后B中出现浑浊
C. 已知方框中连接的是C和D,导管口的连接顺序为a→b→c→d
D. 这种方法“炼”出的铁与工业上炼出的生铁在组成上最大的区别是不含碳
C
工业炼铁
(1)原料:铁矿石、焦炭、石灰石。
(2)原理:
Fe2O3 + 3CO ==== 2Fe + 3CO2
高温
(3)设备:炼铁高炉。
炼铁高炉示意图
(4)发生的化学反应
炼铁高炉示意图
CaCO3 ==== CaO + CO2↑
高温
3CO + Fe2O3 ==== 2Fe + 3CO2
高温
C + CO2 ==== 2CO
高温
C + O2 ==== CO2
点燃
(供热、CO2)
(制还原剂)
观察上述反应, Fe2O3、CuO 在反应后变成了什么物质?发生了怎样的变化?这些反应的共同点是什么?
H2+ CuO ==== 2Cu + H2O
高温
Fe2O3+ 3CO ==== 2Fe + 3CO2
Δ
C+ 2CuO ==== 2Cu + CO2↑
Δ
3.还原反应
还原剂:夺取氧的物质叫还原剂。
H2+ CuO ==== 2Cu + H2O
高温
3CO +Fe2O3 ==== 2Fe + 3CO2
Δ
C+ 2CuO ==== 2Cu + CO2↑
Δ
还原反应:含氧化合物中的氧被夺去的反应属于还原反应。
4.冶炼金属的常用方法
(1)活泼金属(如K、Ca、Na、Mg、Al)
电解法: 2Al2O3 ==== 4Al+3O2↑
(2)一般金属(如Zn、Fe、Sn、Pb、Cu)
热还原法: Fe2O3+3CO ==== 2Fe+3CO
(3)较稳定金属(如Hg、Ag)
直接加热法: 2HgO ==== 2Hg+O2 ↑
(4)稳定金属(如Pt、Au): 直接以单质形式存在。
通电
高温
加热
B
例2 某化学兴趣小组用以下装置探究炼铁原理,关于该装置和反应过程描述错误的是( )
A. 盛装药品前应先检查装置气密性
B. 加热前要先通CO,加热后B中出现浑浊
C. 已知方框中连接的是C和D,导管口的连接顺序为a→b→c→d
D. 这种方法“炼”出的铁与工业上炼出的生铁在组成上最大的区别是不含碳
C
三、含杂质的化学方程式计算
注意:代入化学方程式计算的物质的质量应是纯净物的质量。
例题:用1 000 t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是多少吨?
解:设生铁的质量为x。
160 2×56
1 000 t×80% x·96%
x =
2×56×1 000 t×80%
160×96%
= 583.3 t
答:生铁的质量为583.3 t 。
Fe2O3+3CO === 2Fe+3CO2
高温
课堂小结
铁的冶炼
原理
工业炼铁
含杂质物质的计算
CO还原Fe2O3
原料
原理
设备
随 堂 测试
2.炼铁的原理是利用一氧化碳与氧化铁反应,某同学利用该原理设计一个实验,实验装置如图:
1. 工业生产中,不仅要考虑生产效率和经济效益的高低,还要考虑对环境污染的程度。在铁矿石的成本价格和杂质含量都相同的条件下,选择下列哪种矿石用来冶炼生铁比较好( )
A. 赤铁矿(主要成分Fe2O3) B. 黄铁矿(主要成分FeS2)
C. 菱铁矿(主要成分FeCO3) D. 磁铁矿(主要成分Fe3O4)
D
(1)给玻璃管加热的仪器叫酒精喷灯,要用其______(填“外焰”、“内焰”或“焰心”)进行加热。
(2)实验中玻璃管里氧化铁粉末的颜色变化是____________________,观察到澄清石灰水的现象是_____________________。
(3)实验前“通入CO”与“开始加热”的顺序是__________________________;实验后“停止通入CO ”与“停止加热”的顺序是__________________________
___________。
(4)实验要在装置末端a处燃着一只酒精灯,其作用是_____________________ 。
外焰
先“通入CO”后“开始加热”
通入CO”
红色粉末变为黑色
澄清石灰水变浑浊
尾气处理
先“停止加热”后“停止
第一节 常见的金属材料
课时2 金属矿物及其冶炼
学习目标
1.了解金属在自然界的存在以及常见的铁矿石、铝矿石。
2.通过对炼铁矿石选择、化学反应、实验装置的分析,理解还原法炼铁原理并了解还原反应和还原剂。
3.通过用铁矿石炼铁的有关实际计算了解有关不纯物质的计算方法。
4.通过金属冶炼的方法与原理的学习,进一步认识到化学是认识物质、改造物质、应用物质的一门科学。
情景导入
在日常生活中我们经常用到用铁制成的工具,如剪刀、钉子、铁轨、铁丝等,大家知道铁是怎么来的吗?铁是自然界中直接存在的吗?
一、金属在自然界的存在
游离态(单质):
学习探究
化合态(化合物):
Ag、 Pt、 Au等。
Fe、 Cu、 Na等绝大多数金属。
金
银
1.地壳中含量最高的金属——铝(化合物形式存在)
钾长石
明矾石
铝土矿Al2O3
2.常见的铁矿石
菱铁矿
黄铁矿
赤铁矿
磁铁矿(主要成分Fe3O4)
赤铁矿(主要成分Fe2O3)
菱铁矿(主要成分FeCO3)
常见的
铁矿石
黄铁矿(主要成分FeS2)
磁铁矿
1.如何选择炼铁的原料矿石
黄铁矿
主要成分 FeS2
菱铁矿
主要成分FeCO3
磁铁矿
主要成分 Fe3O4
主要成分 Fe2O3
赤铁矿
70%
72%
48%
46%
主要成分中的含铁量
二、一氧化碳还原氧化铁
2.原理
(1)实验操作
①检查装置的气密性。
②装药品。
③先通一氧化碳,再点燃酒精喷灯。
目的:
④先停止加热,再通一会一氧化碳,直至玻璃管冷却。
目的:
Fe2O3 + 3CO ==== 2Fe + 3CO2
高温
排出玻璃管中的空气,防止发生爆炸。
防止生成的铁被氧化。
(2)现象
玻璃管内红色的粉末逐渐变黑,同时产生使石灰水变浑浊的气体。
巧记:一氧化碳早来晚走,酒精喷灯迟到早退。
问题讨论
(1)如何判断反应中生成了什么物质?
将产生的气体通入到澄清石灰水中,澄清石灰水变浑浊,则生成二氧化碳:CO2+Ca(OH)2====CaCO3↓+H2O ;红色粉末变黑色,用磁铁检验,证明黑色粉末为铁。
问题讨论
(2)装置中右边的气球起什么作用?
收集尾气,防止污染空气。
(3)石灰水的作用有哪些?
澄清石灰水用来检验生成物二氧化碳,并吸收二氧化碳便于处理尾气。
实验改进
可将上述装置除尾气的部分,改成用气球或方便袋收集,这样收集得到的未燃一氧化碳气体可重复利用。
把尾气烧掉,防
止污染空气。
B
例1 某化学兴趣小组用以下装置探究炼铁原理,关于该装置和反应过程描述错误的是( )
A. 盛装药品前应先检查装置气密性
B. 加热前要先通CO,加热后B中出现浑浊
C. 已知方框中连接的是C和D,导管口的连接顺序为a→b→c→d
D. 这种方法“炼”出的铁与工业上炼出的生铁在组成上最大的区别是不含碳
C
工业炼铁
(1)原料:铁矿石、焦炭、石灰石。
(2)原理:
Fe2O3 + 3CO ==== 2Fe + 3CO2
高温
(3)设备:炼铁高炉。
炼铁高炉示意图
(4)发生的化学反应
炼铁高炉示意图
CaCO3 ==== CaO + CO2↑
高温
3CO + Fe2O3 ==== 2Fe + 3CO2
高温
C + CO2 ==== 2CO
高温
C + O2 ==== CO2
点燃
(供热、CO2)
(制还原剂)
观察上述反应, Fe2O3、CuO 在反应后变成了什么物质?发生了怎样的变化?这些反应的共同点是什么?
H2+ CuO ==== 2Cu + H2O
高温
Fe2O3+ 3CO ==== 2Fe + 3CO2
Δ
C+ 2CuO ==== 2Cu + CO2↑
Δ
3.还原反应
还原剂:夺取氧的物质叫还原剂。
H2+ CuO ==== 2Cu + H2O
高温
3CO +Fe2O3 ==== 2Fe + 3CO2
Δ
C+ 2CuO ==== 2Cu + CO2↑
Δ
还原反应:含氧化合物中的氧被夺去的反应属于还原反应。
4.冶炼金属的常用方法
(1)活泼金属(如K、Ca、Na、Mg、Al)
电解法: 2Al2O3 ==== 4Al+3O2↑
(2)一般金属(如Zn、Fe、Sn、Pb、Cu)
热还原法: Fe2O3+3CO ==== 2Fe+3CO
(3)较稳定金属(如Hg、Ag)
直接加热法: 2HgO ==== 2Hg+O2 ↑
(4)稳定金属(如Pt、Au): 直接以单质形式存在。
通电
高温
加热
B
例2 某化学兴趣小组用以下装置探究炼铁原理,关于该装置和反应过程描述错误的是( )
A. 盛装药品前应先检查装置气密性
B. 加热前要先通CO,加热后B中出现浑浊
C. 已知方框中连接的是C和D,导管口的连接顺序为a→b→c→d
D. 这种方法“炼”出的铁与工业上炼出的生铁在组成上最大的区别是不含碳
C
三、含杂质的化学方程式计算
注意:代入化学方程式计算的物质的质量应是纯净物的质量。
例题:用1 000 t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是多少吨?
解:设生铁的质量为x。
160 2×56
1 000 t×80% x·96%
x =
2×56×1 000 t×80%
160×96%
= 583.3 t
答:生铁的质量为583.3 t 。
Fe2O3+3CO === 2Fe+3CO2
高温
课堂小结
铁的冶炼
原理
工业炼铁
含杂质物质的计算
CO还原Fe2O3
原料
原理
设备
随 堂 测试
2.炼铁的原理是利用一氧化碳与氧化铁反应,某同学利用该原理设计一个实验,实验装置如图:
1. 工业生产中,不仅要考虑生产效率和经济效益的高低,还要考虑对环境污染的程度。在铁矿石的成本价格和杂质含量都相同的条件下,选择下列哪种矿石用来冶炼生铁比较好( )
A. 赤铁矿(主要成分Fe2O3) B. 黄铁矿(主要成分FeS2)
C. 菱铁矿(主要成分FeCO3) D. 磁铁矿(主要成分Fe3O4)
D
(1)给玻璃管加热的仪器叫酒精喷灯,要用其______(填“外焰”、“内焰”或“焰心”)进行加热。
(2)实验中玻璃管里氧化铁粉末的颜色变化是____________________,观察到澄清石灰水的现象是_____________________。
(3)实验前“通入CO”与“开始加热”的顺序是__________________________;实验后“停止通入CO ”与“停止加热”的顺序是__________________________
___________。
(4)实验要在装置末端a处燃着一只酒精灯,其作用是_____________________ 。
外焰
先“通入CO”后“开始加热”
通入CO”
红色粉末变为黑色
澄清石灰水变浑浊
尾气处理
先“停止加热”后“停止
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
