4.2金属的化学性质课件(共23张PPT)
文档属性
| 名称 | 4.2金属的化学性质课件(共23张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-17 00:00:00 | ||
图片预览







文档简介
(共23张PPT)
第四单元 金 属
第二节 金属的化学性质
学习目标
1.知道镁、铝、铁、铜等常见金属与氧气的反应;认识常见金属与盐酸、硫酸和盐溶液的置换反应,并能解释日常生活中的一些现象。
2.理解金属活动顺序表的含义,能利用它判断金属与酸和盐溶液的反应。
3.通过对金属化学性质的探究,培养学生严谨求实的态度和敢于质疑的精神。
情景导入
三星堆遗址被世人称为20世纪人类最伟大的考古发现之一,出土了很多文物,如锈迹斑斑的铜巨型神兽、金光闪闪的黄金面罩。同样是金属,为什么铜锈迹斑斑而金光亮如鲜呢?
这和金属的化学性质有关!
金属材料具有优良的物理性能,被广泛应用于生产、生活中。由于金属原子容易失去最外层电子,所以化学性质活泼。能与很多物质发生化学反应。那么,金属具有哪些化学性质呢?
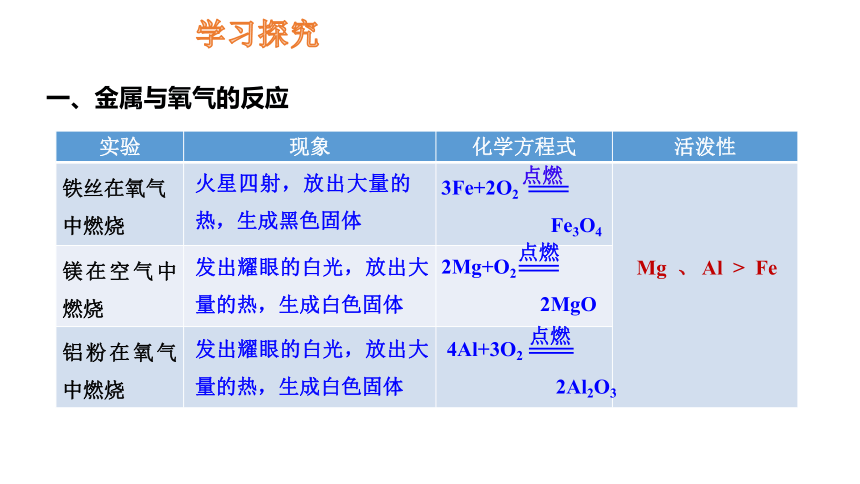
一、金属与氧气的反应
学习探究
实验 现象 化学方程式 活泼性
铁丝在氧气中燃烧
镁在空气中燃烧
铝粉在氧气中燃烧
火星四射,放出大量的热,生成黑色固体
发出耀眼的白光,放出大量的热,生成白色固体
发出耀眼的白光,放出大量的热,生成白色固体
3Fe+2O2
Fe3O4
点燃
2Mg+O2
2MgO
点燃
4Al+3O2
2Al2O3
点燃
Mg 、 Al > Fe
1.对比镁、铁、铝分别与氧气发生反应的实验现象,分析一下可能有哪些原因导致了在这三个实验中金属与氧气反应的难易和剧烈程度不同?
(1)氧气的浓度 (2)金属与氧气的接触面积
(3)金属本身的化学性质(即金属的活泼性)
2.铝比铁更易与氧气反应,为什么日常生活中很少见到铝制品生锈?
4Al+3O2====2Al2O3
交流共享
3.分析“真金不怕火炼”蕴含的化学原理?
金即使在高温时不能与氧气反应。
B
例1 下列说法正确的是( )
A. 铝制品在空气中不易锈蚀是因为铝不易与氧气发生反应
B. 灼热的细铁丝在空气中不能燃烧是因为温度没有达到着火点
C. 镁在空气中点燃能与氧气发生反应, 其化学方程式为Mg+O2 ====MgO2
D. 根据各种金属与氧气反应的难易程度,可以初步比较一些金属的活动性强弱
D
解析:铝制品在空气中不易锈蚀,是因为铝的表面形成了一层致密的氧化物保护膜,A错误;细铁丝在空气中不能燃烧是因为空气中氧气的含量低,B错误;镁带在空气中燃烧的化学方程式为2Mg+O2 ====2MgO,故C错误。
点燃
点燃
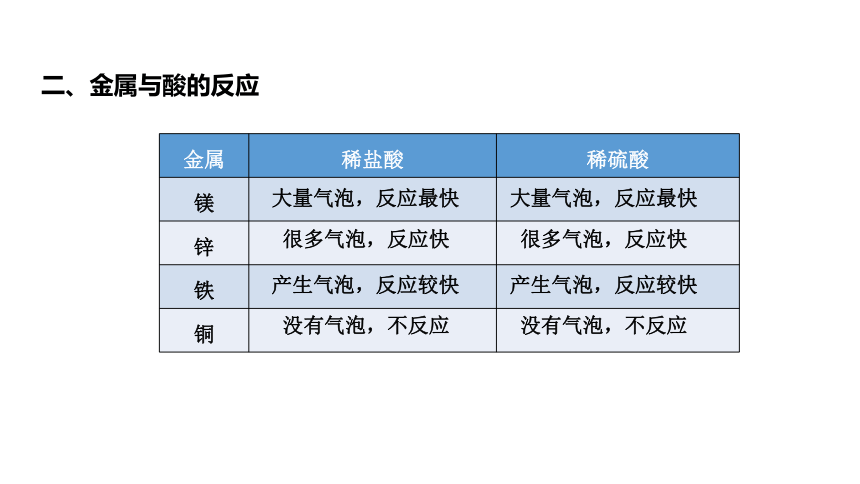
二、金属与酸的反应
金属 稀盐酸 稀硫酸
镁
锌
铁
铜
大量气泡,反应最快
大量气泡,反应最快
很多气泡,反应快
很多气泡,反应快
产生气泡,反应较快
产生气泡,反应较快
没有气泡,不反应
没有气泡,不反应
各反应的化学方程式
实验结论
(1)能与盐酸、稀硫酸反应的金属有:Mg、Fe、Zn。
(2)比较四种金属与盐酸、硫酸反应的难易、剧烈程度,由易到难的顺序:Mg>Zn>Fe>Cu。
Mg+2HCl === MgCl2+H2↑
Mg+H2SO4 === MgSO4+H2↑
Zn+H2SO4 === ZnSO4+H2↑
Zn+2HCl === ZnCl2+H2↑
Fe+2HCl === FeCl2+H2↑
Fe+H2SO4 === FeSO4+H2↑
1.金属活动性顺序
符号:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
名称:
金属活动性由强逐渐减弱
钾 钙 钠 镁 铝 锌 铁 锡 铅 (氢)铜 汞 银 铂 金
镁、锌、铁、铜的金属活动性由强到弱
(1)在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。
(2)在金属活动性顺序里,排在氢前面的金属能与酸反应放出氢气,而排在氢后面的金属不能与酸反应放出氢气。
金属活动性顺序的理解
2.置换反应
(1)定义
一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应。
(2)特点
A+BC====B+AC
B
例2 铕(Eu)是非常活泼的金属, 能与冷水反应,应保存在氩气中。铕与水反应的化学方程式为Eu+2H2O===Eu(OH)2↓+H2↑。该反应属于( )
A. 化合反应 B. 分解反应
C. 置换反应 D. 复分解反应
C
解析:置换反应是一种单质和一种化合物反应, 生成另一种单质和另一种化合物,Eu+2H2O===Eu(OH)2↓+H2↑属于置换反应,故C正确。
B
例3 把一枚洁净的铁钉放入稀硫酸中, 下列说法错误的是( )
A. 铁钉表面产生气泡 B. 溶液由无色变成浅绿色
C. 铁钉质量减轻 D. 溶液质量减轻
D
解析:铁与稀硫酸反应生成硫酸亚铁和氢气,所以铁钉表面有气泡产生,铁钉逐渐溶解, 质量减轻,生成的硫酸亚铁溶液为浅绿色, 故A、B、C项都正确;铁与稀硫酸反应的实质是铁置换出酸中的氢,根据化学方程式可知,每溶解56份质量的铁能置换出2份质量的氢,因此溶液质量会增加。
三、金属与盐溶液的反应
【提出问题 】除了金属与盐酸或稀硫酸能否反应以及反应的剧烈程度,可比较金属的活动性以外,还有其他方法吗
活动性较强的金属能与酸溶液中的氢离子发生置换反应,NaCl、CaCl2、CuSO4、AgNO3这些盐的溶液中都含有金属离子,这些离子能否与金属发生置换反应呢?
通过盐与金属是否发生置换反应我们也可以比较金属的化学活动性强弱。
金属 CuSO4溶液 AgNO3溶液 NaCl溶液
Zn
Fe
Cu
锌片表面覆盖一层红色物质,溶液由蓝色变为无色
无变化
锌片表面覆盖一层银白色物质
铁丝表面覆盖一层红色物质,溶液由蓝色变为浅绿色
铁丝表面覆盖一层银白色物质,溶液变为浅绿色
无变化
无变化
无变化
铜丝表面覆盖一层银白色物质,溶液变为蓝色
Fe + 2AgNO3 == 2Ag + Fe(NO3)2
Cu + 2AgNO3 == 2Ag + Cu(NO3)2
Zn + CuSO4 == Cu + ZnSO4
Fe + CuSO4 == Cu + FeSO4
Zn + 2AgNO3 == 2Ag + Zn(NO3)2
探究:金属与盐溶液的反应规律
1.上述反应都是什么类型?
2.从金属活动性强弱的角度分析:上述反应有什么共同点?
置换反应
活动性强的金属置换活动性弱的金属
Zn>Cu
Fe>Cu
Zn>Ag
Fe>Ag
Cu>Ag
2.金属和盐发生置换反应,生成新金属和新盐:
金属+盐→新金属+新盐
金属与盐溶液的反应规律
1.在金属活动性顺序中,位置靠前的金属可以把位于其后的金属从它的盐溶液中置换出来。
(K、Ca、Na除外!)
注意:
1.盐必须是可溶性盐,不溶性盐不与金属反应
2.K、Ca、Na的活动性太强,与盐反应比较复杂,不能置换盐中金属。
3.K、Ca、Na太活泼,与水反应,不能把排在后面的金属从它们的盐溶液置换出来。
4. Fe若参与反应,一定生成二价铁离子(亚铁离子)。
5.在金属活动顺序中距离远的优先置换(例:将铁放在硝酸铜和硝酸银混合溶液中,铁先置换出银)。
B
例4 将一根洁净的铜丝放入AgNO3溶液中, 一段时间后,溶液由无色变为蓝色,铜丝表面生长出白色“树枝”,下列叙述错误的是( )
A. 白色“树枝”的成分是银
B. 溶液变为蓝色, 表明Cu转变为Cu2+
C. 所得溶液中肯定不含有Ag+
D. 铜的金属活动性比银的强
C
解析:铜与硝酸银发生置换反应生成硝酸铜和银,无法确定硝酸银是否有剩余, 所得溶液中可能含有Ag+,C错误。
课堂小结
通过本课题的学习,我们知道了多数金属能与氧气发生反应,且不同金属的活动性 ;根据金属与酸反应是否有 生成或一种金属能否把另一种金属从它的化合物的溶液中 出来,可以判断出金属活动性的相对强弱。同时,我们也认识了一种新的化学反应类型 。
不同
氢气
置换
置换反应
随 堂 测试
2.有X、Y、Z三种金属,将Y、Z分别放入稀硫酸中,Y溶解、Z不溶解;将 Z 放入XSO4的溶液里,Z 的表面有 X 析出。则X、Y、Z三种金属的活动性由强到弱的顺序是 ( )
A. X>Y>Z B. Y>Z>X
C. Y>X>Z D. X>Z>Y
B
1.下列物质不能由金属和酸反应直接生成的是 ( )
A. ZnCl2 B. CuSO4
C. FeCl2 D.Al2(SO4)3
B
3.要验证镁、铁、铜三种金属的活动性顺序,可用于进行实验的物质( )
A. 铁、铜、氯化镁溶液
B. 铁、氯化铜溶液、氯化镁溶液
C. 镁、铜、氯化亚铁溶液
D. 镁、氯化铜溶液、氯化亚铁溶液
BC
4.把足量的铁粉分别放入到含下列各组物质的溶液中,充分反应后过滤,滤液中只有一种溶质的是 ( )
A. ZnSO4、CuSO4 B. H2SO4、CuSO4
C. HCl、 CuSO4 D. AgNO3、Al(NO3)3
B
5.为了达到收旧、利废、节能减排的目的,从含有金属镁、铁、铜的粉末中, 分离和提取出重要化工原料MgSO4和有关金属, 实验过程如下。请回答:
铜
(1)金属B是_____。操作a的过程中需要使用玻璃棒,其作用是________。
(3)判断步骤②中稀硫酸适量的依据是_______________,发生反应的化学方程式为_______________________。
引流
不再产生气泡
Mg+H2SO4 === MgSO4+H2↑
第四单元 金 属
第二节 金属的化学性质
学习目标
1.知道镁、铝、铁、铜等常见金属与氧气的反应;认识常见金属与盐酸、硫酸和盐溶液的置换反应,并能解释日常生活中的一些现象。
2.理解金属活动顺序表的含义,能利用它判断金属与酸和盐溶液的反应。
3.通过对金属化学性质的探究,培养学生严谨求实的态度和敢于质疑的精神。
情景导入
三星堆遗址被世人称为20世纪人类最伟大的考古发现之一,出土了很多文物,如锈迹斑斑的铜巨型神兽、金光闪闪的黄金面罩。同样是金属,为什么铜锈迹斑斑而金光亮如鲜呢?
这和金属的化学性质有关!
金属材料具有优良的物理性能,被广泛应用于生产、生活中。由于金属原子容易失去最外层电子,所以化学性质活泼。能与很多物质发生化学反应。那么,金属具有哪些化学性质呢?
一、金属与氧气的反应
学习探究
实验 现象 化学方程式 活泼性
铁丝在氧气中燃烧
镁在空气中燃烧
铝粉在氧气中燃烧
火星四射,放出大量的热,生成黑色固体
发出耀眼的白光,放出大量的热,生成白色固体
发出耀眼的白光,放出大量的热,生成白色固体
3Fe+2O2
Fe3O4
点燃
2Mg+O2
2MgO
点燃
4Al+3O2
2Al2O3
点燃
Mg 、 Al > Fe
1.对比镁、铁、铝分别与氧气发生反应的实验现象,分析一下可能有哪些原因导致了在这三个实验中金属与氧气反应的难易和剧烈程度不同?
(1)氧气的浓度 (2)金属与氧气的接触面积
(3)金属本身的化学性质(即金属的活泼性)
2.铝比铁更易与氧气反应,为什么日常生活中很少见到铝制品生锈?
4Al+3O2====2Al2O3
交流共享
3.分析“真金不怕火炼”蕴含的化学原理?
金即使在高温时不能与氧气反应。
B
例1 下列说法正确的是( )
A. 铝制品在空气中不易锈蚀是因为铝不易与氧气发生反应
B. 灼热的细铁丝在空气中不能燃烧是因为温度没有达到着火点
C. 镁在空气中点燃能与氧气发生反应, 其化学方程式为Mg+O2 ====MgO2
D. 根据各种金属与氧气反应的难易程度,可以初步比较一些金属的活动性强弱
D
解析:铝制品在空气中不易锈蚀,是因为铝的表面形成了一层致密的氧化物保护膜,A错误;细铁丝在空气中不能燃烧是因为空气中氧气的含量低,B错误;镁带在空气中燃烧的化学方程式为2Mg+O2 ====2MgO,故C错误。
点燃
点燃
二、金属与酸的反应
金属 稀盐酸 稀硫酸
镁
锌
铁
铜
大量气泡,反应最快
大量气泡,反应最快
很多气泡,反应快
很多气泡,反应快
产生气泡,反应较快
产生气泡,反应较快
没有气泡,不反应
没有气泡,不反应
各反应的化学方程式
实验结论
(1)能与盐酸、稀硫酸反应的金属有:Mg、Fe、Zn。
(2)比较四种金属与盐酸、硫酸反应的难易、剧烈程度,由易到难的顺序:Mg>Zn>Fe>Cu。
Mg+2HCl === MgCl2+H2↑
Mg+H2SO4 === MgSO4+H2↑
Zn+H2SO4 === ZnSO4+H2↑
Zn+2HCl === ZnCl2+H2↑
Fe+2HCl === FeCl2+H2↑
Fe+H2SO4 === FeSO4+H2↑
1.金属活动性顺序
符号:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
名称:
金属活动性由强逐渐减弱
钾 钙 钠 镁 铝 锌 铁 锡 铅 (氢)铜 汞 银 铂 金
镁、锌、铁、铜的金属活动性由强到弱
(1)在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。
(2)在金属活动性顺序里,排在氢前面的金属能与酸反应放出氢气,而排在氢后面的金属不能与酸反应放出氢气。
金属活动性顺序的理解
2.置换反应
(1)定义
一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应。
(2)特点
A+BC====B+AC
B
例2 铕(Eu)是非常活泼的金属, 能与冷水反应,应保存在氩气中。铕与水反应的化学方程式为Eu+2H2O===Eu(OH)2↓+H2↑。该反应属于( )
A. 化合反应 B. 分解反应
C. 置换反应 D. 复分解反应
C
解析:置换反应是一种单质和一种化合物反应, 生成另一种单质和另一种化合物,Eu+2H2O===Eu(OH)2↓+H2↑属于置换反应,故C正确。
B
例3 把一枚洁净的铁钉放入稀硫酸中, 下列说法错误的是( )
A. 铁钉表面产生气泡 B. 溶液由无色变成浅绿色
C. 铁钉质量减轻 D. 溶液质量减轻
D
解析:铁与稀硫酸反应生成硫酸亚铁和氢气,所以铁钉表面有气泡产生,铁钉逐渐溶解, 质量减轻,生成的硫酸亚铁溶液为浅绿色, 故A、B、C项都正确;铁与稀硫酸反应的实质是铁置换出酸中的氢,根据化学方程式可知,每溶解56份质量的铁能置换出2份质量的氢,因此溶液质量会增加。
三、金属与盐溶液的反应
【提出问题 】除了金属与盐酸或稀硫酸能否反应以及反应的剧烈程度,可比较金属的活动性以外,还有其他方法吗
活动性较强的金属能与酸溶液中的氢离子发生置换反应,NaCl、CaCl2、CuSO4、AgNO3这些盐的溶液中都含有金属离子,这些离子能否与金属发生置换反应呢?
通过盐与金属是否发生置换反应我们也可以比较金属的化学活动性强弱。
金属 CuSO4溶液 AgNO3溶液 NaCl溶液
Zn
Fe
Cu
锌片表面覆盖一层红色物质,溶液由蓝色变为无色
无变化
锌片表面覆盖一层银白色物质
铁丝表面覆盖一层红色物质,溶液由蓝色变为浅绿色
铁丝表面覆盖一层银白色物质,溶液变为浅绿色
无变化
无变化
无变化
铜丝表面覆盖一层银白色物质,溶液变为蓝色
Fe + 2AgNO3 == 2Ag + Fe(NO3)2
Cu + 2AgNO3 == 2Ag + Cu(NO3)2
Zn + CuSO4 == Cu + ZnSO4
Fe + CuSO4 == Cu + FeSO4
Zn + 2AgNO3 == 2Ag + Zn(NO3)2
探究:金属与盐溶液的反应规律
1.上述反应都是什么类型?
2.从金属活动性强弱的角度分析:上述反应有什么共同点?
置换反应
活动性强的金属置换活动性弱的金属
Zn>Cu
Fe>Cu
Zn>Ag
Fe>Ag
Cu>Ag
2.金属和盐发生置换反应,生成新金属和新盐:
金属+盐→新金属+新盐
金属与盐溶液的反应规律
1.在金属活动性顺序中,位置靠前的金属可以把位于其后的金属从它的盐溶液中置换出来。
(K、Ca、Na除外!)
注意:
1.盐必须是可溶性盐,不溶性盐不与金属反应
2.K、Ca、Na的活动性太强,与盐反应比较复杂,不能置换盐中金属。
3.K、Ca、Na太活泼,与水反应,不能把排在后面的金属从它们的盐溶液置换出来。
4. Fe若参与反应,一定生成二价铁离子(亚铁离子)。
5.在金属活动顺序中距离远的优先置换(例:将铁放在硝酸铜和硝酸银混合溶液中,铁先置换出银)。
B
例4 将一根洁净的铜丝放入AgNO3溶液中, 一段时间后,溶液由无色变为蓝色,铜丝表面生长出白色“树枝”,下列叙述错误的是( )
A. 白色“树枝”的成分是银
B. 溶液变为蓝色, 表明Cu转变为Cu2+
C. 所得溶液中肯定不含有Ag+
D. 铜的金属活动性比银的强
C
解析:铜与硝酸银发生置换反应生成硝酸铜和银,无法确定硝酸银是否有剩余, 所得溶液中可能含有Ag+,C错误。
课堂小结
通过本课题的学习,我们知道了多数金属能与氧气发生反应,且不同金属的活动性 ;根据金属与酸反应是否有 生成或一种金属能否把另一种金属从它的化合物的溶液中 出来,可以判断出金属活动性的相对强弱。同时,我们也认识了一种新的化学反应类型 。
不同
氢气
置换
置换反应
随 堂 测试
2.有X、Y、Z三种金属,将Y、Z分别放入稀硫酸中,Y溶解、Z不溶解;将 Z 放入XSO4的溶液里,Z 的表面有 X 析出。则X、Y、Z三种金属的活动性由强到弱的顺序是 ( )
A. X>Y>Z B. Y>Z>X
C. Y>X>Z D. X>Z>Y
B
1.下列物质不能由金属和酸反应直接生成的是 ( )
A. ZnCl2 B. CuSO4
C. FeCl2 D.Al2(SO4)3
B
3.要验证镁、铁、铜三种金属的活动性顺序,可用于进行实验的物质( )
A. 铁、铜、氯化镁溶液
B. 铁、氯化铜溶液、氯化镁溶液
C. 镁、铜、氯化亚铁溶液
D. 镁、氯化铜溶液、氯化亚铁溶液
BC
4.把足量的铁粉分别放入到含下列各组物质的溶液中,充分反应后过滤,滤液中只有一种溶质的是 ( )
A. ZnSO4、CuSO4 B. H2SO4、CuSO4
C. HCl、 CuSO4 D. AgNO3、Al(NO3)3
B
5.为了达到收旧、利废、节能减排的目的,从含有金属镁、铁、铜的粉末中, 分离和提取出重要化工原料MgSO4和有关金属, 实验过程如下。请回答:
铜
(1)金属B是_____。操作a的过程中需要使用玻璃棒,其作用是________。
(3)判断步骤②中稀硫酸适量的依据是_______________,发生反应的化学方程式为_______________________。
引流
不再产生气泡
Mg+H2SO4 === MgSO4+H2↑
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
