上海市高桥中学2023-2024学年高二下学期期中能力诊断(等级性)考试化学试题(无答案)
文档属性
| 名称 | 上海市高桥中学2023-2024学年高二下学期期中能力诊断(等级性)考试化学试题(无答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 252.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-18 14:33:26 | ||
图片预览

文档简介
上海市高桥中学2023-2024学年高二下学期期中能力诊断(等级)考试
化学试卷
(考试时间60分钟 满分100 分)
相对原子质量:Mg-24 A1-27
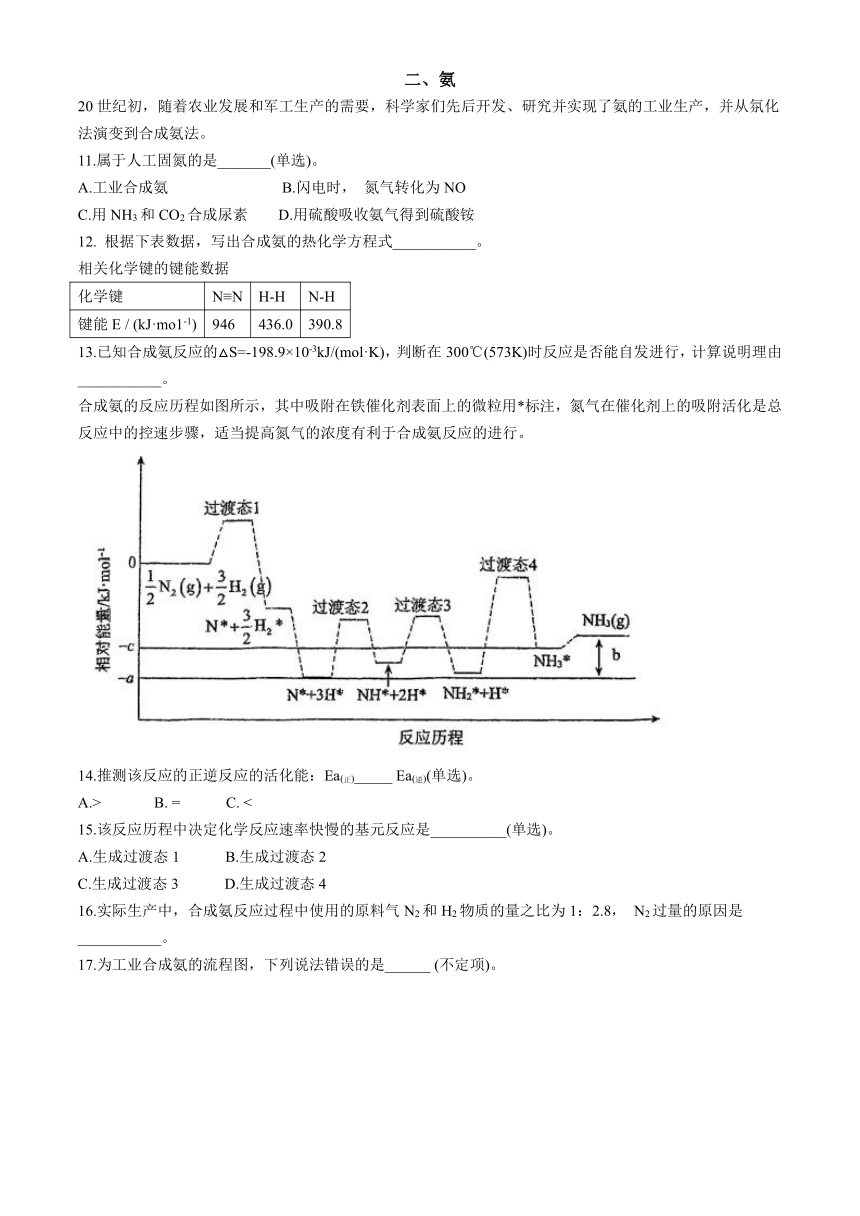
一、镁
海洋中蕴藏着多种金属元素的资源,例如,海水中镁的含量仅次于氯和钠,位居第三,总储量约为1.8×1016t。镁用途广泛,用海水提取金属镁,成本较低,其流程如下图所示:
已知:MgO熔点2852℃,沸点3600℃, 0℃溶解度0. 00062 g/100g 水; MgC12熔点714℃,沸点1412℃,0℃溶解度59.5 g/100g 水。
1.获取Mg (OH)2用石灰乳而不用NaOH溶液的原因是___________。
2.已知:Ca(OH) 2微溶于水,Mg (OH)2难溶于水。为除去Mg (OH)2沉淀中混有少量Ca(OH) 2,先将沉淀加入到_____溶液浸洗,再经过滤、洗涤可得较纯净的Mg(OH)2。
3.上述流程中用过量盐酸溶解氢氧化镁的原因是:_____________。
4.已知Mg (OH)2的Ksp=5.6×10-12(25℃),则溶液中镁离子沉淀完全时pH=_
5.从MgCl2溶液获得MgCl2·6H2O操作步骤包括:_______________。
6.如要得到无水氯化镁需在干燥的HCl气流中加热MgCl2·6H2O,HC1作用是________。
7.写出MgC12制Mg的化学方程式___________。
8.不用MgO制Mg是因为_____________。
9. NH4Cl溶液中放入镁粉能放出H2和NH3,产生这种现象的原因是__________(不定项)
A.金属镁把NH3置换出来
B.镁具有强还原性,具有氧化性,发生氧化还原反应
C.因为水解后溶液显酸性,Mg与H+反应放出H2,平衡向正反应方向移动
D.因为Mg与水反应,生成的Mg (OH)2与NH4Cl反应
10.在标准状况下进行甲、乙、丙三组实验:三组各取30. 0 mL同浓度的盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
实验序号 甲 乙 丙
合金质量/mg 255 385 459
产生气体体积/mL 280 336 336
合金中Mg、Al的物质的量之比为_________。
二、氨
20世纪初,随着农业发展和军工生产的需要,科学家们先后开发、研究并实现了氨的工业生产,并从氛化法演变到合成氨法。
11.属于人工固氮的是_______(单选)。
A.工业合成氨 B.闪电时, 氮气转化为NO
C.用NH3和CO2合成尿素 D.用硫酸吸收氨气得到硫酸铵
12. 根据下表数据,写出合成氨的热化学方程式___________。
相关化学键的键能数据
化学键 N≡N H-H N-H
键能E / (kJ·mo1-1) 946 436.0 390.8
13.已知合成氨反应的△S=-198.9×10-3kJ/(mol·K),判断在300℃(573K)时反应是否能自发进行,计算说明理由___________。
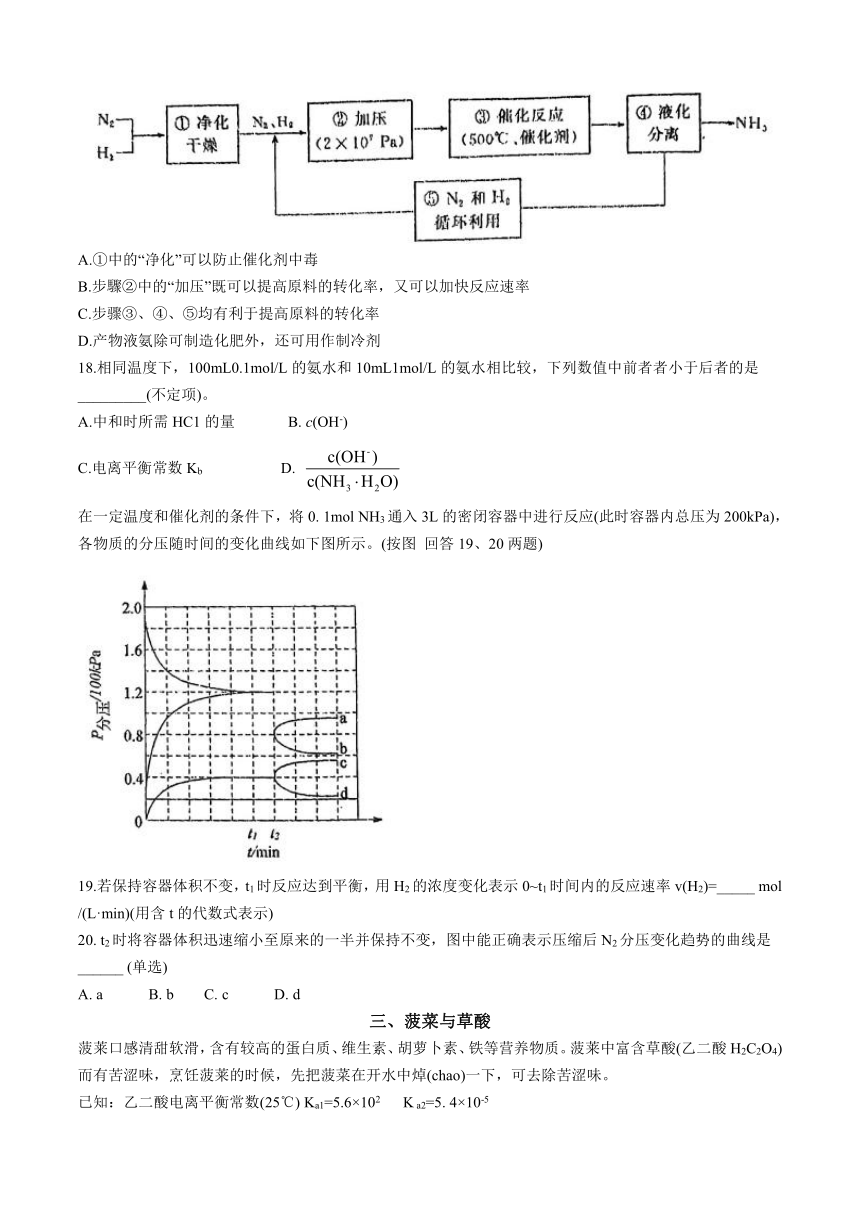
合成氨的反应历程如图所示,其中吸附在铁催化剂表面上的微粒用*标注,氮气在催化剂上的吸附活化是总反应中的控速步骤,适当提高氮气的浓度有利于合成氨反应的进行。
14.推测该反应的正逆反应的活化能:Ea(正)_____ Ea(逆)(单选)。
A.> B. = C. <
15.该反应历程中决定化学反应速率快慢的基元反应是__________(单选)。
A.生成过渡态1 B.生成过渡态2
C.生成过渡态3 D.生成过渡态4
16.实际生产中,合成氨反应过程中使用的原料气N2和H2物质的量之比为1:2.8, N2过量的原因是___________。
17.为工业合成氨的流程图,下列说法错误的是______ (不定项)。
A.①中的“净化”可以防止催化剂中毒
B.步驟②中的“加压”既可以提高原料的转化率,又可以加快反应速率
C.步骤③、④、⑤均有利于提高原料的转化率
D.产物液氨除可制造化肥外,还可用作制冷剂
18.相同温度下,100mL0.1mol/L的氨水和10mL1mol/L的氨水相比较,下列数值中前者者小于后者的是_________(不定项)。
A.中和时所需HC1的量 B. c(OH-)
C.电离平衡常数Kb D.
在一定温度和催化剂的条件下,将0. 1mol NH3通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如下图所示。(按图 回答19、20两题)
19.若保持容器体积不变,t1时反应达到平衡,用H2的浓度变化表示0~t1时间内的反应速率v(H2)=_____ mol /(L·min)(用含t的代数式表示)
20. t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是______ (单选)
A. a B. b C. c D. d
三、菠菜与草酸
菠莱口感清甜软滑,含有较高的蛋白质、维生素、胡萝卜素、铁等营养物质。菠莱中富含草酸(乙二酸H2C2O4)而有苦涩味,烹饪菠莱的时候,先把菠菜在开水中焯(chao)一下,可去除苦涩味。
已知:乙二酸电离平衡常数(25℃) Ka1=5.6×102 K a2=5. 4×10-5
草酸溶解度9. 5g/100g水(20℃) ;草酸钙Ksp=2.57×109 (25°C)
21.写出草酸在水中的电离方程式____________。
22.食用菠菜后,在胃部草酸主要的存在形式是_________(单选)
A. H2C2O4 B. C.
23.为什么烹饪菠菜把菠菜在开水中焯(chao)一下,可去除苦涩味 _________。
24.要使溶液中H2C2O4的电离程度增大,可以采取措施______(不定项)
A.加水 B.加热 C.加压 D.通入HC1气体
25.通过计算判断常温下(25℃) NaHC2O4溶液酸碱性________。
26.0. 1mol/L草酸溶液中c(H2C2O4)、c()、c()、c(H+)的大小_____(单选)
A.c(H2C2O4)> c()>c()>c(H+)
B.c(H2C2O4)>c(H+)> c()>c()
C.c()>c()>c(H+)>c(H2C2O4)
D.c(H+)>c()>c()>c(H2C2O4)
27.关于K2C2O4溶液中有关离子浓度的说法正确的是_____ (不定项)
A. c(K+)+c(H+)= 2 c()+c()+c(OH-)
B. 2c(K+)= c()+c()+c(H2C2O4)
C. c()+c(H2C2O4)+ c(H+)= [0H]
D.对溶液进行稀释,c()与c()的比值减小
28.25℃时, 在草酸钙(CaC2O4)的饱和溶液中存在平衡:CaC2O4(s)Ca2+(aq)+ (aq),下列说法错误的是_____(单选)
A.胃酸能使沉淀溶解平衡向右移动
B.加入少量CaCl2固体,溶液中浓度减小
C.加入少量CaCl2固体,溶度积常数Ksp减小
D. CaC2O4在 CaCl2 溶液中的溶解度比在水中小
29.为什么过量吃菠菜会造成人体缺钙 ________________。
30.若0.1mol/L的H2C2O4溶液中第二步电离的c(H+)=a mol/L,则0. mol/L的NaHC2O4溶液中电离出来的c(H+)__ a mol/L(单选)
A. = B. < C. >
四、草酸亚铁的制备
草酸亚铁是一种被广泛使用的化工原料,可用于染料、涂料、陶瓷、玻璃器皿等的着色剂、新型感光材料的生产,也是合成纳米磁性材料、超级电容器的多孔材料及锂离子电池磷酸铁锂正极材料所需的主要原材料。
实验室制备草酸亚铁并测定其中Fe2+和的物质的量之比确定其纯度,步骤如下:
I .称取一定质量的硫酸亚铁铵[ (NH4)2Fe(SO4)2]于烧杯中,加蒸馏水和稀硫酸,加热溶解,再加饱和H2C2O4溶液,加热沸腾数分钟,冷却、过滤、洗涤、晾干,得黄色晶体。
Ⅱ.称取m gI中制得的晶体于锥形瓶中,加入过量稀硫酸使其溶解,70℃水浴加热, 用cmol/LKMnO4溶液滴定至终点,消耗KMnO4溶液V1mL (其中所含杂质与KMnO4不反应)。
Ⅲ.向Ⅱ滴定后的溶液中加入过量锌粉和稀硫酸,煮沸,至反应完全,过滤,用cmo1/LKMnO4溶液滴定滤液至终点,消耗KMnO4溶液V2mL。
Ⅳ.重复上述实验3次,计算。
已知:①草酸有较强还原性。②pH>4 时,Fe2+易被O2氧化。③酸性条件下,KMnO4溶液的还原产物为近乎无色的Mn2+。
回答下列问题:
31.0.1mol/L(NH4)2Fe(SO4)2、(NH4)2SO4、NH4Cl和NH4HCO3溶液中, 浓度关系为__________(单选)。
A. (NH4)2Fe(SO4)2>(NH4)2SO4>NH4Cl >NH4HCO3
B. (NH4)2SO4>(NH4)2Fe(SO4)2>NH4Cl>NH4HCO3
C. ((NH4)2Fe(SO4)2=(NH4)2SO4>NH4Cl> NH4HCO3
D. (NH4)2SO4>(NH4)2Fe(SO4)2> NH4HCO3> NH4Cl
32. Ⅰ中加入稀硫酸的目的是____________。
33. Ⅱ中与KMnO4溶液反应的微粒是____________。
34.配平Ⅲ中反应的离子方程式:
____Fe2++__ +____ H+=_____Fe3++__ Mn2++_ H2O
35. Ⅲ中加入过量锌粉仅将Fe3+完全还原为Fe2+。若未除净过量锌粉,则消耗KMnO4溶液的体积V,比较大小V___ V2(单选)。
A. = B.< C. >
36.在标有“20℃,25mL”的滴定管内装液至刻度“0” 时,管内液体的体积____ (单选)
A.等于25mL B.大于25mL C.小于25mL D.无法确定
37.图分别是量简和滴定管的两个液面。下列有关读数正确的是_____ (单选)
A.量筒读数是6.5mL,滴定管读数是15.5mL
B.量筒读数是7. 5mL,滴定管读数是16.50mL
C.量简读数是6. 5mL,滴定管读數是15.50mL
D.量简读数是6. 5mL,滴定管读数是16.50mL
38. Ⅲ中滴定时,当_____即为滴定终点。
39.写出Fe2+离子结构示意图__________。
40. mgI中制得的晶体中,Fe2+和的物质的量之比是_____(用含V1、V2的计算式表示)。提示:5+2+16H+=10CO2↑+2Mn2++8H2O
五、有机
CPAE是蜂胶的主要活性成分,具有抗癌的作用。人工合成CPAE的一种路线如下:
已知:①A分子中苯环上一溴代物只有2种
②R1-CHO+ R2-CH2-CHO→
41.写出反应类型:反应①________,反应⑤______________。
42.写出结构简式:A__________,C___________。
43.在反应②中,1 mol C7H6O2Br最多消耗NaOH_______mol。
44.写出反应方程式;反应⑦_______________。
45.写出两种符合下列条件的E的同分异构体_________、___________。
①1 mol该物质与1 mol Na2CO3反应,生成1 mol CO2气体
②含有4种化学环境不同的氢原子
46.写出实验室用Y制备苯乙酮()的合成路线(不超过四步)
(合成路线常用的表示方式为:AB……目标产物)。
化学试卷
(考试时间60分钟 满分100 分)
相对原子质量:Mg-24 A1-27
一、镁
海洋中蕴藏着多种金属元素的资源,例如,海水中镁的含量仅次于氯和钠,位居第三,总储量约为1.8×1016t。镁用途广泛,用海水提取金属镁,成本较低,其流程如下图所示:
已知:MgO熔点2852℃,沸点3600℃, 0℃溶解度0. 00062 g/100g 水; MgC12熔点714℃,沸点1412℃,0℃溶解度59.5 g/100g 水。
1.获取Mg (OH)2用石灰乳而不用NaOH溶液的原因是___________。
2.已知:Ca(OH) 2微溶于水,Mg (OH)2难溶于水。为除去Mg (OH)2沉淀中混有少量Ca(OH) 2,先将沉淀加入到_____溶液浸洗,再经过滤、洗涤可得较纯净的Mg(OH)2。
3.上述流程中用过量盐酸溶解氢氧化镁的原因是:_____________。
4.已知Mg (OH)2的Ksp=5.6×10-12(25℃),则溶液中镁离子沉淀完全时pH=_
5.从MgCl2溶液获得MgCl2·6H2O操作步骤包括:_______________。
6.如要得到无水氯化镁需在干燥的HCl气流中加热MgCl2·6H2O,HC1作用是________。
7.写出MgC12制Mg的化学方程式___________。
8.不用MgO制Mg是因为_____________。
9. NH4Cl溶液中放入镁粉能放出H2和NH3,产生这种现象的原因是__________(不定项)
A.金属镁把NH3置换出来
B.镁具有强还原性,具有氧化性,发生氧化还原反应
C.因为水解后溶液显酸性,Mg与H+反应放出H2,平衡向正反应方向移动
D.因为Mg与水反应,生成的Mg (OH)2与NH4Cl反应
10.在标准状况下进行甲、乙、丙三组实验:三组各取30. 0 mL同浓度的盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
实验序号 甲 乙 丙
合金质量/mg 255 385 459
产生气体体积/mL 280 336 336
合金中Mg、Al的物质的量之比为_________。
二、氨
20世纪初,随着农业发展和军工生产的需要,科学家们先后开发、研究并实现了氨的工业生产,并从氛化法演变到合成氨法。
11.属于人工固氮的是_______(单选)。
A.工业合成氨 B.闪电时, 氮气转化为NO
C.用NH3和CO2合成尿素 D.用硫酸吸收氨气得到硫酸铵
12. 根据下表数据,写出合成氨的热化学方程式___________。
相关化学键的键能数据
化学键 N≡N H-H N-H
键能E / (kJ·mo1-1) 946 436.0 390.8
13.已知合成氨反应的△S=-198.9×10-3kJ/(mol·K),判断在300℃(573K)时反应是否能自发进行,计算说明理由___________。
合成氨的反应历程如图所示,其中吸附在铁催化剂表面上的微粒用*标注,氮气在催化剂上的吸附活化是总反应中的控速步骤,适当提高氮气的浓度有利于合成氨反应的进行。
14.推测该反应的正逆反应的活化能:Ea(正)_____ Ea(逆)(单选)。
A.> B. = C. <
15.该反应历程中决定化学反应速率快慢的基元反应是__________(单选)。
A.生成过渡态1 B.生成过渡态2
C.生成过渡态3 D.生成过渡态4
16.实际生产中,合成氨反应过程中使用的原料气N2和H2物质的量之比为1:2.8, N2过量的原因是___________。
17.为工业合成氨的流程图,下列说法错误的是______ (不定项)。
A.①中的“净化”可以防止催化剂中毒
B.步驟②中的“加压”既可以提高原料的转化率,又可以加快反应速率
C.步骤③、④、⑤均有利于提高原料的转化率
D.产物液氨除可制造化肥外,还可用作制冷剂
18.相同温度下,100mL0.1mol/L的氨水和10mL1mol/L的氨水相比较,下列数值中前者者小于后者的是_________(不定项)。
A.中和时所需HC1的量 B. c(OH-)
C.电离平衡常数Kb D.
在一定温度和催化剂的条件下,将0. 1mol NH3通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如下图所示。(按图 回答19、20两题)
19.若保持容器体积不变,t1时反应达到平衡,用H2的浓度变化表示0~t1时间内的反应速率v(H2)=_____ mol /(L·min)(用含t的代数式表示)
20. t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是______ (单选)
A. a B. b C. c D. d
三、菠菜与草酸
菠莱口感清甜软滑,含有较高的蛋白质、维生素、胡萝卜素、铁等营养物质。菠莱中富含草酸(乙二酸H2C2O4)而有苦涩味,烹饪菠莱的时候,先把菠菜在开水中焯(chao)一下,可去除苦涩味。
已知:乙二酸电离平衡常数(25℃) Ka1=5.6×102 K a2=5. 4×10-5
草酸溶解度9. 5g/100g水(20℃) ;草酸钙Ksp=2.57×109 (25°C)
21.写出草酸在水中的电离方程式____________。
22.食用菠菜后,在胃部草酸主要的存在形式是_________(单选)
A. H2C2O4 B. C.
23.为什么烹饪菠菜把菠菜在开水中焯(chao)一下,可去除苦涩味 _________。
24.要使溶液中H2C2O4的电离程度增大,可以采取措施______(不定项)
A.加水 B.加热 C.加压 D.通入HC1气体
25.通过计算判断常温下(25℃) NaHC2O4溶液酸碱性________。
26.0. 1mol/L草酸溶液中c(H2C2O4)、c()、c()、c(H+)的大小_____(单选)
A.c(H2C2O4)> c()>c()>c(H+)
B.c(H2C2O4)>c(H+)> c()>c()
C.c()>c()>c(H+)>c(H2C2O4)
D.c(H+)>c()>c()>c(H2C2O4)
27.关于K2C2O4溶液中有关离子浓度的说法正确的是_____ (不定项)
A. c(K+)+c(H+)= 2 c()+c()+c(OH-)
B. 2c(K+)= c()+c()+c(H2C2O4)
C. c()+c(H2C2O4)+ c(H+)= [0H]
D.对溶液进行稀释,c()与c()的比值减小
28.25℃时, 在草酸钙(CaC2O4)的饱和溶液中存在平衡:CaC2O4(s)Ca2+(aq)+ (aq),下列说法错误的是_____(单选)
A.胃酸能使沉淀溶解平衡向右移动
B.加入少量CaCl2固体,溶液中浓度减小
C.加入少量CaCl2固体,溶度积常数Ksp减小
D. CaC2O4在 CaCl2 溶液中的溶解度比在水中小
29.为什么过量吃菠菜会造成人体缺钙 ________________。
30.若0.1mol/L的H2C2O4溶液中第二步电离的c(H+)=a mol/L,则0. mol/L的NaHC2O4溶液中电离出来的c(H+)__ a mol/L(单选)
A. = B. < C. >
四、草酸亚铁的制备
草酸亚铁是一种被广泛使用的化工原料,可用于染料、涂料、陶瓷、玻璃器皿等的着色剂、新型感光材料的生产,也是合成纳米磁性材料、超级电容器的多孔材料及锂离子电池磷酸铁锂正极材料所需的主要原材料。
实验室制备草酸亚铁并测定其中Fe2+和的物质的量之比确定其纯度,步骤如下:
I .称取一定质量的硫酸亚铁铵[ (NH4)2Fe(SO4)2]于烧杯中,加蒸馏水和稀硫酸,加热溶解,再加饱和H2C2O4溶液,加热沸腾数分钟,冷却、过滤、洗涤、晾干,得黄色晶体。
Ⅱ.称取m gI中制得的晶体于锥形瓶中,加入过量稀硫酸使其溶解,70℃水浴加热, 用cmol/LKMnO4溶液滴定至终点,消耗KMnO4溶液V1mL (其中所含杂质与KMnO4不反应)。
Ⅲ.向Ⅱ滴定后的溶液中加入过量锌粉和稀硫酸,煮沸,至反应完全,过滤,用cmo1/LKMnO4溶液滴定滤液至终点,消耗KMnO4溶液V2mL。
Ⅳ.重复上述实验3次,计算。
已知:①草酸有较强还原性。②pH>4 时,Fe2+易被O2氧化。③酸性条件下,KMnO4溶液的还原产物为近乎无色的Mn2+。
回答下列问题:
31.0.1mol/L(NH4)2Fe(SO4)2、(NH4)2SO4、NH4Cl和NH4HCO3溶液中, 浓度关系为__________(单选)。
A. (NH4)2Fe(SO4)2>(NH4)2SO4>NH4Cl >NH4HCO3
B. (NH4)2SO4>(NH4)2Fe(SO4)2>NH4Cl>NH4HCO3
C. ((NH4)2Fe(SO4)2=(NH4)2SO4>NH4Cl> NH4HCO3
D. (NH4)2SO4>(NH4)2Fe(SO4)2> NH4HCO3> NH4Cl
32. Ⅰ中加入稀硫酸的目的是____________。
33. Ⅱ中与KMnO4溶液反应的微粒是____________。
34.配平Ⅲ中反应的离子方程式:
____Fe2++__ +____ H+=_____Fe3++__ Mn2++_ H2O
35. Ⅲ中加入过量锌粉仅将Fe3+完全还原为Fe2+。若未除净过量锌粉,则消耗KMnO4溶液的体积V,比较大小V___ V2(单选)。
A. = B.< C. >
36.在标有“20℃,25mL”的滴定管内装液至刻度“0” 时,管内液体的体积____ (单选)
A.等于25mL B.大于25mL C.小于25mL D.无法确定
37.图分别是量简和滴定管的两个液面。下列有关读数正确的是_____ (单选)
A.量筒读数是6.5mL,滴定管读数是15.5mL
B.量筒读数是7. 5mL,滴定管读数是16.50mL
C.量简读数是6. 5mL,滴定管读數是15.50mL
D.量简读数是6. 5mL,滴定管读数是16.50mL
38. Ⅲ中滴定时,当_____即为滴定终点。
39.写出Fe2+离子结构示意图__________。
40. mgI中制得的晶体中,Fe2+和的物质的量之比是_____(用含V1、V2的计算式表示)。提示:5+2+16H+=10CO2↑+2Mn2++8H2O
五、有机
CPAE是蜂胶的主要活性成分,具有抗癌的作用。人工合成CPAE的一种路线如下:
已知:①A分子中苯环上一溴代物只有2种
②R1-CHO+ R2-CH2-CHO→
41.写出反应类型:反应①________,反应⑤______________。
42.写出结构简式:A__________,C___________。
43.在反应②中,1 mol C7H6O2Br最多消耗NaOH_______mol。
44.写出反应方程式;反应⑦_______________。
45.写出两种符合下列条件的E的同分异构体_________、___________。
①1 mol该物质与1 mol Na2CO3反应,生成1 mol CO2气体
②含有4种化学环境不同的氢原子
46.写出实验室用Y制备苯乙酮()的合成路线(不超过四步)
(合成路线常用的表示方式为:AB……目标产物)。
同课章节目录
