江苏省淮安市2023-2024学年高二下学期期末调研测试化学模拟试卷(含答案)
文档属性
| 名称 | 江苏省淮安市2023-2024学年高二下学期期末调研测试化学模拟试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-18 19:21:09 | ||
图片预览

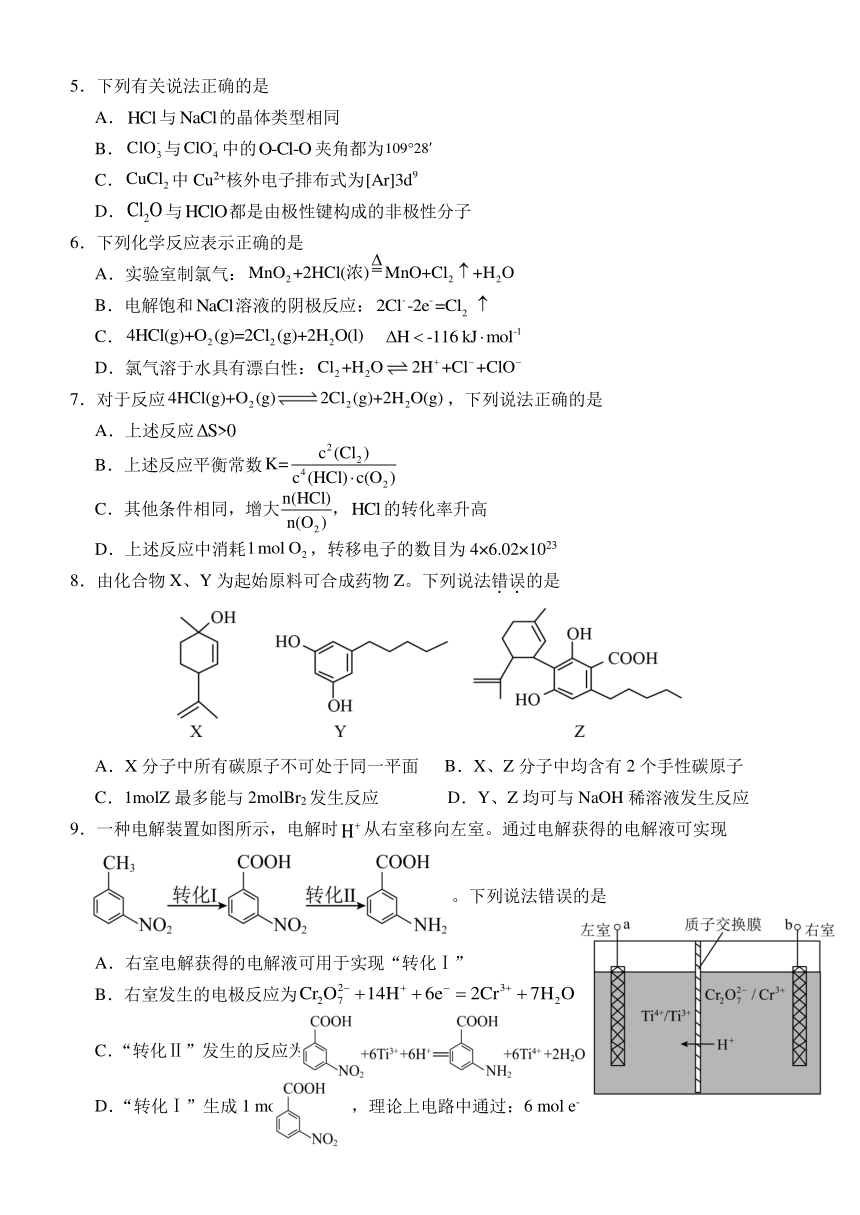
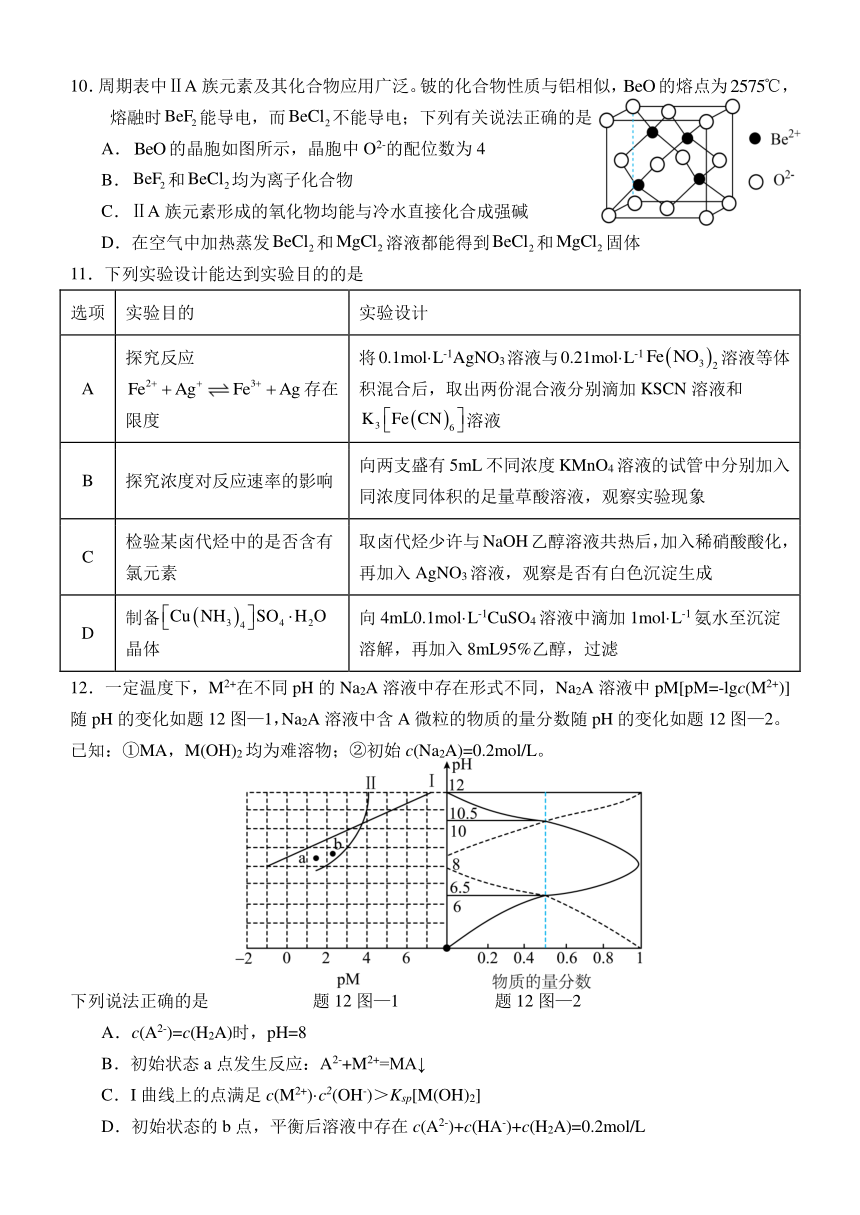
文档简介
淮安市2023-2024学年高二下学期期末调研测试化学模拟试卷
2024.05
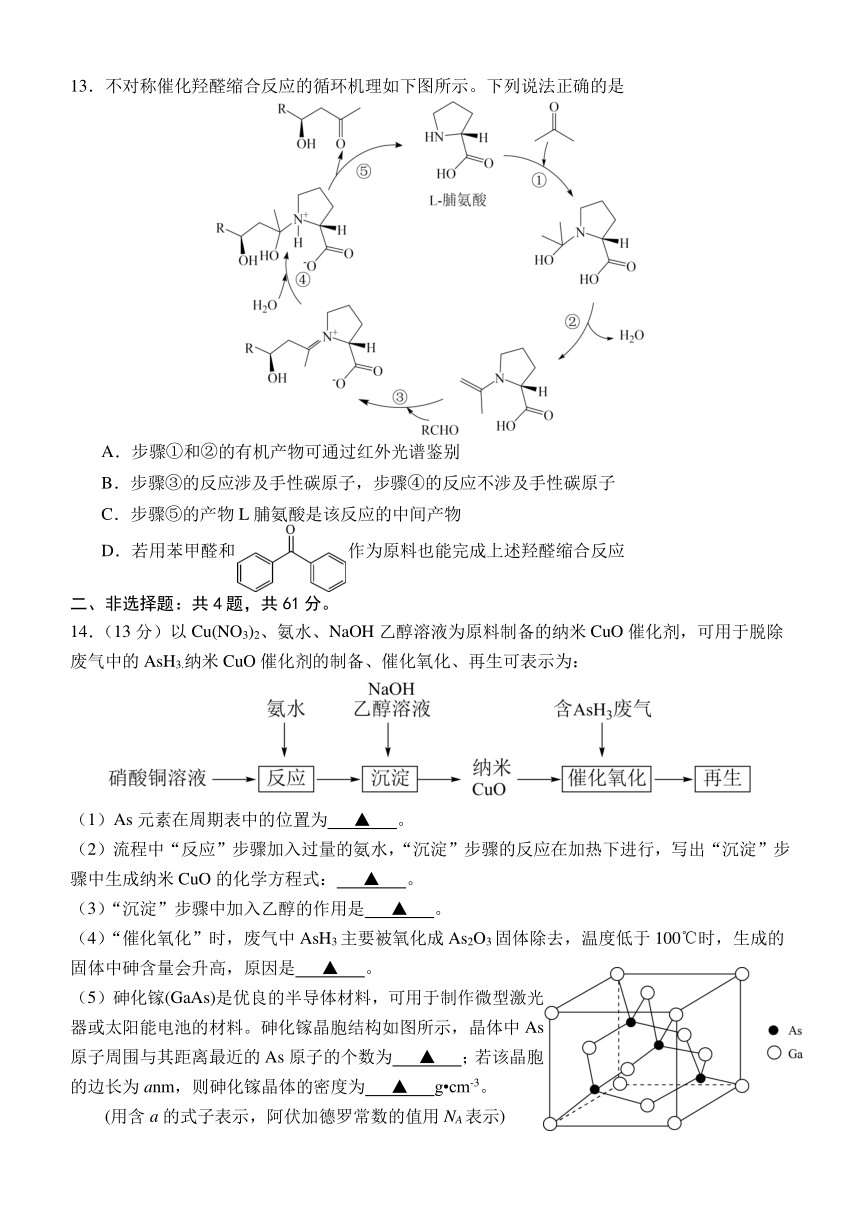
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32
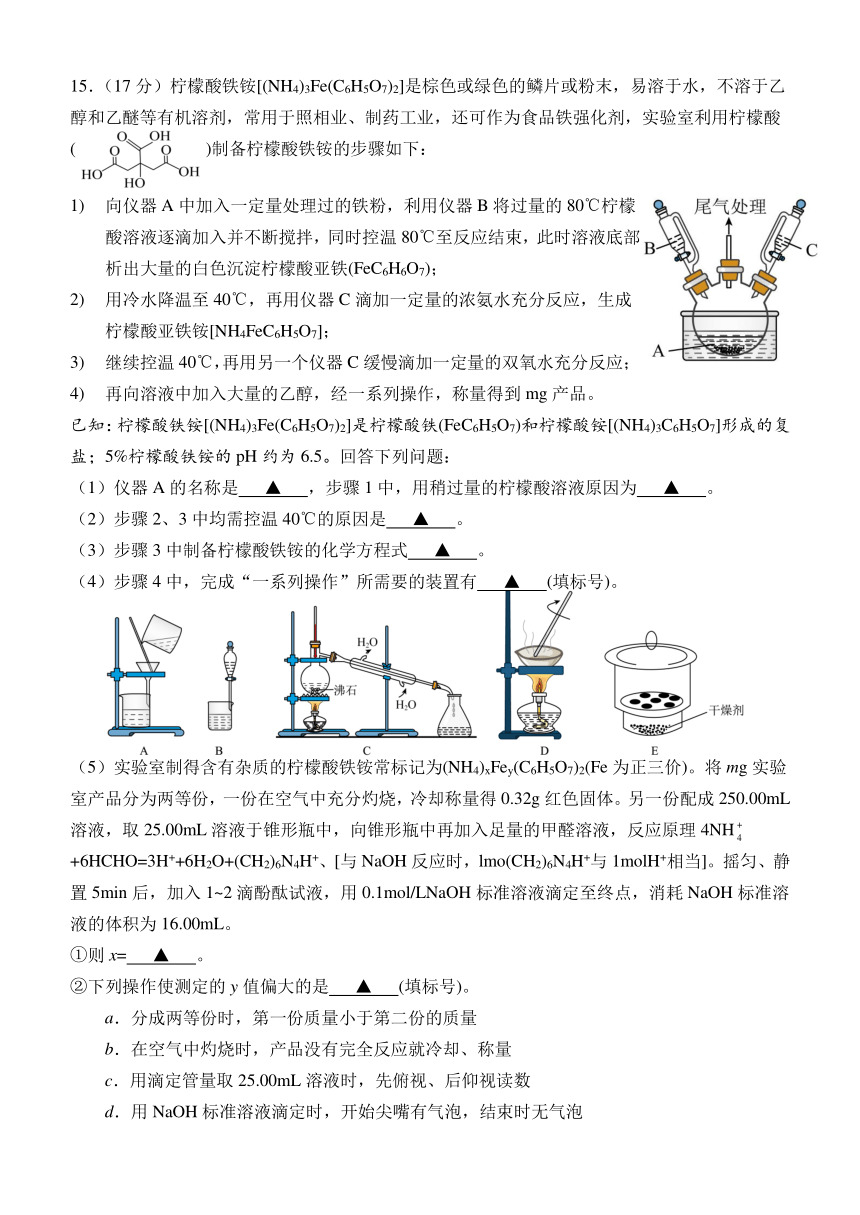
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1.化学与生产、生活密切相关。下列说法不正确的是
A.我国成功研制出多款新冠疫苗,采用冷链运输疫苗,可以防止蛋白质变性
B.用聚乳酸塑料代替聚乙烯塑料,可以减少温室效应
C.北斗卫星导航系统由中国自主研发、独立运行,其所用芯片的主要成分为Si
D.“神舟13号”宇宙飞船返回舱所用高温结构陶瓷,属于新型无机非金属材料
2.反应可以除去天然气中的。下列说法正确的是
A.为非极性分子 B.的电子式为
C.的空间构型为平面正方形 D.反应中作氧化剂
3.下列由废易拉罐制取的实验原理与装置不能达到实验目的的是
A.用装置甲溶解废易拉罐细屑 B.用装置乙过滤得到Na[Al(OH)4]溶液
C.用装置丙制取沉淀 D.用装置丁灼烧制取
4.工业上分别用Mg、C还原SiO2可得无定形硅、晶体硅。下列说法正确的是
A.硅单质属于极性分子 B.酸性:H2CO3<H2SiO3
C.电负性:x(O)<x(Mg) D.电离能:I1(O)<I1(Mg)
阅读下列材料,完成5~7题。
含氯化合物在生产生活中应用广泛。舍勒发现将软锰矿和浓盐酸混合加热可产生氯气,该方法仍是当今实验室制备氯气的主要方法之一,工业上以NaCl为原料可制得Cl2、Cl2O、HClO、和等。在催化剂作用下,通过氧气直接氧化氯化氢制备氯气。该反应为可逆反应,热化学方程式为 。
5.下列有关说法正确的是
A.与的晶体类型相同
B.与中的夹角都为
C.中Cu2+核外电子排布式为
D.与都是由极性键构成的非极性分子
6.下列化学反应表示正确的是
A.实验室制氯气:
B.电解饱和溶液的阴极反应:
C.
D.氯气溶于水具有漂白性:
7.对于反应,下列说法正确的是
A.上述反应
B.上述反应平衡常数
C.其他条件相同,增大 ,的转化率升高
D.上述反应中消耗,转移电子的数目为4×6.02×1023
8.由化合物X、Y为起始原料可合成药物Z。下列说法错误的是
A.X分子中所有碳原子不可处于同一平面 B.X、Z分子中均含有2个手性碳原子
C.1molZ最多能与2molBr2发生反应 D.Y、Z均可与NaOH稀溶液发生反应
9.一种电解装置如图所示,电解时从右室移向左室。通过电解获得的电解液可实现
。下列说法错误的是
A.右室电解获得的电解液可用于实现“转化Ⅰ”
B.右室发生的电极反应为
C.“转化Ⅱ”发生的反应为
D.“转化Ⅰ”生成1 mol ,理论上电路中通过:6 mol e-
10.周期表中ⅡA族元素及其化合物应用广泛。铍的化合物性质与铝相似,的熔点为,熔融时能导电,而不能导电;下列有关说法正确的是
A.的晶胞如图所示,晶胞中O2-的配位数为4
B.和均为离子化合物
C.ⅡA族元素形成的氧化物均能与冷水直接化合成强碱
D.在空气中加热蒸发和溶液都能得到和固体
11.下列实验设计能达到实验目的的是
选项 实验目的 实验设计
A 探究反应存在限度 将0.1mol·L-1AgNO3溶液与0.21mol·L-1溶液等体积混合后,取出两份混合液分别滴加KSCN溶液和溶液
B 探究浓度对反应速率的影响 向两支盛有5mL不同浓度KMnO4溶液的试管中分别加入同浓度同体积的足量草酸溶液,观察实验现象
C 检验某卤代烃中的是否含有氯元素 取卤代烃少许与NaOH乙醇溶液共热后,加入稀硝酸酸化,再加入AgNO3溶液,观察是否有白色沉淀生成
D 制备晶体 向4mL0.1mol·L-1CuSO4溶液中滴加1mol·L-1氨水至沉淀溶解,再加入8mL95%乙醇,过滤
12.一定温度下,M2+在不同pH的Na2A溶液中存在形式不同,Na2A溶液中pM[pM=-lgc(M2+)]随pH的变化如题12图—1,Na2A溶液中含A微粒的物质的量分数随pH的变化如题12图—2。
已知:①MA,M(OH)2均为难溶物;②初始c(Na2A)=0.2mol/L。
下列说法正确的是 题12图—1 题12图—2
A.c(A2-)=c(H2A)时,pH=8
B.初始状态a点发生反应:A2-+M2+=MA↓
C.I曲线上的点满足c(M2+)·c2(OH-)>Ksp[M(OH)2]
D.初始状态的b点,平衡后溶液中存在c(A2-)+c(HA-)+c(H2A)=0.2mol/L
13.不对称催化羟醛缩合反应的循环机理如下图所示。下列说法正确的是
A.步骤①和②的有机产物可通过红外光谱鉴别
B.步骤③的反应涉及手性碳原子,步骤④的反应不涉及手性碳原子
C.步骤⑤的产物L脯氨酸是该反应的中间产物
D.若用苯甲醛和 作为原料也能完成上述羟醛缩合反应
二、非选择题:共4题,共61分。
14.(13分)以Cu(NO3)2、氨水、NaOH乙醇溶液为原料制备的纳米CuO催化剂,可用于脱除废气中的AsH3.纳米CuO催化剂的制备、催化氧化、再生可表示为:
(1)As元素在周期表中的位置为 ▲ 。
(2)流程中“反应”步骤加入过量的氨水,“沉淀”步骤的反应在加热下进行,写出“沉淀”步骤中生成纳米CuO的化学方程式: ▲ 。
(3)“沉淀”步骤中加入乙醇的作用是 ▲ 。
(4)“催化氧化”时,废气中AsH3主要被氧化成As2O3固体除去,温度低于100℃时,生成的固体中砷含量会升高,原因是 ▲ 。
(5)砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料。砷化镓晶胞结构如图所示,晶体中As原子周围与其距离最近的As原子的个数为 ▲ ;若该晶胞的边长为anm,则砷化镓晶体的密度为 ▲ g cm-3。
(用含a的式子表示,阿伏加德罗常数的值用NA表示)
15.(17分)柠檬酸铁铵[(NH4)3Fe(C6H5O7)2]是棕色或绿色的鳞片或粉末,易溶于水,不溶于乙醇和乙醚等有机溶剂,常用于照相业、制药工业,还可作为食品铁强化剂,实验室利用柠檬酸( )制备柠檬酸铁铵的步骤如下:
向仪器A中加入一定量处理过的铁粉,利用仪器B将过量的80℃柠檬酸溶液逐滴加入并不断搅拌,同时控温80℃至反应结束,此时溶液底部析出大量的白色沉淀柠檬酸亚铁(FeC6H6O7);
用冷水降温至40℃,再用仪器C滴加一定量的浓氨水充分反应,生成柠檬酸亚铁铵[NH4FeC6H5O7];
继续控温40℃,再用另一个仪器C缓慢滴加一定量的双氧水充分反应;
再向溶液中加入大量的乙醇,经一系列操作,称量得到mg产品。
已知:柠檬酸铁铵[(NH4)3Fe(C6H5O7)2]是柠檬酸铁(FeC6H5O7)和柠檬酸铵[(NH4)3C6H5O7]形成的复盐;5%柠檬酸铁铵的pH约为6.5。回答下列问题:
(1)仪器A的名称是 ▲ ,步骤1中,用稍过量的柠檬酸溶液原因为 ▲ 。
(2)步骤2、3中均需控温40℃的原因是 ▲ 。
(3)步骤3中制备柠檬酸铁铵的化学方程式 ▲ 。
(4)步骤4中,完成“一系列操作”所需要的装置有 ▲ (填标号)。
(5)实验室制得含有杂质的柠檬酸铁铵常标记为(NH4)xFey(C6H5O7)2(Fe为正三价)。将mg实验室产品分为两等份,一份在空气中充分灼烧,冷却称量得0.32g红色固体。另一份配成250.00mL溶液,取25.00mL溶液于锥形瓶中,向锥形瓶中再加入足量的甲醛溶液,反应原理4NH+6HCHO=3H++6H2O+(CH2)6N4H+、[与NaOH反应时,lmo(CH2)6N4H+与1molH+相当]。摇匀、静置5min后,加入1~2滴酚酞试液,用0.1mol/LNaOH标准溶液滴定至终点,消耗NaOH标准溶液的体积为16.00mL。
①则x= ▲ 。
②下列操作使测定的y值偏大的是 ▲ (填标号)。
a.分成两等份时,第一份质量小于第二份的质量
b.在空气中灼烧时,产品没有完全反应就冷却、称量
c.用滴定管量取25.00mL溶液时,先俯视、后仰视读数
d.用NaOH标准溶液滴定时,开始尖嘴有气泡,结束时无气泡
16.(16分)化合物F(普瑞巴林)是一种治疗神经痛的药物。其合成路线如下:
(1)在催化剂作用下,烃X和CO、H2化合生成A,则X的结构简式是 ▲ ;
(2)B分子中碳原子的杂化方式为 ▲ ;F中官能团名称是 ▲ ;
(3)E→F的化学方程式是 ▲ ;
(4)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式 ▲ ;
①该分子为环状结构,分子中含有碳碳双键和羟基;
②分子中不同化学环境的氢原子数目比为1∶2∶2∶1。
(5)3-苯基丙烯酸乙酯()是一种重要的医药中间体。设计以丙二酸、乙醇和甲苯为原料制备3-苯基丙烯酸乙酯的合成路线。
(无机试剂和有机溶剂任用,合成路线见本题题干)
17.(15分)中国首次实现了利用二氧化碳人工合成淀粉,为全球的“碳达峰”、“碳中和”起到重大的支撑作用,研究二氧化碳的收集和利用成为了科研方面的热点。
(1)工业利用加氢制二甲醚的反应体系中,主要发生反应的热化学方程式为
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
在,起始投料 时,的平衡转化率及CH3OCH3和的平衡体积分数随温度变化如题17图—1所示。
题17图—1
①从453-553℃,升高温度平衡转化率降低的原因是 ▲ 。
②为提高单位时间内CH3OCH3产率。研发的催化剂需具备的特点是 ▲ 。
(2)在熔融中电解还原为正丙醇(CH3CH2CH2OH)的阴极反应式为 ▲ 。
(3)科研人员研究出在催化剂上氢化合成甲醇的反应历程如题17图—2所示,反应③的化学方程式为 ▲ 。
题17图—2
(4)和环氧乙烷在作催化剂的条件下合成碳酸乙烯酯。
①溶液中加入尿素[CO(NH2)2]生成沉淀。与沉淀剂(尿素、氢氧化钠)反应生成沉淀,过滤后将沉淀焙烧得到。与氢氧化钠作沉淀剂相比,用尿素作沉淀剂焙烧生成的作催化剂效果更好,其原因是 ▲ 。
②催化合成碳酸乙烯酯( )可能的反应机理如题17图—3所示,根据元素电负性的变化规律,步骤Ⅰ、Ⅱ的过程可描述为 ▲ 。
题17图—3
化学模拟试题参考答案 2024.05
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1 2 3 4 5 6 7 8 9 10
B D D A C C D C B A
11 12 13
D B A
二、非选择题:共4题,共61分。
14.(13分)
(1)第4周期VA族(2分)
(2)[Cu(NH3)4](NO3)2+2NaOHCuO↓+2NaNO3+4NH3↑+H2O (2分)
(注:化学式写错不得分,方程式系数配平错误或未配平扣1分)
(3)有利于除去纳米CuO表面吸附的NaNO3,使生成的纳米CuO颗粒更均匀 (2分)
(4)生成As单质 (2分) (5)12 (2分) ×1021 (3分)
15.(17分)
(1)三颈烧瓶(2分) 使铁粉完全转化为柠檬酸亚铁、柠檬酸抑制亚铁离子水解、与后续加入的氨水反应生成柠檬酸铵。(3分)
(2)温度低于40℃化学反应速率慢,高于40℃双氧水和氨水发生分解反应而损耗。(2分)
(3) (3分)
(4)AE(2分) (5)1.5 (3分) bc (2分)(注:字母大写不得分,错选不得分。)
16.(16分)
(1) (2分)
(2)sp2、sp3 (2分) 氨基、羧基 (2分)
(3) (2分)
(4) 或 (3分)
(5)
(注:5分,如果条件明显错误,熔断;仅少加热符号扣1分,其他评分参照执行;其他合理答案参照给分)
17.(15分)
(1)①在温度为453-553℃范围内,反应Ⅰ为吸热反应,温度升高平衡正向移动,平衡转化率增大;(1分)反应Ⅱ为放热反应,温度升高平衡逆向移动,平衡转化率降低;(1分)温度对反应Ⅱ的影响大于温度对反应Ⅰ的影响,从而导致平衡转化率降低(1分)
②在较低温度下催化活性较强(2分)
(2) (2分)
(3) (3分)
(4)①焙烧释放更多的气体,制得的更加疏松多孔(或比表面积大,2分)
②环氧乙烷中带部分负电荷的原子吸附在上;(1分)形成键的同时使环氧乙烷中的键断裂;(1分)中的带部分正电荷的原子与结合;带部分负电荷的原子与环氧乙烷中的带部分正电荷的一个原子结合,形成碳氧键。(1分)
2024.05
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1.化学与生产、生活密切相关。下列说法不正确的是
A.我国成功研制出多款新冠疫苗,采用冷链运输疫苗,可以防止蛋白质变性
B.用聚乳酸塑料代替聚乙烯塑料,可以减少温室效应
C.北斗卫星导航系统由中国自主研发、独立运行,其所用芯片的主要成分为Si
D.“神舟13号”宇宙飞船返回舱所用高温结构陶瓷,属于新型无机非金属材料
2.反应可以除去天然气中的。下列说法正确的是
A.为非极性分子 B.的电子式为
C.的空间构型为平面正方形 D.反应中作氧化剂
3.下列由废易拉罐制取的实验原理与装置不能达到实验目的的是
A.用装置甲溶解废易拉罐细屑 B.用装置乙过滤得到Na[Al(OH)4]溶液
C.用装置丙制取沉淀 D.用装置丁灼烧制取
4.工业上分别用Mg、C还原SiO2可得无定形硅、晶体硅。下列说法正确的是
A.硅单质属于极性分子 B.酸性:H2CO3<H2SiO3
C.电负性:x(O)<x(Mg) D.电离能:I1(O)<I1(Mg)
阅读下列材料,完成5~7题。
含氯化合物在生产生活中应用广泛。舍勒发现将软锰矿和浓盐酸混合加热可产生氯气,该方法仍是当今实验室制备氯气的主要方法之一,工业上以NaCl为原料可制得Cl2、Cl2O、HClO、和等。在催化剂作用下,通过氧气直接氧化氯化氢制备氯气。该反应为可逆反应,热化学方程式为 。
5.下列有关说法正确的是
A.与的晶体类型相同
B.与中的夹角都为
C.中Cu2+核外电子排布式为
D.与都是由极性键构成的非极性分子
6.下列化学反应表示正确的是
A.实验室制氯气:
B.电解饱和溶液的阴极反应:
C.
D.氯气溶于水具有漂白性:
7.对于反应,下列说法正确的是
A.上述反应
B.上述反应平衡常数
C.其他条件相同,增大 ,的转化率升高
D.上述反应中消耗,转移电子的数目为4×6.02×1023
8.由化合物X、Y为起始原料可合成药物Z。下列说法错误的是
A.X分子中所有碳原子不可处于同一平面 B.X、Z分子中均含有2个手性碳原子
C.1molZ最多能与2molBr2发生反应 D.Y、Z均可与NaOH稀溶液发生反应
9.一种电解装置如图所示,电解时从右室移向左室。通过电解获得的电解液可实现
。下列说法错误的是
A.右室电解获得的电解液可用于实现“转化Ⅰ”
B.右室发生的电极反应为
C.“转化Ⅱ”发生的反应为
D.“转化Ⅰ”生成1 mol ,理论上电路中通过:6 mol e-
10.周期表中ⅡA族元素及其化合物应用广泛。铍的化合物性质与铝相似,的熔点为,熔融时能导电,而不能导电;下列有关说法正确的是
A.的晶胞如图所示,晶胞中O2-的配位数为4
B.和均为离子化合物
C.ⅡA族元素形成的氧化物均能与冷水直接化合成强碱
D.在空气中加热蒸发和溶液都能得到和固体
11.下列实验设计能达到实验目的的是
选项 实验目的 实验设计
A 探究反应存在限度 将0.1mol·L-1AgNO3溶液与0.21mol·L-1溶液等体积混合后,取出两份混合液分别滴加KSCN溶液和溶液
B 探究浓度对反应速率的影响 向两支盛有5mL不同浓度KMnO4溶液的试管中分别加入同浓度同体积的足量草酸溶液,观察实验现象
C 检验某卤代烃中的是否含有氯元素 取卤代烃少许与NaOH乙醇溶液共热后,加入稀硝酸酸化,再加入AgNO3溶液,观察是否有白色沉淀生成
D 制备晶体 向4mL0.1mol·L-1CuSO4溶液中滴加1mol·L-1氨水至沉淀溶解,再加入8mL95%乙醇,过滤
12.一定温度下,M2+在不同pH的Na2A溶液中存在形式不同,Na2A溶液中pM[pM=-lgc(M2+)]随pH的变化如题12图—1,Na2A溶液中含A微粒的物质的量分数随pH的变化如题12图—2。
已知:①MA,M(OH)2均为难溶物;②初始c(Na2A)=0.2mol/L。
下列说法正确的是 题12图—1 题12图—2
A.c(A2-)=c(H2A)时,pH=8
B.初始状态a点发生反应:A2-+M2+=MA↓
C.I曲线上的点满足c(M2+)·c2(OH-)>Ksp[M(OH)2]
D.初始状态的b点,平衡后溶液中存在c(A2-)+c(HA-)+c(H2A)=0.2mol/L
13.不对称催化羟醛缩合反应的循环机理如下图所示。下列说法正确的是
A.步骤①和②的有机产物可通过红外光谱鉴别
B.步骤③的反应涉及手性碳原子,步骤④的反应不涉及手性碳原子
C.步骤⑤的产物L脯氨酸是该反应的中间产物
D.若用苯甲醛和 作为原料也能完成上述羟醛缩合反应
二、非选择题:共4题,共61分。
14.(13分)以Cu(NO3)2、氨水、NaOH乙醇溶液为原料制备的纳米CuO催化剂,可用于脱除废气中的AsH3.纳米CuO催化剂的制备、催化氧化、再生可表示为:
(1)As元素在周期表中的位置为 ▲ 。
(2)流程中“反应”步骤加入过量的氨水,“沉淀”步骤的反应在加热下进行,写出“沉淀”步骤中生成纳米CuO的化学方程式: ▲ 。
(3)“沉淀”步骤中加入乙醇的作用是 ▲ 。
(4)“催化氧化”时,废气中AsH3主要被氧化成As2O3固体除去,温度低于100℃时,生成的固体中砷含量会升高,原因是 ▲ 。
(5)砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料。砷化镓晶胞结构如图所示,晶体中As原子周围与其距离最近的As原子的个数为 ▲ ;若该晶胞的边长为anm,则砷化镓晶体的密度为 ▲ g cm-3。
(用含a的式子表示,阿伏加德罗常数的值用NA表示)
15.(17分)柠檬酸铁铵[(NH4)3Fe(C6H5O7)2]是棕色或绿色的鳞片或粉末,易溶于水,不溶于乙醇和乙醚等有机溶剂,常用于照相业、制药工业,还可作为食品铁强化剂,实验室利用柠檬酸( )制备柠檬酸铁铵的步骤如下:
向仪器A中加入一定量处理过的铁粉,利用仪器B将过量的80℃柠檬酸溶液逐滴加入并不断搅拌,同时控温80℃至反应结束,此时溶液底部析出大量的白色沉淀柠檬酸亚铁(FeC6H6O7);
用冷水降温至40℃,再用仪器C滴加一定量的浓氨水充分反应,生成柠檬酸亚铁铵[NH4FeC6H5O7];
继续控温40℃,再用另一个仪器C缓慢滴加一定量的双氧水充分反应;
再向溶液中加入大量的乙醇,经一系列操作,称量得到mg产品。
已知:柠檬酸铁铵[(NH4)3Fe(C6H5O7)2]是柠檬酸铁(FeC6H5O7)和柠檬酸铵[(NH4)3C6H5O7]形成的复盐;5%柠檬酸铁铵的pH约为6.5。回答下列问题:
(1)仪器A的名称是 ▲ ,步骤1中,用稍过量的柠檬酸溶液原因为 ▲ 。
(2)步骤2、3中均需控温40℃的原因是 ▲ 。
(3)步骤3中制备柠檬酸铁铵的化学方程式 ▲ 。
(4)步骤4中,完成“一系列操作”所需要的装置有 ▲ (填标号)。
(5)实验室制得含有杂质的柠檬酸铁铵常标记为(NH4)xFey(C6H5O7)2(Fe为正三价)。将mg实验室产品分为两等份,一份在空气中充分灼烧,冷却称量得0.32g红色固体。另一份配成250.00mL溶液,取25.00mL溶液于锥形瓶中,向锥形瓶中再加入足量的甲醛溶液,反应原理4NH+6HCHO=3H++6H2O+(CH2)6N4H+、[与NaOH反应时,lmo(CH2)6N4H+与1molH+相当]。摇匀、静置5min后,加入1~2滴酚酞试液,用0.1mol/LNaOH标准溶液滴定至终点,消耗NaOH标准溶液的体积为16.00mL。
①则x= ▲ 。
②下列操作使测定的y值偏大的是 ▲ (填标号)。
a.分成两等份时,第一份质量小于第二份的质量
b.在空气中灼烧时,产品没有完全反应就冷却、称量
c.用滴定管量取25.00mL溶液时,先俯视、后仰视读数
d.用NaOH标准溶液滴定时,开始尖嘴有气泡,结束时无气泡
16.(16分)化合物F(普瑞巴林)是一种治疗神经痛的药物。其合成路线如下:
(1)在催化剂作用下,烃X和CO、H2化合生成A,则X的结构简式是 ▲ ;
(2)B分子中碳原子的杂化方式为 ▲ ;F中官能团名称是 ▲ ;
(3)E→F的化学方程式是 ▲ ;
(4)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式 ▲ ;
①该分子为环状结构,分子中含有碳碳双键和羟基;
②分子中不同化学环境的氢原子数目比为1∶2∶2∶1。
(5)3-苯基丙烯酸乙酯()是一种重要的医药中间体。设计以丙二酸、乙醇和甲苯为原料制备3-苯基丙烯酸乙酯的合成路线。
(无机试剂和有机溶剂任用,合成路线见本题题干)
17.(15分)中国首次实现了利用二氧化碳人工合成淀粉,为全球的“碳达峰”、“碳中和”起到重大的支撑作用,研究二氧化碳的收集和利用成为了科研方面的热点。
(1)工业利用加氢制二甲醚的反应体系中,主要发生反应的热化学方程式为
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
在,起始投料 时,的平衡转化率及CH3OCH3和的平衡体积分数随温度变化如题17图—1所示。
题17图—1
①从453-553℃,升高温度平衡转化率降低的原因是 ▲ 。
②为提高单位时间内CH3OCH3产率。研发的催化剂需具备的特点是 ▲ 。
(2)在熔融中电解还原为正丙醇(CH3CH2CH2OH)的阴极反应式为 ▲ 。
(3)科研人员研究出在催化剂上氢化合成甲醇的反应历程如题17图—2所示,反应③的化学方程式为 ▲ 。
题17图—2
(4)和环氧乙烷在作催化剂的条件下合成碳酸乙烯酯。
①溶液中加入尿素[CO(NH2)2]生成沉淀。与沉淀剂(尿素、氢氧化钠)反应生成沉淀,过滤后将沉淀焙烧得到。与氢氧化钠作沉淀剂相比,用尿素作沉淀剂焙烧生成的作催化剂效果更好,其原因是 ▲ 。
②催化合成碳酸乙烯酯( )可能的反应机理如题17图—3所示,根据元素电负性的变化规律,步骤Ⅰ、Ⅱ的过程可描述为 ▲ 。
题17图—3
化学模拟试题参考答案 2024.05
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1 2 3 4 5 6 7 8 9 10
B D D A C C D C B A
11 12 13
D B A
二、非选择题:共4题,共61分。
14.(13分)
(1)第4周期VA族(2分)
(2)[Cu(NH3)4](NO3)2+2NaOHCuO↓+2NaNO3+4NH3↑+H2O (2分)
(注:化学式写错不得分,方程式系数配平错误或未配平扣1分)
(3)有利于除去纳米CuO表面吸附的NaNO3,使生成的纳米CuO颗粒更均匀 (2分)
(4)生成As单质 (2分) (5)12 (2分) ×1021 (3分)
15.(17分)
(1)三颈烧瓶(2分) 使铁粉完全转化为柠檬酸亚铁、柠檬酸抑制亚铁离子水解、与后续加入的氨水反应生成柠檬酸铵。(3分)
(2)温度低于40℃化学反应速率慢,高于40℃双氧水和氨水发生分解反应而损耗。(2分)
(3) (3分)
(4)AE(2分) (5)1.5 (3分) bc (2分)(注:字母大写不得分,错选不得分。)
16.(16分)
(1) (2分)
(2)sp2、sp3 (2分) 氨基、羧基 (2分)
(3) (2分)
(4) 或 (3分)
(5)
(注:5分,如果条件明显错误,熔断;仅少加热符号扣1分,其他评分参照执行;其他合理答案参照给分)
17.(15分)
(1)①在温度为453-553℃范围内,反应Ⅰ为吸热反应,温度升高平衡正向移动,平衡转化率增大;(1分)反应Ⅱ为放热反应,温度升高平衡逆向移动,平衡转化率降低;(1分)温度对反应Ⅱ的影响大于温度对反应Ⅰ的影响,从而导致平衡转化率降低(1分)
②在较低温度下催化活性较强(2分)
(2) (2分)
(3) (3分)
(4)①焙烧释放更多的气体,制得的更加疏松多孔(或比表面积大,2分)
②环氧乙烷中带部分负电荷的原子吸附在上;(1分)形成键的同时使环氧乙烷中的键断裂;(1分)中的带部分正电荷的原子与结合;带部分负电荷的原子与环氧乙烷中的带部分正电荷的一个原子结合,形成碳氧键。(1分)
同课章节目录
