四川省内江市第六中学2023-2024学年高一下学期期中考试化学试卷(含答案)
文档属性
| 名称 | 四川省内江市第六中学2023-2024学年高一下学期期中考试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 780.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-18 22:48:34 | ||
图片预览


文档简介
内江市第六中学2023-2024学年高一下学期期中考试
化学试题
考试时间:75分钟 满分:100分
可能用到的相对原子质量:H-1 C- 12 N- 14 O- 16 Na- 23 S- 32 Ba- 137
第Ⅰ卷 选择题(满分 45分)
一、选择题(本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.化学与生活、科技、社会发展息息相关,下列说法错误的是
A.单质硅具有半导体性能,可作计算机芯片
B.氨气易液化,液化时吸热,液氨可做为制冷剂
C.二氧化硫具有漂白性,可做纸浆的漂白剂
D.浓硫酸具有吸水性,可干燥氨气
2.下列化学用语表示正确的是
A. HCl的电子式: B.正丁烷的结构简式:
C. 乙烷的结构式:
D.空间填充模型可表示CH4分子,也可表示CCl4分子
3.在2A(g)+B(g)3C(g)+4D(g)反应中,表示该反应速率最快的是
A. B.
C. D.
4. NA为阿伏加德罗常数的值。下列叙述正确的是
A. 一定条件下,2molSO2与1molO2充分反应后分子总数为2NA
B. 3mol的NO2与H2O完全反应时转移的电子数为2NA
C. 15g甲基(-CH3)中含有的电子数为10NA
D. 标准状况下,22.4LSO3中含有的原子数目为3NA
5.下列说法正确的是
A.甲烷、乙烷、正丁烷、异丁烷的沸点由低到高
B.分子式为C4H9Cl的同分异构体有4种
C.丙烷分子中所有原子可能共面
D.常温下,CH3Cl和四氯化碳均为液态
6.下列关于物质之间的关系,说法正确的是
A.2H与H2是同素异形体
正丁烷和异丁烷互为同系物
C.和互为同分异构体
D.与CH2==CH2的分子组成相差一个“”,它们互为同系物
7. 下列方程式书写不正确的是
A. 向溶液中滴加稀硫酸:
B. 将SO2通入BaCl2溶液中:SO2+H2O+Ba2+=BaSO3↓+2H+
C. 过量Fe和稀HNO3的反应:3Fe+8H++2NO=3Fe2++2NO↑+4H2O
B.通入溶液中:
8.某一容积为5L的密闭容器内,加入0.2mol单质D和0.2mol的,加热至发生反应:
D(s)+A2(g)A2D(g),下列说法正确的是
A.向体系中加入更多单质D可以加快该反应的反应速率
B.向该体系中通入更多Ar,可以加快该反应的反应速率
C.体积和温度一定时,容器内的压强不再改变说明反应达到平衡状态
D.体积和温度一定时,混合气体的密度不再改变说明反应达到平衡状态
9. 下列有关实验的操作、现象和实验结论正确的是
选项 操作 现象 实验结论
A 向某溶液中加入稀NaOH溶液 湿润的红色石蕊试纸未变蓝 该溶液不含NH4+
B 将久置的Na2SO3固体溶于稀硝酸后再加入BaCl2溶液 产生白色沉淀 该Na2SO3固体已变质
C 将甲烷和氯气以体积比1∶1混合发生取代反应 试管内气体颜色变浅,液面上升,试管壁出现油状液滴 甲烷全部转化为CCl4
D 向2mL0.1mol/L的FeCl3溶液中加入5mL0.1mol/LKI溶液,充分反应后加入KSCN溶液 溶液变红 Fe3+与I-的反应有一定限度
10.计算机模拟催化剂表面水煤气产氢反应[]过程中能量的变化如图所示。下列说法错误的是
A.过程Ⅰ、Ⅱ均需要吸收能量 B.过程Ⅲ既有共价键断裂;又有共价键形成
C.该反应为放热反应 D.由图可知比CO稳定
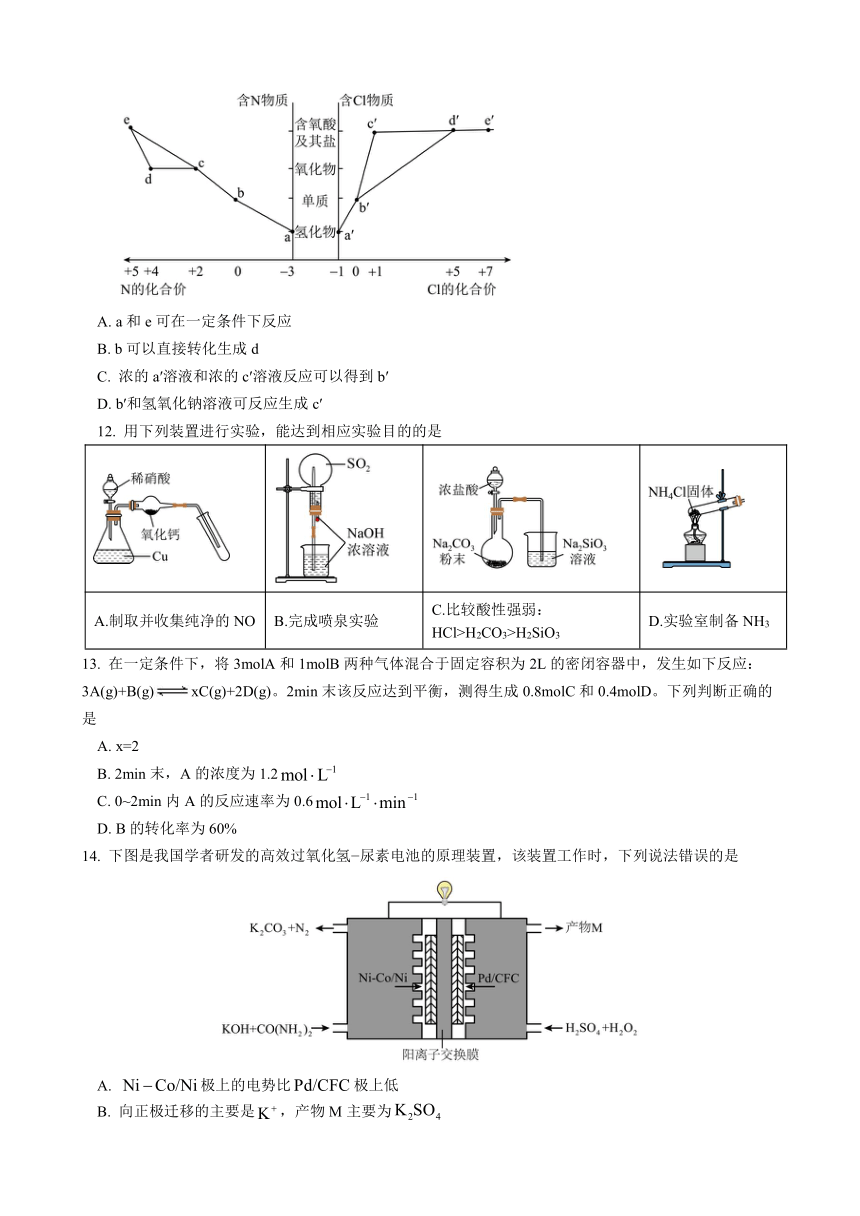
11. 部分含氮及氯物质的价类二维图如下,下列推断不合理的是
A. a和e可在一定条件下反应
B. b可以直接转化生成d
C. 浓的a′溶液和浓的c′溶液反应可以得到b′
D. b′和氢氧化钠溶液可反应生成c′
12. 用下列装置进行实验,能达到相应实验目的的是
A.制取并收集纯净的NO B.完成喷泉实验 C.比较酸性强弱:HCl>H2CO3>H2SiO3 D.实验室制备NH3
13. 在一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g)。2min末该反应达到平衡,测得生成0.8molC和0.4molD。下列判断正确的是
A. x=2
B. 2min末,A的浓度为1.2
C. 0~2min内A的反应速率为0.6
D. B的转化率为60%
14. 下图是我国学者研发的高效过氧化氢 尿素电池的原理装置,该装置工作时,下列说法错误的是
A. 极上的电势比极上低
B. 向正极迁移的主要是,产物M主要为
C. 极上发生反应:
D. 负极电极反应方程式为
15. 某试样溶液中可能含有NH、Na+、Fe3+、Mg2+、SO、CO、Cl-、NO,阴离子的物质的量浓度相等。某同学利用该试样溶液进行实验,现象如图。下列说法正确的是
A. 气体X和气体Y均属于电解质
B. 滤液M在酸性条件下与铜片的反应中,还原产物是NO2
C. 将气体Y全部通入15mL1.0mol/L的NaOH溶液中,所得溶液中c(CO):c(HCO)=1
D. 该试样溶液中至少有5种离子存在,其中Na+一定存在,且c(Na+)=0.4mol/L
第Ⅱ卷 非选择题(满分 55分)
16 (15分)I.(1)A~D是四种烃分子的球棍模型(如下图)
物质A与氯气生成一氯代物的化学方程式为_________________________________,
B的分子式为 ,C的结构简式为 ,D的一氯代物有 种。
(2)从下列各组物质中进行分析,互为同分异构体的是 (填序号,下同),
互为同系物的是 ,为同种物质的是 。
①CH2=CHCH2CH3 和CH3CH=CHCH3 ②CH3Cl和(CH3)2CHCH2Cl
③和 ④和
Ⅱ. 用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。
2MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O
【实验内容及记录】
实验编号 实验温度/℃ 试管中所加试剂及其用量/mL 溶液褪至无色所需时间(min)
0.6mol/L H2C2O4溶液 H2O 3mol/L稀硫酸溶液 0.05mol/L KMnO4溶液
① 25 3.0 V1 2.0 3.0 1.5
② 25 2.0 3.0 2.0 3.0 2.7
③ 50 2.0 V2 2.0 3.0 1.7
(3)请完成此实验设计,其中:V1=__________,V2=__________。
(4)探究温度对化学反应速率的影响,应选择_____(填实验编号)。
(5)利用实验①中的数据,计算用KMnO4表示的化学反应速率为__________。
17(17分)I.我国提出争取在2060年实现碳中和,这对于改善环境、实现绿色发展至关重要。“碳中和”是指CO2的排放总量和减少总量相当。工业上有一种方法是利用CO2生产甲醇(CH3OH):CO2(g)+3H2(g) CH3OH(g)+H2O(g),该反应过程中的能量变化如图所示:
(1)该反应是_____(填“放热”或“吸热”)反应,若有1molCO2(g)参加反应,则变化的能量是_____kJ。
(2)一定条件下,将2molCO2和6molH2在2L恒容密闭容器中发生上述反应,经过2min反应达到了平衡,此时CH3OH浓度为0.8mol/L。
①2min内用CO2表示该反应的速率为v(CO2)=_____。
②达到平衡时氢气的转化率为______,平衡时体系内气体压强与开始时的压强之比为_____。
(3)一定能说明该反应达到平衡的标志是_____。
A.v正(CO2)=3v逆(H2)
B.单位时间内3molH-H键断裂,同时形成2molO-H键
C.CO2和CH3OH物质的量浓度的比值不变
D.混合气体的平均摩尔质量不再改变
E.混合气体的密度保持不变
(4)如表列出了在不同温度和压强下,反应达到平衡时CO2的转化率,从化学反应速率、化学平衡及生产成本、产量等角度综合分析,在实际生产中有关该反应适宜条件选择的说法正确的是_______。
温度/℃ 平衡时的转化率
0.1Mpa 0.5Mpa 1Mpa 5Mpa 10Mpa
450 97.5 98.9 99.2 99.6 99.7
550 85.6 92.9 94.9 97.7 98.3
A.CO2的转化率与温度成反比,故采用尽可能低的温度
B.该反应在450℃左右、0.1Mpa(常压)下进行较为合适
C.CO2的转化率与压强成正比,故采用尽可能高的压强
Ⅱ.有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出一种既能提供电能,又能实现氮固定的新型燃料电池,如图所示。
(5)该电池在工作过程中负极附近溶液的pH值_____(填“增大”或“减小”)
(6)a电极上的电极反应式是____________________________________,当a电极极消耗1mol氮气,则b电极消耗氢气体积(标况下)为__________。
18.(12分)焦亚硫酸钠(Na2S2O5)是一种重要的化工原料。工业上,以黄铁矿(主要成分FeS2)生产硫酸的尾气为原料制备焦亚硫酸钠的一种流程如下图所示:
请回答下列问题:
(1)FeS2中铁元素的化合价为____。
(2)“煅烧”时,主要反应的化学方程式为_________________________________________。
(3)将含有少量SO2的尾气通入烧碱溶液中,反应的离子方程式是________________。
(4)因为Na2S2O5具有________性,长期放置Na2S2O5样品会不可避免地存在Na2SO4,检验其中含有SO42-的试剂是________________。
(5)Na2S2O5可用于葡萄酒的抗氧化剂,用碘标准液可以测定葡萄酒中Na2S2O5的含量。请配平该反应的化学方程式:___I2+ __S2O52- + ___H2O = ___I- + ____SO42-+ ____H+
在测定某葡萄酒中Na2S2O5的含量时,取100.00mL葡萄酒样品,消耗0.01mol/L 碘标准液20.00mL 。样品中Na2S2O5的含量为_________g/L。
19. (12分)较活泼金属与硝酸反应,产物复杂。如一定浓度的硝酸与镁反应,可同时得到NO、NO2、N2三种气体。某同学欲用下列仪器组装装置来直接验证有NO、NO2生成并制取氮化镁(假设实验中每步转化均是完全的;且实验装置可重复利用)。已知:①NO2的沸点是21.1℃、熔点是-11℃;NO的沸点是-151℃、熔点是-164℃;②氮化镁遇水会发生反应生成氢氧化镁和氨气 ③NO可被酸性高锰酸钾溶液氧化为NO3-
回答下列问题:
(1)为达到上述实验目的,所选用仪器的正确连接方式是:A→_____→_____→F→B→F→E。
(2)装置D的作用______________________________________。
(3)实验前需先打开开关K,向装置内通CO2气体,当_________________时停止通入CO2。
(4)实验过程中,发现在装置D中产生预期现象的同时,装置C中溶液颜色慢慢褪去,试写出装置C中反应的离子方程式:___________________________________________________。
(5)在装置A中反应开始时,某同学马上点燃装置B中的酒精灯,实验结束后通过测定发现装置B中的产品纯度不高,原因是_________________________________。(用化学方程式回答)。
(6)验证装置B中有氮化镁生成的方法是____________________。
内江市第六中学2023-2024学年高一下学期期中考试答案
选择题(本题共15小题,每小题3分,共45分)
1-5 DCBBB 6-10 CBDDD 11-15BBBCC
二、填空题(除注明外,每空2分)
16(共15分).
Ⅰ(1)
C4H10(1分) CH3CH2CH2CH3 (1分)4
①(1分)②(1分)③④(2分)
Ⅱ(1)2.0(1分) 3.0(1分)
(3)②③(1分) (3)0.01mol L-1 min-1
(共16分)Ⅰ(1) 放热(1分) 445(1分)
(2)0.4mol L-1 min-1 80% 3∶5
(3) CD (4) B(1分)
Ⅱ(5) 减小(1分)(6)N2+8H++6e-=2NH4+ 67.2L
18(共12分)
(1分)
SO2+2OH-=SO32-+H2O
(4)还原(1分) 稀盐酸、BaCl2溶液
(2分)
19.(共12分)(1)D C(2分)
(2)冷凝收集NO2,证明镁和硝酸反应产物中有NO2
(3)装置E中产生白色沉淀
(4)
(5)
(6)取装置B中固体少量于试管中,向其中加入少量水,加热,若产生能使湿润的红色石蕊试纸变蓝的气体,则装置B中有氮化镁
化学试题
考试时间:75分钟 满分:100分
可能用到的相对原子质量:H-1 C- 12 N- 14 O- 16 Na- 23 S- 32 Ba- 137
第Ⅰ卷 选择题(满分 45分)
一、选择题(本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.化学与生活、科技、社会发展息息相关,下列说法错误的是
A.单质硅具有半导体性能,可作计算机芯片
B.氨气易液化,液化时吸热,液氨可做为制冷剂
C.二氧化硫具有漂白性,可做纸浆的漂白剂
D.浓硫酸具有吸水性,可干燥氨气
2.下列化学用语表示正确的是
A. HCl的电子式: B.正丁烷的结构简式:
C. 乙烷的结构式:
D.空间填充模型可表示CH4分子,也可表示CCl4分子
3.在2A(g)+B(g)3C(g)+4D(g)反应中,表示该反应速率最快的是
A. B.
C. D.
4. NA为阿伏加德罗常数的值。下列叙述正确的是
A. 一定条件下,2molSO2与1molO2充分反应后分子总数为2NA
B. 3mol的NO2与H2O完全反应时转移的电子数为2NA
C. 15g甲基(-CH3)中含有的电子数为10NA
D. 标准状况下,22.4LSO3中含有的原子数目为3NA
5.下列说法正确的是
A.甲烷、乙烷、正丁烷、异丁烷的沸点由低到高
B.分子式为C4H9Cl的同分异构体有4种
C.丙烷分子中所有原子可能共面
D.常温下,CH3Cl和四氯化碳均为液态
6.下列关于物质之间的关系,说法正确的是
A.2H与H2是同素异形体
正丁烷和异丁烷互为同系物
C.和互为同分异构体
D.与CH2==CH2的分子组成相差一个“”,它们互为同系物
7. 下列方程式书写不正确的是
A. 向溶液中滴加稀硫酸:
B. 将SO2通入BaCl2溶液中:SO2+H2O+Ba2+=BaSO3↓+2H+
C. 过量Fe和稀HNO3的反应:3Fe+8H++2NO=3Fe2++2NO↑+4H2O
B.通入溶液中:
8.某一容积为5L的密闭容器内,加入0.2mol单质D和0.2mol的,加热至发生反应:
D(s)+A2(g)A2D(g),下列说法正确的是
A.向体系中加入更多单质D可以加快该反应的反应速率
B.向该体系中通入更多Ar,可以加快该反应的反应速率
C.体积和温度一定时,容器内的压强不再改变说明反应达到平衡状态
D.体积和温度一定时,混合气体的密度不再改变说明反应达到平衡状态
9. 下列有关实验的操作、现象和实验结论正确的是
选项 操作 现象 实验结论
A 向某溶液中加入稀NaOH溶液 湿润的红色石蕊试纸未变蓝 该溶液不含NH4+
B 将久置的Na2SO3固体溶于稀硝酸后再加入BaCl2溶液 产生白色沉淀 该Na2SO3固体已变质
C 将甲烷和氯气以体积比1∶1混合发生取代反应 试管内气体颜色变浅,液面上升,试管壁出现油状液滴 甲烷全部转化为CCl4
D 向2mL0.1mol/L的FeCl3溶液中加入5mL0.1mol/LKI溶液,充分反应后加入KSCN溶液 溶液变红 Fe3+与I-的反应有一定限度
10.计算机模拟催化剂表面水煤气产氢反应[]过程中能量的变化如图所示。下列说法错误的是
A.过程Ⅰ、Ⅱ均需要吸收能量 B.过程Ⅲ既有共价键断裂;又有共价键形成
C.该反应为放热反应 D.由图可知比CO稳定
11. 部分含氮及氯物质的价类二维图如下,下列推断不合理的是
A. a和e可在一定条件下反应
B. b可以直接转化生成d
C. 浓的a′溶液和浓的c′溶液反应可以得到b′
D. b′和氢氧化钠溶液可反应生成c′
12. 用下列装置进行实验,能达到相应实验目的的是
A.制取并收集纯净的NO B.完成喷泉实验 C.比较酸性强弱:HCl>H2CO3>H2SiO3 D.实验室制备NH3
13. 在一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g)。2min末该反应达到平衡,测得生成0.8molC和0.4molD。下列判断正确的是
A. x=2
B. 2min末,A的浓度为1.2
C. 0~2min内A的反应速率为0.6
D. B的转化率为60%
14. 下图是我国学者研发的高效过氧化氢 尿素电池的原理装置,该装置工作时,下列说法错误的是
A. 极上的电势比极上低
B. 向正极迁移的主要是,产物M主要为
C. 极上发生反应:
D. 负极电极反应方程式为
15. 某试样溶液中可能含有NH、Na+、Fe3+、Mg2+、SO、CO、Cl-、NO,阴离子的物质的量浓度相等。某同学利用该试样溶液进行实验,现象如图。下列说法正确的是
A. 气体X和气体Y均属于电解质
B. 滤液M在酸性条件下与铜片的反应中,还原产物是NO2
C. 将气体Y全部通入15mL1.0mol/L的NaOH溶液中,所得溶液中c(CO):c(HCO)=1
D. 该试样溶液中至少有5种离子存在,其中Na+一定存在,且c(Na+)=0.4mol/L
第Ⅱ卷 非选择题(满分 55分)
16 (15分)I.(1)A~D是四种烃分子的球棍模型(如下图)
物质A与氯气生成一氯代物的化学方程式为_________________________________,
B的分子式为 ,C的结构简式为 ,D的一氯代物有 种。
(2)从下列各组物质中进行分析,互为同分异构体的是 (填序号,下同),
互为同系物的是 ,为同种物质的是 。
①CH2=CHCH2CH3 和CH3CH=CHCH3 ②CH3Cl和(CH3)2CHCH2Cl
③和 ④和
Ⅱ. 用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。
2MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O
【实验内容及记录】
实验编号 实验温度/℃ 试管中所加试剂及其用量/mL 溶液褪至无色所需时间(min)
0.6mol/L H2C2O4溶液 H2O 3mol/L稀硫酸溶液 0.05mol/L KMnO4溶液
① 25 3.0 V1 2.0 3.0 1.5
② 25 2.0 3.0 2.0 3.0 2.7
③ 50 2.0 V2 2.0 3.0 1.7
(3)请完成此实验设计,其中:V1=__________,V2=__________。
(4)探究温度对化学反应速率的影响,应选择_____(填实验编号)。
(5)利用实验①中的数据,计算用KMnO4表示的化学反应速率为__________。
17(17分)I.我国提出争取在2060年实现碳中和,这对于改善环境、实现绿色发展至关重要。“碳中和”是指CO2的排放总量和减少总量相当。工业上有一种方法是利用CO2生产甲醇(CH3OH):CO2(g)+3H2(g) CH3OH(g)+H2O(g),该反应过程中的能量变化如图所示:
(1)该反应是_____(填“放热”或“吸热”)反应,若有1molCO2(g)参加反应,则变化的能量是_____kJ。
(2)一定条件下,将2molCO2和6molH2在2L恒容密闭容器中发生上述反应,经过2min反应达到了平衡,此时CH3OH浓度为0.8mol/L。
①2min内用CO2表示该反应的速率为v(CO2)=_____。
②达到平衡时氢气的转化率为______,平衡时体系内气体压强与开始时的压强之比为_____。
(3)一定能说明该反应达到平衡的标志是_____。
A.v正(CO2)=3v逆(H2)
B.单位时间内3molH-H键断裂,同时形成2molO-H键
C.CO2和CH3OH物质的量浓度的比值不变
D.混合气体的平均摩尔质量不再改变
E.混合气体的密度保持不变
(4)如表列出了在不同温度和压强下,反应达到平衡时CO2的转化率,从化学反应速率、化学平衡及生产成本、产量等角度综合分析,在实际生产中有关该反应适宜条件选择的说法正确的是_______。
温度/℃ 平衡时的转化率
0.1Mpa 0.5Mpa 1Mpa 5Mpa 10Mpa
450 97.5 98.9 99.2 99.6 99.7
550 85.6 92.9 94.9 97.7 98.3
A.CO2的转化率与温度成反比,故采用尽可能低的温度
B.该反应在450℃左右、0.1Mpa(常压)下进行较为合适
C.CO2的转化率与压强成正比,故采用尽可能高的压强
Ⅱ.有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出一种既能提供电能,又能实现氮固定的新型燃料电池,如图所示。
(5)该电池在工作过程中负极附近溶液的pH值_____(填“增大”或“减小”)
(6)a电极上的电极反应式是____________________________________,当a电极极消耗1mol氮气,则b电极消耗氢气体积(标况下)为__________。
18.(12分)焦亚硫酸钠(Na2S2O5)是一种重要的化工原料。工业上,以黄铁矿(主要成分FeS2)生产硫酸的尾气为原料制备焦亚硫酸钠的一种流程如下图所示:
请回答下列问题:
(1)FeS2中铁元素的化合价为____。
(2)“煅烧”时,主要反应的化学方程式为_________________________________________。
(3)将含有少量SO2的尾气通入烧碱溶液中,反应的离子方程式是________________。
(4)因为Na2S2O5具有________性,长期放置Na2S2O5样品会不可避免地存在Na2SO4,检验其中含有SO42-的试剂是________________。
(5)Na2S2O5可用于葡萄酒的抗氧化剂,用碘标准液可以测定葡萄酒中Na2S2O5的含量。请配平该反应的化学方程式:___I2+ __S2O52- + ___H2O = ___I- + ____SO42-+ ____H+
在测定某葡萄酒中Na2S2O5的含量时,取100.00mL葡萄酒样品,消耗0.01mol/L 碘标准液20.00mL 。样品中Na2S2O5的含量为_________g/L。
19. (12分)较活泼金属与硝酸反应,产物复杂。如一定浓度的硝酸与镁反应,可同时得到NO、NO2、N2三种气体。某同学欲用下列仪器组装装置来直接验证有NO、NO2生成并制取氮化镁(假设实验中每步转化均是完全的;且实验装置可重复利用)。已知:①NO2的沸点是21.1℃、熔点是-11℃;NO的沸点是-151℃、熔点是-164℃;②氮化镁遇水会发生反应生成氢氧化镁和氨气 ③NO可被酸性高锰酸钾溶液氧化为NO3-
回答下列问题:
(1)为达到上述实验目的,所选用仪器的正确连接方式是:A→_____→_____→F→B→F→E。
(2)装置D的作用______________________________________。
(3)实验前需先打开开关K,向装置内通CO2气体,当_________________时停止通入CO2。
(4)实验过程中,发现在装置D中产生预期现象的同时,装置C中溶液颜色慢慢褪去,试写出装置C中反应的离子方程式:___________________________________________________。
(5)在装置A中反应开始时,某同学马上点燃装置B中的酒精灯,实验结束后通过测定发现装置B中的产品纯度不高,原因是_________________________________。(用化学方程式回答)。
(6)验证装置B中有氮化镁生成的方法是____________________。
内江市第六中学2023-2024学年高一下学期期中考试答案
选择题(本题共15小题,每小题3分,共45分)
1-5 DCBBB 6-10 CBDDD 11-15BBBCC
二、填空题(除注明外,每空2分)
16(共15分).
Ⅰ(1)
C4H10(1分) CH3CH2CH2CH3 (1分)4
①(1分)②(1分)③④(2分)
Ⅱ(1)2.0(1分) 3.0(1分)
(3)②③(1分) (3)0.01mol L-1 min-1
(共16分)Ⅰ(1) 放热(1分) 445(1分)
(2)0.4mol L-1 min-1 80% 3∶5
(3) CD (4) B(1分)
Ⅱ(5) 减小(1分)(6)N2+8H++6e-=2NH4+ 67.2L
18(共12分)
(1分)
SO2+2OH-=SO32-+H2O
(4)还原(1分) 稀盐酸、BaCl2溶液
(2分)
19.(共12分)(1)D C(2分)
(2)冷凝收集NO2,证明镁和硝酸反应产物中有NO2
(3)装置E中产生白色沉淀
(4)
(5)
(6)取装置B中固体少量于试管中,向其中加入少量水,加热,若产生能使湿润的红色石蕊试纸变蓝的气体,则装置B中有氮化镁
同课章节目录
