湖北省宜昌市部分省级示范高中2023-2024学年高一下学期期中考试化学试卷(含答案)
文档属性
| 名称 | 湖北省宜昌市部分省级示范高中2023-2024学年高一下学期期中考试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 680.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-19 12:28:59 | ||
图片预览




文档简介
湖北省宜昌市部分省级示范高中2023-2024学年高一下学期期中考试化学试卷
考生须知:
1.答题前,在答题卷指定区域填写班级、姓名、考场号、座位号及准考证号并填涂相应数字。
2.所有答案必须写在答题纸上,写在试卷上无效。考试结束后,只需上交答题纸。
本卷可能用到的相对原子质量:H 1 C 12 N 14 O 16
一、单选题
1.2022北京冬奥会的主题口号是“一起向未来”,秉承绿色冬奥、科技冬奥的理念。下列有关材料属于新型无机非金属单质材料的是( )
A B C D
“冰丝带”速滑馆场馆幕墙:钢化玻璃 “冰墩墩”吉祥物透明外壳:硅胶 “瑞雪祥云”礼仪服 智能发热:石墨烯 “飞扬”火炬 内胆:铝合金
A.A B.B C.C D.D
2.化学与生活密切相关,下列不涉及化学变化的是( )
A.沙里淘金 B.自来水中加入消毒
C.电动汽车充电 D.胃酸过多
3.我国力争在2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当。在实际生产中,可利用反应或来捕捉废气中的,下列有关化学用语或说法正确的是( )
A.Na的结构示意图:
B.俗称小苏打
C.中子数为8的氧原子:
D.的电离方程式:
4.室温下,下列各组离子在指定溶液中可能大量共存的是( )
A.含有大量的溶液: 、
B.含有大量的溶液:、、、
C.与铝粉反应放出的透明溶液:、、、
D.使石蕊试液显蓝色的溶液:、、、
5.解释下列事实的化学方程式或离子方程式正确的是( )
A.石英和焦炭制取粗硅的反应:
B.氢氟酸雕刻玻璃发生的离子反应:
C.烧碱溶液除去中少量的反应:
D.氧化铁溶于氢碘酸发生的离子反应:
6.下列说法正确的是( )
A.Cl2的摩尔质量为35.5g/mol
B.1mol可与3mol完全反应生成2mol
C.标准状况和通常状况下,2mol的质量都是34g
D.标准状况下,1mol和1mol的体积不相等
7.设NA为阿伏加德罗常数的值。下列说法不正确的是( )
A.22.4L(标准状况)氩气含有的质子数为18
B.标准状况下,2.24L和的混合气体中分子数为0.2
C.1mol被还原为转移的电子数为6
D.120g和的固体混合物中含有的阳离子数为
8.“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )
A.加热时,①中上部汇集了固体
B.加热时,②中溶液变红,冷却后又都变为无色
C.加热时,③中溶液变红,冷却后红色褪去,体现的氧化性
D.三个“封管实验”中所发生的化学反应都是可逆反应
9.某无色强碱性溶液中仅含有、、、、、中的若干种,为了确定该溶液的组成,某同学进行如下实验:
①取少量溶液,加入过量溶液,有白色沉淀产生;
②向①所得白色沉淀中加入足量盐酸,沉淀部分溶解,并有无色气体生成;
③将②所得混合物过滤,向滤液中加入溶液,有白色沉淀生成。
分析上述实验,下列说法正确的是( )
A.一定不含有 B.一定含有、、
C.可能含有 D.一定含有、、、
10.是一种常用的消毒剂,可通过反应制取,下列有关说法正确的是( )
A.还原性:
B.每消耗 , 转移 4mol电子
C.氧化剂与还原剂的物质的量之比为2:1
D.若该反应通过原电池来实现,则是负极产物
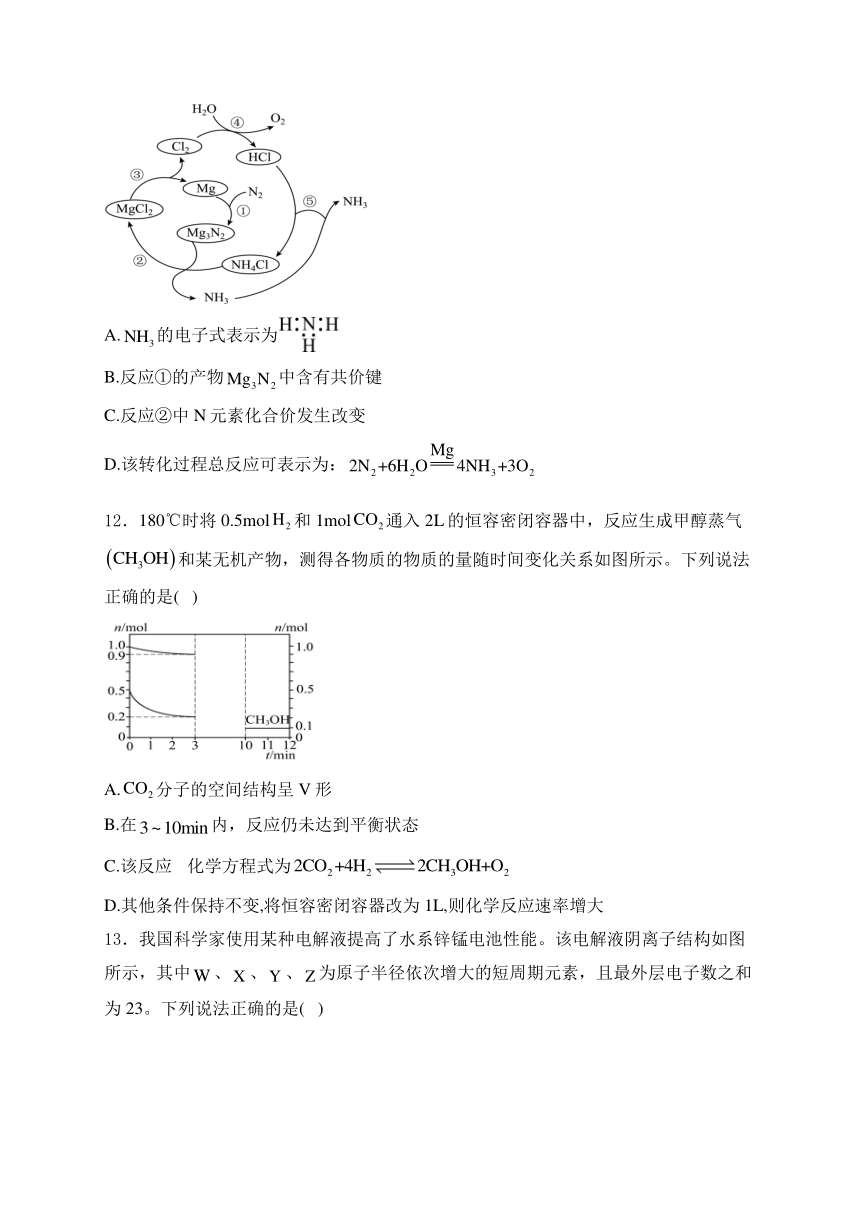
11.氨广泛应用于化工、化肥、制药等领域,一种新型制备氨的方法如图。下列说法正确的是( )
A.的电子式表示为
B.反应①的产物中含有共价键
C.反应②中N元素化合价发生改变
D.该转化过程总反应可表示为:
12.180℃时将0.5mol和1mol通入2L的恒容密闭容器中,反应生成甲醇蒸气和某无机产物,测得各物质的物质的量随时间变化关系如图所示。下列说法正确的是( )
A.分子的空间结构呈V形
B.在内,反应仍未达到平衡状态
C.该反应化学方程式为
D.其他条件保持不变,将恒容密闭容器改为1L,则化学反应速率增大
13.我国科学家使用某种电解液提高了水系锌锰电池性能。该电解液阴离子结构如图所示,其中、、、为原子半径依次增大的短周期元素,且最外层电子数之和为23。下列说法正确的是( )
A.元素的非金属性:
B.该离子中都满足8电子稳定结构
C.最高价氧化物的水化物的酸性强于
D.单质不能通过置换反应生成单质
14.一种可穿戴电池的结构如图所示,该电池的总反应为。下列关于电池工作原理的说法中,错误的是( )
A.为负极
B.电子由负极经隔离膜流向正极
C.正极反应式为
D.凝胶电解质可提高电池的安全性和稳定性
15.实验改进与优化应遵循科学性、直观性、易操作性、安全性的原则,提升化学实验效率。下列有关实验改进分析不正确的是( )
A B C D
A.使用恒压滴液漏斗可防止浓氨水污染环境,并使漏斗内液体顺利流下
B.用点燃的木条靠近肥皂泡,听到爆鸣声,可检验产物中有氢气产生
C.该改进装置可用于性质的探究实验
D.利用此装置可较长时间看到白色絮状沉淀
二、填空题
16.2022年5月6日,我国科学家利用“墨子号”卫星首次实现了地球上相距1200公里的地面站之间的量子态远程传输。化学助力我国科技发展,借助元素周期表可以认识各种材料的结构与性质,元素a~h是元素周期表中短周期元素,其相对位置如下表所示:
请回答下列问题:
(1)a的单质常用作火箭推进剂,该过程中a单质对应的产物为_______(填化学式)。
(2)元素b的一种单质是“墨子号”的储能器件,b在元素周期表中的位置是_______。比较元素g与元素h所形成的简单氢化物的稳定性大小:g______h(填“<”、“=”或“>”)。
(3)c与f的化合物是“墨子号”实现远程传输的核心材料,该化合物属于_______(填“离子”或“共价”)化合物。
(4)g的一种氧化物在果酒的加工中有着重要作用,请写出该氧化物与g的简单氢化物发生反应的化学方程式:___________________________________。
(5)实验室常用制取h的单质,请写出该反应的离子方程式:。
(6)元素d的单质在一定条件下,能与a单质化合生成一种化合物da,灼烧该化合物时,火焰呈___色,da能与水反应放出氢气,若将0.5molda和1mole单质混合加入足量的水,充分反应后生成的气体在标准状况下的体积是___L。
17.层状结构薄膜能用于制作电极材料.薄膜由辉钼矿(主要含及少量FeO、)制得后再与S经气相反应并沉积得到,其流程如下.
回答下列问题:
(1)“焙烧”产生的用溶液吸收生成的离子方程式为________。
(2)“焙烧”后的固体用氨水“浸取”得到重钼酸铵溶液,为提高“浸取”速率,可采用的措施是__________(举一例)。
(3)“灼烧”过程中需回收利用的气体是_________(填化学式)。
(4)在650℃下“气相沉积”生成的反应需在特定气流中进行,选用Ar而不选用形成该气流的原因是__________。
(5)层状晶体与石墨晶体结构类似,层状的晶体类型为________.将嵌入层状充电后得到的可作电池负极,该负极放电时的电极反应式为___________.结合原子结构分析,能嵌入层间可能的原因是_________。
18.化学反应原理在指导实验和生产实际具有重要作用,请结合所学知识完成下列问题:
(1)在2L的密闭绝热容器中,通入等物质的量的NO和气体,随时间的变化如下表:
0 1 2 3 4 5
0.020 0.012 0.008 0.005 0.004 0.004
①反应开始至第2s时,NO的平均反应速率为_______。
②在第5s时,的转化率为_______。
③下列能说明反应已达平衡的是_______。
a.单位时间内,每生成一定物质的量浓度的NO,同时有相同物质的量浓度的生成
b.气体混合物物质的量不再改变
c.气体混合物平均相对分子质量不再改变
d.容器内温度不再发生变化
e.密闭容器内气体颜色不再改变
f.混合气的密度不再改变
(2)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为_______。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片
(3)燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:
①氢氧燃料电池的正极电极反应式为:_______。
②当有5mol电子通过外电路时,负极消耗的气体体积(标准状况下)为_______。
三、实验题
19.Ⅰ、过氧化钠是重要的化工原料,具有多种用途。
(1)过氧化钠是___________色固体,电子式为_______________。
(2)过氧化钠可用作呼吸面具、潜水艇的供氧剂,写出和反应的化学方程式:___________________________________。
(3)某实验小组通过如图所示实验,探究与水的反应,下列说法正确的是___________。(填写字母)
A.②中的大量气泡主要成分是氢气
B.③中溶液变红,说明有酸性物质生成
C.④中现象可能是由于溶液中含有强氧化性物质造成的
D.⑤中MnO2的主要作用是降低了水中氧气的溶解度
(4)具有强氧化性,与反应能生成硫酸钠,写出反应的化学方程式:。
Ⅱ、欲配制0.80mol/L的NaOH溶液480mL,现有以下仪器:
①烧杯,②100mL量筒,③托盘天平(带砝码),④玻璃棒,⑤胶头滴管
(1)配制时,还缺少的玻璃仪器是______________。
(2)使用容量瓶前必须进行的一步操作是__________________。
(3)下列哪些操作会引起所配溶液浓度偏大_________(填写字母)。
A.容量瓶底部有蒸馏水未干燥即用来配制溶液
B.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,并进行定容
C.往容量瓶转移时,有少量液体溅出
D.在容量瓶中定容时俯视刻度线
E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
参考答案
1.答案:C
解析:A.钢化玻璃属于无机非金属材料,故A错误;
B.硅胶是一种高活性吸附材料,不属于新型无机非金属单质材料,故B错误
C.石墨烯属于新型无机非金属单质材料,故C正确;
D.铝合金属于金属材料,不属于新型无机非金属单质材料,故D错误:故选:C。
2.答案:A
解析:沙里淘金是利用金的密度大,沙子在水中漂走而金
留在水底,而将沙子与金分开,没有发生化学变化,故A符合题意;中铁元素化合价为+6价,有强氧化性,能杀菌消毒,杀菌消毒过程发生了化学变化,故B不符合题意;粮食酿酒是将淀粉水解生成葡萄糖,葡萄糖发酵变为乙醇,发生了化学变化,故C不符合题意
3.答案:B
解析:
4.答案:C
解析:A.溶液中与结合生成碳酸镁沉淀,不能大量共存,A不选;
B.含有大量的溶液中亚铁离子、之间发生氧化还原反应,不能大量共存,B不选;
C.与铝粉反应放出的透明溶液,如果显酸性,则可以大量共存,C选;
D.使石莈试液显蓝色的溶液显碱性,转化为氢氧化物沉淀,不能大量共存,D不选;答案选C。
5.答案:C
解析:A.焦炭与二氧化硅在高温条件下反应生成硅单质和一氧化碳,反应方程式:,故A错误,
B.氢氞酸为弱酸,不能拆为离子形式,离子方程式:,故B错误,
C.少量会与强哺氢氧化钠反应生成,反应方程式:
,故C正确,
D.氧化铁溶于氢磺酸生成的铁离子具有氧化性,与 离子发生氧化还原反应,离子方程式:,故D错误,
答案选C。
6.答案:C
解析:
7.答案:B
解析:标准状况)氞气的物质的量为,氞气是单原子分子,氞气含有的质子数是,A正确;
标准状况下,和的混合气体的物质的量为,所含分子数为,B错误,
转移的电子数为,C正确;
与的庠尔质量均为,含有的阳离子分别为,故和的混合物的物质的量为,含有阳京子的物质的量为正确。
8.答案:A
解析:A.加热时,①上部汇集了固体,是由于氯化铵不稳定,受热易分解,分解生成的氨气遇冷重新反应生成氯化铵,故A正确;
B.加热时氨气逸出,②中颜色为无色,冷却后氨气溶解②中为红色,故B错误;
C.二氧化硫与有机色素化合生成无色物质而具有漂白性,受热又分解,恢复颜色,所以加热时,③溶液变红,冷却后又变为无色,故C错误;
D.可逆反应应在同一条件下进行,题中实验分别在加热条件下和冷却后进行,不是可逆反应,故D错误。故选:A。
9.答案:D
解析:【详解】A.由分析可知,不能确定是否含有,A错误;
B.由分析可知,必含,不含,不能确定是否含有,B错误;
C.由分析可知,不含C错误;
D.由分析可知,必含,D正确;故选D。
10.答案:C
解析:A.元素的化合价由+5价降低为+4,被还原,为还原产物,S元素的化合价由+4价升高为+6价,为还原剂,还原性:还原剂>还原产物,故还原性:,故A错误;B..S元素的化合价由+4价升高为+6价,转移2个电子,故每消耗1mol,转移2mol电子,故B错误;C.元素的化合价由+5价降低为+4,S元素的化合价由+4价升高为+6价,则氧化剂是,还原剂是,氧化剂与还原剂的物质的量之比为2:1,故C正确;D.原电池中正极得电子,元素的化合价由+5价降低为+4,得电子生成,则是正极产物,故D错误;故选:C。
11.答案:D
解析:A.中有孤对电子,其电子式表示为故A错误;
B.产物排列顺序是氮离子、镁离子、氮离子、镁离子、氮离子,中只含有离子键,故B错误;
C.反应(2)中N元素化合价前后都为-3价,没有发生改变,故C错误;
D.根据图中信息得到该转化过程总反应可表示,故D正确。综上所述,答案为D。
12.答案:D
解析:
13.答案:B
解析:解析:W为为O,Y为C,Z为,最外层电子数之和为;A.同周期元素从左到右非金属性逐渐增强,同主族元素从上到下非金属性逐渐较弱,故元素非金属性:,A错误;
B.该离子中O元素均满足8电子结构,正确;
C.Z的非金属性强于Y,故最高氧,化物对应水化物酸性,C错误;
D.由于氧,化性比氧气强,故可置换出水中的O,,错误答 选B。
14.答案:B
解析:A.根据总反应式,锌失电子化合价升高,所以为负极,故A正确;
B.原电池中电子由负极外电路流向正极,故B错误;
C.根据总反应式,正极得电子生成,正极反应式为,故C正确;
D.凝胶聚合物电解质具有优异的耐火性能,凝胶电解质可提高电池的安全性和稳定性,故D正确;
故选B。
15.答案:C
解析:C恒压滴液漏斗为密闭装置且能平衡压强,使用恒压滴液漏斗可防止浓氨水污染环境,并使漏斗内液体顺利流下,A正确;氢气具有可燃性,和氧气混合点燃容易爆炸;用点燃的木条靠近肥皂泡,听到爆鸣声,可检验产物中有氢气产生,B正确;铜和浓硫酸需要加热才能反应生成二氧化硫,C错误;装置A中生成氢气排净装置中空气且生成硫酸亚铁,一段时间后关闭a,A中压强变大,硫酸亚铁被压入B中生成氢氧化亚铁沉淀,利用此装置可较长时间看到白色絮状沉淀,D正确。
16.答案:(1)H2O
(2)第二周期第ⅣA族;<
(3)共价
(4)
(5)
(6)黄;28
解析:
17.答案:(1)
(2)将固体粉碎
(3)
(4)和S在加热条件下发生生成H2S
(5)①分子晶体/混合型晶体
②
③为Li失去一个电子形成,原子半径小
解析:
18.答案:(1)①;②40%;③abcde
(2)B
(3)①;②56L
解析:
19.答案:I(1)淡黄;
(2)
(3)C
(4)
Ⅱ(1)500mL容量瓶
(2)检验是否漏液
(3)BD
解析:
考生须知:
1.答题前,在答题卷指定区域填写班级、姓名、考场号、座位号及准考证号并填涂相应数字。
2.所有答案必须写在答题纸上,写在试卷上无效。考试结束后,只需上交答题纸。
本卷可能用到的相对原子质量:H 1 C 12 N 14 O 16
一、单选题
1.2022北京冬奥会的主题口号是“一起向未来”,秉承绿色冬奥、科技冬奥的理念。下列有关材料属于新型无机非金属单质材料的是( )
A B C D
“冰丝带”速滑馆场馆幕墙:钢化玻璃 “冰墩墩”吉祥物透明外壳:硅胶 “瑞雪祥云”礼仪服 智能发热:石墨烯 “飞扬”火炬 内胆:铝合金
A.A B.B C.C D.D
2.化学与生活密切相关,下列不涉及化学变化的是( )
A.沙里淘金 B.自来水中加入消毒
C.电动汽车充电 D.胃酸过多
3.我国力争在2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当。在实际生产中,可利用反应或来捕捉废气中的,下列有关化学用语或说法正确的是( )
A.Na的结构示意图:
B.俗称小苏打
C.中子数为8的氧原子:
D.的电离方程式:
4.室温下,下列各组离子在指定溶液中可能大量共存的是( )
A.含有大量的溶液: 、
B.含有大量的溶液:、、、
C.与铝粉反应放出的透明溶液:、、、
D.使石蕊试液显蓝色的溶液:、、、
5.解释下列事实的化学方程式或离子方程式正确的是( )
A.石英和焦炭制取粗硅的反应:
B.氢氟酸雕刻玻璃发生的离子反应:
C.烧碱溶液除去中少量的反应:
D.氧化铁溶于氢碘酸发生的离子反应:
6.下列说法正确的是( )
A.Cl2的摩尔质量为35.5g/mol
B.1mol可与3mol完全反应生成2mol
C.标准状况和通常状况下,2mol的质量都是34g
D.标准状况下,1mol和1mol的体积不相等
7.设NA为阿伏加德罗常数的值。下列说法不正确的是( )
A.22.4L(标准状况)氩气含有的质子数为18
B.标准状况下,2.24L和的混合气体中分子数为0.2
C.1mol被还原为转移的电子数为6
D.120g和的固体混合物中含有的阳离子数为
8.“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )
A.加热时,①中上部汇集了固体
B.加热时,②中溶液变红,冷却后又都变为无色
C.加热时,③中溶液变红,冷却后红色褪去,体现的氧化性
D.三个“封管实验”中所发生的化学反应都是可逆反应
9.某无色强碱性溶液中仅含有、、、、、中的若干种,为了确定该溶液的组成,某同学进行如下实验:
①取少量溶液,加入过量溶液,有白色沉淀产生;
②向①所得白色沉淀中加入足量盐酸,沉淀部分溶解,并有无色气体生成;
③将②所得混合物过滤,向滤液中加入溶液,有白色沉淀生成。
分析上述实验,下列说法正确的是( )
A.一定不含有 B.一定含有、、
C.可能含有 D.一定含有、、、
10.是一种常用的消毒剂,可通过反应制取,下列有关说法正确的是( )
A.还原性:
B.每消耗 , 转移 4mol电子
C.氧化剂与还原剂的物质的量之比为2:1
D.若该反应通过原电池来实现,则是负极产物
11.氨广泛应用于化工、化肥、制药等领域,一种新型制备氨的方法如图。下列说法正确的是( )
A.的电子式表示为
B.反应①的产物中含有共价键
C.反应②中N元素化合价发生改变
D.该转化过程总反应可表示为:
12.180℃时将0.5mol和1mol通入2L的恒容密闭容器中,反应生成甲醇蒸气和某无机产物,测得各物质的物质的量随时间变化关系如图所示。下列说法正确的是( )
A.分子的空间结构呈V形
B.在内,反应仍未达到平衡状态
C.该反应化学方程式为
D.其他条件保持不变,将恒容密闭容器改为1L,则化学反应速率增大
13.我国科学家使用某种电解液提高了水系锌锰电池性能。该电解液阴离子结构如图所示,其中、、、为原子半径依次增大的短周期元素,且最外层电子数之和为23。下列说法正确的是( )
A.元素的非金属性:
B.该离子中都满足8电子稳定结构
C.最高价氧化物的水化物的酸性强于
D.单质不能通过置换反应生成单质
14.一种可穿戴电池的结构如图所示,该电池的总反应为。下列关于电池工作原理的说法中,错误的是( )
A.为负极
B.电子由负极经隔离膜流向正极
C.正极反应式为
D.凝胶电解质可提高电池的安全性和稳定性
15.实验改进与优化应遵循科学性、直观性、易操作性、安全性的原则,提升化学实验效率。下列有关实验改进分析不正确的是( )
A B C D
A.使用恒压滴液漏斗可防止浓氨水污染环境,并使漏斗内液体顺利流下
B.用点燃的木条靠近肥皂泡,听到爆鸣声,可检验产物中有氢气产生
C.该改进装置可用于性质的探究实验
D.利用此装置可较长时间看到白色絮状沉淀
二、填空题
16.2022年5月6日,我国科学家利用“墨子号”卫星首次实现了地球上相距1200公里的地面站之间的量子态远程传输。化学助力我国科技发展,借助元素周期表可以认识各种材料的结构与性质,元素a~h是元素周期表中短周期元素,其相对位置如下表所示:
请回答下列问题:
(1)a的单质常用作火箭推进剂,该过程中a单质对应的产物为_______(填化学式)。
(2)元素b的一种单质是“墨子号”的储能器件,b在元素周期表中的位置是_______。比较元素g与元素h所形成的简单氢化物的稳定性大小:g______h(填“<”、“=”或“>”)。
(3)c与f的化合物是“墨子号”实现远程传输的核心材料,该化合物属于_______(填“离子”或“共价”)化合物。
(4)g的一种氧化物在果酒的加工中有着重要作用,请写出该氧化物与g的简单氢化物发生反应的化学方程式:___________________________________。
(5)实验室常用制取h的单质,请写出该反应的离子方程式:。
(6)元素d的单质在一定条件下,能与a单质化合生成一种化合物da,灼烧该化合物时,火焰呈___色,da能与水反应放出氢气,若将0.5molda和1mole单质混合加入足量的水,充分反应后生成的气体在标准状况下的体积是___L。
17.层状结构薄膜能用于制作电极材料.薄膜由辉钼矿(主要含及少量FeO、)制得后再与S经气相反应并沉积得到,其流程如下.
回答下列问题:
(1)“焙烧”产生的用溶液吸收生成的离子方程式为________。
(2)“焙烧”后的固体用氨水“浸取”得到重钼酸铵溶液,为提高“浸取”速率,可采用的措施是__________(举一例)。
(3)“灼烧”过程中需回收利用的气体是_________(填化学式)。
(4)在650℃下“气相沉积”生成的反应需在特定气流中进行,选用Ar而不选用形成该气流的原因是__________。
(5)层状晶体与石墨晶体结构类似,层状的晶体类型为________.将嵌入层状充电后得到的可作电池负极,该负极放电时的电极反应式为___________.结合原子结构分析,能嵌入层间可能的原因是_________。
18.化学反应原理在指导实验和生产实际具有重要作用,请结合所学知识完成下列问题:
(1)在2L的密闭绝热容器中,通入等物质的量的NO和气体,随时间的变化如下表:
0 1 2 3 4 5
0.020 0.012 0.008 0.005 0.004 0.004
①反应开始至第2s时,NO的平均反应速率为_______。
②在第5s时,的转化率为_______。
③下列能说明反应已达平衡的是_______。
a.单位时间内,每生成一定物质的量浓度的NO,同时有相同物质的量浓度的生成
b.气体混合物物质的量不再改变
c.气体混合物平均相对分子质量不再改变
d.容器内温度不再发生变化
e.密闭容器内气体颜色不再改变
f.混合气的密度不再改变
(2)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为_______。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片
(3)燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:
①氢氧燃料电池的正极电极反应式为:_______。
②当有5mol电子通过外电路时,负极消耗的气体体积(标准状况下)为_______。
三、实验题
19.Ⅰ、过氧化钠是重要的化工原料,具有多种用途。
(1)过氧化钠是___________色固体,电子式为_______________。
(2)过氧化钠可用作呼吸面具、潜水艇的供氧剂,写出和反应的化学方程式:___________________________________。
(3)某实验小组通过如图所示实验,探究与水的反应,下列说法正确的是___________。(填写字母)
A.②中的大量气泡主要成分是氢气
B.③中溶液变红,说明有酸性物质生成
C.④中现象可能是由于溶液中含有强氧化性物质造成的
D.⑤中MnO2的主要作用是降低了水中氧气的溶解度
(4)具有强氧化性,与反应能生成硫酸钠,写出反应的化学方程式:。
Ⅱ、欲配制0.80mol/L的NaOH溶液480mL,现有以下仪器:
①烧杯,②100mL量筒,③托盘天平(带砝码),④玻璃棒,⑤胶头滴管
(1)配制时,还缺少的玻璃仪器是______________。
(2)使用容量瓶前必须进行的一步操作是__________________。
(3)下列哪些操作会引起所配溶液浓度偏大_________(填写字母)。
A.容量瓶底部有蒸馏水未干燥即用来配制溶液
B.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,并进行定容
C.往容量瓶转移时,有少量液体溅出
D.在容量瓶中定容时俯视刻度线
E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
参考答案
1.答案:C
解析:A.钢化玻璃属于无机非金属材料,故A错误;
B.硅胶是一种高活性吸附材料,不属于新型无机非金属单质材料,故B错误
C.石墨烯属于新型无机非金属单质材料,故C正确;
D.铝合金属于金属材料,不属于新型无机非金属单质材料,故D错误:故选:C。
2.答案:A
解析:沙里淘金是利用金的密度大,沙子在水中漂走而金
留在水底,而将沙子与金分开,没有发生化学变化,故A符合题意;中铁元素化合价为+6价,有强氧化性,能杀菌消毒,杀菌消毒过程发生了化学变化,故B不符合题意;粮食酿酒是将淀粉水解生成葡萄糖,葡萄糖发酵变为乙醇,发生了化学变化,故C不符合题意
3.答案:B
解析:
4.答案:C
解析:A.溶液中与结合生成碳酸镁沉淀,不能大量共存,A不选;
B.含有大量的溶液中亚铁离子、之间发生氧化还原反应,不能大量共存,B不选;
C.与铝粉反应放出的透明溶液,如果显酸性,则可以大量共存,C选;
D.使石莈试液显蓝色的溶液显碱性,转化为氢氧化物沉淀,不能大量共存,D不选;答案选C。
5.答案:C
解析:A.焦炭与二氧化硅在高温条件下反应生成硅单质和一氧化碳,反应方程式:,故A错误,
B.氢氞酸为弱酸,不能拆为离子形式,离子方程式:,故B错误,
C.少量会与强哺氢氧化钠反应生成,反应方程式:
,故C正确,
D.氧化铁溶于氢磺酸生成的铁离子具有氧化性,与 离子发生氧化还原反应,离子方程式:,故D错误,
答案选C。
6.答案:C
解析:
7.答案:B
解析:标准状况)氞气的物质的量为,氞气是单原子分子,氞气含有的质子数是,A正确;
标准状况下,和的混合气体的物质的量为,所含分子数为,B错误,
转移的电子数为,C正确;
与的庠尔质量均为,含有的阳离子分别为,故和的混合物的物质的量为,含有阳京子的物质的量为正确。
8.答案:A
解析:A.加热时,①上部汇集了固体,是由于氯化铵不稳定,受热易分解,分解生成的氨气遇冷重新反应生成氯化铵,故A正确;
B.加热时氨气逸出,②中颜色为无色,冷却后氨气溶解②中为红色,故B错误;
C.二氧化硫与有机色素化合生成无色物质而具有漂白性,受热又分解,恢复颜色,所以加热时,③溶液变红,冷却后又变为无色,故C错误;
D.可逆反应应在同一条件下进行,题中实验分别在加热条件下和冷却后进行,不是可逆反应,故D错误。故选:A。
9.答案:D
解析:【详解】A.由分析可知,不能确定是否含有,A错误;
B.由分析可知,必含,不含,不能确定是否含有,B错误;
C.由分析可知,不含C错误;
D.由分析可知,必含,D正确;故选D。
10.答案:C
解析:A.元素的化合价由+5价降低为+4,被还原,为还原产物,S元素的化合价由+4价升高为+6价,为还原剂,还原性:还原剂>还原产物,故还原性:,故A错误;B..S元素的化合价由+4价升高为+6价,转移2个电子,故每消耗1mol,转移2mol电子,故B错误;C.元素的化合价由+5价降低为+4,S元素的化合价由+4价升高为+6价,则氧化剂是,还原剂是,氧化剂与还原剂的物质的量之比为2:1,故C正确;D.原电池中正极得电子,元素的化合价由+5价降低为+4,得电子生成,则是正极产物,故D错误;故选:C。
11.答案:D
解析:A.中有孤对电子,其电子式表示为故A错误;
B.产物排列顺序是氮离子、镁离子、氮离子、镁离子、氮离子,中只含有离子键,故B错误;
C.反应(2)中N元素化合价前后都为-3价,没有发生改变,故C错误;
D.根据图中信息得到该转化过程总反应可表示,故D正确。综上所述,答案为D。
12.答案:D
解析:
13.答案:B
解析:解析:W为为O,Y为C,Z为,最外层电子数之和为;A.同周期元素从左到右非金属性逐渐增强,同主族元素从上到下非金属性逐渐较弱,故元素非金属性:,A错误;
B.该离子中O元素均满足8电子结构,正确;
C.Z的非金属性强于Y,故最高氧,化物对应水化物酸性,C错误;
D.由于氧,化性比氧气强,故可置换出水中的O,,错误答 选B。
14.答案:B
解析:A.根据总反应式,锌失电子化合价升高,所以为负极,故A正确;
B.原电池中电子由负极外电路流向正极,故B错误;
C.根据总反应式,正极得电子生成,正极反应式为,故C正确;
D.凝胶聚合物电解质具有优异的耐火性能,凝胶电解质可提高电池的安全性和稳定性,故D正确;
故选B。
15.答案:C
解析:C恒压滴液漏斗为密闭装置且能平衡压强,使用恒压滴液漏斗可防止浓氨水污染环境,并使漏斗内液体顺利流下,A正确;氢气具有可燃性,和氧气混合点燃容易爆炸;用点燃的木条靠近肥皂泡,听到爆鸣声,可检验产物中有氢气产生,B正确;铜和浓硫酸需要加热才能反应生成二氧化硫,C错误;装置A中生成氢气排净装置中空气且生成硫酸亚铁,一段时间后关闭a,A中压强变大,硫酸亚铁被压入B中生成氢氧化亚铁沉淀,利用此装置可较长时间看到白色絮状沉淀,D正确。
16.答案:(1)H2O
(2)第二周期第ⅣA族;<
(3)共价
(4)
(5)
(6)黄;28
解析:
17.答案:(1)
(2)将固体粉碎
(3)
(4)和S在加热条件下发生生成H2S
(5)①分子晶体/混合型晶体
②
③为Li失去一个电子形成,原子半径小
解析:
18.答案:(1)①;②40%;③abcde
(2)B
(3)①;②56L
解析:
19.答案:I(1)淡黄;
(2)
(3)C
(4)
Ⅱ(1)500mL容量瓶
(2)检验是否漏液
(3)BD
解析:
同课章节目录
