安徽省宿州市省、市示范高中2023-2024学年高一下学期期中联考化学试卷(含答案)
文档属性
| 名称 | 安徽省宿州市省、市示范高中2023-2024学年高一下学期期中联考化学试卷(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 826.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-19 13:01:46 | ||
图片预览


文档简介
安徽省宿州市省、市示范高中2023-2024学年高一下学期期中联考
化学试卷
考生须知:
1.答题前,在答题卷指定区域填写班级、姓名、考场号、座位号及准考证号并填涂相应数字。
2.所有答案必须写在答题纸上,写在试卷上无效。考试结束后,只需上交答题纸。
本卷可能用到的相对原子质量:H 1 C 12
一、单选题
1.材料是人类赖以生存和发展的物质基础,下列说法正确的是( )
A.“北斗导航”系统应用一体化芯片手机,芯片成分为
B.“天宫二号”空间实验室的硅电池板将光能直接转换为电能
C.C919大飞机采用的材料中使用了高温陶瓷材料氮化硅,氮化硅属于硅酸盐
D.用于北京冬奥会礼仪服智能发热的石墨烯属于无机非金属化合物
2.古典诗词凝聚了古人的智慧,下列诗句中涉及到化学变化且该反应符合下面能量变化图的是( )
A.《望庐山瀑布》“日照香炉生紫烟,遥看瀑布挂前川”
B.《无题》“春蚕到死丝方尽,蜡炬成灰泪始干”
C.《浪淘沙》“千淘万漉虽辛苦,吹尽狂沙始到金”
D.《石灰吟》“千锤万凿出深山,烈火焚烧若等闲”
3.下表中给出了四个实验装置和对应的部分实验现象,其中a、b、c、d为金属电极,由此可判断四种金属的活动性顺序是( )
实验装置
部分实验现象 a表面出现气泡b无变化 溶液中的向c极移动 d极溶解c极有气体产生 电流从a极流向d极
A.b>c>d>a B.d>a>b>c C.a>b>c>d D.a>b>d>c
4.下列各物质间的转化在给定条件下不能实现的是( )
A.
B.
C.
D.
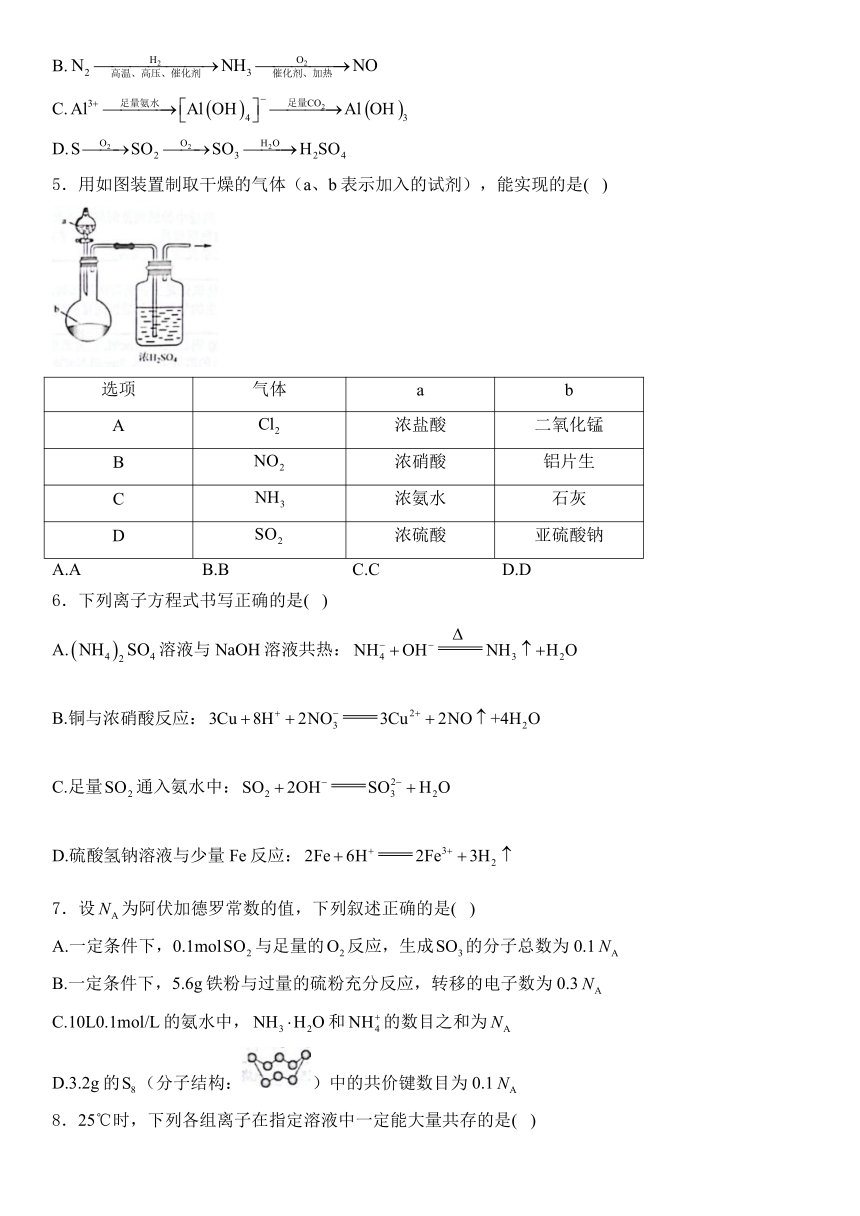
5.用如图装置制取干燥的气体(a、b表示加入的试剂),能实现的是( )
选项 气体 a b
A 浓盐酸 二氧化锰
B 浓硝酸 铝片生
C 浓氨水 石灰
D 浓硫酸 亚硫酸钠
A.A B.B C.C D.D
6.下列离子方程式书写正确的是( )
A.溶液与NaOH溶液共热:
B.铜与浓硝酸反应:
C.足量通入氨水中:
D.硫酸氢钠溶液与少量Fe反应:
7.设为阿伏加德罗常数的值,下列叙述正确的是( )
A.一定条件下,0.1mol与足量的反应,生成的分子总数为0.1
B.一定条件下,5.6g铁粉与过量的硫粉充分反应,转移的电子数为0.3
C.10L0.1mol/L的氨水中,和的数目之和为
D.3.2g的(分子结构:)中的共价键数目为0.1
8.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.硝酸银溶液中:、、、
B.硫酸中:、、、
C.使酚酞变红的溶液中:、、、
D.pH=1的硝酸中:、、、
9.在强碱性溶液中主要以形式存在。燃料电池工作原理如图所示。正极反应式为。(提示:电池效率等于电路上通过的电子数与负极失去电子数之比)下列说法正确的是( )
A.Al电极反应:
B.该电池不适合在较高温度下使用
C.电子由Al极经溶液流向Pt极
D.若正极生成,电路经过2.4mol电子,电池效率为60%
10.利用臭氧可以实现烟气脱硝,反应在体积固定的密闭容器中进行,反应过程中测得的浓度随时间t的变化曲线如图所示。下列叙述错误的是( )
A.反应速率:a-b段>c-d段
B.若向容器内充入一定体积的,化学反应速率加快
C.该脱硝技术还可以将NO转化为,并通过碱液吸收后得到盐,据此判断是酸性氧化物
D.2~8min的化学反应速率
11.制备高纯硅的装置如图所示(加热及夹持装置已省略),利用与过量在1000~1200℃反应(沸点为31.8℃,遇水会剧烈反应)。下列说法正确的是( )
A.实验开始时先加热装置Ⅳ中的石英管,再打开装置Ⅰ中的活塞
B.工业生产中获得的中含有少量的(沸点57.6℃),通过蒸馏可提纯
C.装置将Ⅰ中稀硫酸改用浓硫酸,会使反应速率加快
D.装置Ⅳ的反应:,产生的HCl可直接通入NaOH溶液中
12.下列实验设计能完成相应的实验目的的是( )
选项 A B C D
实验设计
实验目的 向水槽中慢慢加入足量浓硫酸并打开止水夹,产生喷泉 探究化学反应速率的影响因素 验证浓硫酸的脱水性 检验样品是否含钠元素
A.A B.B C.C D.D
13.我国研究人员研制出一种新型催化剂,可借助太阳光在催化剂表面实现高效分解水,过程如图所示。
已知:断裂1mol相关化学键所需能量如表所示。
化学键 中H-O键 中O=O键 中H-H键 中O-O键 中O-H键
键能kJ/mol 463 496 436 138 463
若反应过程中分解了2mol水,则下列说法不正确的是( )
A.氢能资源丰富,属于可再生能源 B.过程Ⅱ放出了574kJ能量
C.的电子式: D.总反应为
14.部分含氮、硫元素的化合物的价-类二维图如图所示。下列关于各物质的说法正确的是( )
A.将c分别通入紫色石蕊溶液和品红溶液中,最终都褪色,证明c具有漂白性
B.a和c反应转化为b,该反应中氧化产物和还原产物质量比为2:1
C.e的浓溶液常温下与Cu反应,e呈现酸性和强氧化性
D.e和f反应产生白烟,可用来检验气体f存在
15.氮氧化物是大气污染物之一,如图为消除氮氧化物的反应机理,下列说法错误( )
A.该过程的总反应是将NO分解成和
B.过程Ⅰ的反应方程式为
C.过程Ⅱ中得到44.8L氧气时,转移电子数为
D.整个过程中作催化剂,和属于中间产物
二、实验题
16.Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用如图装置可以探究与溶液反应生成白色沉淀的条件。
请回答下列问题:
(1)为使与溶液反应生成白色沉淀,可以向其中通入下列哪些气体( )
A. B. C.HCl D.
(2)若e、f两管中的试剂分别是浓氨水和NaOH固体,乙中产生氨气,此时溶液中产生的白色沉淀是______(化学式),的电子式为______,实验室制取该气体的化学反应方程式为______,用装置乙制取氨气时,该套装置图中不足之处______。
(3)氨的催化氧化是工业制硝酸的基础,该反应中还原产物是______。
(4)甲中产生的气体通入酸性高锰酸钾溶液中,可以观察到溶液颜色变浅或褪去,解释原因:______(用离子方程式表示)。
(5)将19.2g铜加入1L1mol/L的稀硝酸中,充分反应后铜全部溶解,还原产物只有NO,向反应后的溶液中加入2mol/LNaOH溶液至沉淀完全,消耗NaOH溶液的体积为______mL。
三、填空题
17.利用某工业废弃固体(成分为和)制备硫酸铜溶液和硫酸亚铁晶体,流程如图所示。
(已知:固体B含有氧化铜、氧化铁)
(1)为了提高废弃固体的反应速率,可以采取的具体措施有______。(写两条)。
(2)操作Ⅰ所使用的玻璃仪器有______;X是______。
(3)常用作工业制硫酸的原料,写出在空气中煅烧的化学方程式______。
(4)气体A与足量的NaOH溶液反应的离子方程式:______。产物在空气中易变质,设计实验探究产物是否变质的具体操作______。
(5)从制备的溶液中提取蓝矾,采用“一系列操作”包括______、______、过滤、洗涤、干燥。
18.Ⅰ.2024年2月23日19时30分,长征五号遥七运载火箭在我国文昌航天发射场成功发射,运载火箭的推进器中装有还原剂肼()和强氧化剂过氧化氢,一定量的和完全反应生成氮气和1mol气态水放出160.4KJ热量。则一定量的与完全反应生成2mol液态时,放出热量______320.8KJ(填“>”“=”或“<”)。
Ⅱ.电池的种类繁多,应用广泛,根据电化学原理回答下列问题。
(1)下图中,若溶液C为稀,A电极材料为Zn,B为Cu电极,电流流向______(用A,B表示),电池工作一段时间后,B电极的质量______(填“增大”“减小”或“不变”)。
(2)燃料电池也是电池的一种,某课外小组自制的氢氧燃料电池,电池的构造如下图所示,a、b均为惰性电极。
则a电极为电池的______(填“正极”或“负极”),b电极的电极反应式为______,标准状况下,若a电极消耗22.4L,则b电极消耗的质量为______g。
19.Ⅰ:在一定温度下,2L密闭的刚性容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:
(1)写出反应的化学方程式:______。
(2)计算反应开始至时刻用N的浓度变化表示的平均反应速率______。
(3)时如果向体系中通入He气,则______(填“增大”“减小”或“不变”)。
(4)能说明该反应已达到平衡状态的标志是______。
a.反应速率
b.容器内压强不再随时间而发生变化
c.容器内N的物质的量分数不再随时间而发生变化
d.混合气体的密度不随时间的变化而变化
e.混合气体的平均相对分子质量不随时间的变化而变化
Ⅱ:某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) 1 2 3 4 5
氢气体积(mL) 50 120 232 290 310
(1)哪一时间段(用0~1、1~2、2~3、3~4、4~5min)反应速率最小______,原因是______。
(2)求2~3min时间段,以单位时间产生气体的体积来表示的该反应速率______mL/min。
参考答案
1.答案:B
解析:A.芯片成分为Si,故A错误;B.硅电池板将光能直接转换为电能,故B正确:C氮化硅属于无机非金属材料,不属于硅酸盐,故C错误:D.石墨烯属于单质,不属于化合物,故D错误;故选B.
2.答案:D
解析::A项,水蒸气凝结为瀑布,为物理变化,不符合题意:B项,蜡烛燃烧为放热反应,生成物的总能量低于反应物的总能量,符合题意;C项,沙里淘金为物理变化,不符合题意;D项,碳酸钙分解为吸热反应,生成物的总能量高于反应物的总能量,不符合题意。答案:B
3.答案:B
解析:电流从a极流到d极,a极为正极,d极为负极,所以d>a,C、D排除。
4.答案:C
解析:
5.答案:D
解析:氨气不能用浓硫酸干燥,C错误;用亚硫酸钠和70%浓硫酸可以制得,再利用浓硫酸干燥可以制得纯净且干燥的,D正确。
6.答案:A
解析:A项,,正确;B项,铜与浓硝酸反应:
,错误,应该是
;C项,足量通入氨水中:
,错误,应该是;D项,硫酸
钠溶液与少量Fe反应:,错误,应该是。
7.答案:D
解析:
8.答案:C
解析:pH=1的硝酸中,与因氧化还原反应而不能大量共存,故D错误。
9.答案:B
解析:
10.答案:C
解析:
11.答案:B
解析:实验开始时先打开装置T中的活塞,再加热装置N中的石英管,A项错误;的沸点为57.6℃,的沸点为31.8℃,故可通过蒸馏的方法分离,B项正确;浓硫酸具有强氧化性,会与发生氧化还原反应,C项错误:HCl气体中含有少量的,若直接通入NaOH溶液,SiHCI3会与NaOH反应,D项错误,答案:B
12.答案:A
解析:
13.答案:C
解析::形成化学键释放能量,则过程Ⅱ放出了436kJ+138kJ=574kJ能量,故B正确;用太阳光在催化剂表面实现高效分解水,总反应为,故D正确.
14.答案:B
解析:
15.答案:C
解析:
16.答案:(1)AB
(2)
直接插入溶液中易引起倒吸
(3)NO、
(4)
(5)400
解析:
17.答案:(1)固体粉碎、提高温度、通入足量的氧气
(2)烧杯、玻璃棒、漏斗;Fe或铁
(3)
(4)
取少量溶液于试管中,先加入足量盐酸,再加入氯化钡溶液,若生成白色沉淀,则证明样品中含有
(5)蒸发浓缩、冷却结晶
解析:
18.答案:Ⅰ.>
Ⅱ.(1)B→A增加
(2)负极
解析:
19.答案:Ⅰ.(1)
(2)
(3)不变
(4)bce
Ⅱ.(1)4~5min
随着反应的进行,溶液中浓度逐渐降低,反应速率降低,在上述几段时间内,4~5min段时间内的浓度最低。
(2)112ml/min
解析:
化学试卷
考生须知:
1.答题前,在答题卷指定区域填写班级、姓名、考场号、座位号及准考证号并填涂相应数字。
2.所有答案必须写在答题纸上,写在试卷上无效。考试结束后,只需上交答题纸。
本卷可能用到的相对原子质量:H 1 C 12
一、单选题
1.材料是人类赖以生存和发展的物质基础,下列说法正确的是( )
A.“北斗导航”系统应用一体化芯片手机,芯片成分为
B.“天宫二号”空间实验室的硅电池板将光能直接转换为电能
C.C919大飞机采用的材料中使用了高温陶瓷材料氮化硅,氮化硅属于硅酸盐
D.用于北京冬奥会礼仪服智能发热的石墨烯属于无机非金属化合物
2.古典诗词凝聚了古人的智慧,下列诗句中涉及到化学变化且该反应符合下面能量变化图的是( )
A.《望庐山瀑布》“日照香炉生紫烟,遥看瀑布挂前川”
B.《无题》“春蚕到死丝方尽,蜡炬成灰泪始干”
C.《浪淘沙》“千淘万漉虽辛苦,吹尽狂沙始到金”
D.《石灰吟》“千锤万凿出深山,烈火焚烧若等闲”
3.下表中给出了四个实验装置和对应的部分实验现象,其中a、b、c、d为金属电极,由此可判断四种金属的活动性顺序是( )
实验装置
部分实验现象 a表面出现气泡b无变化 溶液中的向c极移动 d极溶解c极有气体产生 电流从a极流向d极
A.b>c>d>a B.d>a>b>c C.a>b>c>d D.a>b>d>c
4.下列各物质间的转化在给定条件下不能实现的是( )
A.
B.
C.
D.
5.用如图装置制取干燥的气体(a、b表示加入的试剂),能实现的是( )
选项 气体 a b
A 浓盐酸 二氧化锰
B 浓硝酸 铝片生
C 浓氨水 石灰
D 浓硫酸 亚硫酸钠
A.A B.B C.C D.D
6.下列离子方程式书写正确的是( )
A.溶液与NaOH溶液共热:
B.铜与浓硝酸反应:
C.足量通入氨水中:
D.硫酸氢钠溶液与少量Fe反应:
7.设为阿伏加德罗常数的值,下列叙述正确的是( )
A.一定条件下,0.1mol与足量的反应,生成的分子总数为0.1
B.一定条件下,5.6g铁粉与过量的硫粉充分反应,转移的电子数为0.3
C.10L0.1mol/L的氨水中,和的数目之和为
D.3.2g的(分子结构:)中的共价键数目为0.1
8.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.硝酸银溶液中:、、、
B.硫酸中:、、、
C.使酚酞变红的溶液中:、、、
D.pH=1的硝酸中:、、、
9.在强碱性溶液中主要以形式存在。燃料电池工作原理如图所示。正极反应式为。(提示:电池效率等于电路上通过的电子数与负极失去电子数之比)下列说法正确的是( )
A.Al电极反应:
B.该电池不适合在较高温度下使用
C.电子由Al极经溶液流向Pt极
D.若正极生成,电路经过2.4mol电子,电池效率为60%
10.利用臭氧可以实现烟气脱硝,反应在体积固定的密闭容器中进行,反应过程中测得的浓度随时间t的变化曲线如图所示。下列叙述错误的是( )
A.反应速率:a-b段>c-d段
B.若向容器内充入一定体积的,化学反应速率加快
C.该脱硝技术还可以将NO转化为,并通过碱液吸收后得到盐,据此判断是酸性氧化物
D.2~8min的化学反应速率
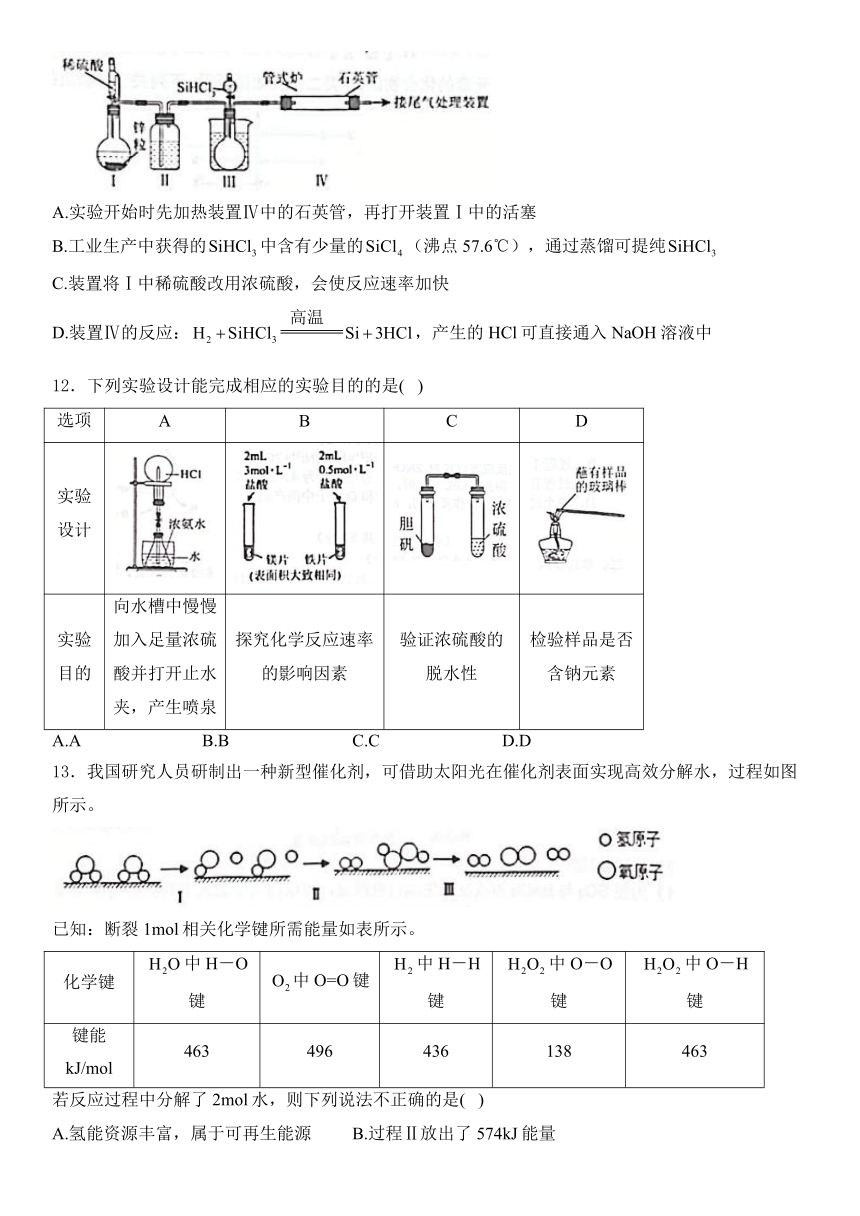
11.制备高纯硅的装置如图所示(加热及夹持装置已省略),利用与过量在1000~1200℃反应(沸点为31.8℃,遇水会剧烈反应)。下列说法正确的是( )
A.实验开始时先加热装置Ⅳ中的石英管,再打开装置Ⅰ中的活塞
B.工业生产中获得的中含有少量的(沸点57.6℃),通过蒸馏可提纯
C.装置将Ⅰ中稀硫酸改用浓硫酸,会使反应速率加快
D.装置Ⅳ的反应:,产生的HCl可直接通入NaOH溶液中
12.下列实验设计能完成相应的实验目的的是( )
选项 A B C D
实验设计
实验目的 向水槽中慢慢加入足量浓硫酸并打开止水夹,产生喷泉 探究化学反应速率的影响因素 验证浓硫酸的脱水性 检验样品是否含钠元素
A.A B.B C.C D.D
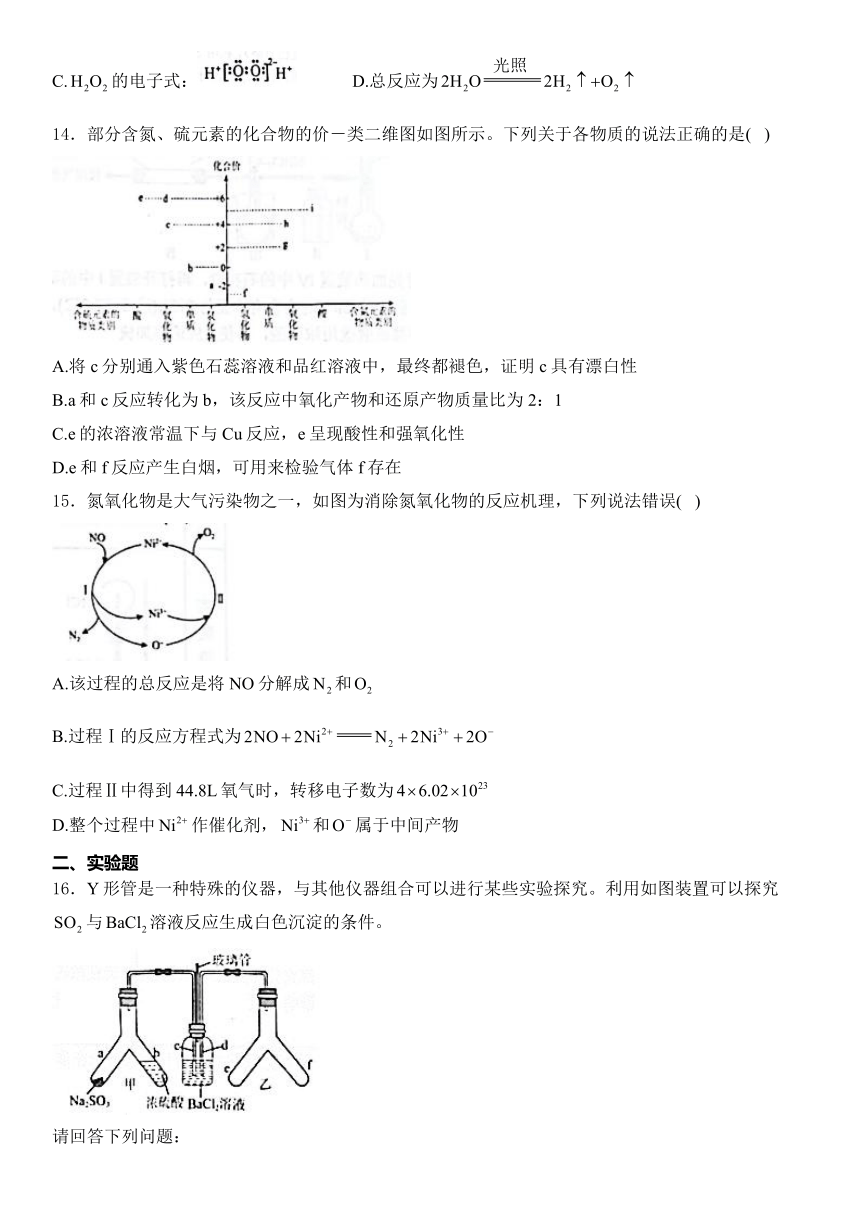
13.我国研究人员研制出一种新型催化剂,可借助太阳光在催化剂表面实现高效分解水,过程如图所示。
已知:断裂1mol相关化学键所需能量如表所示。
化学键 中H-O键 中O=O键 中H-H键 中O-O键 中O-H键
键能kJ/mol 463 496 436 138 463
若反应过程中分解了2mol水,则下列说法不正确的是( )
A.氢能资源丰富,属于可再生能源 B.过程Ⅱ放出了574kJ能量
C.的电子式: D.总反应为
14.部分含氮、硫元素的化合物的价-类二维图如图所示。下列关于各物质的说法正确的是( )
A.将c分别通入紫色石蕊溶液和品红溶液中,最终都褪色,证明c具有漂白性
B.a和c反应转化为b,该反应中氧化产物和还原产物质量比为2:1
C.e的浓溶液常温下与Cu反应,e呈现酸性和强氧化性
D.e和f反应产生白烟,可用来检验气体f存在
15.氮氧化物是大气污染物之一,如图为消除氮氧化物的反应机理,下列说法错误( )
A.该过程的总反应是将NO分解成和
B.过程Ⅰ的反应方程式为
C.过程Ⅱ中得到44.8L氧气时,转移电子数为
D.整个过程中作催化剂,和属于中间产物
二、实验题
16.Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用如图装置可以探究与溶液反应生成白色沉淀的条件。
请回答下列问题:
(1)为使与溶液反应生成白色沉淀,可以向其中通入下列哪些气体( )
A. B. C.HCl D.
(2)若e、f两管中的试剂分别是浓氨水和NaOH固体,乙中产生氨气,此时溶液中产生的白色沉淀是______(化学式),的电子式为______,实验室制取该气体的化学反应方程式为______,用装置乙制取氨气时,该套装置图中不足之处______。
(3)氨的催化氧化是工业制硝酸的基础,该反应中还原产物是______。
(4)甲中产生的气体通入酸性高锰酸钾溶液中,可以观察到溶液颜色变浅或褪去,解释原因:______(用离子方程式表示)。
(5)将19.2g铜加入1L1mol/L的稀硝酸中,充分反应后铜全部溶解,还原产物只有NO,向反应后的溶液中加入2mol/LNaOH溶液至沉淀完全,消耗NaOH溶液的体积为______mL。
三、填空题
17.利用某工业废弃固体(成分为和)制备硫酸铜溶液和硫酸亚铁晶体,流程如图所示。
(已知:固体B含有氧化铜、氧化铁)
(1)为了提高废弃固体的反应速率,可以采取的具体措施有______。(写两条)。
(2)操作Ⅰ所使用的玻璃仪器有______;X是______。
(3)常用作工业制硫酸的原料,写出在空气中煅烧的化学方程式______。
(4)气体A与足量的NaOH溶液反应的离子方程式:______。产物在空气中易变质,设计实验探究产物是否变质的具体操作______。
(5)从制备的溶液中提取蓝矾,采用“一系列操作”包括______、______、过滤、洗涤、干燥。
18.Ⅰ.2024年2月23日19时30分,长征五号遥七运载火箭在我国文昌航天发射场成功发射,运载火箭的推进器中装有还原剂肼()和强氧化剂过氧化氢,一定量的和完全反应生成氮气和1mol气态水放出160.4KJ热量。则一定量的与完全反应生成2mol液态时,放出热量______320.8KJ(填“>”“=”或“<”)。
Ⅱ.电池的种类繁多,应用广泛,根据电化学原理回答下列问题。
(1)下图中,若溶液C为稀,A电极材料为Zn,B为Cu电极,电流流向______(用A,B表示),电池工作一段时间后,B电极的质量______(填“增大”“减小”或“不变”)。
(2)燃料电池也是电池的一种,某课外小组自制的氢氧燃料电池,电池的构造如下图所示,a、b均为惰性电极。
则a电极为电池的______(填“正极”或“负极”),b电极的电极反应式为______,标准状况下,若a电极消耗22.4L,则b电极消耗的质量为______g。
19.Ⅰ:在一定温度下,2L密闭的刚性容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:
(1)写出反应的化学方程式:______。
(2)计算反应开始至时刻用N的浓度变化表示的平均反应速率______。
(3)时如果向体系中通入He气,则______(填“增大”“减小”或“不变”)。
(4)能说明该反应已达到平衡状态的标志是______。
a.反应速率
b.容器内压强不再随时间而发生变化
c.容器内N的物质的量分数不再随时间而发生变化
d.混合气体的密度不随时间的变化而变化
e.混合气体的平均相对分子质量不随时间的变化而变化
Ⅱ:某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) 1 2 3 4 5
氢气体积(mL) 50 120 232 290 310
(1)哪一时间段(用0~1、1~2、2~3、3~4、4~5min)反应速率最小______,原因是______。
(2)求2~3min时间段,以单位时间产生气体的体积来表示的该反应速率______mL/min。
参考答案
1.答案:B
解析:A.芯片成分为Si,故A错误;B.硅电池板将光能直接转换为电能,故B正确:C氮化硅属于无机非金属材料,不属于硅酸盐,故C错误:D.石墨烯属于单质,不属于化合物,故D错误;故选B.
2.答案:D
解析::A项,水蒸气凝结为瀑布,为物理变化,不符合题意:B项,蜡烛燃烧为放热反应,生成物的总能量低于反应物的总能量,符合题意;C项,沙里淘金为物理变化,不符合题意;D项,碳酸钙分解为吸热反应,生成物的总能量高于反应物的总能量,不符合题意。答案:B
3.答案:B
解析:电流从a极流到d极,a极为正极,d极为负极,所以d>a,C、D排除。
4.答案:C
解析:
5.答案:D
解析:氨气不能用浓硫酸干燥,C错误;用亚硫酸钠和70%浓硫酸可以制得,再利用浓硫酸干燥可以制得纯净且干燥的,D正确。
6.答案:A
解析:A项,,正确;B项,铜与浓硝酸反应:
,错误,应该是
;C项,足量通入氨水中:
,错误,应该是;D项,硫酸
钠溶液与少量Fe反应:,错误,应该是。
7.答案:D
解析:
8.答案:C
解析:pH=1的硝酸中,与因氧化还原反应而不能大量共存,故D错误。
9.答案:B
解析:
10.答案:C
解析:
11.答案:B
解析:实验开始时先打开装置T中的活塞,再加热装置N中的石英管,A项错误;的沸点为57.6℃,的沸点为31.8℃,故可通过蒸馏的方法分离,B项正确;浓硫酸具有强氧化性,会与发生氧化还原反应,C项错误:HCl气体中含有少量的,若直接通入NaOH溶液,SiHCI3会与NaOH反应,D项错误,答案:B
12.答案:A
解析:
13.答案:C
解析::形成化学键释放能量,则过程Ⅱ放出了436kJ+138kJ=574kJ能量,故B正确;用太阳光在催化剂表面实现高效分解水,总反应为,故D正确.
14.答案:B
解析:
15.答案:C
解析:
16.答案:(1)AB
(2)
直接插入溶液中易引起倒吸
(3)NO、
(4)
(5)400
解析:
17.答案:(1)固体粉碎、提高温度、通入足量的氧气
(2)烧杯、玻璃棒、漏斗;Fe或铁
(3)
(4)
取少量溶液于试管中,先加入足量盐酸,再加入氯化钡溶液,若生成白色沉淀,则证明样品中含有
(5)蒸发浓缩、冷却结晶
解析:
18.答案:Ⅰ.>
Ⅱ.(1)B→A增加
(2)负极
解析:
19.答案:Ⅰ.(1)
(2)
(3)不变
(4)bce
Ⅱ.(1)4~5min
随着反应的进行,溶液中浓度逐渐降低,反应速率降低,在上述几段时间内,4~5min段时间内的浓度最低。
(2)112ml/min
解析:
同课章节目录
