吉林省白山市抚松县第一中学2023-2024学年高二下学期5月期中考试化学试题(含答案)
文档属性
| 名称 | 吉林省白山市抚松县第一中学2023-2024学年高二下学期5月期中考试化学试题(含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 1001.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-19 00:00:00 | ||
图片预览


文档简介
抚松县第一中学2023-2024学年高二下学期5月期中考试
化学学科试卷
可能用到的相对原子质量:H:1 C:12 O:16 Fe:56 Al:27
Ⅰ卷
一、单选题(本小题包括1-15题,每小题只有一个正确选项,每小题3分,共45分)
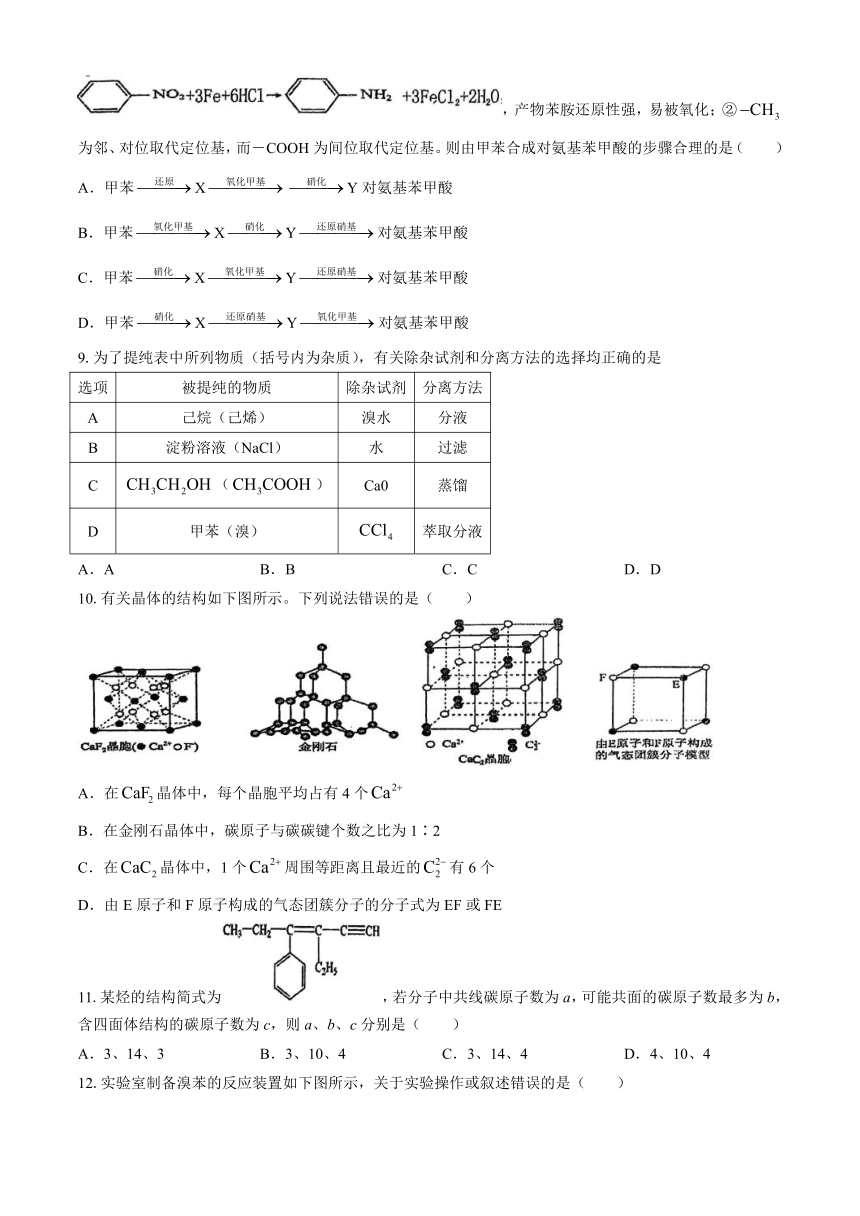
1.烟气中的二氧化硫可用于处理含铬(Ⅵ)废水,其反应为:
,下列化学用语正确的是( )
A.基态Cr原子的价电子排布式:
B.的VSEPR模型:
C.中子数为21的K核素符号
D.用轨道表示式表示中O原子的杂化:
2.下列有机物的命名正确的是( )
A.:二甲苯
B.:4-甲基-2-乙基-1-戊烯
C.:3-甲基-3-乙基-1-丁炔
D.:2,2,3-三甲基戊烷
3.下列实验装置图正确的是( )
A.实验室制备及收集乙烯 B.石油分馏
C.实验室制硝基苯 D.检验乙炔还原性
4.丙烯可发生如下转化,下列说法错误的是( )
A.的同分异构体有4种 B.X的结构简式为
C.等质量的丙烯和乙烯完全燃烧耗氧量相同 D.聚合物Z的链节为
5.对下列事实的解释不正确的是( )
选项 事实 解释
A 稳定性:HF>HI HF分子间存在氢键,HI分子间不存在氢键
B 键角: 中心原子均采取杂化,孤电子对有较大的斥力
C 熔点:石英>于冰 石英是共价晶体,干冰是分子晶体;共价键比分子间作用力强
D 酸性: F的电负性大于Cl,F-C的极性大于C1-C,使的极性大于的极性
A.A B.B C.C D.D
6.某盐可作防霉剂,其阴、阳离子结构如图所示,由X、Y、Z、W、Q五种原子序数依次增大的短周期主族元素构成。其中Y核外电子占据的原子轨道数为4,W的简单离子半径在同周期中最小。下列说法错误的是( )
A.氢化物的沸点:Y<Z B.第一电离能:W<Q
C.该阴离子中含有配位键 D.最高价氧化物对应水化物的酸性:W<Y
7.下列说法中正确的是( )
A.配合物可用于离子检验,1mol配合物中键数目为6
B.配离子为,中心离子为,配位数为6,配位原子有C和N
C.1mol苯乙烯()中含有的碳碳双键数目为4
D.标准状况下,2.24L 含有的氯原子数为0.3
8.对氨基苯甲酸可用甲苯为原料合成。已知①苯环上的硝基可被还原为氨基:
,产物苯胺还原性强,易被氧化;②为邻、对位取代定位基,而-COOH为间位取代定位基。则由甲苯合成对氨基苯甲酸的步骤合理的是( )
A.甲苯XY对氨基苯甲酸
B.甲苯XY对氨基苯甲酸
C.甲苯XY对氨基苯甲酸
D.甲苯XY对氨基苯甲酸
9.为了提纯表中所列物质(括号内为杂质),有关除杂试剂和分离方法的选择均正确的是
选项 被提纯的物质 除杂试剂 分离方法
A 己烷(己烯) 溴水 分液
B 淀粉溶液(NaCl) 水 过滤
C () Ca0 蒸馏
D 甲苯(溴) 萃取分液
A.A B.B C.C D.D
10.有关晶体的结构如下图所示。下列说法错误的是( )
A.在晶体中,每个晶胞平均占有4个
B.在金刚石晶体中,碳原子与碳碳键个数之比为1∶2
C.在晶体中,1个周围等距离且最近的有6个
D.由E原子和F原子构成的气态团簇分子的分子式为EF或FE
11.某烃的结构简式为,若分子中共线碳原子数为a,可能共面的碳原子数最多为b,含四面体结构的碳原子数为c,则a、b、c分别是( )
A.3、14、3 B.3、10、4 C.3、14、4 D.4、10、4
12.实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是( )
A.向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
C.装置c中的碳酸钠溶液的作用是吸收溴化氢
D.实验中装置b中的液体逐渐变为浅红色
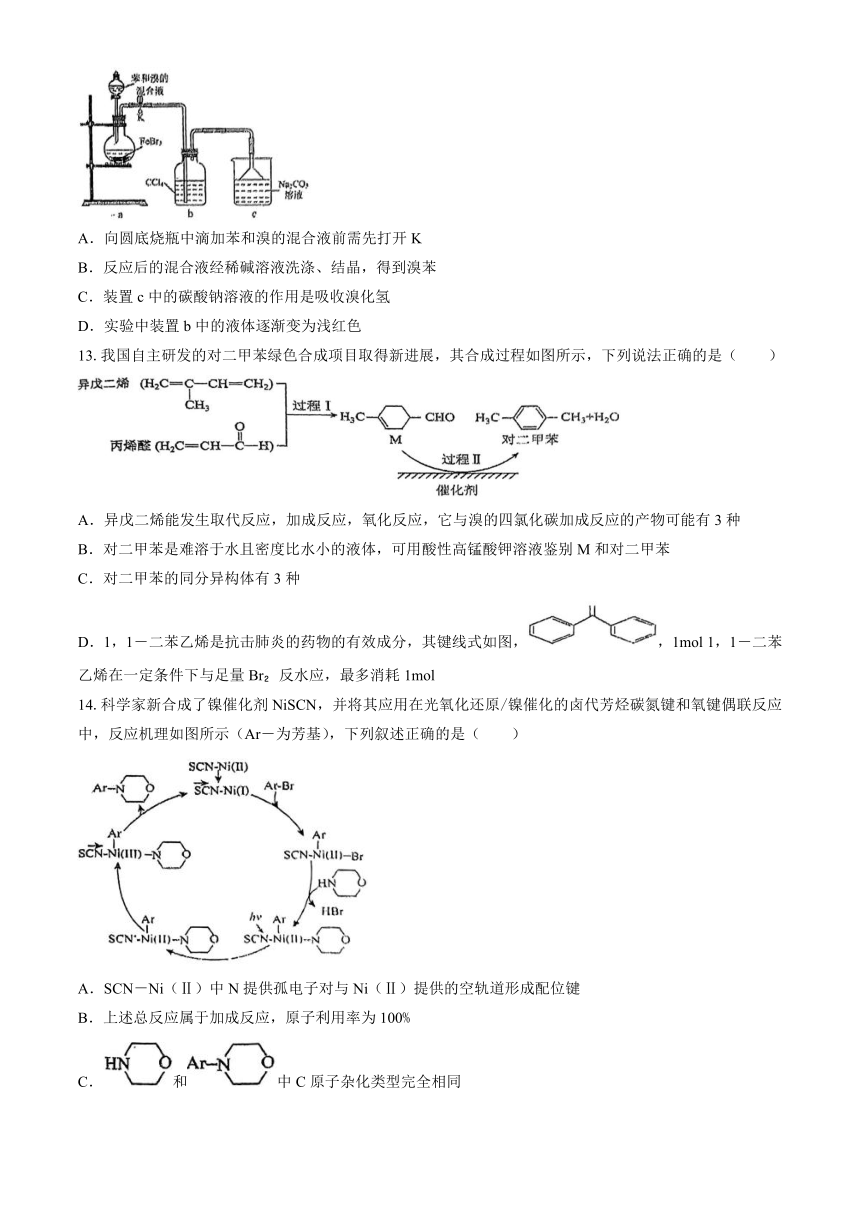
13.我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示,下列说法正确的是( )
A.异戊二烯能发生取代反应,加成反应,氧化反应,它与溴的四氯化碳加成反应的产物可能有3种
B.对二甲苯是难溶于水且密度比水小的液体,可用酸性高锰酸钾溶液鉴别M和对二甲苯
C.对二甲苯的同分异构体有3种
D.1,1-二苯乙烯是抗击肺炎的药物的有效成分,其键线式如图,,1mol 1,1-二苯乙烯在一定条件下与足量Br 反水应,最多消耗1mol
14.科学家新合成了镍催化剂NiSCN,并将其应用在光氧化还原/镍催化的卤代芳烃碳氮键和氧键偶联反应中,反应机理如图所示(Ar-为芳基),下列叙述正确的是( )
A.SCN-Ni(Ⅱ)中N提供孤电子对与Ni(Ⅱ)提供的空轨道形成配位键
B.上述总反应属于加成反应,原子利用率为100%
C.和中C原子杂化类型完全相同
D.上述循环中,Ni的化合价保持不变
15.三位科学家因在烯烃复分解反应研究中的杰出贡献而荣获2005年度诺贝尔化学奖,烯烃复分解反应可示意如下:
下列化合物中,经过烯烃复分解反应可以生成的是( )
A. B. C. D.
Ⅱ卷
二、填空题(本题包括16、17、18、19四小题,共55分)
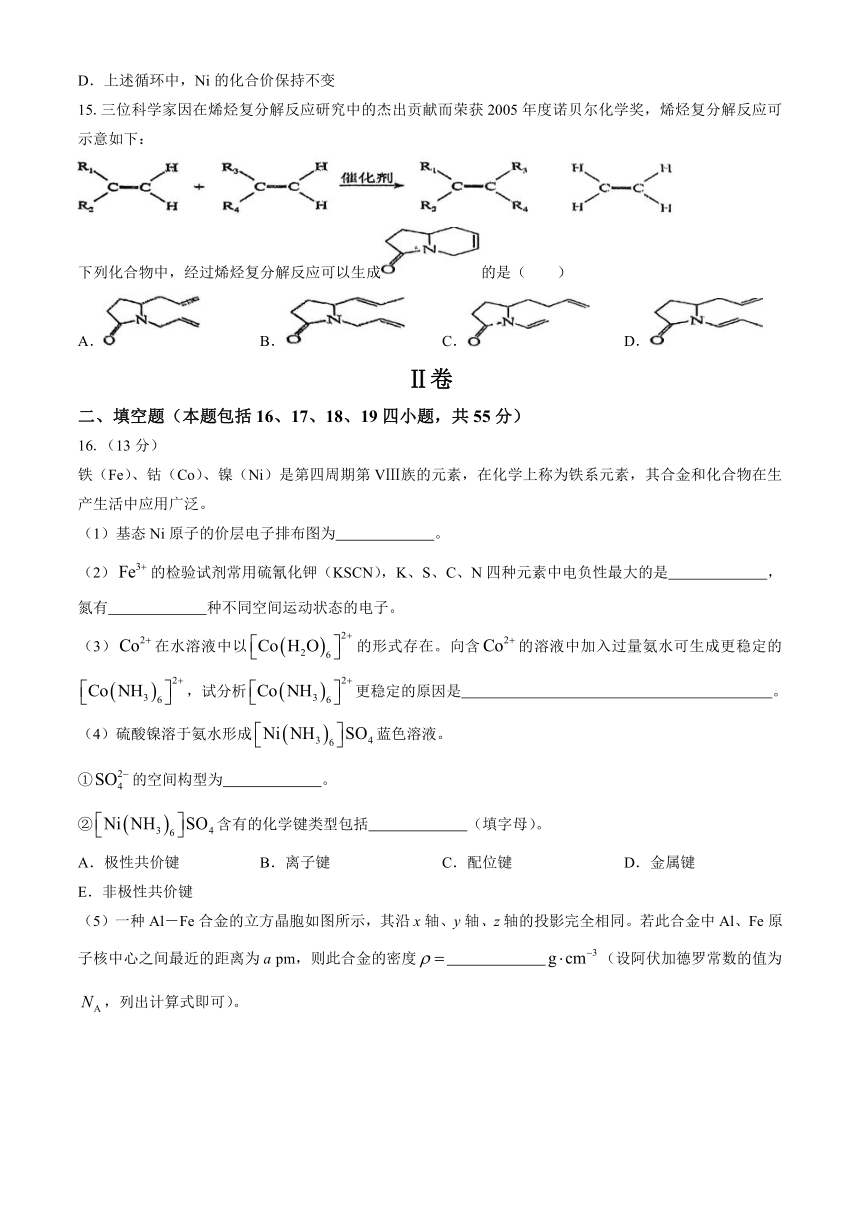
16.(13分)
铁(Fe)、钴(Co)、镍(Ni)是第四周期第VⅢ族的元素,在化学上称为铁系元素,其合金和化合物在生产生活中应用广泛。
(1)基态Ni原子的价层电子排布图为 。
(2)的检验试剂常用硫氰化钾(KSCN),K、S、C、N四种元素中电负性最大的是 ,氮有 种不同空间运动状态的电子。
(3)在水溶液中以的形式存在。向含的溶液中加入过量氨水可生成更稳定的,试分析更稳定的原因是 。
(4)硫酸镍溶于氨水形成蓝色溶液。
①的空间构型为 。
②含有的化学键类型包括 (填字母)。
A.极性共价键 B.离子键 C.配位键 D.金属键
E.非极性共价键
(5)一种Al-Fe合金的立方晶胞如图所示,其沿x轴、y轴、z轴的投影完全相同。若此合金中Al、Fe原子核中心之间最近的距离为a pm,则此合金的密度 (设阿伏加德罗常数的值为,列出计算式即可)。
17.(18分)
2-溴戊二酸二甲酯(相对分子质量为239)是某抗癌药物的重要中间体,其制备的反应原理如图所示:
制备装置如图所示(夹持装置已略去):
实验步骤如下:
步骤一:制备
将10.0g戊二酸(固态,相对分子质量为132)加入到三颈烧瓶中,再向其中加入三氯甲烷25mL,搅拌均匀,保持78℃条件下,依次缓慢滴加12mL氯化亚砜、3滴催化剂、10ml液溴,随后回流;回流完毕后,将三颈烧瓶置于冰盐浴中,将溶液温度降到-10℃后,缓慢滴加25mL甲醇(沸点64.7℃)保持滴加过程中温度不超过0℃。
步骤二:除杂
向三颈烧瓶中加入25mL饱和碳酸氢钠溶液进行洗涤,分液除去上层水相,下层有机相再用25mL饱和氯化钠溶液洗涤3次,洗涤完毕,“用无水硫酸镁干燥,过滤。
步骤三:提纯
过滤后的液体置于热浴容器中(外温170℃),接上精馏装置,进行减压蒸馏。
步骤四:收集
收集100—110℃的馏分,得到10.86g无色透明油状液体。
回答下列问题:
(1)使用装置A的优点是 ,三颈烧瓶宜选择的规格是 (填标号)。
A.50mL B.150mL C.200mL D.500mL
(2)步骤一中采取“温度降到-10℃”“缓慢滴加”这些措施的可能原因有 。
a.减缓反应速率
b.防止高温下发生复杂的有机副反应
c.避免原料挥发,使反应物充分反应
(3)步骤二中用饱和氯化钠溶液洗涤的目的是 。
(4)步骤三中使用减压蒸馏的目的是 。
(5)中间产物Ⅰ比戊二酸的沸点低很多的原因是 ,反应中生成中间产物1(戊二酰氯)的同时得到两种有刺激性气味的气体,该反应的化学方程式为 。
(6)从环保角度分析,该实验装置存在明显不足之处,解决的办法是 。
(7)本实验的产率约是 。
A.30% B.50% C.60% D.80%
18.(8分)
化合物A经李比希法测得其中含C 72.0%、H 6.67%,其余为氧;现代仪器分析有机化合物的分子结构有以下两种方法。
方法一:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为1∶2∶2∶2∶3。
方法二:利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱和质谱图如下图:
已知:A分子中只含一个苯环,且苯环上只有一个取代基。试回答下列问题。
(1)A的相对分子质量 ,分子式为 。
(2)A可能的结构简式为 (至少写出两种)
(3)A的芳香化合物类同分异构体多种,其中分子中含甲基的芳香酸共有 种
19.(16分)
化合物W为2-甲基-1,3-丁二烯是一种重要的化工原料。可以发生以下反应。
已知:
1.共轭二烯烃(含有两个碳碳双键,且两个双键被一个单键隔开的烯烃)可以与含碳碳双键的化合物在一定条件下发生第尔斯-阿尔德(Diels-Alder)反应,得到环状产物。
例如:
2.已知烯烃与酸性溶液反应时,不同的结构可以得到不同的氧化产物。如
。
请回答下列问题:
(1)化合物A存在顺反异构,写出A的结构简式 。
(2)B为含有六元环的有机物,写出2-甲基-1,3-丁二烯与乙烯反应的化学方程式
。
(3)第尔斯-阿尔德(Diels-Alder)反应在有机合成中有重要作用
下列不能与乙烯发生Diels-Alder反应的有机物是 (填字母)
a. b. c. d.
(4)W的一种同系物H用酸性溶液氧化,得到乙酸()琥珀酸()丙酮三者的混合物,则H的结构简式为 。
Ⅱ以甲苯为原料可制得重要的药物合成中间体P,合成线路如下所示:
已知:
①
②具有较强的还原性
回答下列问题:
(5)B的结构简式为 ,F中含氧官能团的名称为 。
(5)D→E转化需加入的试剂为 。设计C→D步骤的目的是 。
(7)M→N反应的化学方程式为 。
(8)通过N、F合成P的反应属类型为 ,合成过程中还需加入适量可提高产率原因为 。
化学答案
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 D B C B A A B C C D C B D A A
16.(13分)【除特殊标注外,每空2分】
(1)
(2)N 5(各一分)
(3)N元素电负性比O元素电负性小,N原子提供孤电子对的倾向更大,与形成的配位键更强
(4)正四面体形 ABC
(5)
17.(18分)【每空2分】
(1)平衡气压,便于液体顺利流下;B
(2)abc
(3)除去有机相中残留的
(4)降低有机物沸点,减少挥发
(5)戊二酸分子间存在氢键,中间产物Ⅰ分子间不存在氢键
(6)在冷凝管上端尾部连接装有碱石灰的球形干燥管
(7)C
18.(8分)【每空2分(2)任写两种得2分】
150
(4)
、、、
10
19.(16分)【每题2分】
Ⅰ
(1)
(2)
(3)ac
(4)或
Ⅱ
(5) 羧基
(6)酸性溶液保护氨基(),避免氨基被酸性溶液氧化
(7)
(8)取代反应,消耗生成的HCl,促使反应正向进行,提高产率
化学学科试卷
可能用到的相对原子质量:H:1 C:12 O:16 Fe:56 Al:27
Ⅰ卷
一、单选题(本小题包括1-15题,每小题只有一个正确选项,每小题3分,共45分)
1.烟气中的二氧化硫可用于处理含铬(Ⅵ)废水,其反应为:
,下列化学用语正确的是( )
A.基态Cr原子的价电子排布式:
B.的VSEPR模型:
C.中子数为21的K核素符号
D.用轨道表示式表示中O原子的杂化:
2.下列有机物的命名正确的是( )
A.:二甲苯
B.:4-甲基-2-乙基-1-戊烯
C.:3-甲基-3-乙基-1-丁炔
D.:2,2,3-三甲基戊烷
3.下列实验装置图正确的是( )
A.实验室制备及收集乙烯 B.石油分馏
C.实验室制硝基苯 D.检验乙炔还原性
4.丙烯可发生如下转化,下列说法错误的是( )
A.的同分异构体有4种 B.X的结构简式为
C.等质量的丙烯和乙烯完全燃烧耗氧量相同 D.聚合物Z的链节为
5.对下列事实的解释不正确的是( )
选项 事实 解释
A 稳定性:HF>HI HF分子间存在氢键,HI分子间不存在氢键
B 键角: 中心原子均采取杂化,孤电子对有较大的斥力
C 熔点:石英>于冰 石英是共价晶体,干冰是分子晶体;共价键比分子间作用力强
D 酸性: F的电负性大于Cl,F-C的极性大于C1-C,使的极性大于的极性
A.A B.B C.C D.D
6.某盐可作防霉剂,其阴、阳离子结构如图所示,由X、Y、Z、W、Q五种原子序数依次增大的短周期主族元素构成。其中Y核外电子占据的原子轨道数为4,W的简单离子半径在同周期中最小。下列说法错误的是( )
A.氢化物的沸点:Y<Z B.第一电离能:W<Q
C.该阴离子中含有配位键 D.最高价氧化物对应水化物的酸性:W<Y
7.下列说法中正确的是( )
A.配合物可用于离子检验,1mol配合物中键数目为6
B.配离子为,中心离子为,配位数为6,配位原子有C和N
C.1mol苯乙烯()中含有的碳碳双键数目为4
D.标准状况下,2.24L 含有的氯原子数为0.3
8.对氨基苯甲酸可用甲苯为原料合成。已知①苯环上的硝基可被还原为氨基:
,产物苯胺还原性强,易被氧化;②为邻、对位取代定位基,而-COOH为间位取代定位基。则由甲苯合成对氨基苯甲酸的步骤合理的是( )
A.甲苯XY对氨基苯甲酸
B.甲苯XY对氨基苯甲酸
C.甲苯XY对氨基苯甲酸
D.甲苯XY对氨基苯甲酸
9.为了提纯表中所列物质(括号内为杂质),有关除杂试剂和分离方法的选择均正确的是
选项 被提纯的物质 除杂试剂 分离方法
A 己烷(己烯) 溴水 分液
B 淀粉溶液(NaCl) 水 过滤
C () Ca0 蒸馏
D 甲苯(溴) 萃取分液
A.A B.B C.C D.D
10.有关晶体的结构如下图所示。下列说法错误的是( )
A.在晶体中,每个晶胞平均占有4个
B.在金刚石晶体中,碳原子与碳碳键个数之比为1∶2
C.在晶体中,1个周围等距离且最近的有6个
D.由E原子和F原子构成的气态团簇分子的分子式为EF或FE
11.某烃的结构简式为,若分子中共线碳原子数为a,可能共面的碳原子数最多为b,含四面体结构的碳原子数为c,则a、b、c分别是( )
A.3、14、3 B.3、10、4 C.3、14、4 D.4、10、4
12.实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是( )
A.向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
C.装置c中的碳酸钠溶液的作用是吸收溴化氢
D.实验中装置b中的液体逐渐变为浅红色
13.我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示,下列说法正确的是( )
A.异戊二烯能发生取代反应,加成反应,氧化反应,它与溴的四氯化碳加成反应的产物可能有3种
B.对二甲苯是难溶于水且密度比水小的液体,可用酸性高锰酸钾溶液鉴别M和对二甲苯
C.对二甲苯的同分异构体有3种
D.1,1-二苯乙烯是抗击肺炎的药物的有效成分,其键线式如图,,1mol 1,1-二苯乙烯在一定条件下与足量Br 反水应,最多消耗1mol
14.科学家新合成了镍催化剂NiSCN,并将其应用在光氧化还原/镍催化的卤代芳烃碳氮键和氧键偶联反应中,反应机理如图所示(Ar-为芳基),下列叙述正确的是( )
A.SCN-Ni(Ⅱ)中N提供孤电子对与Ni(Ⅱ)提供的空轨道形成配位键
B.上述总反应属于加成反应,原子利用率为100%
C.和中C原子杂化类型完全相同
D.上述循环中,Ni的化合价保持不变
15.三位科学家因在烯烃复分解反应研究中的杰出贡献而荣获2005年度诺贝尔化学奖,烯烃复分解反应可示意如下:
下列化合物中,经过烯烃复分解反应可以生成的是( )
A. B. C. D.
Ⅱ卷
二、填空题(本题包括16、17、18、19四小题,共55分)
16.(13分)
铁(Fe)、钴(Co)、镍(Ni)是第四周期第VⅢ族的元素,在化学上称为铁系元素,其合金和化合物在生产生活中应用广泛。
(1)基态Ni原子的价层电子排布图为 。
(2)的检验试剂常用硫氰化钾(KSCN),K、S、C、N四种元素中电负性最大的是 ,氮有 种不同空间运动状态的电子。
(3)在水溶液中以的形式存在。向含的溶液中加入过量氨水可生成更稳定的,试分析更稳定的原因是 。
(4)硫酸镍溶于氨水形成蓝色溶液。
①的空间构型为 。
②含有的化学键类型包括 (填字母)。
A.极性共价键 B.离子键 C.配位键 D.金属键
E.非极性共价键
(5)一种Al-Fe合金的立方晶胞如图所示,其沿x轴、y轴、z轴的投影完全相同。若此合金中Al、Fe原子核中心之间最近的距离为a pm,则此合金的密度 (设阿伏加德罗常数的值为,列出计算式即可)。
17.(18分)
2-溴戊二酸二甲酯(相对分子质量为239)是某抗癌药物的重要中间体,其制备的反应原理如图所示:
制备装置如图所示(夹持装置已略去):
实验步骤如下:
步骤一:制备
将10.0g戊二酸(固态,相对分子质量为132)加入到三颈烧瓶中,再向其中加入三氯甲烷25mL,搅拌均匀,保持78℃条件下,依次缓慢滴加12mL氯化亚砜、3滴催化剂、10ml液溴,随后回流;回流完毕后,将三颈烧瓶置于冰盐浴中,将溶液温度降到-10℃后,缓慢滴加25mL甲醇(沸点64.7℃)保持滴加过程中温度不超过0℃。
步骤二:除杂
向三颈烧瓶中加入25mL饱和碳酸氢钠溶液进行洗涤,分液除去上层水相,下层有机相再用25mL饱和氯化钠溶液洗涤3次,洗涤完毕,“用无水硫酸镁干燥,过滤。
步骤三:提纯
过滤后的液体置于热浴容器中(外温170℃),接上精馏装置,进行减压蒸馏。
步骤四:收集
收集100—110℃的馏分,得到10.86g无色透明油状液体。
回答下列问题:
(1)使用装置A的优点是 ,三颈烧瓶宜选择的规格是 (填标号)。
A.50mL B.150mL C.200mL D.500mL
(2)步骤一中采取“温度降到-10℃”“缓慢滴加”这些措施的可能原因有 。
a.减缓反应速率
b.防止高温下发生复杂的有机副反应
c.避免原料挥发,使反应物充分反应
(3)步骤二中用饱和氯化钠溶液洗涤的目的是 。
(4)步骤三中使用减压蒸馏的目的是 。
(5)中间产物Ⅰ比戊二酸的沸点低很多的原因是 ,反应中生成中间产物1(戊二酰氯)的同时得到两种有刺激性气味的气体,该反应的化学方程式为 。
(6)从环保角度分析,该实验装置存在明显不足之处,解决的办法是 。
(7)本实验的产率约是 。
A.30% B.50% C.60% D.80%
18.(8分)
化合物A经李比希法测得其中含C 72.0%、H 6.67%,其余为氧;现代仪器分析有机化合物的分子结构有以下两种方法。
方法一:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为1∶2∶2∶2∶3。
方法二:利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱和质谱图如下图:
已知:A分子中只含一个苯环,且苯环上只有一个取代基。试回答下列问题。
(1)A的相对分子质量 ,分子式为 。
(2)A可能的结构简式为 (至少写出两种)
(3)A的芳香化合物类同分异构体多种,其中分子中含甲基的芳香酸共有 种
19.(16分)
化合物W为2-甲基-1,3-丁二烯是一种重要的化工原料。可以发生以下反应。
已知:
1.共轭二烯烃(含有两个碳碳双键,且两个双键被一个单键隔开的烯烃)可以与含碳碳双键的化合物在一定条件下发生第尔斯-阿尔德(Diels-Alder)反应,得到环状产物。
例如:
2.已知烯烃与酸性溶液反应时,不同的结构可以得到不同的氧化产物。如
。
请回答下列问题:
(1)化合物A存在顺反异构,写出A的结构简式 。
(2)B为含有六元环的有机物,写出2-甲基-1,3-丁二烯与乙烯反应的化学方程式
。
(3)第尔斯-阿尔德(Diels-Alder)反应在有机合成中有重要作用
下列不能与乙烯发生Diels-Alder反应的有机物是 (填字母)
a. b. c. d.
(4)W的一种同系物H用酸性溶液氧化,得到乙酸()琥珀酸()丙酮三者的混合物,则H的结构简式为 。
Ⅱ以甲苯为原料可制得重要的药物合成中间体P,合成线路如下所示:
已知:
①
②具有较强的还原性
回答下列问题:
(5)B的结构简式为 ,F中含氧官能团的名称为 。
(5)D→E转化需加入的试剂为 。设计C→D步骤的目的是 。
(7)M→N反应的化学方程式为 。
(8)通过N、F合成P的反应属类型为 ,合成过程中还需加入适量可提高产率原因为 。
化学答案
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 D B C B A A B C C D C B D A A
16.(13分)【除特殊标注外,每空2分】
(1)
(2)N 5(各一分)
(3)N元素电负性比O元素电负性小,N原子提供孤电子对的倾向更大,与形成的配位键更强
(4)正四面体形 ABC
(5)
17.(18分)【每空2分】
(1)平衡气压,便于液体顺利流下;B
(2)abc
(3)除去有机相中残留的
(4)降低有机物沸点,减少挥发
(5)戊二酸分子间存在氢键,中间产物Ⅰ分子间不存在氢键
(6)在冷凝管上端尾部连接装有碱石灰的球形干燥管
(7)C
18.(8分)【每空2分(2)任写两种得2分】
150
(4)
、、、
10
19.(16分)【每题2分】
Ⅰ
(1)
(2)
(3)ac
(4)或
Ⅱ
(5) 羧基
(6)酸性溶液保护氨基(),避免氨基被酸性溶液氧化
(7)
(8)取代反应,消耗生成的HCl,促使反应正向进行,提高产率
同课章节目录
