河北省邢台市翰林高级中学等校2023-2024学年高一下学期期中考试化学试题(含答案)
文档属性
| 名称 | 河北省邢台市翰林高级中学等校2023-2024学年高一下学期期中考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 500.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-19 15:27:39 | ||
图片预览



文档简介
邢台市翰林高级中学等校2023-2024学年高一下学期期中考试
化学试题
本试卷满分100分,考试用时75分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.本试卷主要考试内容:人教版必修第二册第五章至第六章。
5.可能用到的相对原子质量:
一、选择题:本题共14小题,每小题3分,共42分。每小题只有一个选项符合题目要求。
1.化学与生活密切相关,下列能量主要转化形式描述错误的是
天然气烧开水 烟花的燃放 电磁炉炒菜 风力发电
A.化学能转化为热能 B.化学能转化为光能和热能 C.电能转化为化学能 D.风能转化为电能
2.下列各图中,能表示人工合成氨反应的能量变化的是
A. B.
C. D.
3.下列物质的性质与用途具有对应关系的是
A.液氨具有刺激性气味,可用作制冷剂 B.浓硫酸具有吸水性,可用于干燥
C.SiC的硬度很大,可用作砂纸和砂轮的磨料 D.高纯硅具有良好的导电性,可用于制作太阳能电池
4.酸雨形成的示意图如图。下列说法错误的是
A.均为酸性氧化物 B.火山喷发、森林火灾都会产生
C.工厂产生的烟气应经脱硫处理后再排放 D.酸雨形成过程中涉及氧化还原反应
5.下列各组离子在溶液中能大量共存的是
A. B. C. D.
6.下列说法正确的是
A.吸热反应在常温下可能发生 B.需要加热的反应一定是吸热反应
C.放热反应一定不需要加热 D.有能量放出的过程一定是放热反应
7.常温常压下,断裂或生成化学键所吸收或放出的能量称为键能。部分化学键的键能数据如表所示,下列说法错误的是
化学键
链能 243 193 436 431 366
A.的稳定性强于的
B.的能量高于(1)的
C.相比,等物质的量的与反应放出的能量更少
D.形成键会放出的能量
8.取溶液,向其中加入溶液,振荡,使之充分反应:,下列说法正确的是
A.若滴加的溶液为,则充分反应后的溶液中无
B.向反应后的溶液中加入淀粉溶液,溶液变蓝,证明该反应是可逆反应
C.向反应后的溶液中加入溶液,溶液变红,证明该反应是可逆反应
D.将上述反应设计成原电池,一段时间后电流表指针不再发生偏转,说明该反应停止了
9.设为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,含有的原子数为
B.与充分反应,容器内分子的数目大于
C.标准状况下,铁片与足量浓硝酸反应,转移的电子数为
D.高温下,用石英砂制备粗硅时,每生成的同时,生成的分子数为
10.将置于恒容密闭的烧瓶中,然后将烧瓶放入的恒温槽中,烧瓶内的气体由黄色变为红棕色,颜色逐渐加深:。下列结论不能说明该反应在该条件下已经达到反应限度的是
A.烧瓶内气体的压强不再变化 B.烧瓶内气体的颜色不再加深
C.烧瓶内气体的密度不再变化 D.的消耗速率与的消耗速率之比为1:2
11.燃料电池是把化学能直接转化为电能的发电装置,一种—空气燃料电池的工作原理示意图如图所示,下列说法正确的是
A.极为负极,发生还原反应
B.为,在电极上发生反应后生成
C.电极上每消耗,电路中转移电子
D.电子的移动方向为极电流表极溶液
12.下列关于图示的叙述正确的是
A.图甲:溶于水会放出能量 B.图乙:可观察到电流表指针发生偏转
C.图丙:可观察到蓝色喷泉 D.图丁:比较不同金属离子对分解速率的影响
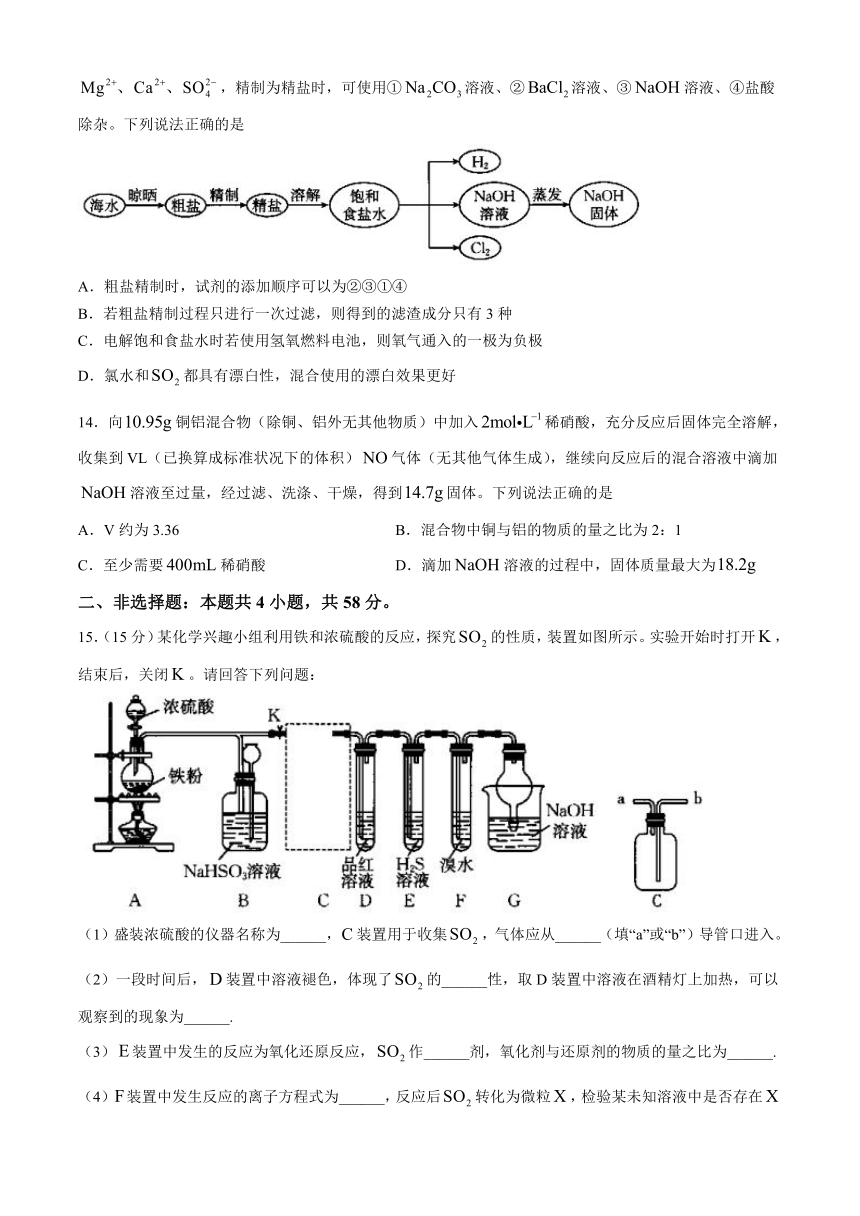
13.海水是巨大的资源宝库,对海水进行如图操作制备和等。粗盐中含有泥沙、,精制为精盐时,可使用①溶液、②溶液、③溶液、④盐酸除杂。下列说法正确的是
A.粗盐精制时,试剂的添加顺序可以为②③①④
B.若粗盐精制过程只进行一次过滤,则得到的滤渣成分只有3种
C.电解饱和食盐水时若使用氢氧燃料电池,则氧气通入的一极为负极
D.氯水和都具有漂白性,混合使用的漂白效果更好
14.向铜铝混合物(除铜、铝外无其他物质)中加入稀硝酸,充分反应后固体完全溶解,收集到VL(已换算成标准状况下的体积)气体(无其他气体生成),继续向反应后的混合溶液中滴加溶液至过量,经过滤、洗涤、干燥,得到固体。下列说法正确的是
A.V约为3.36 B.混合物中铜与铝的物质的量之比为2:1
C.至少需要稀硝酸 D.滴加溶液的过程中,固体质量最大为
二、非选择题:本题共4小题,共58分。
15.(15分)某化学兴趣小组利用铁和浓硫酸的反应,探究的性质,装置如图所示。实验开始时打开,结束后,关闭。请回答下列问题:
(1)盛装浓硫酸的仪器名称为______,装置用于收集,气体应从______(填“a”或“b”)导管口进入。
(2)一段时间后,装置中溶液褪色,体现了的______性,取D装置中溶液在酒精灯上加热,可以观察到的现象为______.
(3)装置中发生的反应为氧化还原反应,作______剂,氧化剂与还原剂的物质的量之比为______.
(4)装置中发生反应的离子方程式为______,反应后转化为微粒,检验某未知溶液中是否存在需要用到的试剂为______(写试剂名称)。
(5)G装置中球形干燥管的作用为______,溶液的作用为______。
16.(14分)某化学兴趣小组利用图1装置及秒表,测定锌和硫酸溶液的反应速率。已知常温常压下,,忽略反应前后溶液体积变化。请回答下列问题:
(1)组装好仪器后,实验开始前,需要先进行的操作为______。
(2)锥形瓶中发生反应的离子方程式为______。
(3)若时,针筒内收集到(常温常压下)气体,______,此时消耗的质量为______g。
(4)将图1装置中的针筒换成针筒,相同时间内,该反应在不同时间段内有如下变化:①锌的质量减少了;②硫酸浓度由变为;③增大了;④生成了(标准状况)。对应的化学反应速率由大到小的顺序为______(填标号)。
(5)实验室测定锌与硫酸溶液的反应速率的装置如图2,相比图2装置,图1装置的优点是______(任写一条)。
(6)在恒温条件下锌粒与足量硫酸溶液反应,测得随时间的变化如图3曲线甲所示,若仅改变一个反应条件,对应得到曲线乙、丙,则曲线乙改变的反应条件可能是______(填标号,下同),曲线丙改变的反应条件可能是______。
A.将锌粒换成锌粉 B.将硫酸溶液换成浓硫酸
C.向硫酸溶液中加入少量固体 D.将硫酸溶液换成足量硫酸溶液
17.(14分)电能是现代社会应用最广泛的能源之一,四种原电池装置如图所示。请回答下列问题:
(1)图1装置中,负极是______,正极上可观察到的现象为______。
(2)图2装置中:
①若M、N均为金属,观察到极溶解,则金属的活动性:是______(填“>”或“<”)N。
②若极为铜,极为石墨,极的电极反应式为是______。
(3)图3为锌锰干电池,属于______(填“一次”或“二次”)电池,发生还原反应的物质是是______,电子的移动方向为是______。
(4)图4为铅酸蓄电池,该电池放电时发生的总反应的化学方程式为。放电时电解液中移向______(填“”或“”)电极,一段时间后,电路中转移了电子,负极的质量增加了______。
18.(15分)某温度时,在恒容密闭容器中发生两种气体间的转化反应,的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
(1)该转化反应的化学方程式为______。
(2)a点时,______的反应速率为______时容器内的压强与起始时的压强之比为______。
(3)比较a、b两点该反应的正反应速率的相对大小:______(填“>”“<”或“=”)。
(4)若不同条件下,上述反应在甲、乙两个相同容器内同时进行,相同时间段内分别测得甲容器中,乙容器中,则______(填“甲”或“乙”)容器中反应更快。
(5)若仅降低温度,则该反应的正反应速率______(填“加快”“减慢”或“不变”,下同),逆反应速率______;若向该容器中通入氩气,的反应速率将______。
邢台市翰林高级中学等校2023-2024学年高一下学期期中考试
化学参考答案
15.(1)分液漏斗(1分);b(1分) (2)漂白(1分);无色溶液变红(2分)
(3)氧化(1分);1:2(2分)
(4)(2分);稀盐酸、氯化钡溶液(2分)
(5)防倒吸(1分);吸收尾气,防止污染空气(2分)
16.(1)检查装置气密性(2分) (2)(2分)
(3)0.00012或(2分);0.078(2分) (4)②④③①或②>④>③>①(2分)
(5)可以随时控制反应的开始和停止(或其他合理答案,2分) (6)D(1分);C(1分)
7.(1)A1(1分);有气泡产生(l分) (2)①<(2分) ②(2分)
(3)一次(1分);(1分);锌筒灯泡石墨棒(不写“灯泡”不扣分,2分)
(4)(2分);14.4(2分)
(4)(2分);14.4(2分)
18.(1)(2分)
(2)3.2(2分);(2分);7:10(2分) (3)>(1分)
(4)乙(2分) (5)减慢(1分);減慢(1分);不变(2分)
化学试题
本试卷满分100分,考试用时75分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.本试卷主要考试内容:人教版必修第二册第五章至第六章。
5.可能用到的相对原子质量:
一、选择题:本题共14小题,每小题3分,共42分。每小题只有一个选项符合题目要求。
1.化学与生活密切相关,下列能量主要转化形式描述错误的是
天然气烧开水 烟花的燃放 电磁炉炒菜 风力发电
A.化学能转化为热能 B.化学能转化为光能和热能 C.电能转化为化学能 D.风能转化为电能
2.下列各图中,能表示人工合成氨反应的能量变化的是
A. B.
C. D.
3.下列物质的性质与用途具有对应关系的是
A.液氨具有刺激性气味,可用作制冷剂 B.浓硫酸具有吸水性,可用于干燥
C.SiC的硬度很大,可用作砂纸和砂轮的磨料 D.高纯硅具有良好的导电性,可用于制作太阳能电池
4.酸雨形成的示意图如图。下列说法错误的是
A.均为酸性氧化物 B.火山喷发、森林火灾都会产生
C.工厂产生的烟气应经脱硫处理后再排放 D.酸雨形成过程中涉及氧化还原反应
5.下列各组离子在溶液中能大量共存的是
A. B. C. D.
6.下列说法正确的是
A.吸热反应在常温下可能发生 B.需要加热的反应一定是吸热反应
C.放热反应一定不需要加热 D.有能量放出的过程一定是放热反应
7.常温常压下,断裂或生成化学键所吸收或放出的能量称为键能。部分化学键的键能数据如表所示,下列说法错误的是
化学键
链能 243 193 436 431 366
A.的稳定性强于的
B.的能量高于(1)的
C.相比,等物质的量的与反应放出的能量更少
D.形成键会放出的能量
8.取溶液,向其中加入溶液,振荡,使之充分反应:,下列说法正确的是
A.若滴加的溶液为,则充分反应后的溶液中无
B.向反应后的溶液中加入淀粉溶液,溶液变蓝,证明该反应是可逆反应
C.向反应后的溶液中加入溶液,溶液变红,证明该反应是可逆反应
D.将上述反应设计成原电池,一段时间后电流表指针不再发生偏转,说明该反应停止了
9.设为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,含有的原子数为
B.与充分反应,容器内分子的数目大于
C.标准状况下,铁片与足量浓硝酸反应,转移的电子数为
D.高温下,用石英砂制备粗硅时,每生成的同时,生成的分子数为
10.将置于恒容密闭的烧瓶中,然后将烧瓶放入的恒温槽中,烧瓶内的气体由黄色变为红棕色,颜色逐渐加深:。下列结论不能说明该反应在该条件下已经达到反应限度的是
A.烧瓶内气体的压强不再变化 B.烧瓶内气体的颜色不再加深
C.烧瓶内气体的密度不再变化 D.的消耗速率与的消耗速率之比为1:2
11.燃料电池是把化学能直接转化为电能的发电装置,一种—空气燃料电池的工作原理示意图如图所示,下列说法正确的是
A.极为负极,发生还原反应
B.为,在电极上发生反应后生成
C.电极上每消耗,电路中转移电子
D.电子的移动方向为极电流表极溶液
12.下列关于图示的叙述正确的是
A.图甲:溶于水会放出能量 B.图乙:可观察到电流表指针发生偏转
C.图丙:可观察到蓝色喷泉 D.图丁:比较不同金属离子对分解速率的影响
13.海水是巨大的资源宝库,对海水进行如图操作制备和等。粗盐中含有泥沙、,精制为精盐时,可使用①溶液、②溶液、③溶液、④盐酸除杂。下列说法正确的是
A.粗盐精制时,试剂的添加顺序可以为②③①④
B.若粗盐精制过程只进行一次过滤,则得到的滤渣成分只有3种
C.电解饱和食盐水时若使用氢氧燃料电池,则氧气通入的一极为负极
D.氯水和都具有漂白性,混合使用的漂白效果更好
14.向铜铝混合物(除铜、铝外无其他物质)中加入稀硝酸,充分反应后固体完全溶解,收集到VL(已换算成标准状况下的体积)气体(无其他气体生成),继续向反应后的混合溶液中滴加溶液至过量,经过滤、洗涤、干燥,得到固体。下列说法正确的是
A.V约为3.36 B.混合物中铜与铝的物质的量之比为2:1
C.至少需要稀硝酸 D.滴加溶液的过程中,固体质量最大为
二、非选择题:本题共4小题,共58分。
15.(15分)某化学兴趣小组利用铁和浓硫酸的反应,探究的性质,装置如图所示。实验开始时打开,结束后,关闭。请回答下列问题:
(1)盛装浓硫酸的仪器名称为______,装置用于收集,气体应从______(填“a”或“b”)导管口进入。
(2)一段时间后,装置中溶液褪色,体现了的______性,取D装置中溶液在酒精灯上加热,可以观察到的现象为______.
(3)装置中发生的反应为氧化还原反应,作______剂,氧化剂与还原剂的物质的量之比为______.
(4)装置中发生反应的离子方程式为______,反应后转化为微粒,检验某未知溶液中是否存在需要用到的试剂为______(写试剂名称)。
(5)G装置中球形干燥管的作用为______,溶液的作用为______。
16.(14分)某化学兴趣小组利用图1装置及秒表,测定锌和硫酸溶液的反应速率。已知常温常压下,,忽略反应前后溶液体积变化。请回答下列问题:
(1)组装好仪器后,实验开始前,需要先进行的操作为______。
(2)锥形瓶中发生反应的离子方程式为______。
(3)若时,针筒内收集到(常温常压下)气体,______,此时消耗的质量为______g。
(4)将图1装置中的针筒换成针筒,相同时间内,该反应在不同时间段内有如下变化:①锌的质量减少了;②硫酸浓度由变为;③增大了;④生成了(标准状况)。对应的化学反应速率由大到小的顺序为______(填标号)。
(5)实验室测定锌与硫酸溶液的反应速率的装置如图2,相比图2装置,图1装置的优点是______(任写一条)。
(6)在恒温条件下锌粒与足量硫酸溶液反应,测得随时间的变化如图3曲线甲所示,若仅改变一个反应条件,对应得到曲线乙、丙,则曲线乙改变的反应条件可能是______(填标号,下同),曲线丙改变的反应条件可能是______。
A.将锌粒换成锌粉 B.将硫酸溶液换成浓硫酸
C.向硫酸溶液中加入少量固体 D.将硫酸溶液换成足量硫酸溶液
17.(14分)电能是现代社会应用最广泛的能源之一,四种原电池装置如图所示。请回答下列问题:
(1)图1装置中,负极是______,正极上可观察到的现象为______。
(2)图2装置中:
①若M、N均为金属,观察到极溶解,则金属的活动性:是______(填“>”或“<”)N。
②若极为铜,极为石墨,极的电极反应式为是______。
(3)图3为锌锰干电池,属于______(填“一次”或“二次”)电池,发生还原反应的物质是是______,电子的移动方向为是______。
(4)图4为铅酸蓄电池,该电池放电时发生的总反应的化学方程式为。放电时电解液中移向______(填“”或“”)电极,一段时间后,电路中转移了电子,负极的质量增加了______。
18.(15分)某温度时,在恒容密闭容器中发生两种气体间的转化反应,的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
(1)该转化反应的化学方程式为______。
(2)a点时,______的反应速率为______时容器内的压强与起始时的压强之比为______。
(3)比较a、b两点该反应的正反应速率的相对大小:______(填“>”“<”或“=”)。
(4)若不同条件下,上述反应在甲、乙两个相同容器内同时进行,相同时间段内分别测得甲容器中,乙容器中,则______(填“甲”或“乙”)容器中反应更快。
(5)若仅降低温度,则该反应的正反应速率______(填“加快”“减慢”或“不变”,下同),逆反应速率______;若向该容器中通入氩气,的反应速率将______。
邢台市翰林高级中学等校2023-2024学年高一下学期期中考试
化学参考答案
15.(1)分液漏斗(1分);b(1分) (2)漂白(1分);无色溶液变红(2分)
(3)氧化(1分);1:2(2分)
(4)(2分);稀盐酸、氯化钡溶液(2分)
(5)防倒吸(1分);吸收尾气,防止污染空气(2分)
16.(1)检查装置气密性(2分) (2)(2分)
(3)0.00012或(2分);0.078(2分) (4)②④③①或②>④>③>①(2分)
(5)可以随时控制反应的开始和停止(或其他合理答案,2分) (6)D(1分);C(1分)
7.(1)A1(1分);有气泡产生(l分) (2)①<(2分) ②(2分)
(3)一次(1分);(1分);锌筒灯泡石墨棒(不写“灯泡”不扣分,2分)
(4)(2分);14.4(2分)
(4)(2分);14.4(2分)
18.(1)(2分)
(2)3.2(2分);(2分);7:10(2分) (3)>(1分)
(4)乙(2分) (5)减慢(1分);減慢(1分);不变(2分)
同课章节目录
