福建省莆田市第八中学苏教版高中化学必修二课件:专题1 第3单元 从微观结构看物质的多样性(共25张PPT)
文档属性
| 名称 | 福建省莆田市第八中学苏教版高中化学必修二课件:专题1 第3单元 从微观结构看物质的多样性(共25张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-11-30 11:02:45 | ||
图片预览





文档简介
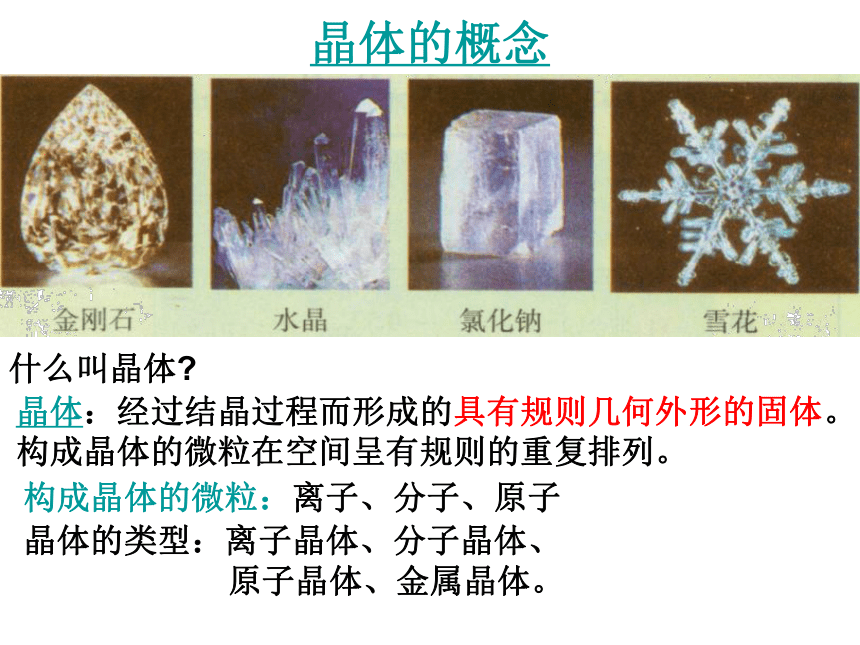
课件25张PPT。不同类型的晶体第三单元 从微观结构看物质的多样性专题1 微观结构与物质的多样性晶体的概念什么叫晶体?晶体:经过结晶过程而形成的具有规则几何外形的固体。
构成晶体的微粒在空间呈有规则的重复排列。
构成晶体的微粒:离子、分子、原子晶体的类型:离子晶体、分子晶体、
原子晶体、金属晶体。一、离子晶体
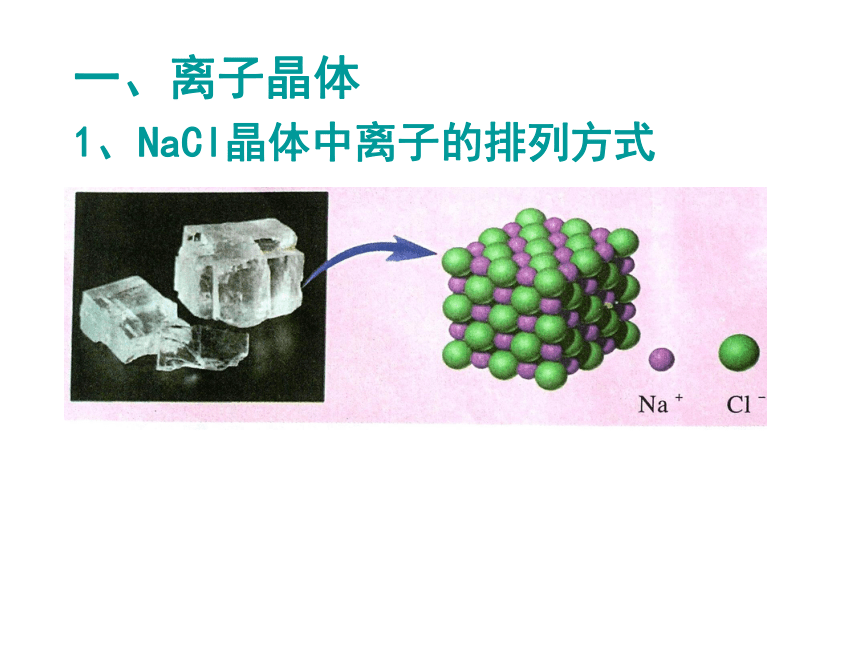
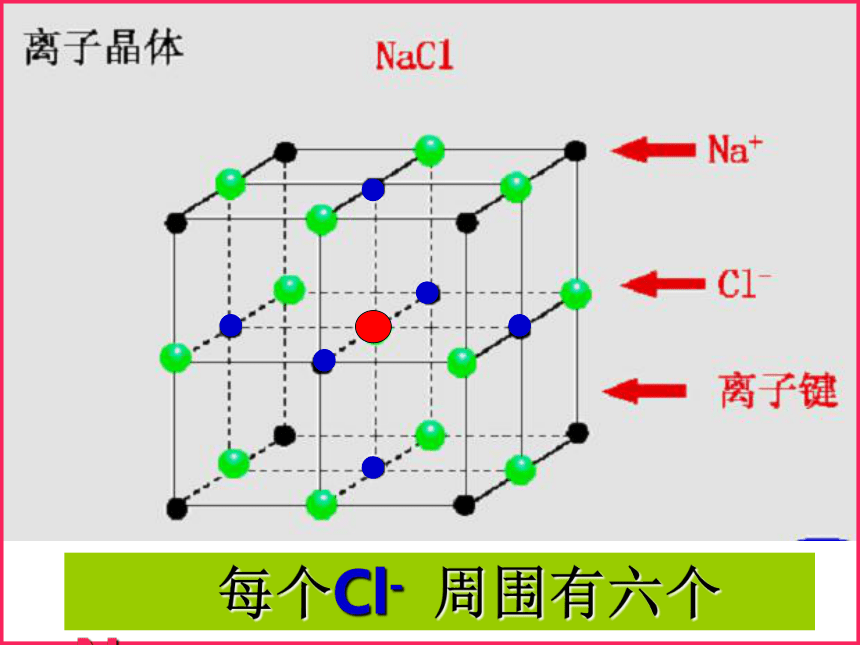
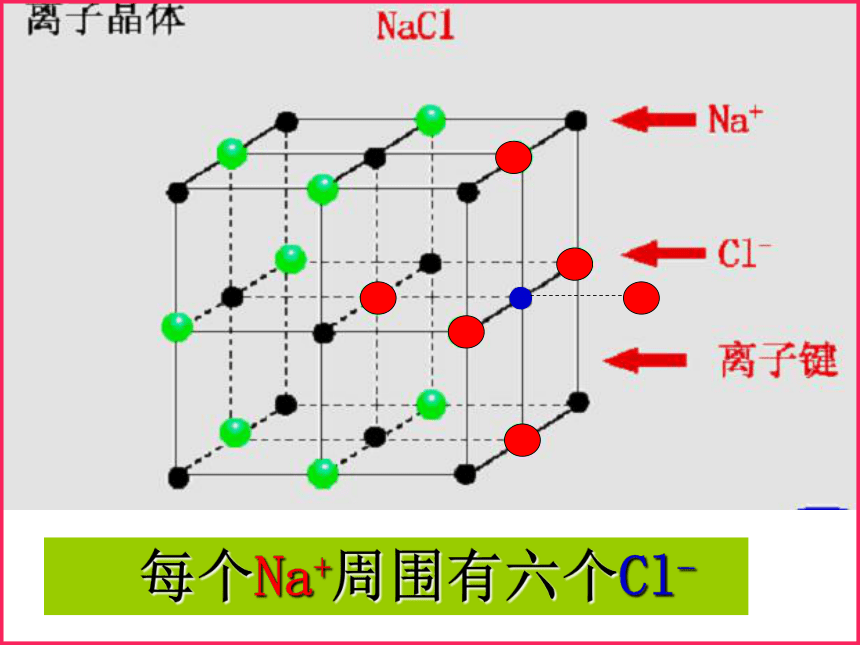
1、NaCl晶体中离子的排列方式氯化钠晶体结构Na+Cl-问题一:组成晶体的微粒?问题三:晶体中,是否存在独立的NaCl分子?不存在,只存在Na+和 Cl-问题二:微粒之间的作用力?离子键 每个Cl- 周围有六个Na+ 每个Na+周围有六个Cl-[小结]:在NaCl晶体中, (填存在或不存在)分子,存在许多 离子和 离子,以 键相结合,阴阳离子的个数比为 ,因此NaCl表示的含义是 。 不存在Na+Cl-离子1:1晶体中钠离子与氯离子个数比为1:11、定义:一、离子晶体2、物理性质:3、形成离子晶体的物质: 离子化合物中的阴、阳离子按一定的方式有规则
地排列而形成的晶体叫做离子晶体。强碱、大多数盐、金属氧化物等离子化合物较高较硬固态不导电,熔化或溶于水后能导电二、分子晶体
1、干冰及其二氧化碳分子的排列方式分子间作用力共价键干冰的晶体结构示意图问题一:组成晶体的微粒?CO2分子问题二:微粒之间的作用力?问题三:晶体中,是否存在独立的CO2分子?存在 二、分子晶体2、物理性质:1、定义:3、形成分子晶体的物质:多数非金属单质(卤素、氧气、氢气等、稀有气体)
含氧酸、非金属氢化物、多数非金属氧化物、
大部分有机物分子间通过分子间作用力相结合的晶体较低,易挥发较小固态和熔融状态下
都不导电,溶于水有的导电109o28′金刚石的晶体结构示意图共价键三、原子晶体109o28′晶体硅共价键返回
石英晶体中的硅、氧原子的排列方式[小结]:在SiO2晶体中, (填存在或不存在)分子, 存在许多 和 ,以 键相结合, SiO2表示的含义是 不存在Si原子氧原子共价键SiO2晶体中硅原子与氧原子个数比为1:2
三、原子晶体1、定义:2、实例:3、物理性质: 金刚石、金刚砂(SiC)、
晶体硅、石英(SiO2)相邻原子通过共价键结合而形成
空间网状结构的晶体,叫做原子晶体。很高很大难溶于水一般不导电石墨的晶体结构石墨石墨为什么很软?
石墨的熔沸点为什么很高?石墨为层状结构,各层之间是分子间作用力结合,容易滑动,所以石墨很软。
石墨各层均为平面网状结构,碳原子之间存在很强的共价键,故熔沸点很高。
所以,石墨称为混合型晶体。—混合型晶体拓展视野金属晶体金属阳离子自由电子四、金属晶体1、金属晶体的结构 通过金属阳离子与
自由电子之间的较强
作用形成的单质晶体,
叫做通过金属阳离子与
自由电子之间的较强
作用形成的单质晶体,
叫做金属晶体
四、金属晶体
物理特性:有金属光泽、能导电和
传热、具有延展性等
常见金属晶体:金属单质或合金
如:钠、钾、铜等。
离子晶体、分子晶体、原子晶体结构与性质的比较:阴、阳离子分子原子离子键分子间
作用力共价键差距大很大低较大小很高差距大导电溶于水
有些导电较高熔融或溶于水导电一般熔沸点与硬度:原子晶体 > 离子晶体 > 分子晶体金属阳离子
与自由电子金属键物质溶沸点的比较(1)不同类型晶体:
一般情况下,原子晶体>离子晶体>分子晶体 (2)同种类型晶体:构成晶体质点间的作用力大,则熔沸点高,反之则小。 ①离子晶体:离子所带的电荷数越多,离子半径越小,则其熔沸点就越高。 ②分子晶体:对于组成和结构相似的分子晶体,相对分子质量越大,则熔沸点越高。 ③原子晶体:一般原子半径越小,则熔沸点越高。(3)常温常压下状态
①熔点:固态物质>液态物质
②沸点:液态物质>气态物质晶体类型的判断(一)从组成上判断(仅限于中学范围):
凡是由非金属元素(包含零族元素)组成的物质,在固态时除铵盐为离子晶体,金刚石、SiO2、 SiC 、单晶硅为中学常见原子晶体外,其余物质在中学阶段均可判断为分子晶体。
(二)从性质上判断:
(1)熔沸点和硬度;(高:原子晶体;中:离子晶体;低:分子晶体)
(2)熔融状态的导电性。(导电:离子晶体、金属晶体)课堂练习题1. 下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是 ( )
A.SO2和SiO2 B.CO2和H2O
C.NaCl和HCl D.CCl4和KCl
2.下列物质的晶体中,不存在分子的是( )
(A)二氧化碳 (B)二氧化硫
(C)二氧化硅 (D)二硫化碳
3、下列晶体熔化时,不需要破坏化学键的是( )
A、金刚石 B、干冰 C、食盐 D、晶体硅
4、实现下列变化时,需克服相同类型作用力的是( )
(A)水晶和干冰的熔化 (B)食盐和冰醋酸熔化
(C)液溴和液汞的气化 (D)纯碱和烧碱的熔化
BBCD
构成晶体的微粒在空间呈有规则的重复排列。
构成晶体的微粒:离子、分子、原子晶体的类型:离子晶体、分子晶体、
原子晶体、金属晶体。一、离子晶体
1、NaCl晶体中离子的排列方式氯化钠晶体结构Na+Cl-问题一:组成晶体的微粒?问题三:晶体中,是否存在独立的NaCl分子?不存在,只存在Na+和 Cl-问题二:微粒之间的作用力?离子键 每个Cl- 周围有六个Na+ 每个Na+周围有六个Cl-[小结]:在NaCl晶体中, (填存在或不存在)分子,存在许多 离子和 离子,以 键相结合,阴阳离子的个数比为 ,因此NaCl表示的含义是 。 不存在Na+Cl-离子1:1晶体中钠离子与氯离子个数比为1:11、定义:一、离子晶体2、物理性质:3、形成离子晶体的物质: 离子化合物中的阴、阳离子按一定的方式有规则
地排列而形成的晶体叫做离子晶体。强碱、大多数盐、金属氧化物等离子化合物较高较硬固态不导电,熔化或溶于水后能导电二、分子晶体
1、干冰及其二氧化碳分子的排列方式分子间作用力共价键干冰的晶体结构示意图问题一:组成晶体的微粒?CO2分子问题二:微粒之间的作用力?问题三:晶体中,是否存在独立的CO2分子?存在 二、分子晶体2、物理性质:1、定义:3、形成分子晶体的物质:多数非金属单质(卤素、氧气、氢气等、稀有气体)
含氧酸、非金属氢化物、多数非金属氧化物、
大部分有机物分子间通过分子间作用力相结合的晶体较低,易挥发较小固态和熔融状态下
都不导电,溶于水有的导电109o28′金刚石的晶体结构示意图共价键三、原子晶体109o28′晶体硅共价键返回
石英晶体中的硅、氧原子的排列方式[小结]:在SiO2晶体中, (填存在或不存在)分子, 存在许多 和 ,以 键相结合, SiO2表示的含义是 不存在Si原子氧原子共价键SiO2晶体中硅原子与氧原子个数比为1:2
三、原子晶体1、定义:2、实例:3、物理性质: 金刚石、金刚砂(SiC)、
晶体硅、石英(SiO2)相邻原子通过共价键结合而形成
空间网状结构的晶体,叫做原子晶体。很高很大难溶于水一般不导电石墨的晶体结构石墨石墨为什么很软?
石墨的熔沸点为什么很高?石墨为层状结构,各层之间是分子间作用力结合,容易滑动,所以石墨很软。
石墨各层均为平面网状结构,碳原子之间存在很强的共价键,故熔沸点很高。
所以,石墨称为混合型晶体。—混合型晶体拓展视野金属晶体金属阳离子自由电子四、金属晶体1、金属晶体的结构 通过金属阳离子与
自由电子之间的较强
作用形成的单质晶体,
叫做通过金属阳离子与
自由电子之间的较强
作用形成的单质晶体,
叫做金属晶体
四、金属晶体
物理特性:有金属光泽、能导电和
传热、具有延展性等
常见金属晶体:金属单质或合金
如:钠、钾、铜等。
离子晶体、分子晶体、原子晶体结构与性质的比较:阴、阳离子分子原子离子键分子间
作用力共价键差距大很大低较大小很高差距大导电溶于水
有些导电较高熔融或溶于水导电一般熔沸点与硬度:原子晶体 > 离子晶体 > 分子晶体金属阳离子
与自由电子金属键物质溶沸点的比较(1)不同类型晶体:
一般情况下,原子晶体>离子晶体>分子晶体 (2)同种类型晶体:构成晶体质点间的作用力大,则熔沸点高,反之则小。 ①离子晶体:离子所带的电荷数越多,离子半径越小,则其熔沸点就越高。 ②分子晶体:对于组成和结构相似的分子晶体,相对分子质量越大,则熔沸点越高。 ③原子晶体:一般原子半径越小,则熔沸点越高。(3)常温常压下状态
①熔点:固态物质>液态物质
②沸点:液态物质>气态物质晶体类型的判断(一)从组成上判断(仅限于中学范围):
凡是由非金属元素(包含零族元素)组成的物质,在固态时除铵盐为离子晶体,金刚石、SiO2、 SiC 、单晶硅为中学常见原子晶体外,其余物质在中学阶段均可判断为分子晶体。
(二)从性质上判断:
(1)熔沸点和硬度;(高:原子晶体;中:离子晶体;低:分子晶体)
(2)熔融状态的导电性。(导电:离子晶体、金属晶体)课堂练习题1. 下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是 ( )
A.SO2和SiO2 B.CO2和H2O
C.NaCl和HCl D.CCl4和KCl
2.下列物质的晶体中,不存在分子的是( )
(A)二氧化碳 (B)二氧化硫
(C)二氧化硅 (D)二硫化碳
3、下列晶体熔化时,不需要破坏化学键的是( )
A、金刚石 B、干冰 C、食盐 D、晶体硅
4、实现下列变化时,需克服相同类型作用力的是( )
(A)水晶和干冰的熔化 (B)食盐和冰醋酸熔化
(C)液溴和液汞的气化 (D)纯碱和烧碱的熔化
BBCD
