福建省莆田市第八中学苏教版高中化学选修四课件:专题1 第2单元 化学能转化为电能(共29张PPT)
文档属性
| 名称 | 福建省莆田市第八中学苏教版高中化学选修四课件:专题1 第2单元 化学能转化为电能(共29张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 360.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-11-30 12:31:27 | ||
图片预览






文档简介
课件29张PPT。 化学能转化为电能 第三单元
化学能与电能的转化
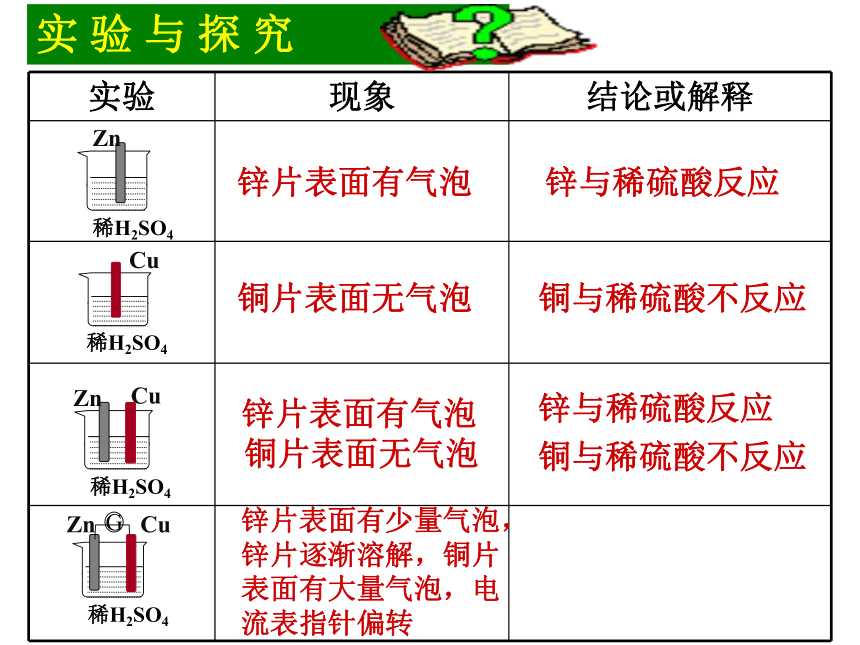
思考:锌片表面有气泡铜片表面无气泡铜与稀硫酸不反应锌与稀硫酸反应锌片表面有少量气泡,锌片逐渐溶解,铜片表面有大量气泡,电流表指针偏转锌片表面有气泡
铜片表面无气泡G一、原电池 这种将化学能直接转化为电能
的装置叫做原电池从能量变化的角度分析这是什么装置?
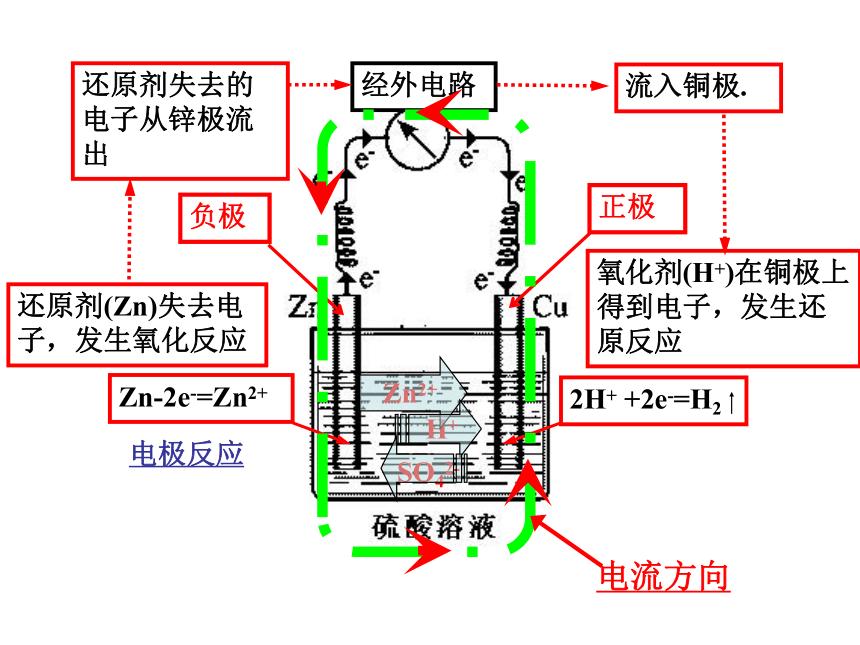
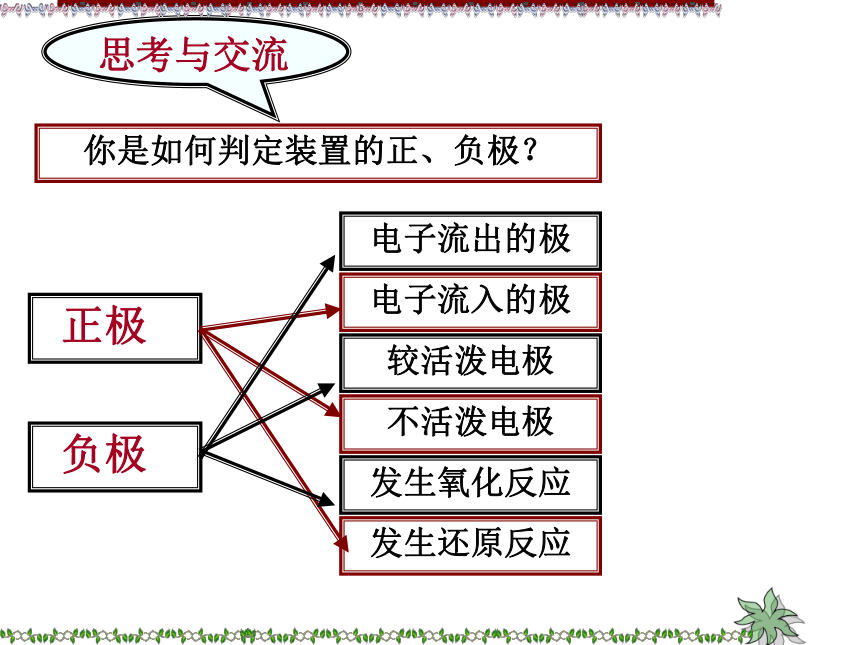
铜片上氢气是怎么产生的?原电池的原理是什么?还原剂(Zn)失去电子,发生氧化反应氧化剂(H+)在铜极上得到电子,发生还原反应还原剂失去的电子从锌极流出流入铜极.经外电路Zn2+H+SO42-电流方向电极反应你是如何判定装置的正、负极?思考与交流氧化反应Zn-2e-= Zn2+2H+ + 2e-=H2↑负极正极Zn+2H+=Zn2++H2↑锌铜原电池原理还原反应观察原电池的装置图,
思考构成原电池应具备哪些条件 ?三、原电池的形成条件 —— 电极材料均插入电解质溶液中—— 两极相连形成闭合电路1. 电极2. 电解质溶液3. 回路两极一液成回路自发进行氧化还原反应是前提条件练习⒈判断下列哪些装置构成了原电池?若不是,请说明理由.①②③(×)(×)(√)④(√)⑤(×)
2.下列装置哪些可以形成原电池? 形成原电池的写出电极反应式,并指出电子流动方向。
C5、下列方程式能设计成原电池吗?若能,判断原电池的正负极。 ⑴、Fe+Cu2+=Fe2++Cu⑵、2NaOH+H2S04=Na2SO4+2H2O4、在锌与盐酸的反应过程当中,某同学为了加快反应速率,在盐酸和锌的混合物中滴加几滴CuCl2溶液,请分析其机理.四、原电池原理的应用 a、加快氧化还原反应的速率 b、比较金属的活动性强弱 c、设计原电池 如利用 Cu+2FeCl3= CuCl2+2FeCl2 的氧化还原反应设计原电池 负极:正极:Cu—2e — = Cu2+2Fe3+ +2e— =2Fe2+氧化反应还原反应d、金属的腐蚀 金属阳离子失e-氧化反应化学腐蚀电化学腐蚀析氢腐蚀吸氧腐蚀(常见普遍)金属腐蚀金属原子是指金属或合金跟接触的气体或液体发生化学反应(氧化—还原)而腐蚀损耗的过程。化学腐蚀(次要) 金属跟接触到的物质(如O2、Cl2、SO2等)直接
发生化学反应而引起的腐蚀叫做化学腐蚀。这类反
应比较简单,仅仅是金属跟氧化剂之间的氧化还原
反应。电化学腐蚀(主要) 不纯的金属跟电解质溶液接触时,会发生原电池反应,比较活泼的金属失电子而被氧化,这种腐蚀叫做电化学腐蚀。 化学腐蚀与电化学腐蚀比较 负极(Fe):2Fe - 4e  ̄ = 2Fe2+
正极(C): 2H2O+O2+4e  ̄ = 4OH  ̄
Fe2+与OH-形成Fe(OH)2,又被氧化成Fe(OH)3,分解后形成铁锈Fe2O3.
电化学腐蚀是造成钢铁腐蚀的主要原因。在潮湿的空气里,钢铁表面吸附了一层薄薄的水膜,这层水膜里含有少量H+和OH-,还溶解了氧气,结果在钢铁表面形成了一层电解质溶液,它跟钢铁里的铁和少量的碳恰好形成无数微小的原电池。在这些原电池里,铁是负极,碳是正极。铁失去电子而被氧化:2Fe+O2+2H2O=2Fe(OH)2总式:例如铁的腐蚀1、析氢腐蚀(酸性较强的条件下的腐蚀)负极:正极:Fe—2e— =Fe2+2H++ 2e— =H2↑2、吸氧腐蚀(酸性较弱或中性条件下的腐蚀)负极:正极:2Fe—4e— =2Fe2+O2+2H2O+4e— =4OH—在溶液中发生反应: Fe2+ + 2OH - = Fe(OH)24Fe(OH)2+O2+2H2O=4Fe(OH)3(形成褐色锈斑)将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中
一段时间,以下叙述正确的是
A 两烧杯中铜片表面均无气泡产生
B 甲中铜片是正极,乙中铜片是负极
C 两烧杯中溶液的pH均增大
D 产生气泡的速度甲比乙慢(C)空气电池锂电池二、化学电源二.化学电源一次电池(如干电池):用过后不能复原
二次电池(如蓄电池):充电后能继续使用
燃料电池:将燃料和氧化剂中的化学能直接、连续地转化为电能的发电装置。
化学电源:1、干电池普通锌—锰干电池正极石墨棒负极锌筒电解质溶液调成糊状的氯化铵碱性锌—锰干电池电解液改成碱液负极改作锌粉主要反应:负极:Zn – 2e- ==Zn2+正极: 2MnO2 + 2NH4+ + 2e- == 2MnO(OH) + 2NH3 Zn + 2MnO2 + 2NH4+ == Zn2+ + 2MnO(OH) + 2NH3 2、铅蓄电池正极PbO2负极Pb电解质溶液稀硫酸又叫铅酸蓄电池主要反应:负极:Pb + SO42- – 2e- ==PbSO4正极:PbO2 + SO42- + 4H+ + 2e- == PbSO4 + 2H2O总反应:Pb + PbO2 + 2H2SO4 == 2PbSO4 + 2H2O镍—镉蓄电池可广泛用于收录机、电话机银—锌蓄电池是一种高能电池,体积小,质量轻锂电池也是一种高能电池,体积小,质量轻3、银锌纽扣电池正极负极电解质溶液Zn + Ag2O + H2O Zn(OH)2 + 2AgZnZn – 2e- = Zn2+KOH溶液Zn – 2e- + 2OH- = Zn(OH)2Ag2OAg2O + 2e- + H2O = 2Ag +2OH-4、镍氢电池正极负极MHNiO(OH)5、氢氧燃料电池极板为惰性电极KOH溶液为电解质溶液主要反应:负极:2H2 + 4OH- – 4e- ==4H2O正极:O2 + 2H2O + 4e- == 4OH-总反应:2H2 + O2 ==2H2O6、甲醇-空气燃料电池2CH3OH + 3O2 + 4 OH- == 2CO32- + 6H2O负极:2CH3OH + 16OH- – 12e- ==12H2O + 2CO32-正极:3O2 + 6H2O + 12e- == 12OH-⑵甲烷氧气燃料电池
该电池用铂片插入KOH溶液中作电极,在两极上分别通甲烷和氧气
负极:
正极:
放电总反应式:
CH4+10OH——8e—=CO32—+7H2O2O2+4H2O+8e—= 8OH—CH4+ 2O2+2KOH =K2CO3 +3H2O⑶Al—空气—海水电池
负极:
正极:
放电总反应式: 4Al —12e— = 4Al3+3O2+6H2O+12e—= 12OH—4Al + 3O2+6H2O= 4Al( OH)3
化学能与电能的转化
思考:锌片表面有气泡铜片表面无气泡铜与稀硫酸不反应锌与稀硫酸反应锌片表面有少量气泡,锌片逐渐溶解,铜片表面有大量气泡,电流表指针偏转锌片表面有气泡
铜片表面无气泡G一、原电池 这种将化学能直接转化为电能
的装置叫做原电池从能量变化的角度分析这是什么装置?
铜片上氢气是怎么产生的?原电池的原理是什么?还原剂(Zn)失去电子,发生氧化反应氧化剂(H+)在铜极上得到电子,发生还原反应还原剂失去的电子从锌极流出流入铜极.经外电路Zn2+H+SO42-电流方向电极反应你是如何判定装置的正、负极?思考与交流氧化反应Zn-2e-= Zn2+2H+ + 2e-=H2↑负极正极Zn+2H+=Zn2++H2↑锌铜原电池原理还原反应观察原电池的装置图,
思考构成原电池应具备哪些条件 ?三、原电池的形成条件 —— 电极材料均插入电解质溶液中—— 两极相连形成闭合电路1. 电极2. 电解质溶液3. 回路两极一液成回路自发进行氧化还原反应是前提条件练习⒈判断下列哪些装置构成了原电池?若不是,请说明理由.①②③(×)(×)(√)④(√)⑤(×)
2.下列装置哪些可以形成原电池? 形成原电池的写出电极反应式,并指出电子流动方向。
C5、下列方程式能设计成原电池吗?若能,判断原电池的正负极。 ⑴、Fe+Cu2+=Fe2++Cu⑵、2NaOH+H2S04=Na2SO4+2H2O4、在锌与盐酸的反应过程当中,某同学为了加快反应速率,在盐酸和锌的混合物中滴加几滴CuCl2溶液,请分析其机理.四、原电池原理的应用 a、加快氧化还原反应的速率 b、比较金属的活动性强弱 c、设计原电池 如利用 Cu+2FeCl3= CuCl2+2FeCl2 的氧化还原反应设计原电池 负极:正极:Cu—2e — = Cu2+2Fe3+ +2e— =2Fe2+氧化反应还原反应d、金属的腐蚀 金属阳离子失e-氧化反应化学腐蚀电化学腐蚀析氢腐蚀吸氧腐蚀(常见普遍)金属腐蚀金属原子是指金属或合金跟接触的气体或液体发生化学反应(氧化—还原)而腐蚀损耗的过程。化学腐蚀(次要) 金属跟接触到的物质(如O2、Cl2、SO2等)直接
发生化学反应而引起的腐蚀叫做化学腐蚀。这类反
应比较简单,仅仅是金属跟氧化剂之间的氧化还原
反应。电化学腐蚀(主要) 不纯的金属跟电解质溶液接触时,会发生原电池反应,比较活泼的金属失电子而被氧化,这种腐蚀叫做电化学腐蚀。 化学腐蚀与电化学腐蚀比较 负极(Fe):2Fe - 4e  ̄ = 2Fe2+
正极(C): 2H2O+O2+4e  ̄ = 4OH  ̄
Fe2+与OH-形成Fe(OH)2,又被氧化成Fe(OH)3,分解后形成铁锈Fe2O3.
电化学腐蚀是造成钢铁腐蚀的主要原因。在潮湿的空气里,钢铁表面吸附了一层薄薄的水膜,这层水膜里含有少量H+和OH-,还溶解了氧气,结果在钢铁表面形成了一层电解质溶液,它跟钢铁里的铁和少量的碳恰好形成无数微小的原电池。在这些原电池里,铁是负极,碳是正极。铁失去电子而被氧化:2Fe+O2+2H2O=2Fe(OH)2总式:例如铁的腐蚀1、析氢腐蚀(酸性较强的条件下的腐蚀)负极:正极:Fe—2e— =Fe2+2H++ 2e— =H2↑2、吸氧腐蚀(酸性较弱或中性条件下的腐蚀)负极:正极:2Fe—4e— =2Fe2+O2+2H2O+4e— =4OH—在溶液中发生反应: Fe2+ + 2OH - = Fe(OH)24Fe(OH)2+O2+2H2O=4Fe(OH)3(形成褐色锈斑)将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中
一段时间,以下叙述正确的是
A 两烧杯中铜片表面均无气泡产生
B 甲中铜片是正极,乙中铜片是负极
C 两烧杯中溶液的pH均增大
D 产生气泡的速度甲比乙慢(C)空气电池锂电池二、化学电源二.化学电源一次电池(如干电池):用过后不能复原
二次电池(如蓄电池):充电后能继续使用
燃料电池:将燃料和氧化剂中的化学能直接、连续地转化为电能的发电装置。
化学电源:1、干电池普通锌—锰干电池正极石墨棒负极锌筒电解质溶液调成糊状的氯化铵碱性锌—锰干电池电解液改成碱液负极改作锌粉主要反应:负极:Zn – 2e- ==Zn2+正极: 2MnO2 + 2NH4+ + 2e- == 2MnO(OH) + 2NH3 Zn + 2MnO2 + 2NH4+ == Zn2+ + 2MnO(OH) + 2NH3 2、铅蓄电池正极PbO2负极Pb电解质溶液稀硫酸又叫铅酸蓄电池主要反应:负极:Pb + SO42- – 2e- ==PbSO4正极:PbO2 + SO42- + 4H+ + 2e- == PbSO4 + 2H2O总反应:Pb + PbO2 + 2H2SO4 == 2PbSO4 + 2H2O镍—镉蓄电池可广泛用于收录机、电话机银—锌蓄电池是一种高能电池,体积小,质量轻锂电池也是一种高能电池,体积小,质量轻3、银锌纽扣电池正极负极电解质溶液Zn + Ag2O + H2O Zn(OH)2 + 2AgZnZn – 2e- = Zn2+KOH溶液Zn – 2e- + 2OH- = Zn(OH)2Ag2OAg2O + 2e- + H2O = 2Ag +2OH-4、镍氢电池正极负极MHNiO(OH)5、氢氧燃料电池极板为惰性电极KOH溶液为电解质溶液主要反应:负极:2H2 + 4OH- – 4e- ==4H2O正极:O2 + 2H2O + 4e- == 4OH-总反应:2H2 + O2 ==2H2O6、甲醇-空气燃料电池2CH3OH + 3O2 + 4 OH- == 2CO32- + 6H2O负极:2CH3OH + 16OH- – 12e- ==12H2O + 2CO32-正极:3O2 + 6H2O + 12e- == 12OH-⑵甲烷氧气燃料电池
该电池用铂片插入KOH溶液中作电极,在两极上分别通甲烷和氧气
负极:
正极:
放电总反应式:
CH4+10OH——8e—=CO32—+7H2O2O2+4H2O+8e—= 8OH—CH4+ 2O2+2KOH =K2CO3 +3H2O⑶Al—空气—海水电池
负极:
正极:
放电总反应式: 4Al —12e— = 4Al3+3O2+6H2O+12e—= 12OH—4Al + 3O2+6H2O= 4Al( OH)3
