福建省莆田市第八中学苏教版高中化学选修四课件:专题2 第1单元 化学反应速率(共28张PPT)
文档属性
| 名称 | 福建省莆田市第八中学苏教版高中化学选修四课件:专题2 第1单元 化学反应速率(共28张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 580.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-11-30 12:31:51 | ||
图片预览


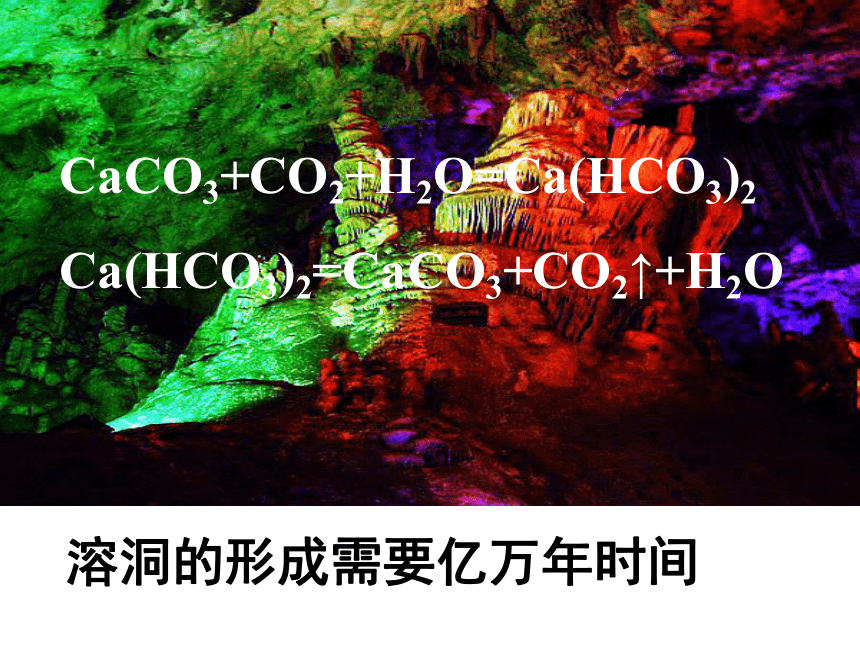





文档简介
课件28张PPT。化学反应速率的表示方法 专题2 化学反应速率与化学平衡
第一单元化学反应速率化学组:陈丽双烟花的爆炸是瞬间完成溶洞的形成需要亿万年时间CaCO3+CO2+H2O=Ca(HCO3)2
Ca(HCO3)2=CaCO3+CO2↑+H2O①一次性快餐盒、聚乙烯等塑料制品分解需要几百年。
②汽车尾气NO、CO反应能生成N2、CO2,但汽车尾气中仍有NO、CO排放,因为反应太慢了有的反应我们认为快一点好!一、化学反应速率1、定义:用来衡量化学反应进行快慢程度。
通常用单位时间内反应物浓度的减少或生成物的浓度的增加来表示。 3、单位:mol/(L·s)或mol·L-1·min-12、数学表达式看课本第32页H2O2分解的浓度变化表格,求0~20分钟内过氧化氢分解的平均速率。H2O2浓度变化量:0.80mol·L-1-0.40mol·L-1=0.40mol·L-1
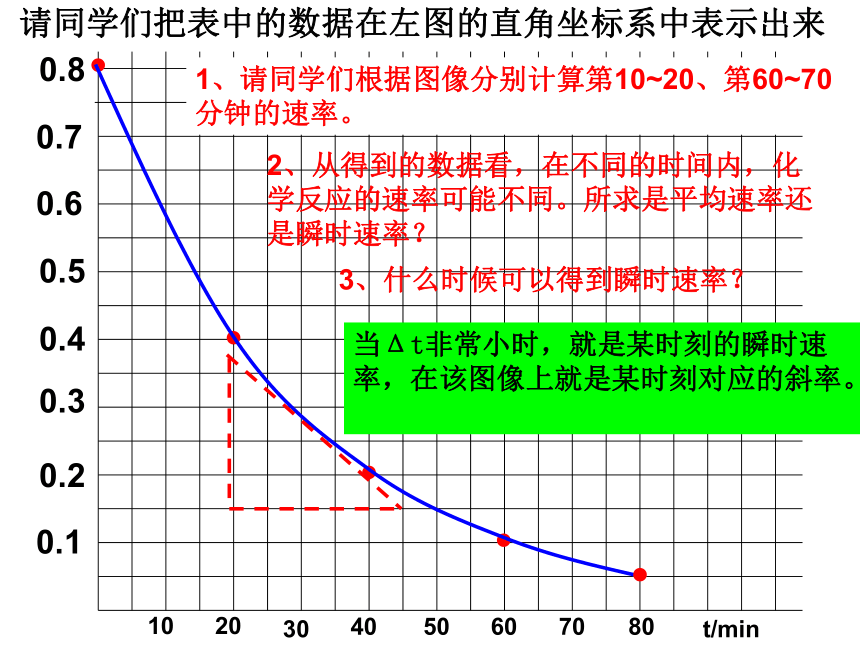
时间变化量:20min练习:请计算20~40分钟内过氧化氢分解的平均速率V( H2O2 ) = 0.01mol·L-1·min-1请同学们把表中的数据在左图的直角坐标系中表示出来当Δt非常小时,就是某时刻的瞬时速率,在该图像上就是某时刻对应的斜率。1、请同学们根据图像分别计算第10~20、第60~70分钟的速率。2、从得到的数据看,在不同的时间内,化学反应的速率可能不同。所求是平均速率还是瞬时速率? 3、什么时候可以得到瞬时速率?一个化学反应既有反应物又有生成物,表示化学反应速率时,即可用某反应物的浓度变化来表示,还可以用其它反应物或生成物的浓度变化来表示。例如:请同学们看课本第33页的化学反应,该反应的速率即可以用单位时间内N2O5的浓度减少来计算,还可以用单位时间内NO2或O2的浓度增加来表示。请同学们分别用三种物质来表示第3~4分钟内该反应的平均速率。V(N2O5)=0.10mol·L-1·min-1V(NO2)=0.20mol·L-1·min-1V(O2)=0.05mol·L-1·min-1这三个数字都可用于表示第3~4分钟内该反应的平均速率,也就是说,它们表示的化学反应速率是一样快的,但三者有什么关系?结论:同一化学反应其速率可以用不同物质浓度变化表示,其数值之比等于方程式中的化学计量数之比。只要知道某种物质的化学反应速率,就可以换算成用其它物质来表示该反应速率。小结:
①化学反应速率是平均速率,且均取正值。但在时间-速率图像中某时刻对应的速率为瞬时速率。
②在同一个反应里,各物质表示的速率比等于该反应方程式的系数比。
例:对于反应:mA+nB==pC+qD
V(A)∶V(B)∶V(C)∶V(D)=m∶n∶p∶q
③用化学反应速率来比较不同反应进行得快慢或同一反应在不同条件下反应的快慢时,应选择同一物质来比较,且单位统一。
④在一定温度下,固态和纯液态物质,物质的量浓度视为常数,,它们的反应速率也视为常数,不用这些物质表示反应速率。如CaCO3 、浓硫酸等。[例1]在2L的密闭容器中,加入1mol和3mol的H2和N2,发生 N2 + 3H2 2NH3 ,在2s末时,测得容器中含有0.4mol的NH3 求该反应的化学反应速率。【说明】计算反应速率一般运用“三段思维法”,即“起始”、
“转化”、“平衡”时的情况来考虑,这种方法的优点在于各物质的量
及变化非常清晰,一目了然。(3)已知N2和H2在四种不同的情况下分别发生反应。反应速率如下
①V(N2)=0.2mol/(L·s) ②V(H2)= 0.6 mol/(L·s)
③V(NH3)=0.8 mol/(L·s)④V(N2)=0.3 mol/(L·s)
其中反应进行快慢的顺序是 。 单位要一样、换算成用同种物质来表示1、某化合物A的蒸气1mol充入0.5L容器中加热分解:2A(g)=B(g)+nC(g),反应到3min时,容器内A的浓度变为0.8mol/L,测得这段时间内,平均速率v(c)=0.6mol/ (L.min),则化学反应方程式中n值为_____, v(B)=_______mol/(L.min)。30.2知识应用2、某温度时,在2L容器中,x、y、z三种物质随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式是:_______________,反应开始至2min,z的平均速率是 。3x+y=2z0.05mol/(L.min)知识应用3、在2L密闭容器中,发生3A+B = 2C 的反应,若最初加入A和B都是4mol,前 10s A的平均反应速率是0.12mol/(L.s),则第10s末容器中的B的物质的量是( )
A、1.6mol B、2.8mol
C、3.2mol D、3.6molC知识应用2、测定一定时间所释放出气体的体积。1、测定溶液浓度的变化二、化学反应速率的实验测定:例如测定二氧化碳气体体积的方法3.根据在溶液中的颜色变化,当反应物或产物本身有较明显的颜色时,人们常利用颜色深浅和显色物质的浓度间的正比关系来测量反应速率。作业布置 一、作业本
P46-47第1、6、7题
二、课课练(课时13)二、化学反应速率的测定
1.测定原理
测定不同反应时刻反应物或生成物的 ,可通过观察和测量体系中的 ,再进行适当的转换和计算。
2.测定方法
(1)量气法
对于反应2H2O2===2H2O+O2↑,CaCO3+2HCl===CaCl2+CO2↑+H2O等有气体生成的反应,可测量反应在一定温度和压强下释放出来的气体的体积。浓度某一物质的相关性质(2)比色法
有些反应物(或生成物)有颜色,随着反应的进行,溶液的颜色不断变化,可以用 方法测定溶液的颜色深浅,换算成反应物(或生成物)在不同反应时刻的 。比色浓度例如测定二氧化碳气体体积的方法实验测定盐酸与碳酸钙的反应速率1.从反应原理分析测定方法:2.考虑实验设计依据(测量二氧化碳的体积):3.设计实验方案:4.实验操作与现象(数据)记录:5.现象分析与数据处理:活动探究如图:在具支试管中加一小块大理石,再加入5毫升1 mol·L -1的盐酸。每隔10S,读一次数据。思考测定二氧化碳的体积的方法化学反应速率的测定方法小结2.测定一定时间所释放出气体的体积。3.根据在溶液中的颜色变化,当反应物或产物本身有较明显的颜色时,人们常利用颜色深浅和显色物质的浓度间的正比关系来测量反应速率。1、测定溶液浓度的变化4、化学反应的速率的实验测定:测定方法有∶
1、直接观察某些性质(如释放出气体的体积和体系压强);
2、科学仪器测定(如颜色的深浅、光的吸收和发射、导电能力等);
第一单元化学反应速率化学组:陈丽双烟花的爆炸是瞬间完成溶洞的形成需要亿万年时间CaCO3+CO2+H2O=Ca(HCO3)2
Ca(HCO3)2=CaCO3+CO2↑+H2O①一次性快餐盒、聚乙烯等塑料制品分解需要几百年。
②汽车尾气NO、CO反应能生成N2、CO2,但汽车尾气中仍有NO、CO排放,因为反应太慢了有的反应我们认为快一点好!一、化学反应速率1、定义:用来衡量化学反应进行快慢程度。
通常用单位时间内反应物浓度的减少或生成物的浓度的增加来表示。 3、单位:mol/(L·s)或mol·L-1·min-12、数学表达式看课本第32页H2O2分解的浓度变化表格,求0~20分钟内过氧化氢分解的平均速率。H2O2浓度变化量:0.80mol·L-1-0.40mol·L-1=0.40mol·L-1
时间变化量:20min练习:请计算20~40分钟内过氧化氢分解的平均速率V( H2O2 ) = 0.01mol·L-1·min-1请同学们把表中的数据在左图的直角坐标系中表示出来当Δt非常小时,就是某时刻的瞬时速率,在该图像上就是某时刻对应的斜率。1、请同学们根据图像分别计算第10~20、第60~70分钟的速率。2、从得到的数据看,在不同的时间内,化学反应的速率可能不同。所求是平均速率还是瞬时速率? 3、什么时候可以得到瞬时速率?一个化学反应既有反应物又有生成物,表示化学反应速率时,即可用某反应物的浓度变化来表示,还可以用其它反应物或生成物的浓度变化来表示。例如:请同学们看课本第33页的化学反应,该反应的速率即可以用单位时间内N2O5的浓度减少来计算,还可以用单位时间内NO2或O2的浓度增加来表示。请同学们分别用三种物质来表示第3~4分钟内该反应的平均速率。V(N2O5)=0.10mol·L-1·min-1V(NO2)=0.20mol·L-1·min-1V(O2)=0.05mol·L-1·min-1这三个数字都可用于表示第3~4分钟内该反应的平均速率,也就是说,它们表示的化学反应速率是一样快的,但三者有什么关系?结论:同一化学反应其速率可以用不同物质浓度变化表示,其数值之比等于方程式中的化学计量数之比。只要知道某种物质的化学反应速率,就可以换算成用其它物质来表示该反应速率。小结:
①化学反应速率是平均速率,且均取正值。但在时间-速率图像中某时刻对应的速率为瞬时速率。
②在同一个反应里,各物质表示的速率比等于该反应方程式的系数比。
例:对于反应:mA+nB==pC+qD
V(A)∶V(B)∶V(C)∶V(D)=m∶n∶p∶q
③用化学反应速率来比较不同反应进行得快慢或同一反应在不同条件下反应的快慢时,应选择同一物质来比较,且单位统一。
④在一定温度下,固态和纯液态物质,物质的量浓度视为常数,,它们的反应速率也视为常数,不用这些物质表示反应速率。如CaCO3 、浓硫酸等。[例1]在2L的密闭容器中,加入1mol和3mol的H2和N2,发生 N2 + 3H2 2NH3 ,在2s末时,测得容器中含有0.4mol的NH3 求该反应的化学反应速率。【说明】计算反应速率一般运用“三段思维法”,即“起始”、
“转化”、“平衡”时的情况来考虑,这种方法的优点在于各物质的量
及变化非常清晰,一目了然。(3)已知N2和H2在四种不同的情况下分别发生反应。反应速率如下
①V(N2)=0.2mol/(L·s) ②V(H2)= 0.6 mol/(L·s)
③V(NH3)=0.8 mol/(L·s)④V(N2)=0.3 mol/(L·s)
其中反应进行快慢的顺序是 。 单位要一样、换算成用同种物质来表示1、某化合物A的蒸气1mol充入0.5L容器中加热分解:2A(g)=B(g)+nC(g),反应到3min时,容器内A的浓度变为0.8mol/L,测得这段时间内,平均速率v(c)=0.6mol/ (L.min),则化学反应方程式中n值为_____, v(B)=_______mol/(L.min)。30.2知识应用2、某温度时,在2L容器中,x、y、z三种物质随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式是:_______________,反应开始至2min,z的平均速率是 。3x+y=2z0.05mol/(L.min)知识应用3、在2L密闭容器中,发生3A+B = 2C 的反应,若最初加入A和B都是4mol,前 10s A的平均反应速率是0.12mol/(L.s),则第10s末容器中的B的物质的量是( )
A、1.6mol B、2.8mol
C、3.2mol D、3.6molC知识应用2、测定一定时间所释放出气体的体积。1、测定溶液浓度的变化二、化学反应速率的实验测定:例如测定二氧化碳气体体积的方法3.根据在溶液中的颜色变化,当反应物或产物本身有较明显的颜色时,人们常利用颜色深浅和显色物质的浓度间的正比关系来测量反应速率。作业布置 一、作业本
P46-47第1、6、7题
二、课课练(课时13)二、化学反应速率的测定
1.测定原理
测定不同反应时刻反应物或生成物的 ,可通过观察和测量体系中的 ,再进行适当的转换和计算。
2.测定方法
(1)量气法
对于反应2H2O2===2H2O+O2↑,CaCO3+2HCl===CaCl2+CO2↑+H2O等有气体生成的反应,可测量反应在一定温度和压强下释放出来的气体的体积。浓度某一物质的相关性质(2)比色法
有些反应物(或生成物)有颜色,随着反应的进行,溶液的颜色不断变化,可以用 方法测定溶液的颜色深浅,换算成反应物(或生成物)在不同反应时刻的 。比色浓度例如测定二氧化碳气体体积的方法实验测定盐酸与碳酸钙的反应速率1.从反应原理分析测定方法:2.考虑实验设计依据(测量二氧化碳的体积):3.设计实验方案:4.实验操作与现象(数据)记录:5.现象分析与数据处理:活动探究如图:在具支试管中加一小块大理石,再加入5毫升1 mol·L -1的盐酸。每隔10S,读一次数据。思考测定二氧化碳的体积的方法化学反应速率的测定方法小结2.测定一定时间所释放出气体的体积。3.根据在溶液中的颜色变化,当反应物或产物本身有较明显的颜色时,人们常利用颜色深浅和显色物质的浓度间的正比关系来测量反应速率。1、测定溶液浓度的变化4、化学反应的速率的实验测定:测定方法有∶
1、直接观察某些性质(如释放出气体的体积和体系压强);
2、科学仪器测定(如颜色的深浅、光的吸收和发射、导电能力等);
