山东省威海市荣成市实验中学2023-2024学年九年级下学期期中化学试题(含答案)
文档属性
| 名称 | 山东省威海市荣成市实验中学2023-2024学年九年级下学期期中化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 639.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-21 07:54:27 | ||
图片预览

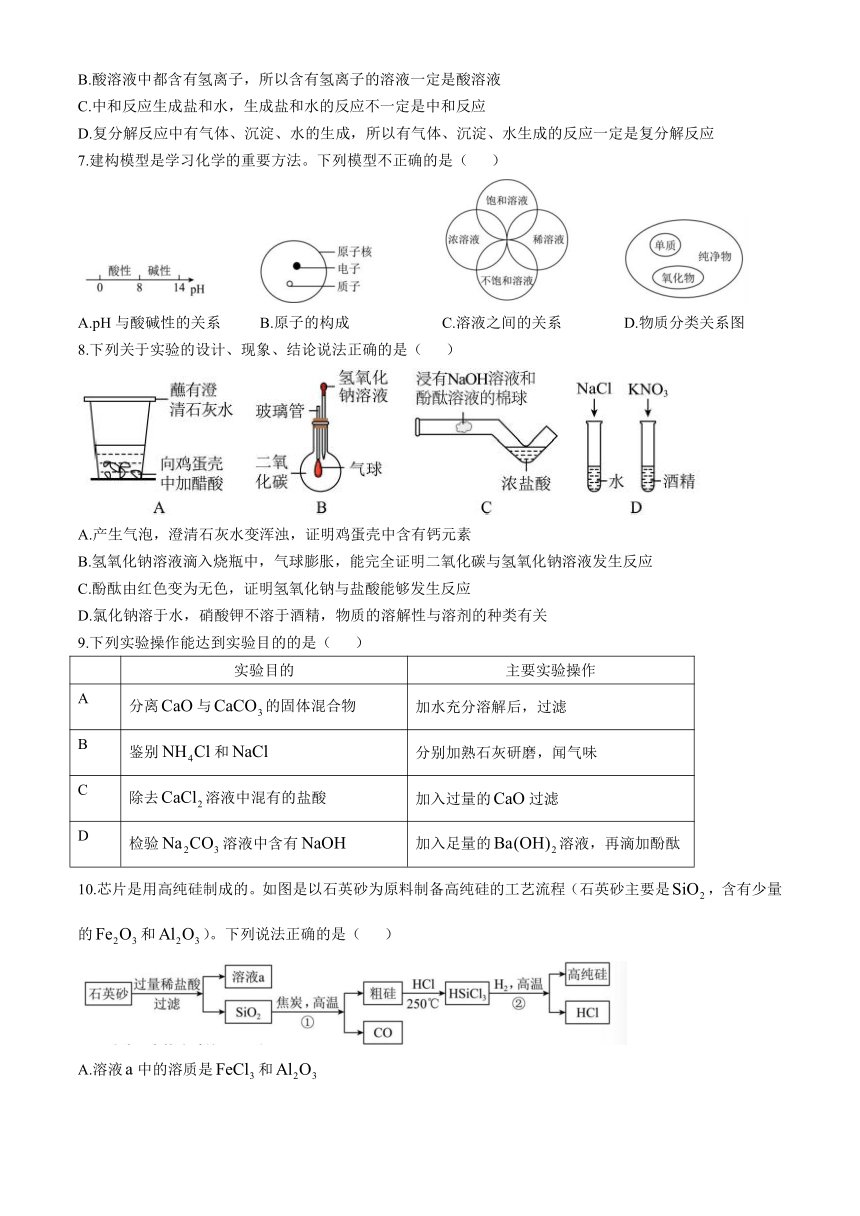
文档简介
实验中学2023——2024学年度第二学期初四化学期中考试
相对原子质量:,,,,,,,
一、选择题(每题只有一个正确选项,每小题2分,共20分)
1.下列图示实验中能明显观察到发生化学变化的是( )
A. B. C. D.石墨导电
2.下列有关空气各成分的说法错误的是( )
A.工业上利用各成分颗粒大小不同的原理,用分离液态空气的方法制取氧气
B.食品包装袋填充氮气可延长食品的保质期
C.空气污染指数越高,空气质量越差
D.稀有气体通电发出各种不同颜色的光是物理变化
3.如图是a、b、c三种固体物质的溶解度曲线。下列说法正确的是( )
A.使a、c的饱和溶液析出晶体都可以采用降温结晶的方法
B.时,a、c两种物质的溶液溶质质量分数一定相等
C.将时,a、b、c三种物质的饱和溶液降温到时,溶质质量分数由大到小的关系是:
D.在时,将物质加入水中充分溶解,所得溶液质量为
4.下列说法错误的是( )
A.金属与酸发生置换反应,溶液质量一定增加
B.酸与碱发生中和反应,溶液质量一定不变
C.碱溶液与盐溶液发生复分解反应,溶液质量一定减小
D.金属与盐溶液发生置换反应,溶液质量可能增加,也可能减小
5.下列事实能用金属活动性解释的是( )
①铝制品比铁制品耐腐蚀 ②用硫酸铜溶液和铁制取铜
③用稀盐酸除铁锈 ④金属铜不能与稀硫酸反应
A.①② B.①②③ C.②④ D.①②④
6.类推是一种重要的学习方式,但要具体问题具体分析,下列类推正确的是( )
A.氢氧化钠溶液能使酚酞试液变红,所以氢氧化铜也能使酚酞溶液变红
B.酸溶液中都含有氢离子,所以含有氢离子的溶液一定是酸溶液
C.中和反应生成盐和水,生成盐和水的反应不一定是中和反应
D.复分解反应中有气体、沉淀、水的生成,所以有气体、沉淀、水生成的反应一定是复分解反应
7.建构模型是学习化学的重要方法。下列模型不正确的是( )
A.pH与酸碱性的关系 B.原子的构成 C.溶液之间的关系 D.物质分类关系图
8.下列关于实验的设计、现象、结论说法正确的是( )
A.产生气泡,澄清石灰水变浑浊,证明鸡蛋壳中含有钙元素
B.氢氧化钠溶液滴入烧瓶中,气球膨胀,能完全证明二氧化碳与氢氧化钠溶液发生反应
C.酚酞由红色变为无色,证明氢氧化钠与盐酸能够发生反应
D.氯化钠溶于水,硝酸钾不溶于酒精,物质的溶解性与溶剂的种类有关
9.下列实验操作能达到实验目的的是( )
实验目的 主要实验操作
A 分离与的固体混合物 加水充分溶解后,过滤
B 鉴别和 分别加熟石灰研磨,闻气味
C 除去溶液中混有的盐酸 加入过量的过滤
D 检验溶液中含有 加入足量的溶液,再滴加酚酞
10.芯片是用高纯硅制成的。如图是以石英砂为原料制备高纯硅的工艺流程(石英砂主要是,含有少量的和)。下列说法正确的是( )
A.溶液中的溶质是和
B.①中发生还原反应的物质是碳
C.②中反应需要在无氧环境下进行
D.该流程中可以循环利用的物质是和
二、填空题
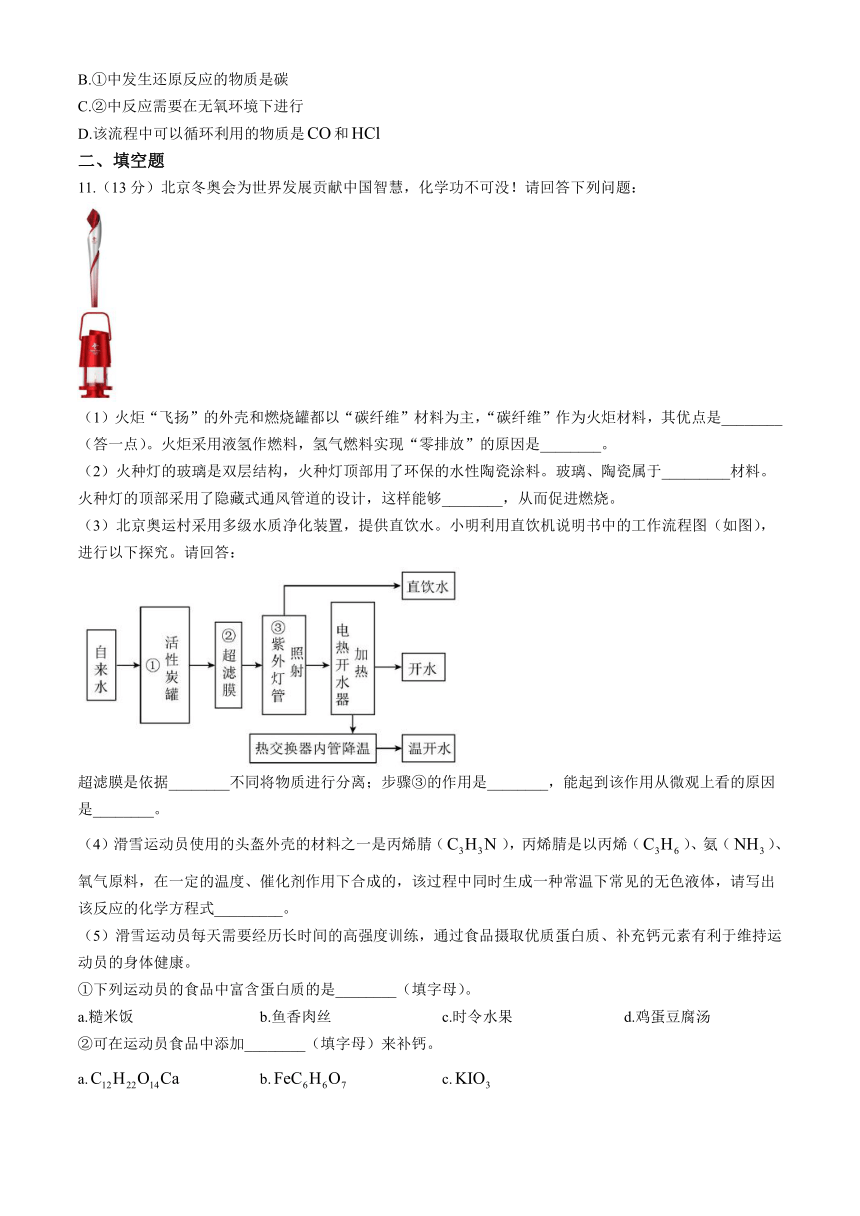
11.(13分)北京冬奥会为世界发展贡献中国智慧,化学功不可没!请回答下列问题:
(1)火炬“飞扬”的外壳和燃烧罐都以“碳纤维”材料为主,“碳纤维”作为火炬材料,其优点是________(答一点)。火炬采用液氢作燃料,氢气燃料实现“零排放”的原因是________。
(2)火种灯的玻璃是双层结构,火种灯顶部用了环保的水性陶瓷涂料。玻璃、陶瓷属于_________材料。火种灯的顶部采用了隐藏式通风管道的设计,这样能够________,从而促进燃烧。
(3)北京奥运村采用多级水质净化装置,提供直饮水。小明利用直饮机说明书中的工作流程图(如图),进行以下探究。请回答:
超滤膜是依据________不同将物质进行分离;步骤③的作用是________,能起到该作用从微观上看的原因是________。
(4)滑雪运动员使用的头盔外壳的材料之一是丙烯腈(),丙烯腈是以丙烯()、氨()、氧气原料,在一定的温度、催化剂作用下合成的,该过程中同时生成一种常温下常见的无色液体,请写出该反应的化学方程式_________。
(5)滑雪运动员每天需要经历长时间的高强度训练,通过食品摄取优质蛋白质、补充钙元素有利于维持运动员的身体健康。
①下列运动员的食品中富含蛋白质的是________(填字母)。
a.糙米饭 b.鱼香肉丝 c.时令水果 d.鸡蛋豆腐汤
②可在运动员食品中添加________(填字母)来补钙。
a. b. c.
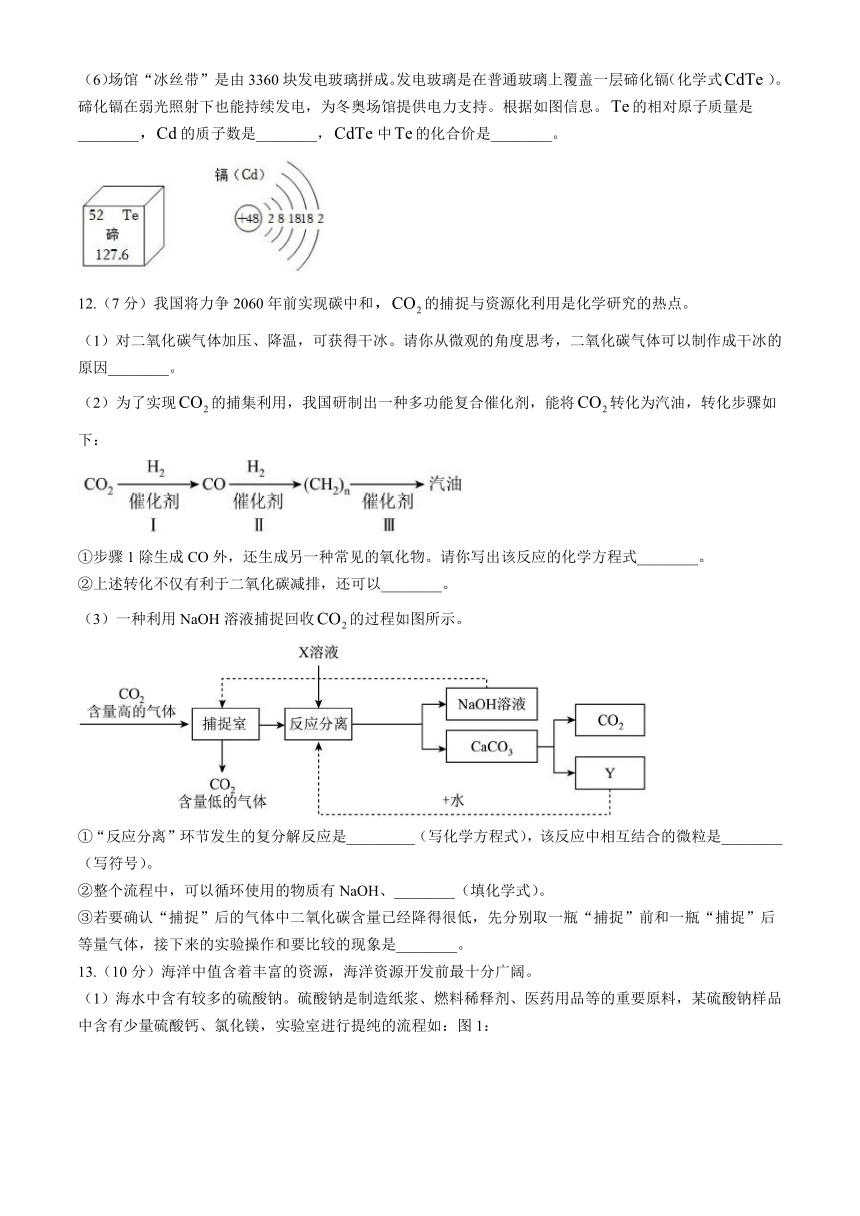
(6)场馆“冰丝带”是由3360块发电玻璃拼成。发电玻璃是在普通玻璃上覆盖一层碲化镉(化学式)。碲化镉在弱光照射下也能持续发电,为冬奥场馆提供电力支持。根据如图信息。的相对原子质量是________的质子数是________,中的化合价是________。
12.(7分)我国将力争2060年前实现碳中和的捕捉与资源化利用是化学研究的热点。
(1)对二氧化碳气体加压、降温,可获得干冰。请你从微观的角度思考,二氧化碳气体可以制作成干冰的原因________。
(2)为了实现的捕集利用,我国研制出一种多功能复合催化剂,能将转化为汽油,转化步骤如下:
①步骤1除生成CO外,还生成另一种常见的氧化物。请你写出该反应的化学方程式________。
②上述转化不仅有利于二氧化碳减排,还可以________。
(3)一种利用NaOH溶液捕捉回收的过程如图所示。
①“反应分离”环节发生的复分解反应是_________(写化学方程式),该反应中相互结合的微粒是________(写符号)。
②整个流程中,可以循环使用的物质有NaOH、________(填化学式)。
③若要确认“捕捉”后的气体中二氧化碳含量已经降得很低,先分别取一瓶“捕捉”前和一瓶“捕捉”后等量气体,接下来的实验操作和要比较的现象是________。
13.(10分)海洋中值含着丰富的资源,海洋资源开发前最十分广阔。
(1)海水中含有较多的硫酸钠。硫酸钠是制造纸浆、燃料稀释剂、医药用品等的重要原料,某硫酸钠样品中含有少量硫酸钙、氯化镁,实验室进行提纯的流程如:图1:
回答下列问题:
①用氢氧化钠和碳酸钠除杂时,反应的化学方程式分别为________、_________。
②氢氧化钠和碳酸钠如果添加过量了,可在滤液中加入适量________(写溶质的化学式)溶液除去。
③“后续处理”的主要操作时蒸发,为了获得纯净的硫酸钠,应蒸发至________(填序号)。
A.完全蒸干时停止加热
B.快干时停止加热,利用余热蒸干
C.有大量固体析出时停止加热,过滤弃去剩余的少量溶液
④已知硫酸钠的溶解度随温度变化的曲线如图所示。时,硫酸钠的溶解度为________g。将该饱和溶液升高温度至,观察到的现象是_________。
(2)利用苦卤制取镁,主要流程如图:
步骤Ⅱ中的试剂a________。步骤Ⅲ中反应的化学方程式是________。
(3)采用氨碱法生产纯碱,主要流程如图:
①上述Ⅰ、Ⅱ两个步骤总反应的化学方程式:________。
②从步骤Ⅱ过滤得到碳酸氢钠,近日,一则《重大突破!癌细胞,竟被中国医生用小苏打“饿”死了》的新闻在网络上热传:研究人员用小苏打用来去除肿瘤内的氢离子,就可破坏乳酸根和氢离子的协同作用,从而快速有效地杀死处于葡萄糖饥饿或缺乏的肿瘤细胞,请你用一个化学反应实质证明该研究成果的科学性________。当然,科学原理如何转换到临床上来,还会是一个很艰难漫长的过程。
三、实验探究题
14.(8分)垃圾是放错地方的资源,城市的废旧电器是一座“金属矿山”,某废旧电器中含有锌、铜、镍(Ni)三种金属,兴趣小组的同学为了从中回收金属铜和镍,做了如下的探究。
【已知】硫酸镍(化学式)能溶于水。
实验一:探究锌、铜、镍三种金属在溶液中的活动性强弱
【提出猜想】兴趣小组结合常见金属活动性顺序,提出了以下猜想。
猜想一:;猜想二:;猜想三:_________。
【进行实验】兴趣小组进行了如下的实验,请完成实验报告。
实验步骤 实验现象 解释与结论
____________________________ ____________________________ 锌片表面产生的气泡较快;镍片表面产生的气泡较慢;铜片无明显现象。 猜想_________正确。镍与稀硫酸反应的化学方程式是________。
实验二:从含有锌、铜、镍三种金属的废旧电器中回收铜和镍
【设计方案】兴趣小组设计了如图所示的物质转化流程。
步骤①中得到的A是_________。步骤②中发生反应的化学方程式(2分)_________。
【反思评价】合理开发城市“金属矿山”的意义是_________(答1条)。
15.(7分)某兴趣小组在实验室发现一瓶敞口放置的氧化钙,猜测该氧化钙可能变质。小明为确定该瓶氧化钙的成分进行了实验探究,如下表所示:
实验步骤 实验现象 实验结论
取少量该氧化钙样品于烧杯中,加水搅拌,静置,取上层清液滴加到红色石蕊试纸上 ①烧杯壁变热,石蕊试纸变为蓝色 样品中含有氧化钙和氢氧化钙
②烧杯底部有白色固体 样品中含有碳酸钙
【交流讨论】小组讨论后,同学们认为:“现象①”不足以证明样品中有氢氧化钙,原因是________(用化学方程式表示);“现象②”不足以证明样品中有碳酸钙,原因是________。
兴趣小组同学为准确测定该瓶氧化钙的成分,进行了如下探究。
【提出问题】该瓶氧化钙中都有哪些成分,各成分的质量比是多少?
【查阅资料】氢氧化钙在一定温度下能分解:
碱石灰是氢氧化钠与氧化钙的固体混合物,能吸收水和二氧化碳
【设计并实施实验】兴趣小组设计了如图所示的实验(装置气密性良好)。取该氧化钙样品放在装置B的玻璃管中,先通入一会空气,再称量C、D装置的质量,然后边通入空气,边用酒精喷灯加热(能达到高温),至固体不再发生变化,继续通一会空气,实验后测得C装置增重,D装置增重。
【形成结论】该氧化钙样品中的成分是_________,它们的质量比是________。
【反思评价】E装置的作用是_________。如果没有A装置,可能会导致氧化钙样品成分中的__________测定结果偏大。
【拓展应用】为废物利用,兴趣小组打算用这瓶变质的氧化钙与足量的稀盐酸反应,再蒸发制取产品氯化钙固体,与变质前的氧化钙相比,变质后的氧化钙对产品氯化钙的产量是否会有影响?原因_________。
四、计算题(5分)
16.某品牌炉具清洁剂的有效成分是氢氧化钠,化学兴趣小组的同学为测定该炉具清洁剂中氢氧化钠的质量分数,做了如下探究,取炉具清洁剂样品于烧杯中,加水稀释,再逐滴加入溶质质量分数为的稀盐酸(密度是),并用玻璃棒不断搅拌(如图1所示)。
图1 图2
同时利用传感器测定溶液的,反应过程中溶液的随加入稀盐酸的体积变化关系如图2所示。(已知:该清洁剂中其他成分不与水、稀盐酸发生反应)
请完成下列问题:
(1)样品中的氢氧化钠恰好被完全反应时,加入的稀盐酸的质量是________g。
(2)计算该炉具清洁剂中氢氧化钠的质量分数。(写出计算过程)
参考答案
一、
1 2 3 4 5 6 7 8 9 10
答案 C A C C C C B C B C
二、填空题:
11.(1)质量轻/耐高温,燃烧产物是水,无污染
(2)无机非金属,增大与氧气接触面积
(3)颗粒大小,杀菌消毒,破坏蛋白质分子的结构使其失去生理活性
(4)略,无条件不得分
(5)①bd,②a
(6)127.6,48,-2
12.(1)二氧化碳分子之间间隔变小(或分子之间有间隔)
(2)①略,②减缓能源危机(合理即可)
①,和
②,③加入等体积、等浓度的澄清石灰水,比较石灰水的浑浊程度
13.(1)①略
②
③C,④45(44~46都可),溶液中有晶体析出
(2)盐酸,略
(3)①略,②
14.【提出猜想】Ni>Zn>Cu
【进行实验】步骤:取三支试管,分别向其中加入等质量、等浓度(没有-0.5)的稀硫酸,然后将大小、形状(没有-0.5)相同的锌、铜、镍三种金属片分别插入三支试管中。
一,方程式略
【设计方案】Cu,,
【反思评价】节约金属资源,减少对环境的污染(合理即可)
15.,氢氧化钙微溶于水,白色固体也可能是没有溶解的氢氧化钙
【形成结论】氧化钙、氢氧化钙、碳酸钙,38:37:25。
【反思评价】防止空气中的水蒸气和二氧化碳进入D装置,氢氧化钙、碳酸钙
【拓展应用】没有影响,是因为无论是否变质,最终钙元素完全转化到氯化钙中。
16.(1)50;(2)4%。
相对原子质量:,,,,,,,
一、选择题(每题只有一个正确选项,每小题2分,共20分)
1.下列图示实验中能明显观察到发生化学变化的是( )
A. B. C. D.石墨导电
2.下列有关空气各成分的说法错误的是( )
A.工业上利用各成分颗粒大小不同的原理,用分离液态空气的方法制取氧气
B.食品包装袋填充氮气可延长食品的保质期
C.空气污染指数越高,空气质量越差
D.稀有气体通电发出各种不同颜色的光是物理变化
3.如图是a、b、c三种固体物质的溶解度曲线。下列说法正确的是( )
A.使a、c的饱和溶液析出晶体都可以采用降温结晶的方法
B.时,a、c两种物质的溶液溶质质量分数一定相等
C.将时,a、b、c三种物质的饱和溶液降温到时,溶质质量分数由大到小的关系是:
D.在时,将物质加入水中充分溶解,所得溶液质量为
4.下列说法错误的是( )
A.金属与酸发生置换反应,溶液质量一定增加
B.酸与碱发生中和反应,溶液质量一定不变
C.碱溶液与盐溶液发生复分解反应,溶液质量一定减小
D.金属与盐溶液发生置换反应,溶液质量可能增加,也可能减小
5.下列事实能用金属活动性解释的是( )
①铝制品比铁制品耐腐蚀 ②用硫酸铜溶液和铁制取铜
③用稀盐酸除铁锈 ④金属铜不能与稀硫酸反应
A.①② B.①②③ C.②④ D.①②④
6.类推是一种重要的学习方式,但要具体问题具体分析,下列类推正确的是( )
A.氢氧化钠溶液能使酚酞试液变红,所以氢氧化铜也能使酚酞溶液变红
B.酸溶液中都含有氢离子,所以含有氢离子的溶液一定是酸溶液
C.中和反应生成盐和水,生成盐和水的反应不一定是中和反应
D.复分解反应中有气体、沉淀、水的生成,所以有气体、沉淀、水生成的反应一定是复分解反应
7.建构模型是学习化学的重要方法。下列模型不正确的是( )
A.pH与酸碱性的关系 B.原子的构成 C.溶液之间的关系 D.物质分类关系图
8.下列关于实验的设计、现象、结论说法正确的是( )
A.产生气泡,澄清石灰水变浑浊,证明鸡蛋壳中含有钙元素
B.氢氧化钠溶液滴入烧瓶中,气球膨胀,能完全证明二氧化碳与氢氧化钠溶液发生反应
C.酚酞由红色变为无色,证明氢氧化钠与盐酸能够发生反应
D.氯化钠溶于水,硝酸钾不溶于酒精,物质的溶解性与溶剂的种类有关
9.下列实验操作能达到实验目的的是( )
实验目的 主要实验操作
A 分离与的固体混合物 加水充分溶解后,过滤
B 鉴别和 分别加熟石灰研磨,闻气味
C 除去溶液中混有的盐酸 加入过量的过滤
D 检验溶液中含有 加入足量的溶液,再滴加酚酞
10.芯片是用高纯硅制成的。如图是以石英砂为原料制备高纯硅的工艺流程(石英砂主要是,含有少量的和)。下列说法正确的是( )
A.溶液中的溶质是和
B.①中发生还原反应的物质是碳
C.②中反应需要在无氧环境下进行
D.该流程中可以循环利用的物质是和
二、填空题
11.(13分)北京冬奥会为世界发展贡献中国智慧,化学功不可没!请回答下列问题:
(1)火炬“飞扬”的外壳和燃烧罐都以“碳纤维”材料为主,“碳纤维”作为火炬材料,其优点是________(答一点)。火炬采用液氢作燃料,氢气燃料实现“零排放”的原因是________。
(2)火种灯的玻璃是双层结构,火种灯顶部用了环保的水性陶瓷涂料。玻璃、陶瓷属于_________材料。火种灯的顶部采用了隐藏式通风管道的设计,这样能够________,从而促进燃烧。
(3)北京奥运村采用多级水质净化装置,提供直饮水。小明利用直饮机说明书中的工作流程图(如图),进行以下探究。请回答:
超滤膜是依据________不同将物质进行分离;步骤③的作用是________,能起到该作用从微观上看的原因是________。
(4)滑雪运动员使用的头盔外壳的材料之一是丙烯腈(),丙烯腈是以丙烯()、氨()、氧气原料,在一定的温度、催化剂作用下合成的,该过程中同时生成一种常温下常见的无色液体,请写出该反应的化学方程式_________。
(5)滑雪运动员每天需要经历长时间的高强度训练,通过食品摄取优质蛋白质、补充钙元素有利于维持运动员的身体健康。
①下列运动员的食品中富含蛋白质的是________(填字母)。
a.糙米饭 b.鱼香肉丝 c.时令水果 d.鸡蛋豆腐汤
②可在运动员食品中添加________(填字母)来补钙。
a. b. c.
(6)场馆“冰丝带”是由3360块发电玻璃拼成。发电玻璃是在普通玻璃上覆盖一层碲化镉(化学式)。碲化镉在弱光照射下也能持续发电,为冬奥场馆提供电力支持。根据如图信息。的相对原子质量是________的质子数是________,中的化合价是________。
12.(7分)我国将力争2060年前实现碳中和的捕捉与资源化利用是化学研究的热点。
(1)对二氧化碳气体加压、降温,可获得干冰。请你从微观的角度思考,二氧化碳气体可以制作成干冰的原因________。
(2)为了实现的捕集利用,我国研制出一种多功能复合催化剂,能将转化为汽油,转化步骤如下:
①步骤1除生成CO外,还生成另一种常见的氧化物。请你写出该反应的化学方程式________。
②上述转化不仅有利于二氧化碳减排,还可以________。
(3)一种利用NaOH溶液捕捉回收的过程如图所示。
①“反应分离”环节发生的复分解反应是_________(写化学方程式),该反应中相互结合的微粒是________(写符号)。
②整个流程中,可以循环使用的物质有NaOH、________(填化学式)。
③若要确认“捕捉”后的气体中二氧化碳含量已经降得很低,先分别取一瓶“捕捉”前和一瓶“捕捉”后等量气体,接下来的实验操作和要比较的现象是________。
13.(10分)海洋中值含着丰富的资源,海洋资源开发前最十分广阔。
(1)海水中含有较多的硫酸钠。硫酸钠是制造纸浆、燃料稀释剂、医药用品等的重要原料,某硫酸钠样品中含有少量硫酸钙、氯化镁,实验室进行提纯的流程如:图1:
回答下列问题:
①用氢氧化钠和碳酸钠除杂时,反应的化学方程式分别为________、_________。
②氢氧化钠和碳酸钠如果添加过量了,可在滤液中加入适量________(写溶质的化学式)溶液除去。
③“后续处理”的主要操作时蒸发,为了获得纯净的硫酸钠,应蒸发至________(填序号)。
A.完全蒸干时停止加热
B.快干时停止加热,利用余热蒸干
C.有大量固体析出时停止加热,过滤弃去剩余的少量溶液
④已知硫酸钠的溶解度随温度变化的曲线如图所示。时,硫酸钠的溶解度为________g。将该饱和溶液升高温度至,观察到的现象是_________。
(2)利用苦卤制取镁,主要流程如图:
步骤Ⅱ中的试剂a________。步骤Ⅲ中反应的化学方程式是________。
(3)采用氨碱法生产纯碱,主要流程如图:
①上述Ⅰ、Ⅱ两个步骤总反应的化学方程式:________。
②从步骤Ⅱ过滤得到碳酸氢钠,近日,一则《重大突破!癌细胞,竟被中国医生用小苏打“饿”死了》的新闻在网络上热传:研究人员用小苏打用来去除肿瘤内的氢离子,就可破坏乳酸根和氢离子的协同作用,从而快速有效地杀死处于葡萄糖饥饿或缺乏的肿瘤细胞,请你用一个化学反应实质证明该研究成果的科学性________。当然,科学原理如何转换到临床上来,还会是一个很艰难漫长的过程。
三、实验探究题
14.(8分)垃圾是放错地方的资源,城市的废旧电器是一座“金属矿山”,某废旧电器中含有锌、铜、镍(Ni)三种金属,兴趣小组的同学为了从中回收金属铜和镍,做了如下的探究。
【已知】硫酸镍(化学式)能溶于水。
实验一:探究锌、铜、镍三种金属在溶液中的活动性强弱
【提出猜想】兴趣小组结合常见金属活动性顺序,提出了以下猜想。
猜想一:;猜想二:;猜想三:_________。
【进行实验】兴趣小组进行了如下的实验,请完成实验报告。
实验步骤 实验现象 解释与结论
____________________________ ____________________________ 锌片表面产生的气泡较快;镍片表面产生的气泡较慢;铜片无明显现象。 猜想_________正确。镍与稀硫酸反应的化学方程式是________。
实验二:从含有锌、铜、镍三种金属的废旧电器中回收铜和镍
【设计方案】兴趣小组设计了如图所示的物质转化流程。
步骤①中得到的A是_________。步骤②中发生反应的化学方程式(2分)_________。
【反思评价】合理开发城市“金属矿山”的意义是_________(答1条)。
15.(7分)某兴趣小组在实验室发现一瓶敞口放置的氧化钙,猜测该氧化钙可能变质。小明为确定该瓶氧化钙的成分进行了实验探究,如下表所示:
实验步骤 实验现象 实验结论
取少量该氧化钙样品于烧杯中,加水搅拌,静置,取上层清液滴加到红色石蕊试纸上 ①烧杯壁变热,石蕊试纸变为蓝色 样品中含有氧化钙和氢氧化钙
②烧杯底部有白色固体 样品中含有碳酸钙
【交流讨论】小组讨论后,同学们认为:“现象①”不足以证明样品中有氢氧化钙,原因是________(用化学方程式表示);“现象②”不足以证明样品中有碳酸钙,原因是________。
兴趣小组同学为准确测定该瓶氧化钙的成分,进行了如下探究。
【提出问题】该瓶氧化钙中都有哪些成分,各成分的质量比是多少?
【查阅资料】氢氧化钙在一定温度下能分解:
碱石灰是氢氧化钠与氧化钙的固体混合物,能吸收水和二氧化碳
【设计并实施实验】兴趣小组设计了如图所示的实验(装置气密性良好)。取该氧化钙样品放在装置B的玻璃管中,先通入一会空气,再称量C、D装置的质量,然后边通入空气,边用酒精喷灯加热(能达到高温),至固体不再发生变化,继续通一会空气,实验后测得C装置增重,D装置增重。
【形成结论】该氧化钙样品中的成分是_________,它们的质量比是________。
【反思评价】E装置的作用是_________。如果没有A装置,可能会导致氧化钙样品成分中的__________测定结果偏大。
【拓展应用】为废物利用,兴趣小组打算用这瓶变质的氧化钙与足量的稀盐酸反应,再蒸发制取产品氯化钙固体,与变质前的氧化钙相比,变质后的氧化钙对产品氯化钙的产量是否会有影响?原因_________。
四、计算题(5分)
16.某品牌炉具清洁剂的有效成分是氢氧化钠,化学兴趣小组的同学为测定该炉具清洁剂中氢氧化钠的质量分数,做了如下探究,取炉具清洁剂样品于烧杯中,加水稀释,再逐滴加入溶质质量分数为的稀盐酸(密度是),并用玻璃棒不断搅拌(如图1所示)。
图1 图2
同时利用传感器测定溶液的,反应过程中溶液的随加入稀盐酸的体积变化关系如图2所示。(已知:该清洁剂中其他成分不与水、稀盐酸发生反应)
请完成下列问题:
(1)样品中的氢氧化钠恰好被完全反应时,加入的稀盐酸的质量是________g。
(2)计算该炉具清洁剂中氢氧化钠的质量分数。(写出计算过程)
参考答案
一、
1 2 3 4 5 6 7 8 9 10
答案 C A C C C C B C B C
二、填空题:
11.(1)质量轻/耐高温,燃烧产物是水,无污染
(2)无机非金属,增大与氧气接触面积
(3)颗粒大小,杀菌消毒,破坏蛋白质分子的结构使其失去生理活性
(4)略,无条件不得分
(5)①bd,②a
(6)127.6,48,-2
12.(1)二氧化碳分子之间间隔变小(或分子之间有间隔)
(2)①略,②减缓能源危机(合理即可)
①,和
②,③加入等体积、等浓度的澄清石灰水,比较石灰水的浑浊程度
13.(1)①略
②
③C,④45(44~46都可),溶液中有晶体析出
(2)盐酸,略
(3)①略,②
14.【提出猜想】Ni>Zn>Cu
【进行实验】步骤:取三支试管,分别向其中加入等质量、等浓度(没有-0.5)的稀硫酸,然后将大小、形状(没有-0.5)相同的锌、铜、镍三种金属片分别插入三支试管中。
一,方程式略
【设计方案】Cu,,
【反思评价】节约金属资源,减少对环境的污染(合理即可)
15.,氢氧化钙微溶于水,白色固体也可能是没有溶解的氢氧化钙
【形成结论】氧化钙、氢氧化钙、碳酸钙,38:37:25。
【反思评价】防止空气中的水蒸气和二氧化碳进入D装置,氢氧化钙、碳酸钙
【拓展应用】没有影响,是因为无论是否变质,最终钙元素完全转化到氯化钙中。
16.(1)50;(2)4%。
同课章节目录
