江西省赣州市第三中学2015-2016学年高中化学《第四章 非金属及其化合物》单元练习 新人教版必修1
文档属性
| 名称 | 江西省赣州市第三中学2015-2016学年高中化学《第四章 非金属及其化合物》单元练习 新人教版必修1 |  | |
| 格式 | zip | ||
| 文件大小 | 55.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-11-30 19:51:21 | ||
图片预览



文档简介
第四章 非金属及其化合物
一、选择题
1.近年来,光化学烟雾污染问题已引起人们的注意,下列哪种气体是造成光化学烟雾的最主要因素( )。
A.NO2 B.SO2 C.CO D.CH4
2.将少量的CO2通入下列溶液中,不能产生沉淀的是( )。
A.硅酸钠溶液 B.石灰水 C.氢氧化钡溶液 D.氯化钙溶液
3.下列金属中,一定条件下既能跟Cl2反应,又能跟稀盐酸反应,且均生成MCl2型化合物的是( )。
A.Al B.Fe C.Cu D.Mg
4.新制氯水与久置的氯水相比较,下列结论不正确的是( )。
A.颜色相同 B.前者能使有色布条褪色
C.都含有H+ D.加AgNO3溶液都能生成白色沉淀
5.“84”消毒液在日常生活中被广泛应用。该消毒液无色,pH大于7,对某些有色物质有漂白作用。你认为它可能的有效成分是( )。
A.SO2 B.Na2CO3 C.KMnO4 D.NaClO
6.检验铵盐的一般方法是将待测物取少许置于试管中,然后( )。
A.加水溶解后,再滴入酚酞溶液
B.加强碱溶液加热后,用湿润红色石蕊试纸在试管口检验
C.加入强酸溶液加热后,再滴入酚酞溶液
D.加入强碱溶液加热后,再滴入酚酞溶液
7.自来水可用氯气消毒,某学生用这种自来水去配制下列物质溶液,会产生明显的药品变质问题的是( )。
A.NaNO3 B.FeCl2 C.Na2SO4 D.AlCl3
8.某冶炼厂利用炼铜产生的SO2生产硫酸,变废为宝,化害为利。其原理是( )。
A.利用了SO2的水溶性,将SO2直接通入水中
B.利用了SO2的氧化性,将SO2直接通入水中
C.利用了SO2的氧化性,使其与O2反应而转化为SO3,再与水反应
D.利用了SO2的还原性,使其与O2反应而转化为SO3,再与水反应
9.有NaCl、FeCl2、FeCl3、 ( http: / / www.21cnjy.com )MgCl2、AlCl3、NH4Cl六种溶液,只用一种试剂就可把它们鉴别开来,这种试剂是( )。
A.盐酸 B.烧碱溶液 C.氨水 D.KSCN溶液
10.现有H2SO4、Ba(OH)2、Na ( http: / / www.21cnjy.com )2CO3和氯水四种溶液,有如图所示的相互关系,右下图中每条线段两端的物质可以发生化学反应。下列推断合理的是( )。
A.M一定是Ba(OH)2
B.Y可能是氯水
C.X一定是Na2CO3溶液
D.Z可能是H2SO4
11.下列关于SO2的叙述,正确的是( )。
A.SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物
B.SO2是硫酸的酸酐
C.SO2是无色、无味、有毒的气体
D.SO2具有漂白性,因而可以用于食品增白
12.有关硫酸的下列化学反应中,不是表现硫酸氧化性的是( )。
A.浓硫酸与铝的反应 B.浓硫酸与木炭的反应
C.稀硫酸与锌的反应 D.稀硫酸与纯碱的反应
13.下列根据实验现象作出的推断,正确的是( )。
A.溶于水后能形成无色溶液的红棕色气体一定是 NO
B.能使湿润的淀粉碘化钾试纸变蓝的气体一定是Cl2
C.遇空气立即形成红棕色气体的一定是 NO
D.在潮湿的空气中形成白雾的气体一定是 HCl
14.为了除去镀在铝制品表面的铜镀层,可选用的试剂是( )。
A.稀硝酸 B.浓硝酸 C.浓硫酸 D.浓盐酸
15.随着人们生活节奏的加快,方便的小包装 ( http: / / www.21cnjy.com )食品已被广泛接受。为了防止食品受潮及氧化变质,在包装内放置的起保护作用的小纸袋中应放入的化学物质是( )。
A.无水硫酸铜、蔗糖 B.硅胶、硫酸亚铁
C.食盐、硫酸亚铁 D.生石灰、食盐
16.如图所示,小试管内盛 ( http: / / www.21cnjy.com )有约3 mL饱和硫酸铜溶液,与锥形瓶连通的U型细管内盛有少量水(为便于观察,预先染成红色),沿小试管的内壁小心地慢慢注入约3 mL浓硫酸,静置片刻,不可能观察到的现象是( )。
A.小试管内液体分成两层,上层蓝色,下层无色
B.U型细管内左边液面下降,右边液面升高
C.小试管内有少量白色固体析出
D.小试管内液体不分层,但有蓝色晶体析出
二、填空题
17.2002年9月26日,中国北京曙光公司研制出了第—款具有我国完全自主知识产权的高性能CPU芯片——“龙芯”1号。
(1)“龙芯”(芯片)关键材料的主要化学成分是 (填化学式,下同)。
(2)计算机长距离联网传输很快的线路中使用的材料叫 ,其主要化学成分是 。
(3)上述这种埋在地下的材料如果裸露在 ( http: / / www.21cnjy.com )碱性土壤中,结果会断路,用离子方程式说明原因 。
*18.某些防治碘缺乏病的碘添加剂 ( http: / / www.21cnjy.com )是KIO3(如加碘盐),可用盐酸酸化的淀粉碘化钾混合液检验食盐是否加碘,其反应的离子方程式为: 。
*19.下图中每一方框中表示一种反 ( http: / / www.21cnjy.com )应物或生成物,其中A、C、D、E在通常情况下均为气体,B为液体,(图中有些反应的产物和反应条件没有标出)。试回答:
(1)X是 ,C是 ,F是 。
(2)写出A→D反应的化学方程式 。
(3)写出G→E反应的化学方程式 。
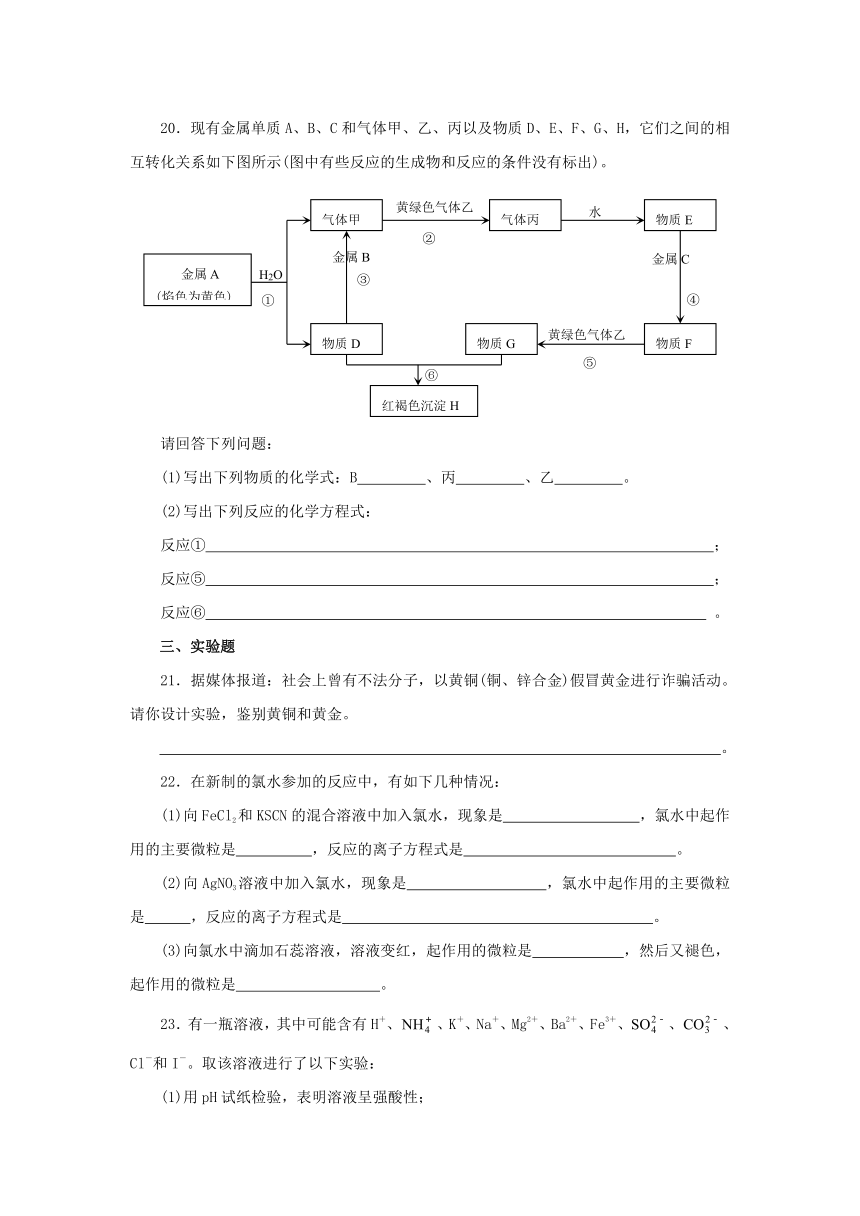
20.现有金属单质A、B、C和气体甲、乙、丙 ( http: / / www.21cnjy.com )以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
请回答下列问题:
(1)写出下列物质的化学式:B 、丙 、乙 。
(2)写出下列反应的化学方程式:
反应① ;
反应⑤ ;
反应⑥ 。
三、实验题
21.据媒体报道:社会上曾有不法分子,以黄铜(铜、锌合金)假冒黄金进行诈骗活动。请你设计实验,鉴别黄铜和黄金。
。
22.在新制的氯水参加的反应中,有如下几种情况:
(1)向FeCl2和KSCN的混合溶液 ( http: / / www.21cnjy.com )中加入氯水,现象是 ,氯水中起作用的主要微粒是 ,反应的离子方程式是 。
(2)向AgNO3溶液中加入氯水, ( http: / / www.21cnjy.com )现象是 ,氯水中起作用的主要微粒是 ,反应的离子方程式是 。
(3)向氯水中滴加石蕊溶液,溶液变红,起 ( http: / / www.21cnjy.com )作用的微粒是 ,然后又褪色,起作用的微粒是 。
23.有一瓶溶液,其中可能含有H+、、K+、Na+、Mg2+、Ba2+、Fe3+、、、Cl-和I-。取该溶液进行了以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入数滴氯水及2 mL CCl4,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入NaOH 溶液使其变为碱性,无沉淀生成;
(4)取部分上述碱性溶液,加Na2CO3溶液,有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝;
根据上述实验事实,可知原溶液中肯定含有的离子是 ;肯定没有的离子是 ;还不能确定是否含有的离子是 。
24.实验室通常用如右图所示的装置来制取氨气。回答下列问题:
(1)制取氨气时反应的化学方程式为:
。
(2)收集氨气时必须使用干燥的集气装置的原因是 。
(3)下列操作不能用于检验NH3的是( )
A.气体使湿润的酚酞试纸变红 B.气体能使湿润的红色石蕊试纸变蓝
C.气体与蘸有浓H2SO4的玻璃棒靠近 D.气体与蘸有浓盐酸的玻璃棒靠近
(4)除氨气外,还可以用该装置制取的常见气体是 。
四、计算题
25.将32.64 g Cu与140 mL一定浓度的HNO3反应,Cu完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。
(1)NO的体积为多少?
(2)NO2的体积为多少?
参考答案
一、选择题
1.A
解析:考查空气污染的常识。
2.D
解析:CO2通入硅酸钠溶液会产生硅酸 ( http: / / www.21cnjy.com )沉淀;CO2通入石灰水会产生碳酸钙沉淀;CO2通入氢氧化钡溶液会产生碳酸钡沉淀;CO2不能与氯化钙反应,因为弱酸不能制强酸。
3.D
解析:Al不论是与氯气反应还是与稀盐酸 ( http: / / www.21cnjy.com )反应均生成AlCl3,Fe跟C12反应生成FeCl3,Fe跟稀盐酸反应生成FeCl2;Cu不与稀盐酸反应。
4.A
解析:新制的氯水中有氯气、次氯酸和盐酸;久置的氯水主要含有盐酸。
5.D
解析:考查NaClO的应用。
6.B
解析:考查铵盐的检验方法。
7.B
解析:FeCl2有还原性,会被氯水氧化。
8.D
解析:考查SO2的性质,及硫酸工业的原理。
9.B
解析:现象分别为:无明显现象、产生白色沉淀很快变成灰绿色、产生红褐色沉淀、产生白色沉淀、先产生白色沉淀后消失、产生刺激性气味气体。
10.D
解析:根据两两反应进行判断,H2SO4和氯水分别可以与2种物质反应,而Ba(OH)2、Na2CO3分别可以与3种物质反应。
11.A
解析:SO2是亚硫酸的酸酐;SO2是有刺激性气味的气体;SO2有漂白性,但不能用来加工食品。
12.D
解析:稀硫酸与纯碱反应时,元素化合价没有改变,所以不体现氧化性。
13.C
解析:NO2是红棕色气体,溶于 ( http: / / www.21cnjy.com )水后与水反应得到无色溶液。使湿润的淀粉碘化钾试纸变蓝的气体可以是 Cl2、Br2、NO2 等。NO与 O2 反应生成红棕色气体 NO2。在潮湿的空气中形成白雾的有 HF、HCl、HBr 等。
14.B
解析:浓硝酸能与铜反应,但不会与铝反应,因为钝化。
15.B
解析:硅胶能吸水,硫酸亚铁能吸收氧气。
16.D
解析:浓硫酸会吸收硫酸铜晶体中的结晶水,所以不可能析出蓝色晶体。
二、填空题
17.(1)Si (2)光导纤维 SiO2 (3)SiO2+2OH-=SiO+H2O
解析:考查硅、二氧化硅的性质及用途。
*18.5I-+IO+6H+=3I2+3H2O
解析:考查氧化还原反应方程式的书写。
*19.(1)NH4HCO3 NH3 NO2 (2)2CO2+2Na2O2=2Na2CO3+O2
(3)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
解析:破题点是NH4HCO3既能与酸反 ( http: / / www.21cnjy.com )应,又能与碱反应,且受热生成三种气体;能与Na2O2反应的一般是水或二氧化碳;浓、稀硝酸均能与铜反应,但还原产物不同。
20.(1) Al HCl Cl2
(2)①2Na+2H2O=2NaOH+H2↑
⑤2FeCl2+Cl2=2FeCl3
⑥3NaOH+FeCl3=Fe(OH)3↓+3NaCl
解析:金属A为Na,黄绿色气体乙为Cl2,红褐色沉淀H为Fe(OH)3,由此往前顺推即可。
三、实验题
21.分别取样放入稀硝酸(或盐酸)中,能溶解的是黄铜,无反应的是黄金。
解析:考查不同金属与酸反应的情况。金不溶于稀硝酸(或盐酸),而锌、铜能溶入硝酸(答案合理即可)。
22.(1)溶液变红 Cl2 2Fe2++Cl2=2Fe3++2Cl-
(2)产生白色沉淀 Cl- Ag++Cl-=AgCl↓
(3)H+ HClO
解析:考查氯水的成分及其性质。
23.H+、Ba2+、I-、NH CO、SO、Mg2+、Fe3+ K+、Na+、Cl-
解析: CO不能与 H+共存,SO不能与Ba2+共存,Mg2+、Fe3+在碱性条件下会产生白色沉淀,所以它们肯定不存在。
24.(1)2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑
(2)氨气极易溶于水
(3)C
(4)氧气
解析:考查氨气的实验室制备。
四、计算题
25.方法一:
解:由题意可知HNO3被还原的产物既有NO又有NO2,设生成NO n1 mol,它得到的电子就是3n1 mol,设生成NO2 n2 mol,这也是它得到电子的物质的量。由电子得失守恒得到:
n1+n2=
3n1+n2=×2
解得 n1=0.26,n2=0.24
标况下生成NO的体积是:0.26 mol×22.4 L/mol=5.8 L
标况下生成NO2的体积是:0. 24 mol×22.4 L/mol=5.4 L
方法二:
解:4HNO3(浓)+Cu=Cu(NO3)2+2NO2↑+2H2O
1 mol 2 mol
n1 2n1
8HNO3(稀)+3Cu=3Cu(NO3)2+2NO↑+4H2O
3 mol 2 mol
n2 n2
2n1+n2= mol
n1+n2= mol
解得 n1=0.12 mol,n2=0.39 mol;n(NO2)=2n1=0.24 mol,n(NO)=n2=0.26 mol标况下生成NO的体积是:0.26 mol×22.4 L/mol=5.8 L
标况下生成NO2的体积是:0.24 mol×22.4 L/mol=5.4 L
解析:涉及氧化还原反应的混合物计算可以根据化学方程式列方程组,也可以根据电子得失守恒进行计算。
X
A
B
C
D
E
F
G
+HCl
△
+NaOH
Na2O2
+D
催化剂
+Cu
+Cu
+B
金属A
(焰色为黄色)
气体甲
气体丙
物质E
物质D
物质G
物质F
红褐色沉淀H
④
黄绿色气体乙
黄绿色气体乙
金属B
①
金属C
②
⑤
③
⑥
水
H2O
NH4Cl和
Ca(OH)2
一、选择题
1.近年来,光化学烟雾污染问题已引起人们的注意,下列哪种气体是造成光化学烟雾的最主要因素( )。
A.NO2 B.SO2 C.CO D.CH4
2.将少量的CO2通入下列溶液中,不能产生沉淀的是( )。
A.硅酸钠溶液 B.石灰水 C.氢氧化钡溶液 D.氯化钙溶液
3.下列金属中,一定条件下既能跟Cl2反应,又能跟稀盐酸反应,且均生成MCl2型化合物的是( )。
A.Al B.Fe C.Cu D.Mg
4.新制氯水与久置的氯水相比较,下列结论不正确的是( )。
A.颜色相同 B.前者能使有色布条褪色
C.都含有H+ D.加AgNO3溶液都能生成白色沉淀
5.“84”消毒液在日常生活中被广泛应用。该消毒液无色,pH大于7,对某些有色物质有漂白作用。你认为它可能的有效成分是( )。
A.SO2 B.Na2CO3 C.KMnO4 D.NaClO
6.检验铵盐的一般方法是将待测物取少许置于试管中,然后( )。
A.加水溶解后,再滴入酚酞溶液
B.加强碱溶液加热后,用湿润红色石蕊试纸在试管口检验
C.加入强酸溶液加热后,再滴入酚酞溶液
D.加入强碱溶液加热后,再滴入酚酞溶液
7.自来水可用氯气消毒,某学生用这种自来水去配制下列物质溶液,会产生明显的药品变质问题的是( )。
A.NaNO3 B.FeCl2 C.Na2SO4 D.AlCl3
8.某冶炼厂利用炼铜产生的SO2生产硫酸,变废为宝,化害为利。其原理是( )。
A.利用了SO2的水溶性,将SO2直接通入水中
B.利用了SO2的氧化性,将SO2直接通入水中
C.利用了SO2的氧化性,使其与O2反应而转化为SO3,再与水反应
D.利用了SO2的还原性,使其与O2反应而转化为SO3,再与水反应
9.有NaCl、FeCl2、FeCl3、 ( http: / / www.21cnjy.com )MgCl2、AlCl3、NH4Cl六种溶液,只用一种试剂就可把它们鉴别开来,这种试剂是( )。
A.盐酸 B.烧碱溶液 C.氨水 D.KSCN溶液
10.现有H2SO4、Ba(OH)2、Na ( http: / / www.21cnjy.com )2CO3和氯水四种溶液,有如图所示的相互关系,右下图中每条线段两端的物质可以发生化学反应。下列推断合理的是( )。
A.M一定是Ba(OH)2
B.Y可能是氯水
C.X一定是Na2CO3溶液
D.Z可能是H2SO4
11.下列关于SO2的叙述,正确的是( )。
A.SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物
B.SO2是硫酸的酸酐
C.SO2是无色、无味、有毒的气体
D.SO2具有漂白性,因而可以用于食品增白
12.有关硫酸的下列化学反应中,不是表现硫酸氧化性的是( )。
A.浓硫酸与铝的反应 B.浓硫酸与木炭的反应
C.稀硫酸与锌的反应 D.稀硫酸与纯碱的反应
13.下列根据实验现象作出的推断,正确的是( )。
A.溶于水后能形成无色溶液的红棕色气体一定是 NO
B.能使湿润的淀粉碘化钾试纸变蓝的气体一定是Cl2
C.遇空气立即形成红棕色气体的一定是 NO
D.在潮湿的空气中形成白雾的气体一定是 HCl
14.为了除去镀在铝制品表面的铜镀层,可选用的试剂是( )。
A.稀硝酸 B.浓硝酸 C.浓硫酸 D.浓盐酸
15.随着人们生活节奏的加快,方便的小包装 ( http: / / www.21cnjy.com )食品已被广泛接受。为了防止食品受潮及氧化变质,在包装内放置的起保护作用的小纸袋中应放入的化学物质是( )。
A.无水硫酸铜、蔗糖 B.硅胶、硫酸亚铁
C.食盐、硫酸亚铁 D.生石灰、食盐
16.如图所示,小试管内盛 ( http: / / www.21cnjy.com )有约3 mL饱和硫酸铜溶液,与锥形瓶连通的U型细管内盛有少量水(为便于观察,预先染成红色),沿小试管的内壁小心地慢慢注入约3 mL浓硫酸,静置片刻,不可能观察到的现象是( )。
A.小试管内液体分成两层,上层蓝色,下层无色
B.U型细管内左边液面下降,右边液面升高
C.小试管内有少量白色固体析出
D.小试管内液体不分层,但有蓝色晶体析出
二、填空题
17.2002年9月26日,中国北京曙光公司研制出了第—款具有我国完全自主知识产权的高性能CPU芯片——“龙芯”1号。
(1)“龙芯”(芯片)关键材料的主要化学成分是 (填化学式,下同)。
(2)计算机长距离联网传输很快的线路中使用的材料叫 ,其主要化学成分是 。
(3)上述这种埋在地下的材料如果裸露在 ( http: / / www.21cnjy.com )碱性土壤中,结果会断路,用离子方程式说明原因 。
*18.某些防治碘缺乏病的碘添加剂 ( http: / / www.21cnjy.com )是KIO3(如加碘盐),可用盐酸酸化的淀粉碘化钾混合液检验食盐是否加碘,其反应的离子方程式为: 。
*19.下图中每一方框中表示一种反 ( http: / / www.21cnjy.com )应物或生成物,其中A、C、D、E在通常情况下均为气体,B为液体,(图中有些反应的产物和反应条件没有标出)。试回答:
(1)X是 ,C是 ,F是 。
(2)写出A→D反应的化学方程式 。
(3)写出G→E反应的化学方程式 。
20.现有金属单质A、B、C和气体甲、乙、丙 ( http: / / www.21cnjy.com )以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
请回答下列问题:
(1)写出下列物质的化学式:B 、丙 、乙 。
(2)写出下列反应的化学方程式:
反应① ;
反应⑤ ;
反应⑥ 。
三、实验题
21.据媒体报道:社会上曾有不法分子,以黄铜(铜、锌合金)假冒黄金进行诈骗活动。请你设计实验,鉴别黄铜和黄金。
。
22.在新制的氯水参加的反应中,有如下几种情况:
(1)向FeCl2和KSCN的混合溶液 ( http: / / www.21cnjy.com )中加入氯水,现象是 ,氯水中起作用的主要微粒是 ,反应的离子方程式是 。
(2)向AgNO3溶液中加入氯水, ( http: / / www.21cnjy.com )现象是 ,氯水中起作用的主要微粒是 ,反应的离子方程式是 。
(3)向氯水中滴加石蕊溶液,溶液变红,起 ( http: / / www.21cnjy.com )作用的微粒是 ,然后又褪色,起作用的微粒是 。
23.有一瓶溶液,其中可能含有H+、、K+、Na+、Mg2+、Ba2+、Fe3+、、、Cl-和I-。取该溶液进行了以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入数滴氯水及2 mL CCl4,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入NaOH 溶液使其变为碱性,无沉淀生成;
(4)取部分上述碱性溶液,加Na2CO3溶液,有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝;
根据上述实验事实,可知原溶液中肯定含有的离子是 ;肯定没有的离子是 ;还不能确定是否含有的离子是 。
24.实验室通常用如右图所示的装置来制取氨气。回答下列问题:
(1)制取氨气时反应的化学方程式为:
。
(2)收集氨气时必须使用干燥的集气装置的原因是 。
(3)下列操作不能用于检验NH3的是( )
A.气体使湿润的酚酞试纸变红 B.气体能使湿润的红色石蕊试纸变蓝
C.气体与蘸有浓H2SO4的玻璃棒靠近 D.气体与蘸有浓盐酸的玻璃棒靠近
(4)除氨气外,还可以用该装置制取的常见气体是 。
四、计算题
25.将32.64 g Cu与140 mL一定浓度的HNO3反应,Cu完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。
(1)NO的体积为多少?
(2)NO2的体积为多少?
参考答案
一、选择题
1.A
解析:考查空气污染的常识。
2.D
解析:CO2通入硅酸钠溶液会产生硅酸 ( http: / / www.21cnjy.com )沉淀;CO2通入石灰水会产生碳酸钙沉淀;CO2通入氢氧化钡溶液会产生碳酸钡沉淀;CO2不能与氯化钙反应,因为弱酸不能制强酸。
3.D
解析:Al不论是与氯气反应还是与稀盐酸 ( http: / / www.21cnjy.com )反应均生成AlCl3,Fe跟C12反应生成FeCl3,Fe跟稀盐酸反应生成FeCl2;Cu不与稀盐酸反应。
4.A
解析:新制的氯水中有氯气、次氯酸和盐酸;久置的氯水主要含有盐酸。
5.D
解析:考查NaClO的应用。
6.B
解析:考查铵盐的检验方法。
7.B
解析:FeCl2有还原性,会被氯水氧化。
8.D
解析:考查SO2的性质,及硫酸工业的原理。
9.B
解析:现象分别为:无明显现象、产生白色沉淀很快变成灰绿色、产生红褐色沉淀、产生白色沉淀、先产生白色沉淀后消失、产生刺激性气味气体。
10.D
解析:根据两两反应进行判断,H2SO4和氯水分别可以与2种物质反应,而Ba(OH)2、Na2CO3分别可以与3种物质反应。
11.A
解析:SO2是亚硫酸的酸酐;SO2是有刺激性气味的气体;SO2有漂白性,但不能用来加工食品。
12.D
解析:稀硫酸与纯碱反应时,元素化合价没有改变,所以不体现氧化性。
13.C
解析:NO2是红棕色气体,溶于 ( http: / / www.21cnjy.com )水后与水反应得到无色溶液。使湿润的淀粉碘化钾试纸变蓝的气体可以是 Cl2、Br2、NO2 等。NO与 O2 反应生成红棕色气体 NO2。在潮湿的空气中形成白雾的有 HF、HCl、HBr 等。
14.B
解析:浓硝酸能与铜反应,但不会与铝反应,因为钝化。
15.B
解析:硅胶能吸水,硫酸亚铁能吸收氧气。
16.D
解析:浓硫酸会吸收硫酸铜晶体中的结晶水,所以不可能析出蓝色晶体。
二、填空题
17.(1)Si (2)光导纤维 SiO2 (3)SiO2+2OH-=SiO+H2O
解析:考查硅、二氧化硅的性质及用途。
*18.5I-+IO+6H+=3I2+3H2O
解析:考查氧化还原反应方程式的书写。
*19.(1)NH4HCO3 NH3 NO2 (2)2CO2+2Na2O2=2Na2CO3+O2
(3)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
解析:破题点是NH4HCO3既能与酸反 ( http: / / www.21cnjy.com )应,又能与碱反应,且受热生成三种气体;能与Na2O2反应的一般是水或二氧化碳;浓、稀硝酸均能与铜反应,但还原产物不同。
20.(1) Al HCl Cl2
(2)①2Na+2H2O=2NaOH+H2↑
⑤2FeCl2+Cl2=2FeCl3
⑥3NaOH+FeCl3=Fe(OH)3↓+3NaCl
解析:金属A为Na,黄绿色气体乙为Cl2,红褐色沉淀H为Fe(OH)3,由此往前顺推即可。
三、实验题
21.分别取样放入稀硝酸(或盐酸)中,能溶解的是黄铜,无反应的是黄金。
解析:考查不同金属与酸反应的情况。金不溶于稀硝酸(或盐酸),而锌、铜能溶入硝酸(答案合理即可)。
22.(1)溶液变红 Cl2 2Fe2++Cl2=2Fe3++2Cl-
(2)产生白色沉淀 Cl- Ag++Cl-=AgCl↓
(3)H+ HClO
解析:考查氯水的成分及其性质。
23.H+、Ba2+、I-、NH CO、SO、Mg2+、Fe3+ K+、Na+、Cl-
解析: CO不能与 H+共存,SO不能与Ba2+共存,Mg2+、Fe3+在碱性条件下会产生白色沉淀,所以它们肯定不存在。
24.(1)2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑
(2)氨气极易溶于水
(3)C
(4)氧气
解析:考查氨气的实验室制备。
四、计算题
25.方法一:
解:由题意可知HNO3被还原的产物既有NO又有NO2,设生成NO n1 mol,它得到的电子就是3n1 mol,设生成NO2 n2 mol,这也是它得到电子的物质的量。由电子得失守恒得到:
n1+n2=
3n1+n2=×2
解得 n1=0.26,n2=0.24
标况下生成NO的体积是:0.26 mol×22.4 L/mol=5.8 L
标况下生成NO2的体积是:0. 24 mol×22.4 L/mol=5.4 L
方法二:
解:4HNO3(浓)+Cu=Cu(NO3)2+2NO2↑+2H2O
1 mol 2 mol
n1 2n1
8HNO3(稀)+3Cu=3Cu(NO3)2+2NO↑+4H2O
3 mol 2 mol
n2 n2
2n1+n2= mol
n1+n2= mol
解得 n1=0.12 mol,n2=0.39 mol;n(NO2)=2n1=0.24 mol,n(NO)=n2=0.26 mol标况下生成NO的体积是:0.26 mol×22.4 L/mol=5.8 L
标况下生成NO2的体积是:0.24 mol×22.4 L/mol=5.4 L
解析:涉及氧化还原反应的混合物计算可以根据化学方程式列方程组,也可以根据电子得失守恒进行计算。
X
A
B
C
D
E
F
G
+HCl
△
+NaOH
Na2O2
+D
催化剂
+Cu
+Cu
+B
金属A
(焰色为黄色)
气体甲
气体丙
物质E
物质D
物质G
物质F
红褐色沉淀H
④
黄绿色气体乙
黄绿色气体乙
金属B
①
金属C
②
⑤
③
⑥
水
H2O
NH4Cl和
Ca(OH)2
