甘肃省白银市2023-2024学年高二下学期5月期中考试 化学(含答案)
文档属性
| 名称 | 甘肃省白银市2023-2024学年高二下学期5月期中考试 化学(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-22 16:24:16 | ||
图片预览



文档简介
高二阶段性检测
化学
本试卷满分100分,考试用时75分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.本试卷主要考试内容:人教版选择性必修1、选择性必修2。
5.可能用到的相对原子质量:H1 C12 N14 O16 Na23 Al27 P31 S32 Cl35.5
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生产、生活密切相关,下列叙述正确的是
A.可溶性的铝盐和铁盐均可用作自来水的消毒剂
B.融雪剂中使用氯化钠是因为氯化钠溶于水是一个放热反应
C.食品放入冰箱能延长其保质期,是因为低温下化学反应速率会变慢
D.喝补铁剂时,加服维生素C效果更好,是因为维生素C能促进铁离子的水解
2.非极性分子是指正负电荷中心重叠的分子,下列物质中是由极性键构成的非极性分子的是
A.CCl4 B.HF C.H2S D.PCl3
3.下列化学用语表述正确的是
A.水分子的空间结构模型:
B.Cl2分子中形成的σ键电子云轮廓图:
C.某基态原子的价层电子轨道表示式:
D.基态S原子的结构示意图:
4.下列物质(括号内为杂质)的除杂方法运用到水解原理的是
A.溶液——通入
B.溶液——用MgO调节溶液pH
C.——加入稀硫酸
D.——通过灼热的CuO
5.下列性质与氢键无关的是
A.易溶于水
B.对羟基苯甲醛的沸点高于邻羟基苯甲醛
C.冰的密度小于水
D.、、的酸性依次增强
6.下列物质熔点大小的比较正确的是
A. B.金刚石 C. D.
7.已知X、Y、Z、W、M五种元素的结构信息如下:
①基态X原子的价层电子排布式为 ②基态Y原子的价层电子轨道表示式为 ③的结构示意图为 ④中子数为16的W原子:⑤基态M原子核外有12种运动状态的电子
下列说法正确的是
A.X与Y能形成型的离子化合物
B.中含有共价键和离子键
C.分子中的原子均满足8电子稳定结构
D.最简单氢化物的稳定性:X>Z
8.分子光开关作为一种新兴领域吸引了广泛的关注。一个重要的分子光开关系统为四环烷(QC)和莽戊烯(NBD)两种异构体在紫外光范围内的光吸收下相互转化,如图所示。下列说法正确的是
A.QC与NBD均为极性分子
B.QC与NBD互为同素异形体
C.QC与NBD中的手性碳原子数之比为3:1
D.QC转化为NBD的过程中,碳原子的杂化类型由转化为
9.设为阿伏加德罗常数的值,下列说法正确的是
A.中含有的配位键数为
B.2.7 g基态Al原子中含有的p电子数为
C.标准状况下,中含有的孤电子对总数为
D.溶液中含有的数为
10.下列实验装置或操作能达到实验目的的是
A.测定中和反应反应热 B.探究温度对溶解度的影响
C.测定氯水的pH D.外加电流法保护钢阀门
11.X、Y、Z、W是原子序数依次增大的短周期元素,基态X原子电子只有一种自旋状态,Y和W位于同周期且未成对电子数相同,基态Z原子的s电子数与p电子数之比为4:3。由X、Y、Z、W、Pt组成的一种化合物M的结构如图所示,下列说法错误的是
A.电负性:W>Z>Y
B.M中存在极性键和非极性键
C.键长:X—W>X—Z>X—Y
D.X、Y、Z、W四种元素可组成含有极性键的离子晶体
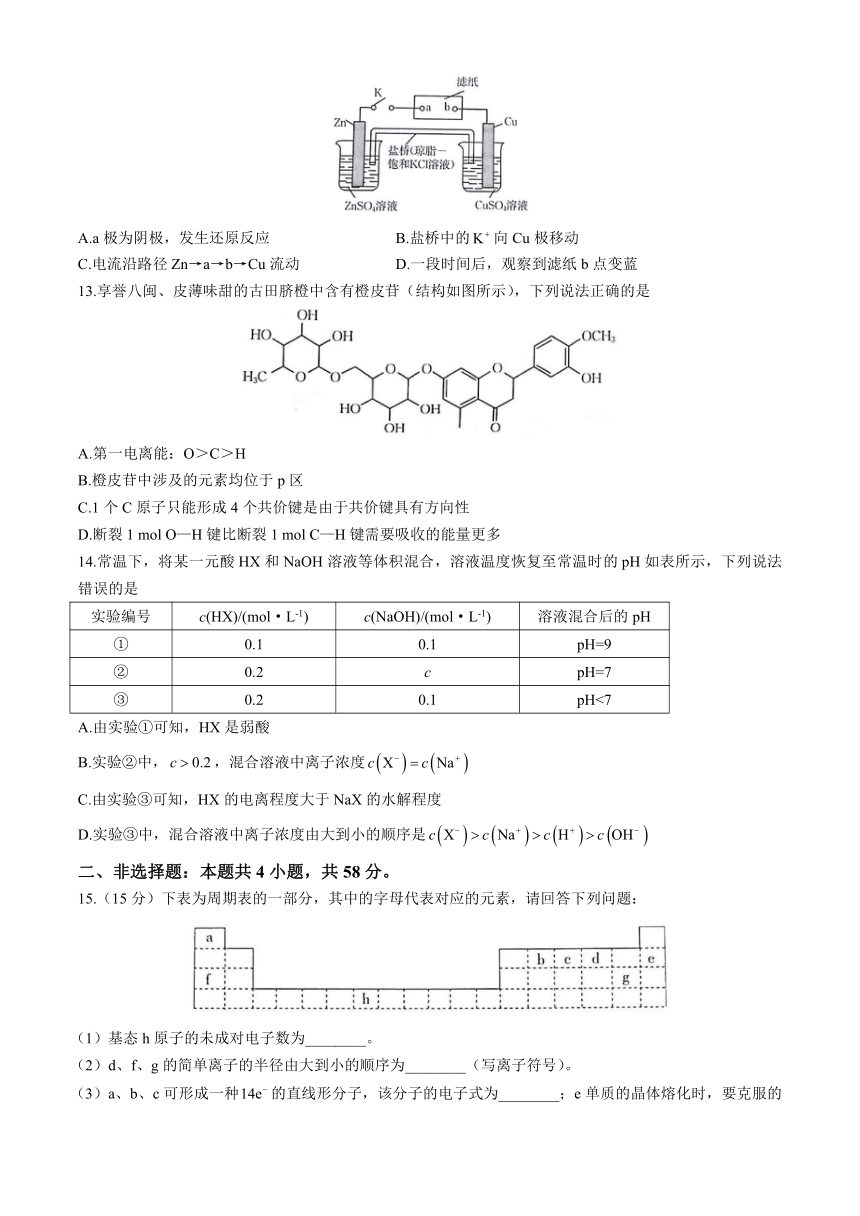
12.一种电化学装置如图所示,滤纸经过饱和NaCl溶液(滴加了淀粉—KI溶液)浸湿,将实验装置的K闭合后,下列说法错误的是
A.a极为阴极,发生还原反应 B.盐桥中的向Cu极移动
C.电流沿路径Zn→a→b→Cu流动 D.一段时间后,观察到滤纸b点变蓝
13.享誉八闽、皮薄味甜的古田脐橙中含有橙皮苷(结构如图所示),下列说法正确的是
A.第一电离能:O>C>H
B.橙皮苷中涉及的元素均位于p区
C.1个C原子只能形成4个共价键是由于共价键具有方向性
D.断裂1 mol O—H键比断裂1 mol C—H键需要吸收的能量更多
14.常温下,将某一元酸HX和NaOH溶液等体积混合,溶液温度恢复至常温时的pH如表所示,下列说法错误的是
实验编号 c(HX)/(mol·L-1) c(NaOH)/(mol·L-1) 溶液混合后的pH
① 0.1 0.1 pH=9
② 0.2 c pH=7
③ 0.2 0.1 pH<7
A.由实验①可知,HX是弱酸
B.实验②中,,混合溶液中离子浓度
C.由实验③可知,HX的电离程度大于NaX的水解程度
D.实验③中,混合溶液中离子浓度由大到小的顺序是
二、非选择题:本题共4小题,共58分。
15.(15分)下表为周期表的一部分,其中的字母代表对应的元素,请回答下列问题:
(1)基态h原子的未成对电子数为________。
(2)d、f、g的简单离子的半径由大到小的顺序为________(写离子符号)。
(3)a、b、c可形成一种的直线形分子,该分子的电子式为________;e单质的晶体熔化时,要克服的作用力为________(填标号)。
A.氢键 B.非极性共价键 C.范德华力
(4)a、d、g三种元素可形成多种化合物,agd中中心原子的杂化类型为________,的空间结构为________,的键角为________。
(5)晶体中,每个分子周围紧邻的分子有12个;晶体中,每个分子周围紧邻的分子有4个,原因是________。
16.(14分)科研工作者设计并合成了一种具有均匀分布的镍-双(二硫烯)和富氮三嗪中心的金属配位3D共价有机骨架(COF)(如图所示),它可以作为双功能锂硫电池中正极和锂负极的主体。丰富的Ni中心和N位可以极大地增强多硫化物的吸附和转化,镍-双(二硫烯)中心的存在使得锂在负极上均匀成核,从而抑制锂枝晶的生长。请回答下列问题:
(1)基态Ni原子的价层电子排布式为________,是Ni的一种配合物,的配位数为________,提供孤电子对的原子是________(写元素符号)。
(2)镍-双(二硫烯)中,H、S、Ni三种元素的电负性由大到小的顺序为________(写元素符号),含有的σ键与π键数目之比为________。
(3)中N的杂化类型为________,属于________晶体。
(4)锂硫电池放电时发生的总反应为,下列说法正确的是________(填标号),的电子式为________。
A.金属锂能导电是因为它含有可自由移动的
B.根据元素周期表的对角线关系可知,常温下易溶于水
C.中含有的非极性共价键数为0.5 mol
D.总反应中涉及的三种物质的晶体类型均不同
17.(15分)是一种良好的离子导体,具有反钙钛矿晶体结构。请回答下列问题:
(1)基态Ca原子的核外电子占据最高能级的电子云轮廓图形状为________。
(2)由O、Cl元素可组成不同的单质和化合物,其中可由盐酸与反应得到。
①中O原子的杂化方式为________。
②的空间结构为________,常温下,其在四氯化碳中的溶解度________(填“大于”或“小于”)在水中的溶解度。
(3)可由以下两种方法制得:
方法Ⅰ:
方法Ⅱ:
在方法Ⅱ的反应过程中,断裂的化学键有________(填标号)。
A.金属键 B.离子键 C.配位键 D.极性键
E.非极性键
(4)的晶胞结构如图所示。已知:晶胞边长为,为阿伏加德罗常数的值。
①若Cl原子位于晶胞的顶点位置,则Na原子位于________位置,与O原子距离相等且最近的Na原子数为________
②已知1号原子、2号原子的分数坐标依次为、,则3号原子的分数坐标为________。
③该晶体的密度为________(用含有a、的式子表示)。
18.(14分)甲醚可用作气雾剂的抛射剂,也可作为制冷剂、局部麻醉药和燃料。
Ⅰ.工业上利用水煤气合成甲醚:
已知:
化学键 C—H C—O H—H
键能/ 413 351 436 803 1071
(1)水煤气合成甲醚发生反应的热化学方程式:________,该反应在________(填“高温”“低温”或“任意条件”)下可自发进行。
(2)一定温度下,在2 L恒容密闭容器中投入和发生上述反应,当容器内压强不再发生变化时,下列说法正确的是________(填标号)。
A.该反应达到最大限度
B.的百分含量不再发生变化
C.、CO全部转化为和
D.CO、、的浓度一定相等
Ⅱ.利用催化加氢合成甲醚,主要发生的反应如下:
反应①:;
反应②:。
恒定压强为时,若开始投入的、分别为、,平衡转化率和平衡时的选择性随温度的变化如图。已知:的选择性。
(3)240℃时,若不改变反应温度,能提高平衡产率的措施有________________(任写一条)。
(4)由图可知,升高温度,的选择性减小,推断出________(填“>”或“<”)0。
(5)300℃时,若10 min时反应达到平衡状态,此时________mol,反应②的压强平衡常数________。
(6)比较不同温度下反应①的平衡常数:K(200℃)________(填“>”或“<”)K(300℃)。
高二阶段性检测
化学参考答案
1.C 2.A 3.В 4.B 5.D 6.A 7.D 8.A 9.A 10.B 11.C 12.C 13.D 14.B
15.(1)5(2分)
(2)(2分)
(3)(2分);C(2分)
(4)(1分);三角锥形(2分);(2分)
(5)冰中的水分子间存在氢键,氢键具有方向性(2分)
16.(1)(2分);6(1分);N(1分)
(2)(2分);(2分)
(3)(1分);分子(1分)
(4)CD(2分);(2分)
17.(1)球形(2分)
(2)①(1分)
②V形(1分);大于(2分)
(3)ABD(2分)
(4)①面心(1分);6(2分)
②(2分)
③(2分)
18.(1)(2分);低温(1分)
(2)AB(2分)
(3)压缩容器体积(或其他合理答案,2分)
(4)<(1分)
(5)(2分);或0.15(2分)
(6)>(2分)
化学
本试卷满分100分,考试用时75分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.本试卷主要考试内容:人教版选择性必修1、选择性必修2。
5.可能用到的相对原子质量:H1 C12 N14 O16 Na23 Al27 P31 S32 Cl35.5
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生产、生活密切相关,下列叙述正确的是
A.可溶性的铝盐和铁盐均可用作自来水的消毒剂
B.融雪剂中使用氯化钠是因为氯化钠溶于水是一个放热反应
C.食品放入冰箱能延长其保质期,是因为低温下化学反应速率会变慢
D.喝补铁剂时,加服维生素C效果更好,是因为维生素C能促进铁离子的水解
2.非极性分子是指正负电荷中心重叠的分子,下列物质中是由极性键构成的非极性分子的是
A.CCl4 B.HF C.H2S D.PCl3
3.下列化学用语表述正确的是
A.水分子的空间结构模型:
B.Cl2分子中形成的σ键电子云轮廓图:
C.某基态原子的价层电子轨道表示式:
D.基态S原子的结构示意图:
4.下列物质(括号内为杂质)的除杂方法运用到水解原理的是
A.溶液——通入
B.溶液——用MgO调节溶液pH
C.——加入稀硫酸
D.——通过灼热的CuO
5.下列性质与氢键无关的是
A.易溶于水
B.对羟基苯甲醛的沸点高于邻羟基苯甲醛
C.冰的密度小于水
D.、、的酸性依次增强
6.下列物质熔点大小的比较正确的是
A. B.金刚石 C. D.
7.已知X、Y、Z、W、M五种元素的结构信息如下:
①基态X原子的价层电子排布式为 ②基态Y原子的价层电子轨道表示式为 ③的结构示意图为 ④中子数为16的W原子:⑤基态M原子核外有12种运动状态的电子
下列说法正确的是
A.X与Y能形成型的离子化合物
B.中含有共价键和离子键
C.分子中的原子均满足8电子稳定结构
D.最简单氢化物的稳定性:X>Z
8.分子光开关作为一种新兴领域吸引了广泛的关注。一个重要的分子光开关系统为四环烷(QC)和莽戊烯(NBD)两种异构体在紫外光范围内的光吸收下相互转化,如图所示。下列说法正确的是
A.QC与NBD均为极性分子
B.QC与NBD互为同素异形体
C.QC与NBD中的手性碳原子数之比为3:1
D.QC转化为NBD的过程中,碳原子的杂化类型由转化为
9.设为阿伏加德罗常数的值,下列说法正确的是
A.中含有的配位键数为
B.2.7 g基态Al原子中含有的p电子数为
C.标准状况下,中含有的孤电子对总数为
D.溶液中含有的数为
10.下列实验装置或操作能达到实验目的的是
A.测定中和反应反应热 B.探究温度对溶解度的影响
C.测定氯水的pH D.外加电流法保护钢阀门
11.X、Y、Z、W是原子序数依次增大的短周期元素,基态X原子电子只有一种自旋状态,Y和W位于同周期且未成对电子数相同,基态Z原子的s电子数与p电子数之比为4:3。由X、Y、Z、W、Pt组成的一种化合物M的结构如图所示,下列说法错误的是
A.电负性:W>Z>Y
B.M中存在极性键和非极性键
C.键长:X—W>X—Z>X—Y
D.X、Y、Z、W四种元素可组成含有极性键的离子晶体
12.一种电化学装置如图所示,滤纸经过饱和NaCl溶液(滴加了淀粉—KI溶液)浸湿,将实验装置的K闭合后,下列说法错误的是
A.a极为阴极,发生还原反应 B.盐桥中的向Cu极移动
C.电流沿路径Zn→a→b→Cu流动 D.一段时间后,观察到滤纸b点变蓝
13.享誉八闽、皮薄味甜的古田脐橙中含有橙皮苷(结构如图所示),下列说法正确的是
A.第一电离能:O>C>H
B.橙皮苷中涉及的元素均位于p区
C.1个C原子只能形成4个共价键是由于共价键具有方向性
D.断裂1 mol O—H键比断裂1 mol C—H键需要吸收的能量更多
14.常温下,将某一元酸HX和NaOH溶液等体积混合,溶液温度恢复至常温时的pH如表所示,下列说法错误的是
实验编号 c(HX)/(mol·L-1) c(NaOH)/(mol·L-1) 溶液混合后的pH
① 0.1 0.1 pH=9
② 0.2 c pH=7
③ 0.2 0.1 pH<7
A.由实验①可知,HX是弱酸
B.实验②中,,混合溶液中离子浓度
C.由实验③可知,HX的电离程度大于NaX的水解程度
D.实验③中,混合溶液中离子浓度由大到小的顺序是
二、非选择题:本题共4小题,共58分。
15.(15分)下表为周期表的一部分,其中的字母代表对应的元素,请回答下列问题:
(1)基态h原子的未成对电子数为________。
(2)d、f、g的简单离子的半径由大到小的顺序为________(写离子符号)。
(3)a、b、c可形成一种的直线形分子,该分子的电子式为________;e单质的晶体熔化时,要克服的作用力为________(填标号)。
A.氢键 B.非极性共价键 C.范德华力
(4)a、d、g三种元素可形成多种化合物,agd中中心原子的杂化类型为________,的空间结构为________,的键角为________。
(5)晶体中,每个分子周围紧邻的分子有12个;晶体中,每个分子周围紧邻的分子有4个,原因是________。
16.(14分)科研工作者设计并合成了一种具有均匀分布的镍-双(二硫烯)和富氮三嗪中心的金属配位3D共价有机骨架(COF)(如图所示),它可以作为双功能锂硫电池中正极和锂负极的主体。丰富的Ni中心和N位可以极大地增强多硫化物的吸附和转化,镍-双(二硫烯)中心的存在使得锂在负极上均匀成核,从而抑制锂枝晶的生长。请回答下列问题:
(1)基态Ni原子的价层电子排布式为________,是Ni的一种配合物,的配位数为________,提供孤电子对的原子是________(写元素符号)。
(2)镍-双(二硫烯)中,H、S、Ni三种元素的电负性由大到小的顺序为________(写元素符号),含有的σ键与π键数目之比为________。
(3)中N的杂化类型为________,属于________晶体。
(4)锂硫电池放电时发生的总反应为,下列说法正确的是________(填标号),的电子式为________。
A.金属锂能导电是因为它含有可自由移动的
B.根据元素周期表的对角线关系可知,常温下易溶于水
C.中含有的非极性共价键数为0.5 mol
D.总反应中涉及的三种物质的晶体类型均不同
17.(15分)是一种良好的离子导体,具有反钙钛矿晶体结构。请回答下列问题:
(1)基态Ca原子的核外电子占据最高能级的电子云轮廓图形状为________。
(2)由O、Cl元素可组成不同的单质和化合物,其中可由盐酸与反应得到。
①中O原子的杂化方式为________。
②的空间结构为________,常温下,其在四氯化碳中的溶解度________(填“大于”或“小于”)在水中的溶解度。
(3)可由以下两种方法制得:
方法Ⅰ:
方法Ⅱ:
在方法Ⅱ的反应过程中,断裂的化学键有________(填标号)。
A.金属键 B.离子键 C.配位键 D.极性键
E.非极性键
(4)的晶胞结构如图所示。已知:晶胞边长为,为阿伏加德罗常数的值。
①若Cl原子位于晶胞的顶点位置,则Na原子位于________位置,与O原子距离相等且最近的Na原子数为________
②已知1号原子、2号原子的分数坐标依次为、,则3号原子的分数坐标为________。
③该晶体的密度为________(用含有a、的式子表示)。
18.(14分)甲醚可用作气雾剂的抛射剂,也可作为制冷剂、局部麻醉药和燃料。
Ⅰ.工业上利用水煤气合成甲醚:
已知:
化学键 C—H C—O H—H
键能/ 413 351 436 803 1071
(1)水煤气合成甲醚发生反应的热化学方程式:________,该反应在________(填“高温”“低温”或“任意条件”)下可自发进行。
(2)一定温度下,在2 L恒容密闭容器中投入和发生上述反应,当容器内压强不再发生变化时,下列说法正确的是________(填标号)。
A.该反应达到最大限度
B.的百分含量不再发生变化
C.、CO全部转化为和
D.CO、、的浓度一定相等
Ⅱ.利用催化加氢合成甲醚,主要发生的反应如下:
反应①:;
反应②:。
恒定压强为时,若开始投入的、分别为、,平衡转化率和平衡时的选择性随温度的变化如图。已知:的选择性。
(3)240℃时,若不改变反应温度,能提高平衡产率的措施有________________(任写一条)。
(4)由图可知,升高温度,的选择性减小,推断出________(填“>”或“<”)0。
(5)300℃时,若10 min时反应达到平衡状态,此时________mol,反应②的压强平衡常数________。
(6)比较不同温度下反应①的平衡常数:K(200℃)________(填“>”或“<”)K(300℃)。
高二阶段性检测
化学参考答案
1.C 2.A 3.В 4.B 5.D 6.A 7.D 8.A 9.A 10.B 11.C 12.C 13.D 14.B
15.(1)5(2分)
(2)(2分)
(3)(2分);C(2分)
(4)(1分);三角锥形(2分);(2分)
(5)冰中的水分子间存在氢键,氢键具有方向性(2分)
16.(1)(2分);6(1分);N(1分)
(2)(2分);(2分)
(3)(1分);分子(1分)
(4)CD(2分);(2分)
17.(1)球形(2分)
(2)①(1分)
②V形(1分);大于(2分)
(3)ABD(2分)
(4)①面心(1分);6(2分)
②(2分)
③(2分)
18.(1)(2分);低温(1分)
(2)AB(2分)
(3)压缩容器体积(或其他合理答案,2分)
(4)<(1分)
(5)(2分);或0.15(2分)
(6)>(2分)
同课章节目录
