2025广东版新教材化学高考第一轮基础练习--专题八 化学键 分子和晶体的结构与性质(含答案)
文档属性
| 名称 | 2025广东版新教材化学高考第一轮基础练习--专题八 化学键 分子和晶体的结构与性质(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-26 15:30:06 | ||
图片预览


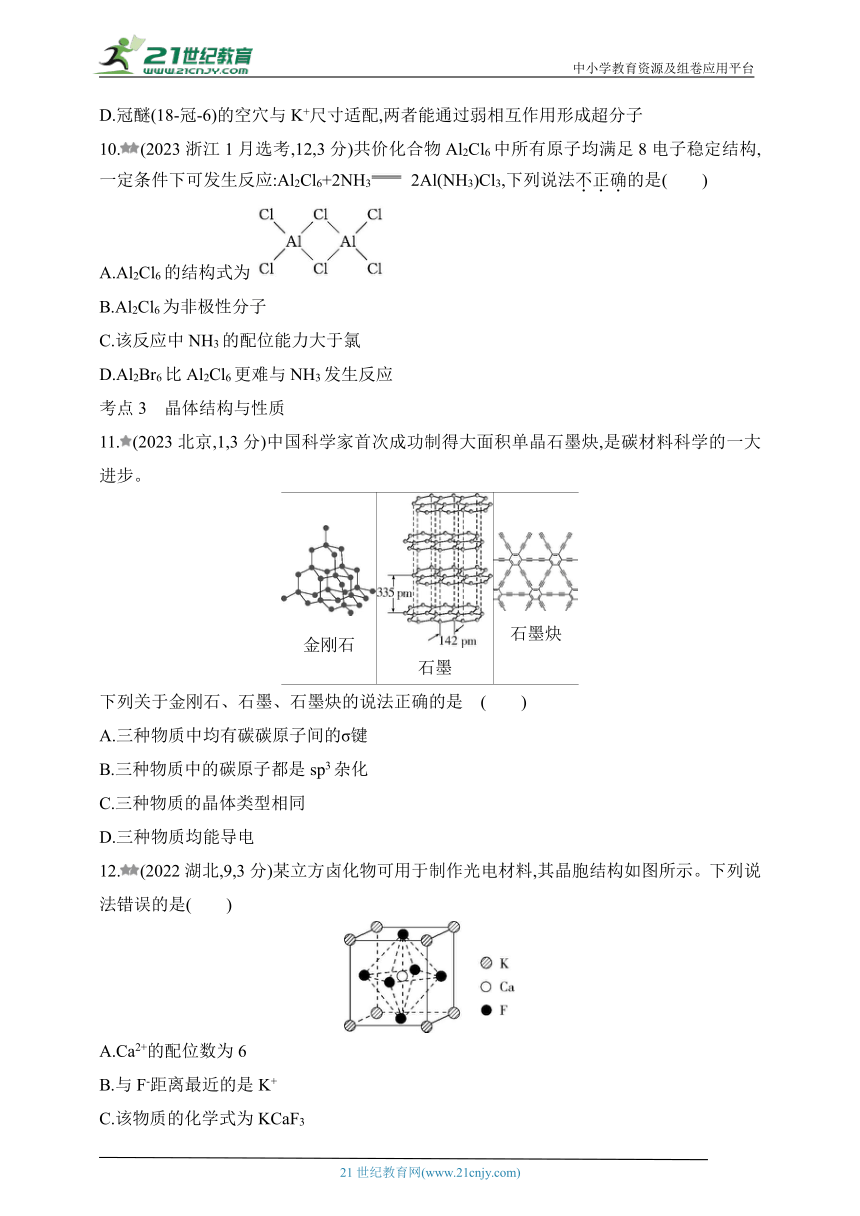


文档简介
中小学教育资源及组卷应用平台
2025广东版新教材化学高考第一轮
专题八 化学键 分子和晶体的结构与性质
五年高考
考点过关练
考点1 化学键
1.(2022湖南,2,3分)下列说法错误的是( )
A.氢键、离子键和共价键都属于化学键
B.化学家门捷列夫编制了第一张元素周期表
C.药剂师和营养师必须具备化学相关专业知识
D.石灰石是制造玻璃和水泥的主要原料之一
2.(2023浙江6月选考,2,3分)下列化学用语表示正确的是( )
A.H2S分子的球棍模型:
B.AlCl3的价层电子对互斥模型:
C.KI的电子式:K····
D.CH3CH(CH2CH3)2的名称:3-甲基戊烷
3.(2023辽宁,2,3分)下列化学用语或表述正确的是( )
A.BeCl2的空间结构:V形
B.P4中的共价键类型:非极性键
C.基态Ni原子价电子排布式:3d10
D.顺-2-丁烯的结构简式:
4.(2023江苏,2,3分)反应NH4Cl+NaNO2 NaCl+N2↑+2H2O应用于石油开采。下列说法正确的是( )
A.N的电子式为H····H
B.N中N元素的化合价为+5
C.N2分子中存在键
D.H2O为非极性分子
5.(2022重庆,2,3分)BCl3水解反应方程式为BCl3+3H2O B(OH)3+3HCl,下列说法错误的是( )
A.Cl的原子结构示意图为
B.H2O的空间填充模型为
C.BCl3的电子式为····
D.B(OH)3的结构简式为
考点2 分子结构与性质
6.(2023江苏,5,3分)下列说法正确的是( )
A. H都属于氢元素
B.N和H2O的中心原子轨道杂化类型均为sp2
C.H2O2分子中的化学键均为极性共价键
D.CaH2晶体中存在Ca与H2之间的强烈相互作用
7.(2023江苏,7,3分)下列物质结构与性质或物质性质与用途具有对应关系的是( )
A.H2具有还原性,可作为氢氧燃料电池的燃料
B.氨极易溶于水,液氨可用作制冷剂
C.H2O分子之间形成氢键,H2O(g)的热稳定性比H2S(g)的高
D.N2H4中的N原子与H+形成配位键,N2H4具有还原性
8.(2022江苏,2,3分)少量Na2O2与H2O反应生成H2O2和NaOH。下列说法正确的是( )
A.Na2O2的电子式为Na+[····]2-Na+
B.H2O的空间构型为直线形
C.H2O2中O元素的化合价为-1
D.NaOH仅含离子键
9.(2023湖南,4,3分)下列有关物质结构和性质的说法错误的是( )
A.含有手性碳原子的分子叫做手性分子
B.邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点
C.酰胺在酸或碱存在并加热的条件下可发生水解反应
D.冠醚(18-冠-6)的空穴与K+尺寸适配,两者能通过弱相互作用形成超分子
10.(2023浙江1月选考,12,3分)共价化合物Al2Cl6中所有原子均满足8电子稳定结构,一定条件下可发生反应:Al2Cl6+2NH3 2Al(NH3)Cl3,下列说法不正确的是( )
A.Al2Cl6的结构式为
B.Al2Cl6为非极性分子
C.该反应中NH3的配位能力大于氯
D.Al2Br6比Al2Cl6更难与NH3发生反应
考点3 晶体结构与性质
11.(2023北京,1,3分)中国科学家首次成功制得大面积单晶石墨炔,是碳材料科学的一大进步。
金刚石 石墨 石墨炔
下列关于金刚石、石墨、石墨炔的说法正确的是 ( )
A.三种物质中均有碳碳原子间的σ键
B.三种物质中的碳原子都是sp3杂化
C.三种物质的晶体类型相同
D.三种物质均能导电
12.(2022湖北,9,3分)某立方卤化物可用于制作光电材料,其晶胞结构如图所示。下列说法错误的是( )
A.Ca2+的配位数为6
B.与F-距离最近的是K+
C.该物质的化学式为KCaF3
D.若F-换为Cl-,则晶胞棱长将改变
13.(2023湖南,11,3分)科学家合成了一种高温超导材料,其晶胞结构如图所示,该立方晶胞参数为a pm。阿伏加德罗常数的值为NA。下列说法错误的是 ( )
A.晶体最简化学式为KCaB6C6
B.晶体中与K+最近且距离相等的Ca2+有8个
C.晶胞中B和C原子构成的多面体有12个面
D.晶体的密度为 g·cm-3
14.(2023辽宁,14,3分)晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是( )
A.图1晶体密度为72.5/(NA×a3×10-30) g·cm-3
B.图1中O原子的配位数为6
C.图2表示的化学式为LiMg2OClxBr1-x
D.Mg2+取代产生的空位有利于Li+传导
15.(2023湖北,15,3分)镧La和H可以形成一系列晶体材料LaHn,在储氢和超导等领域具有重要应用。LaHn属于立方晶系,晶胞结构和参数如图所示。高压下,LaH2中的每个H结合4个H形成类似CH4的结构,即得到晶体LaHx。下列说法错误的是( )
A.LaH2晶体中La的配位数为8
B.晶体中H和H的最短距离:LaH2>LaHx
C.在LaHx晶胞中,H形成一个顶点数为40的闭合多面体笼
D.LaHx单位体积中含氢质量的计算式为 g·cm-3
16.(2020全国Ⅰ,15分)Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)基态Fe2+与Fe3+离子中未成对的电子数之比为 。
(2)Li及其周期表中相邻元素的第一电离能(I1)如表所示。I1(Li)>I1(Na),原因是 。I1(Be)>I1(B)>I1(Li),原因是
。
I1/(kJ·mol-1)
Li 520 Be 900 B 801 Na 496 Mg 738 Al 578
(3)磷酸根离子的空间构型为 ,其中P的价层电子对数为 、杂化轨道类型为 。
(4)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有 个。
电池充电时,LiFePO4脱出部分Li+,形成Li1-xFePO4,结构示意图如(b)所示,则x= ,n(Fe2+)∶n(Fe3+)= 。
考法强化练
考法1 杂化轨道类型及分子极性的判断
1.(2023山东,3,2分)下列分子属于极性分子的是 ( )
A.CS2 B.NF3
C.SO3 D.SiF4
2.(2022辽宁,7,3分)理论化学模拟得到一种离子,结构如图。下列关于该离子的说法错误的是( )
A.所有原子均满足8电子结构
B.N原子的杂化方式有2种
C.空间结构为四面体形
D.常温下不稳定
3.(2023新课标,12,6分)“肼合成酶”以其中的Fe2+配合物为催化中心,可将NH2OH与NH3转化为肼(NH2NH2),其反应历程如下所示。
下列说法错误的是( )
A.NH2OH、NH3和H2O均为极性分子
B.反应涉及N—H、N—O键断裂和N—N键生成
C.催化中心的Fe2+被氧化为Fe3+,后又被还原为Fe2+
D.将NH2OH替换为ND2OD,反应可得ND2ND2
4.(2023新课标,9,6分)一种可吸附甲醇的材料,其化学式为[C(NH2)3]4[B(OCH3)4]3Cl,部分晶体结构如下图所示,其中[C(NH2)3]+为平面结构。
下列说法正确的是( )
A.该晶体中存在N—H…O氢键
B.基态原子的第一电离能:CC.基态原子未成对电子数:BD.晶体中B、N和O原子轨道的杂化类型相同
考法2 键参数大小的比较 大π键分析
5.(2022北京,9,3分)由键能数据大小,不能解释下列事实的是( )
化学键 C—H Si—H C—O Si—O C—C Si—Si
键能/ kJ·mol-1 411 318 799 358 452 346 222
A.稳定性:CH4>SiH4
B.键长:C.熔点:CO2D.硬度:金刚石>晶体硅
6.(2023北京,10,3分)下列事实不能通过比较氟元素和氯元素的电负性进行解释的是( )
A.F—F键的键能小于Cl—Cl键的键能
B.三氟乙酸的Ka大于三氯乙酸的Ka
C.氟化氢分子的极性强于氯化氢分子的极性
D.气态氟化氢中存在(HF)2,而气态氯化氢中是 HCl分子
7.(2023湖北,9,3分)价层电子对互斥理论可以预测某些微粒的空间结构。下列说法正确的是( )
A.CH4和H2O的VSEPR模型均为四面体
B.S和C的空间构型均为平面三角形
C.CF4和SF4均为非极性分子
D.XeF2与XeO2的键角相等
8.(2023山东,5,2分)石墨与F2在450 ℃反应,石墨层间插入F得到层状结构化合物(CF)x,该物质仍具润滑性,其单层局部结构如图所示。下列关于该化合物的说法正确的是 ( )
A.与石墨相比,(CF)x导电性增强
B.与石墨相比,(CF)x抗氧化性增强
C.(CF)x中C—C的键长比C—F短
D.1 mol (CF)x中含有2x mol共价单键
考法3 物质熔、沸点高低的比较
9.(2023湖北,11,3分)物质结构决定物质性质。下列性质差异与结构因素匹配错误的是( )
性质差异 结构因素
A 沸点:正戊烷(36.1 ℃)高于新戊烷(9.5 ℃) 分子间作用力
B 熔点:AlF3(1 040 ℃)远高于AlCl3(178 ℃升华) 晶体类型
C 酸性:CF3COOH(pKa=0.23)远强于CH3COOH(pKa=4.76) 羟基极性
D 溶解度(20 ℃):Na2CO3(29 g)大于NaHCO3(8 g) 阴离子电荷
10.(2022全国乙,35节选)卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
卤化物CsICl2受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为 。解释X的熔点比Y高的原因 。
11.(2022福建,14,10分)1962年首个稀有气体化合物XePtF6问世,目前已知的稀有气体化合物中,含氙(54Xe)的最多,氪(36Kr)次之,氩(18Ar)化合物极少。[BrOF2][AsF6]·xKrF2是[BrOF2]+、[AsF6]-与KrF2分子形成的加合物,其晶胞如下图所示。
回答下列问题:
(1)基态As原子的价电子排布式为 。
(2)Ar、Kr、Xe原子的活泼性依序增强,原因是 。
(3)晶体熔点:KrF2 XeF2(填“>”“<”或“=”),判断依据是 。
12.(2022浙江1月选考,26,4分)(1)两种有机物的相关数据如下表:
物质 HCON(CH3)2 HCONH2
相对分子质量 73 45
沸点/℃ 153 220
HCON(CH3)2的相对分子质量比HCONH2的大,但其沸点反而比HCONH2的低,主要原因是 。
(2)四种晶体的熔点数据如下表:
物质 CF4 SiF4 BF3 AlF3
熔点/℃ -183 -90 -127 >1 000
CF4和SiF4熔点相差较小,BF3和AlF3熔点相差较大,原因是 。
三年模拟
考点强化练
考点1 化学键
1.(2024届广东一调,2)下列化学用语正确的是( )
A.H2O2的电子式:H+[····]2-H+
B.CO2的结构式:
C.中子数为18的Cl原子Cl
D.基态碳原子的最外层电子排布图:
↑
↑ ↑ ↑
2.(2024届深圳宝安一调,4)下列说法或化学用语表述正确的是( )
A.N2的电子式:NN
B.CH2Cl2中的共价键类型:非极性键和极性键
C.CO2的空间结构:V形
D.反-2-丁烯的结构简式:
3.(2024届广东实验中学10月月考,5)已知:Na2O2与H2O反应生成NaOH和O2,CaH2与H2O反应生成Ca(OH)2和H2。下列有关说法正确的是( )
A.Na2O2的电子式为Na+[····]2-Na+
B.CaH2中有非极性共价键
C.CaH2与H2O反应中H2O作氧化剂
D.当两个反应转移的电子数相同时,产生的O2和H2物质的量相同
考点2 分子结构与性质
4.(2023惠州三调,8改编)资源化利用CO2是实现“碳中和”的重要途径,CO2光催化转化为CH4的方法入选了2020年世界十大科技进展,其原理为CO2+4H2 CH4+2H2O。下列有关CO2、CH4的说法正确的是( )
A.CO2的空间结构是V形
B.CH4是极性分子
C.电负性:O>C
D.CO2转化为CH4体现了CO2的还原性
5.(2024届广州阶段训练,10)陈述Ⅰ和Ⅱ均正确,且具有因果关系的是( )
选项 陈述Ⅰ 陈述Ⅱ
A 电负性:F>Cl 酸性:CF3COOHB 离子半径:r(Mg2+)CaO
C 分子极性:CO>N2 范德华力:COD 分子间作用力:H2O>H2S 稳定性:H2O>H2S
6.(2024届湖北武汉六中第一次月考,8)北京大学的科技工作者在金(111)表面进行生长的二维双层冰的边缘结构实现了成像观察,二维冰层的AFM表征细节(图1)及其结构模型(图2)如下,该成果发表在2020年1月的《Nature》上。下列说法正确的是( )
图1 图2
A.气相水分子、“准液体”水分子和固态水分子属于三种不同的化合物
B.固态水分子之间的化学键较强,“准液体”水分子之间的化学键较弱
C.由于水分子间的氢键比较牢固,使水分子很稳定,高温下也难分解
D.受到能量激发时“准液体”的水分子与下层固态水分子脱离,使冰面变滑
7.(2024届江苏常熟中学阶段检测,5)元素周期表中第ⅤA族元素及其化合物应用广泛。氨是重要的化工原料,工业合成氨反应中每生成1 mol NH3,释放92.3 kJ热量。“长征二号”运载火箭采用C2H8O2/N2O4作发动机推进剂,燃烧产物无污染。LiFePO4常作锂电池的正极材料,电池充电时,LiFePO4脱出部分Li+,形成Li1-xFePO4。砷化镓(GaAs)是制备第三代半导体材料Ga2O3的重要原料。下列说法正确的是( )
A.NH3和NCl3都是非极性分子
B.1 mol磷酸根离子中含4 mol σ键
C.Fe2+的价层电子排布式为3d54s1
D.GaAs晶胞如图,距离As原子最近的As原子的数目为4
考点3 晶体结构与性质
8.(2023广州一模,4)四氯化锗(GeCl4)是光导纤维的常用掺杂剂,锗与硅同族。下列说法不正确的是( )
A.基态Ge原子价层电子排布式为4s24p2
B.GeCl4的熔点比SiCl4低
C.GeCl4的空间结构为正四面体
D.第一电离能:Cl>Si>Ge
9.(2024届河源中学一调,10)某种新型储氢材料的立方晶胞如图所示,该晶体由[Fe(NH3)6]n+和[BH4]-形成,晶胞参数为a pm。
下列说法不正确的是( )
A.[Fe(NH3)6]n+中n=2
B.晶胞中[Fe(NH3)6]n+和[BH4]-的配位数分别为8和4
C.晶胞中距离最近的2个[Fe(NH3)6]n+之间的距离为 pm
D.[BH4]-中心原子的杂化方式为sp3杂化
10.(2024届广东湛江调研,11)钛酸钡是太阳能电池材料。经X射线衍射分析测定,钛酸钡的晶胞结构如图所示(Ti4+、Ba2+均与O2-接触),已知晶胞边长为a pm,O2-的半径为b pm,NA为阿伏加德罗常数的值。下列叙述错误的是( )
A.与Ba2+等距离且最近的Ti4+有8个
B.Ti4+的半径为 pm
C.钛酸钡的化学式为BaTiO3
D.钛酸钡的密度ρ=×1021 g·cm-3
11.(2024届广东四校第一次联考,18节选)(5)①一种钴的氧化物的晶胞结构如图所示,该氧化物中钴离子的价层电子轨道表示式为 。
②该氧化物中氧离子的配位数是 。
③设NA为阿伏加德罗常数的值,晶体密度为d g/cm3,该晶体中距离最近的两个钴离子之间的距离为 pm。
考法综合练
考法1 杂化轨道类型及分子极性的判断
1.(2023广州二模,10)硒(Se)是人体必需微量元素之一,已知Se与S同族,一种含硒的功能分子的合成路线如下,下列说法不正确的是 ( )
A.沸点:H2O>H2Se>H2S
B.Ⅰ中S原子的杂化轨道类型为sp3
C.Ⅱ中含有极性共价键和非极性共价键
D.Ⅲ含有的元素中O的第一电离能最大
2.(2023佛山一模,5)连花清瘟胶囊的有效成分大黄素的结构如图所示,该成分有很强的抗炎抗菌药理活性,基于结构视角,下列说法正确的是( )
A.该分子中碳原子的杂化类型均为sp2
B.大黄素中所含元素的电负性O>C>H
C.基态氧原子核外电子的空间运动状态有8种
D.该分子为非极性分子
3.(2023广东二模,4)一种具有荧光性能的配合物的结构如图所示。下列有关该配合物的说法不正确的是( )
A.配位原子为N、O
B.碳原子的杂化方式为sp2、sp3
C.基态N原子核外有5种空间运动状态的电子
D.配体中含有两个手性碳原子
4.(2023深圳二调,18节选)(6)铑锰催化剂可催化反应:CO2+4H2 CH4+2H2O。下列有关该反应的说法正确的是 (填标号)。
A.存在极性共价键的断裂与形成
B.所有分子均为非极性分子
C.含碳化合物中心原子杂化轨道类型有sp与sp3
D.H2O的VSEPR模型为V形
E.催化剂可降低该反应的焓变,从而增大反应速率
考法2 键参数大小的比较 大π键分析
5.(2023江苏南通二调,5)下列说法正确的是( )
A.BrCl、CCl4都是由极性键构成的非极性分子
B.Cl中的键角大于C中的键角
C.溴元素位于元素周期表第四周期第ⅤA族
D.F、Cl、Br、I的第一电离能逐渐减小
6.(2023湛江一模,11)乙二胺()是一种重要的有机化工原料,下列关于乙二胺的说法不正确的是( )
A.易溶于水,其水溶液显碱性
B.H—C—H键角大于H—N—H键角
C.第二周期中第一电离能大于C小于N的元素只有一种
D.[Cu(H2NCH2CH2NH2)2]2+中,提供孤电子对形成配位键的是Cu2+
7.(2024届广东六校第一次联考,11)X、Y、Z、W为原子序数依次增大的前四周期元素,基态原子中,X为元素周期表中半径最小的原子,Z是地壳中含量最多的元素,W原子的价层电子排布为3d104s1,X、Y、Z、W形成的阳离子如图所示,下列说法正确的是( )
A.原子半径:Z>Y>X
B.该阳离子中心离子的配位数为6
C.氢化物的沸点:Z>Y
D.两种配体中的键角:X2Z>YX3
8.(2023福建龙岩三模,14节选)硅在地壳中含量丰富,晶体硅与硅化物等新材料在现代工业领域作用巨大。回答下列问题:
(2)SiCl4可发生水解反应,机理如图所示。
①a与c的水溶性:a c(填“>”“<”或“=”),理由是 。
②c分子中氧原子的杂化方式为 ;c分子中键长从大到小顺序为 。
考法3 物质熔、沸点高低的比较
9.(2023广东四校联考,5)铬离子能形成多种配位化合物,下列关于说法正确的是( )
A.[Cr(NH3)3(H2O)2Cl]2+中Cr的化合价为+2
B.[Cr(NH3)3(H2O)2Cl]2+中铬离子的配位数是5
C.NH3的沸点比H2O的低
D.NH3与H2O的键角相同
10.(2023深圳一模,6)“结构决定性质”是化学学科的核心观念。下列有关性质的比较正确的是 ( )
A.在水中的溶解度:戊醇<乙醇
B.熔点:MgOC.硬度:金刚石<碳化硅<硅
D.第一电离能:Cl11.(2023湖南师大附中二模,17节选)(6)BiOCl是一种性能优良的光催化剂,可催化降解有机污染物对硝基苯酚()等。对硝基苯酚的熔点高于邻硝基苯酚()的熔点,其原因是 。
微专题 晶胞结构分析与计算
1.(2023广东一模,9)一种锂的氧化物的晶胞结构如图所示(晶胞参数a=b=c=0.466 5 nm,晶胞棱边夹角均为90°)。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。下列有关说法不正确的是( )
A.该氧化物的化学式为Li2O
B.O原子之间的最短距离为×466.5 pm
C.与Li距离最近且相等的O有8个
D.若p原子的分数坐标为()
2.(2022北京,15节选)工业中可利用生产钛白的副产物FeSO4·7H2O和硫铁矿(FeS2)联合制备铁精粉(FexOy)和硫酸,实现能源及资源的有效利用。
(2)FeS2晶体的晶胞形状为立方体,边长为a nm,结构如图。
①距离Fe2+最近的阴离子有 个。
②FeS2的摩尔质量为120 g·mol-1,阿伏加德罗常数的值为NA。该晶体的密度为 g·cm-3。(1 nm=10-9 m)
3.(2023广州天河综合测试二,18节选)(4)氧铬酸钙是一种常见含铬矿石,其立方晶胞如图所示。
①氧铬酸钙的化学式为 。
②1个钙原子与 个氧原子最近且等距离。
③该晶体密度为 g·cm-3(列出计算式即可,已知Ca和O的最近距离为a nm,NA代表阿伏加德罗常数的值)。
4.(2023茂名一模,16)锗及其化合物广泛用于半导体、催化剂、光伏、制药工业。回答下列问题:
(1)锗的基态原子核外电子排布式为 。
(2)硅、锗、铅的氯化物的熔点如下表:
物质 SiCl4 GeCl4 PbCl4
熔点/℃ -70 约-50 -15
①GeCl4分子的空间结构为 。
②熔点:SiCl4(3)有机锗被称为“生命的奇效元素”,在医疗上具有重要应用。一种锗的有机配合物合成方法如下:
该有机配合物中锗的配位数为 ,其阴离子中C、Ge、O元素的第一电离能从大到小的顺序为 。
(4)一种含锗的化合物应用于太阳能电池,其晶胞为长方体,结构如图(a):
①该锗化合物晶胞的表示方式有多种,图中 (填“b”“c”或“d”)图也能表示此化合物的晶胞。
②用NA表示阿伏加德罗常数的数值,计算晶体(a)密度为 g·cm-3(用含x、y、z和NA的式子表示)。
5.(2023浙江1月选考,17,10分)硅材料在生活中占有重要地位。
请回答:
(1)Si(NH2)4分子的空间结构(以Si为中心)名称为 ,分子中氮原子的杂化轨道类型是 。Si(NH2)4受热分解生成Si3N4和NH3,其受热不稳定的原因是 。
(2)由硅原子核形成的三种微粒,电子排布式分别为:①[Ne]3s23p2、②[Ne]3s23p1、③[Ne]3s23p14s1,有关这些微粒的叙述,正确的是 。
A.微粒半径:③>①>②
B.电子排布属于基态原子(或离子)的是:①②
C.电离一个电子所需最低能量:①>②>③
D.得电子能力:①>②
(3)Si与P形成的某化合物晶体的晶胞如图。该晶体类型是 ,该化合物的化学式为 。
6.(2023全国甲,35,15分)将酞菁—钴酞菁—三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催化剂。回答下列问题:
(1)图1所示的几种碳单质,它们互为 ,其中属于原子晶体的是 ,C60间的作用力是 。
图1
(2)酞菁和钴酞菁的分子结构如图2所示。
图2
酞菁分子中所有原子共平面,其中p轨道能提供一对电子的N原子是 (填图2酞菁中N原子的标号)。钴酞菁分子中,钴离子的化合价为 ,氮原子提供孤对电子与钴离子形成 键。
(3)气态AlCl3通常以二聚体Al2Cl6的形式存在,其空间结构如图3a所示,二聚体中Al的轨道杂化类型为 。AlF3的熔点为1 090 ℃,远高于AlCl3的192 ℃,由此可以判断铝氟之间的化学键为 键。AlF3结构属立方晶系,晶胞如图3b所示,F-的配位数为 。若晶胞参数为a pm,晶体密度ρ= g·cm-3(列出计算式,阿伏加德罗常数的值为NA)。
7.(2022广东,20,14分)硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(AIE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子Ⅳ的合成路线如下:
(1)Se与S同族,基态硒原子价电子排布式为 。
(2)H2Se的沸点低于H2O,其原因是 。
(3)关于Ⅰ~Ⅲ三种反应物,下列说法正确的有 。
A.Ⅰ中仅有σ键
B.Ⅰ中的Se—Se键为非极性共价键
C.Ⅱ易溶于水
D.Ⅱ中原子的杂化轨道类型只有sp与sp2
E.Ⅰ~Ⅲ含有的元素中,O电负性最大
(4)Ⅳ中具有孤对电子的原子有 。
(5)硒的两种含氧酸的酸性强弱为H2SeO4 H2SeO3(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(Na2SeO4)可减轻重金属铊引起的中毒。Se的立体构型为 。
(6)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图a,沿x、y、z轴方向的投影均为图b。
图a
图b
①X的化学式为 。
②设X的最简式的式量为Mr,晶体密度为ρ g·cm-3,则X中相邻K之间的最短距离为 nm(列出计算式,NA为阿伏加德罗常数的值)。
8.(2021广东,20,14分)很多含巯基(—SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物Ⅱ。
(1)基态硫原子价电子排布式为 。
(2)H2S、CH4、H2O的沸点由高到低顺序为 。
(3)汞的原子序数为80,位于元素周期表第 周期第ⅡB族。
(4)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有 。
A.在Ⅰ中S原子采取sp3杂化
B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C—C—C键角是180°
D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物Ⅰ与化合物Ⅲ相比,水溶性较好的是 。
(6)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。
①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是 。
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为 ;该晶胞中粒子个数比Hg∶Ge∶Sb= 。
③设X的最简式的式量为Mr,则X晶体的密度为 g/cm3(列出算式)。
9.(2019课标Ⅰ,35,15分)在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要材料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是 (填标号)。
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是 、 。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是 ,其中与乙二胺形成的化合物稳定性相对较高的是 (填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如下表所示:
氧化物 Li2O MgO P4O6 SO2
熔点/℃ 1 570 2 800 23.8 -75.5
解释表中氧化物之间熔点差异的原因
(4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x= pm,Mg原子之间最短距离y= pm。设阿伏加德罗常数的值为NA,则MgCu2的密度是 g·cm-3(列出计算表达式)。
10.(2022河北,17,15分)含Cu、Zn、Sn及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
(1)基态S原子的价电子中,两种自旋状态的电子数之比为 。
(2)Cu与Zn相比,第二电离能与第一电离能差值更大的是 ,原因是 。
(3)SnC的几何构型为 ,其中心离子杂化方式为 。
(4)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是 (填标号)。
A.[Cu(NH3)2]Cl
B.[Cu(NH3)4]SO4
C.[Zn(NH3)4]SO4
D.Na2[Zn(OH)4]
(5)下图是硫的四种含氧酸根的结构:
根据组成和结构推断,能在酸性溶液中将Mn2+转化为Mn的是 (填标号),理由是 。
(6)下图是CZTS四元半导体化合物的四方晶胞。
①该物质的化学式为 。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中A原子的坐标为(),则B原子的坐标为 。
专题八 化学键 分子和晶体的结构与性质
五年高考
考点过关练
考点1 化学键
1.(2022湖南,2,3分)下列说法错误的是( )
A.氢键、离子键和共价键都属于化学键
B.化学家门捷列夫编制了第一张元素周期表
C.药剂师和营养师必须具备化学相关专业知识
D.石灰石是制造玻璃和水泥的主要原料之一
答案 A
2.(2023浙江6月选考,2,3分)下列化学用语表示正确的是( )
A.H2S分子的球棍模型:
B.AlCl3的价层电子对互斥模型:
C.KI的电子式:K····
D.CH3CH(CH2CH3)2的名称:3-甲基戊烷
答案 D
3.(2023辽宁,2,3分)下列化学用语或表述正确的是( )
A.BeCl2的空间结构:V形
B.P4中的共价键类型:非极性键
C.基态Ni原子价电子排布式:3d10
D.顺-2-丁烯的结构简式:
答案 B
4.(2023江苏,2,3分)反应NH4Cl+NaNO2 NaCl+N2↑+2H2O应用于石油开采。下列说法正确的是( )
A.N的电子式为H····H
B.N中N元素的化合价为+5
C.N2分子中存在键
D.H2O为非极性分子
答案 C
5.(2022重庆,2,3分)BCl3水解反应方程式为BCl3+3H2O B(OH)3+3HCl,下列说法错误的是( )
A.Cl的原子结构示意图为
B.H2O的空间填充模型为
C.BCl3的电子式为····
D.B(OH)3的结构简式为
答案 C
考点2 分子结构与性质
6.(2023江苏,5,3分)下列说法正确的是( )
A. H都属于氢元素
B.N和H2O的中心原子轨道杂化类型均为sp2
C.H2O2分子中的化学键均为极性共价键
D.CaH2晶体中存在Ca与H2之间的强烈相互作用
答案 A
7.(2023江苏,7,3分)下列物质结构与性质或物质性质与用途具有对应关系的是( )
A.H2具有还原性,可作为氢氧燃料电池的燃料
B.氨极易溶于水,液氨可用作制冷剂
C.H2O分子之间形成氢键,H2O(g)的热稳定性比H2S(g)的高
D.N2H4中的N原子与H+形成配位键,N2H4具有还原性
答案 A
8.(2022江苏,2,3分)少量Na2O2与H2O反应生成H2O2和NaOH。下列说法正确的是( )
A.Na2O2的电子式为Na+[····]2-Na+
B.H2O的空间构型为直线形
C.H2O2中O元素的化合价为-1
D.NaOH仅含离子键
答案 C
9.(2023湖南,4,3分)下列有关物质结构和性质的说法错误的是( )
A.含有手性碳原子的分子叫做手性分子
B.邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点
C.酰胺在酸或碱存在并加热的条件下可发生水解反应
D.冠醚(18-冠-6)的空穴与K+尺寸适配,两者能通过弱相互作用形成超分子
答案 A
10.(2023浙江1月选考,12,3分)共价化合物Al2Cl6中所有原子均满足8电子稳定结构,一定条件下可发生反应:Al2Cl6+2NH3 2Al(NH3)Cl3,下列说法不正确的是( )
A.Al2Cl6的结构式为
B.Al2Cl6为非极性分子
C.该反应中NH3的配位能力大于氯
D.Al2Br6比Al2Cl6更难与NH3发生反应
答案 D
考点3 晶体结构与性质
11.(2023北京,1,3分)中国科学家首次成功制得大面积单晶石墨炔,是碳材料科学的一大进步。
金刚石 石墨 石墨炔
下列关于金刚石、石墨、石墨炔的说法正确的是 ( )
A.三种物质中均有碳碳原子间的σ键
B.三种物质中的碳原子都是sp3杂化
C.三种物质的晶体类型相同
D.三种物质均能导电
答案 A
12.(2022湖北,9,3分)某立方卤化物可用于制作光电材料,其晶胞结构如图所示。下列说法错误的是( )
A.Ca2+的配位数为6
B.与F-距离最近的是K+
C.该物质的化学式为KCaF3
D.若F-换为Cl-,则晶胞棱长将改变
答案 B
13.(2023湖南,11,3分)科学家合成了一种高温超导材料,其晶胞结构如图所示,该立方晶胞参数为a pm。阿伏加德罗常数的值为NA。下列说法错误的是 ( )
A.晶体最简化学式为KCaB6C6
B.晶体中与K+最近且距离相等的Ca2+有8个
C.晶胞中B和C原子构成的多面体有12个面
D.晶体的密度为 g·cm-3
答案 C
14.(2023辽宁,14,3分)晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是( )
A.图1晶体密度为72.5/(NA×a3×10-30) g·cm-3
B.图1中O原子的配位数为6
C.图2表示的化学式为LiMg2OClxBr1-x
D.Mg2+取代产生的空位有利于Li+传导
答案 C
15.(2023湖北,15,3分)镧La和H可以形成一系列晶体材料LaHn,在储氢和超导等领域具有重要应用。LaHn属于立方晶系,晶胞结构和参数如图所示。高压下,LaH2中的每个H结合4个H形成类似CH4的结构,即得到晶体LaHx。下列说法错误的是( )
A.LaH2晶体中La的配位数为8
B.晶体中H和H的最短距离:LaH2>LaHx
C.在LaHx晶胞中,H形成一个顶点数为40的闭合多面体笼
D.LaHx单位体积中含氢质量的计算式为 g·cm-3
答案 C
16.(2020全国Ⅰ,15分)Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)基态Fe2+与Fe3+离子中未成对的电子数之比为 。
(2)Li及其周期表中相邻元素的第一电离能(I1)如表所示。I1(Li)>I1(Na),原因是 。I1(Be)>I1(B)>I1(Li),原因是
。
I1/(kJ·mol-1)
Li 520 Be 900 B 801 Na 496 Mg 738 Al 578
(3)磷酸根离子的空间构型为 ,其中P的价层电子对数为 、杂化轨道类型为 。
(4)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有 个。
电池充电时,LiFePO4脱出部分Li+,形成Li1-xFePO4,结构示意图如(b)所示,则x= ,n(Fe2+)∶n(Fe3+)= 。
答案 (1) 13∶3
考法强化练
考法1 杂化轨道类型及分子极性的判断
1.(2023山东,3,2分)下列分子属于极性分子的是 ( )
A.CS2 B.NF3
C.SO3 D.SiF4
答案 B
2.(2022辽宁,7,3分)理论化学模拟得到一种离子,结构如图。下列关于该离子的说法错误的是( )
A.所有原子均满足8电子结构
B.N原子的杂化方式有2种
C.空间结构为四面体形
D.常温下不稳定
答案 B
3.(2023新课标,12,6分)“肼合成酶”以其中的Fe2+配合物为催化中心,可将NH2OH与NH3转化为肼(NH2NH2),其反应历程如下所示。
下列说法错误的是( )
A.NH2OH、NH3和H2O均为极性分子
B.反应涉及N—H、N—O键断裂和N—N键生成
C.催化中心的Fe2+被氧化为Fe3+,后又被还原为Fe2+
D.将NH2OH替换为ND2OD,反应可得ND2ND2
答案 D
4.(2023新课标,9,6分)一种可吸附甲醇的材料,其化学式为[C(NH2)3]4[B(OCH3)4]3Cl,部分晶体结构如下图所示,其中[C(NH2)3]+为平面结构。
下列说法正确的是( )
A.该晶体中存在N—H…O氢键
B.基态原子的第一电离能:CC.基态原子未成对电子数:BD.晶体中B、N和O原子轨道的杂化类型相同
答案 A
考法2 键参数大小的比较 大π键分析
5.(2022北京,9,3分)由键能数据大小,不能解释下列事实的是( )
化学键 C—H Si—H C—O Si—O C—C Si—Si
键能/ kJ·mol-1 411 318 799 358 452 346 222
A.稳定性:CH4>SiH4
B.键长:C.熔点:CO2D.硬度:金刚石>晶体硅
答案 C
6.(2023北京,10,3分)下列事实不能通过比较氟元素和氯元素的电负性进行解释的是( )
A.F—F键的键能小于Cl—Cl键的键能
B.三氟乙酸的Ka大于三氯乙酸的Ka
C.氟化氢分子的极性强于氯化氢分子的极性
D.气态氟化氢中存在(HF)2,而气态氯化氢中是 HCl分子
答案 A
7.(2023湖北,9,3分)价层电子对互斥理论可以预测某些微粒的空间结构。下列说法正确的是( )
A.CH4和H2O的VSEPR模型均为四面体
B.S和C的空间构型均为平面三角形
C.CF4和SF4均为非极性分子
D.XeF2与XeO2的键角相等
答案 A
8.(2023山东,5,2分)石墨与F2在450 ℃反应,石墨层间插入F得到层状结构化合物(CF)x,该物质仍具润滑性,其单层局部结构如图所示。下列关于该化合物的说法正确的是 ( )
A.与石墨相比,(CF)x导电性增强
B.与石墨相比,(CF)x抗氧化性增强
C.(CF)x中C—C的键长比C—F短
D.1 mol (CF)x中含有2x mol共价单键
答案 B
考法3 物质熔、沸点高低的比较
9.(2023湖北,11,3分)物质结构决定物质性质。下列性质差异与结构因素匹配错误的是( )
性质差异 结构因素
A 沸点:正戊烷(36.1 ℃)高于新戊烷(9.5 ℃) 分子间作用力
B 熔点:AlF3(1 040 ℃)远高于AlCl3(178 ℃升华) 晶体类型
C 酸性:CF3COOH(pKa=0.23)远强于CH3COOH(pKa=4.76) 羟基极性
D 溶解度(20 ℃):Na2CO3(29 g)大于NaHCO3(8 g) 阴离子电荷
答案 D
10.(2022全国乙,35节选)卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
卤化物CsICl2受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为 。解释X的熔点比Y高的原因 。
答案 CsCl CsCl是离子晶体,熔化时需要克服Cs+和Cl-之间的离子键,而ICl是分子晶体,熔化时只需要克服范德华力
11.(2022福建,14,10分)1962年首个稀有气体化合物XePtF6问世,目前已知的稀有气体化合物中,含氙(54Xe)的最多,氪(36Kr)次之,氩(18Ar)化合物极少。[BrOF2][AsF6]·xKrF2是[BrOF2]+、[AsF6]-与KrF2分子形成的加合物,其晶胞如下图所示。
回答下列问题:
(1)基态As原子的价电子排布式为 。
(2)Ar、Kr、Xe原子的活泼性依序增强,原因是 。
(3)晶体熔点:KrF2 XeF2(填“>”“<”或“=”),判断依据是 。
答案 (1)4s24p3
(2)同主族元素,从上而下原子半径逐渐增大,原子核对外层电子的有效吸引逐渐减弱,失电子能力逐渐增强
(3)< 二者为同构型的分子晶体,XeF2相对分子质量大,范德华力大,熔点高
12.(2022浙江1月选考,26,4分)(1)两种有机物的相关数据如下表:
物质 HCON(CH3)2 HCONH2
相对分子质量 73 45
沸点/℃ 153 220
HCON(CH3)2的相对分子质量比HCONH2的大,但其沸点反而比HCONH2的低,主要原因是 。
(2)四种晶体的熔点数据如下表:
物质 CF4 SiF4 BF3 AlF3
熔点/℃ -183 -90 -127 >1 000
CF4和SiF4熔点相差较小,BF3和AlF3熔点相差较大,原因是 。
答案 (1)HCON(CH3)2分子间只有一般的分子间作用力,HCONH2分子间存在氢键,破坏一般的分子间作用力更容易,所以沸点低
(2)CF4和SiF4都是分子晶体,结构相似,分子间作用力相差较小,所以熔点相差较小;BF3通过分子间作用力形成分子晶体,AlF3通过离子键形成离子晶体,破坏离子键需要能量多得多,所以熔点相差较大
三年模拟
考点强化练
考点1 化学键
1.(2024届广东一调,2)下列化学用语正确的是( )
A.H2O2的电子式:H+[····]2-H+
B.CO2的结构式:
C.中子数为18的Cl原子Cl
D.基态碳原子的最外层电子排布图:
↑
↑ ↑ ↑
答案 B
2.(2024届深圳宝安一调,4)下列说法或化学用语表述正确的是( )
A.N2的电子式:NN
B.CH2Cl2中的共价键类型:非极性键和极性键
C.CO2的空间结构:V形
D.反-2-丁烯的结构简式:
答案 D
3.(2024届广东实验中学10月月考,5)已知:Na2O2与H2O反应生成NaOH和O2,CaH2与H2O反应生成Ca(OH)2和H2。下列有关说法正确的是( )
A.Na2O2的电子式为Na+[····]2-Na+
B.CaH2中有非极性共价键
C.CaH2与H2O反应中H2O作氧化剂
D.当两个反应转移的电子数相同时,产生的O2和H2物质的量相同
答案 C
考点2 分子结构与性质
4.(2023惠州三调,8改编)资源化利用CO2是实现“碳中和”的重要途径,CO2光催化转化为CH4的方法入选了2020年世界十大科技进展,其原理为CO2+4H2 CH4+2H2O。下列有关CO2、CH4的说法正确的是( )
A.CO2的空间结构是V形
B.CH4是极性分子
C.电负性:O>C
D.CO2转化为CH4体现了CO2的还原性
答案 C
5.(2024届广州阶段训练,10)陈述Ⅰ和Ⅱ均正确,且具有因果关系的是( )
选项 陈述Ⅰ 陈述Ⅱ
A 电负性:F>Cl 酸性:CF3COOHB 离子半径:r(Mg2+)CaO
C 分子极性:CO>N2 范德华力:COD 分子间作用力:H2O>H2S 稳定性:H2O>H2S
答案 B
6.(2024届湖北武汉六中第一次月考,8)北京大学的科技工作者在金(111)表面进行生长的二维双层冰的边缘结构实现了成像观察,二维冰层的AFM表征细节(图1)及其结构模型(图2)如下,该成果发表在2020年1月的《Nature》上。下列说法正确的是( )
图1 图2
A.气相水分子、“准液体”水分子和固态水分子属于三种不同的化合物
B.固态水分子之间的化学键较强,“准液体”水分子之间的化学键较弱
C.由于水分子间的氢键比较牢固,使水分子很稳定,高温下也难分解
D.受到能量激发时“准液体”的水分子与下层固态水分子脱离,使冰面变滑
答案 D
7.(2024届江苏常熟中学阶段检测,5)元素周期表中第ⅤA族元素及其化合物应用广泛。氨是重要的化工原料,工业合成氨反应中每生成1 mol NH3,释放92.3 kJ热量。“长征二号”运载火箭采用C2H8O2/N2O4作发动机推进剂,燃烧产物无污染。LiFePO4常作锂电池的正极材料,电池充电时,LiFePO4脱出部分Li+,形成Li1-xFePO4。砷化镓(GaAs)是制备第三代半导体材料Ga2O3的重要原料。下列说法正确的是( )
A.NH3和NCl3都是非极性分子
B.1 mol磷酸根离子中含4 mol σ键
C.Fe2+的价层电子排布式为3d54s1
D.GaAs晶胞如图,距离As原子最近的As原子的数目为4
答案 B
考点3 晶体结构与性质
8.(2023广州一模,4)四氯化锗(GeCl4)是光导纤维的常用掺杂剂,锗与硅同族。下列说法不正确的是( )
A.基态Ge原子价层电子排布式为4s24p2
B.GeCl4的熔点比SiCl4低
C.GeCl4的空间结构为正四面体
D.第一电离能:Cl>Si>Ge
答案 B
9.(2024届河源中学一调,10)某种新型储氢材料的立方晶胞如图所示,该晶体由[Fe(NH3)6]n+和[BH4]-形成,晶胞参数为a pm。
下列说法不正确的是( )
A.[Fe(NH3)6]n+中n=2
B.晶胞中[Fe(NH3)6]n+和[BH4]-的配位数分别为8和4
C.晶胞中距离最近的2个[Fe(NH3)6]n+之间的距离为 pm
D.[BH4]-中心原子的杂化方式为sp3杂化
答案 C
10.(2024届广东湛江调研,11)钛酸钡是太阳能电池材料。经X射线衍射分析测定,钛酸钡的晶胞结构如图所示(Ti4+、Ba2+均与O2-接触),已知晶胞边长为a pm,O2-的半径为b pm,NA为阿伏加德罗常数的值。下列叙述错误的是( )
A.与Ba2+等距离且最近的Ti4+有8个
B.Ti4+的半径为 pm
C.钛酸钡的化学式为BaTiO3
D.钛酸钡的密度ρ=×1021 g·cm-3
答案 D
11.(2024届广东四校第一次联考,18节选)(5)①一种钴的氧化物的晶胞结构如图所示,该氧化物中钴离子的价层电子轨道表示式为 。
②该氧化物中氧离子的配位数是 。
③设NA为阿伏加德罗常数的值,晶体密度为d g/cm3,该晶体中距离最近的两个钴离子之间的距离为 pm。
答案 (5)①
↑↓ ↑↓ ↑ ↑ ↑
×1010
考法综合练
考法1 杂化轨道类型及分子极性的判断
1.(2023广州二模,10)硒(Se)是人体必需微量元素之一,已知Se与S同族,一种含硒的功能分子的合成路线如下,下列说法不正确的是 ( )
A.沸点:H2O>H2Se>H2S
B.Ⅰ中S原子的杂化轨道类型为sp3
C.Ⅱ中含有极性共价键和非极性共价键
D.Ⅲ含有的元素中O的第一电离能最大
答案 D
2.(2023佛山一模,5)连花清瘟胶囊的有效成分大黄素的结构如图所示,该成分有很强的抗炎抗菌药理活性,基于结构视角,下列说法正确的是( )
A.该分子中碳原子的杂化类型均为sp2
B.大黄素中所含元素的电负性O>C>H
C.基态氧原子核外电子的空间运动状态有8种
D.该分子为非极性分子
答案 B
3.(2023广东二模,4)一种具有荧光性能的配合物的结构如图所示。下列有关该配合物的说法不正确的是( )
A.配位原子为N、O
B.碳原子的杂化方式为sp2、sp3
C.基态N原子核外有5种空间运动状态的电子
D.配体中含有两个手性碳原子
答案 D
4.(2023深圳二调,18节选)(6)铑锰催化剂可催化反应:CO2+4H2 CH4+2H2O。下列有关该反应的说法正确的是 (填标号)。
A.存在极性共价键的断裂与形成
B.所有分子均为非极性分子
C.含碳化合物中心原子杂化轨道类型有sp与sp3
D.H2O的VSEPR模型为V形
E.催化剂可降低该反应的焓变,从而增大反应速率
答案 (6)AC
考法2 键参数大小的比较 大π键分析
5.(2023江苏南通二调,5)下列说法正确的是( )
A.BrCl、CCl4都是由极性键构成的非极性分子
B.Cl中的键角大于C中的键角
C.溴元素位于元素周期表第四周期第ⅤA族
D.F、Cl、Br、I的第一电离能逐渐减小
答案 D
6.(2023湛江一模,11)乙二胺()是一种重要的有机化工原料,下列关于乙二胺的说法不正确的是( )
A.易溶于水,其水溶液显碱性
B.H—C—H键角大于H—N—H键角
C.第二周期中第一电离能大于C小于N的元素只有一种
D.[Cu(H2NCH2CH2NH2)2]2+中,提供孤电子对形成配位键的是Cu2+
答案 D
7.(2024届广东六校第一次联考,11)X、Y、Z、W为原子序数依次增大的前四周期元素,基态原子中,X为元素周期表中半径最小的原子,Z是地壳中含量最多的元素,W原子的价层电子排布为3d104s1,X、Y、Z、W形成的阳离子如图所示,下列说法正确的是( )
A.原子半径:Z>Y>X
B.该阳离子中心离子的配位数为6
C.氢化物的沸点:Z>Y
D.两种配体中的键角:X2Z>YX3
答案 B
8.(2023福建龙岩三模,14节选)硅在地壳中含量丰富,晶体硅与硅化物等新材料在现代工业领域作用巨大。回答下列问题:
(2)SiCl4可发生水解反应,机理如图所示。
①a与c的水溶性:a c(填“>”“<”或“=”),理由是 。
②c分子中氧原子的杂化方式为 ;c分子中键长从大到小顺序为 。
答案 (2)①< c为极性分子且能与水分子形成氢键 ②sp3 Si—Cl>Si—O>H—O
考法3 物质熔、沸点高低的比较
9.(2023广东四校联考,5)铬离子能形成多种配位化合物,下列关于说法正确的是( )
A.[Cr(NH3)3(H2O)2Cl]2+中Cr的化合价为+2
B.[Cr(NH3)3(H2O)2Cl]2+中铬离子的配位数是5
C.NH3的沸点比H2O的低
D.NH3与H2O的键角相同
答案 C
10.(2023深圳一模,6)“结构决定性质”是化学学科的核心观念。下列有关性质的比较正确的是 ( )
A.在水中的溶解度:戊醇<乙醇
B.熔点:MgOC.硬度:金刚石<碳化硅<硅
D.第一电离能:Cl答案 A
11.(2023湖南师大附中二模,17节选)(6)BiOCl是一种性能优良的光催化剂,可催化降解有机污染物对硝基苯酚()等。对硝基苯酚的熔点高于邻硝基苯酚()的熔点,其原因是 。
答案 (6)对硝基苯酚可形成分子间氢键,而邻硝基苯酚更易形成分子内氢键,导致对硝基苯酚分子间的作用力比邻硝基苯酚分子间的作用力更强
微专题 晶胞结构分析与计算
1.(2023广东一模,9)一种锂的氧化物的晶胞结构如图所示(晶胞参数a=b=c=0.466 5 nm,晶胞棱边夹角均为90°)。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。下列有关说法不正确的是( )
A.该氧化物的化学式为Li2O
B.O原子之间的最短距离为×466.5 pm
C.与Li距离最近且相等的O有8个
D.若p原子的分数坐标为()
答案 C
2.(2022北京,15节选)工业中可利用生产钛白的副产物FeSO4·7H2O和硫铁矿(FeS2)联合制备铁精粉(FexOy)和硫酸,实现能源及资源的有效利用。
(2)FeS2晶体的晶胞形状为立方体,边长为a nm,结构如图。
①距离Fe2+最近的阴离子有 个。
②FeS2的摩尔质量为120 g·mol-1,阿伏加德罗常数的值为NA。该晶体的密度为 g·cm-3。(1 nm=10-9 m)
答案 (2)①6 ②
3.(2023广州天河综合测试二,18节选)(4)氧铬酸钙是一种常见含铬矿石,其立方晶胞如图所示。
①氧铬酸钙的化学式为 。
②1个钙原子与 个氧原子最近且等距离。
③该晶体密度为 g·cm-3(列出计算式即可,已知Ca和O的最近距离为a nm,NA代表阿伏加德罗常数的值)。
答案 (4)①CaCrO3 ②12 ③
4.(2023茂名一模,16)锗及其化合物广泛用于半导体、催化剂、光伏、制药工业。回答下列问题:
(1)锗的基态原子核外电子排布式为 。
(2)硅、锗、铅的氯化物的熔点如下表:
物质 SiCl4 GeCl4 PbCl4
熔点/℃ -70 约-50 -15
①GeCl4分子的空间结构为 。
②熔点:SiCl4(3)有机锗被称为“生命的奇效元素”,在医疗上具有重要应用。一种锗的有机配合物合成方法如下:
该有机配合物中锗的配位数为 ,其阴离子中C、Ge、O元素的第一电离能从大到小的顺序为 。
(4)一种含锗的化合物应用于太阳能电池,其晶胞为长方体,结构如图(a):
①该锗化合物晶胞的表示方式有多种,图中 (填“b”“c”或“d”)图也能表示此化合物的晶胞。
②用NA表示阿伏加德罗常数的数值,计算晶体(a)密度为 g·cm-3(用含x、y、z和NA的式子表示)。
答案 (1)1s22s22p63s23p63d104s24p2或[Ar]3d104s24p2
(2)①正四面体形 ②三者均为分子晶体,随着相对分子质量增大,范德华力增强,物质的熔点逐渐升高
(3)6 O>C>Ge (4)①b ②×1021
5.(2023浙江1月选考,17,10分)硅材料在生活中占有重要地位。
请回答:
(1)Si(NH2)4分子的空间结构(以Si为中心)名称为 ,分子中氮原子的杂化轨道类型是 。Si(NH2)4受热分解生成Si3N4和NH3,其受热不稳定的原因是 。
(2)由硅原子核形成的三种微粒,电子排布式分别为:①[Ne]3s23p2、②[Ne]3s23p1、③[Ne]3s23p14s1,有关这些微粒的叙述,正确的是 。
A.微粒半径:③>①>②
B.电子排布属于基态原子(或离子)的是:①②
C.电离一个电子所需最低能量:①>②>③
D.得电子能力:①>②
(3)Si与P形成的某化合物晶体的晶胞如图。该晶体类型是 ,该化合物的化学式为 。
答案 (1)正四面体形 sp3 Si周围的NH2基团体积较大,受热时斥力较强[Si(NH2)4中Si—N键能相对较小];产物中气态分子数显著增多(熵增) (2)AB (3)共价晶体 SiP2
6.(2023全国甲,35,15分)将酞菁—钴酞菁—三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催化剂。回答下列问题:
(1)图1所示的几种碳单质,它们互为 ,其中属于原子晶体的是 ,C60间的作用力是 。
图1
(2)酞菁和钴酞菁的分子结构如图2所示。
图2
酞菁分子中所有原子共平面,其中p轨道能提供一对电子的N原子是 (填图2酞菁中N原子的标号)。钴酞菁分子中,钴离子的化合价为 ,氮原子提供孤对电子与钴离子形成 键。
(3)气态AlCl3通常以二聚体Al2Cl6的形式存在,其空间结构如图3a所示,二聚体中Al的轨道杂化类型为 。AlF3的熔点为1 090 ℃,远高于AlCl3的192 ℃,由此可以判断铝氟之间的化学键为 键。AlF3结构属立方晶系,晶胞如图3b所示,F-的配位数为 。若晶胞参数为a pm,晶体密度ρ= g·cm-3(列出计算式,阿伏加德罗常数的值为NA)。
答案 (1)同素异形体 金刚石 范德华力
(2)③ +2 配位
(3)sp3 离子 2 ×1030)
7.(2022广东,20,14分)硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(AIE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子Ⅳ的合成路线如下:
(1)Se与S同族,基态硒原子价电子排布式为 。
(2)H2Se的沸点低于H2O,其原因是 。
(3)关于Ⅰ~Ⅲ三种反应物,下列说法正确的有 。
A.Ⅰ中仅有σ键
B.Ⅰ中的Se—Se键为非极性共价键
C.Ⅱ易溶于水
D.Ⅱ中原子的杂化轨道类型只有sp与sp2
E.Ⅰ~Ⅲ含有的元素中,O电负性最大
(4)Ⅳ中具有孤对电子的原子有 。
(5)硒的两种含氧酸的酸性强弱为H2SeO4 H2SeO3(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(Na2SeO4)可减轻重金属铊引起的中毒。Se的立体构型为 。
(6)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图a,沿x、y、z轴方向的投影均为图b。
图a
图b
①X的化学式为 。
②设X的最简式的式量为Mr,晶体密度为ρ g·cm-3,则X中相邻K之间的最短距离为 nm(列出计算式,NA为阿伏加德罗常数的值)。
答案 (1)4s24p4 (2)H2O分子间形成氢键,H2Se分子间只有范德华力 (3)BDE (4)O、Se (5)> 正四面体形 (6)①K2SeBr6 ②×107
8.(2021广东,20,14分)很多含巯基(—SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物Ⅱ。
(1)基态硫原子价电子排布式为 。
(2)H2S、CH4、H2O的沸点由高到低顺序为 。
(3)汞的原子序数为80,位于元素周期表第 周期第ⅡB族。
(4)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有 。
A.在Ⅰ中S原子采取sp3杂化
B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C—C—C键角是180°
D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物Ⅰ与化合物Ⅲ相比,水溶性较好的是 。
(6)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。
①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是 。
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为 ;该晶胞中粒子个数比Hg∶Ge∶Sb= 。
③设X的最简式的式量为Mr,则X晶体的密度为 g/cm3(列出算式)。
答案 (1)3s23p4 (2)H2O>H2S>CH4 (3)六
(4)AD (5)化合物Ⅲ (6)①垂直平移后,顶点原子不能重复 ②4 1∶1∶2 ③
9.(2019课标Ⅰ,35,15分)在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要材料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是 (填标号)。
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是 、 。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是 ,其中与乙二胺形成的化合物稳定性相对较高的是 (填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如下表所示:
氧化物 Li2O MgO P4O6 SO2
熔点/℃ 1 570 2 800 23.8 -75.5
解释表中氧化物之间熔点差异的原因
(4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x= pm,Mg原子之间最短距离y= pm。设阿伏加德罗常数的值为NA,则MgCu2的密度是 g·cm-3(列出计算表达式)。
答案 (1)A (2)sp3 sp3 乙二胺的两个N提供孤对电子给金属离子形成配位键 Cu2+
(3)Li2O、MgO为离子晶体,P4O6、SO2为分子晶体。离子键:MgO>Li2O,分子间作用力:P4O6>SO2
(4)
10.(2022河北,17,15分)含Cu、Zn、Sn及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
(1)基态S原子的价电子中,两种自旋状态的电子数之比为 。
(2)Cu与Zn相比,第二电离能与第一电离能差值更大的是 ,原因是 。
(3)SnC的几何构型为 ,其中心离子杂化方式为 。
(4)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是 (填标号)。
A.[Cu(NH3)2]Cl
B.[Cu(NH3)4]SO4
C.[Zn(NH3)4]SO4
D.Na2[Zn(OH)4]
(5)下图是硫的四种含氧酸根的结构:
根据组成和结构推断,能在酸性溶液中将Mn2+转化为Mn的是 (填标号),理由是 。
(6)下图是CZTS四元半导体化合物的四方晶胞。
①该物质的化学式为 。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中A原子的坐标为(),则B原子的坐标为 。
答案 (1)2∶1(或1∶2) (2)Cu Cu的第二电离能是失去3d10电子所需的最低能量,第一电离能是失去4s1电子所需的最低能量;Zn的第二电离能是失去4s1电子所需的最低能量,第一电离能是失去4s2电子所需的最低能量,3d10电子处于全充满状态,其与4s1电子能量差值更大 (3)三角锥形 sp3 (4)B (5)D D中含有-1价的O,具有强氧化性,能将Mn2+转化为Mn)
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025广东版新教材化学高考第一轮
专题八 化学键 分子和晶体的结构与性质
五年高考
考点过关练
考点1 化学键
1.(2022湖南,2,3分)下列说法错误的是( )
A.氢键、离子键和共价键都属于化学键
B.化学家门捷列夫编制了第一张元素周期表
C.药剂师和营养师必须具备化学相关专业知识
D.石灰石是制造玻璃和水泥的主要原料之一
2.(2023浙江6月选考,2,3分)下列化学用语表示正确的是( )
A.H2S分子的球棍模型:
B.AlCl3的价层电子对互斥模型:
C.KI的电子式:K····
D.CH3CH(CH2CH3)2的名称:3-甲基戊烷
3.(2023辽宁,2,3分)下列化学用语或表述正确的是( )
A.BeCl2的空间结构:V形
B.P4中的共价键类型:非极性键
C.基态Ni原子价电子排布式:3d10
D.顺-2-丁烯的结构简式:
4.(2023江苏,2,3分)反应NH4Cl+NaNO2 NaCl+N2↑+2H2O应用于石油开采。下列说法正确的是( )
A.N的电子式为H····H
B.N中N元素的化合价为+5
C.N2分子中存在键
D.H2O为非极性分子
5.(2022重庆,2,3分)BCl3水解反应方程式为BCl3+3H2O B(OH)3+3HCl,下列说法错误的是( )
A.Cl的原子结构示意图为
B.H2O的空间填充模型为
C.BCl3的电子式为····
D.B(OH)3的结构简式为
考点2 分子结构与性质
6.(2023江苏,5,3分)下列说法正确的是( )
A. H都属于氢元素
B.N和H2O的中心原子轨道杂化类型均为sp2
C.H2O2分子中的化学键均为极性共价键
D.CaH2晶体中存在Ca与H2之间的强烈相互作用
7.(2023江苏,7,3分)下列物质结构与性质或物质性质与用途具有对应关系的是( )
A.H2具有还原性,可作为氢氧燃料电池的燃料
B.氨极易溶于水,液氨可用作制冷剂
C.H2O分子之间形成氢键,H2O(g)的热稳定性比H2S(g)的高
D.N2H4中的N原子与H+形成配位键,N2H4具有还原性
8.(2022江苏,2,3分)少量Na2O2与H2O反应生成H2O2和NaOH。下列说法正确的是( )
A.Na2O2的电子式为Na+[····]2-Na+
B.H2O的空间构型为直线形
C.H2O2中O元素的化合价为-1
D.NaOH仅含离子键
9.(2023湖南,4,3分)下列有关物质结构和性质的说法错误的是( )
A.含有手性碳原子的分子叫做手性分子
B.邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点
C.酰胺在酸或碱存在并加热的条件下可发生水解反应
D.冠醚(18-冠-6)的空穴与K+尺寸适配,两者能通过弱相互作用形成超分子
10.(2023浙江1月选考,12,3分)共价化合物Al2Cl6中所有原子均满足8电子稳定结构,一定条件下可发生反应:Al2Cl6+2NH3 2Al(NH3)Cl3,下列说法不正确的是( )
A.Al2Cl6的结构式为
B.Al2Cl6为非极性分子
C.该反应中NH3的配位能力大于氯
D.Al2Br6比Al2Cl6更难与NH3发生反应
考点3 晶体结构与性质
11.(2023北京,1,3分)中国科学家首次成功制得大面积单晶石墨炔,是碳材料科学的一大进步。
金刚石 石墨 石墨炔
下列关于金刚石、石墨、石墨炔的说法正确的是 ( )
A.三种物质中均有碳碳原子间的σ键
B.三种物质中的碳原子都是sp3杂化
C.三种物质的晶体类型相同
D.三种物质均能导电
12.(2022湖北,9,3分)某立方卤化物可用于制作光电材料,其晶胞结构如图所示。下列说法错误的是( )
A.Ca2+的配位数为6
B.与F-距离最近的是K+
C.该物质的化学式为KCaF3
D.若F-换为Cl-,则晶胞棱长将改变
13.(2023湖南,11,3分)科学家合成了一种高温超导材料,其晶胞结构如图所示,该立方晶胞参数为a pm。阿伏加德罗常数的值为NA。下列说法错误的是 ( )
A.晶体最简化学式为KCaB6C6
B.晶体中与K+最近且距离相等的Ca2+有8个
C.晶胞中B和C原子构成的多面体有12个面
D.晶体的密度为 g·cm-3
14.(2023辽宁,14,3分)晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是( )
A.图1晶体密度为72.5/(NA×a3×10-30) g·cm-3
B.图1中O原子的配位数为6
C.图2表示的化学式为LiMg2OClxBr1-x
D.Mg2+取代产生的空位有利于Li+传导
15.(2023湖北,15,3分)镧La和H可以形成一系列晶体材料LaHn,在储氢和超导等领域具有重要应用。LaHn属于立方晶系,晶胞结构和参数如图所示。高压下,LaH2中的每个H结合4个H形成类似CH4的结构,即得到晶体LaHx。下列说法错误的是( )
A.LaH2晶体中La的配位数为8
B.晶体中H和H的最短距离:LaH2>LaHx
C.在LaHx晶胞中,H形成一个顶点数为40的闭合多面体笼
D.LaHx单位体积中含氢质量的计算式为 g·cm-3
16.(2020全国Ⅰ,15分)Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)基态Fe2+与Fe3+离子中未成对的电子数之比为 。
(2)Li及其周期表中相邻元素的第一电离能(I1)如表所示。I1(Li)>I1(Na),原因是 。I1(Be)>I1(B)>I1(Li),原因是
。
I1/(kJ·mol-1)
Li 520 Be 900 B 801 Na 496 Mg 738 Al 578
(3)磷酸根离子的空间构型为 ,其中P的价层电子对数为 、杂化轨道类型为 。
(4)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有 个。
电池充电时,LiFePO4脱出部分Li+,形成Li1-xFePO4,结构示意图如(b)所示,则x= ,n(Fe2+)∶n(Fe3+)= 。
考法强化练
考法1 杂化轨道类型及分子极性的判断
1.(2023山东,3,2分)下列分子属于极性分子的是 ( )
A.CS2 B.NF3
C.SO3 D.SiF4
2.(2022辽宁,7,3分)理论化学模拟得到一种离子,结构如图。下列关于该离子的说法错误的是( )
A.所有原子均满足8电子结构
B.N原子的杂化方式有2种
C.空间结构为四面体形
D.常温下不稳定
3.(2023新课标,12,6分)“肼合成酶”以其中的Fe2+配合物为催化中心,可将NH2OH与NH3转化为肼(NH2NH2),其反应历程如下所示。
下列说法错误的是( )
A.NH2OH、NH3和H2O均为极性分子
B.反应涉及N—H、N—O键断裂和N—N键生成
C.催化中心的Fe2+被氧化为Fe3+,后又被还原为Fe2+
D.将NH2OH替换为ND2OD,反应可得ND2ND2
4.(2023新课标,9,6分)一种可吸附甲醇的材料,其化学式为[C(NH2)3]4[B(OCH3)4]3Cl,部分晶体结构如下图所示,其中[C(NH2)3]+为平面结构。
下列说法正确的是( )
A.该晶体中存在N—H…O氢键
B.基态原子的第一电离能:C
考法2 键参数大小的比较 大π键分析
5.(2022北京,9,3分)由键能数据大小,不能解释下列事实的是( )
化学键 C—H Si—H C—O Si—O C—C Si—Si
键能/ kJ·mol-1 411 318 799 358 452 346 222
A.稳定性:CH4>SiH4
B.键长:
6.(2023北京,10,3分)下列事实不能通过比较氟元素和氯元素的电负性进行解释的是( )
A.F—F键的键能小于Cl—Cl键的键能
B.三氟乙酸的Ka大于三氯乙酸的Ka
C.氟化氢分子的极性强于氯化氢分子的极性
D.气态氟化氢中存在(HF)2,而气态氯化氢中是 HCl分子
7.(2023湖北,9,3分)价层电子对互斥理论可以预测某些微粒的空间结构。下列说法正确的是( )
A.CH4和H2O的VSEPR模型均为四面体
B.S和C的空间构型均为平面三角形
C.CF4和SF4均为非极性分子
D.XeF2与XeO2的键角相等
8.(2023山东,5,2分)石墨与F2在450 ℃反应,石墨层间插入F得到层状结构化合物(CF)x,该物质仍具润滑性,其单层局部结构如图所示。下列关于该化合物的说法正确的是 ( )
A.与石墨相比,(CF)x导电性增强
B.与石墨相比,(CF)x抗氧化性增强
C.(CF)x中C—C的键长比C—F短
D.1 mol (CF)x中含有2x mol共价单键
考法3 物质熔、沸点高低的比较
9.(2023湖北,11,3分)物质结构决定物质性质。下列性质差异与结构因素匹配错误的是( )
性质差异 结构因素
A 沸点:正戊烷(36.1 ℃)高于新戊烷(9.5 ℃) 分子间作用力
B 熔点:AlF3(1 040 ℃)远高于AlCl3(178 ℃升华) 晶体类型
C 酸性:CF3COOH(pKa=0.23)远强于CH3COOH(pKa=4.76) 羟基极性
D 溶解度(20 ℃):Na2CO3(29 g)大于NaHCO3(8 g) 阴离子电荷
10.(2022全国乙,35节选)卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
卤化物CsICl2受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为 。解释X的熔点比Y高的原因 。
11.(2022福建,14,10分)1962年首个稀有气体化合物XePtF6问世,目前已知的稀有气体化合物中,含氙(54Xe)的最多,氪(36Kr)次之,氩(18Ar)化合物极少。[BrOF2][AsF6]·xKrF2是[BrOF2]+、[AsF6]-与KrF2分子形成的加合物,其晶胞如下图所示。
回答下列问题:
(1)基态As原子的价电子排布式为 。
(2)Ar、Kr、Xe原子的活泼性依序增强,原因是 。
(3)晶体熔点:KrF2 XeF2(填“>”“<”或“=”),判断依据是 。
12.(2022浙江1月选考,26,4分)(1)两种有机物的相关数据如下表:
物质 HCON(CH3)2 HCONH2
相对分子质量 73 45
沸点/℃ 153 220
HCON(CH3)2的相对分子质量比HCONH2的大,但其沸点反而比HCONH2的低,主要原因是 。
(2)四种晶体的熔点数据如下表:
物质 CF4 SiF4 BF3 AlF3
熔点/℃ -183 -90 -127 >1 000
CF4和SiF4熔点相差较小,BF3和AlF3熔点相差较大,原因是 。
三年模拟
考点强化练
考点1 化学键
1.(2024届广东一调,2)下列化学用语正确的是( )
A.H2O2的电子式:H+[····]2-H+
B.CO2的结构式:
C.中子数为18的Cl原子Cl
D.基态碳原子的最外层电子排布图:
↑
↑ ↑ ↑
2.(2024届深圳宝安一调,4)下列说法或化学用语表述正确的是( )
A.N2的电子式:NN
B.CH2Cl2中的共价键类型:非极性键和极性键
C.CO2的空间结构:V形
D.反-2-丁烯的结构简式:
3.(2024届广东实验中学10月月考,5)已知:Na2O2与H2O反应生成NaOH和O2,CaH2与H2O反应生成Ca(OH)2和H2。下列有关说法正确的是( )
A.Na2O2的电子式为Na+[····]2-Na+
B.CaH2中有非极性共价键
C.CaH2与H2O反应中H2O作氧化剂
D.当两个反应转移的电子数相同时,产生的O2和H2物质的量相同
考点2 分子结构与性质
4.(2023惠州三调,8改编)资源化利用CO2是实现“碳中和”的重要途径,CO2光催化转化为CH4的方法入选了2020年世界十大科技进展,其原理为CO2+4H2 CH4+2H2O。下列有关CO2、CH4的说法正确的是( )
A.CO2的空间结构是V形
B.CH4是极性分子
C.电负性:O>C
D.CO2转化为CH4体现了CO2的还原性
5.(2024届广州阶段训练,10)陈述Ⅰ和Ⅱ均正确,且具有因果关系的是( )
选项 陈述Ⅰ 陈述Ⅱ
A 电负性:F>Cl 酸性:CF3COOH
C 分子极性:CO>N2 范德华力:CO
6.(2024届湖北武汉六中第一次月考,8)北京大学的科技工作者在金(111)表面进行生长的二维双层冰的边缘结构实现了成像观察,二维冰层的AFM表征细节(图1)及其结构模型(图2)如下,该成果发表在2020年1月的《Nature》上。下列说法正确的是( )
图1 图2
A.气相水分子、“准液体”水分子和固态水分子属于三种不同的化合物
B.固态水分子之间的化学键较强,“准液体”水分子之间的化学键较弱
C.由于水分子间的氢键比较牢固,使水分子很稳定,高温下也难分解
D.受到能量激发时“准液体”的水分子与下层固态水分子脱离,使冰面变滑
7.(2024届江苏常熟中学阶段检测,5)元素周期表中第ⅤA族元素及其化合物应用广泛。氨是重要的化工原料,工业合成氨反应中每生成1 mol NH3,释放92.3 kJ热量。“长征二号”运载火箭采用C2H8O2/N2O4作发动机推进剂,燃烧产物无污染。LiFePO4常作锂电池的正极材料,电池充电时,LiFePO4脱出部分Li+,形成Li1-xFePO4。砷化镓(GaAs)是制备第三代半导体材料Ga2O3的重要原料。下列说法正确的是( )
A.NH3和NCl3都是非极性分子
B.1 mol磷酸根离子中含4 mol σ键
C.Fe2+的价层电子排布式为3d54s1
D.GaAs晶胞如图,距离As原子最近的As原子的数目为4
考点3 晶体结构与性质
8.(2023广州一模,4)四氯化锗(GeCl4)是光导纤维的常用掺杂剂,锗与硅同族。下列说法不正确的是( )
A.基态Ge原子价层电子排布式为4s24p2
B.GeCl4的熔点比SiCl4低
C.GeCl4的空间结构为正四面体
D.第一电离能:Cl>Si>Ge
9.(2024届河源中学一调,10)某种新型储氢材料的立方晶胞如图所示,该晶体由[Fe(NH3)6]n+和[BH4]-形成,晶胞参数为a pm。
下列说法不正确的是( )
A.[Fe(NH3)6]n+中n=2
B.晶胞中[Fe(NH3)6]n+和[BH4]-的配位数分别为8和4
C.晶胞中距离最近的2个[Fe(NH3)6]n+之间的距离为 pm
D.[BH4]-中心原子的杂化方式为sp3杂化
10.(2024届广东湛江调研,11)钛酸钡是太阳能电池材料。经X射线衍射分析测定,钛酸钡的晶胞结构如图所示(Ti4+、Ba2+均与O2-接触),已知晶胞边长为a pm,O2-的半径为b pm,NA为阿伏加德罗常数的值。下列叙述错误的是( )
A.与Ba2+等距离且最近的Ti4+有8个
B.Ti4+的半径为 pm
C.钛酸钡的化学式为BaTiO3
D.钛酸钡的密度ρ=×1021 g·cm-3
11.(2024届广东四校第一次联考,18节选)(5)①一种钴的氧化物的晶胞结构如图所示,该氧化物中钴离子的价层电子轨道表示式为 。
②该氧化物中氧离子的配位数是 。
③设NA为阿伏加德罗常数的值,晶体密度为d g/cm3,该晶体中距离最近的两个钴离子之间的距离为 pm。
考法综合练
考法1 杂化轨道类型及分子极性的判断
1.(2023广州二模,10)硒(Se)是人体必需微量元素之一,已知Se与S同族,一种含硒的功能分子的合成路线如下,下列说法不正确的是 ( )
A.沸点:H2O>H2Se>H2S
B.Ⅰ中S原子的杂化轨道类型为sp3
C.Ⅱ中含有极性共价键和非极性共价键
D.Ⅲ含有的元素中O的第一电离能最大
2.(2023佛山一模,5)连花清瘟胶囊的有效成分大黄素的结构如图所示,该成分有很强的抗炎抗菌药理活性,基于结构视角,下列说法正确的是( )
A.该分子中碳原子的杂化类型均为sp2
B.大黄素中所含元素的电负性O>C>H
C.基态氧原子核外电子的空间运动状态有8种
D.该分子为非极性分子
3.(2023广东二模,4)一种具有荧光性能的配合物的结构如图所示。下列有关该配合物的说法不正确的是( )
A.配位原子为N、O
B.碳原子的杂化方式为sp2、sp3
C.基态N原子核外有5种空间运动状态的电子
D.配体中含有两个手性碳原子
4.(2023深圳二调,18节选)(6)铑锰催化剂可催化反应:CO2+4H2 CH4+2H2O。下列有关该反应的说法正确的是 (填标号)。
A.存在极性共价键的断裂与形成
B.所有分子均为非极性分子
C.含碳化合物中心原子杂化轨道类型有sp与sp3
D.H2O的VSEPR模型为V形
E.催化剂可降低该反应的焓变,从而增大反应速率
考法2 键参数大小的比较 大π键分析
5.(2023江苏南通二调,5)下列说法正确的是( )
A.BrCl、CCl4都是由极性键构成的非极性分子
B.Cl中的键角大于C中的键角
C.溴元素位于元素周期表第四周期第ⅤA族
D.F、Cl、Br、I的第一电离能逐渐减小
6.(2023湛江一模,11)乙二胺()是一种重要的有机化工原料,下列关于乙二胺的说法不正确的是( )
A.易溶于水,其水溶液显碱性
B.H—C—H键角大于H—N—H键角
C.第二周期中第一电离能大于C小于N的元素只有一种
D.[Cu(H2NCH2CH2NH2)2]2+中,提供孤电子对形成配位键的是Cu2+
7.(2024届广东六校第一次联考,11)X、Y、Z、W为原子序数依次增大的前四周期元素,基态原子中,X为元素周期表中半径最小的原子,Z是地壳中含量最多的元素,W原子的价层电子排布为3d104s1,X、Y、Z、W形成的阳离子如图所示,下列说法正确的是( )
A.原子半径:Z>Y>X
B.该阳离子中心离子的配位数为6
C.氢化物的沸点:Z>Y
D.两种配体中的键角:X2Z>YX3
8.(2023福建龙岩三模,14节选)硅在地壳中含量丰富,晶体硅与硅化物等新材料在现代工业领域作用巨大。回答下列问题:
(2)SiCl4可发生水解反应,机理如图所示。
①a与c的水溶性:a c(填“>”“<”或“=”),理由是 。
②c分子中氧原子的杂化方式为 ;c分子中键长从大到小顺序为 。
考法3 物质熔、沸点高低的比较
9.(2023广东四校联考,5)铬离子能形成多种配位化合物,下列关于说法正确的是( )
A.[Cr(NH3)3(H2O)2Cl]2+中Cr的化合价为+2
B.[Cr(NH3)3(H2O)2Cl]2+中铬离子的配位数是5
C.NH3的沸点比H2O的低
D.NH3与H2O的键角相同
10.(2023深圳一模,6)“结构决定性质”是化学学科的核心观念。下列有关性质的比较正确的是 ( )
A.在水中的溶解度:戊醇<乙醇
B.熔点:MgO
D.第一电离能:Cl
微专题 晶胞结构分析与计算
1.(2023广东一模,9)一种锂的氧化物的晶胞结构如图所示(晶胞参数a=b=c=0.466 5 nm,晶胞棱边夹角均为90°)。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。下列有关说法不正确的是( )
A.该氧化物的化学式为Li2O
B.O原子之间的最短距离为×466.5 pm
C.与Li距离最近且相等的O有8个
D.若p原子的分数坐标为()
2.(2022北京,15节选)工业中可利用生产钛白的副产物FeSO4·7H2O和硫铁矿(FeS2)联合制备铁精粉(FexOy)和硫酸,实现能源及资源的有效利用。
(2)FeS2晶体的晶胞形状为立方体,边长为a nm,结构如图。
①距离Fe2+最近的阴离子有 个。
②FeS2的摩尔质量为120 g·mol-1,阿伏加德罗常数的值为NA。该晶体的密度为 g·cm-3。(1 nm=10-9 m)
3.(2023广州天河综合测试二,18节选)(4)氧铬酸钙是一种常见含铬矿石,其立方晶胞如图所示。
①氧铬酸钙的化学式为 。
②1个钙原子与 个氧原子最近且等距离。
③该晶体密度为 g·cm-3(列出计算式即可,已知Ca和O的最近距离为a nm,NA代表阿伏加德罗常数的值)。
4.(2023茂名一模,16)锗及其化合物广泛用于半导体、催化剂、光伏、制药工业。回答下列问题:
(1)锗的基态原子核外电子排布式为 。
(2)硅、锗、铅的氯化物的熔点如下表:
物质 SiCl4 GeCl4 PbCl4
熔点/℃ -70 约-50 -15
①GeCl4分子的空间结构为 。
②熔点:SiCl4
该有机配合物中锗的配位数为 ,其阴离子中C、Ge、O元素的第一电离能从大到小的顺序为 。
(4)一种含锗的化合物应用于太阳能电池,其晶胞为长方体,结构如图(a):
①该锗化合物晶胞的表示方式有多种,图中 (填“b”“c”或“d”)图也能表示此化合物的晶胞。
②用NA表示阿伏加德罗常数的数值,计算晶体(a)密度为 g·cm-3(用含x、y、z和NA的式子表示)。
5.(2023浙江1月选考,17,10分)硅材料在生活中占有重要地位。
请回答:
(1)Si(NH2)4分子的空间结构(以Si为中心)名称为 ,分子中氮原子的杂化轨道类型是 。Si(NH2)4受热分解生成Si3N4和NH3,其受热不稳定的原因是 。
(2)由硅原子核形成的三种微粒,电子排布式分别为:①[Ne]3s23p2、②[Ne]3s23p1、③[Ne]3s23p14s1,有关这些微粒的叙述,正确的是 。
A.微粒半径:③>①>②
B.电子排布属于基态原子(或离子)的是:①②
C.电离一个电子所需最低能量:①>②>③
D.得电子能力:①>②
(3)Si与P形成的某化合物晶体的晶胞如图。该晶体类型是 ,该化合物的化学式为 。
6.(2023全国甲,35,15分)将酞菁—钴酞菁—三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催化剂。回答下列问题:
(1)图1所示的几种碳单质,它们互为 ,其中属于原子晶体的是 ,C60间的作用力是 。
图1
(2)酞菁和钴酞菁的分子结构如图2所示。
图2
酞菁分子中所有原子共平面,其中p轨道能提供一对电子的N原子是 (填图2酞菁中N原子的标号)。钴酞菁分子中,钴离子的化合价为 ,氮原子提供孤对电子与钴离子形成 键。
(3)气态AlCl3通常以二聚体Al2Cl6的形式存在,其空间结构如图3a所示,二聚体中Al的轨道杂化类型为 。AlF3的熔点为1 090 ℃,远高于AlCl3的192 ℃,由此可以判断铝氟之间的化学键为 键。AlF3结构属立方晶系,晶胞如图3b所示,F-的配位数为 。若晶胞参数为a pm,晶体密度ρ= g·cm-3(列出计算式,阿伏加德罗常数的值为NA)。
7.(2022广东,20,14分)硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(AIE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子Ⅳ的合成路线如下:
(1)Se与S同族,基态硒原子价电子排布式为 。
(2)H2Se的沸点低于H2O,其原因是 。
(3)关于Ⅰ~Ⅲ三种反应物,下列说法正确的有 。
A.Ⅰ中仅有σ键
B.Ⅰ中的Se—Se键为非极性共价键
C.Ⅱ易溶于水
D.Ⅱ中原子的杂化轨道类型只有sp与sp2
E.Ⅰ~Ⅲ含有的元素中,O电负性最大
(4)Ⅳ中具有孤对电子的原子有 。
(5)硒的两种含氧酸的酸性强弱为H2SeO4 H2SeO3(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(Na2SeO4)可减轻重金属铊引起的中毒。Se的立体构型为 。
(6)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图a,沿x、y、z轴方向的投影均为图b。
图a
图b
①X的化学式为 。
②设X的最简式的式量为Mr,晶体密度为ρ g·cm-3,则X中相邻K之间的最短距离为 nm(列出计算式,NA为阿伏加德罗常数的值)。
8.(2021广东,20,14分)很多含巯基(—SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物Ⅱ。
(1)基态硫原子价电子排布式为 。
(2)H2S、CH4、H2O的沸点由高到低顺序为 。
(3)汞的原子序数为80,位于元素周期表第 周期第ⅡB族。
(4)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有 。
A.在Ⅰ中S原子采取sp3杂化
B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C—C—C键角是180°
D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物Ⅰ与化合物Ⅲ相比,水溶性较好的是 。
(6)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。
①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是 。
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为 ;该晶胞中粒子个数比Hg∶Ge∶Sb= 。
③设X的最简式的式量为Mr,则X晶体的密度为 g/cm3(列出算式)。
9.(2019课标Ⅰ,35,15分)在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要材料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是 (填标号)。
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是 、 。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是 ,其中与乙二胺形成的化合物稳定性相对较高的是 (填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如下表所示:
氧化物 Li2O MgO P4O6 SO2
熔点/℃ 1 570 2 800 23.8 -75.5
解释表中氧化物之间熔点差异的原因
(4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x= pm,Mg原子之间最短距离y= pm。设阿伏加德罗常数的值为NA,则MgCu2的密度是 g·cm-3(列出计算表达式)。
10.(2022河北,17,15分)含Cu、Zn、Sn及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
(1)基态S原子的价电子中,两种自旋状态的电子数之比为 。
(2)Cu与Zn相比,第二电离能与第一电离能差值更大的是 ,原因是 。
(3)SnC的几何构型为 ,其中心离子杂化方式为 。
(4)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是 (填标号)。
A.[Cu(NH3)2]Cl
B.[Cu(NH3)4]SO4
C.[Zn(NH3)4]SO4
D.Na2[Zn(OH)4]
(5)下图是硫的四种含氧酸根的结构:
根据组成和结构推断,能在酸性溶液中将Mn2+转化为Mn的是 (填标号),理由是 。
(6)下图是CZTS四元半导体化合物的四方晶胞。
①该物质的化学式为 。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中A原子的坐标为(),则B原子的坐标为 。
专题八 化学键 分子和晶体的结构与性质
五年高考
考点过关练
考点1 化学键
1.(2022湖南,2,3分)下列说法错误的是( )
A.氢键、离子键和共价键都属于化学键
B.化学家门捷列夫编制了第一张元素周期表
C.药剂师和营养师必须具备化学相关专业知识
D.石灰石是制造玻璃和水泥的主要原料之一
答案 A
2.(2023浙江6月选考,2,3分)下列化学用语表示正确的是( )
A.H2S分子的球棍模型:
B.AlCl3的价层电子对互斥模型:
C.KI的电子式:K····
D.CH3CH(CH2CH3)2的名称:3-甲基戊烷
答案 D
3.(2023辽宁,2,3分)下列化学用语或表述正确的是( )
A.BeCl2的空间结构:V形
B.P4中的共价键类型:非极性键
C.基态Ni原子价电子排布式:3d10
D.顺-2-丁烯的结构简式:
答案 B
4.(2023江苏,2,3分)反应NH4Cl+NaNO2 NaCl+N2↑+2H2O应用于石油开采。下列说法正确的是( )
A.N的电子式为H····H
B.N中N元素的化合价为+5
C.N2分子中存在键
D.H2O为非极性分子
答案 C
5.(2022重庆,2,3分)BCl3水解反应方程式为BCl3+3H2O B(OH)3+3HCl,下列说法错误的是( )
A.Cl的原子结构示意图为
B.H2O的空间填充模型为
C.BCl3的电子式为····
D.B(OH)3的结构简式为
答案 C
考点2 分子结构与性质
6.(2023江苏,5,3分)下列说法正确的是( )
A. H都属于氢元素
B.N和H2O的中心原子轨道杂化类型均为sp2
C.H2O2分子中的化学键均为极性共价键
D.CaH2晶体中存在Ca与H2之间的强烈相互作用
答案 A
7.(2023江苏,7,3分)下列物质结构与性质或物质性质与用途具有对应关系的是( )
A.H2具有还原性,可作为氢氧燃料电池的燃料
B.氨极易溶于水,液氨可用作制冷剂
C.H2O分子之间形成氢键,H2O(g)的热稳定性比H2S(g)的高
D.N2H4中的N原子与H+形成配位键,N2H4具有还原性
答案 A
8.(2022江苏,2,3分)少量Na2O2与H2O反应生成H2O2和NaOH。下列说法正确的是( )
A.Na2O2的电子式为Na+[····]2-Na+
B.H2O的空间构型为直线形
C.H2O2中O元素的化合价为-1
D.NaOH仅含离子键
答案 C
9.(2023湖南,4,3分)下列有关物质结构和性质的说法错误的是( )
A.含有手性碳原子的分子叫做手性分子
B.邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点
C.酰胺在酸或碱存在并加热的条件下可发生水解反应
D.冠醚(18-冠-6)的空穴与K+尺寸适配,两者能通过弱相互作用形成超分子
答案 A
10.(2023浙江1月选考,12,3分)共价化合物Al2Cl6中所有原子均满足8电子稳定结构,一定条件下可发生反应:Al2Cl6+2NH3 2Al(NH3)Cl3,下列说法不正确的是( )
A.Al2Cl6的结构式为
B.Al2Cl6为非极性分子
C.该反应中NH3的配位能力大于氯
D.Al2Br6比Al2Cl6更难与NH3发生反应
答案 D
考点3 晶体结构与性质
11.(2023北京,1,3分)中国科学家首次成功制得大面积单晶石墨炔,是碳材料科学的一大进步。
金刚石 石墨 石墨炔
下列关于金刚石、石墨、石墨炔的说法正确的是 ( )
A.三种物质中均有碳碳原子间的σ键
B.三种物质中的碳原子都是sp3杂化
C.三种物质的晶体类型相同
D.三种物质均能导电
答案 A
12.(2022湖北,9,3分)某立方卤化物可用于制作光电材料,其晶胞结构如图所示。下列说法错误的是( )
A.Ca2+的配位数为6
B.与F-距离最近的是K+
C.该物质的化学式为KCaF3
D.若F-换为Cl-,则晶胞棱长将改变
答案 B
13.(2023湖南,11,3分)科学家合成了一种高温超导材料,其晶胞结构如图所示,该立方晶胞参数为a pm。阿伏加德罗常数的值为NA。下列说法错误的是 ( )
A.晶体最简化学式为KCaB6C6
B.晶体中与K+最近且距离相等的Ca2+有8个
C.晶胞中B和C原子构成的多面体有12个面
D.晶体的密度为 g·cm-3
答案 C
14.(2023辽宁,14,3分)晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是( )
A.图1晶体密度为72.5/(NA×a3×10-30) g·cm-3
B.图1中O原子的配位数为6
C.图2表示的化学式为LiMg2OClxBr1-x
D.Mg2+取代产生的空位有利于Li+传导
答案 C
15.(2023湖北,15,3分)镧La和H可以形成一系列晶体材料LaHn,在储氢和超导等领域具有重要应用。LaHn属于立方晶系,晶胞结构和参数如图所示。高压下,LaH2中的每个H结合4个H形成类似CH4的结构,即得到晶体LaHx。下列说法错误的是( )
A.LaH2晶体中La的配位数为8
B.晶体中H和H的最短距离:LaH2>LaHx
C.在LaHx晶胞中,H形成一个顶点数为40的闭合多面体笼
D.LaHx单位体积中含氢质量的计算式为 g·cm-3
答案 C
16.(2020全国Ⅰ,15分)Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)基态Fe2+与Fe3+离子中未成对的电子数之比为 。
(2)Li及其周期表中相邻元素的第一电离能(I1)如表所示。I1(Li)>I1(Na),原因是 。I1(Be)>I1(B)>I1(Li),原因是
。
I1/(kJ·mol-1)
Li 520 Be 900 B 801 Na 496 Mg 738 Al 578
(3)磷酸根离子的空间构型为 ,其中P的价层电子对数为 、杂化轨道类型为 。
(4)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有 个。
电池充电时,LiFePO4脱出部分Li+,形成Li1-xFePO4,结构示意图如(b)所示,则x= ,n(Fe2+)∶n(Fe3+)= 。
答案 (1) 13∶3
考法强化练
考法1 杂化轨道类型及分子极性的判断
1.(2023山东,3,2分)下列分子属于极性分子的是 ( )
A.CS2 B.NF3
C.SO3 D.SiF4
答案 B
2.(2022辽宁,7,3分)理论化学模拟得到一种离子,结构如图。下列关于该离子的说法错误的是( )
A.所有原子均满足8电子结构
B.N原子的杂化方式有2种
C.空间结构为四面体形
D.常温下不稳定
答案 B
3.(2023新课标,12,6分)“肼合成酶”以其中的Fe2+配合物为催化中心,可将NH2OH与NH3转化为肼(NH2NH2),其反应历程如下所示。
下列说法错误的是( )
A.NH2OH、NH3和H2O均为极性分子
B.反应涉及N—H、N—O键断裂和N—N键生成
C.催化中心的Fe2+被氧化为Fe3+,后又被还原为Fe2+
D.将NH2OH替换为ND2OD,反应可得ND2ND2
答案 D
4.(2023新课标,9,6分)一种可吸附甲醇的材料,其化学式为[C(NH2)3]4[B(OCH3)4]3Cl,部分晶体结构如下图所示,其中[C(NH2)3]+为平面结构。
下列说法正确的是( )
A.该晶体中存在N—H…O氢键
B.基态原子的第一电离能:C
答案 A
考法2 键参数大小的比较 大π键分析
5.(2022北京,9,3分)由键能数据大小,不能解释下列事实的是( )
化学键 C—H Si—H C—O Si—O C—C Si—Si
键能/ kJ·mol-1 411 318 799 358 452 346 222
A.稳定性:CH4>SiH4
B.键长:
答案 C
6.(2023北京,10,3分)下列事实不能通过比较氟元素和氯元素的电负性进行解释的是( )
A.F—F键的键能小于Cl—Cl键的键能
B.三氟乙酸的Ka大于三氯乙酸的Ka
C.氟化氢分子的极性强于氯化氢分子的极性
D.气态氟化氢中存在(HF)2,而气态氯化氢中是 HCl分子
答案 A
7.(2023湖北,9,3分)价层电子对互斥理论可以预测某些微粒的空间结构。下列说法正确的是( )
A.CH4和H2O的VSEPR模型均为四面体
B.S和C的空间构型均为平面三角形
C.CF4和SF4均为非极性分子
D.XeF2与XeO2的键角相等
答案 A
8.(2023山东,5,2分)石墨与F2在450 ℃反应,石墨层间插入F得到层状结构化合物(CF)x,该物质仍具润滑性,其单层局部结构如图所示。下列关于该化合物的说法正确的是 ( )
A.与石墨相比,(CF)x导电性增强
B.与石墨相比,(CF)x抗氧化性增强
C.(CF)x中C—C的键长比C—F短
D.1 mol (CF)x中含有2x mol共价单键
答案 B
考法3 物质熔、沸点高低的比较
9.(2023湖北,11,3分)物质结构决定物质性质。下列性质差异与结构因素匹配错误的是( )
性质差异 结构因素
A 沸点:正戊烷(36.1 ℃)高于新戊烷(9.5 ℃) 分子间作用力
B 熔点:AlF3(1 040 ℃)远高于AlCl3(178 ℃升华) 晶体类型
C 酸性:CF3COOH(pKa=0.23)远强于CH3COOH(pKa=4.76) 羟基极性
D 溶解度(20 ℃):Na2CO3(29 g)大于NaHCO3(8 g) 阴离子电荷
答案 D
10.(2022全国乙,35节选)卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
卤化物CsICl2受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为 。解释X的熔点比Y高的原因 。
答案 CsCl CsCl是离子晶体,熔化时需要克服Cs+和Cl-之间的离子键,而ICl是分子晶体,熔化时只需要克服范德华力
11.(2022福建,14,10分)1962年首个稀有气体化合物XePtF6问世,目前已知的稀有气体化合物中,含氙(54Xe)的最多,氪(36Kr)次之,氩(18Ar)化合物极少。[BrOF2][AsF6]·xKrF2是[BrOF2]+、[AsF6]-与KrF2分子形成的加合物,其晶胞如下图所示。
回答下列问题:
(1)基态As原子的价电子排布式为 。
(2)Ar、Kr、Xe原子的活泼性依序增强,原因是 。
(3)晶体熔点:KrF2 XeF2(填“>”“<”或“=”),判断依据是 。
答案 (1)4s24p3
(2)同主族元素,从上而下原子半径逐渐增大,原子核对外层电子的有效吸引逐渐减弱,失电子能力逐渐增强
(3)< 二者为同构型的分子晶体,XeF2相对分子质量大,范德华力大,熔点高
12.(2022浙江1月选考,26,4分)(1)两种有机物的相关数据如下表:
物质 HCON(CH3)2 HCONH2
相对分子质量 73 45
沸点/℃ 153 220
HCON(CH3)2的相对分子质量比HCONH2的大,但其沸点反而比HCONH2的低,主要原因是 。
(2)四种晶体的熔点数据如下表:
物质 CF4 SiF4 BF3 AlF3
熔点/℃ -183 -90 -127 >1 000
CF4和SiF4熔点相差较小,BF3和AlF3熔点相差较大,原因是 。
答案 (1)HCON(CH3)2分子间只有一般的分子间作用力,HCONH2分子间存在氢键,破坏一般的分子间作用力更容易,所以沸点低
(2)CF4和SiF4都是分子晶体,结构相似,分子间作用力相差较小,所以熔点相差较小;BF3通过分子间作用力形成分子晶体,AlF3通过离子键形成离子晶体,破坏离子键需要能量多得多,所以熔点相差较大
三年模拟
考点强化练
考点1 化学键
1.(2024届广东一调,2)下列化学用语正确的是( )
A.H2O2的电子式:H+[····]2-H+
B.CO2的结构式:
C.中子数为18的Cl原子Cl
D.基态碳原子的最外层电子排布图:
↑
↑ ↑ ↑
答案 B
2.(2024届深圳宝安一调,4)下列说法或化学用语表述正确的是( )
A.N2的电子式:NN
B.CH2Cl2中的共价键类型:非极性键和极性键
C.CO2的空间结构:V形
D.反-2-丁烯的结构简式:
答案 D
3.(2024届广东实验中学10月月考,5)已知:Na2O2与H2O反应生成NaOH和O2,CaH2与H2O反应生成Ca(OH)2和H2。下列有关说法正确的是( )
A.Na2O2的电子式为Na+[····]2-Na+
B.CaH2中有非极性共价键
C.CaH2与H2O反应中H2O作氧化剂
D.当两个反应转移的电子数相同时,产生的O2和H2物质的量相同
答案 C
考点2 分子结构与性质
4.(2023惠州三调,8改编)资源化利用CO2是实现“碳中和”的重要途径,CO2光催化转化为CH4的方法入选了2020年世界十大科技进展,其原理为CO2+4H2 CH4+2H2O。下列有关CO2、CH4的说法正确的是( )
A.CO2的空间结构是V形
B.CH4是极性分子
C.电负性:O>C
D.CO2转化为CH4体现了CO2的还原性
答案 C
5.(2024届广州阶段训练,10)陈述Ⅰ和Ⅱ均正确,且具有因果关系的是( )
选项 陈述Ⅰ 陈述Ⅱ
A 电负性:F>Cl 酸性:CF3COOH
C 分子极性:CO>N2 范德华力:CO
答案 B
6.(2024届湖北武汉六中第一次月考,8)北京大学的科技工作者在金(111)表面进行生长的二维双层冰的边缘结构实现了成像观察,二维冰层的AFM表征细节(图1)及其结构模型(图2)如下,该成果发表在2020年1月的《Nature》上。下列说法正确的是( )
图1 图2
A.气相水分子、“准液体”水分子和固态水分子属于三种不同的化合物
B.固态水分子之间的化学键较强,“准液体”水分子之间的化学键较弱
C.由于水分子间的氢键比较牢固,使水分子很稳定,高温下也难分解
D.受到能量激发时“准液体”的水分子与下层固态水分子脱离,使冰面变滑
答案 D
7.(2024届江苏常熟中学阶段检测,5)元素周期表中第ⅤA族元素及其化合物应用广泛。氨是重要的化工原料,工业合成氨反应中每生成1 mol NH3,释放92.3 kJ热量。“长征二号”运载火箭采用C2H8O2/N2O4作发动机推进剂,燃烧产物无污染。LiFePO4常作锂电池的正极材料,电池充电时,LiFePO4脱出部分Li+,形成Li1-xFePO4。砷化镓(GaAs)是制备第三代半导体材料Ga2O3的重要原料。下列说法正确的是( )
A.NH3和NCl3都是非极性分子
B.1 mol磷酸根离子中含4 mol σ键
C.Fe2+的价层电子排布式为3d54s1
D.GaAs晶胞如图,距离As原子最近的As原子的数目为4
答案 B
考点3 晶体结构与性质
8.(2023广州一模,4)四氯化锗(GeCl4)是光导纤维的常用掺杂剂,锗与硅同族。下列说法不正确的是( )
A.基态Ge原子价层电子排布式为4s24p2
B.GeCl4的熔点比SiCl4低
C.GeCl4的空间结构为正四面体
D.第一电离能:Cl>Si>Ge
答案 B
9.(2024届河源中学一调,10)某种新型储氢材料的立方晶胞如图所示,该晶体由[Fe(NH3)6]n+和[BH4]-形成,晶胞参数为a pm。
下列说法不正确的是( )
A.[Fe(NH3)6]n+中n=2
B.晶胞中[Fe(NH3)6]n+和[BH4]-的配位数分别为8和4
C.晶胞中距离最近的2个[Fe(NH3)6]n+之间的距离为 pm
D.[BH4]-中心原子的杂化方式为sp3杂化
答案 C
10.(2024届广东湛江调研,11)钛酸钡是太阳能电池材料。经X射线衍射分析测定,钛酸钡的晶胞结构如图所示(Ti4+、Ba2+均与O2-接触),已知晶胞边长为a pm,O2-的半径为b pm,NA为阿伏加德罗常数的值。下列叙述错误的是( )
A.与Ba2+等距离且最近的Ti4+有8个
B.Ti4+的半径为 pm
C.钛酸钡的化学式为BaTiO3
D.钛酸钡的密度ρ=×1021 g·cm-3
答案 D
11.(2024届广东四校第一次联考,18节选)(5)①一种钴的氧化物的晶胞结构如图所示,该氧化物中钴离子的价层电子轨道表示式为 。
②该氧化物中氧离子的配位数是 。
③设NA为阿伏加德罗常数的值,晶体密度为d g/cm3,该晶体中距离最近的两个钴离子之间的距离为 pm。
答案 (5)①
↑↓ ↑↓ ↑ ↑ ↑
×1010
考法综合练
考法1 杂化轨道类型及分子极性的判断
1.(2023广州二模,10)硒(Se)是人体必需微量元素之一,已知Se与S同族,一种含硒的功能分子的合成路线如下,下列说法不正确的是 ( )
A.沸点:H2O>H2Se>H2S
B.Ⅰ中S原子的杂化轨道类型为sp3
C.Ⅱ中含有极性共价键和非极性共价键
D.Ⅲ含有的元素中O的第一电离能最大
答案 D
2.(2023佛山一模,5)连花清瘟胶囊的有效成分大黄素的结构如图所示,该成分有很强的抗炎抗菌药理活性,基于结构视角,下列说法正确的是( )
A.该分子中碳原子的杂化类型均为sp2
B.大黄素中所含元素的电负性O>C>H
C.基态氧原子核外电子的空间运动状态有8种
D.该分子为非极性分子
答案 B
3.(2023广东二模,4)一种具有荧光性能的配合物的结构如图所示。下列有关该配合物的说法不正确的是( )
A.配位原子为N、O
B.碳原子的杂化方式为sp2、sp3
C.基态N原子核外有5种空间运动状态的电子
D.配体中含有两个手性碳原子
答案 D
4.(2023深圳二调,18节选)(6)铑锰催化剂可催化反应:CO2+4H2 CH4+2H2O。下列有关该反应的说法正确的是 (填标号)。
A.存在极性共价键的断裂与形成
B.所有分子均为非极性分子
C.含碳化合物中心原子杂化轨道类型有sp与sp3
D.H2O的VSEPR模型为V形
E.催化剂可降低该反应的焓变,从而增大反应速率
答案 (6)AC
考法2 键参数大小的比较 大π键分析
5.(2023江苏南通二调,5)下列说法正确的是( )
A.BrCl、CCl4都是由极性键构成的非极性分子
B.Cl中的键角大于C中的键角
C.溴元素位于元素周期表第四周期第ⅤA族
D.F、Cl、Br、I的第一电离能逐渐减小
答案 D
6.(2023湛江一模,11)乙二胺()是一种重要的有机化工原料,下列关于乙二胺的说法不正确的是( )
A.易溶于水,其水溶液显碱性
B.H—C—H键角大于H—N—H键角
C.第二周期中第一电离能大于C小于N的元素只有一种
D.[Cu(H2NCH2CH2NH2)2]2+中,提供孤电子对形成配位键的是Cu2+
答案 D
7.(2024届广东六校第一次联考,11)X、Y、Z、W为原子序数依次增大的前四周期元素,基态原子中,X为元素周期表中半径最小的原子,Z是地壳中含量最多的元素,W原子的价层电子排布为3d104s1,X、Y、Z、W形成的阳离子如图所示,下列说法正确的是( )
A.原子半径:Z>Y>X
B.该阳离子中心离子的配位数为6
C.氢化物的沸点:Z>Y
D.两种配体中的键角:X2Z>YX3
答案 B
8.(2023福建龙岩三模,14节选)硅在地壳中含量丰富,晶体硅与硅化物等新材料在现代工业领域作用巨大。回答下列问题:
(2)SiCl4可发生水解反应,机理如图所示。
①a与c的水溶性:a c(填“>”“<”或“=”),理由是 。
②c分子中氧原子的杂化方式为 ;c分子中键长从大到小顺序为 。
答案 (2)①< c为极性分子且能与水分子形成氢键 ②sp3 Si—Cl>Si—O>H—O
考法3 物质熔、沸点高低的比较
9.(2023广东四校联考,5)铬离子能形成多种配位化合物,下列关于说法正确的是( )
A.[Cr(NH3)3(H2O)2Cl]2+中Cr的化合价为+2
B.[Cr(NH3)3(H2O)2Cl]2+中铬离子的配位数是5
C.NH3的沸点比H2O的低
D.NH3与H2O的键角相同
答案 C
10.(2023深圳一模,6)“结构决定性质”是化学学科的核心观念。下列有关性质的比较正确的是 ( )
A.在水中的溶解度:戊醇<乙醇
B.熔点:MgO
D.第一电离能:Cl
11.(2023湖南师大附中二模,17节选)(6)BiOCl是一种性能优良的光催化剂,可催化降解有机污染物对硝基苯酚()等。对硝基苯酚的熔点高于邻硝基苯酚()的熔点,其原因是 。
答案 (6)对硝基苯酚可形成分子间氢键,而邻硝基苯酚更易形成分子内氢键,导致对硝基苯酚分子间的作用力比邻硝基苯酚分子间的作用力更强
微专题 晶胞结构分析与计算
1.(2023广东一模,9)一种锂的氧化物的晶胞结构如图所示(晶胞参数a=b=c=0.466 5 nm,晶胞棱边夹角均为90°)。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。下列有关说法不正确的是( )
A.该氧化物的化学式为Li2O
B.O原子之间的最短距离为×466.5 pm
C.与Li距离最近且相等的O有8个
D.若p原子的分数坐标为()
答案 C
2.(2022北京,15节选)工业中可利用生产钛白的副产物FeSO4·7H2O和硫铁矿(FeS2)联合制备铁精粉(FexOy)和硫酸,实现能源及资源的有效利用。
(2)FeS2晶体的晶胞形状为立方体,边长为a nm,结构如图。
①距离Fe2+最近的阴离子有 个。
②FeS2的摩尔质量为120 g·mol-1,阿伏加德罗常数的值为NA。该晶体的密度为 g·cm-3。(1 nm=10-9 m)
答案 (2)①6 ②
3.(2023广州天河综合测试二,18节选)(4)氧铬酸钙是一种常见含铬矿石,其立方晶胞如图所示。
①氧铬酸钙的化学式为 。
②1个钙原子与 个氧原子最近且等距离。
③该晶体密度为 g·cm-3(列出计算式即可,已知Ca和O的最近距离为a nm,NA代表阿伏加德罗常数的值)。
答案 (4)①CaCrO3 ②12 ③
4.(2023茂名一模,16)锗及其化合物广泛用于半导体、催化剂、光伏、制药工业。回答下列问题:
(1)锗的基态原子核外电子排布式为 。
(2)硅、锗、铅的氯化物的熔点如下表:
物质 SiCl4 GeCl4 PbCl4
熔点/℃ -70 约-50 -15
①GeCl4分子的空间结构为 。
②熔点:SiCl4
该有机配合物中锗的配位数为 ,其阴离子中C、Ge、O元素的第一电离能从大到小的顺序为 。
(4)一种含锗的化合物应用于太阳能电池,其晶胞为长方体,结构如图(a):
①该锗化合物晶胞的表示方式有多种,图中 (填“b”“c”或“d”)图也能表示此化合物的晶胞。
②用NA表示阿伏加德罗常数的数值,计算晶体(a)密度为 g·cm-3(用含x、y、z和NA的式子表示)。
答案 (1)1s22s22p63s23p63d104s24p2或[Ar]3d104s24p2
(2)①正四面体形 ②三者均为分子晶体,随着相对分子质量增大,范德华力增强,物质的熔点逐渐升高
(3)6 O>C>Ge (4)①b ②×1021
5.(2023浙江1月选考,17,10分)硅材料在生活中占有重要地位。
请回答:
(1)Si(NH2)4分子的空间结构(以Si为中心)名称为 ,分子中氮原子的杂化轨道类型是 。Si(NH2)4受热分解生成Si3N4和NH3,其受热不稳定的原因是 。
(2)由硅原子核形成的三种微粒,电子排布式分别为:①[Ne]3s23p2、②[Ne]3s23p1、③[Ne]3s23p14s1,有关这些微粒的叙述,正确的是 。
A.微粒半径:③>①>②
B.电子排布属于基态原子(或离子)的是:①②
C.电离一个电子所需最低能量:①>②>③
D.得电子能力:①>②
(3)Si与P形成的某化合物晶体的晶胞如图。该晶体类型是 ,该化合物的化学式为 。
答案 (1)正四面体形 sp3 Si周围的NH2基团体积较大,受热时斥力较强[Si(NH2)4中Si—N键能相对较小];产物中气态分子数显著增多(熵增) (2)AB (3)共价晶体 SiP2
6.(2023全国甲,35,15分)将酞菁—钴酞菁—三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催化剂。回答下列问题:
(1)图1所示的几种碳单质,它们互为 ,其中属于原子晶体的是 ,C60间的作用力是 。
图1
(2)酞菁和钴酞菁的分子结构如图2所示。
图2
酞菁分子中所有原子共平面,其中p轨道能提供一对电子的N原子是 (填图2酞菁中N原子的标号)。钴酞菁分子中,钴离子的化合价为 ,氮原子提供孤对电子与钴离子形成 键。
(3)气态AlCl3通常以二聚体Al2Cl6的形式存在,其空间结构如图3a所示,二聚体中Al的轨道杂化类型为 。AlF3的熔点为1 090 ℃,远高于AlCl3的192 ℃,由此可以判断铝氟之间的化学键为 键。AlF3结构属立方晶系,晶胞如图3b所示,F-的配位数为 。若晶胞参数为a pm,晶体密度ρ= g·cm-3(列出计算式,阿伏加德罗常数的值为NA)。
答案 (1)同素异形体 金刚石 范德华力
(2)③ +2 配位
(3)sp3 离子 2 ×1030)
7.(2022广东,20,14分)硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(AIE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子Ⅳ的合成路线如下:
(1)Se与S同族,基态硒原子价电子排布式为 。
(2)H2Se的沸点低于H2O,其原因是 。
(3)关于Ⅰ~Ⅲ三种反应物,下列说法正确的有 。
A.Ⅰ中仅有σ键
B.Ⅰ中的Se—Se键为非极性共价键
C.Ⅱ易溶于水
D.Ⅱ中原子的杂化轨道类型只有sp与sp2
E.Ⅰ~Ⅲ含有的元素中,O电负性最大
(4)Ⅳ中具有孤对电子的原子有 。
(5)硒的两种含氧酸的酸性强弱为H2SeO4 H2SeO3(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(Na2SeO4)可减轻重金属铊引起的中毒。Se的立体构型为 。
(6)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图a,沿x、y、z轴方向的投影均为图b。
图a
图b
①X的化学式为 。
②设X的最简式的式量为Mr,晶体密度为ρ g·cm-3,则X中相邻K之间的最短距离为 nm(列出计算式,NA为阿伏加德罗常数的值)。
答案 (1)4s24p4 (2)H2O分子间形成氢键,H2Se分子间只有范德华力 (3)BDE (4)O、Se (5)> 正四面体形 (6)①K2SeBr6 ②×107
8.(2021广东,20,14分)很多含巯基(—SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物Ⅱ。
(1)基态硫原子价电子排布式为 。
(2)H2S、CH4、H2O的沸点由高到低顺序为 。
(3)汞的原子序数为80,位于元素周期表第 周期第ⅡB族。
(4)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有 。
A.在Ⅰ中S原子采取sp3杂化
B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C—C—C键角是180°
D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物Ⅰ与化合物Ⅲ相比,水溶性较好的是 。
(6)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。
①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是 。
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为 ;该晶胞中粒子个数比Hg∶Ge∶Sb= 。
③设X的最简式的式量为Mr,则X晶体的密度为 g/cm3(列出算式)。
答案 (1)3s23p4 (2)H2O>H2S>CH4 (3)六
(4)AD (5)化合物Ⅲ (6)①垂直平移后,顶点原子不能重复 ②4 1∶1∶2 ③
9.(2019课标Ⅰ,35,15分)在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要材料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是 (填标号)。
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是 、 。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是 ,其中与乙二胺形成的化合物稳定性相对较高的是 (填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如下表所示:
氧化物 Li2O MgO P4O6 SO2
熔点/℃ 1 570 2 800 23.8 -75.5
解释表中氧化物之间熔点差异的原因
(4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x= pm,Mg原子之间最短距离y= pm。设阿伏加德罗常数的值为NA,则MgCu2的密度是 g·cm-3(列出计算表达式)。
答案 (1)A (2)sp3 sp3 乙二胺的两个N提供孤对电子给金属离子形成配位键 Cu2+
(3)Li2O、MgO为离子晶体,P4O6、SO2为分子晶体。离子键:MgO>Li2O,分子间作用力:P4O6>SO2
(4)
10.(2022河北,17,15分)含Cu、Zn、Sn及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
(1)基态S原子的价电子中,两种自旋状态的电子数之比为 。
(2)Cu与Zn相比,第二电离能与第一电离能差值更大的是 ,原因是 。
(3)SnC的几何构型为 ,其中心离子杂化方式为 。
(4)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是 (填标号)。
A.[Cu(NH3)2]Cl
B.[Cu(NH3)4]SO4
C.[Zn(NH3)4]SO4
D.Na2[Zn(OH)4]
(5)下图是硫的四种含氧酸根的结构:
根据组成和结构推断,能在酸性溶液中将Mn2+转化为Mn的是 (填标号),理由是 。
(6)下图是CZTS四元半导体化合物的四方晶胞。
①该物质的化学式为 。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中A原子的坐标为(),则B原子的坐标为 。
答案 (1)2∶1(或1∶2) (2)Cu Cu的第二电离能是失去3d10电子所需的最低能量,第一电离能是失去4s1电子所需的最低能量;Zn的第二电离能是失去4s1电子所需的最低能量,第一电离能是失去4s2电子所需的最低能量,3d10电子处于全充满状态,其与4s1电子能量差值更大 (3)三角锥形 sp3 (4)B (5)D D中含有-1价的O,具有强氧化性,能将Mn2+转化为Mn)
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
