北京师范大学第二附属中学2023-2024学年高二下学期期中考试化学试题(含答案)
文档属性
| 名称 | 北京师范大学第二附属中学2023-2024学年高二下学期期中考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 5.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-25 19:36:06 | ||
图片预览



文档简介
北京师范大学第二附属中学2023-2024学年高二下学期期中考试
化学试题
考生须知:
1.答题前,在答题卷指定区域填写班级、姓名、考场号、座位号及准考证号并填涂相应数字。
2.所有答案必须写在答题纸上,写在试卷上无效。考试结束后,只需上交答题纸。
本卷可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 S 32
I卷(42分)
本部分共14题,每题3分。在每题列出的四个选项中,选出最符合题目要求的一项。
1.天然色素的富集会用到萃取操作,现有用大量水提取的天然色素,下列溶剂不能用来富集这些天然色素的是
A.石油醚 B.苯 C.酒精 D.四氯化碳
2.我国在CO2催化加氢制取汽油方面取得突破性进展,CO2转化过程示意图如下:
下列说法不正确的是
A.反应①的产物中含有水 B.反应②中只有碳碳键形成
C.汽油主要是C5~C11的烃类混合物 D.图中a的名称是2-甲基丁烷
3. 下列说法正确的是
A.晶体中有阳离子,就一定有阴离子
B.共价晶体的熔点一定高于离子晶体
C.N2与CO的沸点差异源于二者的极性不同
D.晶体与非晶体的本质区别在于晶体具有各向异性
4.下列物质的性质不能用化学键解释的是
A.碘单质常温为固体 B.氮气化学性质稳定
C.金刚石熔点高 D.金属铜能导电
5.某烃与H2反应后能生成 ,则该烃不可能是
A. B.
C. D.
6.下列事实不能说明基团间存在影响的是
A.氯乙酸的酸性强于乙酸
B.苯酚能和溴水反应而苯不能
C.甲苯能使酸性高锰酸钾溶液褪色而甲烷不能
D.乙烯能使酸性高锰酸钾溶液褪色而乙烷不能
7.下列事实不能通过比较氟元素和氯元素的电负性进行解释的是
A.F-F键的键能小于Cl-Cl键的键能
B.三氟乙酸的Ka大于三氯乙酸的Ka
C.氟化氢分子的极性强于氯化氢分子的极性
D.气态氟化氢中存在(HF)2,而气态氯化氢中是HCl分子
8.下列说法不正确的是
A.PCl3是极性键构成的极性分子
B.H+能与H2O以配位键形成H3O+
C.分子晶体中,分子间作用力越大,分子越稳定
D.对固体进行X射线衍射测定是区分晶体和非晶体最可靠的科学方法
9.SF6分子为正八面体构型,分子结构如图所示,该物质难溶于水,在高温下仍有良好的绝缘性,在电器工业方面具有广泛用途。下列推测正确的是
A.SF6中各原子均达到最外层8电子稳定结构
B.SF6易燃烧生成SO2
C.SF6分子是含有极性键的非极性分子
D.固态SF6是共价晶体
10.冠醚能与碱金属离子作用,并随环的大小不同而与不同的金属离子作用。
如:18-冠-6与K+作用(如图),但不与Li+或Na+作用。下列说法不正确的是
A.18-冠-6中C和O的杂化轨道类型相同
B.18-冠-6中O原子与K+间存在离子键
C.18-冠-6与K+作用,不与Li+或Na+作用,这反映了超分子的“分子识别”的特征
D.利用该原理可以用冠醚将KMnO4带入有机物中,更有利于有机物的氧化
11.二甲苯苯环上的一溴代物有六种同分异构体,其熔点和对应的二甲苯熔点数据如下表所示。下列叙述正确的是
二甲苯一溴代物的熔点(℃) 234 206 214 204 212 205
对应的二甲苯的熔点(℃) 13 -48 -25 -48 -25 -48
A.熔点为234℃的是一溴代间二甲苯 B.熔点为234℃的是一溴代邻二甲苯
C.熔点为-25℃的是对二甲苯 D.熔点为-48℃的是间二甲苯
12.维生素C的结构如右图所示。下列说法不正确的是
A.分子式是C6H8O6
B.分子中含有多个羟基,其水溶性较好
C.分子中含有碳碳双键、羟基、醚键3种官能团
D.能使酸性高锰酸钾溶液、溴的四氯化碳溶液褪色
13.为研究配合物的形成及性质,研究小组进行如下实验。下列说法不正确的是
序号 实验步骤 实验现象或结论
① 向CuSO4溶液中逐滴加入氨水至过量 产生蓝色沉淀,后溶解,得到深蓝色的溶液
② 再加入无水乙醇 得到深蓝色晶体
③ 测定深蓝色晶体的结构 晶体的化学式为 [Cu(NH3)4]SO4·H2O
④ 将深蓝色晶体洗净后溶于水配成溶液,再加入稀NaOH溶液 无蓝色沉淀生成
A.在深蓝色的配离子[Cu(NH3)4]2+中,Cu2+提供空轨道,NH3给出孤电子对
B.加入乙醇有晶体析出是因为离子晶体在极性较弱的乙醇中溶解度小
C.该实验条件下,Cu2+与NH3的结合能力大于Cu2+与OH-的结合能力
D.向④中深蓝色溶液中加入BaCl2溶液,不会产生白色沉淀
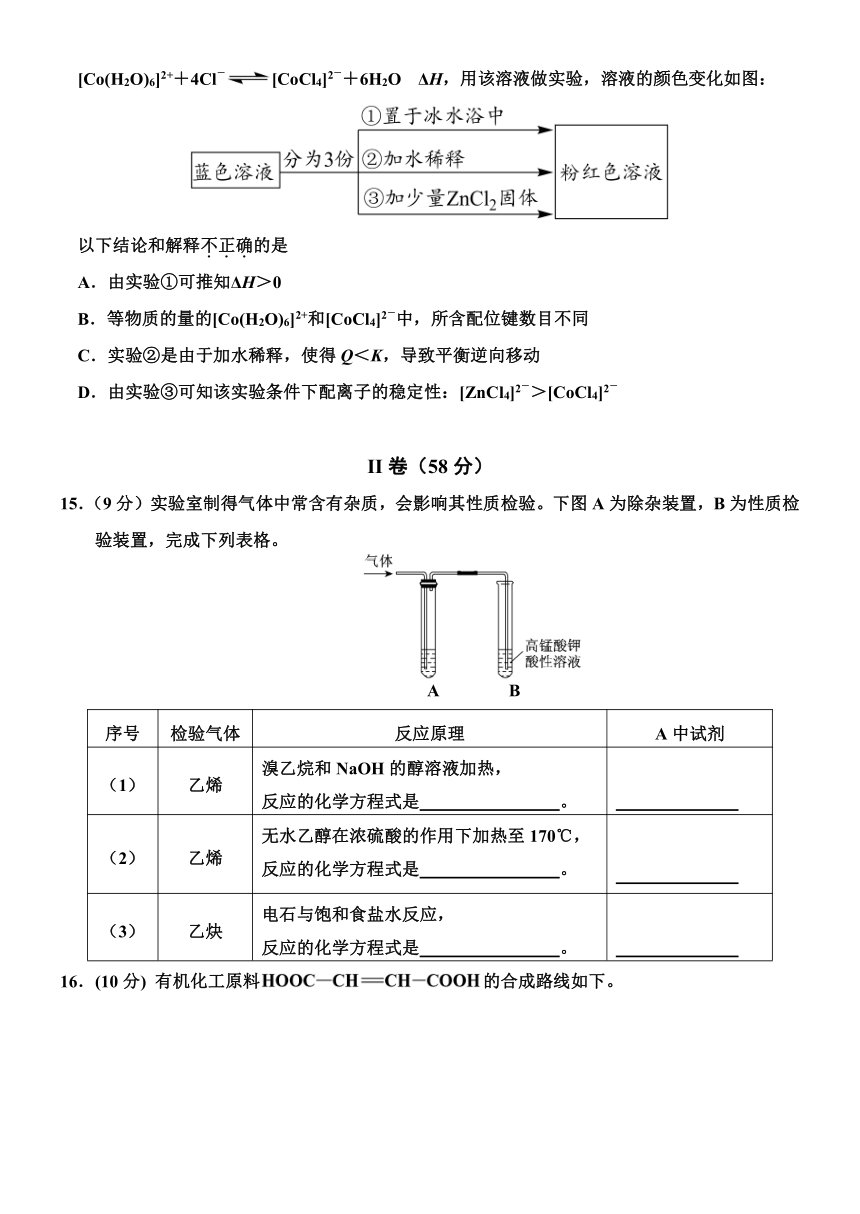
14.已知[Co(H2O)6]2+呈粉红色,[CoCl4]2-呈蓝色,[ZnCl4]2-为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
[Co(H2O)6]2++4Cl-[CoCl4]2-+6H2O ΔH,用该溶液做实验,溶液的颜色变化如图:
以下结论和解释不正确的是
A.由实验①可推知ΔH>0
B.等物质的量的[Co(H2O)6]2+和[CoCl4]2-中,所含配位键数目不同
C.实验②是由于加水稀释,使得Q<K,导致平衡逆向移动
D.由实验③可知该实验条件下配离子的稳定性:[ZnCl4]2->[CoCl4]2-
II卷(58分)
15.(9分)实验室制得气体中常含有杂质,会影响其性质检验。下图A为除杂装置,B为性质检验装置,完成下列表格。
序号 检验气体 反应原理 A中试剂
(1) 乙烯 溴乙烷和NaOH的醇溶液加热, 反应的化学方程式是 。
(2) 乙烯 无水乙醇在浓硫酸的作用下加热至170℃,反应的化学方程式是 。
(3) 乙炔 电石与饱和食盐水反应, 反应的化学方程式是 。
16.(10分) 有机化工原料的合成路线如下。
已知:
(1)A中所含的官能团是______________。
(2)试剂a是________________。
(3)E的结构简式是_____________________。
(4)写出“反应①”的化学方程式______________________。
(5)合成过程中,设计步骤“D→E”的目的是__________
17.(11分)
中国科学家参与的国际阿伏加德罗组织以高纯单晶28Si为样品高精度地测定了NA。
I.高纯单晶28Si的制备流程如下
(1)写出基态Si原子的电子排布式_________________。
(2)SiF4分子的空间构型是_____________。
(3)写出反应②的化学方程式____________________________。
(4)③中发生分解反应,判断SiH4的分解温度_________(填“大于”或“小于”)CH4的分解温度,理由是______________________。
II.NA的测定
(5)单晶硅的晶胞结构如图所示,X射线衍射测定其边长为a cm。
还需要测定的物理量有:硅的相对原子质量A、宏观硅球的质量m g和体积V cm3以及缺陷修正值δ(晶胞内实际原子数=理论原子数 +δ)。用上述物理量列出NA的计算表达式______。
18.(14分)
过渡元素铂(Pt)的单质是一种重要的催化剂,其化合物可用于医药领域。
(1)基态Pt的价层电子排布式是5d96s1,该元素在元素周期表中位于第______周期。
(2)Pt的晶胞示意图如下。
该晶体中,每个铂原子周围与它最近且等距离的铂原子有______个。
(3)PtCl2(NH3)2是铂的重要配位化合物,它有甲、乙两种同分异构体,其中甲为极性分子,乙为非极性分子。甲、乙水解产物的化学式均为Pt(OH)2(NH3)2,但只有甲的水解产物能与草酸(HOOC-COOH)反应生成Pt(C2O4)(NH3)2。
①推断______(填“甲”或“乙”)在水中的溶解度较大,依据是_____________。
②依据文中信息:____________,可推断PtCl2(NH3)2的分子不是四面体结构。
③PtCl2(NH3)2发生水解反应的化学方程式是____________________________________。
④PtCl2(NH3)2和Pt(C2O4)(NH3)2中铂的配体数不同,但配位数均为4,原因是____________________。
⑤画出乙的水解产物的空间结构并推测其不能与草酸反应生成Pt(C2O4)(NH3)2的原因________________。
19.(14分)优良的有机溶剂对孟烷、耐热型特种高分子功能材料PMnMA的合成路线如下。
(
(
R
为烷基,
X
为卤原子)
催化剂
)已知:芳香化合物苯环上的H原子可以被卤代烷中的烷基取代。如:
(1)(CH3)2CHCl的官能团是________。
(2)B为芳香烃。
① (CH3)2CHCl与A反应生成B的化学方程式是 。
②B的同系物中,相对分子质量最小的物质是__________。
(3)C的分子式是C7H8O,0.01mol C和浓溴水反应生成白色沉淀,完全反应时消耗
0.03 mol Br2。E不能使Br2的CCl4溶液褪色。
①反应Ⅰ的化学方程式是 。
②E→F的反应类型是_____________。
(4)下列说法中正确的是(选填字母) 。
a.B可使酸性高锰酸钾溶液褪色 b.D的酸性比E弱 c.E 的沸点高于对孟烷(5)G中含有-COOH,其核磁共振氢谱有3种峰,峰面积之比为3︰2︰1。
反应Ⅱ的化学方程式是 。
化学期中参考答案
I卷(每题3分,共42分)
题号 1 2 3 4 5 6 7
答案 C B C A D D A
题号 8 9 10 11 12 13 14
答案 C C B D C D C
II卷(58分)
15. (9分)
反应原理 A中试剂
(2分) 水(1分)
C2H5OH CH2=CH2↑+H2O (2分) NaOH溶液 (1分)
CaC2+2H2O→C2H2+Ca(OH)2 (2分) CuSO4溶液 (1分)
16. (10分)
(1)碳碳双键 (2分) (2)NaOH水溶液 (2分)
(3) (2分)
(4)
(2分)
(5)保护碳碳双键,防止其在后续反应中被氧化。(2分)
17. (11分)
(1)1s22s22p63s23p2 (2分) (2)正四面体 (2分)
(3)SiF4 +2 CaH2 = SiH4 + 2 CaF2 (2分)
(4)小于;(1分)
C和Si位于同一主族,原子半径Si>C,键长Si-H>C-H,键能Si-H<C-H,则SiH4分解温度低(或C和Si位于同一主族,原子半径Si>C,非金属性Si<C,对应氢化物的稳定性CH4>SiH4)。 (2分)
(5) (2分)
18. (14分)
(1)六 (1分) (2)12 (2分)
(3)①甲 (1分) 甲为极性分子,水是极性溶剂。根据“相似相溶”规律,极性分子易溶于极性溶剂。 (2分)
②PtCl2(NH3)2存在同分异构体 (2分)
③PtCl2(NH3)2+2H2O Pt(OH)2(NH3)2+2HCl (2分)
④每个C2O42-中有2个原子与铂配位 (2分)
⑤乙分子水解产物的结构为 ,O-Pt-O键角为180°(两个配位氧原
子的距离较远),草酸的两个羧基无法与铂同时形成配位键。 (2分)
19. (14分)
(1)碳氯键或氯原子 (2分)
(2)①
(2分)
② 苯 (2分)
(
3H
2
)(3)① (2分)
②消去反应 (2分)
(4)ac (2分)
(5)
N (2分)
化学试题
考生须知:
1.答题前,在答题卷指定区域填写班级、姓名、考场号、座位号及准考证号并填涂相应数字。
2.所有答案必须写在答题纸上,写在试卷上无效。考试结束后,只需上交答题纸。
本卷可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 S 32
I卷(42分)
本部分共14题,每题3分。在每题列出的四个选项中,选出最符合题目要求的一项。
1.天然色素的富集会用到萃取操作,现有用大量水提取的天然色素,下列溶剂不能用来富集这些天然色素的是
A.石油醚 B.苯 C.酒精 D.四氯化碳
2.我国在CO2催化加氢制取汽油方面取得突破性进展,CO2转化过程示意图如下:
下列说法不正确的是
A.反应①的产物中含有水 B.反应②中只有碳碳键形成
C.汽油主要是C5~C11的烃类混合物 D.图中a的名称是2-甲基丁烷
3. 下列说法正确的是
A.晶体中有阳离子,就一定有阴离子
B.共价晶体的熔点一定高于离子晶体
C.N2与CO的沸点差异源于二者的极性不同
D.晶体与非晶体的本质区别在于晶体具有各向异性
4.下列物质的性质不能用化学键解释的是
A.碘单质常温为固体 B.氮气化学性质稳定
C.金刚石熔点高 D.金属铜能导电
5.某烃与H2反应后能生成 ,则该烃不可能是
A. B.
C. D.
6.下列事实不能说明基团间存在影响的是
A.氯乙酸的酸性强于乙酸
B.苯酚能和溴水反应而苯不能
C.甲苯能使酸性高锰酸钾溶液褪色而甲烷不能
D.乙烯能使酸性高锰酸钾溶液褪色而乙烷不能
7.下列事实不能通过比较氟元素和氯元素的电负性进行解释的是
A.F-F键的键能小于Cl-Cl键的键能
B.三氟乙酸的Ka大于三氯乙酸的Ka
C.氟化氢分子的极性强于氯化氢分子的极性
D.气态氟化氢中存在(HF)2,而气态氯化氢中是HCl分子
8.下列说法不正确的是
A.PCl3是极性键构成的极性分子
B.H+能与H2O以配位键形成H3O+
C.分子晶体中,分子间作用力越大,分子越稳定
D.对固体进行X射线衍射测定是区分晶体和非晶体最可靠的科学方法
9.SF6分子为正八面体构型,分子结构如图所示,该物质难溶于水,在高温下仍有良好的绝缘性,在电器工业方面具有广泛用途。下列推测正确的是
A.SF6中各原子均达到最外层8电子稳定结构
B.SF6易燃烧生成SO2
C.SF6分子是含有极性键的非极性分子
D.固态SF6是共价晶体
10.冠醚能与碱金属离子作用,并随环的大小不同而与不同的金属离子作用。
如:18-冠-6与K+作用(如图),但不与Li+或Na+作用。下列说法不正确的是
A.18-冠-6中C和O的杂化轨道类型相同
B.18-冠-6中O原子与K+间存在离子键
C.18-冠-6与K+作用,不与Li+或Na+作用,这反映了超分子的“分子识别”的特征
D.利用该原理可以用冠醚将KMnO4带入有机物中,更有利于有机物的氧化
11.二甲苯苯环上的一溴代物有六种同分异构体,其熔点和对应的二甲苯熔点数据如下表所示。下列叙述正确的是
二甲苯一溴代物的熔点(℃) 234 206 214 204 212 205
对应的二甲苯的熔点(℃) 13 -48 -25 -48 -25 -48
A.熔点为234℃的是一溴代间二甲苯 B.熔点为234℃的是一溴代邻二甲苯
C.熔点为-25℃的是对二甲苯 D.熔点为-48℃的是间二甲苯
12.维生素C的结构如右图所示。下列说法不正确的是
A.分子式是C6H8O6
B.分子中含有多个羟基,其水溶性较好
C.分子中含有碳碳双键、羟基、醚键3种官能团
D.能使酸性高锰酸钾溶液、溴的四氯化碳溶液褪色
13.为研究配合物的形成及性质,研究小组进行如下实验。下列说法不正确的是
序号 实验步骤 实验现象或结论
① 向CuSO4溶液中逐滴加入氨水至过量 产生蓝色沉淀,后溶解,得到深蓝色的溶液
② 再加入无水乙醇 得到深蓝色晶体
③ 测定深蓝色晶体的结构 晶体的化学式为 [Cu(NH3)4]SO4·H2O
④ 将深蓝色晶体洗净后溶于水配成溶液,再加入稀NaOH溶液 无蓝色沉淀生成
A.在深蓝色的配离子[Cu(NH3)4]2+中,Cu2+提供空轨道,NH3给出孤电子对
B.加入乙醇有晶体析出是因为离子晶体在极性较弱的乙醇中溶解度小
C.该实验条件下,Cu2+与NH3的结合能力大于Cu2+与OH-的结合能力
D.向④中深蓝色溶液中加入BaCl2溶液,不会产生白色沉淀
14.已知[Co(H2O)6]2+呈粉红色,[CoCl4]2-呈蓝色,[ZnCl4]2-为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
[Co(H2O)6]2++4Cl-[CoCl4]2-+6H2O ΔH,用该溶液做实验,溶液的颜色变化如图:
以下结论和解释不正确的是
A.由实验①可推知ΔH>0
B.等物质的量的[Co(H2O)6]2+和[CoCl4]2-中,所含配位键数目不同
C.实验②是由于加水稀释,使得Q<K,导致平衡逆向移动
D.由实验③可知该实验条件下配离子的稳定性:[ZnCl4]2->[CoCl4]2-
II卷(58分)
15.(9分)实验室制得气体中常含有杂质,会影响其性质检验。下图A为除杂装置,B为性质检验装置,完成下列表格。
序号 检验气体 反应原理 A中试剂
(1) 乙烯 溴乙烷和NaOH的醇溶液加热, 反应的化学方程式是 。
(2) 乙烯 无水乙醇在浓硫酸的作用下加热至170℃,反应的化学方程式是 。
(3) 乙炔 电石与饱和食盐水反应, 反应的化学方程式是 。
16.(10分) 有机化工原料的合成路线如下。
已知:
(1)A中所含的官能团是______________。
(2)试剂a是________________。
(3)E的结构简式是_____________________。
(4)写出“反应①”的化学方程式______________________。
(5)合成过程中,设计步骤“D→E”的目的是__________
17.(11分)
中国科学家参与的国际阿伏加德罗组织以高纯单晶28Si为样品高精度地测定了NA。
I.高纯单晶28Si的制备流程如下
(1)写出基态Si原子的电子排布式_________________。
(2)SiF4分子的空间构型是_____________。
(3)写出反应②的化学方程式____________________________。
(4)③中发生分解反应,判断SiH4的分解温度_________(填“大于”或“小于”)CH4的分解温度,理由是______________________。
II.NA的测定
(5)单晶硅的晶胞结构如图所示,X射线衍射测定其边长为a cm。
还需要测定的物理量有:硅的相对原子质量A、宏观硅球的质量m g和体积V cm3以及缺陷修正值δ(晶胞内实际原子数=理论原子数 +δ)。用上述物理量列出NA的计算表达式______。
18.(14分)
过渡元素铂(Pt)的单质是一种重要的催化剂,其化合物可用于医药领域。
(1)基态Pt的价层电子排布式是5d96s1,该元素在元素周期表中位于第______周期。
(2)Pt的晶胞示意图如下。
该晶体中,每个铂原子周围与它最近且等距离的铂原子有______个。
(3)PtCl2(NH3)2是铂的重要配位化合物,它有甲、乙两种同分异构体,其中甲为极性分子,乙为非极性分子。甲、乙水解产物的化学式均为Pt(OH)2(NH3)2,但只有甲的水解产物能与草酸(HOOC-COOH)反应生成Pt(C2O4)(NH3)2。
①推断______(填“甲”或“乙”)在水中的溶解度较大,依据是_____________。
②依据文中信息:____________,可推断PtCl2(NH3)2的分子不是四面体结构。
③PtCl2(NH3)2发生水解反应的化学方程式是____________________________________。
④PtCl2(NH3)2和Pt(C2O4)(NH3)2中铂的配体数不同,但配位数均为4,原因是____________________。
⑤画出乙的水解产物的空间结构并推测其不能与草酸反应生成Pt(C2O4)(NH3)2的原因________________。
19.(14分)优良的有机溶剂对孟烷、耐热型特种高分子功能材料PMnMA的合成路线如下。
(
(
R
为烷基,
X
为卤原子)
催化剂
)已知:芳香化合物苯环上的H原子可以被卤代烷中的烷基取代。如:
(1)(CH3)2CHCl的官能团是________。
(2)B为芳香烃。
① (CH3)2CHCl与A反应生成B的化学方程式是 。
②B的同系物中,相对分子质量最小的物质是__________。
(3)C的分子式是C7H8O,0.01mol C和浓溴水反应生成白色沉淀,完全反应时消耗
0.03 mol Br2。E不能使Br2的CCl4溶液褪色。
①反应Ⅰ的化学方程式是 。
②E→F的反应类型是_____________。
(4)下列说法中正确的是(选填字母) 。
a.B可使酸性高锰酸钾溶液褪色 b.D的酸性比E弱 c.E 的沸点高于对孟烷(5)G中含有-COOH,其核磁共振氢谱有3种峰,峰面积之比为3︰2︰1。
反应Ⅱ的化学方程式是 。
化学期中参考答案
I卷(每题3分,共42分)
题号 1 2 3 4 5 6 7
答案 C B C A D D A
题号 8 9 10 11 12 13 14
答案 C C B D C D C
II卷(58分)
15. (9分)
反应原理 A中试剂
(2分) 水(1分)
C2H5OH CH2=CH2↑+H2O (2分) NaOH溶液 (1分)
CaC2+2H2O→C2H2+Ca(OH)2 (2分) CuSO4溶液 (1分)
16. (10分)
(1)碳碳双键 (2分) (2)NaOH水溶液 (2分)
(3) (2分)
(4)
(2分)
(5)保护碳碳双键,防止其在后续反应中被氧化。(2分)
17. (11分)
(1)1s22s22p63s23p2 (2分) (2)正四面体 (2分)
(3)SiF4 +2 CaH2 = SiH4 + 2 CaF2 (2分)
(4)小于;(1分)
C和Si位于同一主族,原子半径Si>C,键长Si-H>C-H,键能Si-H<C-H,则SiH4分解温度低(或C和Si位于同一主族,原子半径Si>C,非金属性Si<C,对应氢化物的稳定性CH4>SiH4)。 (2分)
(5) (2分)
18. (14分)
(1)六 (1分) (2)12 (2分)
(3)①甲 (1分) 甲为极性分子,水是极性溶剂。根据“相似相溶”规律,极性分子易溶于极性溶剂。 (2分)
②PtCl2(NH3)2存在同分异构体 (2分)
③PtCl2(NH3)2+2H2O Pt(OH)2(NH3)2+2HCl (2分)
④每个C2O42-中有2个原子与铂配位 (2分)
⑤乙分子水解产物的结构为 ,O-Pt-O键角为180°(两个配位氧原
子的距离较远),草酸的两个羧基无法与铂同时形成配位键。 (2分)
19. (14分)
(1)碳氯键或氯原子 (2分)
(2)①
(2分)
② 苯 (2分)
(
3H
2
)(3)① (2分)
②消去反应 (2分)
(4)ac (2分)
(5)
N (2分)
同课章节目录
