北京市宣武外国语实验学校2023-2024学年高二下学期期中考试化学试题(PDF版,含答案)
文档属性
| 名称 | 北京市宣武外国语实验学校2023-2024学年高二下学期期中考试化学试题(PDF版,含答案) |  | |
| 格式 | |||
| 文件大小 | 876.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-27 09:34:22 | ||
图片预览


文档简介
北京市宣武外国语实验学校 2023-2024 学年度 6.下列有机化合物分子中,所有原子不.可.能.位于同一平面的是
A.乙烷 B.乙烯 C.乙炔 D.苯
第二学期期中试卷高二化学 7.下列物质:①甲烷、②乙烯、③乙炔、④苯、⑤甲苯,既能使酸性高锰酸钾溶液褪色,又
1、本试卷共 100 分,考试时间 90 分钟。
考 生 能使溴的四氯化碳溶液褪色的是
2、试卷分为两部分,共 8 页。请考生在答题纸上作答。
须 知
3、请考生在左侧认真填写自己的个人信息。 A.①② B.②④ C.②③ D.④⑤
H—1 C—12 O—16 Si—28 8.下列说法正确的是
第一部分 A.BF3是由极性共价键构成的极性分子
B.HCl和 Cl2分子中均含有 s-p σ键
本部分共16题,每题3分,共48分。在每题列出的四个选项中,选出最符合题目要求的一项。
C.H+能与 H2O以配位键形成 H3O+
1.下列物质的用途中,不.正.确.的是 D.酸性:CH2ClCOOH>CHCl2COOH>CCl3COOH
A.醋酸可除水垢 B.乙烯可用于催熟果实 9.下列事实不.能.用氢键解释的是
C.乙炔可用于焊接或切割金属 D.乙醇可用于萃取碘水中的碘 A.氨气极易溶于水
2.下列化学用语或模型不.正.确.的是 B.0 ℃时,冰的密度比水的小
A.苯的实验式:CH B.乙烯的结构简式:CH2CH2 C.甲烷的沸点比 SiH4的低
D.接近水的沸点的水蒸气的相对分子质量测定值大于 18
C.乙炔的球棍模型: D.甲基的电子式: 10.下列有机反应中,C—H发生断裂的是
3.下列分子或离子中,VSEPR模型和空间结构一致的是 A.甲烷与氯气在光照条件下反应
A.H2O B.NH +3 C.SO2 D.NH4 B.乙烯与溴的四氯化碳溶液反应
C.乙炔与氯化氢在催化剂和加热条件下反应
D.苯与氢气在催化剂和加热条件下反应
4.某烷烃的结构简式为 ,其系统命名正确的是
11.某烃与氢气发生反应后能生成 ,则该烃不.可.能.是
A.2,3,3-三甲基戊烷 B.3,3,4-三甲基戊烷
C.2,3-二甲基-2-乙基丁烷 D.2,3-二甲基-3-乙基丁烷
A. B.
5.下列事实不.能.用键能的数据解释的是
A.N2的化学性质很稳定 C. D.
B.Cl2的沸点小于 Br2的沸点
C.HF、HCl、HBr、HI的稳定性逐渐减弱
D.金刚石的熔点大于晶体硅的熔点
化学 第 1页 (共 8页) 化学 第 2页 (共 8页)
{#{QQABLYSQogAgQoBAABgCQwmACAOQkAACCAoOQAAEoAAASQNABAA=}#}
姓名: 班级: 考号:
密 封 线 内 不 要 答 题
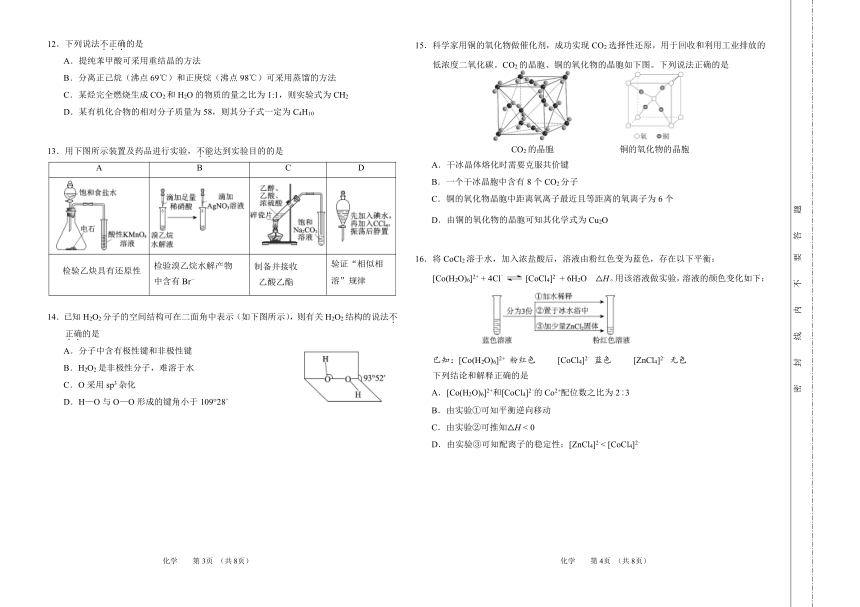
12.下列说法不.正.确.的是 15.科学家用铜的氧化物做催化剂,成功实现 CO2选择性还原,用于回收和利用工业排放的
A.提纯苯甲酸可采用重结晶的方法 低浓度二氧化碳。CO2的晶胞、铜的氧化物的晶胞如下图。下列说法正确的是
B.分离正己烷(沸点 69℃)和正庚烷(沸点 98℃)可采用蒸馏的方法
C.某烃完全燃烧生成 CO2和 H2O的物质的量之比为 1:1,则实验式为 CH2
D.某有机化合物的相对分子质量为 58,则其分子式一定为 C4H10
13.用下图所示装置及药品进行实验,不 CO 的晶胞 铜的氧化物的晶胞.能.达到实验目的的是 2
A B C D A.干冰晶体熔化时需要克服共价键
B.一个干冰晶胞中含有 8个 CO2分子
C.铜的氧化物晶胞中距离氧离子最近且等距离的氧离子为 6个
D.由铜的氧化物的晶胞可知其化学式为 Cu2O
16.将 CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
检验溴乙烷水解产物 验证“相似相
检验乙炔具有还原性 制备并接收
2+
中含有 Br- 乙酸乙酯 溶”规律 [Co(H2O)6] + 4Cl
- [CoCl -4]2 + 6H2O △H。用该溶液做实验,溶液的颜色变化如下:
14.已知 H2O2分子的空间结构可在二面角中表示(如下图所示),则有关 H2O2结构的说法不.
正.确.的是
A.分子中含有极性键和非极性键
已知:[Co(H2O)6]2+ 粉红色 [CoCl4]2- 蓝色 [ZnCl ]2-4 无色
B.H2O2是非极性分子,难溶于水
下列结论和解释正确的是
C.O采用 sp3杂化
A.[Co(H2O) -6]2+和[CoCl4]2 的 Co2+配位数之比为 2︰3
D.H—O与 O—O形成的键角小于 109°28
B.由实验①可知平衡逆向移动
C.由实验②可推知△H < 0
D.由实验③可知配离子的稳定性:[ZnCl4]2-< [CoCl4]2-
化学 第 3页 (共 8页) 化学 第 4页 (共 8页)
{#{QQABLYSQogAgQoBAABgCQwmACAOQkAACCAoOQAAEoAAASQNABAA=}#}
密 封 线 内 不 要 答 题
第二部分
本部分共7题,共52分。 20.(7分)研究发现,CO2低压合成甲醇的反应: ,
17.(5分)下列各组中的两种有机化合物可能是:A.同一物质;B.同系物;C.同分异构 钴氧化物负载的锰氧化物纳米粒子催化剂具有较高的活性,有良好的应用前景。
体;D.同素异形体;E.同位素。请判断它们之间的关系。 (1)CO2分子和 CH3OH分子中,C原子的杂化轨道类型分别为 和 。
(1)12C和 14C是 (填字母,下同); (2)CO2和 H2O中,沸点较高的是 ,从结构角度分析,原因是 。
(2)O2和 O3是 ; (3)基态锰原子的价层电子排布式为 。
(3)2—甲基丁烷和丁烷是 ; (4)工业上利用甲醇空气氧化法生产甲醛(HCHO,结构式 )。
(4)正戊烷和新戊烷是 ; 下列关于甲醛分子的说法正确的是 (填序号)。
a.碳氧双键中有一个σ键,一个π键 b.中心原子的孤电子对数为 0
(5) 和 是 。 c.甲醛分子为极性分子 d.甲醛的 VSEPR模型为平面三角形
21.(9分)甲硅烷 SiH4可用于制备多种新型无机非金属材料。
(1)Si原子与 H原子结合时,Si表现为正价,则电负性:Si H(填“>”“<”
18.(5分)右图是某烃 A分子的球棍模型。回答下列问题: 或“=”),SiH4分子的空间结构为 。
(1)A的名称是 。 (2)利用 SiH4与 NH3可制得氮化硅(Si3N4)材料。
(2)A能够发生的反应类型有 (填序号)。 ①热稳定性:SiH4 NH3(填“>”“<”或“=”)。
①氧化反应 ②加成反应 ③取代反应 ②SiH4中 H—Si—H的键角 NH3中 H—N—H的键角(填“>”“<”或“=”),
(3)A与溴的四氯化碳溶液反应的化学方程式是 。 其键角差异的原因是 。
(3)利用 SiH4与 CH4反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶
19.(5分)维生素 C是重要的营养素,其分子结构如右图所示。 点和面心,碳原子位于立方体的内部。
(1)维生素 C的分子式为 。 ①碳化硅晶体中每个 Si原子周围距离最近的C原
Si
(2)维生素 C含有的官能团是 。 子数目为 ,SiC的晶体类型是 。 C
(3)维生素 C易溶于水,可能的原因是 。 ②已知碳化硅的晶胞边长为 a nm (1 nm =10 9m),
(4)维生素 C具有较强的还原性,向碘和淀粉的混合液中加入维生素 C,可观察到的 阿伏伽德罗常数为 NA。则碳化硅晶体的密度为
g·cm 3(列出计算式)。
现象是 。
化学 第 5页 (共 8页) 化学 第 6页 (共 8页)
{#{QQABLYSQogAgQoBAABgCQwmACAOQkAACCAoOQAAEoAAASQNABAA=}#}
姓名: 班级: 考号:
密 封 线 内 不 要 答 题
22.(8分)有机化合物 A可由葡萄糖发酵得到,在医药和食品领域中有广泛应用。通过实验 23.(13分)甲基丙烯酸羟乙酯(HEMA)是制隐形眼镜的材料,一种工业合成路线如下:
测定有机化合物 A的分子结构的过程如下:
(1)确定 A的实验式。
9.0 g有机化合物 A完全燃烧,经检测,得到 6.72 L CO2(标准状况)和 5.4 g H2O,
则 A的实验式为 。
(2)确定 A的分子式。
已知:ⅰ.
通过 (填仪器分析方法)法可以测得 A的相对分子质量为 90,则 A的
分子式为 。
ⅱ.
(3)确定 A的分子结构。
使用使用现代分析仪器对 A的分子结构进行测定,结果如下:
谱图 数据分析结果 (1)乙烯是常见的工业原料,可用于制备塑料,请写出制备聚乙烯的化学方程式 。
(2)①的化学方程式是 。
红外光谱 含有—COOH、—OH
(3)试剂 a是 。
(4)②的反应类型是 。
核磁共振氢谱 峰面积比为 1︰1︰1︰3 (5)B的结构简式是 。
(6)③的化学方程式是 。
的结构简式为______。 (7)B有多种同分异构体,其中能与 NaHCO3溶液反应放出气体的链状异构体有(不考
(4)研究 A的结构和性质的关系。
虑立体异构): 、 。
① A的分子存在两种空间结构,它们具有完全相同的组成和原子排列,却互为镜像,
具有不同的光学性质,两种分子的关系为______(填字母,下同)。 (8)工业上以 为原料生产 HEMA,还可利用反应:
a.碳架异构 b.位置异构 c.官能团异构 d.手性异构 制备环氧乙烷,环氧乙烷可代替 A,与 B反
② 已知:电离常数 Ka(A)=1.38×10-4,Ka(丙酸)=1.34×10-5,分析数据可知 A的酸
应生成 HEMA,与上述流程对比其优点是 (答出一条即可)。
性强于丙酸,请从共价键极性的角度解释原因______。
化学 第 7页 (共 8页) 化学 第 8页 (共 8页)
{#{QQABLYSQogAgQoBAABgCQwmACAOQkAACCAoOQAAEoAAASQNABAA=}#}
密 封 线 内 不 要 答 题
北京市宣武外国语实验学校 2023-2024 学年度第二学期
期中考试评分标准 高二 化学
第一部分(选择题 共 48分)
每小题只.有.一.个.选.项.符合题意(每小题 3分)
题号 1 2 3 4 5 6 7 8
答案 D B D A B A C C
题号 9 10 11 12 13 14 15 16
答案 C A C D A B D B
第二部分(非选择题 共 52分)
17.(5分)(每空 1分)
(1)E (2)D (3)B (4)C (5)A
18.(5分)
(1)2-甲基-1-丙烯(1分) (2)①②③(2分)
(3)CH2=C(CH3)2 + Br2 → BrCH2CBr(CH3)2(2分)
19.(5分)
(1)C6H8O6(1分) (2)碳碳双键、羟基、酯基(2分,写结构式给分)
(3)分子中含有多个羟基(1分) (4)蓝色褪去(1分)
20.(7分)
(1)sp(1分) sp3(1分) (2)H2O(1分) H2O分子之间能形成氢键(1分)
(3)3d54s2(1分) (4)abcd(2分)
21.(9分)
(1)<(1分) 正四面体形(1分)
(2)①<(1分) ②>(1分) SiH4与 NH3的中心原子上价层电子对数均为 4,但
NH3中心原子 N原子上含有一对孤对电子,孤对电子与成键电子之间的排斥力强于成键电
{#{QQABLYSQogAgQoBAABgCQwmACAOQkAACCAoOQAAEoAAASQNABAA=}#}
子与成键电子之间的斥力,导致 SiH4中 H—Si—H的键角大于 NH3中 H—N—H的键角(2
分)
(3 4 40)① 4(1分)共价晶体(1分) ②
N (a 10 7 3
(1分)
A )
22.(8分)
(1)CH2O(1分) (2)质谱(1分) C3H6O3(1分) (3) (2分)
(4)①d(1分) ②O—C的极性大于 H—C的极性,A羧基中的羟基的极性增强,更易
电离出氢离子(2分)
23.(13分)
(1) (2分)
(2) (2分)
(3)NaOH水溶液(1分) (4)酯化反应(取代反应)(1分)
(5) (2分)
(6) (2分)
(7) (各 1分)
(8)步骤少、原子利用率高等(答出一条即可)(1分)
{#{QQABLYSQogAgQoBAABgCQwmACAOQkAACCAoOQAAEoAAASQNABAA=}#}
A.乙烷 B.乙烯 C.乙炔 D.苯
第二学期期中试卷高二化学 7.下列物质:①甲烷、②乙烯、③乙炔、④苯、⑤甲苯,既能使酸性高锰酸钾溶液褪色,又
1、本试卷共 100 分,考试时间 90 分钟。
考 生 能使溴的四氯化碳溶液褪色的是
2、试卷分为两部分,共 8 页。请考生在答题纸上作答。
须 知
3、请考生在左侧认真填写自己的个人信息。 A.①② B.②④ C.②③ D.④⑤
H—1 C—12 O—16 Si—28 8.下列说法正确的是
第一部分 A.BF3是由极性共价键构成的极性分子
B.HCl和 Cl2分子中均含有 s-p σ键
本部分共16题,每题3分,共48分。在每题列出的四个选项中,选出最符合题目要求的一项。
C.H+能与 H2O以配位键形成 H3O+
1.下列物质的用途中,不.正.确.的是 D.酸性:CH2ClCOOH>CHCl2COOH>CCl3COOH
A.醋酸可除水垢 B.乙烯可用于催熟果实 9.下列事实不.能.用氢键解释的是
C.乙炔可用于焊接或切割金属 D.乙醇可用于萃取碘水中的碘 A.氨气极易溶于水
2.下列化学用语或模型不.正.确.的是 B.0 ℃时,冰的密度比水的小
A.苯的实验式:CH B.乙烯的结构简式:CH2CH2 C.甲烷的沸点比 SiH4的低
D.接近水的沸点的水蒸气的相对分子质量测定值大于 18
C.乙炔的球棍模型: D.甲基的电子式: 10.下列有机反应中,C—H发生断裂的是
3.下列分子或离子中,VSEPR模型和空间结构一致的是 A.甲烷与氯气在光照条件下反应
A.H2O B.NH +3 C.SO2 D.NH4 B.乙烯与溴的四氯化碳溶液反应
C.乙炔与氯化氢在催化剂和加热条件下反应
D.苯与氢气在催化剂和加热条件下反应
4.某烷烃的结构简式为 ,其系统命名正确的是
11.某烃与氢气发生反应后能生成 ,则该烃不.可.能.是
A.2,3,3-三甲基戊烷 B.3,3,4-三甲基戊烷
C.2,3-二甲基-2-乙基丁烷 D.2,3-二甲基-3-乙基丁烷
A. B.
5.下列事实不.能.用键能的数据解释的是
A.N2的化学性质很稳定 C. D.
B.Cl2的沸点小于 Br2的沸点
C.HF、HCl、HBr、HI的稳定性逐渐减弱
D.金刚石的熔点大于晶体硅的熔点
化学 第 1页 (共 8页) 化学 第 2页 (共 8页)
{#{QQABLYSQogAgQoBAABgCQwmACAOQkAACCAoOQAAEoAAASQNABAA=}#}
姓名: 班级: 考号:
密 封 线 内 不 要 答 题
12.下列说法不.正.确.的是 15.科学家用铜的氧化物做催化剂,成功实现 CO2选择性还原,用于回收和利用工业排放的
A.提纯苯甲酸可采用重结晶的方法 低浓度二氧化碳。CO2的晶胞、铜的氧化物的晶胞如下图。下列说法正确的是
B.分离正己烷(沸点 69℃)和正庚烷(沸点 98℃)可采用蒸馏的方法
C.某烃完全燃烧生成 CO2和 H2O的物质的量之比为 1:1,则实验式为 CH2
D.某有机化合物的相对分子质量为 58,则其分子式一定为 C4H10
13.用下图所示装置及药品进行实验,不 CO 的晶胞 铜的氧化物的晶胞.能.达到实验目的的是 2
A B C D A.干冰晶体熔化时需要克服共价键
B.一个干冰晶胞中含有 8个 CO2分子
C.铜的氧化物晶胞中距离氧离子最近且等距离的氧离子为 6个
D.由铜的氧化物的晶胞可知其化学式为 Cu2O
16.将 CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
检验溴乙烷水解产物 验证“相似相
检验乙炔具有还原性 制备并接收
2+
中含有 Br- 乙酸乙酯 溶”规律 [Co(H2O)6] + 4Cl
- [CoCl -4]2 + 6H2O △H。用该溶液做实验,溶液的颜色变化如下:
14.已知 H2O2分子的空间结构可在二面角中表示(如下图所示),则有关 H2O2结构的说法不.
正.确.的是
A.分子中含有极性键和非极性键
已知:[Co(H2O)6]2+ 粉红色 [CoCl4]2- 蓝色 [ZnCl ]2-4 无色
B.H2O2是非极性分子,难溶于水
下列结论和解释正确的是
C.O采用 sp3杂化
A.[Co(H2O) -6]2+和[CoCl4]2 的 Co2+配位数之比为 2︰3
D.H—O与 O—O形成的键角小于 109°28
B.由实验①可知平衡逆向移动
C.由实验②可推知△H < 0
D.由实验③可知配离子的稳定性:[ZnCl4]2-< [CoCl4]2-
化学 第 3页 (共 8页) 化学 第 4页 (共 8页)
{#{QQABLYSQogAgQoBAABgCQwmACAOQkAACCAoOQAAEoAAASQNABAA=}#}
密 封 线 内 不 要 答 题
第二部分
本部分共7题,共52分。 20.(7分)研究发现,CO2低压合成甲醇的反应: ,
17.(5分)下列各组中的两种有机化合物可能是:A.同一物质;B.同系物;C.同分异构 钴氧化物负载的锰氧化物纳米粒子催化剂具有较高的活性,有良好的应用前景。
体;D.同素异形体;E.同位素。请判断它们之间的关系。 (1)CO2分子和 CH3OH分子中,C原子的杂化轨道类型分别为 和 。
(1)12C和 14C是 (填字母,下同); (2)CO2和 H2O中,沸点较高的是 ,从结构角度分析,原因是 。
(2)O2和 O3是 ; (3)基态锰原子的价层电子排布式为 。
(3)2—甲基丁烷和丁烷是 ; (4)工业上利用甲醇空气氧化法生产甲醛(HCHO,结构式 )。
(4)正戊烷和新戊烷是 ; 下列关于甲醛分子的说法正确的是 (填序号)。
a.碳氧双键中有一个σ键,一个π键 b.中心原子的孤电子对数为 0
(5) 和 是 。 c.甲醛分子为极性分子 d.甲醛的 VSEPR模型为平面三角形
21.(9分)甲硅烷 SiH4可用于制备多种新型无机非金属材料。
(1)Si原子与 H原子结合时,Si表现为正价,则电负性:Si H(填“>”“<”
18.(5分)右图是某烃 A分子的球棍模型。回答下列问题: 或“=”),SiH4分子的空间结构为 。
(1)A的名称是 。 (2)利用 SiH4与 NH3可制得氮化硅(Si3N4)材料。
(2)A能够发生的反应类型有 (填序号)。 ①热稳定性:SiH4 NH3(填“>”“<”或“=”)。
①氧化反应 ②加成反应 ③取代反应 ②SiH4中 H—Si—H的键角 NH3中 H—N—H的键角(填“>”“<”或“=”),
(3)A与溴的四氯化碳溶液反应的化学方程式是 。 其键角差异的原因是 。
(3)利用 SiH4与 CH4反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶
19.(5分)维生素 C是重要的营养素,其分子结构如右图所示。 点和面心,碳原子位于立方体的内部。
(1)维生素 C的分子式为 。 ①碳化硅晶体中每个 Si原子周围距离最近的C原
Si
(2)维生素 C含有的官能团是 。 子数目为 ,SiC的晶体类型是 。 C
(3)维生素 C易溶于水,可能的原因是 。 ②已知碳化硅的晶胞边长为 a nm (1 nm =10 9m),
(4)维生素 C具有较强的还原性,向碘和淀粉的混合液中加入维生素 C,可观察到的 阿伏伽德罗常数为 NA。则碳化硅晶体的密度为
g·cm 3(列出计算式)。
现象是 。
化学 第 5页 (共 8页) 化学 第 6页 (共 8页)
{#{QQABLYSQogAgQoBAABgCQwmACAOQkAACCAoOQAAEoAAASQNABAA=}#}
姓名: 班级: 考号:
密 封 线 内 不 要 答 题
22.(8分)有机化合物 A可由葡萄糖发酵得到,在医药和食品领域中有广泛应用。通过实验 23.(13分)甲基丙烯酸羟乙酯(HEMA)是制隐形眼镜的材料,一种工业合成路线如下:
测定有机化合物 A的分子结构的过程如下:
(1)确定 A的实验式。
9.0 g有机化合物 A完全燃烧,经检测,得到 6.72 L CO2(标准状况)和 5.4 g H2O,
则 A的实验式为 。
(2)确定 A的分子式。
已知:ⅰ.
通过 (填仪器分析方法)法可以测得 A的相对分子质量为 90,则 A的
分子式为 。
ⅱ.
(3)确定 A的分子结构。
使用使用现代分析仪器对 A的分子结构进行测定,结果如下:
谱图 数据分析结果 (1)乙烯是常见的工业原料,可用于制备塑料,请写出制备聚乙烯的化学方程式 。
(2)①的化学方程式是 。
红外光谱 含有—COOH、—OH
(3)试剂 a是 。
(4)②的反应类型是 。
核磁共振氢谱 峰面积比为 1︰1︰1︰3 (5)B的结构简式是 。
(6)③的化学方程式是 。
的结构简式为______。 (7)B有多种同分异构体,其中能与 NaHCO3溶液反应放出气体的链状异构体有(不考
(4)研究 A的结构和性质的关系。
虑立体异构): 、 。
① A的分子存在两种空间结构,它们具有完全相同的组成和原子排列,却互为镜像,
具有不同的光学性质,两种分子的关系为______(填字母,下同)。 (8)工业上以 为原料生产 HEMA,还可利用反应:
a.碳架异构 b.位置异构 c.官能团异构 d.手性异构 制备环氧乙烷,环氧乙烷可代替 A,与 B反
② 已知:电离常数 Ka(A)=1.38×10-4,Ka(丙酸)=1.34×10-5,分析数据可知 A的酸
应生成 HEMA,与上述流程对比其优点是 (答出一条即可)。
性强于丙酸,请从共价键极性的角度解释原因______。
化学 第 7页 (共 8页) 化学 第 8页 (共 8页)
{#{QQABLYSQogAgQoBAABgCQwmACAOQkAACCAoOQAAEoAAASQNABAA=}#}
密 封 线 内 不 要 答 题
北京市宣武外国语实验学校 2023-2024 学年度第二学期
期中考试评分标准 高二 化学
第一部分(选择题 共 48分)
每小题只.有.一.个.选.项.符合题意(每小题 3分)
题号 1 2 3 4 5 6 7 8
答案 D B D A B A C C
题号 9 10 11 12 13 14 15 16
答案 C A C D A B D B
第二部分(非选择题 共 52分)
17.(5分)(每空 1分)
(1)E (2)D (3)B (4)C (5)A
18.(5分)
(1)2-甲基-1-丙烯(1分) (2)①②③(2分)
(3)CH2=C(CH3)2 + Br2 → BrCH2CBr(CH3)2(2分)
19.(5分)
(1)C6H8O6(1分) (2)碳碳双键、羟基、酯基(2分,写结构式给分)
(3)分子中含有多个羟基(1分) (4)蓝色褪去(1分)
20.(7分)
(1)sp(1分) sp3(1分) (2)H2O(1分) H2O分子之间能形成氢键(1分)
(3)3d54s2(1分) (4)abcd(2分)
21.(9分)
(1)<(1分) 正四面体形(1分)
(2)①<(1分) ②>(1分) SiH4与 NH3的中心原子上价层电子对数均为 4,但
NH3中心原子 N原子上含有一对孤对电子,孤对电子与成键电子之间的排斥力强于成键电
{#{QQABLYSQogAgQoBAABgCQwmACAOQkAACCAoOQAAEoAAASQNABAA=}#}
子与成键电子之间的斥力,导致 SiH4中 H—Si—H的键角大于 NH3中 H—N—H的键角(2
分)
(3 4 40)① 4(1分)共价晶体(1分) ②
N (a 10 7 3
(1分)
A )
22.(8分)
(1)CH2O(1分) (2)质谱(1分) C3H6O3(1分) (3) (2分)
(4)①d(1分) ②O—C的极性大于 H—C的极性,A羧基中的羟基的极性增强,更易
电离出氢离子(2分)
23.(13分)
(1) (2分)
(2) (2分)
(3)NaOH水溶液(1分) (4)酯化反应(取代反应)(1分)
(5) (2分)
(6) (2分)
(7) (各 1分)
(8)步骤少、原子利用率高等(答出一条即可)(1分)
{#{QQABLYSQogAgQoBAABgCQwmACAOQkAACCAoOQAAEoAAASQNABAA=}#}
同课章节目录
