2.3 构成物质的微粒(Ⅱ)——原子和离子 课件(共59张PPT)初中化学 科粤版 九年级上册
文档属性
| 名称 | 2.3 构成物质的微粒(Ⅱ)——原子和离子 课件(共59张PPT)初中化学 科粤版 九年级上册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 7.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-27 00:00:00 | ||
图片预览










文档简介
(共59张PPT)
第二章 空气、物质的构成
2.3
构成物质的微粒(Ⅱ)——原子和离子
逐点
导讲练
课堂小结
作业提升
学习目标
课时讲解
1
课时流程
2
原子
(1)概念 (2)特性
原子的构成
(1)构成 (2)原子结构示意图
相对原子质量
离子
课时导入
【投影展示】由原子构成的物质
硅由硅原子构成
感悟新知
知识点
1
1. 根据氧化汞的分解,利用总结归纳法总结得出原子的相关知识:
(1) 原子是构成物质的另一种微粒,金属、稀有气体和部分固态非金属都是由原子直接构成的,如汞由汞原子构成,氦气由氦原子构成等。
原 子
知1-讲
感悟新知
(2) 分子是由原子构成的,如氧化汞分子是由
氧原子和汞原子构成的。
(3) 氧化汞受热时,氧化汞分子分解成汞原子和氧原子,汞原子直接构成金属汞,氧原子两两结合形成氧分子,众多氧分子聚集形成氧气。即在化学变化中,分子本身发生改变,分解成原子;原子重新组合成新分子,构成新物质。
(4)原子是化学变化中的最小微粒。
知1-讲
感悟新知
2. 原子作为构成物质的微粒之一,也具有一些基本的性质:在不断地运动,原子间存在间隔,原子的质量和体积都很小等。
知1-讲
感悟新知
易错提示
1.分子由原子构成,分子不一定比原子大,但分子比构成它的原子大。
2.原子在化学变化中不能再分,是化学变化中的最小粒子。但原子不是最小的粒子。通过其他方法原子可以再分。
知1-讲
知1-练
感悟新知
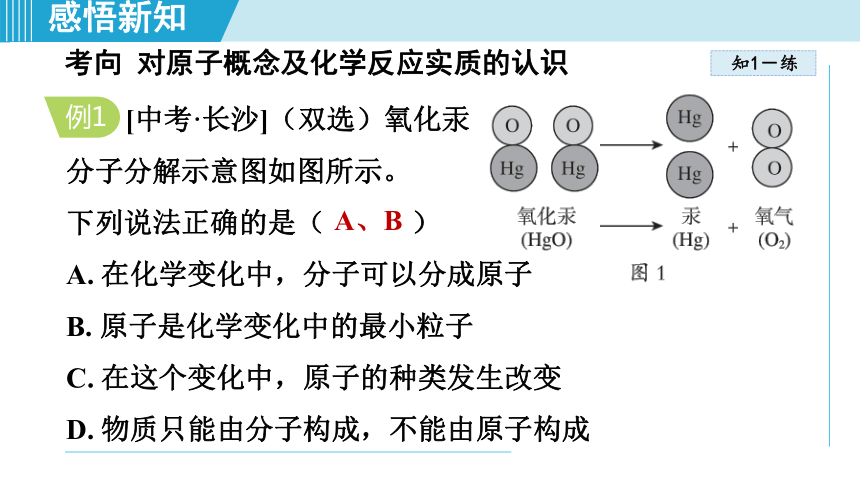
[中考·长沙](双选)氧化汞
分子分解示意图如图所示。
下列说法正确的是( )
A. 在化学变化中,分子可以分成原子
B. 原子是化学变化中的最小粒子
C. 在这个变化中,原子的种类发生改变
D. 物质只能由分子构成,不能由原子构成
A、B
例1
考向 对原子概念及化学反应实质的认识
感悟新知
解题秘方:导引:在化学变化中,分子可以分成原子,原子重新组合成新分子,原子是化学变化中的最小粒子,A、B 正确;反应前后原子种类不变,C 不正确;分子、原子、离子都能构成物质,D 不正确。
知1-练
感悟新知
教你一招:关于原子常有以下几种错误认识:1. 原子不能构成物质。原子也是构成物质的一种粒子,金属、稀有气体由原子构成;2. 原子是最小的粒子,不能再分。原子是化学变化中的最小粒子,在化学变化中不能再分;3. 化学变化前后原子的种类改变。在化学变化中,分子分成原子,原子重新组合成新的分子,因此化学变化前后分子的种类改变,而原子的种类、数目不变。
知1-练
感悟新知
知1-练
知识拓展
原子是化学变化中的最小粒子,在化学变化中不能再分。
离开“化学变化”这一前提,原子可以再分。原子可分为原子核与核外电子。原子弹爆炸其实是利用核裂变时产生巨大的能量,该变化中原子发生了变化,不是化学变化。
感悟新知
知识点
2
比较分子和原子
知2-讲
分子 原子
概念 分子是保持物质化学性质的一种微粒 化学变化中的最小微粒
本质区别 在化学反应中,分子可分成原子 在化学反应中,原子不可再分
感悟新知
知2-讲
分子 原子
相同点 ①质量和体积都很小;②都在不停地运动; ③粒子间有间隔;④都是构成物质的微粒。 联系 感悟新知
特别提醒
分子、原子都可以构成物质,也能保持相应物质的化学性质。如水由水分子构成,保持水化学性质的最小微粒是水分子;汞由汞原子构成,汞原子是保持汞化学性质的最小微粒。
知2-讲
知2-练
感悟新知
[改编·锦州] 下列有关微粒的说法正确的是( )
A. 分子都由原子构成
B. 分子大,原子小
C. 保持水的化学性质的粒子是氢原子和氧原子
D. 分子可以再分而原子不可再分
A
例2
考向 分子和原子的区别与联系
感悟新知
解题秘方:可从物质的构成、微粒的性质、物质的变化等角度来比较。
导引:保持水的化学性质的最小粒子是水分子;分子与原子的本质区别是:在化学反应中,分子可分,而原子却不能再分。
知2-练
感悟新知
易错提醒
1.分子、原子都可以构成物质。
2.分子、原子都在不停地运动。
3.在化学变化中,分子可以再分,原子不能再分。
知2-练
感悟新知
知识点
3
1. 为研究原子结构做出贡献的科学家:英国的科学家汤姆逊发现了电子,卢瑟福发现了原子核并指出其构成。
原子的构成
知3-讲
易错提醒
原子一般由质子、中子、电子构成,但不是所有的原子中都含有中子,如普通氢原子中不含有中子。
感悟新知
2. 原子由原子核和核外电子构成。
3. 原子核一般由一定数目的质子和一定数目的中子构成。
4. 每个质子带一个单位的正电荷,每个电子带一个单位的负电荷,中子不带电。
5. 通过对几种原子的内部构成的观察,利用总结归纳法得出原子结构的规律:
知3-讲
感悟新知
(1)质子数不同,原子的种类不同。
(2)在原子中,质子数不一定等于中子数。
(3)不是所有的原子都是由质子、中子、电子构成的,普通氢原子的原子核内无中子。
(4)在原子中,质子数=核电荷数=核外电子数。
6. 原子的质量主要集中在原子核上,原子核所占体积极小,电子在核外较大空间做高速运转。
知3-讲
知3-练
感悟新知
原子的构成示意图如图1 所示,下列叙述正确的是( )
A. 原子是实心球体
B. 质子、中子、电子均匀地分布在原子中
C. 质子与电子质量相等
D. 整个原子的质量主要集中在原子核上
D
例3
考向 对原子构成的认识
题型1 原子的结构
感悟新知
解题秘方:学会看图识原子:一看原子结构——由原子核和核外电子构成,二看数字——原子核的直径数量级是原子直径数量级的10-5~10-4,原子核的体积很小,原子不是实心球体。
知3-练
感悟新知
知3-练
知识链接
知3-练
感悟新知
[中考·云南]“嫦娥五号”已完成我国首次月球采样任务,带回1 731 g 月壤,月壤中含有丰富的氦3。已知氦3 的质子数为2,中子数为1。则氦3 的核外电子数为( )
A.1 B.2 C.3 D.4
B
例4
题型2 原子中各微粒间的数量关系
感悟新知
解题秘方:利用原子中质子、电子间的数量关系,即质子数= 核电荷数= 核外电子数来解题。
教你一招:原子中质子、中子、电子间的数量关系可运用推理法得出结论。原子由带正电荷的原子核与核外带负电荷的电子构成,原子不显电性,因此,原子核所带正电荷数与核外电子所带负电荷数相等,中子不带电,所以原子中质子数、核电荷数与核外电子数均相等。
知3-练
感悟新知
易错提醒
在原子中,质子数与核外电子数一定相等,与中子数可能相等,也可能不相等。
知3-练
感悟新知
知识点
4
1. 原子结构示意图
圈内数字表示质子数(或核电荷数),“+”表示原子核带正电荷,弧线表示电子层,弧线上的数字表示该电子层上的电子数(如镁原子结构示意图):
核外电子的分层排布
知4-讲
感悟新知
知4-讲
感悟新知
2. 通过观察分析质子数1~18 的原子结构示意图,得出以下规律:
(1) 原子核外第一层最多排2 个电子,第二层最多排8 个电子;
(2) 最外层最多不超过8 个电子,达到8 个电子的惰性状态是一种稳定结构;
(3) 金属原子最外层电子数一般小于4,在反应中较易失去;非金属原子最外层电子数一般大于4 个,在反应中较易得到电子。
知4-讲
感悟新知
易错提示
1.一般来讲,金属原子的最外层电子数少于4个,但最外层电子数少于4的原子不一定是金属原子,如氦原子、氢原子。
2.原子的化学性质与最外层电子数关系密切,但是最外层电子数相同的原子化学性质不一定相似,如氦与镁。
知4-讲
知4-练
感悟新知
[中考·益阳] 如图4 为钠的原子结构示意图,由图可获得的信息是( )
A. 钠原子的核外第一层有1 个电子
B. 钠原子在化学反应中容易失去1 个电子
C. 钠原子核内的质子数为11,中子数为0
D. 钠原子的核外有2 层电子
B
例5
考向 原子结构与原子的化学性质
题型1 原子结构示意图的意义
感悟新知
解题秘方:根据原子结构示意图的意义来判断质子数及核外电子的分层排布情况,根据最外层电子数判断化学变化中电子的得失情况。
导引:由钠原子结构示意图可知,钠原子的核外第一层有2 个电子,A 错误;由钠原子结构示意图可知,钠原子核内的质子数为11,无法确定中子数,C 错误;由钠原子结构示意图可知,钠原子的核外有3 层电子,D 错误。
知4-练
感悟新知
规律点拨
原子结构示意图能够直观地反映原子的结构,即原子核和核外电子的分层排布。圆圈内标明核内质子数及带电荷情况,弧线表示电子层,弧线上的数字表示每一电子层上的电子数,因为原子不显电性,所以质子数与核外电子数相等。
知4-练
知4-练
感悟新知
[中考·随州] 如图5 所示是几种粒子的结构示意图,有关说法正确的是( )
A. ①和②两种粒子的
化学性质相似
B. ③和④最外层电子数都是8,达到相对稳定结构,都是稀有气体的原子
C. 粒子②在化学反应中容易失去电子
D. ①②③④都达到了相对稳定结构
例6
题型2 分析原子结构与化学性质间的关系
C
感悟新知
解题秘方:根据结构示意图中的最外层电子数可推断其化学性质,最外层电子数为8(只有一个电子层,电子数为2)的已达到相对稳定结构,如①③④,②中最外层有2 个电子,易失去2 个电子达到相对稳定结构。
知4-练
感悟新知
教你一招:根据粒子结构示意图判断其类别及化学性质时,要注意特殊与一般的思想的运用,如原子的化学性质与最外层电子数关系密切,一般来讲,原子最外层电子数相同,化学性质相似,但是也有特例,如氦原子与镁原子的最外层电子数相同,化学性质却不相似。
知4-练
感悟新知
技法指导
只含有一个电子层且电子数为2或含多个电子层且最外层电子数为8的结构为相对稳定结构。最外层电子数( n )小于4个的则易失去最外层电子达到相对稳定结构,最外层电子数( n )大于4 个,则易得到( 8-n ) 个电子达到相对稳定结构。
原子可以通过得失电子达到相对稳定结构,因此达到相对稳定结构的粒子不一定是稀有气体的原子。
知4-练
感悟新知
知识点
5
1. 概念 相对原子质量是指一个原子的质量与一个碳原子 (C-12)质量的1/12 相比较所得的比值。
2. 相对原子质量的计算方法
(1)相对原子质量可用公式表示为:
相对原子质量=
由公式可推出:原子的实际质量越大,相对原子质量就越大。
(2)相对原子质量≈质子数+ 中子数。
相对原子质量
知5-讲
感悟新知
易错提示
相对原子质量的单位是“1”,常略去不写,所以看起来是一个数值。
张青莲教授为相对原子质量的测定作出了卓越贡献。
知5-讲
知5-练
感悟新知
下列关于相对原子质量的说法正确的是( )
A. 相对原子质量就是原子的实际质量
B. 相对原子质量是原子质量与一种碳原子质量的比值
C. 原子质量越大,相对原子质量就越大
D. 相对原子质量的单位为“g”
C
例7
考向 考查对相对原子质量的理解及有关计算
题型1 理解相对原子质量
感悟新知
解题秘方:根据相对原子质量的计算公式:相对原子质量等于原子质量与C-12 原子质量的1/ 12 之比,结合数学思想可得出相关结论。相对原子质量单位不是“g”,不是实际质量,与实际质量成正比。
知5-练
感悟新知
方法点拨:可用“对比法”来学习相对原子质量。
知5-练
相对原子质量 原子实际质量
性质 比较出来的,相对的 测出来的,绝对的
数值 大于或等于1 非常小
单位 1 “g”或“kg”
联系 某原子的相对原子质量= 一个该原子的实际质量(kg) 一个碳(12)原子的实际质量(kg)× 含有6个质子和6个中子的碳原子
感悟新知
规律点拨
相对原子质量不等于原子的实际质量,相对原子质量与原子质量成正比,原子质量越大、相对原子质量越大;不同原子的相对原子质量之比等于其原子质量之比。
知5-练
知5-练
感悟新知
美国科学家劳伦斯·利费莫尔宣布他与俄罗斯科学家成功合成了一种核外电子数为118、中子数为179 的超重元素原子,该原子的相对原子质量和质子数分别是( )
A. 297、118 B. 118、297 C. 118、179 D. 179、118
A
例8
题型2 相对原子质量的计算
感悟新知
解题秘方:根据原子中粒子间的数量关系
解题,即:在原子中,质子数等于核外电子数,相对原子质量近似等于质子数与中子数之和。
误区警示
在原子中,质子数与核外电子数一定相等,与中子数不一定相等,相对原子质量(近似)可用质子数(或核电荷数)与中子数之和表示。
知5-练
感悟新知
知识点
6
1. 离子也是构成物质的一种微粒,具有原子、分子等微粒的共同特性。
2. 离子的形成 离子是由原子通过得失电子后形成的,其中带正电荷的离子为阳离子,带负电荷的离子为阴离子。
3. 离子可以构成物质。
如氯化钠由氯离子和钠离子构成,氯化钾由氯离子和钾离子构成。
离 子
知6-讲
感悟新知
原子和离子的区别与联系:
知6-讲
粒子种类 原子 阳离子 阴离子
区 别 粒子结构 质子数= 电子数 质子数>电子数 质子数<电子数
粒子电性 不显电性 带正电荷 带负电荷
联系 阳离子 原子 阴离子
失电子
得电子
得电子
失电子
感悟新知
特别提醒
1.原子形成离子只是电子的得失,核内质子数不变,如钠离子( Na+ )和钠原子( Na ) 质子数都为11。
2.原子与其形成的离子电子层数可能相同(如Cl和CI-),也可能不同( 如Na 和Na+)。
知6-讲
知6-练
感悟新知
[图像信息题] 图6 是钠与氯气(Cl2)反应生成氯化钠的模拟图。
例9
考向 考查离子的形成、判断及与物质间的关系
题型1 离子的形成
知6-练
感悟新知
从图示可知下列说法不正确的是( )
A. 反应中钠原子转移一个电子给氯原子
B. 反应中氯气分子分成氯原子
C. 核外电子在化学反应中起着重要作用
D. 氯化钠由氯化钠分子构成
D
感悟新知
导引:金属原子在反应中失去电子,分子在化学变化中分裂为原子,原子最外层电子数与化学性质密切相关,氯化钠由钠离子和氯离子构成。
知6-练
感悟新知
知6-练
易错提醒
结合结构示意图认识氯化钠的形成过程:
知6-练
感悟新知
[中考·恩施] 下列是四种粒子结构示意图,其中表示阳离子的是( )
例10
题型2 根据结构示意图判断微粒的种类
B
感悟新知
解题秘方:比较粒子结构示意图中质子数与核外电子数的大小,可判断是原子、阳离子,还是阴离子。
导引:①质子数=核外电子数=10,为原子,A 错误;②质子数=12,核外电子数=10,质子数> 核外电子数,为阳离子,B 正确;③质子数= 核外电子数=12,为原子,C错误;④质子数< 核外电子数,为阴离子,D 错误。
知6-练
感悟新知
知6-练
方法点拨
根据结构示意图判断粒子种类的方法:
质子数-核外电子数=n
n>0→阳离子(带n个单位正电荷)
n=0 →原子
n<0→阴离子(带|n|个单位负电荷)
知6-练
感悟新知
[中考·河南] 物质由微观粒子构成。下列都由离子构成的一组物质是( )
A. 氯化钠、硫酸铜 B. 水、干冰
C. 金刚石、氧化汞 D. 氦气、氨气
例11
题型3 判断离子与物质间的关系
A
感悟新知
导引:氯化钠、硫酸铜分别是由钠离子和氯离子、铜离子和硫酸根离子构成的;水和干冰均是由分子构成的;金刚石是由碳原子直接构成的;氦气是由氦原子直接构成的,氨气是由氨分子构成的。
知6-练
感悟新知
教你一招:稀有气体、金属一般由原子构成,由离子构成的物质有以下特点:一方失电子(如金属原子),一方得电子(如非金属原子),双方通过得失电子形成稳定的离子,阴阳离子间通过静电作用形成稳定的物质。
知6-练
易错提示
由离子构成的物质中含有阴、阳离子,但该物质不显电性。
课堂小结
原子
离子
逻辑关系法
特性
概念
原子结构示意图
原子的构成
相对原子质量
得失
电子
构成
分子
第二章 空气、物质的构成
2.3
构成物质的微粒(Ⅱ)——原子和离子
逐点
导讲练
课堂小结
作业提升
学习目标
课时讲解
1
课时流程
2
原子
(1)概念 (2)特性
原子的构成
(1)构成 (2)原子结构示意图
相对原子质量
离子
课时导入
【投影展示】由原子构成的物质
硅由硅原子构成
感悟新知
知识点
1
1. 根据氧化汞的分解,利用总结归纳法总结得出原子的相关知识:
(1) 原子是构成物质的另一种微粒,金属、稀有气体和部分固态非金属都是由原子直接构成的,如汞由汞原子构成,氦气由氦原子构成等。
原 子
知1-讲
感悟新知
(2) 分子是由原子构成的,如氧化汞分子是由
氧原子和汞原子构成的。
(3) 氧化汞受热时,氧化汞分子分解成汞原子和氧原子,汞原子直接构成金属汞,氧原子两两结合形成氧分子,众多氧分子聚集形成氧气。即在化学变化中,分子本身发生改变,分解成原子;原子重新组合成新分子,构成新物质。
(4)原子是化学变化中的最小微粒。
知1-讲
感悟新知
2. 原子作为构成物质的微粒之一,也具有一些基本的性质:在不断地运动,原子间存在间隔,原子的质量和体积都很小等。
知1-讲
感悟新知
易错提示
1.分子由原子构成,分子不一定比原子大,但分子比构成它的原子大。
2.原子在化学变化中不能再分,是化学变化中的最小粒子。但原子不是最小的粒子。通过其他方法原子可以再分。
知1-讲
知1-练
感悟新知
[中考·长沙](双选)氧化汞
分子分解示意图如图所示。
下列说法正确的是( )
A. 在化学变化中,分子可以分成原子
B. 原子是化学变化中的最小粒子
C. 在这个变化中,原子的种类发生改变
D. 物质只能由分子构成,不能由原子构成
A、B
例1
考向 对原子概念及化学反应实质的认识
感悟新知
解题秘方:导引:在化学变化中,分子可以分成原子,原子重新组合成新分子,原子是化学变化中的最小粒子,A、B 正确;反应前后原子种类不变,C 不正确;分子、原子、离子都能构成物质,D 不正确。
知1-练
感悟新知
教你一招:关于原子常有以下几种错误认识:1. 原子不能构成物质。原子也是构成物质的一种粒子,金属、稀有气体由原子构成;2. 原子是最小的粒子,不能再分。原子是化学变化中的最小粒子,在化学变化中不能再分;3. 化学变化前后原子的种类改变。在化学变化中,分子分成原子,原子重新组合成新的分子,因此化学变化前后分子的种类改变,而原子的种类、数目不变。
知1-练
感悟新知
知1-练
知识拓展
原子是化学变化中的最小粒子,在化学变化中不能再分。
离开“化学变化”这一前提,原子可以再分。原子可分为原子核与核外电子。原子弹爆炸其实是利用核裂变时产生巨大的能量,该变化中原子发生了变化,不是化学变化。
感悟新知
知识点
2
比较分子和原子
知2-讲
分子 原子
概念 分子是保持物质化学性质的一种微粒 化学变化中的最小微粒
本质区别 在化学反应中,分子可分成原子 在化学反应中,原子不可再分
感悟新知
知2-讲
分子 原子
相同点 ①质量和体积都很小;②都在不停地运动; ③粒子间有间隔;④都是构成物质的微粒。 联系 感悟新知
特别提醒
分子、原子都可以构成物质,也能保持相应物质的化学性质。如水由水分子构成,保持水化学性质的最小微粒是水分子;汞由汞原子构成,汞原子是保持汞化学性质的最小微粒。
知2-讲
知2-练
感悟新知
[改编·锦州] 下列有关微粒的说法正确的是( )
A. 分子都由原子构成
B. 分子大,原子小
C. 保持水的化学性质的粒子是氢原子和氧原子
D. 分子可以再分而原子不可再分
A
例2
考向 分子和原子的区别与联系
感悟新知
解题秘方:可从物质的构成、微粒的性质、物质的变化等角度来比较。
导引:保持水的化学性质的最小粒子是水分子;分子与原子的本质区别是:在化学反应中,分子可分,而原子却不能再分。
知2-练
感悟新知
易错提醒
1.分子、原子都可以构成物质。
2.分子、原子都在不停地运动。
3.在化学变化中,分子可以再分,原子不能再分。
知2-练
感悟新知
知识点
3
1. 为研究原子结构做出贡献的科学家:英国的科学家汤姆逊发现了电子,卢瑟福发现了原子核并指出其构成。
原子的构成
知3-讲
易错提醒
原子一般由质子、中子、电子构成,但不是所有的原子中都含有中子,如普通氢原子中不含有中子。
感悟新知
2. 原子由原子核和核外电子构成。
3. 原子核一般由一定数目的质子和一定数目的中子构成。
4. 每个质子带一个单位的正电荷,每个电子带一个单位的负电荷,中子不带电。
5. 通过对几种原子的内部构成的观察,利用总结归纳法得出原子结构的规律:
知3-讲
感悟新知
(1)质子数不同,原子的种类不同。
(2)在原子中,质子数不一定等于中子数。
(3)不是所有的原子都是由质子、中子、电子构成的,普通氢原子的原子核内无中子。
(4)在原子中,质子数=核电荷数=核外电子数。
6. 原子的质量主要集中在原子核上,原子核所占体积极小,电子在核外较大空间做高速运转。
知3-讲
知3-练
感悟新知
原子的构成示意图如图1 所示,下列叙述正确的是( )
A. 原子是实心球体
B. 质子、中子、电子均匀地分布在原子中
C. 质子与电子质量相等
D. 整个原子的质量主要集中在原子核上
D
例3
考向 对原子构成的认识
题型1 原子的结构
感悟新知
解题秘方:学会看图识原子:一看原子结构——由原子核和核外电子构成,二看数字——原子核的直径数量级是原子直径数量级的10-5~10-4,原子核的体积很小,原子不是实心球体。
知3-练
感悟新知
知3-练
知识链接
知3-练
感悟新知
[中考·云南]“嫦娥五号”已完成我国首次月球采样任务,带回1 731 g 月壤,月壤中含有丰富的氦3。已知氦3 的质子数为2,中子数为1。则氦3 的核外电子数为( )
A.1 B.2 C.3 D.4
B
例4
题型2 原子中各微粒间的数量关系
感悟新知
解题秘方:利用原子中质子、电子间的数量关系,即质子数= 核电荷数= 核外电子数来解题。
教你一招:原子中质子、中子、电子间的数量关系可运用推理法得出结论。原子由带正电荷的原子核与核外带负电荷的电子构成,原子不显电性,因此,原子核所带正电荷数与核外电子所带负电荷数相等,中子不带电,所以原子中质子数、核电荷数与核外电子数均相等。
知3-练
感悟新知
易错提醒
在原子中,质子数与核外电子数一定相等,与中子数可能相等,也可能不相等。
知3-练
感悟新知
知识点
4
1. 原子结构示意图
圈内数字表示质子数(或核电荷数),“+”表示原子核带正电荷,弧线表示电子层,弧线上的数字表示该电子层上的电子数(如镁原子结构示意图):
核外电子的分层排布
知4-讲
感悟新知
知4-讲
感悟新知
2. 通过观察分析质子数1~18 的原子结构示意图,得出以下规律:
(1) 原子核外第一层最多排2 个电子,第二层最多排8 个电子;
(2) 最外层最多不超过8 个电子,达到8 个电子的惰性状态是一种稳定结构;
(3) 金属原子最外层电子数一般小于4,在反应中较易失去;非金属原子最外层电子数一般大于4 个,在反应中较易得到电子。
知4-讲
感悟新知
易错提示
1.一般来讲,金属原子的最外层电子数少于4个,但最外层电子数少于4的原子不一定是金属原子,如氦原子、氢原子。
2.原子的化学性质与最外层电子数关系密切,但是最外层电子数相同的原子化学性质不一定相似,如氦与镁。
知4-讲
知4-练
感悟新知
[中考·益阳] 如图4 为钠的原子结构示意图,由图可获得的信息是( )
A. 钠原子的核外第一层有1 个电子
B. 钠原子在化学反应中容易失去1 个电子
C. 钠原子核内的质子数为11,中子数为0
D. 钠原子的核外有2 层电子
B
例5
考向 原子结构与原子的化学性质
题型1 原子结构示意图的意义
感悟新知
解题秘方:根据原子结构示意图的意义来判断质子数及核外电子的分层排布情况,根据最外层电子数判断化学变化中电子的得失情况。
导引:由钠原子结构示意图可知,钠原子的核外第一层有2 个电子,A 错误;由钠原子结构示意图可知,钠原子核内的质子数为11,无法确定中子数,C 错误;由钠原子结构示意图可知,钠原子的核外有3 层电子,D 错误。
知4-练
感悟新知
规律点拨
原子结构示意图能够直观地反映原子的结构,即原子核和核外电子的分层排布。圆圈内标明核内质子数及带电荷情况,弧线表示电子层,弧线上的数字表示每一电子层上的电子数,因为原子不显电性,所以质子数与核外电子数相等。
知4-练
知4-练
感悟新知
[中考·随州] 如图5 所示是几种粒子的结构示意图,有关说法正确的是( )
A. ①和②两种粒子的
化学性质相似
B. ③和④最外层电子数都是8,达到相对稳定结构,都是稀有气体的原子
C. 粒子②在化学反应中容易失去电子
D. ①②③④都达到了相对稳定结构
例6
题型2 分析原子结构与化学性质间的关系
C
感悟新知
解题秘方:根据结构示意图中的最外层电子数可推断其化学性质,最外层电子数为8(只有一个电子层,电子数为2)的已达到相对稳定结构,如①③④,②中最外层有2 个电子,易失去2 个电子达到相对稳定结构。
知4-练
感悟新知
教你一招:根据粒子结构示意图判断其类别及化学性质时,要注意特殊与一般的思想的运用,如原子的化学性质与最外层电子数关系密切,一般来讲,原子最外层电子数相同,化学性质相似,但是也有特例,如氦原子与镁原子的最外层电子数相同,化学性质却不相似。
知4-练
感悟新知
技法指导
只含有一个电子层且电子数为2或含多个电子层且最外层电子数为8的结构为相对稳定结构。最外层电子数( n )小于4个的则易失去最外层电子达到相对稳定结构,最外层电子数( n )大于4 个,则易得到( 8-n ) 个电子达到相对稳定结构。
原子可以通过得失电子达到相对稳定结构,因此达到相对稳定结构的粒子不一定是稀有气体的原子。
知4-练
感悟新知
知识点
5
1. 概念 相对原子质量是指一个原子的质量与一个碳原子 (C-12)质量的1/12 相比较所得的比值。
2. 相对原子质量的计算方法
(1)相对原子质量可用公式表示为:
相对原子质量=
由公式可推出:原子的实际质量越大,相对原子质量就越大。
(2)相对原子质量≈质子数+ 中子数。
相对原子质量
知5-讲
感悟新知
易错提示
相对原子质量的单位是“1”,常略去不写,所以看起来是一个数值。
张青莲教授为相对原子质量的测定作出了卓越贡献。
知5-讲
知5-练
感悟新知
下列关于相对原子质量的说法正确的是( )
A. 相对原子质量就是原子的实际质量
B. 相对原子质量是原子质量与一种碳原子质量的比值
C. 原子质量越大,相对原子质量就越大
D. 相对原子质量的单位为“g”
C
例7
考向 考查对相对原子质量的理解及有关计算
题型1 理解相对原子质量
感悟新知
解题秘方:根据相对原子质量的计算公式:相对原子质量等于原子质量与C-12 原子质量的1/ 12 之比,结合数学思想可得出相关结论。相对原子质量单位不是“g”,不是实际质量,与实际质量成正比。
知5-练
感悟新知
方法点拨:可用“对比法”来学习相对原子质量。
知5-练
相对原子质量 原子实际质量
性质 比较出来的,相对的 测出来的,绝对的
数值 大于或等于1 非常小
单位 1 “g”或“kg”
联系 某原子的相对原子质量= 一个该原子的实际质量(kg) 一个碳(12)原子的实际质量(kg)× 含有6个质子和6个中子的碳原子
感悟新知
规律点拨
相对原子质量不等于原子的实际质量,相对原子质量与原子质量成正比,原子质量越大、相对原子质量越大;不同原子的相对原子质量之比等于其原子质量之比。
知5-练
知5-练
感悟新知
美国科学家劳伦斯·利费莫尔宣布他与俄罗斯科学家成功合成了一种核外电子数为118、中子数为179 的超重元素原子,该原子的相对原子质量和质子数分别是( )
A. 297、118 B. 118、297 C. 118、179 D. 179、118
A
例8
题型2 相对原子质量的计算
感悟新知
解题秘方:根据原子中粒子间的数量关系
解题,即:在原子中,质子数等于核外电子数,相对原子质量近似等于质子数与中子数之和。
误区警示
在原子中,质子数与核外电子数一定相等,与中子数不一定相等,相对原子质量(近似)可用质子数(或核电荷数)与中子数之和表示。
知5-练
感悟新知
知识点
6
1. 离子也是构成物质的一种微粒,具有原子、分子等微粒的共同特性。
2. 离子的形成 离子是由原子通过得失电子后形成的,其中带正电荷的离子为阳离子,带负电荷的离子为阴离子。
3. 离子可以构成物质。
如氯化钠由氯离子和钠离子构成,氯化钾由氯离子和钾离子构成。
离 子
知6-讲
感悟新知
原子和离子的区别与联系:
知6-讲
粒子种类 原子 阳离子 阴离子
区 别 粒子结构 质子数= 电子数 质子数>电子数 质子数<电子数
粒子电性 不显电性 带正电荷 带负电荷
联系 阳离子 原子 阴离子
失电子
得电子
得电子
失电子
感悟新知
特别提醒
1.原子形成离子只是电子的得失,核内质子数不变,如钠离子( Na+ )和钠原子( Na ) 质子数都为11。
2.原子与其形成的离子电子层数可能相同(如Cl和CI-),也可能不同( 如Na 和Na+)。
知6-讲
知6-练
感悟新知
[图像信息题] 图6 是钠与氯气(Cl2)反应生成氯化钠的模拟图。
例9
考向 考查离子的形成、判断及与物质间的关系
题型1 离子的形成
知6-练
感悟新知
从图示可知下列说法不正确的是( )
A. 反应中钠原子转移一个电子给氯原子
B. 反应中氯气分子分成氯原子
C. 核外电子在化学反应中起着重要作用
D. 氯化钠由氯化钠分子构成
D
感悟新知
导引:金属原子在反应中失去电子,分子在化学变化中分裂为原子,原子最外层电子数与化学性质密切相关,氯化钠由钠离子和氯离子构成。
知6-练
感悟新知
知6-练
易错提醒
结合结构示意图认识氯化钠的形成过程:
知6-练
感悟新知
[中考·恩施] 下列是四种粒子结构示意图,其中表示阳离子的是( )
例10
题型2 根据结构示意图判断微粒的种类
B
感悟新知
解题秘方:比较粒子结构示意图中质子数与核外电子数的大小,可判断是原子、阳离子,还是阴离子。
导引:①质子数=核外电子数=10,为原子,A 错误;②质子数=12,核外电子数=10,质子数> 核外电子数,为阳离子,B 正确;③质子数= 核外电子数=12,为原子,C错误;④质子数< 核外电子数,为阴离子,D 错误。
知6-练
感悟新知
知6-练
方法点拨
根据结构示意图判断粒子种类的方法:
质子数-核外电子数=n
n>0→阳离子(带n个单位正电荷)
n=0 →原子
n<0→阴离子(带|n|个单位负电荷)
知6-练
感悟新知
[中考·河南] 物质由微观粒子构成。下列都由离子构成的一组物质是( )
A. 氯化钠、硫酸铜 B. 水、干冰
C. 金刚石、氧化汞 D. 氦气、氨气
例11
题型3 判断离子与物质间的关系
A
感悟新知
导引:氯化钠、硫酸铜分别是由钠离子和氯离子、铜离子和硫酸根离子构成的;水和干冰均是由分子构成的;金刚石是由碳原子直接构成的;氦气是由氦原子直接构成的,氨气是由氨分子构成的。
知6-练
感悟新知
教你一招:稀有气体、金属一般由原子构成,由离子构成的物质有以下特点:一方失电子(如金属原子),一方得电子(如非金属原子),双方通过得失电子形成稳定的离子,阴阳离子间通过静电作用形成稳定的物质。
知6-练
易错提示
由离子构成的物质中含有阴、阳离子,但该物质不显电性。
课堂小结
原子
离子
逻辑关系法
特性
概念
原子结构示意图
原子的构成
相对原子质量
得失
电子
构成
分子
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
