2.4 辨别物质的元素组成 课件(共51张PPT)初中化学科粤版九年级上册
文档属性
| 名称 | 2.4 辨别物质的元素组成 课件(共51张PPT)初中化学科粤版九年级上册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-27 16:10:57 | ||
图片预览









文档简介
(共51张PPT)
第二章 空气、物质的构成
2.4
辨别物质的元素组成
逐点
导讲练
课堂小结
作业提升
学习目标
课时讲解
1
课时流程
2
元素
元素符号
元素周期表
单质和化合物
课时导入
感悟新知
知识点
1
1. 概念
元素是质子数(即核电荷数)相同的一类原子的总称。
不同种元素之间质子数一定不同,即质子数决定元素的种类。
元 素
知1-讲
质子数相同的微粒,不一定属于同种元素,
一定要强调“同一类原子”
感悟新知
2. 特点 只讲种类,不论个数。
3. 作用 用于描述物质的宏观组成。如二氧化碳(CO2)是由碳元素和氧元素组成的。
4. 元素在地壳中的存在 按质量分数计算,含量由多到少的前五种元素顺序为:氧、硅、铝、铁、钙;元素在生物细胞中的存在:按质量分数计算,含量居前五位的元素分别是:氧、碳、氢、氮、钙。
知1-讲
感悟新知
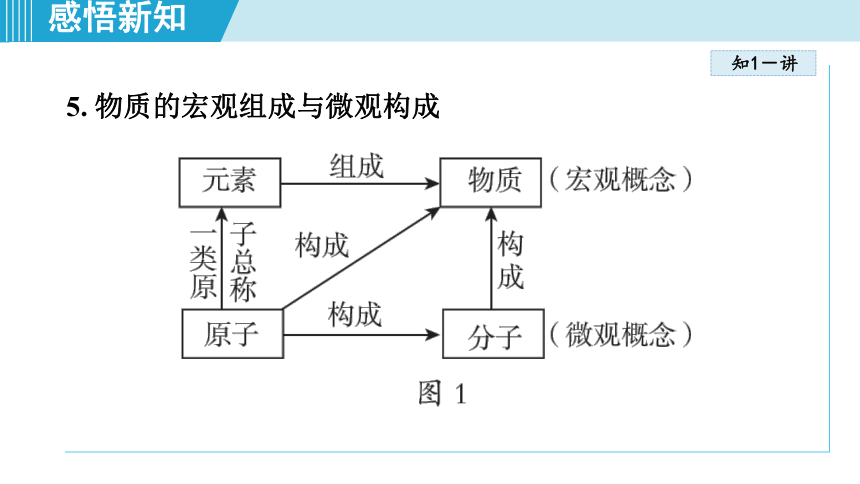
5. 物质的宏观组成与微观构成
知1-讲
感悟新知
拓展延伸
元素之最
地壳中含量最多的元素是氧元素;
地壳中含量最多的金属元素是铝元素;
空气中含量最多的元素是氮元素;
海洋中含量最多的元素是氧元素;
生物体内含量最多的元素是氧元素;
人体中含量最多的金属元素是钙元素;
相对原子质量最小的元素是氢元素。
知1-讲
知1-练
感悟新知
[中考·怀化] 不同种元素最本质的区别是( )
A. 中子数不同 B. 质子数不同
C. 相对原子质量不同 D. 核外电子数不同
B
例1
考向 考查对元素的理解、分类及化学性质
题型1 元素的概念
感悟新知
解题秘方:正确理解元素的概念:元素的种类是由质子数决定的,不同种元素之间最本质的区别是质子数(即核电荷数)不同。
误区警示:元素的种类是由质子数决定的,如钠原子与镁原子的质子数不同,属不同种元素;核外电子数相同的粒子不一定属同种元素,如Na+ 与Mg2+ 核外电子数均为10,但不是同种元素。
知1-练
感悟新知
知1-练
知识链接
不同种元素之间质子数一定不同,电子数可能相等,如O2- 与F-;同种元素的单核粒子质子数一定相同,电子数可能不同,如Na 与Na+。
知1-练
感悟新知
北京冬奥会于2022 年2 月4 日开幕。冬奥会期间运动员需要补充生理盐水(0.9% 的氯化钠溶液),含钾、钙、镁等无机盐的碱性饮料等。这里的“钾、钙、镁”指的是( )
A. 原子 B. 分子 C. 元素 D. 物质
C
例2
题型2 物质的元素组成
感悟新知
知1-练
特别提醒
物质都是由元素组成的,生活中的一些物质所含的硒、铁、碘、氟等都是指元素。
导引:饮料中所含的“钾、钙、镁”是强调存在的元素,与具体形态无关。
知1-练
感悟新知
[中考·常州] 地壳中的元素分布如图2 所示,其中区域②代表的元素是( )
A. 氧 B. 硅
C. 铝 D. 铁
B
例3
题型3 元素的含量
感悟新知
解题秘方:将地壳中各元素的含量与图形相
对比,可得出正确答案。
导引:地壳中的元素含量较高的有:氧、硅、铝、铁、钙,含量最多的是氧元素,排在第二位的是硅元素,故图中区域②代表的是硅元素。
知1-练
速记口诀
地壳中含量较多的元素:氧硅铝铁钙,可巧记为:养龟铝铁盖。
感悟新知
知1-练
教你一招:地壳中各元素的含量从高到低的
顺序可用数轴表示,如图3 所示:
感悟新知
知识点
2
1. 元素的名称
一般用汉字表示,读汉语中文的名称。金属元素的名称中都有“钅”字旁(汞除外),气态非金属元素用“气”字头,液态非金属元素用“氵”字旁,固态的非金属元素则用“石”字旁。
注意:常温下金属通常为固态,汞(俗称水银)是常温下唯一以液态存在的金属。
元素的名称和符号
知2-讲
感悟新知
2. 元素符号
(1)书写:若元素符号只用一个字母表示时,则用大写字母表示,如氢元素“H”,磷元素“P”;若元素符号用两个或两个以上字母表示时,则第一个字母大写,第二个及以后的字母都小写,简记为“一大二小”。如铁元素用“Fe”表示,氖元素用“Ne”表示等。
(2)意义:宏观上表示一种元素,微观上表示该元素的一个原子。
知2-讲
感悟新知
特别提醒
在元素符号前面添上不为1的数字后,该符号就只具有微观意义,表示几个原子。如O可表示氧元素,1个氧原子,而2O表示2个氧原子,不能表示氧元素。
知2-讲
知2-练
感悟新知
下列元素名称与其对应的元素符号完全正确的是( )
A. 氯cl B. 氖Na C. 镁Mg D. 铜Ca
C
例4
考向 考查元素符号的书写及意义
题型1 元素符号的书写
解题秘方:熟记常见元素的元素符号并规范书写(按英语书写的“四线三格”,遵守“一大二小”)是答题关键。
导引:氯的元素符号应为Cl,氖的元素符号为Ne,镁的元素符号为Mg,铜的元素符号为Cu。
感悟新知
方法提示
记忆元素符号时,有的可采用联想法记忆。如锰、镁的第一个大写字母其实就是汉语拼音的声母;氟的元素符号也是其声母;钠的元素符号与其汉语拼音一致,只不过“一大二小”而已;氦、碘可联系英语“嗨( Hi )、我( I )”来记忆。
知2-练
知2-练
感悟新知
说出下列符号的意义:
(1)N _____________________________________;
(2)2S _____________________________________;
(3)Fe _____________________________________。
氮元素;1 个氮原子
例5
题型2 元素符号的意义
2 个硫原子
铁元素;1 个铁原子;金属铁
感悟新知
解题秘方:元素符号可以表示一种元素,还可
以表示该元素的一个原子;直接由原子构成的物质,其元素符号还可以表示该物质。在元素符号前面添上数字后就只能表示该元素的几个原子。
教你一招:辨别化学符号中数字的意义时,要关注数字所处的位置。如离子符号前面的数字,表示离子的数量,右上角数字表示一个离子所带的电荷数;元素符号前面的数字表示原子的个数。
知2-练
感悟新知
解题对策
1.所有的元素符号都可用来表示一种元素、该元素的一个原子。
2.稀有气体元素、金属元素等的元素符号,还可用来表示一种物质。
3.所有元素符号前面添上一个不为1的数字后就只能表示该元素的几个原子。
知2-练
感悟新知
知识点
3
1. 元素周期表的结构
(1)元素周期表共有7 个横行,18 个纵行。每个横行叫做一个周期,每个纵行叫做一个族(8、9、10 三个纵行组成一个族),所以元素周期表中共有7 个周期,16 个族。
元素周期表
知3-讲
感悟新知
(2)元素周期表中每一小格中包含着一种元素的相关信息(如图4 所示):
原子序数= 质子数= 核电荷数
知3-讲
感悟新知
2. 元素周期表中的规律
(1)元素周期表按照元素的质子数从小到大的顺序排列;
(2)每一周期中的元素从左至右按照金属元素、非金属元素、稀有气体元素的顺序排列(第一周期除外)。
知3-讲
感悟新知
知识链接
从原子结构上来讲,元素周期表还有以下规律:
1.在同一周期中,各元素原子的电子层数相同,最外层电子数从左至右逐渐增加;
2. 在同一族中,各元素原子的最外层电子数一般相同,化学性质相似;
3.等量关系:原子中,质子数=原子序数=核外电子数;周期数=原子的电子层数;
族序数=最外层电子数( 一般)。
知3-讲
知3-练
感悟新知
[中考·苏州] 北京冬奥会上采用了碲化镉发电玻璃,碲元素在元素周期表中的信息如图5 所示。下列有关碲的说法正确的是( )
A. 碲原子的最外层电子数为52
B. 碲的元素符号为Te
C. 碲的相对原子质量为127.6 g
D. 碲属于金属元素
B
例6
考向 对元素周期表的理解和运用
题型1 元素周期表中据单元格的信息
感悟新知
解题秘方:识记元素周期表每一单元格有关元素的四点基本信息[原子序数、元素符号、元素名称和相对原子质量(单位不是“g”)]是解题关键。
知3-练
感悟新知
导引:根据元素周期表中的单元格可知,该元素的原子序数为52,根据原子中原子序数= 核电荷数= 质子数= 核外电子数,则该元素的原子核外电子数为52,A 错误;字母表示该元素的元素符号,碲的元素符号为Te,B 正确;相对原子质量的单位是“1”,不是“g”,C 错误;该元素的名称是碲,带“石”字旁,属于非金属元素,D 错误。
知3-练
感悟新知
特别提醒
元素周期表中每一单元格中数字的意义因位置不同而不同,不要混淆。如左上角的数字表示原子序数,它与原子的质子数相等,下面的数字表示相对原子质量,但注意相对原子质量单位为“1”,不是“g”。
知3-练
知3-练
感悟新知
元素周期表是学习和研究化学的重要工具。如图6 是元素周期表的一部分,请分析图中信息回答:
例7
题型2 元素周期表中元素的排列规律
感悟新知
(1)磷元素的相对原子质量为 _______,该
元素属于_________( 填“金属”或“非金属”)元素;根据元素周期表的信息,______(填“能”或“不能”)找出磷原子的中子数。
(2)在元素周期表中,氪元素排在氩元素的正下方,推测氪气的化学性质比较 _________(填“活泼”或“稳定”),从原子结构上分析,其原因是__________________________________________。
知3-练
30.97
非金属
不能
稳定
原子最外层电子数是8,已达相对稳定结构
感悟新知
解题秘方:解答此类题目可采用归纳比较法,通过归纳比较元素周期表中横行(周期)、纵行(族)的有关规律,得出正确结论。
知3-练
感悟新知
导引:(1)元素周期表单元格中正下方的数字表示相对原子质量,磷元素的相对原子质量为30.97;磷元素的名称带“石”字旁,属于非金属元素;根据元素周期表的信息,不能找出磷原子的中子数。(2)在元素周期表中,氪元素排在氩元素的正下方,属于同一族,推测氪气的化学性质比较稳定,因其最外层电子数是8,已达相对稳定结构。
知3-练
感悟新知
知识链接
元素周期表的规律可从元素、原子两个角度去分析:
1.从元素角度来讲,元素周期表按质子数、元素的类别有序排列;还有数量上的规律,如周期数等于电子层数,质子数等于原子序数等。有了以上规律,就能熟练掌握已知、未知元素的信息。
2.从原子结构来分析元素周期表的规律。
知3-练
感悟新知
知识点
4
1. 单质:
由同种元素组成的纯净物,如氧气、氢气、铁、硫,简称“一物一素”。
2. 化合物:
由不同种元素组成的纯净物,如二氧化碳、高锰酸钾、氯化钠、四氧化三铁,简称“一物多素”。
单质、化合物和氧化物
知4-讲
感悟新知
3. 氧化物:
由两种元素组成,且其中一种为氧元素的化合物,如水、二氧化碳、二氧化硫等, 简称“ 一物两素必有氧”。
拓展:含氧化合物:由不同种元素组成,且其中一种为氧元素的纯净物,如高锰酸钾、水、五氧化二磷、二氧化硫等。
知4-讲
感悟新知
氧化物与含氧化合物的关系:这两类物质都是化合物,且都含有氧元素;不过,氧化物中只含有两种元素,而含氧化合物中含有两种或两种以上的元素。因此氧化物一定是含氧化合物,而含氧化合物不一定是氧化物。
知4-讲
感悟新知
易错提醒
由同种元素组成的物质不一定是单质,还可能是混合物,如氧气和臭氧组成的混合物中就只含一种元素,同理由不同种元素组成的物质也不一定是化合物。
知4-讲
知4-练
感悟新知
[中考·龙东] 下列物质分类正确的是( )
A. 单质:空气、水银
B. 化合物:氢气、酒精
C. 氧化物:水、五氧化二磷
D. 混合物:自来水、氯化钠
C
例8
考向 考查物质的分类
题型1 辨别物质的分类
感悟新知
解题秘方:可结合物质的组成来辨别其类别。
如由多种物质组成的为混合物,纯净物则根据元素组成分为单质、化合物。
导引:空气属于混合物,A 错误;氢气属于单质,B 错误;氧化物是指由两种元素组成的化合物中,其中一种元素是氧元素,水、五氧化二磷属于氧化物,C 正确;氯化钠属于纯净物,D 错误。
知4-练
感悟新知
教你一招:辨别物质的分类时,需掌握各类物质的特点。如:混合物——“多物”,纯净物——“一物”,单质——“一物一(元)素”,化合物——“一物多(元)素”,氧化物——“一物两(元)素含一氧”。
知4-练
感悟新知
方法点拨:利用对比法比较单质和化合物的区别和联系:
知4-练
单质 化合物
概念 同种元素组成的纯净物 不同种元素组成的纯净物
宏观组成 一种元素 至少两种元素
微观构成 一种元素的原子或一种元素的原子构成的一种分子 不同种元素的原子构成的一种分子,或由离子构成
相同点 都是纯净物 联系 化合 单质 化合物 分解
知4-练
感悟新知
[ 中考·邵阳]“〇”和“●”分别表示不同元素的原子,其中表示单质的是( )
D
例9
题型2 从微观角度辨别物质的分类
感悟新知
解题秘方:根据模型图中分子的种类和分子的构成来分析物质的类别。
导引:图A 表示纯净物中的化合物,错误;图B 表示由三种分子构成的混合物,错误;图C 表示由两种化合物组成的混合物,错误;图D 表示纯净物中的单质,正确。
知4-练
感悟新知
解法提醒
本题采用模型分析法解答。先根据模型中有几种分子判断其是纯净物还是混合物(由分子构成的物质),再根据纯净物的模型中该分子是由几种原子构成的判断其是单质还是化合物。
知4-练
知4-练
感悟新知
下列说法正确的是( )
A. 由同种元素组成的物质一定是单质
B. 含有多种元素的物质一定是化合物
C. 含氧元素的化合物一定是氧化物
D. 氧化物一定是化合物
D
例10
题型3 单质、化合物、氧化物的概念理解
感悟新知
导引:单质是只含一种元素的纯净物,如氧气、臭
氧、硫、氮气、铁等,但是由同种元素组成的物质不一定是单质,可能是混合物,如氧气和臭氧的混合气体;化合物是含有不同种元素的纯净物,如二氧化碳、二氧化硫、高锰酸钾等,而含多种元素的物质不一定是化合物,它可能是混合物,如空气;氧化物是指由两种元素组成,其中一种元素是氧元素的化合物,即由氧元素与另一种元素组成的纯净物,如二氧化碳、二氧化硫、四氧化三铁、五氧化二磷等,而含氧化合物中一定含有氧元素,但不一定是氧化物,它可能含两种或两种以上的元素。
知4-练
感悟新知
教你一招
将物质分类可按以下思路进行,首先分析是纯净物还是混合物;若是纯净物,再根据组成纯净物的元素种类进一步分为单质、化合物。单质、化合物、氧化物都必须是纯净物,在表述时不能偷换概念,如把单质、化合物的定义分别说成是“由同种元素组成的物质”“ 由不同种元素组成的物质”。
知4-练
课堂小结
对比法
分类
存在
原子
元素周期表
总称
组成
结构
元素符号
书写
意义
单质
化合物
元素
物质(纯净物)
第二章 空气、物质的构成
2.4
辨别物质的元素组成
逐点
导讲练
课堂小结
作业提升
学习目标
课时讲解
1
课时流程
2
元素
元素符号
元素周期表
单质和化合物
课时导入
感悟新知
知识点
1
1. 概念
元素是质子数(即核电荷数)相同的一类原子的总称。
不同种元素之间质子数一定不同,即质子数决定元素的种类。
元 素
知1-讲
质子数相同的微粒,不一定属于同种元素,
一定要强调“同一类原子”
感悟新知
2. 特点 只讲种类,不论个数。
3. 作用 用于描述物质的宏观组成。如二氧化碳(CO2)是由碳元素和氧元素组成的。
4. 元素在地壳中的存在 按质量分数计算,含量由多到少的前五种元素顺序为:氧、硅、铝、铁、钙;元素在生物细胞中的存在:按质量分数计算,含量居前五位的元素分别是:氧、碳、氢、氮、钙。
知1-讲
感悟新知
5. 物质的宏观组成与微观构成
知1-讲
感悟新知
拓展延伸
元素之最
地壳中含量最多的元素是氧元素;
地壳中含量最多的金属元素是铝元素;
空气中含量最多的元素是氮元素;
海洋中含量最多的元素是氧元素;
生物体内含量最多的元素是氧元素;
人体中含量最多的金属元素是钙元素;
相对原子质量最小的元素是氢元素。
知1-讲
知1-练
感悟新知
[中考·怀化] 不同种元素最本质的区别是( )
A. 中子数不同 B. 质子数不同
C. 相对原子质量不同 D. 核外电子数不同
B
例1
考向 考查对元素的理解、分类及化学性质
题型1 元素的概念
感悟新知
解题秘方:正确理解元素的概念:元素的种类是由质子数决定的,不同种元素之间最本质的区别是质子数(即核电荷数)不同。
误区警示:元素的种类是由质子数决定的,如钠原子与镁原子的质子数不同,属不同种元素;核外电子数相同的粒子不一定属同种元素,如Na+ 与Mg2+ 核外电子数均为10,但不是同种元素。
知1-练
感悟新知
知1-练
知识链接
不同种元素之间质子数一定不同,电子数可能相等,如O2- 与F-;同种元素的单核粒子质子数一定相同,电子数可能不同,如Na 与Na+。
知1-练
感悟新知
北京冬奥会于2022 年2 月4 日开幕。冬奥会期间运动员需要补充生理盐水(0.9% 的氯化钠溶液),含钾、钙、镁等无机盐的碱性饮料等。这里的“钾、钙、镁”指的是( )
A. 原子 B. 分子 C. 元素 D. 物质
C
例2
题型2 物质的元素组成
感悟新知
知1-练
特别提醒
物质都是由元素组成的,生活中的一些物质所含的硒、铁、碘、氟等都是指元素。
导引:饮料中所含的“钾、钙、镁”是强调存在的元素,与具体形态无关。
知1-练
感悟新知
[中考·常州] 地壳中的元素分布如图2 所示,其中区域②代表的元素是( )
A. 氧 B. 硅
C. 铝 D. 铁
B
例3
题型3 元素的含量
感悟新知
解题秘方:将地壳中各元素的含量与图形相
对比,可得出正确答案。
导引:地壳中的元素含量较高的有:氧、硅、铝、铁、钙,含量最多的是氧元素,排在第二位的是硅元素,故图中区域②代表的是硅元素。
知1-练
速记口诀
地壳中含量较多的元素:氧硅铝铁钙,可巧记为:养龟铝铁盖。
感悟新知
知1-练
教你一招:地壳中各元素的含量从高到低的
顺序可用数轴表示,如图3 所示:
感悟新知
知识点
2
1. 元素的名称
一般用汉字表示,读汉语中文的名称。金属元素的名称中都有“钅”字旁(汞除外),气态非金属元素用“气”字头,液态非金属元素用“氵”字旁,固态的非金属元素则用“石”字旁。
注意:常温下金属通常为固态,汞(俗称水银)是常温下唯一以液态存在的金属。
元素的名称和符号
知2-讲
感悟新知
2. 元素符号
(1)书写:若元素符号只用一个字母表示时,则用大写字母表示,如氢元素“H”,磷元素“P”;若元素符号用两个或两个以上字母表示时,则第一个字母大写,第二个及以后的字母都小写,简记为“一大二小”。如铁元素用“Fe”表示,氖元素用“Ne”表示等。
(2)意义:宏观上表示一种元素,微观上表示该元素的一个原子。
知2-讲
感悟新知
特别提醒
在元素符号前面添上不为1的数字后,该符号就只具有微观意义,表示几个原子。如O可表示氧元素,1个氧原子,而2O表示2个氧原子,不能表示氧元素。
知2-讲
知2-练
感悟新知
下列元素名称与其对应的元素符号完全正确的是( )
A. 氯cl B. 氖Na C. 镁Mg D. 铜Ca
C
例4
考向 考查元素符号的书写及意义
题型1 元素符号的书写
解题秘方:熟记常见元素的元素符号并规范书写(按英语书写的“四线三格”,遵守“一大二小”)是答题关键。
导引:氯的元素符号应为Cl,氖的元素符号为Ne,镁的元素符号为Mg,铜的元素符号为Cu。
感悟新知
方法提示
记忆元素符号时,有的可采用联想法记忆。如锰、镁的第一个大写字母其实就是汉语拼音的声母;氟的元素符号也是其声母;钠的元素符号与其汉语拼音一致,只不过“一大二小”而已;氦、碘可联系英语“嗨( Hi )、我( I )”来记忆。
知2-练
知2-练
感悟新知
说出下列符号的意义:
(1)N _____________________________________;
(2)2S _____________________________________;
(3)Fe _____________________________________。
氮元素;1 个氮原子
例5
题型2 元素符号的意义
2 个硫原子
铁元素;1 个铁原子;金属铁
感悟新知
解题秘方:元素符号可以表示一种元素,还可
以表示该元素的一个原子;直接由原子构成的物质,其元素符号还可以表示该物质。在元素符号前面添上数字后就只能表示该元素的几个原子。
教你一招:辨别化学符号中数字的意义时,要关注数字所处的位置。如离子符号前面的数字,表示离子的数量,右上角数字表示一个离子所带的电荷数;元素符号前面的数字表示原子的个数。
知2-练
感悟新知
解题对策
1.所有的元素符号都可用来表示一种元素、该元素的一个原子。
2.稀有气体元素、金属元素等的元素符号,还可用来表示一种物质。
3.所有元素符号前面添上一个不为1的数字后就只能表示该元素的几个原子。
知2-练
感悟新知
知识点
3
1. 元素周期表的结构
(1)元素周期表共有7 个横行,18 个纵行。每个横行叫做一个周期,每个纵行叫做一个族(8、9、10 三个纵行组成一个族),所以元素周期表中共有7 个周期,16 个族。
元素周期表
知3-讲
感悟新知
(2)元素周期表中每一小格中包含着一种元素的相关信息(如图4 所示):
原子序数= 质子数= 核电荷数
知3-讲
感悟新知
2. 元素周期表中的规律
(1)元素周期表按照元素的质子数从小到大的顺序排列;
(2)每一周期中的元素从左至右按照金属元素、非金属元素、稀有气体元素的顺序排列(第一周期除外)。
知3-讲
感悟新知
知识链接
从原子结构上来讲,元素周期表还有以下规律:
1.在同一周期中,各元素原子的电子层数相同,最外层电子数从左至右逐渐增加;
2. 在同一族中,各元素原子的最外层电子数一般相同,化学性质相似;
3.等量关系:原子中,质子数=原子序数=核外电子数;周期数=原子的电子层数;
族序数=最外层电子数( 一般)。
知3-讲
知3-练
感悟新知
[中考·苏州] 北京冬奥会上采用了碲化镉发电玻璃,碲元素在元素周期表中的信息如图5 所示。下列有关碲的说法正确的是( )
A. 碲原子的最外层电子数为52
B. 碲的元素符号为Te
C. 碲的相对原子质量为127.6 g
D. 碲属于金属元素
B
例6
考向 对元素周期表的理解和运用
题型1 元素周期表中据单元格的信息
感悟新知
解题秘方:识记元素周期表每一单元格有关元素的四点基本信息[原子序数、元素符号、元素名称和相对原子质量(单位不是“g”)]是解题关键。
知3-练
感悟新知
导引:根据元素周期表中的单元格可知,该元素的原子序数为52,根据原子中原子序数= 核电荷数= 质子数= 核外电子数,则该元素的原子核外电子数为52,A 错误;字母表示该元素的元素符号,碲的元素符号为Te,B 正确;相对原子质量的单位是“1”,不是“g”,C 错误;该元素的名称是碲,带“石”字旁,属于非金属元素,D 错误。
知3-练
感悟新知
特别提醒
元素周期表中每一单元格中数字的意义因位置不同而不同,不要混淆。如左上角的数字表示原子序数,它与原子的质子数相等,下面的数字表示相对原子质量,但注意相对原子质量单位为“1”,不是“g”。
知3-练
知3-练
感悟新知
元素周期表是学习和研究化学的重要工具。如图6 是元素周期表的一部分,请分析图中信息回答:
例7
题型2 元素周期表中元素的排列规律
感悟新知
(1)磷元素的相对原子质量为 _______,该
元素属于_________( 填“金属”或“非金属”)元素;根据元素周期表的信息,______(填“能”或“不能”)找出磷原子的中子数。
(2)在元素周期表中,氪元素排在氩元素的正下方,推测氪气的化学性质比较 _________(填“活泼”或“稳定”),从原子结构上分析,其原因是__________________________________________。
知3-练
30.97
非金属
不能
稳定
原子最外层电子数是8,已达相对稳定结构
感悟新知
解题秘方:解答此类题目可采用归纳比较法,通过归纳比较元素周期表中横行(周期)、纵行(族)的有关规律,得出正确结论。
知3-练
感悟新知
导引:(1)元素周期表单元格中正下方的数字表示相对原子质量,磷元素的相对原子质量为30.97;磷元素的名称带“石”字旁,属于非金属元素;根据元素周期表的信息,不能找出磷原子的中子数。(2)在元素周期表中,氪元素排在氩元素的正下方,属于同一族,推测氪气的化学性质比较稳定,因其最外层电子数是8,已达相对稳定结构。
知3-练
感悟新知
知识链接
元素周期表的规律可从元素、原子两个角度去分析:
1.从元素角度来讲,元素周期表按质子数、元素的类别有序排列;还有数量上的规律,如周期数等于电子层数,质子数等于原子序数等。有了以上规律,就能熟练掌握已知、未知元素的信息。
2.从原子结构来分析元素周期表的规律。
知3-练
感悟新知
知识点
4
1. 单质:
由同种元素组成的纯净物,如氧气、氢气、铁、硫,简称“一物一素”。
2. 化合物:
由不同种元素组成的纯净物,如二氧化碳、高锰酸钾、氯化钠、四氧化三铁,简称“一物多素”。
单质、化合物和氧化物
知4-讲
感悟新知
3. 氧化物:
由两种元素组成,且其中一种为氧元素的化合物,如水、二氧化碳、二氧化硫等, 简称“ 一物两素必有氧”。
拓展:含氧化合物:由不同种元素组成,且其中一种为氧元素的纯净物,如高锰酸钾、水、五氧化二磷、二氧化硫等。
知4-讲
感悟新知
氧化物与含氧化合物的关系:这两类物质都是化合物,且都含有氧元素;不过,氧化物中只含有两种元素,而含氧化合物中含有两种或两种以上的元素。因此氧化物一定是含氧化合物,而含氧化合物不一定是氧化物。
知4-讲
感悟新知
易错提醒
由同种元素组成的物质不一定是单质,还可能是混合物,如氧气和臭氧组成的混合物中就只含一种元素,同理由不同种元素组成的物质也不一定是化合物。
知4-讲
知4-练
感悟新知
[中考·龙东] 下列物质分类正确的是( )
A. 单质:空气、水银
B. 化合物:氢气、酒精
C. 氧化物:水、五氧化二磷
D. 混合物:自来水、氯化钠
C
例8
考向 考查物质的分类
题型1 辨别物质的分类
感悟新知
解题秘方:可结合物质的组成来辨别其类别。
如由多种物质组成的为混合物,纯净物则根据元素组成分为单质、化合物。
导引:空气属于混合物,A 错误;氢气属于单质,B 错误;氧化物是指由两种元素组成的化合物中,其中一种元素是氧元素,水、五氧化二磷属于氧化物,C 正确;氯化钠属于纯净物,D 错误。
知4-练
感悟新知
教你一招:辨别物质的分类时,需掌握各类物质的特点。如:混合物——“多物”,纯净物——“一物”,单质——“一物一(元)素”,化合物——“一物多(元)素”,氧化物——“一物两(元)素含一氧”。
知4-练
感悟新知
方法点拨:利用对比法比较单质和化合物的区别和联系:
知4-练
单质 化合物
概念 同种元素组成的纯净物 不同种元素组成的纯净物
宏观组成 一种元素 至少两种元素
微观构成 一种元素的原子或一种元素的原子构成的一种分子 不同种元素的原子构成的一种分子,或由离子构成
相同点 都是纯净物 联系 化合 单质 化合物 分解
知4-练
感悟新知
[ 中考·邵阳]“〇”和“●”分别表示不同元素的原子,其中表示单质的是( )
D
例9
题型2 从微观角度辨别物质的分类
感悟新知
解题秘方:根据模型图中分子的种类和分子的构成来分析物质的类别。
导引:图A 表示纯净物中的化合物,错误;图B 表示由三种分子构成的混合物,错误;图C 表示由两种化合物组成的混合物,错误;图D 表示纯净物中的单质,正确。
知4-练
感悟新知
解法提醒
本题采用模型分析法解答。先根据模型中有几种分子判断其是纯净物还是混合物(由分子构成的物质),再根据纯净物的模型中该分子是由几种原子构成的判断其是单质还是化合物。
知4-练
知4-练
感悟新知
下列说法正确的是( )
A. 由同种元素组成的物质一定是单质
B. 含有多种元素的物质一定是化合物
C. 含氧元素的化合物一定是氧化物
D. 氧化物一定是化合物
D
例10
题型3 单质、化合物、氧化物的概念理解
感悟新知
导引:单质是只含一种元素的纯净物,如氧气、臭
氧、硫、氮气、铁等,但是由同种元素组成的物质不一定是单质,可能是混合物,如氧气和臭氧的混合气体;化合物是含有不同种元素的纯净物,如二氧化碳、二氧化硫、高锰酸钾等,而含多种元素的物质不一定是化合物,它可能是混合物,如空气;氧化物是指由两种元素组成,其中一种元素是氧元素的化合物,即由氧元素与另一种元素组成的纯净物,如二氧化碳、二氧化硫、四氧化三铁、五氧化二磷等,而含氧化合物中一定含有氧元素,但不一定是氧化物,它可能含两种或两种以上的元素。
知4-练
感悟新知
教你一招
将物质分类可按以下思路进行,首先分析是纯净物还是混合物;若是纯净物,再根据组成纯净物的元素种类进一步分为单质、化合物。单质、化合物、氧化物都必须是纯净物,在表述时不能偷换概念,如把单质、化合物的定义分别说成是“由同种元素组成的物质”“ 由不同种元素组成的物质”。
知4-练
课堂小结
对比法
分类
存在
原子
元素周期表
总称
组成
结构
元素符号
书写
意义
单质
化合物
元素
物质(纯净物)
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
