辽宁省沈阳市五校协作体2023-2024学年高一下学期期中考试 化学(含答案)
文档属性
| 名称 | 辽宁省沈阳市五校协作体2023-2024学年高一下学期期中考试 化学(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 492.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-27 00:00:00 | ||
图片预览


文档简介
2023-2024学年度(下)沈阳市五校协作体期中考试
高一 化学
考试时间:75分钟
分数:100分
试卷说明:试卷共二部分:第一部分:选择题型(1-15题 45分)
第二部分:非选择题型(16-19题 55分)
相对原子质量:H 1、C 12、N 14、O 16、Na 23、Al 27、S 32、Fe 56、Cu 64
第Ⅰ卷(选择题 共45分)
化学与生产、生活密切相关,下列说法正确的是
A .碳酸钡可用于肠胃 X射线造影检查
B .用于制作轴承的金刚砂属于传统的硅酸盐材料,具有优异的高温抗氧化性
C .为增强 84消毒液的杀菌消毒效果,可与洁厕灵混合使用
D .葡萄酒中常添加一定量的 SO2用来抗氧化和杀菌
下列有关物质的工业制备反应错误的是
A. 制漂白粉:
B. 冶炼铁:
C. 制氯气:
D. 制粗硅:
3. 常温常压下,电化学合成氨总反应方程式:,设为阿伏加德罗常数的值。下列说法正确的是
A. 氮气含有的共用电子对数为
B. 每产生,失去电子数为
C. 标况下,参加反应时,产生分子数为
D. 氨水中,含分子数小于
4. 下列实验中的颜色变化,与氧化还原反应无关的是
A B C D
实验 向CaCl2和氨水的混合液中通入CO2 石蕊试液滴入氯水中 NaOH溶液滴入FeSO4溶液中 热铜丝插入稀硝酸中
现象 产生白色沉淀 溶液变红,随后迅速褪色 产生白色沉淀,随后变为红褐色 产生无色气体,随后变为红棕色
5.碘在不同状态(固态或气态)下与氢气反应的热化学方程式如下:
①
②
下列判断正确的是( )。
A.①中的为固态,②中的为气态
B.固态碘升华时将吸热
C.①的反应物总能量比②的反应物总能量高
D.比的热稳定性更好
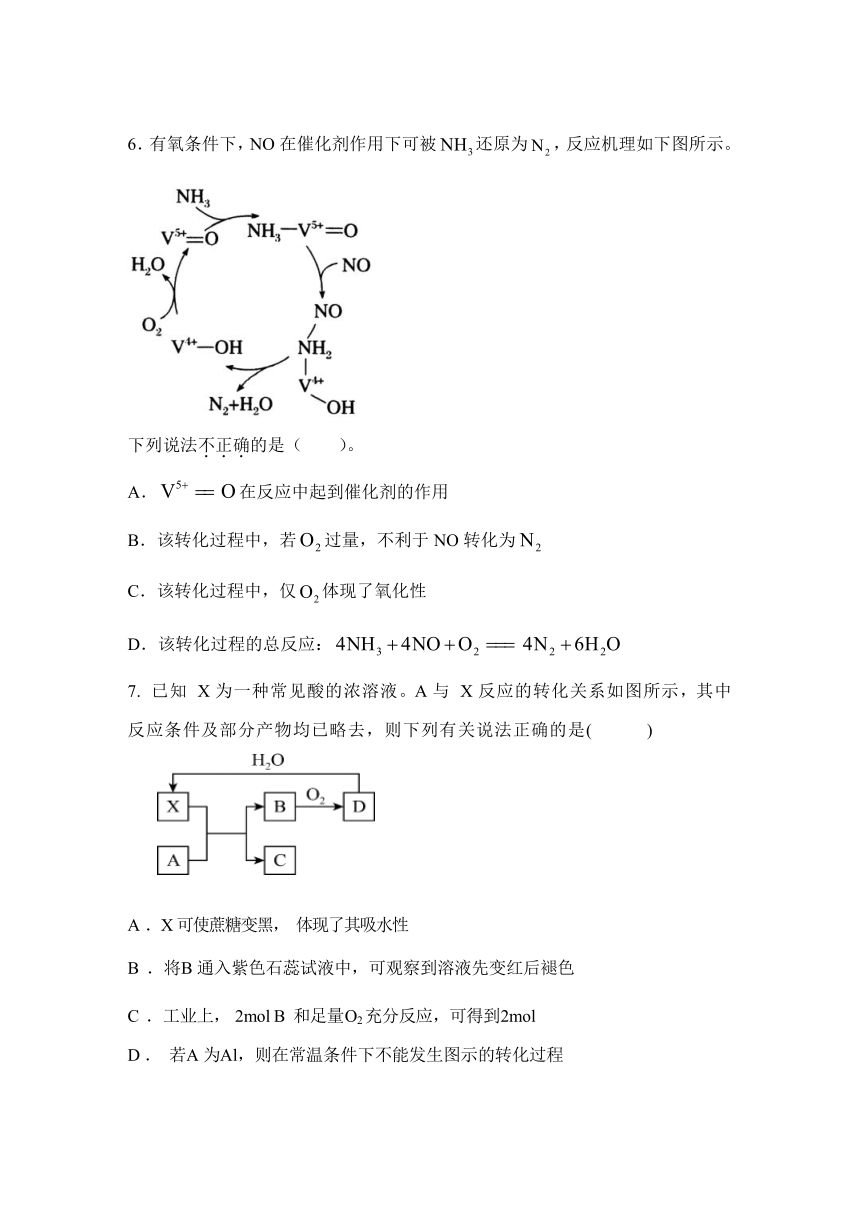
6.有氧条件下,NO在催化剂作用下可被还原为,反应机理如下图所示。
下列说法不正确的是( )。
A.在反应中起到催化剂的作用
B.该转化过程中,若过量,不利于NO转化为
C.该转化过程中,仅体现了氧化性
D.该转化过程的总反应:
7. 已知 X为一种常见酸的浓溶液。A与 X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
A .X可使蔗糖变黑, 体现了其吸水性
B .将 B通入紫色石蕊试液中,可观察到溶液先变红后褪色
C .工业上, 2mol B 和足量 O2充分反应,可得到 2mol
D . 若 A为 Al,则在常温条件下不能发生图示的转化过程
8. 下列实验操作和现象与结论关系不正确的是
操作和现象 结论
A 将大小相同的K和Na放入等体积的水中,钾比钠反应剧烈 钾元素的金属性比钠元素强
B 将铝片放入盐酸中,产生气泡的速率开始时较慢,随后加快,后来又逐渐减慢 H+的浓度是影响反应速率的唯一因素
C 漂白粉与浓HCl混合产生的气体能使湿润蓝色石蕊试纸先变红后褪色 漂白粉和浓HCl反应生成Cl2
D 向盛有H2O2溶液的试管中,加入少量FeCl3溶液,产生气泡的速率比不加FeCl3溶液的快 FeCl3可以加快H2O2分解速率,起了催化作用
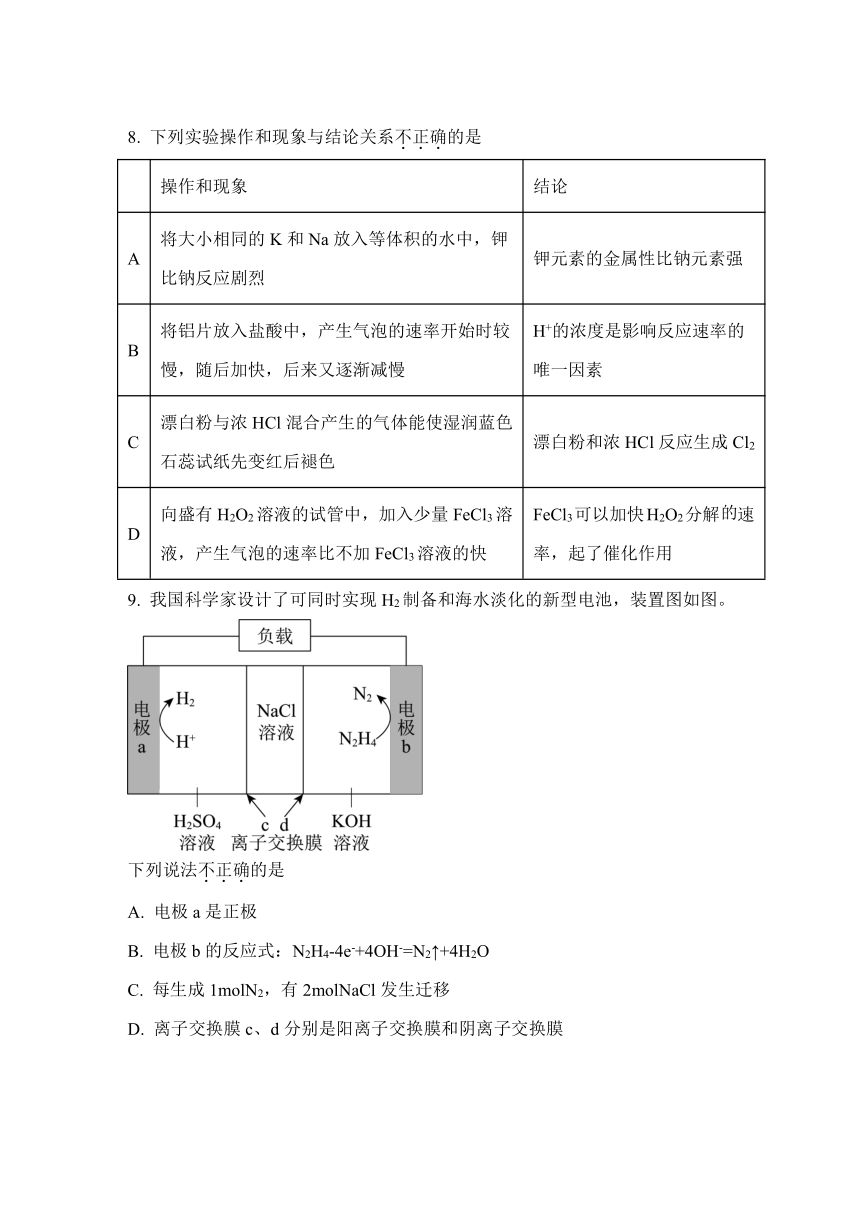
9. 我国科学家设计了可同时实现H2制备和海水淡化的新型电池,装置图如图。
下列说法不正确的是
A. 电极a是正极
B. 电极b的反应式:N2H4-4e-+4OH-=N2↑+4H2O
C. 每生成1molN2,有2molNaCl发生迁移
D. 离子交换膜c、d分别是阳离子交换膜和阴离子交换膜
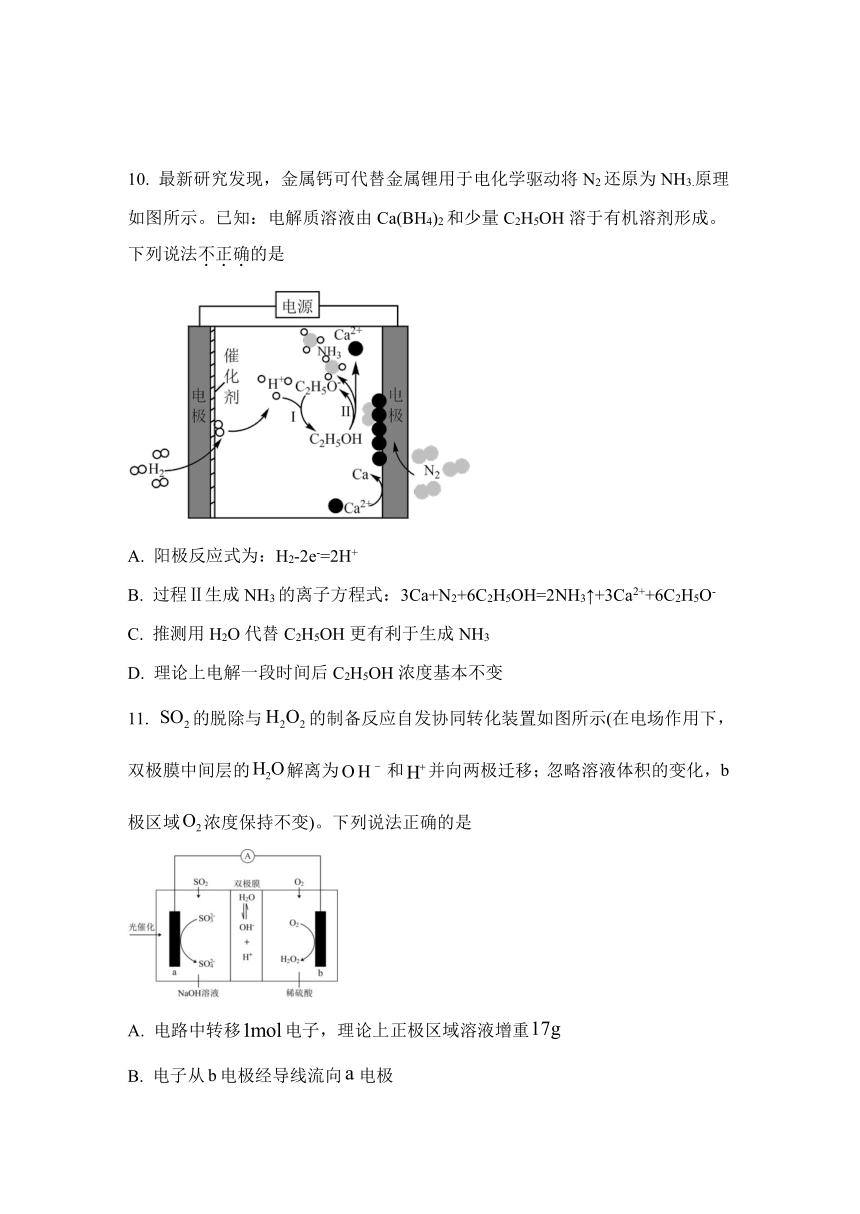
10. 最新研究发现,金属钙可代替金属锂用于电化学驱动将N2还原为NH3.原理如图所示。已知:电解质溶液由Ca(BH4)2和少量C2H5OH溶于有机溶剂形成。
下列说法不正确的是
A. 阳极反应式为:H2-2e-=2H+
B. 过程Ⅱ生成NH3的离子方程式:3Ca+N2+6C2H5OH=2NH3↑+3Ca2++6C2H5O-
C. 推测用H2O代替C2H5OH更有利于生成NH3
D. 理论上电解一段时间后C2H5OH浓度基本不变
11. 的脱除与的制备反应自发协同转化装置如图所示(在电场作用下,双极膜中间层的解离为和并向两极迁移;忽略溶液体积的变化,极区域浓度保持不变)。下列说法正确的是
电路中转移电子,理论上正极区域溶液增重
电子从电极经导线流向电极
C. 两极参与反应的与的物质的量之比为
D. 双极膜中的解离可不断提供和,故无需补加
12. 某同学进行如下实验:
①将H2O2溶液与KI溶液混合,产生大量气泡,溶液颜色变黄;
②将①中的黄色溶液分成两等份,一份加入CCl4,振荡,产生气泡速率明显减小,下层溶液呈紫红色;另一份不加CCl4,振荡,产生气泡速率无明显变化。
下列说法不正确是
A. ①中溶液颜色变黄的原因是:H2O2+2I-=I2+2OH-
B. ②中产生气泡速率减小的原因是H2O2浓度减小
C. ②中下层溶液呈紫红色是因为I2溶于CCl4
D 由该实验可知,I2可以加快H2O2分解产生气泡的反应速率
科学家提出了一种基于电催化多硫化物循环的自供能产氢体系,如下图所示。通过将锌一多硫化物电池与电解制氢装置集成,最大化利用了间歇性太阳光,实现日夜不间断的自供电的H2生产。下列说法错误的是
A. 锌—多硫化物电池白天可实现电能向化学能的转化
B. 装置白天工作时,b极的电极反应式为
C. 装置夜间工作时,应将电极ac、bd分别连接
D. H2生产装置中可以使用钠离子交换膜
14. 研究人员提出利用热化学硫碘循环实现硫化氢分解联产氢气和硫黄,转化过程如下,其中Y、Z代表I2或HI中的一种。下列说法不正确的是
反应I中X的浓度与硫黄的产率无关
B. Y在CCl4中比在H2SO4溶液中易溶
C. 反应Ⅱ的化学方程式为SO2+2H2O+I2=H2SO4+2HI
D. 等压条件下,反应Ⅰ、Ⅱ、Ⅲ的反应热之和等于硫化氢直接分解的反应热
15. 在金表面分解的实验数据如下表。已知反应物消耗一半所需的时间称为半衰期。下列说法错误的是
0 20 40 60 80
A. 消耗一半时的反应速率为
B. 100min时消耗完全
C.该反应的半衰期与起始浓度的关系满足
D. 该反应的速率与的浓度有关
第Ⅰ卷(非选择题 共55分)
16.(12分)Ⅰ.氮元素的单质及其化合物在工农业生产、生活中有着重要作用。回答下列问题:
一定条件下,在2 L密闭容器中发生反应:3A(g) + B(g)2C(g)。开始时加入4 mol A, 6 mol B,2molC,在2 min末测得C的物质的量是3mol
(1)用A的浓度变化表示反应的平均速率:______________。
(2)在2 min末,B的浓度为________________________。
Ⅱ.某反应过程的能量变化如下图所示。请填写下列空白
(3)反应过程________(填“a”或“b”)有催化剂参与。
(4)该反应为________反应(填“放热”或“吸热”),
已知:
反应ⅰ:
反应ⅱ:
则氨气完全燃烧生成氮气和水蒸气的热化学方程式为__________。
Ⅲ.已知反应ⅰ断开化学键所需的能量如下表。
化学键 H—H N—H
键能/ 945 436 ?
则断开 N—H键所需的能量是__________。
17.(13分)Ⅰ. 目前,常利用催化技术将汽车尾气中的NO和CO转化成CO2和N2。为研究如何增大该化学反应的速率,某课题组进行了以下实验探究。
【提岀问题】在其他条件不变的情况下,温度或催化剂的比表面积(单位质量的物质所具有的总面积)如何影响汽车尾气的转化速率?
【查阅资料】使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】
编号 t/°C c(NO)/(mol L-1) c(CO)/(mol·L-1) 催化剂的比表面积/(m2 g-1))
I 280 6.50×10-3 4.00×10-3 80.0
Ⅱ ? 6.50×10-3 4.00×10-3 120
Ⅲ 360 6.50×10-3 ? 80.0
【图像分析与结论】三组实验中CO的浓度随时间的变化如下图所示。
(1)由曲线I、II可知,增大催化剂的比表面积,该化学反应的速率将 (填“增大”“减小”或“无影响”)。
(2)由实验I和Ⅲ可得出的结论是
Ⅱ.兴趣小组通过实验探究溶解铜的方法和本质。
(3)将铜粉分别加到稍过量的氯化铁溶液和硫酸铁溶液中,铜粉溶解,溶液变成浅绿色,两个反应的共同点是(用离子方程式表示)_______________________。
(4)在热水浴中进行4个实验,部分实验报告如下表所示。
序号 实验操作 实验现象
Ⅰ 稀硫酸中加入铜片 无明显变化
Ⅱ 硝酸钠溶液中加入铜片 无明显变化
Ⅲ 无明显变化
Ⅳ 稀硫酸中加入硝酸钠溶液 无明显变化
再加入铜片 有无色气泡;溶液变蓝
①请填写上表中Ⅲ的空格。
②实验I、Ⅱ、Ⅲ的目的是_________________________。
③实验Ⅳ中反应的本质是(用离子方程式表示)_____________________________。
(5)将铜粉加到混有硫酸的过氧化氢溶液中,溶液逐渐变成蓝色,该反应的离子方程式是_____________________________________。
18.(13分)氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备
①氨气的发生装置可以选择上图中的_________,反应的化学方程式为____。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→________________________(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
操作步骤 实验现象 解释原因
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 ①Y管中_____________ ②反应的化学方程式 ____________
将注射器活塞退回原处并固定,待装置恢复到室温 Y管中有少量水珠 生成的气态水凝集
打开K2 ③_______________ ④______________
19. (17分)Ⅰ.某化学兴趣小组为了探索铝电极在原电池中的作用,设计并逬行了以下一系列实验,实验结果记录如下:
编号 电极材料 电解质溶液 电流表指针偏转方向
1 Mg、Al 稀盐酸 偏向A1
2 Al、Cu 稀盐酸 偏向Cu
3 Al、石墨 稀盐酸 偏向石墨
4 Mg、Al NaOH溶液 偏向Mg
填写上表的空格,根据上表中记录的实验现象,回答下列问题。
(1)实验1、2中铝电极作用是否相同? (填“是”或“否”)
(2)实验3中铝为_____极
(3)实验4中铝电极反应式为 ;
电池总反应式为 。
(4)根据以上实验结果,在原电池中相对活泼的金属作正扱还是作负极受到哪些因素的影响?
Ⅱ.电解还原法将CO2转化为甲醇的装置如图。
已知:电解效率和选择性S的定义:
(B)= S(B)=
(5)①电解过程中生成CH3OH的电极反应式:___________。
②当CO2完全消耗时,测得η(CH3OH)=33.3%,S(CH3OH)=25%。推测η(CH3OH)=33.3%的原因:
i.阴极有H2O放电。
ii.阴极有CO生成。
iii.……
a.通过检验电解产物判断推测i是否成立,需要检验的物质是___________。(填气体的化学式)
b.假设放电的CO2一部分生成CH3OH,其余的CO2全部在阴极放电生成CO,则η(CO)=___________。
③研究CH3OH中的C来自于CO2还是KHCO3,方法如下:
方法I.其他条件不变,用N2代替CO2电解,无CH3OH产生。
方法II.其他条件不变,用14CO2代替CO2电解,有___________产生。
综上,证实CH3OH中的C来自于CO2
2023-2024学年度(下)沈阳市五校协作体期中考试
高一 化学参考答案
1-5: DDCAC
6-10: CDBCC
11-15:ABCAD
主观题除特殊标记外每空2分
共12分
Ⅰ.0.375mol.L-1.min-1 2.75mol.L-1(不写单位扣1分)
Ⅱ.b 放热
Ⅲ.(4) (或-1266KJ/mol)(方程式一分反应热一分) 390.9(单位可写可不写)
17(共13分)Ⅰ.增大(1分) 升高温度,反应速率增大
Ⅱ.(3)Cu+2Fe3+=Cu2++2Fe2+ (错一处就不给分)
①. 硫酸钠溶液中加入铜片
②. 说明钠离子、硫酸根离子、硝酸根离子均不能单独使铜溶解(少一个给1分,错了或少俩个不给分)
③. 3Cu+2NO+8H+=3Cu2++2NO↑+4H2O (反应物生成物一分,配平1分)
(5)Cu+2H++H2O2=Cu2++2H2O(错一处就不给分)
18.(共13分)(1)①A(或B) (1分)
2NH4Cl+Ca(OH)22NH3↑+ CaCl2+2H2O(或B NH3·H2ONH3↑+H2O) (反应物生成物1分,配平1分) ②d→c→f→e→i
(2)①红棕色气体慢慢变浅 ② 8NH3+6NO27N2 +12H2O(反应物生成物一分,配平一分)
③Z中NaOH溶液产生倒吸现象
④反应后气体分子数减少,Y管中压强小于外压 (各1分)
19.(共17分)Ⅰ.否(1分) 负 Al-3e-+4OH- = [Al(OH)4]-
2Al+2NaOH+6H2O = 2Na[Al(OH)4]+3H2↑(反应物生成物1分,配平1分) 金属本身的还原性、电解质溶液成分(各1分)
Ⅱ.①. CO2+6HCO+6e-=CH3OH+H2O+6CO(7CO2+6e-+5H2O=CH3OH+6HCO)(反应物生成物1分,配平1分) ②. H2 ③. 33.3%(或) ④. 14CH3OH
高一 化学
考试时间:75分钟
分数:100分
试卷说明:试卷共二部分:第一部分:选择题型(1-15题 45分)
第二部分:非选择题型(16-19题 55分)
相对原子质量:H 1、C 12、N 14、O 16、Na 23、Al 27、S 32、Fe 56、Cu 64
第Ⅰ卷(选择题 共45分)
化学与生产、生活密切相关,下列说法正确的是
A .碳酸钡可用于肠胃 X射线造影检查
B .用于制作轴承的金刚砂属于传统的硅酸盐材料,具有优异的高温抗氧化性
C .为增强 84消毒液的杀菌消毒效果,可与洁厕灵混合使用
D .葡萄酒中常添加一定量的 SO2用来抗氧化和杀菌
下列有关物质的工业制备反应错误的是
A. 制漂白粉:
B. 冶炼铁:
C. 制氯气:
D. 制粗硅:
3. 常温常压下,电化学合成氨总反应方程式:,设为阿伏加德罗常数的值。下列说法正确的是
A. 氮气含有的共用电子对数为
B. 每产生,失去电子数为
C. 标况下,参加反应时,产生分子数为
D. 氨水中,含分子数小于
4. 下列实验中的颜色变化,与氧化还原反应无关的是
A B C D
实验 向CaCl2和氨水的混合液中通入CO2 石蕊试液滴入氯水中 NaOH溶液滴入FeSO4溶液中 热铜丝插入稀硝酸中
现象 产生白色沉淀 溶液变红,随后迅速褪色 产生白色沉淀,随后变为红褐色 产生无色气体,随后变为红棕色
5.碘在不同状态(固态或气态)下与氢气反应的热化学方程式如下:
①
②
下列判断正确的是( )。
A.①中的为固态,②中的为气态
B.固态碘升华时将吸热
C.①的反应物总能量比②的反应物总能量高
D.比的热稳定性更好
6.有氧条件下,NO在催化剂作用下可被还原为,反应机理如下图所示。
下列说法不正确的是( )。
A.在反应中起到催化剂的作用
B.该转化过程中,若过量,不利于NO转化为
C.该转化过程中,仅体现了氧化性
D.该转化过程的总反应:
7. 已知 X为一种常见酸的浓溶液。A与 X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
A .X可使蔗糖变黑, 体现了其吸水性
B .将 B通入紫色石蕊试液中,可观察到溶液先变红后褪色
C .工业上, 2mol B 和足量 O2充分反应,可得到 2mol
D . 若 A为 Al,则在常温条件下不能发生图示的转化过程
8. 下列实验操作和现象与结论关系不正确的是
操作和现象 结论
A 将大小相同的K和Na放入等体积的水中,钾比钠反应剧烈 钾元素的金属性比钠元素强
B 将铝片放入盐酸中,产生气泡的速率开始时较慢,随后加快,后来又逐渐减慢 H+的浓度是影响反应速率的唯一因素
C 漂白粉与浓HCl混合产生的气体能使湿润蓝色石蕊试纸先变红后褪色 漂白粉和浓HCl反应生成Cl2
D 向盛有H2O2溶液的试管中,加入少量FeCl3溶液,产生气泡的速率比不加FeCl3溶液的快 FeCl3可以加快H2O2分解速率,起了催化作用
9. 我国科学家设计了可同时实现H2制备和海水淡化的新型电池,装置图如图。
下列说法不正确的是
A. 电极a是正极
B. 电极b的反应式:N2H4-4e-+4OH-=N2↑+4H2O
C. 每生成1molN2,有2molNaCl发生迁移
D. 离子交换膜c、d分别是阳离子交换膜和阴离子交换膜
10. 最新研究发现,金属钙可代替金属锂用于电化学驱动将N2还原为NH3.原理如图所示。已知:电解质溶液由Ca(BH4)2和少量C2H5OH溶于有机溶剂形成。
下列说法不正确的是
A. 阳极反应式为:H2-2e-=2H+
B. 过程Ⅱ生成NH3的离子方程式:3Ca+N2+6C2H5OH=2NH3↑+3Ca2++6C2H5O-
C. 推测用H2O代替C2H5OH更有利于生成NH3
D. 理论上电解一段时间后C2H5OH浓度基本不变
11. 的脱除与的制备反应自发协同转化装置如图所示(在电场作用下,双极膜中间层的解离为和并向两极迁移;忽略溶液体积的变化,极区域浓度保持不变)。下列说法正确的是
电路中转移电子,理论上正极区域溶液增重
电子从电极经导线流向电极
C. 两极参与反应的与的物质的量之比为
D. 双极膜中的解离可不断提供和,故无需补加
12. 某同学进行如下实验:
①将H2O2溶液与KI溶液混合,产生大量气泡,溶液颜色变黄;
②将①中的黄色溶液分成两等份,一份加入CCl4,振荡,产生气泡速率明显减小,下层溶液呈紫红色;另一份不加CCl4,振荡,产生气泡速率无明显变化。
下列说法不正确是
A. ①中溶液颜色变黄的原因是:H2O2+2I-=I2+2OH-
B. ②中产生气泡速率减小的原因是H2O2浓度减小
C. ②中下层溶液呈紫红色是因为I2溶于CCl4
D 由该实验可知,I2可以加快H2O2分解产生气泡的反应速率
科学家提出了一种基于电催化多硫化物循环的自供能产氢体系,如下图所示。通过将锌一多硫化物电池与电解制氢装置集成,最大化利用了间歇性太阳光,实现日夜不间断的自供电的H2生产。下列说法错误的是
A. 锌—多硫化物电池白天可实现电能向化学能的转化
B. 装置白天工作时,b极的电极反应式为
C. 装置夜间工作时,应将电极ac、bd分别连接
D. H2生产装置中可以使用钠离子交换膜
14. 研究人员提出利用热化学硫碘循环实现硫化氢分解联产氢气和硫黄,转化过程如下,其中Y、Z代表I2或HI中的一种。下列说法不正确的是
反应I中X的浓度与硫黄的产率无关
B. Y在CCl4中比在H2SO4溶液中易溶
C. 反应Ⅱ的化学方程式为SO2+2H2O+I2=H2SO4+2HI
D. 等压条件下,反应Ⅰ、Ⅱ、Ⅲ的反应热之和等于硫化氢直接分解的反应热
15. 在金表面分解的实验数据如下表。已知反应物消耗一半所需的时间称为半衰期。下列说法错误的是
0 20 40 60 80
A. 消耗一半时的反应速率为
B. 100min时消耗完全
C.该反应的半衰期与起始浓度的关系满足
D. 该反应的速率与的浓度有关
第Ⅰ卷(非选择题 共55分)
16.(12分)Ⅰ.氮元素的单质及其化合物在工农业生产、生活中有着重要作用。回答下列问题:
一定条件下,在2 L密闭容器中发生反应:3A(g) + B(g)2C(g)。开始时加入4 mol A, 6 mol B,2molC,在2 min末测得C的物质的量是3mol
(1)用A的浓度变化表示反应的平均速率:______________。
(2)在2 min末,B的浓度为________________________。
Ⅱ.某反应过程的能量变化如下图所示。请填写下列空白
(3)反应过程________(填“a”或“b”)有催化剂参与。
(4)该反应为________反应(填“放热”或“吸热”),
已知:
反应ⅰ:
反应ⅱ:
则氨气完全燃烧生成氮气和水蒸气的热化学方程式为__________。
Ⅲ.已知反应ⅰ断开化学键所需的能量如下表。
化学键 H—H N—H
键能/ 945 436 ?
则断开 N—H键所需的能量是__________。
17.(13分)Ⅰ. 目前,常利用催化技术将汽车尾气中的NO和CO转化成CO2和N2。为研究如何增大该化学反应的速率,某课题组进行了以下实验探究。
【提岀问题】在其他条件不变的情况下,温度或催化剂的比表面积(单位质量的物质所具有的总面积)如何影响汽车尾气的转化速率?
【查阅资料】使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】
编号 t/°C c(NO)/(mol L-1) c(CO)/(mol·L-1) 催化剂的比表面积/(m2 g-1))
I 280 6.50×10-3 4.00×10-3 80.0
Ⅱ ? 6.50×10-3 4.00×10-3 120
Ⅲ 360 6.50×10-3 ? 80.0
【图像分析与结论】三组实验中CO的浓度随时间的变化如下图所示。
(1)由曲线I、II可知,增大催化剂的比表面积,该化学反应的速率将 (填“增大”“减小”或“无影响”)。
(2)由实验I和Ⅲ可得出的结论是
Ⅱ.兴趣小组通过实验探究溶解铜的方法和本质。
(3)将铜粉分别加到稍过量的氯化铁溶液和硫酸铁溶液中,铜粉溶解,溶液变成浅绿色,两个反应的共同点是(用离子方程式表示)_______________________。
(4)在热水浴中进行4个实验,部分实验报告如下表所示。
序号 实验操作 实验现象
Ⅰ 稀硫酸中加入铜片 无明显变化
Ⅱ 硝酸钠溶液中加入铜片 无明显变化
Ⅲ 无明显变化
Ⅳ 稀硫酸中加入硝酸钠溶液 无明显变化
再加入铜片 有无色气泡;溶液变蓝
①请填写上表中Ⅲ的空格。
②实验I、Ⅱ、Ⅲ的目的是_________________________。
③实验Ⅳ中反应的本质是(用离子方程式表示)_____________________________。
(5)将铜粉加到混有硫酸的过氧化氢溶液中,溶液逐渐变成蓝色,该反应的离子方程式是_____________________________________。
18.(13分)氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备
①氨气的发生装置可以选择上图中的_________,反应的化学方程式为____。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→________________________(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
操作步骤 实验现象 解释原因
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 ①Y管中_____________ ②反应的化学方程式 ____________
将注射器活塞退回原处并固定,待装置恢复到室温 Y管中有少量水珠 生成的气态水凝集
打开K2 ③_______________ ④______________
19. (17分)Ⅰ.某化学兴趣小组为了探索铝电极在原电池中的作用,设计并逬行了以下一系列实验,实验结果记录如下:
编号 电极材料 电解质溶液 电流表指针偏转方向
1 Mg、Al 稀盐酸 偏向A1
2 Al、Cu 稀盐酸 偏向Cu
3 Al、石墨 稀盐酸 偏向石墨
4 Mg、Al NaOH溶液 偏向Mg
填写上表的空格,根据上表中记录的实验现象,回答下列问题。
(1)实验1、2中铝电极作用是否相同? (填“是”或“否”)
(2)实验3中铝为_____极
(3)实验4中铝电极反应式为 ;
电池总反应式为 。
(4)根据以上实验结果,在原电池中相对活泼的金属作正扱还是作负极受到哪些因素的影响?
Ⅱ.电解还原法将CO2转化为甲醇的装置如图。
已知:电解效率和选择性S的定义:
(B)= S(B)=
(5)①电解过程中生成CH3OH的电极反应式:___________。
②当CO2完全消耗时,测得η(CH3OH)=33.3%,S(CH3OH)=25%。推测η(CH3OH)=33.3%的原因:
i.阴极有H2O放电。
ii.阴极有CO生成。
iii.……
a.通过检验电解产物判断推测i是否成立,需要检验的物质是___________。(填气体的化学式)
b.假设放电的CO2一部分生成CH3OH,其余的CO2全部在阴极放电生成CO,则η(CO)=___________。
③研究CH3OH中的C来自于CO2还是KHCO3,方法如下:
方法I.其他条件不变,用N2代替CO2电解,无CH3OH产生。
方法II.其他条件不变,用14CO2代替CO2电解,有___________产生。
综上,证实CH3OH中的C来自于CO2
2023-2024学年度(下)沈阳市五校协作体期中考试
高一 化学参考答案
1-5: DDCAC
6-10: CDBCC
11-15:ABCAD
主观题除特殊标记外每空2分
共12分
Ⅰ.0.375mol.L-1.min-1 2.75mol.L-1(不写单位扣1分)
Ⅱ.b 放热
Ⅲ.(4) (或-1266KJ/mol)(方程式一分反应热一分) 390.9(单位可写可不写)
17(共13分)Ⅰ.增大(1分) 升高温度,反应速率增大
Ⅱ.(3)Cu+2Fe3+=Cu2++2Fe2+ (错一处就不给分)
①. 硫酸钠溶液中加入铜片
②. 说明钠离子、硫酸根离子、硝酸根离子均不能单独使铜溶解(少一个给1分,错了或少俩个不给分)
③. 3Cu+2NO+8H+=3Cu2++2NO↑+4H2O (反应物生成物一分,配平1分)
(5)Cu+2H++H2O2=Cu2++2H2O(错一处就不给分)
18.(共13分)(1)①A(或B) (1分)
2NH4Cl+Ca(OH)22NH3↑+ CaCl2+2H2O(或B NH3·H2ONH3↑+H2O) (反应物生成物1分,配平1分) ②d→c→f→e→i
(2)①红棕色气体慢慢变浅 ② 8NH3+6NO27N2 +12H2O(反应物生成物一分,配平一分)
③Z中NaOH溶液产生倒吸现象
④反应后气体分子数减少,Y管中压强小于外压 (各1分)
19.(共17分)Ⅰ.否(1分) 负 Al-3e-+4OH- = [Al(OH)4]-
2Al+2NaOH+6H2O = 2Na[Al(OH)4]+3H2↑(反应物生成物1分,配平1分) 金属本身的还原性、电解质溶液成分(各1分)
Ⅱ.①. CO2+6HCO+6e-=CH3OH+H2O+6CO(7CO2+6e-+5H2O=CH3OH+6HCO)(反应物生成物1分,配平1分) ②. H2 ③. 33.3%(或) ④. 14CH3OH
同课章节目录
