吉林省四平市2023-2024学年高一下学期期中考试化学(含答案)
文档属性
| 名称 | 吉林省四平市2023-2024学年高一下学期期中考试化学(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 692.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-27 17:12:10 | ||
图片预览



文档简介
四平市2023-2024学年度第二学期期中质量监测
高一化学试题
全卷满分100分,考试时间75分钟.
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试卷和答题卡上,并将条形码粘贴在答题卡上的指定位置.
2.请按题号顺序在答题卡上各题目的答题区域内作答,写在试卷、草稿纸和答题卡上的非答题区域均无效.
3.选择题用2B铅笔在答题卡上把所选答案的标号涂黑;非选择题用黑色签字笔在答题卡上作答;字体工整,笔迹清楚.
4.考试结束后,请将试卷和答题卡一并上交.
5.本卷主要考查内容:必修第二册第五章~第六章.
可能用到的相对原子质量:
一、选择题:本题共15小题,每小题3分,共45分.在每小题给出的四个选项中,只有一项是符合题目要求的.
1.化学与生活密切相关.下列说法正确的是( )
A.太阳能电池的主要材料是高纯度的二氧化硅
B.二氧化硫是一种有毒气体,不能用作食品添加剂
C.液氨汽化时放出大量热,故液氨可用作制冷剂
D.次氯酸钠具有强氧化性,能够起到消毒、杀菌的作用
2.在化学变化中能量越低越稳定.如图表示反应C(s,金刚石)C(s,石墨)过程中的能量变化情况,下列有关说法正确的是( )
A.该反应是吸热反应 B.该过程是一个物理变化
C.常温下,石墨比金刚石稳定 D.反应物的总键能大于生成物的总键能
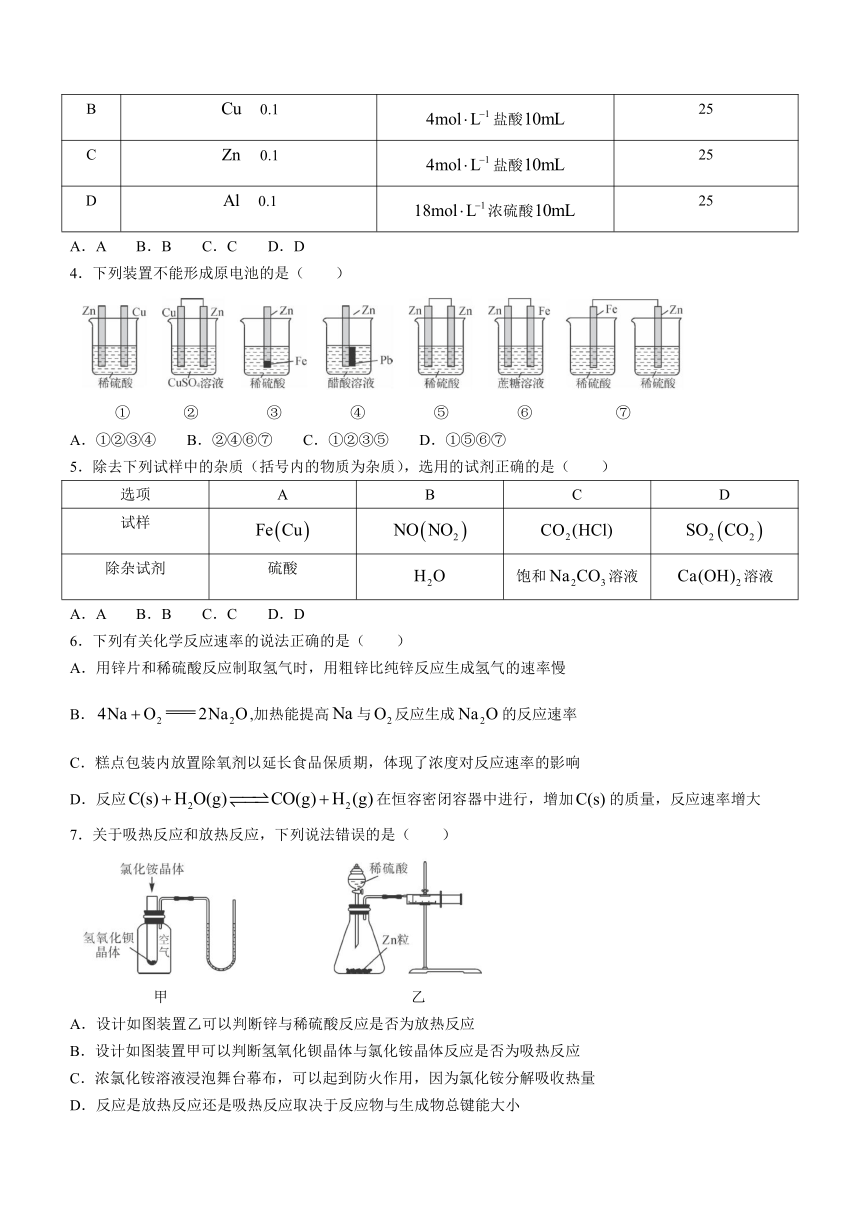
3.下列各组反应(表中物质均为反应物)在反应刚开始时,放出的速率最快的是( )
选项 金属(粉末状)及其物质的量/ 酸的浓度及体积 反应温度/℃
A 0.1 盐酸 25
B 0.1 盐酸 25
C 0.1 盐酸 25
D 0.1 浓硫酸 25
A.A B.B C.C D.D
4.下列装置不能形成原电池的是( )
① ② ③ ④ ⑤ ⑥ ⑦
A.①②③④ B.②④⑥⑦ C.①②③⑤ D.①⑤⑥⑦
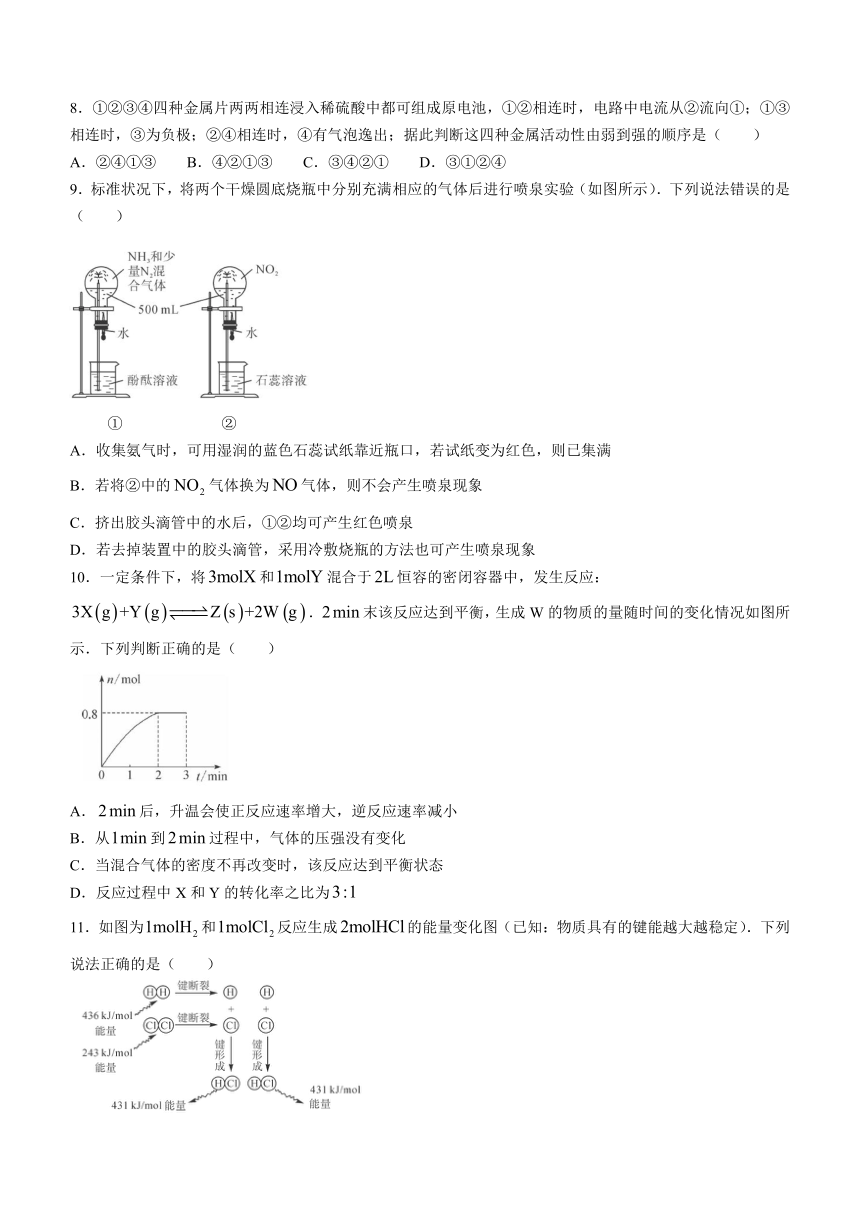
5.除去下列试样中的杂质(括号内的物质为杂质),选用的试剂正确的是( )
选项 A B C D
试样
除杂试剂 硫酸 饱和溶液 溶液
A.A B.B C.C D.D
6.下列有关化学反应速率的说法正确的是( )
A.用锌片和稀硫酸反应制取氢气时,用粗锌比纯锌反应生成氢气的速率慢
B.,加热能提高与反应生成的反应速率
C.糕点包装内放置除氧剂以延长食品保质期,体现了浓度对反应速率的影响
D.反应在恒容密闭容器中进行,增加的质量,反应速率增大
7.关于吸热反应和放热反应,下列说法错误的是( )
甲 乙
A.设计如图装置乙可以判断锌与稀硫酸反应是否为放热反应
B.设计如图装置甲可以判断氢氧化钡晶体与氯化铵晶体反应是否为吸热反应
C.浓氯化铵溶液浸泡舞台幕布,可以起到防火作用,因为氯化铵分解吸收热量
D.反应是放热反应还是吸热反应取决于反应物与生成物总键能大小
8.①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池,①②相连时,电路中电流从②流向①;①③相连时,③为负极;②④相连时,④有气泡逸出;据此判断这四种金属活动性由弱到强的顺序是( )
A.②④①③ B.④②①③ C.③④②① D.③①②④
9.标准状况下,将两个干燥圆底烧瓶中分别充满相应的气体后进行喷泉实验(如图所示).下列说法错误的是( )
① ②
A.收集氨气时,可用湿润的蓝色石蕊试纸靠近瓶口,若试纸变为红色,则已集满
B.若将②中的气体换为气体,则不会产生喷泉现象
C.挤出胶头滴管中的水后,①②均可产生红色喷泉
D.若去掉装置中的胶头滴管,采用冷敷烧瓶的方法也可产生喷泉现象
10.一定条件下,将和混合于恒容的密闭容器中,发生反应:.末该反应达到平衡,生成W的物质的量随时间的变化情况如图所示.下列判断正确的是( )
A.后,升温会使正反应速率增大,逆反应速率减小
B.从到过程中,气体的压强没有变化
C.当混合气体的密度不再改变时,该反应达到平衡状态
D.反应过程中X和Y的转化率之比为
11.如图为和反应生成的能量变化图(已知:物质具有的键能越大越稳定).下列说法正确的是( )
A.该反应每生成,放出的热量
B.由图知H原子和原子形成分子会放出的能量
C.氯气分子中的化学键比氢气分子中的化学键更稳定
D.该反应生成液态比生成气态释放的能量少
12.如图所示,电流计指针发生偏转,发现A极上有气泡产生,同时B极质量减少,C为电解质溶液,下列说法错误的是( )
A.A极为原电池的正极
B.C中阳离子向A极移动
C.B极发生氧化反应,电子从B极经外电路流向A极
D.A、B、C可能分别为石墨、铜、稀盐酸
13.氨催化氧化法是工业生产中制取硝酸的主要途径,某同学用该原理设计实验探究硝酸的制备和性质,装置如图所示(装置内空气均已排尽).下列说法错误的是( )
A.装置丁可以起到防倒吸作用
B.甲装置中的固体也可以是或
C.装置乙中的干燥剂可以为碱石灰
D.理论上装置丙中通入的氨气和氧气物质的量之比为时可以完全被吸收生成硝酸
14.已知:,某温度下,在恒容密闭容器中充入与发生该反应,平衡时总压强增加了20%.下列说法正确的是( )
A.平衡时 B.平衡时B的体积分数为20%
C.A的转化率为20% D.平衡时C与D的化学反应速率相等
15.在一定量的稀硝酸中,加入一定量的镁和铜组成的混合物,充分反应后金属完全溶解(假设还原产物只有),向反应后溶液中加入溶液至沉淀完全,测得生成沉淀质量比原金属质量增加,则下列叙述正确的是( )
A.当金属全部溶解时,收集到标准状况下
B.当生成沉淀的量最多时,消耗溶液体积一定为
C.反应过程中消耗硝酸的物质的量为
D.参加反应的金属总质量可能为
二、非选择题:本题共4小题,共55分.
16.(14分)科研人员研究发现,雾霾的形成与氮及其化合物有关.其关系如图所示:
回答下列问题:
(1)氮的氧化物是空气的主要污染物,下列环境问题与氮的氧化物排放有关的是____________(填字母).
A.酸雨 B.白色污染 C.光化学烟雾 D.温室效应
(2)反应②的离子方程式为_____________________________________;氨水中含10电子的阳离子为____________(填微粒符号).
(3)汽车的尾气治理是在催化剂条件下使与发生反应生成两种无污染的气体,该反应的化学方程式为____________________________________________,当生成时,被还原的的质量为____________g.
(4)该课外兴趣小组将溶液逐滴滴入含淀粉的酸性溶液中,溶液变蓝,同时放出气体,该反应的离子方程式为_____________________________________________.
(5)硝酸铜的浓、稀溶液都呈蓝色,而实验中铜与浓硝酸反应的溶液呈绿色,其原因是生成的溶解在硝酸铜溶液中所致.同学们设计下列实验方案证明其原因,下列方案中可行的是____________(填字母).
a.加水稀释该绿色溶液,观察颜色变化
b.用水浴加热该绿色溶液,观察颜色变化
c.向该绿色溶液中通入空气,观察颜色变化
17.(13分)依据原电池原理,清回答下列问题.
(1)锌锰干电池是应用最普遍的电池之一(如图所示),锌锰干电池属于____________(填“一次电池”或“二次电池”),锌锰电池的正极材料是____________,负极发生的电极反应式为______________________.若反应消耗负极材料,则电池中转移电子的数目为____________.
(2)微型锌银电池可用作电子仪器的电源,其电极分别是和,电解质溶液为溶液,电池总反应为.负极发生的电极反应式为_________________________,电池工作过程中,电解液中向____________(填“”或“”)极迁移.
(3)以为电极,可以组装如图所示原电池装置.
①若电解质溶液为稀硫酸,上发生的电极反应式为_____________________________.
②若电解质溶液为溶液,上发生的电极反应式为_____________________________.
18.(14分)化学反应速率和限度与生产、生活密切相关.请回答下列问题.
(1)在密闭容器内,时仅发生反应,体系中开始仅含有和随时间的变化如下表所示:
时间/s 0 1 2 3 4 5
0.020 0.010 0.008 0.007 0.007 0.007
①时,生成的物质的量为____________,在第时,的转化率为____________.
②如图中表示变化曲线的是____________(填字母).
③下列能说明该反应已达到平衡状态的是____________(填字母).
a.每消耗,生成的
b.各物质组分的物质的浓度不再改变
c.混合气体的平均相对分子质量不变
d.容器内密度保持不变
(2)在一定温度下,密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:
①比较时刻,正、逆反应速率大小____________(填“>”“=”或“<”).
②若,计算反应开始至时刻用M的浓度变化表示的平均反应速率为____________.
③如果升高温度,则____________(填“增大”“减小”或“不变”).
19.(14分)某学习小组用如图所示的实验装置探究能否被硝酸盐氧化(部分夹持仪器省略).
回答下列问题:
(1)盛装浓硫酸的仪器名称是____________,该仪器使用的第一步操作是____________.
(2)实验时,先打开弹簧夹通一段时间,再滴加70%浓硫酸,目的是____________.
(3)装置A中发生反应的化学方程式为________________________________________________.
(4)开始实验后装置C中产生白色沉淀,实验结束后装置D试管中收集到的气体遇空气变为红棕色,则实验初期装置C中发生反应的离子方程式是_________________________________________________________.
(5)若D中试管收集到标准状况下气体,再向其中通入标准状况下____________,可使试管内充满液体.
(6)测定反应后装置B溶液中的浓度时,只考虑与的反应.用酸性溶液与中溶液中的反应,共消耗溶液,则B中为____________(保留两位小数).
四平市2023-2024学年度第二学期期中质量监测·高一化学
参考答案、提示及评分细则
1.D 太阳能电池的主要材料是高纯度的单质硅,A错误;红酒中一般添加少量二氧化硫用于抗氧化和除菌,B错误;液氨汽化时吸收大量热,故可用作制冷剂,C错误.
2.C 如图可知,反应物总能量大于生成物总能量,该反应为放热反应,A错误;同素异形体的转化是一个化学变化,B错误;能量越低越稳定,故石墨能量更低,故更加稳定,C正确;该反应为放热反应,反应物总键能小于生成物总键能,D错误.
3.C A、C两选项中盐酸浓度、体积、所处温度和金属的物质的量均相同,但金属活动性:,故放出的速率最快的是,A不符合题意,C符合题意;铜与盐酸不反应,B不符合题意;常温下,铝的表面被浓硫酸氧化,生成一层致密的氧化物薄膜,这层薄膜阻止了酸与内层金属进一步反应,故与浓硫酸反应不会生成,D不符合题意.
4.D 形成原电池的必要条件:两个活泼性不同的电极;将电极插入电解质溶液或熔融电解质中;两电极构成闭合回路;能自发进行的氧化还原反应.①⑦没有构成闭合回路,所以不能形成原电池;②③④装置符合原电池的构成条件,所以能形成原电池;⑤该装置中电极材料相同,所以不能形成原电池;⑥蔗糖为非电解质,该装置不能自发地进行氧化还原反应,所以不能形成原电池.
5.B 与硫酸反应,而杂质不与硫酸反应,A错误;杂质与反应可生成硝酸和,B正确;均能与溶液反应,C错误;均能与溶液反应,D错误.
6.C 用锌片和稀硫酸反应制取氢气时,粗锌含有杂质,锌可与杂质构成原电池,加快化学反应速率,A错误;加热时与反应生成,不会提高生成的速率,B错误;糕点包装袋里放小包除氧剂,除氧剂和氧气反应,降低包装袋内氧气浓度,反应速率降低,因此糕点包装袋内放置除氧剂以延长食品保质期,体现了浓度对反应速率的影响,C正确;碳是固体,增加固体的质量,反应速率不变,D错误.
7.A 与稀硫酸反应生成氢气,氢气可使针筒活塞向右移动,不能说明相应的化学反应是放热反应,A错误;反应开始后,甲中U形管左边液面高于右边液面,说明装置内温度降低,反应为吸热反应,B正确;浓氯化按溶液浸泡舞台幕布,可以起到防火作用,因为氯化铵分解吸收热量,C正确;反应是放热反应还是吸热反应取决于反应物与生成物总键能大小,D正确.
8.B ①②相连时,电子流动方向与电流方向相反,故电子由①流向②,负极发生氧化反应失去电子,故金属活动性;①③相连时,③为负极,故金属活动性;②④相连时,④有气泡逸出,氢离子在金属④上得电子生成氢气,故金属活动性;故金属活动性由弱到强的顺序是④②①③.
9.A 收集氨气时,可用湿润的红色石蕊试纸靠近瓶口,若试纸变为蓝色,则已集满,A错误;不溶于水,不会使烧瓶内气压减小,故不会产生喷泉现象,B正确;①中氨气极易溶于水,使瓶内气压减小,氨水呈碱性能使酚酞溶液变红,可形成红色喷泉,②中发生反应:,气体体积减小,使瓶内气压减小,硝酸溶液能使石蕊溶液变红,可形成红色喷泉,C正确;去掉装置中的胶头滴管,冷敷烧瓶,造成压强差,也会引发喷泉现象,D正确.
10.C 后,升温,正、逆反应速率都增大,A错误;从到过程中,生成固体Z,且化学计量数减小,气体压强会减小,B错误;为固体,当混合气体的密度不再改变时,该反应一定达到平衡状态,C正确;将和两种气体混合于固定容积为的密闭容器中,反应转化的物质的量之比和起始物质的量之比相同,所以反应过程中X和Y的转化率之比为,D错误.
11.B 根据产生的热量=反应物键能总和—生成物键能总和,所以该反应每生成,放出的热量,A错误;由图可知H原子和原子形成分子会放出的能量,B正确;物质具有的键能越大,越稳定,因此氢气分子中的化学键比氯气分子中的化学键更稳定,C错误;气态变为液态会放出能量,因此生成液态比生成气态释放的能量多,D错误.
12.D 原电池中,负极金属失去电子发生氧化反应,质量减小,故B极是负极,A极是正极,A正确;原电池中阳离子向正极移动,阴离子向负极移动,B正确;B极是负极,发生氧化反应,电子从负极流向正极,C正确;与稀盐酸不能发生反应,D错误.
13.B装置丁为空试管,左管长,右管短,可以起到防倒吸作用,A正确;甲装置需要提供氨气和氧气,如果甲装置中的固体是或,只能提供氨气,不能提供氧气,B错误;碱石灰可用于干燥和,C正确;丙中发生的反应是,由方程式可知和物质的量之比为时,可以完全被吸收生成硝酸,D正确.
14.A 假设平衡时物质的量变化了x,根据题意可知:
得.
平衡时,则,A正确;平衡时,总物质的量为,则平衡时B的体积分数为25%,B错误;的转化率,C错误:与的化学计量数不同,平衡时与的化学反应速率不相等,D错误.
15.A 由题意可知,向稀硝酸与镁、铜混合物反应后的溶液中加入氢氧化钠溶液至沉淀完全,沉淀为氢氧化镁和氢氧化铜的混合物,生成沉淀质量比原金属质量增加,则氢氧根离子的物质的量为,由原子个数守恒可知,镁和铜的物质的量之和为,由得失电子数目守恒可知,反应生成一氧化氮的物质的量为,则稀硝酸与镁、铜混合物反应消耗硝酸的物质的量为.当金属全部溶解时,收集到标准状况下的体积为,A正确;向稀硝酸与镁、铜混合物反应后溶液中加入氢氧化钠溶液至生成沉淀的量最多时,所得溶液为硝酸钠溶液,由分析可知,若稀硝酸溶液与镁、铜混合物完全反应,反应消耗氢氧化钠溶液的体积为,若稀硝酸溶液过量,反应消耗氢氧化钠溶液的体积大于,B错误;反应过程中消耗硝酸的物质的量为,C错误;镁和铜的物质的量之和为,若金属混合物都是镁,金属的质量为,若金属完全是铜,金属的质量为,则参加反应金属总质量为,D错误.
16.(每空2分)
(1)AC(少写且正确得1分,写错不得分)
(2)
(3)(未写条件扣1分) 30
(4)
(5)bc(少写且正确得1分,写错不得分)
17.(除特殊标注外,每空2分)
(1)一次电池(1分) 石墨(1分) (或)
(2) (1分)
(3)① ②
18.(每空2分)
(1)①0.013 65% ②b ③bc
(2)①> ②(不写单位扣1分) ③增大
19.(每空2分)
(1)分液漏斗 检查是否漏水
(2)排尽装置中的空气,防止实验时干扰气体性质验证(答案合理即可)
(3)(浓)
(4)
(5)0.168 (6)
高一化学试题
全卷满分100分,考试时间75分钟.
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试卷和答题卡上,并将条形码粘贴在答题卡上的指定位置.
2.请按题号顺序在答题卡上各题目的答题区域内作答,写在试卷、草稿纸和答题卡上的非答题区域均无效.
3.选择题用2B铅笔在答题卡上把所选答案的标号涂黑;非选择题用黑色签字笔在答题卡上作答;字体工整,笔迹清楚.
4.考试结束后,请将试卷和答题卡一并上交.
5.本卷主要考查内容:必修第二册第五章~第六章.
可能用到的相对原子质量:
一、选择题:本题共15小题,每小题3分,共45分.在每小题给出的四个选项中,只有一项是符合题目要求的.
1.化学与生活密切相关.下列说法正确的是( )
A.太阳能电池的主要材料是高纯度的二氧化硅
B.二氧化硫是一种有毒气体,不能用作食品添加剂
C.液氨汽化时放出大量热,故液氨可用作制冷剂
D.次氯酸钠具有强氧化性,能够起到消毒、杀菌的作用
2.在化学变化中能量越低越稳定.如图表示反应C(s,金刚石)C(s,石墨)过程中的能量变化情况,下列有关说法正确的是( )
A.该反应是吸热反应 B.该过程是一个物理变化
C.常温下,石墨比金刚石稳定 D.反应物的总键能大于生成物的总键能
3.下列各组反应(表中物质均为反应物)在反应刚开始时,放出的速率最快的是( )
选项 金属(粉末状)及其物质的量/ 酸的浓度及体积 反应温度/℃
A 0.1 盐酸 25
B 0.1 盐酸 25
C 0.1 盐酸 25
D 0.1 浓硫酸 25
A.A B.B C.C D.D
4.下列装置不能形成原电池的是( )
① ② ③ ④ ⑤ ⑥ ⑦
A.①②③④ B.②④⑥⑦ C.①②③⑤ D.①⑤⑥⑦
5.除去下列试样中的杂质(括号内的物质为杂质),选用的试剂正确的是( )
选项 A B C D
试样
除杂试剂 硫酸 饱和溶液 溶液
A.A B.B C.C D.D
6.下列有关化学反应速率的说法正确的是( )
A.用锌片和稀硫酸反应制取氢气时,用粗锌比纯锌反应生成氢气的速率慢
B.,加热能提高与反应生成的反应速率
C.糕点包装内放置除氧剂以延长食品保质期,体现了浓度对反应速率的影响
D.反应在恒容密闭容器中进行,增加的质量,反应速率增大
7.关于吸热反应和放热反应,下列说法错误的是( )
甲 乙
A.设计如图装置乙可以判断锌与稀硫酸反应是否为放热反应
B.设计如图装置甲可以判断氢氧化钡晶体与氯化铵晶体反应是否为吸热反应
C.浓氯化铵溶液浸泡舞台幕布,可以起到防火作用,因为氯化铵分解吸收热量
D.反应是放热反应还是吸热反应取决于反应物与生成物总键能大小
8.①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池,①②相连时,电路中电流从②流向①;①③相连时,③为负极;②④相连时,④有气泡逸出;据此判断这四种金属活动性由弱到强的顺序是( )
A.②④①③ B.④②①③ C.③④②① D.③①②④
9.标准状况下,将两个干燥圆底烧瓶中分别充满相应的气体后进行喷泉实验(如图所示).下列说法错误的是( )
① ②
A.收集氨气时,可用湿润的蓝色石蕊试纸靠近瓶口,若试纸变为红色,则已集满
B.若将②中的气体换为气体,则不会产生喷泉现象
C.挤出胶头滴管中的水后,①②均可产生红色喷泉
D.若去掉装置中的胶头滴管,采用冷敷烧瓶的方法也可产生喷泉现象
10.一定条件下,将和混合于恒容的密闭容器中,发生反应:.末该反应达到平衡,生成W的物质的量随时间的变化情况如图所示.下列判断正确的是( )
A.后,升温会使正反应速率增大,逆反应速率减小
B.从到过程中,气体的压强没有变化
C.当混合气体的密度不再改变时,该反应达到平衡状态
D.反应过程中X和Y的转化率之比为
11.如图为和反应生成的能量变化图(已知:物质具有的键能越大越稳定).下列说法正确的是( )
A.该反应每生成,放出的热量
B.由图知H原子和原子形成分子会放出的能量
C.氯气分子中的化学键比氢气分子中的化学键更稳定
D.该反应生成液态比生成气态释放的能量少
12.如图所示,电流计指针发生偏转,发现A极上有气泡产生,同时B极质量减少,C为电解质溶液,下列说法错误的是( )
A.A极为原电池的正极
B.C中阳离子向A极移动
C.B极发生氧化反应,电子从B极经外电路流向A极
D.A、B、C可能分别为石墨、铜、稀盐酸
13.氨催化氧化法是工业生产中制取硝酸的主要途径,某同学用该原理设计实验探究硝酸的制备和性质,装置如图所示(装置内空气均已排尽).下列说法错误的是( )
A.装置丁可以起到防倒吸作用
B.甲装置中的固体也可以是或
C.装置乙中的干燥剂可以为碱石灰
D.理论上装置丙中通入的氨气和氧气物质的量之比为时可以完全被吸收生成硝酸
14.已知:,某温度下,在恒容密闭容器中充入与发生该反应,平衡时总压强增加了20%.下列说法正确的是( )
A.平衡时 B.平衡时B的体积分数为20%
C.A的转化率为20% D.平衡时C与D的化学反应速率相等
15.在一定量的稀硝酸中,加入一定量的镁和铜组成的混合物,充分反应后金属完全溶解(假设还原产物只有),向反应后溶液中加入溶液至沉淀完全,测得生成沉淀质量比原金属质量增加,则下列叙述正确的是( )
A.当金属全部溶解时,收集到标准状况下
B.当生成沉淀的量最多时,消耗溶液体积一定为
C.反应过程中消耗硝酸的物质的量为
D.参加反应的金属总质量可能为
二、非选择题:本题共4小题,共55分.
16.(14分)科研人员研究发现,雾霾的形成与氮及其化合物有关.其关系如图所示:
回答下列问题:
(1)氮的氧化物是空气的主要污染物,下列环境问题与氮的氧化物排放有关的是____________(填字母).
A.酸雨 B.白色污染 C.光化学烟雾 D.温室效应
(2)反应②的离子方程式为_____________________________________;氨水中含10电子的阳离子为____________(填微粒符号).
(3)汽车的尾气治理是在催化剂条件下使与发生反应生成两种无污染的气体,该反应的化学方程式为____________________________________________,当生成时,被还原的的质量为____________g.
(4)该课外兴趣小组将溶液逐滴滴入含淀粉的酸性溶液中,溶液变蓝,同时放出气体,该反应的离子方程式为_____________________________________________.
(5)硝酸铜的浓、稀溶液都呈蓝色,而实验中铜与浓硝酸反应的溶液呈绿色,其原因是生成的溶解在硝酸铜溶液中所致.同学们设计下列实验方案证明其原因,下列方案中可行的是____________(填字母).
a.加水稀释该绿色溶液,观察颜色变化
b.用水浴加热该绿色溶液,观察颜色变化
c.向该绿色溶液中通入空气,观察颜色变化
17.(13分)依据原电池原理,清回答下列问题.
(1)锌锰干电池是应用最普遍的电池之一(如图所示),锌锰干电池属于____________(填“一次电池”或“二次电池”),锌锰电池的正极材料是____________,负极发生的电极反应式为______________________.若反应消耗负极材料,则电池中转移电子的数目为____________.
(2)微型锌银电池可用作电子仪器的电源,其电极分别是和,电解质溶液为溶液,电池总反应为.负极发生的电极反应式为_________________________,电池工作过程中,电解液中向____________(填“”或“”)极迁移.
(3)以为电极,可以组装如图所示原电池装置.
①若电解质溶液为稀硫酸,上发生的电极反应式为_____________________________.
②若电解质溶液为溶液,上发生的电极反应式为_____________________________.
18.(14分)化学反应速率和限度与生产、生活密切相关.请回答下列问题.
(1)在密闭容器内,时仅发生反应,体系中开始仅含有和随时间的变化如下表所示:
时间/s 0 1 2 3 4 5
0.020 0.010 0.008 0.007 0.007 0.007
①时,生成的物质的量为____________,在第时,的转化率为____________.
②如图中表示变化曲线的是____________(填字母).
③下列能说明该反应已达到平衡状态的是____________(填字母).
a.每消耗,生成的
b.各物质组分的物质的浓度不再改变
c.混合气体的平均相对分子质量不变
d.容器内密度保持不变
(2)在一定温度下,密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:
①比较时刻,正、逆反应速率大小____________(填“>”“=”或“<”).
②若,计算反应开始至时刻用M的浓度变化表示的平均反应速率为____________.
③如果升高温度,则____________(填“增大”“减小”或“不变”).
19.(14分)某学习小组用如图所示的实验装置探究能否被硝酸盐氧化(部分夹持仪器省略).
回答下列问题:
(1)盛装浓硫酸的仪器名称是____________,该仪器使用的第一步操作是____________.
(2)实验时,先打开弹簧夹通一段时间,再滴加70%浓硫酸,目的是____________.
(3)装置A中发生反应的化学方程式为________________________________________________.
(4)开始实验后装置C中产生白色沉淀,实验结束后装置D试管中收集到的气体遇空气变为红棕色,则实验初期装置C中发生反应的离子方程式是_________________________________________________________.
(5)若D中试管收集到标准状况下气体,再向其中通入标准状况下____________,可使试管内充满液体.
(6)测定反应后装置B溶液中的浓度时,只考虑与的反应.用酸性溶液与中溶液中的反应,共消耗溶液,则B中为____________(保留两位小数).
四平市2023-2024学年度第二学期期中质量监测·高一化学
参考答案、提示及评分细则
1.D 太阳能电池的主要材料是高纯度的单质硅,A错误;红酒中一般添加少量二氧化硫用于抗氧化和除菌,B错误;液氨汽化时吸收大量热,故可用作制冷剂,C错误.
2.C 如图可知,反应物总能量大于生成物总能量,该反应为放热反应,A错误;同素异形体的转化是一个化学变化,B错误;能量越低越稳定,故石墨能量更低,故更加稳定,C正确;该反应为放热反应,反应物总键能小于生成物总键能,D错误.
3.C A、C两选项中盐酸浓度、体积、所处温度和金属的物质的量均相同,但金属活动性:,故放出的速率最快的是,A不符合题意,C符合题意;铜与盐酸不反应,B不符合题意;常温下,铝的表面被浓硫酸氧化,生成一层致密的氧化物薄膜,这层薄膜阻止了酸与内层金属进一步反应,故与浓硫酸反应不会生成,D不符合题意.
4.D 形成原电池的必要条件:两个活泼性不同的电极;将电极插入电解质溶液或熔融电解质中;两电极构成闭合回路;能自发进行的氧化还原反应.①⑦没有构成闭合回路,所以不能形成原电池;②③④装置符合原电池的构成条件,所以能形成原电池;⑤该装置中电极材料相同,所以不能形成原电池;⑥蔗糖为非电解质,该装置不能自发地进行氧化还原反应,所以不能形成原电池.
5.B 与硫酸反应,而杂质不与硫酸反应,A错误;杂质与反应可生成硝酸和,B正确;均能与溶液反应,C错误;均能与溶液反应,D错误.
6.C 用锌片和稀硫酸反应制取氢气时,粗锌含有杂质,锌可与杂质构成原电池,加快化学反应速率,A错误;加热时与反应生成,不会提高生成的速率,B错误;糕点包装袋里放小包除氧剂,除氧剂和氧气反应,降低包装袋内氧气浓度,反应速率降低,因此糕点包装袋内放置除氧剂以延长食品保质期,体现了浓度对反应速率的影响,C正确;碳是固体,增加固体的质量,反应速率不变,D错误.
7.A 与稀硫酸反应生成氢气,氢气可使针筒活塞向右移动,不能说明相应的化学反应是放热反应,A错误;反应开始后,甲中U形管左边液面高于右边液面,说明装置内温度降低,反应为吸热反应,B正确;浓氯化按溶液浸泡舞台幕布,可以起到防火作用,因为氯化铵分解吸收热量,C正确;反应是放热反应还是吸热反应取决于反应物与生成物总键能大小,D正确.
8.B ①②相连时,电子流动方向与电流方向相反,故电子由①流向②,负极发生氧化反应失去电子,故金属活动性;①③相连时,③为负极,故金属活动性;②④相连时,④有气泡逸出,氢离子在金属④上得电子生成氢气,故金属活动性;故金属活动性由弱到强的顺序是④②①③.
9.A 收集氨气时,可用湿润的红色石蕊试纸靠近瓶口,若试纸变为蓝色,则已集满,A错误;不溶于水,不会使烧瓶内气压减小,故不会产生喷泉现象,B正确;①中氨气极易溶于水,使瓶内气压减小,氨水呈碱性能使酚酞溶液变红,可形成红色喷泉,②中发生反应:,气体体积减小,使瓶内气压减小,硝酸溶液能使石蕊溶液变红,可形成红色喷泉,C正确;去掉装置中的胶头滴管,冷敷烧瓶,造成压强差,也会引发喷泉现象,D正确.
10.C 后,升温,正、逆反应速率都增大,A错误;从到过程中,生成固体Z,且化学计量数减小,气体压强会减小,B错误;为固体,当混合气体的密度不再改变时,该反应一定达到平衡状态,C正确;将和两种气体混合于固定容积为的密闭容器中,反应转化的物质的量之比和起始物质的量之比相同,所以反应过程中X和Y的转化率之比为,D错误.
11.B 根据产生的热量=反应物键能总和—生成物键能总和,所以该反应每生成,放出的热量,A错误;由图可知H原子和原子形成分子会放出的能量,B正确;物质具有的键能越大,越稳定,因此氢气分子中的化学键比氯气分子中的化学键更稳定,C错误;气态变为液态会放出能量,因此生成液态比生成气态释放的能量多,D错误.
12.D 原电池中,负极金属失去电子发生氧化反应,质量减小,故B极是负极,A极是正极,A正确;原电池中阳离子向正极移动,阴离子向负极移动,B正确;B极是负极,发生氧化反应,电子从负极流向正极,C正确;与稀盐酸不能发生反应,D错误.
13.B装置丁为空试管,左管长,右管短,可以起到防倒吸作用,A正确;甲装置需要提供氨气和氧气,如果甲装置中的固体是或,只能提供氨气,不能提供氧气,B错误;碱石灰可用于干燥和,C正确;丙中发生的反应是,由方程式可知和物质的量之比为时,可以完全被吸收生成硝酸,D正确.
14.A 假设平衡时物质的量变化了x,根据题意可知:
得.
平衡时,则,A正确;平衡时,总物质的量为,则平衡时B的体积分数为25%,B错误;的转化率,C错误:与的化学计量数不同,平衡时与的化学反应速率不相等,D错误.
15.A 由题意可知,向稀硝酸与镁、铜混合物反应后的溶液中加入氢氧化钠溶液至沉淀完全,沉淀为氢氧化镁和氢氧化铜的混合物,生成沉淀质量比原金属质量增加,则氢氧根离子的物质的量为,由原子个数守恒可知,镁和铜的物质的量之和为,由得失电子数目守恒可知,反应生成一氧化氮的物质的量为,则稀硝酸与镁、铜混合物反应消耗硝酸的物质的量为.当金属全部溶解时,收集到标准状况下的体积为,A正确;向稀硝酸与镁、铜混合物反应后溶液中加入氢氧化钠溶液至生成沉淀的量最多时,所得溶液为硝酸钠溶液,由分析可知,若稀硝酸溶液与镁、铜混合物完全反应,反应消耗氢氧化钠溶液的体积为,若稀硝酸溶液过量,反应消耗氢氧化钠溶液的体积大于,B错误;反应过程中消耗硝酸的物质的量为,C错误;镁和铜的物质的量之和为,若金属混合物都是镁,金属的质量为,若金属完全是铜,金属的质量为,则参加反应金属总质量为,D错误.
16.(每空2分)
(1)AC(少写且正确得1分,写错不得分)
(2)
(3)(未写条件扣1分) 30
(4)
(5)bc(少写且正确得1分,写错不得分)
17.(除特殊标注外,每空2分)
(1)一次电池(1分) 石墨(1分) (或)
(2) (1分)
(3)① ②
18.(每空2分)
(1)①0.013 65% ②b ③bc
(2)①> ②(不写单位扣1分) ③增大
19.(每空2分)
(1)分液漏斗 检查是否漏水
(2)排尽装置中的空气,防止实验时干扰气体性质验证(答案合理即可)
(3)(浓)
(4)
(5)0.168 (6)
同课章节目录
