1.1物质的分类及转化课件(共44张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 1.1物质的分类及转化课件(共44张ppt)化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 9.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-28 00:00:00 | ||
图片预览








文档简介
(共44张PPT)
1.1 物质的分类及转化
1.以酸、碱、盐及氧化物知识为例,认识不同类型的物质之间在一定条件下可以相关转化,形成转化观念。
2.结合具体情境中的应用实例,了解物质转化在生产、生活中的应用,体会物质转化的应用价值。
课程目标
情境微课堂
冰箱现在已经成为居家必备电器,那么同学们是否观察过冰箱的储物规律呢?
放入冰箱的食物的共同点是需要低温储藏;食物应按“生熟”和“需冷冻还是冷藏”进行分类,放在冰箱内的不同区域。
对于化学物质,如果按照其所含物质种类的多少,可以怎样分类?对于化合物,我们按照不同的分类标准进行分类,可以产生哪些分类结果?
基本反应类型 模型符号 实例
化合反应
分解反应
置换反应
复分解反应
化学反应的分类——基本反应类型
回顾:
一.酸、碱、盐的化学性质
A+B+ =C
A=B+C+
AB+C=CB+A
AB+CD=AD+CB
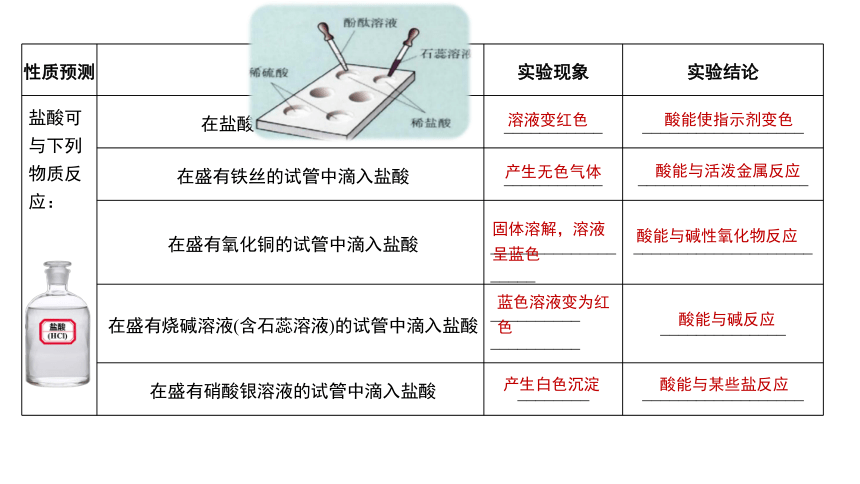
学习活动一:同类物质往往具有相似的性质,请同学们完成P10思考与讨论。
性质预测 实验操作 实验现象 实验结论
盐酸可与下列物质反应: 在盐酸中滴入石蕊溶液 ___________ __________________
在盛有铁丝的试管中滴入盐酸 ___________ ___________________
在盛有氧化铜的试管中滴入盐酸 ___________________ ____________________
在盛有烧碱溶液(含石蕊溶液)的试管中滴入盐酸 __________ __________ ______________
在盛有硝酸银溶液的试管中滴入盐酸 ________ __________________
酸能使指示剂变色
溶液变红色
产生无色气体
酸能与活泼金属反应
固体溶解,溶液呈蓝色
酸能与碱性氧化物反应
蓝色溶液变为红色
酸能与碱反应
产生白色沉淀
酸能与某些盐反应
酸
酸+碱→盐+水
酸+碱性氧化物→盐+水
酸+盐→新盐+新酸
酸+金属→盐+氢气
酸溶液能使指示剂变色
1. 酸的通性
Fe+2HCl===FeCl2+H2↑
CuO+2HCl===CuCl2+H2O
NaOH+HCl===NaCl+H2O
AgNO3+HCl===AgCl↓+HNO3
紫色石蕊溶液遇酸显红色,酚酞溶液遇酸不变色
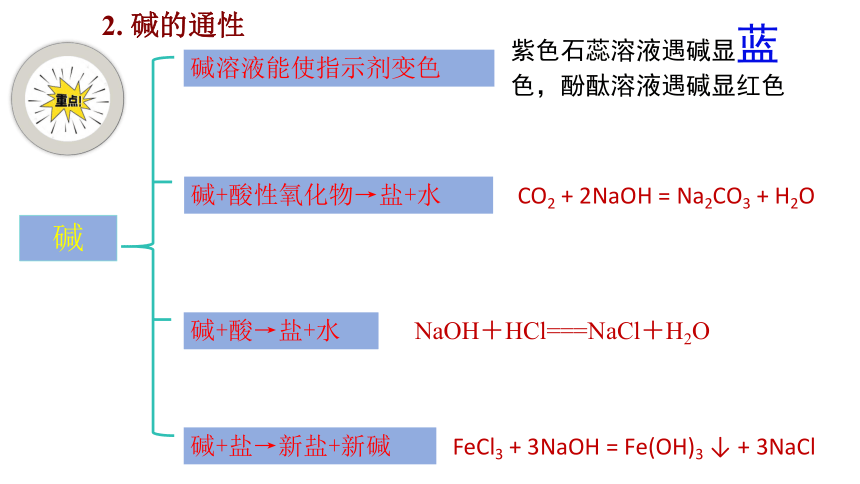
2. 碱的通性
碱溶液能使指示剂变色
碱+盐→新盐+新碱
碱+酸→盐+水
碱+酸性氧化物→盐+水
碱
NaOH+HCl===NaCl+H2O
紫色石蕊溶液遇碱显蓝色,酚酞溶液遇碱显红色
CO2 + 2NaOH = Na2CO3 + H2O
FeCl3 + 3NaOH = Fe(OH)3 ↓ + 3NaCl
3. 盐的通性
盐 + 金属→ 新盐 + 新金属
盐 + 酸→ 新盐 + 新酸
盐 + 碱→ 新盐 + 新碱
盐 + 盐→ 新盐 + 新盐
盐
Zn + CuSO4 = ZnSO4 + Cu
2HCl + CaCO3 = CaCl2 + CO2↑+H2O
2NaOH + CuSO4 = Na2SO4 + Cu (OH)2 ↓
NaCl + AgNO3 = NaNO3 + AgCl ↓
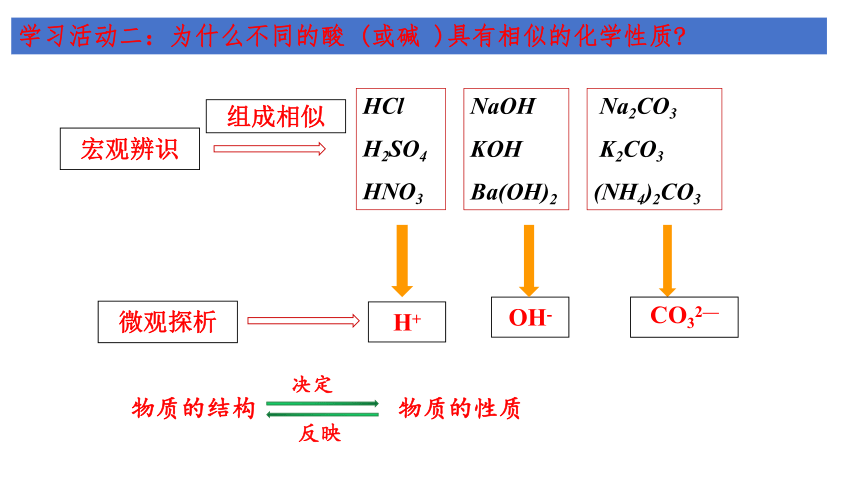
学习活动二:为什么不同的酸 (或碱 )具有相似的化学性质
宏观辨识
组成相似
微观探析
H+
HCl
H2SO4
HNO3
NaOH
KOH
Ba(OH)2
Na2CO3
K2CO3
(NH4)2CO3
OH-
CO32—
物质的结构
决定
物质的性质
反映
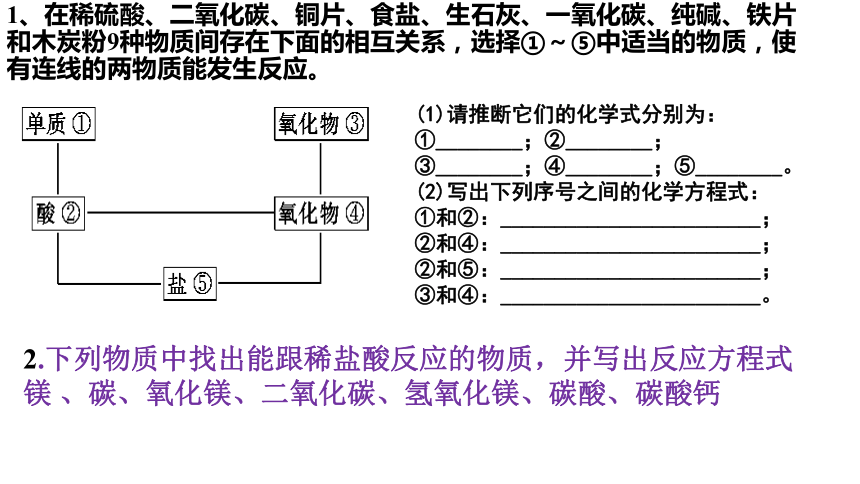
1、在稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉9种物质间存在下面的相互关系,选择①~⑤中适当的物质,使有连线的两物质能发生反应。
(1)请推断它们的化学式分别为:
①________;②________;
③________;④________;⑤________。
(2)写出下列序号之间的化学方程式:
①和②:________________________;
②和④:________________________;
②和⑤:________________________;
③和④:________________________。
2.下列物质中找出能跟稀盐酸反应的物质,并写出反应方程式
镁 、碳、氧化镁、二氧化碳、氢氧化镁、碳酸、碳酸钙
地壳
变动
转化为
石油
一粒种子
美丽的凤仙花
02
物质转化
物质转化
O2
H2O
H2SO4
金属单质
碱性氧化物
碱
盐
氧气
水
酸
O2
H2O
NaOH
非金属单质
酸性氧化物
酸
盐
氧气
水
碱
物质转化的“八圈图”
①金属单质+非金属单质→盐
②金属单质+盐→新盐+新金属单质
③金属单质+酸→盐+氢气
金属单质+氧气→碱性氧化物
单质
非金属单质+氧气→酸性氧化物
物质转化的“八圈图”
④碱性氧化物+酸性氧化物→盐
⑤碱性氧化物+酸→盐+水
碱性氧化物→金属单质
碱性氧化物+水→碱
⑥酸性氧化物+碱→盐+水
酸性氧化物+水→酸
氧化物
物质转化的“八圈图”
⑦酸+碱→盐+水
⑧碱+盐→新盐+新碱
⑨酸+盐→新盐+新酸
⑩盐+盐→新盐+新盐
酸 碱 盐
物质转化的应用
在实际生产中,通过物质的转化制备物质时,除了要考虑反应进行的可能性,还需要考虑原料来源、成本高低、设备要求等因素。
Na2O
Na2CO3
+H2O
NaOH
+Ca(OH)2
NaCl
电解
物质转化的应用
Na2O + H2O == 2NaOH
Na2CO3 + Ca(OH)2 == CaCO3↓ + 2NaOH
2NaCl + 2H2O ==== 2NaOH + H2 ↑ + Cl2 ↑
电解
学以致用
图中“一”表示相连的物质间在一定条件下可以反应,“→”表示丁在一定条件下可以转化为乙。下列选项中,符合图示要求的是( )
甲 乙 丙 丁
A H2SO4 Na2SO4 NaOH NaCl
B KCl K2CO3 KOH HCl
C O2 CO CuO C
D Fe CuCl2 Ag HCl
思考讨论
1、要制取氢氧化钠可以采用哪些方法
(1)碱性氧化物与水反应
Na2O + H2O = 2NaOH
(2)用盐与另一种碱反应
2、工业上如何制取氢氧化钠
Na2CO3 + Ca(OH)2 ═ CaCO3 + 2NaOH
2NaCl + 2H2O ==== 2NaOH + H2↑ + Cl2↑
通电
拓展
金属单质
非金属单质
碱性氧化物
碱
酸性氧化物
盐
酸
盐
盐
两种新盐
盐+水
新酸+新盐
新碱+新盐
盐+氢气
盐+金属
单质、氧化物、酸、碱、盐之间的转化
*只有四种可溶性碱KOH、NaOH、Ca(OH)2、Ba(OH)2对应的碱性氧化物K2O、Na2O、CaO、BaO可直接与水化合生成相应碱,其余不能
如:Na2O+H2O= CaO+H2O=___________
①金属+O2
碱性氧化物(化合反应)
1.六种相互转化关系
2Cu+ O2
_______
如:2Mg+O2 ______
②碱性氧化物+ H2O
碱(化合反应)
故:上述四种氧化物溶于水时得到的都是相应碱的溶液,除Ca(OH)2是微溶碱外,其余都易溶。
b、反应前后元素的化合价不变(特别注意金属元素的化合价)
a、不溶性碱受热才能发生分解反应
③碱
碱性氧化物+水(分解反应)
Cu(OH)2 + 。
如:2Fe(OH)3
+ 。
④非金属+O2
酸性氧化物(化合反应)
如:C+ O2 CO2
S+O2 SO2
⑤酸性氧化物+H2O → 酸(含氧酸)(化合反应)
* a、除SiO2外,其余酸性氧化物一般都能直接与水化合生成相应酸
b、反应前后元素的化合价一定不变(特别注意除氢、氧外的非金属元素的化合价)
如:CO2+ H2O H2CO3 SO3+ H2O = H2SO4
故:酸性氧化物溶于水时得到的都是相应酸的溶液。
* a、仅有含氧酸才能分解
b、反应前后元素的化合价一定不变(特别注意除氢、氧外的非金属元素的化合价)
c、酸性氧化物又叫酸酐(原因是:酸性氧化物可看作是含氧酸脱水的产物)
如:H2SO3 + .
H2CO3 + .
练习:向滴有紫色石蕊试液的水中通入CO2气体,溶液由____色变为___色;再将此溶液加热,溶液又由____色变为____色,原因是(用化学方程式表示)________________________________________________。
写出下列几种含氧酸的酸酐:
H2SO4 HNO3 H3PO4 H2SO3____
⑥酸→酸性氧化物+水(分解反应)
(二)十个相互反应的关系(表中有四个横向、四个交叉、两个远距离关系,共十个)
⑦碱性氧化物+酸性氧化物→含氧酸盐(化合反应)
如:CaO+ CO2 = CaO+SiO2 = .
⑧碱性氧化物+酸→盐+水(复分解反应)
如:CuO+ 2HCl = CuCl2 + _______
Fe2O3+3 H2SO4 = Fe2(SO4)3 + 。
⑨酸性氧化物+碱→盐+水(不是基本反应类型)
* a、参加反应的碱必须可溶
b、注意生成的盐的化学式的书写
如:CO2+ Ca(OH)2 = ↓ + H2O
SO2+2NaOH = Na2SO3 + 、
SiO2+2NaOH = + H2O
SO3+2NaOH = Na2SO4 + 。
⑩碱+酸→盐+水(复分解反应)
*酸跟碱作用生成盐和水的反应叫______反应。该反应属于______反应的类型(填基本反应类型)。
如:Cu(OH)2 +H2SO4 = + 2H2O
NaOH+ HCl== NaCl+ 。
练习:凡是有盐和水生成的反应一定是中和反应,这种说法对吗?为什么?试举例说明。
如:CO2+ Ca(OH)2 = CaCO3↓ + H2O
碱+盐→另一种碱+另一种盐(复分解反应)
* a、参加反应的碱和盐必须都是可溶的
b、必须符合复分解反应发生的条件
c、可溶性碱跟铵盐一定能反应(原因是该反应一定有水和氨气生成)
如:2NaOH+CuSO4==Na2SO4+ ↓
3NaOH+FeCl3==3NaCl+ ↓
Ca(OH)2+2NH4Cl==CaCl2+ + ↑
酸+盐→另一种酸+另一种盐(复分解反应)
*a、只要符合复分解反应发生的条件即可
b、碳酸盐跟酸一定能反应(原因是该反应一定有水和二氧化碳生成)
如:HCl+AgNO3== ↓+HNO3
H2SO4+BaCl2== BaSO4↓+ 、
2 HCl+CaCO3==CaCl2+ + ↑
盐+盐→另外两种新盐(复分解反应)
* a、参加反应的两种盐必须都是可溶的
b 、符合复分解反应发生的条件
如:NaCl+AgNO3= ↓ + NaCl
K2SO4+BaCl2= ↓ + 2KCl
练习:KNO3 、NaNO3一般不能参加复分解反应,原因是___________________。
金属+酸→盐+氢气(置换反应)
* a、这里的酸通常是指盐酸和稀硫酸(硝酸、浓硫酸跟金属反应一般不产生氢气)
b、只有排在(氢)前面的金属才能置换出酸中的氢
c、铁跟盐酸和稀盐酸反应生成亚铁盐
如:Mg+2HCl = + H 2↑
Fe+H2SO4 = FeSO4 + _______↑
金属+盐→另一种金属+另一种盐(置换反应)
*a、盐必须是可溶的
b 、参加反应的金属必须排在盐中金属的前面
c、K.Ca.Na等活泼金属放入盐溶液时,发生的反应有两个,但不能置换出盐中的金属。如:把钠放入溶液中发生的反应为:
2Na+2H2O==2NaOH+ ↑ 2NaOH+CuSO4== ↓+Na2SO4
d、铁跟盐反应生成的是亚铁盐。
如Fe+CuSO4== +Cu Cu+Hg(NO3)2==Cu(NO3 ) 2+_______
金属+非金属→无氧酸盐(化合反应)
* a、这里的非金属不包括氧气
b、活泼金属跟活泼非金属在点燃或加热的条件下一般能反应
如:2Na+Cl2 ___________
Fe+S 。
1.下列物质分类正确的是( )
课堂达标
D
碱 酸 盐 碱性氧化物 酸性氧化物
A Na2CO3 H2SO4 NaOH SO2 CO2
B NaOH HCl NaCl Na2O CO
C NaOH CH3COOH CaF2 CO SO2
D KOH HNO3 CaCO3 CaO SO2
2.下列各组变化中,只有加入酸才能一步实现的是( )
A.Zn→ZnSO4
B.CuO→CuCl2
C.CaCO3→CO2
D.NaOH →Na2SO4
B
3.下列变化,不能通过一步反应实现的是( )
A.Na2CO3→NaOH B.BaCl2 →Ba(OH)2
C.FeCl3→Fe(OH)3 D.CaCO3→CaCl2
B
C
5.下列各组物质,按照单质、化合物、混合物的顺序排列正确的是( )
A. 稀有气体、酒、冰水混合物
B. 乙醇、浓硫酸、胆矾
C.金刚石、铁矿石、大理石
D.水银、水蒸气、水煤气
D
6. 下列各组物质之间可以按如图所示关系直接转化的是
A.Fe―→Fe2O3―→FeSO4―→Fe
B.CO―→CO2―→H2CO3―→CO
C.NaOH―→NaCl―→Na2CO3―→NaOH
D.HCl―→CuCl2―→BaCl2―→HCl
归纳总结1
分类标准
分类方法
同位素
同素异形体
同分异构体
同系物
物质组成
物质性质
树状分类法
交叉分类法
单质
化合物
酸性氧化物
碱性氧化物
归纳总结2
分散系
(混合物)
分散质
分散剂
溶液(<1nm)
悬浊液、乳浊液(>100nm)
胶体(1-100nm)
丁达尔效应
气溶胶:云、雾
液溶胶:Fe(OH)3胶体
固溶胶:有色玻璃
酸碱盐的化学性质
所属化学反应类型
化学反应类型间关系
归纳总结3
氧化还原反应
置换反应
分解反应
复分解反应
化合反应
化学反应类型之间的关系
1.1 物质的分类及转化
1.以酸、碱、盐及氧化物知识为例,认识不同类型的物质之间在一定条件下可以相关转化,形成转化观念。
2.结合具体情境中的应用实例,了解物质转化在生产、生活中的应用,体会物质转化的应用价值。
课程目标
情境微课堂
冰箱现在已经成为居家必备电器,那么同学们是否观察过冰箱的储物规律呢?
放入冰箱的食物的共同点是需要低温储藏;食物应按“生熟”和“需冷冻还是冷藏”进行分类,放在冰箱内的不同区域。
对于化学物质,如果按照其所含物质种类的多少,可以怎样分类?对于化合物,我们按照不同的分类标准进行分类,可以产生哪些分类结果?
基本反应类型 模型符号 实例
化合反应
分解反应
置换反应
复分解反应
化学反应的分类——基本反应类型
回顾:
一.酸、碱、盐的化学性质
A+B+ =C
A=B+C+
AB+C=CB+A
AB+CD=AD+CB
学习活动一:同类物质往往具有相似的性质,请同学们完成P10思考与讨论。
性质预测 实验操作 实验现象 实验结论
盐酸可与下列物质反应: 在盐酸中滴入石蕊溶液 ___________ __________________
在盛有铁丝的试管中滴入盐酸 ___________ ___________________
在盛有氧化铜的试管中滴入盐酸 ___________________ ____________________
在盛有烧碱溶液(含石蕊溶液)的试管中滴入盐酸 __________ __________ ______________
在盛有硝酸银溶液的试管中滴入盐酸 ________ __________________
酸能使指示剂变色
溶液变红色
产生无色气体
酸能与活泼金属反应
固体溶解,溶液呈蓝色
酸能与碱性氧化物反应
蓝色溶液变为红色
酸能与碱反应
产生白色沉淀
酸能与某些盐反应
酸
酸+碱→盐+水
酸+碱性氧化物→盐+水
酸+盐→新盐+新酸
酸+金属→盐+氢气
酸溶液能使指示剂变色
1. 酸的通性
Fe+2HCl===FeCl2+H2↑
CuO+2HCl===CuCl2+H2O
NaOH+HCl===NaCl+H2O
AgNO3+HCl===AgCl↓+HNO3
紫色石蕊溶液遇酸显红色,酚酞溶液遇酸不变色
2. 碱的通性
碱溶液能使指示剂变色
碱+盐→新盐+新碱
碱+酸→盐+水
碱+酸性氧化物→盐+水
碱
NaOH+HCl===NaCl+H2O
紫色石蕊溶液遇碱显蓝色,酚酞溶液遇碱显红色
CO2 + 2NaOH = Na2CO3 + H2O
FeCl3 + 3NaOH = Fe(OH)3 ↓ + 3NaCl
3. 盐的通性
盐 + 金属→ 新盐 + 新金属
盐 + 酸→ 新盐 + 新酸
盐 + 碱→ 新盐 + 新碱
盐 + 盐→ 新盐 + 新盐
盐
Zn + CuSO4 = ZnSO4 + Cu
2HCl + CaCO3 = CaCl2 + CO2↑+H2O
2NaOH + CuSO4 = Na2SO4 + Cu (OH)2 ↓
NaCl + AgNO3 = NaNO3 + AgCl ↓
学习活动二:为什么不同的酸 (或碱 )具有相似的化学性质
宏观辨识
组成相似
微观探析
H+
HCl
H2SO4
HNO3
NaOH
KOH
Ba(OH)2
Na2CO3
K2CO3
(NH4)2CO3
OH-
CO32—
物质的结构
决定
物质的性质
反映
1、在稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉9种物质间存在下面的相互关系,选择①~⑤中适当的物质,使有连线的两物质能发生反应。
(1)请推断它们的化学式分别为:
①________;②________;
③________;④________;⑤________。
(2)写出下列序号之间的化学方程式:
①和②:________________________;
②和④:________________________;
②和⑤:________________________;
③和④:________________________。
2.下列物质中找出能跟稀盐酸反应的物质,并写出反应方程式
镁 、碳、氧化镁、二氧化碳、氢氧化镁、碳酸、碳酸钙
地壳
变动
转化为
石油
一粒种子
美丽的凤仙花
02
物质转化
物质转化
O2
H2O
H2SO4
金属单质
碱性氧化物
碱
盐
氧气
水
酸
O2
H2O
NaOH
非金属单质
酸性氧化物
酸
盐
氧气
水
碱
物质转化的“八圈图”
①金属单质+非金属单质→盐
②金属单质+盐→新盐+新金属单质
③金属单质+酸→盐+氢气
金属单质+氧气→碱性氧化物
单质
非金属单质+氧气→酸性氧化物
物质转化的“八圈图”
④碱性氧化物+酸性氧化物→盐
⑤碱性氧化物+酸→盐+水
碱性氧化物→金属单质
碱性氧化物+水→碱
⑥酸性氧化物+碱→盐+水
酸性氧化物+水→酸
氧化物
物质转化的“八圈图”
⑦酸+碱→盐+水
⑧碱+盐→新盐+新碱
⑨酸+盐→新盐+新酸
⑩盐+盐→新盐+新盐
酸 碱 盐
物质转化的应用
在实际生产中,通过物质的转化制备物质时,除了要考虑反应进行的可能性,还需要考虑原料来源、成本高低、设备要求等因素。
Na2O
Na2CO3
+H2O
NaOH
+Ca(OH)2
NaCl
电解
物质转化的应用
Na2O + H2O == 2NaOH
Na2CO3 + Ca(OH)2 == CaCO3↓ + 2NaOH
2NaCl + 2H2O ==== 2NaOH + H2 ↑ + Cl2 ↑
电解
学以致用
图中“一”表示相连的物质间在一定条件下可以反应,“→”表示丁在一定条件下可以转化为乙。下列选项中,符合图示要求的是( )
甲 乙 丙 丁
A H2SO4 Na2SO4 NaOH NaCl
B KCl K2CO3 KOH HCl
C O2 CO CuO C
D Fe CuCl2 Ag HCl
思考讨论
1、要制取氢氧化钠可以采用哪些方法
(1)碱性氧化物与水反应
Na2O + H2O = 2NaOH
(2)用盐与另一种碱反应
2、工业上如何制取氢氧化钠
Na2CO3 + Ca(OH)2 ═ CaCO3 + 2NaOH
2NaCl + 2H2O ==== 2NaOH + H2↑ + Cl2↑
通电
拓展
金属单质
非金属单质
碱性氧化物
碱
酸性氧化物
盐
酸
盐
盐
两种新盐
盐+水
新酸+新盐
新碱+新盐
盐+氢气
盐+金属
单质、氧化物、酸、碱、盐之间的转化
*只有四种可溶性碱KOH、NaOH、Ca(OH)2、Ba(OH)2对应的碱性氧化物K2O、Na2O、CaO、BaO可直接与水化合生成相应碱,其余不能
如:Na2O+H2O= CaO+H2O=___________
①金属+O2
碱性氧化物(化合反应)
1.六种相互转化关系
2Cu+ O2
_______
如:2Mg+O2 ______
②碱性氧化物+ H2O
碱(化合反应)
故:上述四种氧化物溶于水时得到的都是相应碱的溶液,除Ca(OH)2是微溶碱外,其余都易溶。
b、反应前后元素的化合价不变(特别注意金属元素的化合价)
a、不溶性碱受热才能发生分解反应
③碱
碱性氧化物+水(分解反应)
Cu(OH)2 + 。
如:2Fe(OH)3
+ 。
④非金属+O2
酸性氧化物(化合反应)
如:C+ O2 CO2
S+O2 SO2
⑤酸性氧化物+H2O → 酸(含氧酸)(化合反应)
* a、除SiO2外,其余酸性氧化物一般都能直接与水化合生成相应酸
b、反应前后元素的化合价一定不变(特别注意除氢、氧外的非金属元素的化合价)
如:CO2+ H2O H2CO3 SO3+ H2O = H2SO4
故:酸性氧化物溶于水时得到的都是相应酸的溶液。
* a、仅有含氧酸才能分解
b、反应前后元素的化合价一定不变(特别注意除氢、氧外的非金属元素的化合价)
c、酸性氧化物又叫酸酐(原因是:酸性氧化物可看作是含氧酸脱水的产物)
如:H2SO3 + .
H2CO3 + .
练习:向滴有紫色石蕊试液的水中通入CO2气体,溶液由____色变为___色;再将此溶液加热,溶液又由____色变为____色,原因是(用化学方程式表示)________________________________________________。
写出下列几种含氧酸的酸酐:
H2SO4 HNO3 H3PO4 H2SO3____
⑥酸→酸性氧化物+水(分解反应)
(二)十个相互反应的关系(表中有四个横向、四个交叉、两个远距离关系,共十个)
⑦碱性氧化物+酸性氧化物→含氧酸盐(化合反应)
如:CaO+ CO2 = CaO+SiO2 = .
⑧碱性氧化物+酸→盐+水(复分解反应)
如:CuO+ 2HCl = CuCl2 + _______
Fe2O3+3 H2SO4 = Fe2(SO4)3 + 。
⑨酸性氧化物+碱→盐+水(不是基本反应类型)
* a、参加反应的碱必须可溶
b、注意生成的盐的化学式的书写
如:CO2+ Ca(OH)2 = ↓ + H2O
SO2+2NaOH = Na2SO3 + 、
SiO2+2NaOH = + H2O
SO3+2NaOH = Na2SO4 + 。
⑩碱+酸→盐+水(复分解反应)
*酸跟碱作用生成盐和水的反应叫______反应。该反应属于______反应的类型(填基本反应类型)。
如:Cu(OH)2 +H2SO4 = + 2H2O
NaOH+ HCl== NaCl+ 。
练习:凡是有盐和水生成的反应一定是中和反应,这种说法对吗?为什么?试举例说明。
如:CO2+ Ca(OH)2 = CaCO3↓ + H2O
碱+盐→另一种碱+另一种盐(复分解反应)
* a、参加反应的碱和盐必须都是可溶的
b、必须符合复分解反应发生的条件
c、可溶性碱跟铵盐一定能反应(原因是该反应一定有水和氨气生成)
如:2NaOH+CuSO4==Na2SO4+ ↓
3NaOH+FeCl3==3NaCl+ ↓
Ca(OH)2+2NH4Cl==CaCl2+ + ↑
酸+盐→另一种酸+另一种盐(复分解反应)
*a、只要符合复分解反应发生的条件即可
b、碳酸盐跟酸一定能反应(原因是该反应一定有水和二氧化碳生成)
如:HCl+AgNO3== ↓+HNO3
H2SO4+BaCl2== BaSO4↓+ 、
2 HCl+CaCO3==CaCl2+ + ↑
盐+盐→另外两种新盐(复分解反应)
* a、参加反应的两种盐必须都是可溶的
b 、符合复分解反应发生的条件
如:NaCl+AgNO3= ↓ + NaCl
K2SO4+BaCl2= ↓ + 2KCl
练习:KNO3 、NaNO3一般不能参加复分解反应,原因是___________________。
金属+酸→盐+氢气(置换反应)
* a、这里的酸通常是指盐酸和稀硫酸(硝酸、浓硫酸跟金属反应一般不产生氢气)
b、只有排在(氢)前面的金属才能置换出酸中的氢
c、铁跟盐酸和稀盐酸反应生成亚铁盐
如:Mg+2HCl = + H 2↑
Fe+H2SO4 = FeSO4 + _______↑
金属+盐→另一种金属+另一种盐(置换反应)
*a、盐必须是可溶的
b 、参加反应的金属必须排在盐中金属的前面
c、K.Ca.Na等活泼金属放入盐溶液时,发生的反应有两个,但不能置换出盐中的金属。如:把钠放入溶液中发生的反应为:
2Na+2H2O==2NaOH+ ↑ 2NaOH+CuSO4== ↓+Na2SO4
d、铁跟盐反应生成的是亚铁盐。
如Fe+CuSO4== +Cu Cu+Hg(NO3)2==Cu(NO3 ) 2+_______
金属+非金属→无氧酸盐(化合反应)
* a、这里的非金属不包括氧气
b、活泼金属跟活泼非金属在点燃或加热的条件下一般能反应
如:2Na+Cl2 ___________
Fe+S 。
1.下列物质分类正确的是( )
课堂达标
D
碱 酸 盐 碱性氧化物 酸性氧化物
A Na2CO3 H2SO4 NaOH SO2 CO2
B NaOH HCl NaCl Na2O CO
C NaOH CH3COOH CaF2 CO SO2
D KOH HNO3 CaCO3 CaO SO2
2.下列各组变化中,只有加入酸才能一步实现的是( )
A.Zn→ZnSO4
B.CuO→CuCl2
C.CaCO3→CO2
D.NaOH →Na2SO4
B
3.下列变化,不能通过一步反应实现的是( )
A.Na2CO3→NaOH B.BaCl2 →Ba(OH)2
C.FeCl3→Fe(OH)3 D.CaCO3→CaCl2
B
C
5.下列各组物质,按照单质、化合物、混合物的顺序排列正确的是( )
A. 稀有气体、酒、冰水混合物
B. 乙醇、浓硫酸、胆矾
C.金刚石、铁矿石、大理石
D.水银、水蒸气、水煤气
D
6. 下列各组物质之间可以按如图所示关系直接转化的是
A.Fe―→Fe2O3―→FeSO4―→Fe
B.CO―→CO2―→H2CO3―→CO
C.NaOH―→NaCl―→Na2CO3―→NaOH
D.HCl―→CuCl2―→BaCl2―→HCl
归纳总结1
分类标准
分类方法
同位素
同素异形体
同分异构体
同系物
物质组成
物质性质
树状分类法
交叉分类法
单质
化合物
酸性氧化物
碱性氧化物
归纳总结2
分散系
(混合物)
分散质
分散剂
溶液(<1nm)
悬浊液、乳浊液(>100nm)
胶体(1-100nm)
丁达尔效应
气溶胶:云、雾
液溶胶:Fe(OH)3胶体
固溶胶:有色玻璃
酸碱盐的化学性质
所属化学反应类型
化学反应类型间关系
归纳总结3
氧化还原反应
置换反应
分解反应
复分解反应
化合反应
化学反应类型之间的关系
