2024北京五中高一(下)期中化学(PDF版含答案)
文档属性
| 名称 | 2024北京五中高一(下)期中化学(PDF版含答案) |
|
|
| 格式 | |||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-28 00:00:00 | ||
图片预览



文档简介
2023/2024 学年度第二学期期中检测试卷
高一化学
班级______ 姓名_______学号______ 成绩________
可能用到的原子量 H 1 O 16 N 14 S 32 C 12 Cl 35.5 Na 23
第一部分 选择题
本部分共 14 小题,每小题 3 分,共 42 分。在每小题列出的四个选项中,选出最符合题目要
求的一项。
1.下列物品所使用的主要材料属于无机非金属材料的是
A B C D
陶瓷工艺品 纸质练习簿 不锈钢脸盆 蚕丝领带
2.下列关于浓硫酸的叙述正确的是
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸在常温下能够使铁、铝等金属钝化
3.已知反应 2CO(g)===2C(s)+O2(g)的 ΔH 为正值,ΔS 为负值。设 ΔH 和 ΔS 不随温度而
变,下列说法中正确的是 ( )
A.任何温度下都不能自发进行 B.高温下能自发进行
C.低温下不能自发进行,高温下能自发进行 D.低温下能自发进行
-
4. 已知:2H2(g)+O2(g)=2H2O(g) ΔH=-a kJ·mol 1
已知 a、b、c 均大于零,下列说法正确的是
A.1mol H2 与 O2反应生成水放出的热量为 a kJ
-
B.氢分子变为氢原子需要放出 b kJ·mol 1 的热量
1
C.断开 1 mol H-O 键需要的能量为 (a+b+c)/4 kJ
D.可通过 a、b、c 的具体数值判断 H-H 键与 H-O 键的相对牢固程度
5.如下为火山喷发时硫元素的转化示意图,其中甲、乙在常温下均为气体,丙为液体,丁为固
体。下列关于甲、乙、丙、丁的判断不.正.确.的是
A. 甲只具有还原性 B.乙、丙均为酸性氧化物
C.乙既有氧化性,又有还原性 D.丁为黄色或淡黄色固体
6.为了确定(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)的成分,下列实验操作及叙述中不正确的是
A.取少量样品放入试管中,加热,试管口放一团蘸有无水硫酸铜粉末的棉花团,变蓝则可证
明晶体的成分中含有结晶水
B.取少量样品溶于水,向溶液中滴入几滴新制氯水,再滴入 2 滴 KSCN 溶液,溶液变为红
色,则可证明晶体的成分中含有 Fe2+
C.取少量样品溶于水,加少量稀盐酸,无现象,再滴入几滴 BaCl2 溶液,有白色沉淀生成,
则可证明晶体的成分中含有 SO 2- 4
D.取少量样品放入试管中,加入少量浓 NaOH 溶液并加热,在试管口用湿润的红色石蕊试纸
检验,则可证明晶体的成分中是否含有 NH +4
7.下图是某燃煤发电厂处理废气的装置示意图,下列说
法不.正.确.的是
A.使用此装置可减少导致酸雨的气体形成
B.装置内发生了化合反应和分解反应
C.整个过程的总反应可表示为:
2SO2 + 2CaCO3 + O2=2CaSO4 + 2CO2
D.若排放的气体能使澄清石灰水变浑浊,说明排放的气体中含 SO2
2
8. 在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明反应 A(s)+2B(g)
C(g)+D(g)已达到化学平衡状态
①混合气体的压强 ②混合气体的密度 ③各气体物质的物质的量浓度
④气体的总物质的量 ⑤混合气体的平均相对分子质量
A.②③⑤ B.①②③ C.②③④ D.①③④⑤
9.几种含硫物质的转化如下图(部分反应条件略去),下列判断不.正.确.的是
试剂 a NaOH 溶液 S
浓 H2SO4 SO2 Na2SO3 溶液 Na2S2O3 溶液
△ ② ③
①
A.①中,试剂 a 可以是 Cu
B.②中,需要确保 NaOH 溶液足量
C.③中,生成 1 mol Na2S2O3 时,转移 4 mol 电子
D.③中,将 S 换为 Cl2,氧化产物为 Na2SO4
10.一定温度下,在 2L 的恒容密闭容器中,“甲烷重整”反应(CH4 + H2O CO + 3H2)原理如
下。
已知“甲烷重整”反应在不同温度下的化学平衡常数:
温度/℃ 850 1000 1200 1400
K 0.5 2 275 1772
下列说法不.正.确.的是
A.物质 a 可能是 Fe3O4
B.若增大 n(CH4):n(H2O)的值,则 CH4 的平衡转化率降低
C.CH4 (g)+ H2O(g) CO(g) + 3H2(g) ΔH>0
D.1000 ℃,若容器中 n(CH4) = n(H2O) = n(H2) = 1mol 、n(CO) = 2 mol,则反应处于平衡状
态
3
9
11.某温度下,H2 (g)+CO2(g) CO(g)+ H2O(g) 的平衡常数K = .该温度下在
4
甲、乙、丙三个恒容密闭容器中,投入 H2(g)和 CO2(g),起始浓度如表所示。下列判断不.
正.确.的是
起始浓度 甲 乙 丙
c(H2) mol/L 0.010 0.020 0.020
c(CO2) mol/L 0.010 0.010 0.020
A.平衡时,乙中 CO2 的转化率大于 60%
B.平衡时,甲中和丙中H2的转化率均是 60%
C.平衡时,丙中c(CO2)是甲中的 2 倍,是 0.012mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
12.水煤气变换反应为:CO(g)+H2O(g) ===CO2(g)+H2(g)。我国学者结合实验与计算机模拟结
果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面
上的物种用 标注。下列说法正确的是
A.水煤气变换反应的 ΔH > 0
B. 步骤③的化学方程式为:CO●+OH●+H2O(g) ===COOH●+ H2O●
C. 步骤⑤只有非极性键 H-H 键形成
D.该历程中最大能垒(活化能)E 正=1.70eV
4
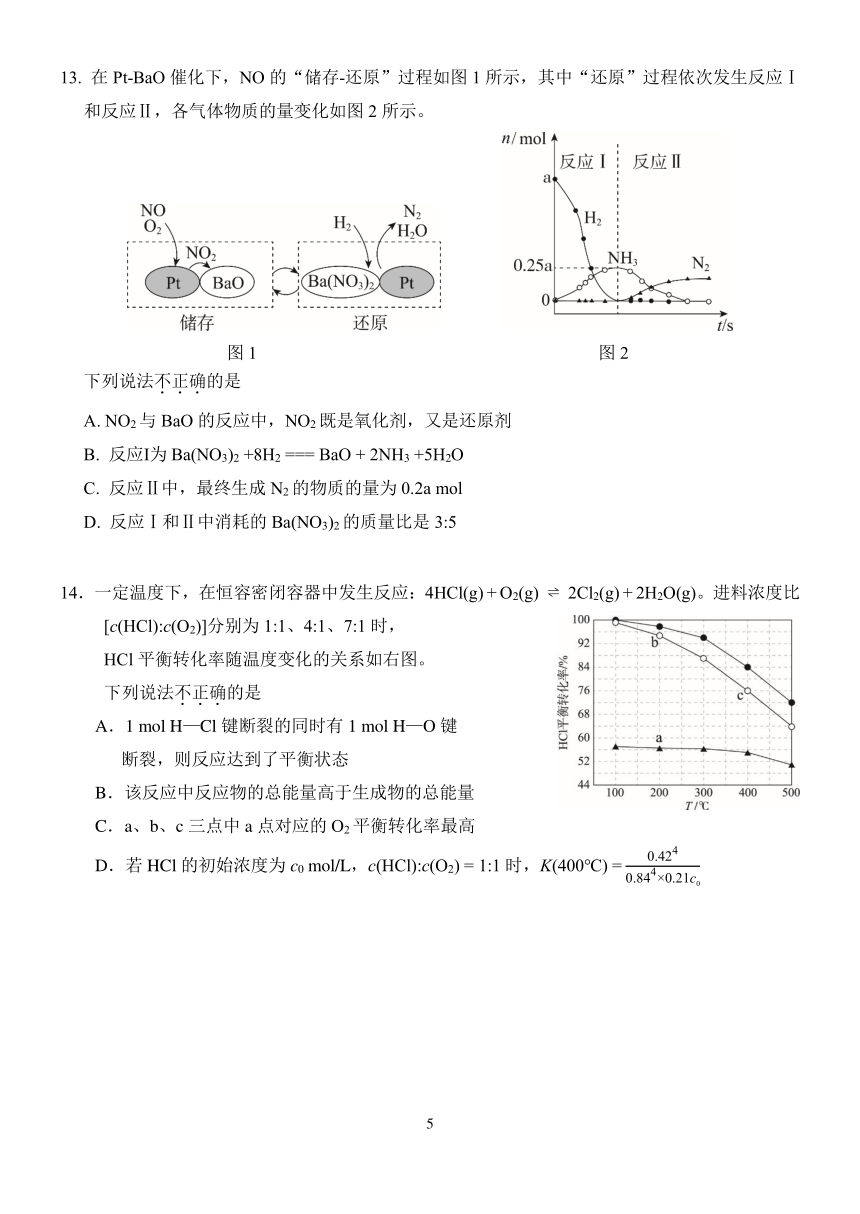
13. 在 Pt-BaO 催化下,NO 的“储存-还原”过程如图 1 所示,其中“还原”过程依次发生反应Ⅰ
和反应Ⅱ,各气体物质的量变化如图 2 所示。
图 1 图 2
下列说法不.正.确.的是
A. NO2与 BaO 的反应中,NO2 既是氧化剂,又是还原剂
B. 反应Ⅰ为 Ba(NO3)2 +8H2 === BaO + 2NH3 +5H2O
C. 反应Ⅱ中,最终生成 N2 的物质的量为 0.2a mol
D. 反应Ⅰ和Ⅱ中消耗的 Ba(NO3)2 的质量比是 3:5
14.一定温度下,在恒容密闭容器中发生反应:4HCl(g) + O2(g) 2Cl2(g) + 2H2O(g)。进料浓度比
[c(HCl):c(O2)]分别为 1:1、4:1、7:1 时,
HCl 平衡转化率随温度变化的关系如右图。
下列说法不.正.确.的是
A.1 mol H—Cl 键断裂的同时有 1 mol H—O 键
断裂,则反应达到了平衡状态
B.该反应中反应物的总能量高于生成物的总能量
C.a、b、c 三点中 a 点对应的 O2平衡转化率最高
4
0.42
D.若 HCl 的初始浓度为 c0 mol/L,c(HCl):c(O2) = 1:1 时,K(400℃) = 4
0.84 ×0.21c0
5
第二部分 非选择题(58 分)
15.(14 分)氨气在工农业生产中有重要应用。
(1) ①写出实验室制氨气的化学方程式;
②NH3的稳定性比 PH3 (填写“强”或“弱”)。
(2)如下图所示,向 NaOH 固体上滴几滴浓氨水,迅速盖上盖,观察现象。
NaOH 固体
浓盐酸
浓硫酸 FeSO4 溶液
表面皿
①浓盐酸液滴附近会出现白烟,发生反应的化学方程式为 。
②浓硫酸液滴上方没有明显现象,一段时间后浓硫酸的液滴中有白色固体,该固体可能是
(写化学式,一种即可)。
③FeSO4 液滴中先出现白色沉淀,写出离子反应方程式
白色沉淀迅速变成灰绿色沉淀,过一段时间后变成红褐色,写出化学反应方程式
。
(3)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反
应的化学方程式为 ,若反应中有 0.3 mol 电子发生转移时,生成亚硝酸
的质量为 g(小数点后保留两位有效数字)。
(4)NH3可以转化为其他含氮物质,下图为 NH3 转化为 HNO3 的流程。
O2 O2 H2O
NH NO NO
3 2 HNO3
① 写出 NH3与 O2 反应转化为 NO 的化学方程式 。
② NH3转化为 HNO3的整个过程中,为提高氮原子的利用率,可采取的措施是 。
6
16.(10 分)合成氨的发展体现了化学科学与技术的不断进步。
(1)1898 年,化学家用氮气、碳化钙(CaC2) 与水蒸气反应制备氨:
ⅰ.碳化钙和氮气在 1000℃的高温下产生氰氨化钙(CaCN2);
ⅱ.氰氨化钙与水蒸气反应生成氨气。写出反应 ⅱ 的化学方程式: 。
(2)20 世纪初,以 N2和 H2 为原料的工业合成氨方法研制成功。其反应为:
① 写出氮气的电子式
② N2 的化学性质稳定,即使在高温、高压下,N2 和 H2 的化合反应仍然进行得十分缓慢。
从结构角度解释原因: 。
③压强对合成氨有较大影响。图 1 为不同压强下,以物质的量分数 x(H2) = 0.75、x(N2) =
0.25 进料(组成 1),反应达平衡时 x(NH3)与温度的计算结果。
图 1
i. 判断压强:p1 p2(填“>”或“<”),简述理由: 。
ii.在 p1、x(NH3)=0.20 时,氮气的转化率为 。
(3)我国科学家研制出 Fe-TiO2-xHy双催化剂,通过光辐射产生温差(如体系温度为 495℃
时,纳米 Fe 的温度为 547℃,而 TiO2-xHy的温度为 415℃),解决了温度对
合成氨工业反应速率和平衡转化率影响矛盾的问题,其催化合成氨机理如图 2 所示。
图 2 热 Fe 冷 Ti 双温催化合成氨机理示意图
分析解释:与传统的催化合成氨(铁触媒、400~500℃)相比,Fe-TiO2-xHy双催化剂双温
催化合成氨具备优势的原因是 。
7
17. (11 分)对烟气高效的脱硫、脱硝是防治空气污染的重要方式。
Ⅰ.尿素液相脱硫脱硝
(1)尿素[CO(NH2)2]中碳元素的化合价是______。
(2)尿素溶液吸收烟气中的 SO2,生成一种正盐和 CO2,反应的化学方程式是______。
(3)研究发现,用尿素溶液吸收烟气中的 NO 时,脱除率很低。若 ClO2 与尿素溶液联
用,将 NO 转化为 NO2,可大大提高 NO 的脱除率。NO2与 CO(NH2)2 溶液反应可
生成两种无毒无污染的气体,反应的化学方程式是______。
Ⅱ.ClO2气相脱硫脱硝
一定温度下,将模拟烟气通入气相氧化反应器中。NO 和 SO2 的初始浓度相同,改变
ClO2的浓度,相同时间内,气体的氧化率随 ClO2 与 NO 或 SO2 的物质的量浓度之比的变
化如图所示。其中①、④分别为 NO 和 SO2 单独通入反应器时 NO、SO2 的氧化率,②、
③分别为将 NO 和 SO2同时通入反应器时 NO、SO2的氧化率。
已知:对于确定的基元反应,反应速率(υ)与速率常数(k)成正比。
ClO2气相氧化 NO 的关键基元反应:
基元反应 1:NO + ClO2 === NO 11 2 + ClO k1=1.7 × 10
基元反应 2:NO + ClO === N O2 + Cl k =8.8 × 10122
ClO2气相氧化 SO2 的关键基元反应:
基元反应 3:SO2 + ClO2 === SO3 + ClO k3=2.1 × 10 4
基元反应 4:SO2 + ClO === S O + Cl k =6.9 × 10113 4
(4)ClO2 单独氧化 SO2时,氧化率很低。原因是______。
(5)将 SO2和 NO 同时通入气相氧化反应器中时,SO2和 NO 的氧化率与将其单独通入
反应器中时不同。原因分别是______。
(6)当体系中有水蒸气时,ClO2 单独氧化 SO2的氧化率有很大提升。研究表明,此时
SO2被氧化不再经历基元反应 3 和基元反应 4,而是生成两种常见的强酸。反应的
化学方程式是______。
8
18.(13 分)探究 Na2SO3 固体的热分解产物。
资料:①4 Na2SO3 Na2S+3 Na2SO4。
② Na2S 能与 S 反应生成 Na2Sx,Na2Sx 与酸反应生成 S 和 H2S。
③ BaS 易溶于水。
隔绝空气条件下,加热无水 Na2SO3 固体得到黄色固体A ,过程中未检测到气体生成。黄
色固体 A 加水得到浊液,放置得无色溶液 B。
(1)检验分解产物 Na2S
取少量溶液 2- B ,向其中滴加 CuSO4 溶液,产生黑色沉淀,证实有 S 。反应的离子方程式-
是 。
(2)检验分解产物 Na2SO4
取少量溶液 B,滴加 BaCl2 溶液,产生白色沉淀,加入盐酸,沉淀增多(经检验 该沉
淀含 S),同时产生有臭鸡蛋气味的气体(H2S)。由于沉淀增多对检验造成干扰, 另取少量溶
液 B,加入足量盐酸,离心沉降(固液分离)后, (填操作和现象),
2-
可证实分解产物中含有 SO4 。
(3)探究(2)中 S 的来源
来源1 :固体 A 中有未分解的N a2SO3,在酸性条件下与 Na2S 反应生成S 。
来源 2:溶液 B 中有 Na2Sx,加酸反应生成 S。
针对来源1 进行如下实验:
①实 验可证实来源 1 不成立。实验证据是_________。
② 不能用盐酸代替硫酸的原因是 。
③ 写出来源 2 产生 S 的反应的离子方程式: 。
(4)实验证明 Na2SO3 固体热分解有 Na2S、Na2SO4 和 S 产生。运用氧化还原反应规律分
析产物中 S 产生的合理性:
9
19.(10分)探究 Fe3+与 Cu2+对 H2O2分解的催化效率。
(1)甲同学进行了如下的实验。
在两支试管中分别加入 4ml 1% H2O2 溶液,然后各滴加 5 滴 1 mol/L CuCl2 溶液和 5 滴 0.5
mol/L Fe2(SO4)3 溶液。观察到两支试管中均只有极微量的气泡。
甲由此得出了结论:Fe3+与 Cu2+对 H2O2 分解的催化效率相似,且均不高。
乙同学认为甲的方案不太合理,做了如下的改进:
试管 1 试管 2
实 在 4ml 20% H2O2 溶液中滴加 5 滴 1mol/L 在 4ml 20% H2O2 溶液中滴加 5 滴 1mol/L
验 CuCl2 溶液 FeCl3 溶液
i.加入溶液后,产生气泡 i.加入溶液后,试管内液体立即变为棕褐
ii.生成气泡速率先加快后又减慢 色,并产生气泡
现
iii.整个过程中溶液始终保持浅蓝色。 ii.生成气泡速率先加快后又减慢。
象
iv.且整个过程中产生气泡的速率低于试 iii.溶液棕褐色逐渐变浅,反应结束时变为
管 2 中。 浅黄色。
①乙认为甲方案不合理的理由有 (填选项符号)。
a.CuCl2溶液和 Fe2(SO4)3 溶液的浓度不同
b.两种催化剂溶液中的阴离子不同
c.H2O2溶液浓度过低
②两支试管中产生气泡的速率先加快后又减慢的合理解释是:
③根据实验结果,乙得出是结论是:
(2)研究试管 2 中出现“溶液变为棕褐色,最后变为浅黄色”的原因。
乙同学查阅文献,发现是因为 Fe3+会与 H O 发生如下反应生成棕褐色的 Fe(H O ) 3+2 2 2 2 6 :
Fe3+ +6H2O2 Fe(H 3+2O2)6
结合化学反应原理解释“溶液颜色先变为棕褐色再变为黄色”的原因:
10
(3)乙同学在翻阅资料时还发现 Fe3+与 F-能发生反应生成无色的 FeF 3- 6
Fe3+
- -
+ 6F FeF 36
他又做了如下的实验:
在一支试管中加入 4ml 20% H2O2 溶液,滴加几滴 1mol/L FeCl3 溶液,待出现大量气泡时,立
即加入 1ml NaF 溶液,观察到溶液颜色立即由棕褐色褪为无色,且气泡立刻消失。
由此判断,下列说法正确的是 (填选项符号)。
a. FeF 3-6 对 H2O2的分解几乎无催化作用
b.温度相同时,含相同浓度的 Fe(H2O2) 3+和 FeF 3-的溶液中 Fe3+6 6 浓度后者的大
- -
c.颜色由棕褐色褪为无色时反应的离子方程式是 Fe(H 3+ 2O2)6 + 6F = FeF 36 + 6H2O2
11
高一化学期中考试答案
一、单项选择题(共 14 小题,每小题 3 分,共 42 分。)
题号 1 2 3 4 5 6 7 8 9 10
答案 A D A D A B D A C D
题号 11 12 13 14
答案 C B D D
15. (14 分)
(1) ① 2NH4Cl+Ca(OH)2=== 2NH3↑+CaCl2+2H2O。 (2 分)
② 强 (1 分)
(2) ①NH3 + HCl === NH4Cl (1 分) ②NH4HSO4或(NH4)2SO4(1 分)
③Fe2+ + 2NH3·H2O == Fe(OH) + 2↓+ 2NH4 (1 分)
4Fe(OH)2 + O2 + 2H2O === 4Fe(OH)3 (1 分)
微生物
(3)2NH3 + 3O2 === 2HNO2 + 2H2O (2 分) 2.35 g (2 分)
(4) 催化剂
① 4NH3+5O2 4NO+6H2O (1 分)
② 将 NO2与 H2O 反应生成的 NO 循环使用(或通入过量氧气,将 NO2与 H2O 反应
生成的 NO 继续氧化为 NO2)(2 分)
16.(10 分)
△
(1) CaCN2 + 3H2O(g) === CaCO3 + 2NH3 (2 分)
(2) ① (1 分)
②N2中含氮氮三键(N ≡ N),键能大,难断裂 (1 分)
③ i.< 合成氨反应是气体分子数减小的反应,相同温度下,增大压强,平衡正向移动,
氨的物质的量分数增大 (2 分)
ii. (2 分)
(3)N ≡ N 在“热 Fe”表面易于断裂,有利于提高合成氨反应的速率;
“冷 Ti”低于体系温度,氨气在“冷 Ti”表面生成,有利于提高氨的平衡产率(2 分)
1
17.(11 分)
(1)+4(1 分)
(2)CO(NH2)2 + SO2 + 2H2O === (NH4)2SO3 + CO2(2 分)
(3)6NO2 + 4CO(NH2)2 === 7N2 + 4CO2 + 8H2O(2 分)
(4)k3小,υ3小,使 c(ClO)小,υ4小,导致ClO2氧化 SO2的总反应速率小(2 分)
(5)与将 SO2 和 NO 单独通入反应器比,将 SO2和 NO 同时通入反应器时,因 k1大,
υ1 大,使 c(ClO)增大,υ4 增大,从而使 SO2 的氧化率提高;
又因部分 ClO 参与了基元反应 4,与 NO 反应的 ClO 的浓度减小,υ2减小,使 NO 的氧化
率降低(2 分)
(6)5SO2 + 2ClO2 + 6H2O === 5H2SO4 + 2HCl(2 分)
18.( 13 分)
(1) Cu 2 +
+ S2- = CuS ↓ (2 分)
(2) 取上层清液,加入氯化钡溶液,产生白色沉淀 (2 分)
(3) ① 向溶液 2 中加入少量高锰酸钾溶液,紫色不褪,证明无 SO 2-3 (2 分)
② 盐酸有还原性,可使高锰酸钾溶液褪色,干扰硫酸根的检验 (3 分)
① Sx2- + 2H+ ==(x-1) S↓+ H2S ↑ (2 分)
(4) Na2SO3 固体热分解有只有+4 硫元素发生氧化还原反应,升价产物有 Na2SO4 ,
降价产物有 S 是合理的。 (2 分)
19.(10 分)
(1) ①b、c (2 分)
②反应放热,温度升高,反应速率增大;一段时间后,H2O2 浓度降低,反应速率随之下降。
(2 分)
③Fe3+与 Cu2+对 H2O2 分解均有一定催化作用,且 Fe3+比 Cu2+的催化效率高。(2 分)
(2)Fe3+ +6H2O2 Fe (H 3+2O2)6 反应较快,溶液立即变为棕褐色,随着 Fe3+催化 H2O2分解,
c(H2O2)降低,上述平衡不断逆向移动,最终只剩 Fe3+,溶液变为浅黄色。 (2 分)
(3)a、c (2 分)
2
高一化学
班级______ 姓名_______学号______ 成绩________
可能用到的原子量 H 1 O 16 N 14 S 32 C 12 Cl 35.5 Na 23
第一部分 选择题
本部分共 14 小题,每小题 3 分,共 42 分。在每小题列出的四个选项中,选出最符合题目要
求的一项。
1.下列物品所使用的主要材料属于无机非金属材料的是
A B C D
陶瓷工艺品 纸质练习簿 不锈钢脸盆 蚕丝领带
2.下列关于浓硫酸的叙述正确的是
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸在常温下能够使铁、铝等金属钝化
3.已知反应 2CO(g)===2C(s)+O2(g)的 ΔH 为正值,ΔS 为负值。设 ΔH 和 ΔS 不随温度而
变,下列说法中正确的是 ( )
A.任何温度下都不能自发进行 B.高温下能自发进行
C.低温下不能自发进行,高温下能自发进行 D.低温下能自发进行
-
4. 已知:2H2(g)+O2(g)=2H2O(g) ΔH=-a kJ·mol 1
已知 a、b、c 均大于零,下列说法正确的是
A.1mol H2 与 O2反应生成水放出的热量为 a kJ
-
B.氢分子变为氢原子需要放出 b kJ·mol 1 的热量
1
C.断开 1 mol H-O 键需要的能量为 (a+b+c)/4 kJ
D.可通过 a、b、c 的具体数值判断 H-H 键与 H-O 键的相对牢固程度
5.如下为火山喷发时硫元素的转化示意图,其中甲、乙在常温下均为气体,丙为液体,丁为固
体。下列关于甲、乙、丙、丁的判断不.正.确.的是
A. 甲只具有还原性 B.乙、丙均为酸性氧化物
C.乙既有氧化性,又有还原性 D.丁为黄色或淡黄色固体
6.为了确定(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)的成分,下列实验操作及叙述中不正确的是
A.取少量样品放入试管中,加热,试管口放一团蘸有无水硫酸铜粉末的棉花团,变蓝则可证
明晶体的成分中含有结晶水
B.取少量样品溶于水,向溶液中滴入几滴新制氯水,再滴入 2 滴 KSCN 溶液,溶液变为红
色,则可证明晶体的成分中含有 Fe2+
C.取少量样品溶于水,加少量稀盐酸,无现象,再滴入几滴 BaCl2 溶液,有白色沉淀生成,
则可证明晶体的成分中含有 SO 2- 4
D.取少量样品放入试管中,加入少量浓 NaOH 溶液并加热,在试管口用湿润的红色石蕊试纸
检验,则可证明晶体的成分中是否含有 NH +4
7.下图是某燃煤发电厂处理废气的装置示意图,下列说
法不.正.确.的是
A.使用此装置可减少导致酸雨的气体形成
B.装置内发生了化合反应和分解反应
C.整个过程的总反应可表示为:
2SO2 + 2CaCO3 + O2=2CaSO4 + 2CO2
D.若排放的气体能使澄清石灰水变浑浊,说明排放的气体中含 SO2
2
8. 在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明反应 A(s)+2B(g)
C(g)+D(g)已达到化学平衡状态
①混合气体的压强 ②混合气体的密度 ③各气体物质的物质的量浓度
④气体的总物质的量 ⑤混合气体的平均相对分子质量
A.②③⑤ B.①②③ C.②③④ D.①③④⑤
9.几种含硫物质的转化如下图(部分反应条件略去),下列判断不.正.确.的是
试剂 a NaOH 溶液 S
浓 H2SO4 SO2 Na2SO3 溶液 Na2S2O3 溶液
△ ② ③
①
A.①中,试剂 a 可以是 Cu
B.②中,需要确保 NaOH 溶液足量
C.③中,生成 1 mol Na2S2O3 时,转移 4 mol 电子
D.③中,将 S 换为 Cl2,氧化产物为 Na2SO4
10.一定温度下,在 2L 的恒容密闭容器中,“甲烷重整”反应(CH4 + H2O CO + 3H2)原理如
下。
已知“甲烷重整”反应在不同温度下的化学平衡常数:
温度/℃ 850 1000 1200 1400
K 0.5 2 275 1772
下列说法不.正.确.的是
A.物质 a 可能是 Fe3O4
B.若增大 n(CH4):n(H2O)的值,则 CH4 的平衡转化率降低
C.CH4 (g)+ H2O(g) CO(g) + 3H2(g) ΔH>0
D.1000 ℃,若容器中 n(CH4) = n(H2O) = n(H2) = 1mol 、n(CO) = 2 mol,则反应处于平衡状
态
3
9
11.某温度下,H2 (g)+CO2(g) CO(g)+ H2O(g) 的平衡常数K = .该温度下在
4
甲、乙、丙三个恒容密闭容器中,投入 H2(g)和 CO2(g),起始浓度如表所示。下列判断不.
正.确.的是
起始浓度 甲 乙 丙
c(H2) mol/L 0.010 0.020 0.020
c(CO2) mol/L 0.010 0.010 0.020
A.平衡时,乙中 CO2 的转化率大于 60%
B.平衡时,甲中和丙中H2的转化率均是 60%
C.平衡时,丙中c(CO2)是甲中的 2 倍,是 0.012mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
12.水煤气变换反应为:CO(g)+H2O(g) ===CO2(g)+H2(g)。我国学者结合实验与计算机模拟结
果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面
上的物种用 标注。下列说法正确的是
A.水煤气变换反应的 ΔH > 0
B. 步骤③的化学方程式为:CO●+OH●+H2O(g) ===COOH●+ H2O●
C. 步骤⑤只有非极性键 H-H 键形成
D.该历程中最大能垒(活化能)E 正=1.70eV
4
13. 在 Pt-BaO 催化下,NO 的“储存-还原”过程如图 1 所示,其中“还原”过程依次发生反应Ⅰ
和反应Ⅱ,各气体物质的量变化如图 2 所示。
图 1 图 2
下列说法不.正.确.的是
A. NO2与 BaO 的反应中,NO2 既是氧化剂,又是还原剂
B. 反应Ⅰ为 Ba(NO3)2 +8H2 === BaO + 2NH3 +5H2O
C. 反应Ⅱ中,最终生成 N2 的物质的量为 0.2a mol
D. 反应Ⅰ和Ⅱ中消耗的 Ba(NO3)2 的质量比是 3:5
14.一定温度下,在恒容密闭容器中发生反应:4HCl(g) + O2(g) 2Cl2(g) + 2H2O(g)。进料浓度比
[c(HCl):c(O2)]分别为 1:1、4:1、7:1 时,
HCl 平衡转化率随温度变化的关系如右图。
下列说法不.正.确.的是
A.1 mol H—Cl 键断裂的同时有 1 mol H—O 键
断裂,则反应达到了平衡状态
B.该反应中反应物的总能量高于生成物的总能量
C.a、b、c 三点中 a 点对应的 O2平衡转化率最高
4
0.42
D.若 HCl 的初始浓度为 c0 mol/L,c(HCl):c(O2) = 1:1 时,K(400℃) = 4
0.84 ×0.21c0
5
第二部分 非选择题(58 分)
15.(14 分)氨气在工农业生产中有重要应用。
(1) ①写出实验室制氨气的化学方程式;
②NH3的稳定性比 PH3 (填写“强”或“弱”)。
(2)如下图所示,向 NaOH 固体上滴几滴浓氨水,迅速盖上盖,观察现象。
NaOH 固体
浓盐酸
浓硫酸 FeSO4 溶液
表面皿
①浓盐酸液滴附近会出现白烟,发生反应的化学方程式为 。
②浓硫酸液滴上方没有明显现象,一段时间后浓硫酸的液滴中有白色固体,该固体可能是
(写化学式,一种即可)。
③FeSO4 液滴中先出现白色沉淀,写出离子反应方程式
白色沉淀迅速变成灰绿色沉淀,过一段时间后变成红褐色,写出化学反应方程式
。
(3)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反
应的化学方程式为 ,若反应中有 0.3 mol 电子发生转移时,生成亚硝酸
的质量为 g(小数点后保留两位有效数字)。
(4)NH3可以转化为其他含氮物质,下图为 NH3 转化为 HNO3 的流程。
O2 O2 H2O
NH NO NO
3 2 HNO3
① 写出 NH3与 O2 反应转化为 NO 的化学方程式 。
② NH3转化为 HNO3的整个过程中,为提高氮原子的利用率,可采取的措施是 。
6
16.(10 分)合成氨的发展体现了化学科学与技术的不断进步。
(1)1898 年,化学家用氮气、碳化钙(CaC2) 与水蒸气反应制备氨:
ⅰ.碳化钙和氮气在 1000℃的高温下产生氰氨化钙(CaCN2);
ⅱ.氰氨化钙与水蒸气反应生成氨气。写出反应 ⅱ 的化学方程式: 。
(2)20 世纪初,以 N2和 H2 为原料的工业合成氨方法研制成功。其反应为:
① 写出氮气的电子式
② N2 的化学性质稳定,即使在高温、高压下,N2 和 H2 的化合反应仍然进行得十分缓慢。
从结构角度解释原因: 。
③压强对合成氨有较大影响。图 1 为不同压强下,以物质的量分数 x(H2) = 0.75、x(N2) =
0.25 进料(组成 1),反应达平衡时 x(NH3)与温度的计算结果。
图 1
i. 判断压强:p1 p2(填“>”或“<”),简述理由: 。
ii.在 p1、x(NH3)=0.20 时,氮气的转化率为 。
(3)我国科学家研制出 Fe-TiO2-xHy双催化剂,通过光辐射产生温差(如体系温度为 495℃
时,纳米 Fe 的温度为 547℃,而 TiO2-xHy的温度为 415℃),解决了温度对
合成氨工业反应速率和平衡转化率影响矛盾的问题,其催化合成氨机理如图 2 所示。
图 2 热 Fe 冷 Ti 双温催化合成氨机理示意图
分析解释:与传统的催化合成氨(铁触媒、400~500℃)相比,Fe-TiO2-xHy双催化剂双温
催化合成氨具备优势的原因是 。
7
17. (11 分)对烟气高效的脱硫、脱硝是防治空气污染的重要方式。
Ⅰ.尿素液相脱硫脱硝
(1)尿素[CO(NH2)2]中碳元素的化合价是______。
(2)尿素溶液吸收烟气中的 SO2,生成一种正盐和 CO2,反应的化学方程式是______。
(3)研究发现,用尿素溶液吸收烟气中的 NO 时,脱除率很低。若 ClO2 与尿素溶液联
用,将 NO 转化为 NO2,可大大提高 NO 的脱除率。NO2与 CO(NH2)2 溶液反应可
生成两种无毒无污染的气体,反应的化学方程式是______。
Ⅱ.ClO2气相脱硫脱硝
一定温度下,将模拟烟气通入气相氧化反应器中。NO 和 SO2 的初始浓度相同,改变
ClO2的浓度,相同时间内,气体的氧化率随 ClO2 与 NO 或 SO2 的物质的量浓度之比的变
化如图所示。其中①、④分别为 NO 和 SO2 单独通入反应器时 NO、SO2 的氧化率,②、
③分别为将 NO 和 SO2同时通入反应器时 NO、SO2的氧化率。
已知:对于确定的基元反应,反应速率(υ)与速率常数(k)成正比。
ClO2气相氧化 NO 的关键基元反应:
基元反应 1:NO + ClO2 === NO 11 2 + ClO k1=1.7 × 10
基元反应 2:NO + ClO === N O2 + Cl k =8.8 × 10122
ClO2气相氧化 SO2 的关键基元反应:
基元反应 3:SO2 + ClO2 === SO3 + ClO k3=2.1 × 10 4
基元反应 4:SO2 + ClO === S O + Cl k =6.9 × 10113 4
(4)ClO2 单独氧化 SO2时,氧化率很低。原因是______。
(5)将 SO2和 NO 同时通入气相氧化反应器中时,SO2和 NO 的氧化率与将其单独通入
反应器中时不同。原因分别是______。
(6)当体系中有水蒸气时,ClO2 单独氧化 SO2的氧化率有很大提升。研究表明,此时
SO2被氧化不再经历基元反应 3 和基元反应 4,而是生成两种常见的强酸。反应的
化学方程式是______。
8
18.(13 分)探究 Na2SO3 固体的热分解产物。
资料:①4 Na2SO3 Na2S+3 Na2SO4。
② Na2S 能与 S 反应生成 Na2Sx,Na2Sx 与酸反应生成 S 和 H2S。
③ BaS 易溶于水。
隔绝空气条件下,加热无水 Na2SO3 固体得到黄色固体A ,过程中未检测到气体生成。黄
色固体 A 加水得到浊液,放置得无色溶液 B。
(1)检验分解产物 Na2S
取少量溶液 2- B ,向其中滴加 CuSO4 溶液,产生黑色沉淀,证实有 S 。反应的离子方程式-
是 。
(2)检验分解产物 Na2SO4
取少量溶液 B,滴加 BaCl2 溶液,产生白色沉淀,加入盐酸,沉淀增多(经检验 该沉
淀含 S),同时产生有臭鸡蛋气味的气体(H2S)。由于沉淀增多对检验造成干扰, 另取少量溶
液 B,加入足量盐酸,离心沉降(固液分离)后, (填操作和现象),
2-
可证实分解产物中含有 SO4 。
(3)探究(2)中 S 的来源
来源1 :固体 A 中有未分解的N a2SO3,在酸性条件下与 Na2S 反应生成S 。
来源 2:溶液 B 中有 Na2Sx,加酸反应生成 S。
针对来源1 进行如下实验:
①实 验可证实来源 1 不成立。实验证据是_________。
② 不能用盐酸代替硫酸的原因是 。
③ 写出来源 2 产生 S 的反应的离子方程式: 。
(4)实验证明 Na2SO3 固体热分解有 Na2S、Na2SO4 和 S 产生。运用氧化还原反应规律分
析产物中 S 产生的合理性:
9
19.(10分)探究 Fe3+与 Cu2+对 H2O2分解的催化效率。
(1)甲同学进行了如下的实验。
在两支试管中分别加入 4ml 1% H2O2 溶液,然后各滴加 5 滴 1 mol/L CuCl2 溶液和 5 滴 0.5
mol/L Fe2(SO4)3 溶液。观察到两支试管中均只有极微量的气泡。
甲由此得出了结论:Fe3+与 Cu2+对 H2O2 分解的催化效率相似,且均不高。
乙同学认为甲的方案不太合理,做了如下的改进:
试管 1 试管 2
实 在 4ml 20% H2O2 溶液中滴加 5 滴 1mol/L 在 4ml 20% H2O2 溶液中滴加 5 滴 1mol/L
验 CuCl2 溶液 FeCl3 溶液
i.加入溶液后,产生气泡 i.加入溶液后,试管内液体立即变为棕褐
ii.生成气泡速率先加快后又减慢 色,并产生气泡
现
iii.整个过程中溶液始终保持浅蓝色。 ii.生成气泡速率先加快后又减慢。
象
iv.且整个过程中产生气泡的速率低于试 iii.溶液棕褐色逐渐变浅,反应结束时变为
管 2 中。 浅黄色。
①乙认为甲方案不合理的理由有 (填选项符号)。
a.CuCl2溶液和 Fe2(SO4)3 溶液的浓度不同
b.两种催化剂溶液中的阴离子不同
c.H2O2溶液浓度过低
②两支试管中产生气泡的速率先加快后又减慢的合理解释是:
③根据实验结果,乙得出是结论是:
(2)研究试管 2 中出现“溶液变为棕褐色,最后变为浅黄色”的原因。
乙同学查阅文献,发现是因为 Fe3+会与 H O 发生如下反应生成棕褐色的 Fe(H O ) 3+2 2 2 2 6 :
Fe3+ +6H2O2 Fe(H 3+2O2)6
结合化学反应原理解释“溶液颜色先变为棕褐色再变为黄色”的原因:
10
(3)乙同学在翻阅资料时还发现 Fe3+与 F-能发生反应生成无色的 FeF 3- 6
Fe3+
- -
+ 6F FeF 36
他又做了如下的实验:
在一支试管中加入 4ml 20% H2O2 溶液,滴加几滴 1mol/L FeCl3 溶液,待出现大量气泡时,立
即加入 1ml NaF 溶液,观察到溶液颜色立即由棕褐色褪为无色,且气泡立刻消失。
由此判断,下列说法正确的是 (填选项符号)。
a. FeF 3-6 对 H2O2的分解几乎无催化作用
b.温度相同时,含相同浓度的 Fe(H2O2) 3+和 FeF 3-的溶液中 Fe3+6 6 浓度后者的大
- -
c.颜色由棕褐色褪为无色时反应的离子方程式是 Fe(H 3+ 2O2)6 + 6F = FeF 36 + 6H2O2
11
高一化学期中考试答案
一、单项选择题(共 14 小题,每小题 3 分,共 42 分。)
题号 1 2 3 4 5 6 7 8 9 10
答案 A D A D A B D A C D
题号 11 12 13 14
答案 C B D D
15. (14 分)
(1) ① 2NH4Cl+Ca(OH)2=== 2NH3↑+CaCl2+2H2O。 (2 分)
② 强 (1 分)
(2) ①NH3 + HCl === NH4Cl (1 分) ②NH4HSO4或(NH4)2SO4(1 分)
③Fe2+ + 2NH3·H2O == Fe(OH) + 2↓+ 2NH4 (1 分)
4Fe(OH)2 + O2 + 2H2O === 4Fe(OH)3 (1 分)
微生物
(3)2NH3 + 3O2 === 2HNO2 + 2H2O (2 分) 2.35 g (2 分)
(4) 催化剂
① 4NH3+5O2 4NO+6H2O (1 分)
② 将 NO2与 H2O 反应生成的 NO 循环使用(或通入过量氧气,将 NO2与 H2O 反应
生成的 NO 继续氧化为 NO2)(2 分)
16.(10 分)
△
(1) CaCN2 + 3H2O(g) === CaCO3 + 2NH3 (2 分)
(2) ① (1 分)
②N2中含氮氮三键(N ≡ N),键能大,难断裂 (1 分)
③ i.< 合成氨反应是气体分子数减小的反应,相同温度下,增大压强,平衡正向移动,
氨的物质的量分数增大 (2 分)
ii. (2 分)
(3)N ≡ N 在“热 Fe”表面易于断裂,有利于提高合成氨反应的速率;
“冷 Ti”低于体系温度,氨气在“冷 Ti”表面生成,有利于提高氨的平衡产率(2 分)
1
17.(11 分)
(1)+4(1 分)
(2)CO(NH2)2 + SO2 + 2H2O === (NH4)2SO3 + CO2(2 分)
(3)6NO2 + 4CO(NH2)2 === 7N2 + 4CO2 + 8H2O(2 分)
(4)k3小,υ3小,使 c(ClO)小,υ4小,导致ClO2氧化 SO2的总反应速率小(2 分)
(5)与将 SO2 和 NO 单独通入反应器比,将 SO2和 NO 同时通入反应器时,因 k1大,
υ1 大,使 c(ClO)增大,υ4 增大,从而使 SO2 的氧化率提高;
又因部分 ClO 参与了基元反应 4,与 NO 反应的 ClO 的浓度减小,υ2减小,使 NO 的氧化
率降低(2 分)
(6)5SO2 + 2ClO2 + 6H2O === 5H2SO4 + 2HCl(2 分)
18.( 13 分)
(1) Cu 2 +
+ S2- = CuS ↓ (2 分)
(2) 取上层清液,加入氯化钡溶液,产生白色沉淀 (2 分)
(3) ① 向溶液 2 中加入少量高锰酸钾溶液,紫色不褪,证明无 SO 2-3 (2 分)
② 盐酸有还原性,可使高锰酸钾溶液褪色,干扰硫酸根的检验 (3 分)
① Sx2- + 2H+ ==(x-1) S↓+ H2S ↑ (2 分)
(4) Na2SO3 固体热分解有只有+4 硫元素发生氧化还原反应,升价产物有 Na2SO4 ,
降价产物有 S 是合理的。 (2 分)
19.(10 分)
(1) ①b、c (2 分)
②反应放热,温度升高,反应速率增大;一段时间后,H2O2 浓度降低,反应速率随之下降。
(2 分)
③Fe3+与 Cu2+对 H2O2 分解均有一定催化作用,且 Fe3+比 Cu2+的催化效率高。(2 分)
(2)Fe3+ +6H2O2 Fe (H 3+2O2)6 反应较快,溶液立即变为棕褐色,随着 Fe3+催化 H2O2分解,
c(H2O2)降低,上述平衡不断逆向移动,最终只剩 Fe3+,溶液变为浅黄色。 (2 分)
(3)a、c (2 分)
2
同课章节目录
